Method Article
Knockdown ciblé des gènes du plexus choroïde
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous décrivons ici une méthode permettant de modifier sélectivement l’expression des gènes dans le plexus choroïde tout en évitant tout impact dans d’autres zones du cerveau.
Résumé
Le plexus choroïde (ChP) sert de porte d’entrée essentielle pour l’infiltration des cellules immunitaires dans le système nerveux central (SNC) dans des conditions physiologiques et pathologiques. Des recherches récentes ont montré que la régulation de l’activité de la ChP peut offrir une protection contre les troubles du SNC. Cependant, il est difficile d’étudier la fonction biologique de la ChP sans affecter d’autres régions du cerveau en raison de sa structure délicate. Cette étude présente une nouvelle méthode d’inactivation des gènes dans les tissus ChP à l’aide de virus adéno-associés (AAV) ou d’une protéine recombinase de l’enzyme de recombinaison de cyclisation (Cre) constituée de la séquence TAT (CRE-TAT). Les résultats démontrent qu’après l’injection d’AAV ou de CRE-TAT dans le ventricule latéral, la fluorescence était exclusivement concentrée dans le ChP. En utilisant cette approche, l’étude a réussi à faire tomber le récepteur de l’adénosine A 2A (A2A R) dans le ChP en utilisant l’interférence ARN (ARNi) ou Cre/locus des systèmes X-overP1 (Cre/LoxP), et a montré que ce knockdown pourrait atténuer la pathologie de l’encéphalomyélite auto-immune expérimentale (EAE). Cette technique pourrait avoir des implications importantes pour les recherches futures sur le rôle de la ChP dans les troubles du SNC.
Introduction
On a souvent pensé que le plexus choroïde (ChP) aidait à maintenir l’homéostasie fonctionnelle du cerveau en sécrétant du liquide céphalorachidien (LCR) et du facteur neurotrophique dérivé du cerveau (BDNF)1,2. De plus en plus de recherches au cours des trois dernières décennies ont révélé que le ChP représente une voie distincte pour l’infiltration des cellules immunitaires dans le système nerveux central (SNC).
Les jonctions serrées (TJs) de la ChP, composées d’un épithélium ChP monocouche, maintiennent l’homéostasie immunologique en empêchant les macromolécules et les cellules immunitaires de pénétrer dans le cerveau3. Cependant, dans certaines conditions pathologiques, le tissu ChP détecte et réagit aux motifs moléculaires associés au danger (DAMP) dans le LCR et le sang, ce qui entraîne une infiltration immunitaire anormale et un dysfonctionnement cérébral 4,5. Malgré son rôle essentiel, la petite taille de la ChP et son emplacement unique dans le cerveau rendent difficile l’étude de sa fonction sans affecter d’autres régions du cerveau. Par conséquent, la manipulation de l’expression des gènes spécifiquement dans la ChP est une approche idéale pour comprendre sa fonction.
Initialement, les lignées transgéniques de l’enzyme de recombinaison de cyclisation (Cre), qui expriment Cre sous le contrôle de promoteurs spécifiques aux gènes exprimés dans le ChP, étaient couramment utilisées pour supprimer des gènes cibles par croisement avec des gènes candidats floxés 6,7,8. Par exemple, le facteur de transcription Forkhead box J1 (FoxJ1) est exclusivement exprimé dans l’épithélium ChP du cerveau prénatal de la souris7. Ainsi, la lignée FoxJ1-Cre a souvent été utilisée pour supprimer des gènes situés dans le ChP 6,9. Cependant, le succès de cette stratégie repose en grande partie sur la spécificité du promoteur. On a progressivement découvert que le profil d’expression de FoxJ1 n’était pas assez distinctif, car FoxJ1 était également présent dans les cellules épithéliales ciliées dans d’autres parties du cerveau et du système périphérique7. Pour surmonter cette limitation, une injection intra-cérébroventriculaire (ICV) de Cre recombinase a été réalisée pour délivrer la recombinase dans les ventricules des lignées transgéniques floxées. Cette stratégie a montré une spécificité élevée, comme en témoigne la présence de fluorescence tdTomato uniquement dans le tissu ChP10,11. Cependant, cette méthode est encore limitée par la disponibilité de lignées de souris transgéniques floxées. Pour résoudre ce problème, les chercheurs ont utilisé l’injection ICV de virus adéno-associé (AAV) pour obtenir le knockdown spécifique de la ChP ou la surexpression des gènes cibles12,13. Une évaluation complète de différents sérotypes AAV pour l’infection à ChP a révélé que AAV2/5 et AAV2/8 présentent de fortes capacités d’infection dans le ChP, tout en n’infectant pas d’autres régions du cerveau. Cependant, AAV2/8 s’est avéré infecter l’épendyme entourant les ventricules, alors que le groupe AAV2/5 n’a montré aucune infection14. Cette méthode a l’avantage de s’affranchir des limites de l’acquisition d’animaux transgéniques floxés.
Cet article décrit un protocole étape par étape pour l’inactivation des gènes dans la ChP à l’aide de deux méthodes : ICV de l’AAV2/5 portant l’ARNsh du récepteur de l’adénosine A 2A (A 2A R) et la protéine de recombinase Cre constituée de la séquence TAT (CRE-TAT) recombinase pour obtenir une inhibition spécifique de la ChP de A2A R. Les résultats de l’étude suggèrent que l’élimination de A2AR dans le ChP peut atténuer l’encéphalomyélite auto-immune expérimentale (EAE). Ce protocole détaillé fournit des conseils utiles pour les études de la fonction ChP et l’inactivation spécifique des gènes dans la ChP.
Protocole
Toutes les procédures animales décrites dans cette étude ont été menées conformément aux directives décrites dans le Guide des NIH pour le soin et l’utilisation des animaux de laboratoire et approuvées par le Comité institutionnel de soins et d’utilisation des animaux de l’Université médicale de Wenzhou.
1. Animaux
- Achetez des souris mâles C57BL/6 âgées de 8 à 12 semaines et pesant 20 à 22 g.
- Obtenir la lignée de souris transgénique Rosa-LSL (Lox-StoP-Lox)-tdTomato (Ai9) et des souris mâles A2AR flox/flox .
- Assignez au hasard les souris à deux groupes et logez-les dans des cages, avec un maximum de cinq souris par cage, selon un cycle standard de 12 h de lumière / 12 h d’obscurité pendant 1 semaine.
- Fournissez aux souris suffisamment de nourriture et d’eau et maintenez-les à une température constante de 25 °C.
2. Knockdown spécifique à la ChP de A2AR avec AAV2/5-shRNA
- Pesez chaque souris et notez les valeurs.
- Anesthésiez les souris par voie intrapéritonéale avec 1 % de pentobarbital sodique à une dose de 6 à 8 mL/kg équivalant à 60 à 80 mg/kg de pentobarbital, et placez la souris sur un coussin chauffant pour la garder au chaud.
REMARQUE : Il est crucial d’administrer la dose correcte de pentobarbital sodique en fonction du poids de la souris pour assurer le succès de la chirurgie. L’anesthésie ne doit pas être trop profonde, car elle peut entraîner la mort, mais ne doit pas être trop superficielle, car la souris peut se réveiller pendant la procédure, ce qui peut affecter l’efficacité de l’injection du virus. Vérifiez la dose d’anesthésie appropriée en pinçant les orteils et en vous assurant que les souris ne répondent pas. - Utilisez un rasoir spécialisé pour couper les poils supérieurs des souris anesthésiées.
- Appliquez une pommade oculaire sur les deux yeux pour éviter qu’ils ne se dessèchent et fixez les souris sur un appareil stéréotaxique pour immobiliser le cerveau. Couvrez l’animal d’un drap stérile.
- Stérilisez soigneusement la peau de la tête et du cou des souris avec trois séries de désinfectant iodophore et d’alcool à 75% pour réduire l’infection postopératoire. Appliquez ensuite 1% de lidocaïne par voie topique sur le cuir chevelu des souris et faites une petite incision pour exposer complètement le crâne au microscope.
REMARQUE : Utilisez des instruments stériles tout au long de la procédure. - Préparez deux seringues de 10 μL : l’une avec l’ARNh R AAV2/5-A2Aacheté (titre : 6,27 × 10 9 vg/μL) et l’autre avec l’AAV2/5-Scramble acheté (titre : 6,21 × 109 vg/μL).
REMARQUE : Lors de l’utilisation de la seringue, l’extrémité avant doit être connectée à un capillaire en verre, et une plage de 10 μL peut être obtenue en contrôlant la longueur du capillaire en verre. - Utilisez le microscope pour localiser le bregma et le lambda et définissez le point de coordonnées (AP : -0,58 ; ML : ±1,10 ; DL : -2,20) sur la seringue de 10 μL (Figure 1). Le point de coordonnées est basé sur l’atlas stéréotaxique du cerveau de souris15.
- Percez un petit trou dans le crâne au point de coordonnées ajusté.
REMARQUE : Sous le microscope, le forage est effectué à l’aide d’une microperceuse stérile contre la surface du crâne. Après le forage, en enlevant les méninges recouvrant le cerveau et en exposant le parenchyme cérébral sous-jacent, on prévient les lésions des vaisseaux sanguins. Cette étape permet d’éviter que l’extrémité du capillaire en verre ne soit cassée par les méninges. Le diamètre du trou percé doit être suffisant pour permettre à la pointe de l’aiguille de pénétrer dans le tissu cérébral. - Administrer 2 μL de virus AAV2/5-A2AR-shRNA dans le ventricule cérébral par injection latérale à un débit constant de 100 nL/min. Gardez l’aiguille en place pendant 10 minutes avant de la retirer. Il est à noter que le virus a été administré par injection unilatérale.
- Scellez rapidement la peau blessée à l’aide de colle à biofibrine médicale pour éviter la perte de virus, qui peut être rincée avec du LCR après avoir retiré l’aiguille si la colle n’est pas appliquée rapidement. De plus, n’utilisez pas de cotons-tiges pour essuyer le LCR, car cela pourrait également entraîner une perte de virus.
- Pour faciliter la récupération, placez la souris sur un coussin chauffant pour maintenir la température corporelle à 37,0 ± 0,5 °C, et appliquez 1% de lidocaïne par voie topique sur le cuir chevelu de la souris. Laissez les souris récupérer pendant 2 semaines avant d’induire le modèle EAE, car cette période est nécessaire à l’expression du virus AAV2/5-A 2A R-shRNA et à l’inactivation ultérieure de A2AR.
3. Knockdown spécifique à la ChP de A2AR avec un système Cre/locus de X-overP1 (Cre/LoxP)
REMARQUE : Les procédures suivantes peuvent être réalisées à l’aide de la méthode décrite précédemment. Reportez-vous aux étapes 2.1 à 2.11 pour connaître les méthodes d’injection détaillées.
- Injecter 2 μL de CRE-TAT recombinase dans chaque ventricule latéral d’une souris Rosa-LSL (Lox-StoP-Lox)-tdTomato en tant que groupe expérimental et 2 μL de solution saline stérile tamponnée au phosphate (PBS) en tant que groupe témoin. En utilisant le même protocole que ci-dessus (section 2), injecter 2 μL de CRE-TAT recombinase dans chacun des ventricules latéraux de souris A2AR flox/flox avec 2 μL de PBS stérile comme groupe témoin.
- Préparer les coupes de tissus congelés et effectuer la coloration nucléaire 2 semaines après l’injection de recombinase CRE-TAT. Reportez-vous aux étapes 4.1 à 4.3 pour plus d’informations.
4. Perfusion transcardique chez la souris
- Administrer 60 à 80 mg/kg de pentobarbital sodique pour anesthésier en profondeur les souris. Confirmer le plan d’anesthésie par un pincement de l’orteil et effectuer une perfusion transcardique à l’aide de 40 mL de solution stérile de PBS suivie de 20 mL de paraformaldéhyde (PFA) à 4 %.
REMARQUE : Une perfusion réussie est indiquée par une couleur blanche dans le foie, tandis que la présence de poumons hypertrophiés ou d’un écoulement PBS de la bouche pendant la perfusion suggère un échec de la procédure. - Extraire rapidement le cerveau de la souris, en assurant une dégradation minimale des protéines.
- Immergez le cerveau de la souris dans 4 % de PFA/PBS pendant la nuit pour la post-fixation, puis remplacez-le par une solution de PB à 30 % de saccharose pendant 72 h.
REMARQUE : Il est essentiel d’éviter une déshydratation excessive du tissu cérébral, de sorte que le cerveau ne doit pas être laissé trop longtemps dans la solution de saccharose PB.
5. Coupe et coloration des tissus congelés
- Intégrez le cerveau de souris préalablement déshydraté dans de la colle à température de coupe optimale (OCT), congelez le cerveau intégré et utilisez un microtome coulissant pour découper des sections coronales d’une épaisseur de 20 μm.
- Placez les sections cérébrales sur la lame de verre. Une fois que les sections du cerveau sont sèches, conservez-les dans un réfrigérateur à -20 °C pour les expériences ultérieures.
- Placez chaque lame de verre dans un boîtier de cadre et plongez le cadre dans un récipient rempli de PBS pour rincer abondamment la lame. Rincez doucement les lames cérébrales avec la solution PBS trois fois, pendant 10 minutes à chaque fois.
REMARQUE : Des précautions doivent être prises pour éviter que les sections du cerveau ne tombent de la lame de verre. - Colorer les lames cérébrales avec une solution de 4′,6-diamidino-2-phénylindole (DAPI) pendant 10 min.
- Rincez les lames cérébrales avec une solution PBS pendant 5 min.
- Appliquez une goutte de produit de montage anti-décoloration sur les sections du cerveau.
- Placez une lamelle sur les sections du cerveau, scellez la lamelle avec du vernis à ongles et analysez les sections à l’aide d’un microscope à fluorescence conventionnel.
6. Induction de l’EAE
REMARQUE : Effectuer l’induction de l’EAE après 2 semaines d’injection de shRNA ou de CRE-TATrecombinase 11.
- Créez une solution aqueuse en mélangeant 2,5 mg de glycoprotéine oligodendrocytaire de myéline (MOG35-55) avec 2 mL de PBS. Préparer une solution complète d’adjuvant de Freunds (CFA) en mélangeant M. tuberculosis (H37Ra) avec un adjuvant de Freunds incomplet (IFA).
- Mélangez les solutions aqueuses et huileuses dans un rapport de 1 :1. Utilisez un tuyau en T pour fouetter le mélange jusqu’à ce qu’il soit huileux dans l’eau.
REMARQUE : Le tuyau en T est également appelé tuyau à trois voies. Il s’agit d’un tube en plastique qui peut contrôler la direction de la solution qui s’écoule pour mélanger complètement le MOG35-55 et le CFA. - Utilisez un homogénéisateur à grande vitesse pour fabriquer l’émulsion d’antigène MOG pour le modèle EAE dans des conditions de bain de glace.
- Anesthésier les souris par voie intrapéritonéale avec 1 % de pentobarbital sodique à une dose de 6 à 8 mL/kg équivalant à 60 à 80 mg/kg de pentobarbital.
- Injecter par voie sous-cutanée l’émulsion d’antigène MOG en quatre points différents (cou, dos, hanches gauche et droite) à raison d’un volume de 10 mL/kg pour un total de quatre injections chacune.
REMARQUE : Il est important de choisir soigneusement le site d’injection, car différents sites peuvent avoir des effets variables sur la morbidité et la mortalité des souris. De plus, les injections répétées de MOG peuvent entraîner une tolérance immunitaire, de sorte que l’équipe de recherche a choisi une seule méthode d’injection pour prévenir ce problème potentiel. - Injecter immédiatement 500 ng/mL de toxine coqueluche (TP) par voie intrapéritonéale à une dose de 5 mg/kg après l’injection de MOG.
REMARQUE : Le ressuage augmente la perméabilité de la barrière hémato-encéphalique (BHE) et facilite l’infiltration des lymphocytes T dans le cerveau. - Après 48 h, injecter la solution de ressuage par voie intrapéritonéale au même volume.
7. Score de déficit neurologique
- Évaluez et notez quotidiennement les souris à l’aide d’une échelle d’évaluation16 allant de 0 à 15 pour évaluer l’incidence et la gravité de l’EAE en fonction des déficits neurologiques suivants :
Queue : 0 indique qu’il n’y a aucun signe, 1 représente une queue à moitié paralysée et 2 indique une queue complètement paralysée.
Membres : 0 indique l’absence de signes, 1 représente une démarche faible ou altérée, 2 indique une parésie et 3 représente un membre complètement paralysé. - Attribuez un score de 12 à un animal tétraplégique atteint d’une paralysie complète et un score de 15 à la mortalité.
8. Coloration à l’hématoxyline-éosine (H&E)
- Prenez le cerveau de souris déshydraté et incorporez-le dans de la paraffine fondue. Laissez le bloc de paraffine refroidir et se solidifier pour une utilisation ultérieure.
REMARQUE : Le bloc de paraffine doit être complètement sec et frais pour éviter d’endommager les tissus. - Coupez le bloc de paraffine du cerveau de souris en lames de 5 μm d’épaisseur. Placez la section de cerveau de souris en paraffine sur une lame de verre et séchez-la dans un four à 60 °C pendant 3 h.
- Immergez les lames séquentiellement dans la solution de xylène I pendant 10 min, la solution de xylène II pendant 10 min, l’alcool 100 % I pendant 3 min, l’alcool 100 % II pendant 3 min, l’alcool à 95 % pendant 3 min, l’alcool à 90 % pendant 3 min, l’alcool à 80 % pendant 3 min, l’alcool à 70 % pendant 3 min et l’eau distillée pendant 1 min.
9. Analyse quantitative de réaction en chaîne par polymérase (qPCR)
- Après avoir perfusé les souris avec du PBS, retirez le ChP des ventricules et extrayez l’ARN avec Trizol. Synthétisez l’ADNc à l’aide du premier kit de synthèse d’ADNc Strand.
- Effectuez une analyse qPCR à l’aide du prémélange Ex Taq SYBR-green et d’un système de PCR en temps réel. Utilisez les amorces A2AR suivantes : vers l’avant - GCCATCCCATTCGCCATCA ; revers - GCAATAGCCAAGAGGCTGAAGA.
Résultats
Knockdown A2AR spécifique à la ChP par injection ICV d’AAV2/5-shRNA ou de CRE-TAT
Le rôle de A2AR dans la ChP en tant que puissant régulateur de l’information neuronale dans la pathogenèse de l’EAE reste incertain. L’inhibition de l’expression A 2A R spécifique de la ChP pourrait fairela lumière sur les effets régulateurs de l’A2AR sur le système immunitaire central dans l’EAE et d’autres inflammations du système nerveux. Cette étude a utilisé l’injection ICV de CRE-TAT pour diminuer l’expression de A 2A R dans la ChP de souris A2AR flox/flox. Pour assurer la spécificité de la ChP, nous avons d’abord injecté du CRE-TAT dans les ventricules latéraux de souris Rosa-LSL (Lox-StoP-Lox)-tdTomato (Ai9). Les images indiquent que la fluorescence spontanée de tdTomato était limitée au tissu ChP (Figure 2). De même, l’étude a administré la protéine fluorescente verte (EGFP) améliorée par AAV2/5-CMV-A2AR-shRNA-CMV à des souris C57BL/6 et a constaté que la fluorescence de l’EGFP était limitée à la couche de cellules épithéliales de la ChP et n’infectait pas les cellules parenchymateuses environnantes près des ventricules latéraux (Figure 3).
Induction EAE avec MOG35-55
Pour induire une EAE stable, des souris ont reçu une injection sous-cutanée d’une émulsion composée de MOG35-55 et de CFA, suivie d’une injection intrapéritonéale de PT les jours 0 et 2 après l’immunisation (Figure 4). L’échelle des symptômes cliniques a été utilisée pour évaluer quotidiennement les scores EAE, en fonction de l’état de la queue et des membres. Le début de l’EAE a été défini comme le premier jour avec un score EAE ≥1, tandis que la durée entre l’apparition et le pic des scores EAE a été appelée stade progressif.
Le knockdown A2AR spécifique à la ChP soulage la pathologie EAE
Pour étudier l’implication du signal A 2A R dans la pathologie EAE, l’étude a utilisé un knockdown A2AR spécifique à la ChP. L’étude a spécifiquement éliminé A 2A R dans le ChP en utilisant l’injection ICV de CRE-TAT ou d’AAV2/5-A2AR-shRNA. À 2 semaines après l’intempestion, l’EAE a été induite par l’immunisation MOG35-55. Les résultats ont montré que, par rapport au groupe témoin, les souris présentant un knockdown A2AR ont développé une pathologie EAE plus légère, comme en témoignent des scores plus faibles et une infiltration réduite des cellules immunitaires dans la moelle épinière (Figure 5A, B, E, F). De plus, cinq souris induites par l’EAE de chaque groupe au jour 20 après l’immunisation MOG35-55 ont été sélectionnées au hasard. Après perfusion avec PBS, les ChP ont été isolés pour l’extraction de l’ARN et la qPCR. L’analyse qPCR a montré que les niveaux d’ARNm de A 2A R étaient manifestement diminués dans les groupes AAV2/5-shRNA (A2AR-Kd) et CRE-TAT, par rapport à chaque témoin (Figure 5C,D).

Figure 1 : Localisation anatomique du site d’injection du ventricule latéral. (A) Un diagramme schématique montrant le point d’injection du virus. (B) Le site d’injection du ventricule latéral est situé à 0,58 mm au-dessous du bregma et à 1,1 mm latéralement à la suture sagittale, comme indiqué par le point rouge. (C) Une image montrant le site d’injection du virus sur une souris. Veuillez cliquer ici pour voir une version agrandie de cette figure.
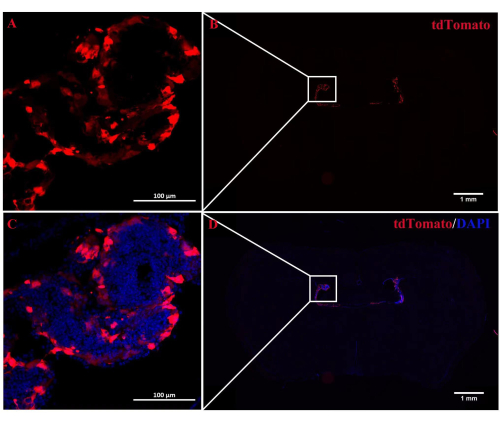
Figure 2 : Localisation de la fluorescence de tdTomato dans le ChP. (A,B) Image représentative de souris Rosa-LSL (Lox-StoP-Lox)-tdTomato traitées par injection ICV de CRETAT. À 2 semaines plus tard, l’autofluorescence de tdTomato a été spécifiquement localisée dans le tissu ChP (n = 3/groupe). (C,D) Les images fusionnées de l’autofluorescence tdTomato et du DAPI. Veuillez cliquer ici pour voir une version agrandie de cette figure.
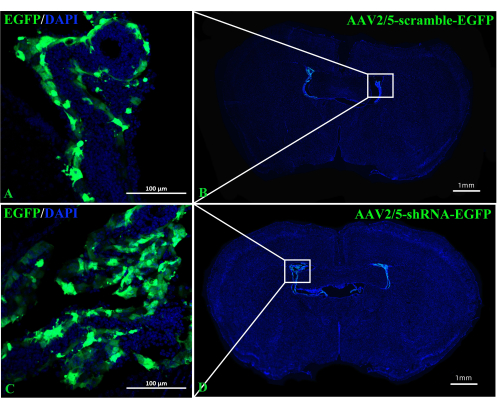
Figure 3 : Images représentatives de souris C57BL/6 prises 2 semaines après l’injection d’AAV2/5-scramble-EGFP ou d’AAV2/5-shRNA-EGFP. (A,B) Les images représentatives des souris injectées avec AAV2/5-scramble-EGFP (n = 3/groupe). (C,D) Les images représentatives de souris injectées avec AAV2/5-shRNA-EGFP (n = 3/groupe). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Induction du modèle EAE. (A) Tout d’abord, l’émulsion d’antigène MOG est injectée par voie sous-cutanée à quatre endroits différents (cou, dos, hanches gauche et droite), qui sont indiqués par des points rouges. (B) Le ressuage est injecté par voie intrapéritonéale au moment de l’immunisation et répété 2 jours plus tard. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : L’inactivation spécifique de la ChP de A 2A R a atténué la pathologie de l’EAE. (A) L’inactivation spécifique de la ChP de A 2A R chez les souris A2AR flox/flox, obtenue par injection ICV de CRE-TAT, a conduit à une diminution des scores cliniques de l’EAE (n = 6-7/groupe). L’analyse statistique a été réalisée à l’aide d’une ANOVA RM bidirectionnelle suivie du test de comparaison multiple de Sidak. (B) L’inactivation spécifique de A2AR par ChP chez les souris de type sauvage (WT), obtenue par injection ICV d’AAV2/5-shRNA, a diminué les scores cliniques de l’EAE (n = 7-8/groupe). L’analyse statistique a été réalisée à l’aide d’une ANOVA RM bidirectionnelle suivie du test de comparaison multiple de Sidak. (C,D) Résultats de l’analyse qPCR des taux d’ARNm A2AR dans les tissus ChP (n = 5/groupe). L’analyse statistique a été effectuée à l’aide d’un test t non apparié. (E,F) Coloration H&E. L’infiltration atténuée des cellules immunitaires dans la moelle épinière est A2AR spécifique à la ChP. La signification statistique est représentée par ###p < 0,001, **p < 0,01 et ***p < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La recherche a présenté deux approches distinctes pour l’inactivation ciblée des gènes ChP. La première approche a consisté en l’injection ICV de CRE-TAT, qui contient de la Cre recombinase, dans des souris A2ARflox/flox. La deuxième approche a consisté en l’injection d’AAV2/5 dans l’ICV portant l’ARNh de A2AR. En utilisant ces deux stratégies, le travail a permis d’obtenir l’inhibition sélective de A 2A R dans le CHP et a pu démontrer les effets protecteurs de l’inhibition de la signalisation A2AR dans le ChP sur la pathologie EAE. Il est à noter que ce protocole comprend deux étapes cruciales. Tout d’abord, l’opération de localisation stéréotaxique est essentielle, et un écart important par rapport aux coordonnées suggérées peut entraîner des défaillances aléatoires. Deuxièmement, le volume du virus injecté est critique, car il a été constaté que l’injection de moins de 1 μL de virus (~6 x 1012) a également un certain risque d’échec. Cela est peut-être dû à la nécessité d’une quantité adéquate de particules virales pour une infection suffisante.
L’utilisation du système Cre/LoxP n’a pas permis d’observer la distribution précise de la recombinase CRE-TAT dans le cerveau après l’injection d’ICV. En conséquence, l’étude a utilisé des souris Rosa-LSL (Lox-StoP-Lox)-tdTomato pour suivre la distribution de CRE-TAT en utilisant l’autofluorescence de la protéine tdTomato. La fluorescence de la tdTomato a été localisée exclusivement dans les tissus de ChP 2 semaines après l’injection intracérébrale de CRE-TAT, ce qui indique que la recombinase était principalement absorbée par la ChP. Ensuite, le CRE-TAT a été administré à des souris A 2A Rflox/flox, et une diminution des niveaux d’ARNm A2AR a été observée dans le tissu ChP. Cette stratégie d’inactivation ciblée a été utilisée pour étudier le rôle de la signalisation des corticostéroïdes dans le ChP dans la médiation du stress psychologique17. Alternativement, la recherche a utilisé AAV2/5 pour fournir un shRNA conçu pour cibler les gènes ChP. Des études antérieures ont évalué la capacité d’infection de différents sérotypes d’AAV et de lentivirus dans les tissus ChP et ont constaté que AAV2/5 et AAV2/8 étaient les plus efficaces14. L’étude a révélé que l’AAV2/5 était capable d’infecter spécifiquement la ChP sans provoquer d’infections évidentes dans d’autres régions du cerveau. Ces deux méthodes sont moins laborieuses que les stratégies classiques de knock-out qui nécessitent deux lignées transgéniques (lignées Cre et Flox)6,18. L’une des limites de cette étude est l’absence d’une expérience de gain de fonction avec la surexpression des gènes. Cependant, une approche possible pour y parvenir serait de cloner l’ADNc complet et de l’intégrer dans le virus AAV2/5, qui serait administré par infection par ICV. Dans une étude précédente, la surexpression de NKCC1 dans la ChP à l’aide d’AAV2/5 s’est avérée favoriser la clairance du LCR et réduire la ventriculomégalie in vivo9. Il est important de noter que la stratégie AAV2/5 ou Cre/LoxP a son propre avantage. L’injection ICV de CRE-TAT dans des souris transgéniques assure une efficacité de knockdown élevée, car le gène cible est directement supprimé de l’ADN des cellules. Cependant, cette méthode dépend de la production et de l’élevage de souris floxées. D’autre part, l’injection d’AAV2/5 par ICV permet d’éviter le processus fastidieux d’élevage de souris transgéniques. Cependant, l’efficacité de knockdown de cette méthode dépend en grande partie de la performance de l’ARNsh conçu. Par conséquent, les chercheurs peuvent choisir une méthode appropriée en fonction de leurs conditions expérimentales.
La sclérose en plaques (SEP) est une maladie auto-immune qui provoque une inflammation et une démyélinisation de la substance blanche dans le SNC19. Pour étudier les mécanismes pathologiques de la SEP, les chercheurs ont utilisé un modèle EAE qui simule les symptômes de la maladie, tels que la démyélinisation et l’infiltration immunitaire. Ce modèle est considéré comme idéal pour comprendre la SEP. En 2009, on a découvert que les cellules immunitaires infiltrent le SNC par l’intermédiaire de la ChP, qui est une voie clé d’entrée des cellules immunitaires dans la pathologie de la SEP. La « première vague » de cellules immunitaires pénètre dans le LCR par le ChP, suivie de la « deuxième vague », qui pénètre dans le parenchyme cérébral par leBHE20. La « première vague » de cellules immunitaires favorise l’inflammation et accélère la fuite de la BHE, de sorte que l’inhibition de l’infiltration immunitaire au niveau de la ChP pourrait être utile pour une intervention précoce dans la SEP. Les chimiokines et les molécules d’adhésion régulent l’activité de déclenchement de la ChP, contrôlant la capacité des lymphocytes à s’infiltrer à travers elle21,22,23.
Des études antérieures ont utilisé une technologie pharmacologique ou de knock-out du corps entier (comme les anticorps neutralisants) pour étudier les molécules de signalisation dans la ChP, mais ces méthodes n’ont pas défini avec précision leur fonction biologique dans le processus pathologique de la SEP. Dans une étude récente, les chercheurs ont éliminé A 2A R, situé dans le ChP des souris A2AR flox/flox, et ont constaté que les scores EAE et l’infiltration immunitaire étaient significativement réduits11. Cette étude confirme le rôle de la signalisation A2AR dans la ChP au cours de la pathologie EAE et démontre que les méthodes de knockdown spécifiques à la ChP sont des outils utiles pour étudier la fonction de la ChP dans les pathologies du SNC.
En conclusion, le protocole de manipulation spécifique à la ChP est un outil idéal pour explorer la fonction biologique de la ChP impliquée dans les maladies dégénératives du SNC, telles que la maladie de Parkinson, la maladie d’Alzheimer, la SEP, etc.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents ou d’autres divulgations à déclarer.
Remerciements
Nous remercions chaleureusement la Fondation nationale des sciences naturelles de Chine (subvention n° 31800903, attribuée à W. Zheng) et le projet scientifique et technologique de Wenzhou (n° Y2020426, attribué à Y. Y. Weng) pour leur soutien.
matériels
| Name | Company | Catalog Number | Comments |
| A2ARflox/flox mice | State Key Laboratory of Ophthalmology, Optometry and Visual Science, Wenzhou Medical University | ||
| AAV2/5-A2AR-ShRNA virus | Shanghai Heyuan Biotechnology Co. LTD | pt-4828 | |
| antifade mounting medium | Beyotime Biotechnology | 0100-01 | |
| borosilicate glass capillary | Beijing Meiyaxian Technology Co. Ltd | B100-50-10 | |
| brain stereotaxic apparatus | RWD, Shenzhen | 69100 | |
| C57BL/6 mice | Beijing Vital Charles River Laboratory Animal Technology Company | ||
| CRE-TAT recombinase | Millipore | SCR508 | |
| DAPI | Absin | B25A031 | |
| frozen slicing machine | Leica | CM1950 | |
| H37Ra | Becton Dickinson and company | 231141 | |
| Hamilton syringe | Hamilton, American | P/N: 86259 | |
| Incomplete Freunds adjuvant | Sigma | F5506 | |
| Laser confocal microscope | Zeiss | LSM900 | |
| MOG35-55 | Suzhou Qiangyao Biotechnology Co., LTD | 4010006243 | |
| OCT glue | Epredia | 6502p | |
| paraformaldehyde | Chengdu Kelong Chemical Reagent Company | 30525-89-4 | |
| pentobarbital sodium | Boyun Biotech | PC13003 | |
| Pipette gun | Eppendorf | N45014F | |
| PrimeScript 1st Strand cDNA Synthesis Kit | Takara | 6110A | |
| Real- Time PCR System | BioRad | CFX96 | |
| Rosa-LSL (Lox-StoP-Lox)-tdTomato mice | Jackson Laboratory | ||
| sucrose | Sangon Biotech | A502792-0500 | |
| super high speed homogenizer | IKA | 3737025 | |
| Trizol | Invitrogen | 15596026 | |
| xylene solution | Chengdu Kelong Chemical Reagent Company | 1330-20-7 |
Références
- Damkier, H. H., Brown, P. D., Praetorius, J. Cerebrospinal fluid secretion by the choroid plexus. Physiological Reviews. 93 (4), 1847-1892 (2013).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews: Neuroscience. 16 (8), 445-457 (2015).
- Wolburg, H., Paulus, W. Choroid plexus: biology and pathology. Acta Neuropathologica. 119 (1), 75-88 (2010).
- Solar, P., Zamani, A., Kubickova, L., Dubovy, P., Joukal, M. Choroid plexus and the blood-cerebrospinal fluid barrier in disease. Fluids Barriers CNS. 17 (1), 35(2020).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Myung, J., et al. The choroid plexus is an important circadian clock component. Nature Communications. 9 (1), 1062(2018).
- Zhang, Y., et al. A transgenic FOXJ1-Cre system for gene inactivation in ciliated epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 36 (5), 515-519 (2007).
- Johansson, P. A., et al. The transcription factor Otx2 regulates choroid plexus development and function. Development. 140 (5), 1055-1066 (2013).
- Xu, H., et al. Choroid plexus NKCC1 mediates cerebrospinal fluid clearance during mouse early postnatal development. Nature Communications. 12 (1), 447(2021).
- Spatazza, J., et al. Choroid-plexus-derived Otx2 homeoprotein constrains adult cortical plasticity. Cell Reports. 3 (6), 1815-1823 (2013).
- Zheng, W., et al. Choroid plexus-selective inactivation of adenosine A2A receptors protects against T cell infiltration and experimental autoimmune encephalomyelitis. Journal of Neuroinflammation. 19 (1), 52(2022).
- Steffensen, A. B., et al. Cotransporter-mediated water transport underlying cerebrospinal fluid formation. Nature Communications. 9 (1), 2167(2018).
- Zhu, L., et al. Klotho controls the brain-immune system interface in the choroid plexus. Proceedings of the National Academy of Sciences. 115 (48), E11388-E11396 (2018).
- Chen, X., et al. Different serotypes of adeno-associated virus vector- and lentivirus-mediated tropism in choroid plexus by intracerebroventricular delivery. Human Gene Therapy. 31 (7-8), 440-447 (2020).
- Konsman, J. P. The mouse brain in stereotaxic coordinates. Psychoneuroendocrinology. 6 (28), 827-828 (2003).
- Weaver, A., et al. An elevated matrix metalloproteinase (MMP) in an animal model of multiple sclerosis is protective by affecting Th1/Th2 polarization. FASEB J. 19 (12), 1668-1670 (2005).
- Kertser, A., et al. Corticosteroid signaling at the brain-immune interface impedes coping with severe psychological stress. Science Advances. 5 (5), 4111(2019).
- Kaiser, K., et al. MEIS-WNT5A axis regulates development of fourth ventricle choroid plexus. Development. 148 (10), (2021).
- Compston, A., Coles, A. Multiple sclerosis. Lancet. 372 (9648), 1502-1517 (2008).
- Reboldi, A., et al. C-C chemokine receptor 6-regulated entry of TH-17 cells into the CNS through the choroid plexus is required for the initiation of EAE. Nature Immunology. 10 (5), 514-523 (2009).
- Jovanova-Nesic, K., et al. Choroid plexus connexin 43 expression and gap junction flexibility are associated with clinical features of acute EAE. Annals of the New York Academy of Sciences. 1173, 75-82 (2009).
- Jovanova-Nesic, K., Jovicic, S., Sovilj, M., Spector, N. H. Magnetic brain stimulation upregulates adhesion and prevents Eae: MMP-2, ICAM-1, and VCAM-1 in the choroid plexus as a target. International Journal of Neuroscience. 119 (9), 1399-1418 (2009).
- Mills, J. H., Alabanza, L. M., Mahamed, D. A., Bynoe, M. S. Extracellular adenosine signaling induces CX3CL1 expression in the brain to promote experimental autoimmune encephalomyelitis. Journal of Neuroinflammation. 9, 193(2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon