Method Article
脊索丛中基因的靶向敲除
* 这些作者具有相同的贡献
摘要
在这里,我们描述了一种选择性地改变脉络丛中基因表达的方法,同时避免对其他大脑区域的任何影响。
摘要
脉络丛 (ChP) 是免疫细胞在生理和病理条件下浸润到中枢神经系统 (CNS) 的关键通道。最近的研究表明,调节 ChP 活性可以预防中枢神经系统疾病。然而,由于其微妙的结构,在不影响其他大脑区域的情况下研究 ChP 的生物学功能具有挑战性。本研究提出了一种使用腺相关病毒 (AAV) 或由 TAT 序列组成的环化重组酶 (Cre) 重组酶 (CRE-TAT) 重组酶蛋白在 ChP 组织中敲低基因的新方法。结果表明,将AAV或CRE-TAT注射到侧脑室后,荧光完全集中在ChP中。 利用这种方法,该研究利用RNA干扰(RNAi)或X-overP1(Cre/LoxP)系统的Cre/位点成功敲低了ChP中的腺苷A 2A受体(A2A R),并表明这种敲低可以缓解实验性自身免疫性脑脊髓炎(EAE)的病理。该技术可能对未来研究 ChP 在中枢神经系统疾病中的作用具有重要意义。
引言
脉络丛 (ChP) 通常被认为通过分泌脑脊液 (CSF) 和脑源性神经营养因子 (BDNF) 来帮助维持脑功能稳态1,2。在过去三十年中,越来越多的研究表明,ChP 代表了免疫细胞浸润到中枢神经系统 (CNS) 的独特途径。
ChP 的紧密连接 (TJ) 由单层 ChP 上皮细胞组成,通过阻止大分子和免疫细胞进入大脑来维持免疫稳态3。然而,在某些病理条件下,ChP 组织会检测脑脊液和血液中的危险相关分子模式 (DAMP) 并做出反应,导致异常免疫浸润和脑功能障碍 4,5。尽管ChP起着关键作用,但它的小尺寸和在大脑中的独特位置使得很难在不影响其他大脑区域的情况下研究其功能。因此,在ChP中特异性地操纵基因表达是了解其功能的理想方法。
最初,环化重组酶 (Cre) 转基因系在 ChP 中表达的基因特异性启动子的控制下表达 Cre,通常用于通过与 flox 候选基因杂交来删除靶基因 6,7,8。例如,转录因子叉头盒J1(FoxJ1)仅在产前小鼠脑的ChP上皮细胞中表达7。因此,FoxJ1-Cre 系通常用于删除位于 ChP 6,9 中的基因。然而,这种策略的成功很大程度上取决于启动子的特殊性。逐渐发现 FoxJ1 的表达模式不够独特,因为 FoxJ1 也存在于大脑和外周系统其他部位的纤毛上皮细胞中7。为了克服这一局限性,进行了脑室内 (ICV) 注射 Cre 重组酶,以将重组酶输送到絮状转基因系的脑室中。该策略显示出高度特异性,仅在 ChP 组织中存在 tdTomato 荧光就证明了这一点 10,11。然而,这种方法仍然受到氟化转基因小鼠品系可用性的限制。为了解决这个问题,研究人员采用了腺相关病毒 (AAV) 的 ICV 注射来实现 ChP 特异性敲低或靶基因的过表达12,13。对不同 AAV 血清型的 ChP 感染的综合评估显示,AAV2/5 和 AAV2/8 在 ChP 中表现出很强的感染能力,而不感染其他大脑区域。然而,发现 AAV2/8 感染心室周围的室管膜,而 AAV2/5 组未显示感染14。该方法的优点是克服了获得floxed转基因动物的局限性。
本文描述了使用两种方法在 ChP 中敲低基因的分步方案:携带腺苷 A 2A 受体 (A 2A R) 的 shRNA 的 AAV2/5 的 ICV 和由 TAT 序列 (CRE-TAT) 重组酶组成的 Cre 重组酶蛋白,以实现 A2A R 的 ChP 特异性敲低。研究结果表明,敲低 ChP 中的 A2AR 可以缓解实验性自身免疫性脑脊髓炎 (EAE)。该详细方案为 ChP 功能研究和 ChP 中基因的特异性敲低提供了有用的指导。
研究方案
本研究中描述的所有动物程序均按照美国国立卫生研究院《实验动物护理和使用指南》中概述的指南进行,并经温州医科大学机构动物护理和使用委员会批准。
1. 动物
- 购买年龄为8-12周,体重为20-22g的雄性C57BL / 6小鼠。
- 获得转基因Rosa-LSL(Lox-StoP-Lox)-tdTomato(Ai9)小鼠系和雄性A2AR flox/ flox 小鼠。
- 将小鼠随机分配到两组并饲养在笼子中,每个笼子最多5只小鼠,在标准的12小时光照/ 12小时黑暗循环下1周。
- 为小鼠提供足够的食物和水,并将它们保持在25°C的恒定温度下。
2. 用 AAV2/5-shRNA 特异性敲低 A2A R
- 称量每只鼠标的重量并记下值。
- 用1%戊巴比妥钠腹膜内麻醉小鼠,剂量为6-8mL / kg,相当于60-80mg / kg戊巴比妥,并将小鼠放在加热垫上保温。
注意:根据小鼠的体重给予正确剂量的戊巴比妥钠以确保手术成功至关重要。麻醉不宜太深,因为它可能导致死亡,但不应太浅,因为小鼠可能会在手术过程中醒来,从而可能影响病毒注射的有效性。通过捏住脚趾并确保小鼠没有反应来检查适当的麻醉剂量。 - 使用专门的剃须刀修剪麻醉小鼠的顶毛。
- 在双眼上涂抹眼药膏以防止干燥,并将小鼠固定在立体定位装置上以固定大脑。用无菌窗帘盖住动物。
- 用三轮碘伏消毒液和75%酒精对小鼠头颈部皮肤进行彻底消毒,以减少术后感染。然后局部将1%利多卡因局部施加在小鼠的头皮上,并做一个小切口,在显微镜下完全暴露颅骨。
注意:在整个过程中使用无菌器械。 - 准备两个 10 μL 注射器:一个装有购买的 AAV2/5-A 2A R-shRNA(滴度:6.27 × 10 9 vg/μL),另一个装有购买的 AAV2/5-Scramble(滴度:6.21× 109 vg/μL)。
注:使用注射器时,前端需要连接玻璃毛细管,通过控制玻璃毛细管的长度可以获得10μL的范围。 - 使用显微镜定位前囟和λ并设置坐标点(AP:-0.58;毫升:±1.10;DL:-2.20)在10μL注射器上(图1)。该坐标点基于小鼠大脑立体定位图谱15。
- 在调整后的坐标点在头骨上钻一个小孔。
注意:在显微镜下,使用无菌微钻对头骨表面进行钻孔。钻孔后,通过去除覆盖大脑的脑膜并暴露下面的脑实质,可以防止血管损伤。这一步可以防止玻璃毛细管的尖端被脑膜折断。钻孔的直径应足以使针尖进入脑组织。 - 通过侧向注射以 100 nL/min 的稳定速率将 2 μL AAV2/5-A2AR-shRNA 病毒注入脑室。在拔出之前将针头保持在原位 10 分钟。请注意,该病毒是通过单侧注射给药的。
- 立即使用医用生物纤维蛋白胶水密封受伤的皮肤,以防止病毒流失,如果不快速涂抹胶水,可以在取下针头后用脑脊液冲洗干净。此外,不要使用棉签擦拭脑脊液,因为它也可能导致病毒丢失。
- 为了促进恢复,将鼠标放在加热垫上,将体温保持在37.0±0.5°C,并将1%利多卡因局部涂抹在小鼠的头皮上。在诱导EAE模型之前,让小鼠休养2周,因为这段时间是AAV2 / 5-A 2A R-shRNA病毒表达和随后的A2AR敲低所必需的。
3. 具有 X-overP1 Cre/位点 (Cre/LoxP) 系统的 A 2A R 的 ChP 特异性敲低
注意:可以使用前面描述的方法实现以下过程。有关详细的注射方法,请参阅步骤 2.1-2.11。
- 将 2 μL CRE-TAT 重组酶注射到 Rosa-LSL (Lox-StoP-Lox)-tdTomato 小鼠的每个侧脑室中作为实验组,将 2 μL 无菌磷酸盐缓冲盐水 (PBS) 作为对照组。使用与上述相同的方案(第2节),将2μL的CRE-TAT重组酶注射到A2AR flox/ flox 小鼠的每个侧脑室中,以及2μL无菌PBS作为对照组。
- 准备冷冻组织切片并在注射 CRE-TAT 重组酶后 2 周进行核染色。有关详细信息,请参阅步骤 4.1-4.3。
4.小鼠心内灌注
- 施用60-80mg / kg戊巴比妥钠对小鼠进行深度麻醉。通过捏脚趾确认麻醉平面,并使用 40 mL 无菌 PBS 溶液和 20 mL 4% 多聚甲醛 (PFA) 进行经心灌注。
注意:肝脏中的白色表明灌注成功,而灌注过程中肺肿大或PBS从口腔流出表明手术失败。 - 快速提取小鼠大脑,确保最小的蛋白质降解。
- 将小鼠脑浸没在4%PFA / PBS中过夜用于固定后,然后用30%蔗糖PB溶液替换72小时。
注意:避免脑组织过度脱水至关重要,因此大脑不应在蔗糖PB溶液中停留太久。
5. 冷冻组织切片和染色
- 将先前脱水的小鼠大脑嵌入最佳切割温度(OCT)胶中,冷冻嵌入的大脑,并使用滑动切片机切割厚度为20μm的冠状切片。
- 将大脑部分放在载玻片上。一旦脑切片干燥,将它们储存在-20°C冰箱中用于后续实验。
- 将每个载玻片放入框架盒中,然后将框架浸入装有 PBS 的容器中以彻底冲洗载玻片。用PBS溶液轻轻冲洗脑载玻片三次,每次10分钟。
注意: 应小心,以防止大脑部分从载玻片上掉下来。 - 用4′,6-二脒基-2-苯基吲哚(DAPI)溶液染色脑载玻片10分钟。
- 用PBS溶液冲洗脑载玻片5分钟。
- 将一滴抗淬灭封固剂涂在大脑部分。
- 将盖玻片放在脑切片上,用指甲油密封盖玻片,并使用常规荧光显微镜分析切片。
6. EAE诱导
注意:在 shRNA 或 CRE-TAT 重组酶注射 2 周后进行 EAE 诱导11.
- 通过将 2.5 mg 髓鞘少突胶质细胞糖蛋白 (MOG35-55) 与 2 mL PBS 混合来制备水溶液。通过将 结核分枝杆菌 (H37Ra) 与不完全弗氏佐剂 (IFA) 混合来制备完整的弗氏佐剂 (CFA) 油溶液。
- 将水溶液和油溶液以 1:1 的比例混合。使用三通管将混合物搅打到水包油状态。
注意: 三通管也称为三通管。它是一种塑料管,可以控制溶液的流动方向,使MOG35-55 和CFA充分混合。 - 使用高速均质机在冰浴条件下为EAE模型制作MOG抗原乳液。
- 用1%戊巴比妥钠腹膜内麻醉小鼠,剂量为6-8mL / kg,相当于60-80mg / kg戊巴比妥。
- 皮下注射MOG抗原乳剂,体积为10mL / kg,每次注射四次。
注意:仔细选择注射部位很重要,因为不同的部位可能对小鼠的发病率和死亡率产生不同的影响。此外,重复注射MOG会导致免疫耐受,因此研究小组选择了一种单一注射方法来防止这种潜在问题。 - 注射 MOG 后立即腹膜内注射 500 ng/mL 百日咳毒素 (PT),剂量为 5 mg/kg。
注意:PT增加血脑屏障(BBB)的通透性,并促进T细胞浸润到大脑中。 - 48小时后,腹膜内以相同体积注射PT溶液。
7. 神经功能缺损评分
- 每天使用从0到15的评定量表16 对小鼠进行评估和分级,以根据以下神经功能缺损评估EAE的发生率和严重程度:
尾巴:0 表示没有迹象,1 表示半瘫痪的尾巴,2 表示完全瘫痪的尾巴。
四肢:0 表示没有体征,1 表示步态无力或改变,2 表示瘫痪,3 表示肢体完全瘫痪。 - 给完全瘫痪的四肢瘫痪动物打 12 分,给死亡率打 15 分。
8. 苏木精-伊红(H&E)染色
- 取脱水的小鼠大脑并将其嵌入熔融石蜡中。让石蜡块冷却并固化以备后用。
注意:石蜡块应完全干燥和冷却,以避免组织损伤。 - 将小鼠脑石蜡块切成5μm厚的载玻片。将石蜡小鼠脑切片放在载玻片上,并在60°C烘箱中干燥3小时。
- 将载玻片依次浸入二甲苯溶液I中10分钟,二甲苯溶液II浸泡10分钟,100%酒精I浸泡3分钟,100%酒精II浸泡3分钟,95%酒精浸泡3分钟,90%酒精浸泡3分钟,80%酒精浸泡3分钟,浸泡在蒸馏水中1分钟。
9. 定量聚合酶链反应(qPCR)分析
- 用PBS灌注小鼠后,从心室中取出ChP并用Trizol提取RNA。使用第一个链 cDNA 合成试剂盒合成 cDNA。
- 使用Ex Taq SYBR-green预混液和实时荧光定量PCR系统进行qPCR分析。使用以下 A2AR 引物:forward - GCCATCCCATTCGCCATCA;反向 - GCAATAGCCAAGAGGCTGAAGA。
结果
通过 ICV 注射 AAV2/5-shRNA 或 CRE-TAT 敲低 ChP 特异性 A2AR
A2AR 在 ChP 中作为 EAE 发病机制中神经信息的强大调节因子的作用尚不清楚。敲低 ChP 特异性 A 2A R 表达可以揭示 A2AR 对 EAE和其他神经系统炎症中枢免疫系统的调节作用。本研究使用 ICV 注射 CRE-TAT 来降低 A 2A R flox/flox 小鼠 ChP 中 A2AR 的表达。为了确保 ChP 特异性,我们首先将 CRE-TAT 注射到 Rosa-LSL (Lox-StoP-Lox)-tdTomato (Ai9) 小鼠的侧脑室中。图像表明,自发的tdTomato荧光仅限于ChP组织(图2)。同样,该研究将AAV2 / 5-CMV-A2AR-shRNA-CMV增强的绿色荧光蛋白(EGFP)施用于C57BL / 6小鼠,发现EGFP荧光仅限于ChP的上皮细胞层,并且没有感染侧脑室附近的周围实质细胞(图3)。
使用 MOG35-55 进行 EAE 诱导
为了诱导稳定的EAE,在皮下注射由MOG35-55 和CFA组成的乳剂,然后在免疫后第0天和第2天腹膜内注射PT(图4)。临床症状量表用于根据尾巴和肢体状况每天评估 EAE 评分。EAE 的发病定义为 EAE 评分为 ≥1 的第一天,而发病和 EAE 评分峰值之间的持续时间称为进行阶段。
ChP 特异性 A2AR 敲低可缓解 EAE 病理学
为了研究 A 2A R 信号在 EAE 病理学中的参与,该研究采用了 ChP 特异性 A2AR 敲低。该研究使用 ICV 注射 CRE-TAT 或 AAV2/5-A 2A R-shRNA 特异性敲低了 ChP 中的 A2AR。敲低后 2 周,MOG35-55 免疫诱导 EAE。结果显示,与对照组相比,A2AR敲低小鼠的EAE病理学较轻,得分较低,脊髓中免疫细胞浸润减少(图5A,B,E,F)。此外,在MOG35-55免疫后第20天从每组中随机选择5只EAE诱导的小鼠。用PBS灌注后,分离ChPs进行RNA提取和qPCR。qPCR分析显示,与各对照组相比,AAV2/5-shRNA(A 2A R-Kd)组和CRE-TAT组的A2AR的mRNA水平明显降低(图5C,D)。

图 1:侧脑室注射部位的解剖定位。 (A) 显示病毒注射点的示意图。(B) 侧脑室的注射部位位于前囟下方 0.58 毫米和矢状缝线外侧 1.1 毫米处,如红点所示。(C) 显示小鼠病毒注射部位的图像。 请点击这里查看此图的较大版本.
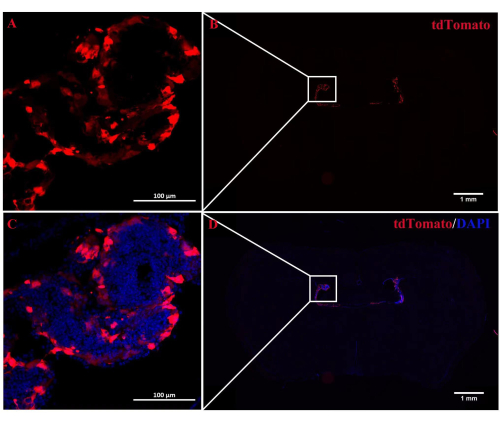
图 2:ChP 中 tdTomato 荧光的定位。 (A,B) 接受 ICV 注射 CRETAT 治疗的 Rosa-LSL (Lox-StoP-Lox)-tdTomato 小鼠的代表性图像。2 周后,tdTomato 自发荧光特异性定位于 ChP 组织 (n = 3/组)。(C,D)tdTomato自发荧光和DAPI的合并图像。请点击这里查看此图的较大版本.
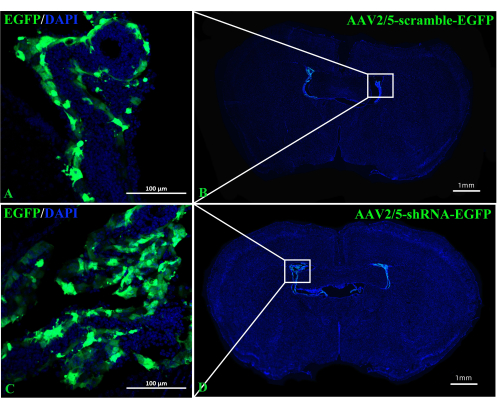
图 3:ICV 注射 AAV2/5-scramble-EGFP 或 AAV2/5-shRNA-EGFP 2 周后拍摄的 C57BL/6 小鼠的代表性图像。 (A,B)注射AAV2/5-scramble-EGFP的小鼠的代表性图像(n = 3 /组)。(C,D)注射AAV2/5-shRNA-EGFP的小鼠的代表性图像(n = 3 /组)。请点击这里查看此图的较大版本.

图 4:EAE 模型的归纳。 (A)首先,将MOG抗原乳液皮下注射到四个不同的部位(颈部、背部、左右臀部),用红点表示。(B) PT 在免疫时腹膜内注射,并在 2 天后重复。请点击这里查看此图的较大版本.

图 5:A 2A R 的 ChP 特异性敲除缓解了 EAE 病理学。 (A) 通过 ICV 注射 CRE-TAT 实现 A 2A R flox/flox 小鼠中 A 2AR 的 ChP 特异性敲低导致 EAE 临床评分降低(n = 6-7/组)。使用双向RM方差分析进行统计分析,然后进行Sidak的多重比较检验。(B) 野生型 (WT) 小鼠中 A2AR 的 ChP 特异性敲低,通过 ICV 注射 AAV2/5-shRNA 实现,EAE 临床评分降低(n = 7-8/组)。使用双向RM方差分析进行统计分析,然后进行Sidak的多重比较检验。(C,D)ChP 组织中 A2AR mRNA 水平的 qPCR 分析结果(n = 5/组)。使用非配对 t 检验进行统计分析。(英,女)H&E 染色。ChP 特异性 A2AR 敲低可减弱免疫细胞浸润到脊髓中。统计显著性表示为 ###p < 0.001、**p < 0.01 和 ***p < 0.001。请点击这里查看此图的较大版本.
讨论
该研究提出了两种不同的方法来靶向敲低ChP基因。第一种方法涉及将含有Cre重组酶的CRE-TAT注射到A2AR flox/ flox小鼠中。第二种方法需要ICV注射携带A2AR的shRNA的AAV2/5。通过利用这两种策略,本工作实现了 ChP 中 A 2A R 的选择性敲低,并能够证明抑制 ChP 中 A2AR 信号传导对 EAE 病理学的保护作用。值得注意的是,该协议包括两个关键步骤。首先,立体定位操作是必不可少的,与建议坐标的明显偏差可能会导致随机故障。其次,注射病毒的体积至关重要,因为已经发现注射少于 1 μL 的病毒 (~6 x 1012) 也有一定的失败几率。这可能是由于需要足够数量的病毒颗粒才能进行充分感染。
使用 Cre/LoxP 系统无法观察 ICV 注射后 CRE-TAT 重组酶在大脑中的精确分布。因此,该研究利用 Rosa-LSL (Lox-StoP-Lox)-tdTomato 小鼠利用 tdTomato 蛋白的自发荧光来追踪 CRE-TAT 的分布。在脑室内注射 CRE-TAT 2 周后,tdTomato 荧光仅位于 ChP 组织中,表明重组酶主要被 ChP 吸收。接下来,将 CRE-TAT 施用于 A 2A R flox/flox 小鼠,并在 ChP 组织中观察到 A2AR mRNA 水平降低。这种靶向敲低策略用于研究皮质类固醇信号转导在 ChP 中介导心理压力中的作用17。或者,该研究使用 AAV2/5 递送旨在靶向 ChP 基因的 shRNA。既往研究评估了不同血清型的AAV和慢病毒在ChP组织中的感染能力,发现AAV2/5和AAV2/8是最有效的14。该研究表明,AAV2/5 能够特异性感染 ChP,而不会在其他大脑区域引起明显的感染。与需要两个转基因系(Cre 和 Flox 系)的经典敲除策略相比,这两种方法更省力6,18。这项研究的一个局限性是缺乏基因过表达的功能获得实验。然而,实现这一目标的一种可能方法是克隆完整的cDNA并将其包装到AAV2 / 5病毒中,该病毒将通过ICV感染给药。在之前的一项研究中,发现使用 AAV2/5 在 ChP 中过表达 NKCC1 可促进脑脊液清除并减少体内脑室扩大 9。需要注意的是,AAV2/5 或 Cre/LoxP 策略各有优势。将 CRE-TAT 注射到 ICV 转基因小鼠中可确保高敲低效率,因为靶基因直接从细胞的 DNA 中删除。然而,这种方法取决于floxed小鼠的生产和繁殖。另一方面,ICV注射AAV2/5避免了转基因小鼠繁育的耗时过程。然而,这种方法的敲低效率很大程度上取决于所设计的shRNA的性能。因此,研究人员可以根据自己的实验条件选择合适的方法。
多发性硬化症 (MS) 是一种自身免疫性疾病,会导致中枢神经系统19 中的白质发炎和脱髓鞘。为了研究多发性硬化症的病理机制,研究人员使用了一种EAE模型来模拟该疾病的症状,如脱髓鞘和免疫浸润。该模型被认为是理解 MS 的理想选择。2009年,人们发现免疫细胞通过ChP浸润中枢神经系统,这是MS病理学中免疫细胞进入的关键途径。免疫细胞的“第一波”通过ChP进入脑脊液,然后是“第二波”,通过BBB20进入脑实质。免疫细胞的“第一波”会促进炎症并加速血脑屏障渗漏,因此抑制 ChP 的免疫浸润可能有助于 MS 的早期干预。 趋化因子和粘附分子调节 ChP 的门控活性,控制淋巴细胞浸润其的能力21,22,23。
以前的研究使用全身敲除或药理学技术(如中和抗体)来研究ChP中的信号分子,但这些方法并未准确定义它们在MS病理过程中的生物学功能。在最近的一项研究中,研究人员敲除了位于 A 2A R flox/flox 小鼠 ChP 中的 A2AR,发现 EAE 评分和免疫浸润显着降低11。本研究证实了 A2AR 信号转导在 EAE 病理学中 ChP 中的作用,并证明 ChP 特异性敲低方法是研究 CNS 病理学中 ChP 功能的有用工具。
总之,ChP 特异性操作方案是探索 ChP 参与中枢神经系统退行性疾病(如帕金森病、阿尔茨海默病、多发性硬化症等)的生物学功能的理想工具。
披露声明
提交人表示,他们没有相互竞争的经济利益或其他披露要申报。
致谢
我们非常感谢中国国家自然科学基金(第31800903项,授予郑伟)和温州科学技术计划(第Y2020426号,授予翁耀彦)对这项工作的支持。
材料
| Name | Company | Catalog Number | Comments |
| A2ARflox/flox mice | State Key Laboratory of Ophthalmology, Optometry and Visual Science, Wenzhou Medical University | ||
| AAV2/5-A2AR-ShRNA virus | Shanghai Heyuan Biotechnology Co. LTD | pt-4828 | |
| antifade mounting medium | Beyotime Biotechnology | 0100-01 | |
| borosilicate glass capillary | Beijing Meiyaxian Technology Co. Ltd | B100-50-10 | |
| brain stereotaxic apparatus | RWD, Shenzhen | 69100 | |
| C57BL/6 mice | Beijing Vital Charles River Laboratory Animal Technology Company | ||
| CRE-TAT recombinase | Millipore | SCR508 | |
| DAPI | Absin | B25A031 | |
| frozen slicing machine | Leica | CM1950 | |
| H37Ra | Becton Dickinson and company | 231141 | |
| Hamilton syringe | Hamilton, American | P/N: 86259 | |
| Incomplete Freunds adjuvant | Sigma | F5506 | |
| Laser confocal microscope | Zeiss | LSM900 | |
| MOG35-55 | Suzhou Qiangyao Biotechnology Co., LTD | 4010006243 | |
| OCT glue | Epredia | 6502p | |
| paraformaldehyde | Chengdu Kelong Chemical Reagent Company | 30525-89-4 | |
| pentobarbital sodium | Boyun Biotech | PC13003 | |
| Pipette gun | Eppendorf | N45014F | |
| PrimeScript 1st Strand cDNA Synthesis Kit | Takara | 6110A | |
| Real- Time PCR System | BioRad | CFX96 | |
| Rosa-LSL (Lox-StoP-Lox)-tdTomato mice | Jackson Laboratory | ||
| sucrose | Sangon Biotech | A502792-0500 | |
| super high speed homogenizer | IKA | 3737025 | |
| Trizol | Invitrogen | 15596026 | |
| xylene solution | Chengdu Kelong Chemical Reagent Company | 1330-20-7 |
参考文献
- Damkier, H. H., Brown, P. D., Praetorius, J. Cerebrospinal fluid secretion by the choroid plexus. Physiological Reviews. 93 (4), 1847-1892 (2013).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews: Neuroscience. 16 (8), 445-457 (2015).
- Wolburg, H., Paulus, W. Choroid plexus: biology and pathology. Acta Neuropathologica. 119 (1), 75-88 (2010).
- Solar, P., Zamani, A., Kubickova, L., Dubovy, P., Joukal, M. Choroid plexus and the blood-cerebrospinal fluid barrier in disease. Fluids Barriers CNS. 17 (1), 35(2020).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Myung, J., et al. The choroid plexus is an important circadian clock component. Nature Communications. 9 (1), 1062(2018).
- Zhang, Y., et al. A transgenic FOXJ1-Cre system for gene inactivation in ciliated epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 36 (5), 515-519 (2007).
- Johansson, P. A., et al. The transcription factor Otx2 regulates choroid plexus development and function. Development. 140 (5), 1055-1066 (2013).
- Xu, H., et al. Choroid plexus NKCC1 mediates cerebrospinal fluid clearance during mouse early postnatal development. Nature Communications. 12 (1), 447(2021).
- Spatazza, J., et al. Choroid-plexus-derived Otx2 homeoprotein constrains adult cortical plasticity. Cell Reports. 3 (6), 1815-1823 (2013).
- Zheng, W., et al. Choroid plexus-selective inactivation of adenosine A2A receptors protects against T cell infiltration and experimental autoimmune encephalomyelitis. Journal of Neuroinflammation. 19 (1), 52(2022).
- Steffensen, A. B., et al. Cotransporter-mediated water transport underlying cerebrospinal fluid formation. Nature Communications. 9 (1), 2167(2018).
- Zhu, L., et al. Klotho controls the brain-immune system interface in the choroid plexus. Proceedings of the National Academy of Sciences. 115 (48), E11388-E11396 (2018).
- Chen, X., et al. Different serotypes of adeno-associated virus vector- and lentivirus-mediated tropism in choroid plexus by intracerebroventricular delivery. Human Gene Therapy. 31 (7-8), 440-447 (2020).
- Konsman, J. P. The mouse brain in stereotaxic coordinates. Psychoneuroendocrinology. 6 (28), 827-828 (2003).
- Weaver, A., et al. An elevated matrix metalloproteinase (MMP) in an animal model of multiple sclerosis is protective by affecting Th1/Th2 polarization. FASEB J. 19 (12), 1668-1670 (2005).
- Kertser, A., et al. Corticosteroid signaling at the brain-immune interface impedes coping with severe psychological stress. Science Advances. 5 (5), 4111(2019).
- Kaiser, K., et al. MEIS-WNT5A axis regulates development of fourth ventricle choroid plexus. Development. 148 (10), (2021).
- Compston, A., Coles, A. Multiple sclerosis. Lancet. 372 (9648), 1502-1517 (2008).
- Reboldi, A., et al. C-C chemokine receptor 6-regulated entry of TH-17 cells into the CNS through the choroid plexus is required for the initiation of EAE. Nature Immunology. 10 (5), 514-523 (2009).
- Jovanova-Nesic, K., et al. Choroid plexus connexin 43 expression and gap junction flexibility are associated with clinical features of acute EAE. Annals of the New York Academy of Sciences. 1173, 75-82 (2009).
- Jovanova-Nesic, K., Jovicic, S., Sovilj, M., Spector, N. H. Magnetic brain stimulation upregulates adhesion and prevents Eae: MMP-2, ICAM-1, and VCAM-1 in the choroid plexus as a target. International Journal of Neuroscience. 119 (9), 1399-1418 (2009).
- Mills, J. H., Alabanza, L. M., Mahamed, D. A., Bynoe, M. S. Extracellular adenosine signaling induces CX3CL1 expression in the brain to promote experimental autoimmune encephalomyelitis. Journal of Neuroinflammation. 9, 193(2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。