Method Article
Gezielter Knockdown von Genen im Plexus aderoid
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine Methode, um die Genexpression im Plexus choroideus selektiv zu verändern und gleichzeitig Auswirkungen auf andere Hirnareale zu vermeiden.
Zusammenfassung
Der Plexus choroideus (ChP) dient sowohl unter physiologischen als auch unter pathologischen Bedingungen als kritisches Einfallstor für die Infiltration von Immunzellen in das zentrale Nervensystem (ZNS). Neuere Forschungen haben gezeigt, dass die Regulierung der ChP-Aktivität Schutz vor ZNS-Erkrankungen bieten kann. Die biologische Funktion des ChP zu untersuchen, ohne andere Hirnregionen zu beeinträchtigen, ist jedoch aufgrund seiner empfindlichen Struktur eine Herausforderung. In dieser Arbeit wird eine neue Methode zum Gen-Knockdown in ChP-Gewebe unter Verwendung von Adeno-assoziierten Viren (AAVs) oder Cyclisierungsrekombinationsenzymen (Cre)-Rekombinase-Proteinen, bestehend aus TAT-Sequenzen (CRE-TAT), vorgestellt. Die Ergebnisse zeigen, dass nach der Injektion von AAV oder CRE-TAT in den lateralen Ventrikel die Fluoreszenz ausschließlich im ChP konzentriert war. Mit diesem Ansatz gelang es in der Studie, den Adenosin-A2A-Rezeptor (A2A R) im ChP mithilfe von RNA-Interferenz (RNAi) oder Cre/Locus von X-overP1 (Cre/LoxP)-Systemen auszuschalten, und zeigte, dass dieser Knockdown die Pathologie der experimentellen autoimmunen Enzephalomyelitis (EAE) lindern könnte. Diese Technik könnte wichtige Implikationen für die zukünftige Forschung über die Rolle des ChP bei ZNS-Erkrankungen haben.
Einleitung
Es wurde oft angenommen, dass der Plexus choroideus (ChP) zur Aufrechterhaltung der funktionellen Homöostase des Gehirns beiträgt, indem er Liquor cerebrospinalis (CSF) und den vom Gehirn abgeleiteten neurotrophen Faktor (BDNF) sezerniert1,2. Zunehmende Forschung in den letzten drei Jahrzehnten hat gezeigt, dass das ChP einen eindeutigen Weg für die Infiltration von Immunzellen in das zentrale Nervensystem (ZNS) darstellt.
Die Tight Junctions (TJs) des ChP, die aus einem monoschichtigen ChP-Epithel bestehen, halten die immunologische Homöostase aufrecht, indem sie verhindern, dass Makromoleküle und Immunzellen in das Gehirn eindringen3. Unter bestimmten pathologischen Bedingungen erkennt und reagiert das ChP-Gewebe jedoch auf gefahrenassoziierte molekulare Muster (DAMPs) im Liquor und im Blut, was zu einer abnormalen Immuninfiltration und einer Dysfunktion des Gehirns führt 4,5. Trotz seiner entscheidenden Rolle machen es die geringe Größe und die einzigartige Lage des ChP im Gehirn schwierig, seine Funktion zu untersuchen, ohne andere Gehirnregionen zu beeinträchtigen. Daher ist die spezifische Manipulation der Genexpression im ChP ein idealer Ansatz, um seine Funktion zu verstehen.
Ursprünglich wurden transgene Linien von Cyclisierungsrekombinationsenzymen (Cre), die Cre unter der Kontrolle von Promotoren exprimieren, die für Gene spezifisch sind, die in der ChP exprimiert werden, verwendet, um Zielgene durch Züchtung mit floxierten Kandidatengenen zu löschen 6,7,8. Zum Beispiel wird der Transkriptionsfaktor Forkhead box J1 (FoxJ1) ausschließlich im ChP-Epithel des pränatalen Mäusegehirns exprimiert7. So wurde die FoxJ1-Cre-Linie häufig verwendet, um Gene zu löschen, die sich im ChP 6,9 befinden. Der Erfolg dieser Strategie hängt jedoch stark von der Spezifität des Projektträgers ab. Nach und nach wurde entdeckt, dass das FoxJ1-Expressionsmuster nicht ausgeprägt genug war, da FoxJ1 auch in Flimmerepithelzellen in anderen Teilen des Gehirns und des peripheren Systems vorhanden war7. Um diese Einschränkung zu überwinden, wurde eine intrazerebroventrikuläre (ICV) Injektion von Cre-Rekombinase durchgeführt, um Rekombinase in die Ventrikel von gefloxten transgenen Linien zu bringen. Diese Strategie zeigte eine hohe Spezifität, was durch das Vorhandensein von tdTomato-Fluoreszenz allein im ChP-Gewebe belegtwird 10,11. Diese Methode ist jedoch noch durch die Verfügbarkeit von floxierten transgenen Mauslinien begrenzt. Um dieses Problem anzugehen, haben Forscher die ICV-Injektion des Adeno-assoziierten Virus (AAV) eingesetzt, um einen ChP-spezifischen Knockdown oder die Überexpression von Zielgenen zu erreichen12,13. Eine umfassende Untersuchung verschiedener AAV-Serotypen für eine ChP-Infektion ergab, dass AAV2/5 und AAV2/8 starke Infektionsfähigkeiten in der ChP aufweisen, während sie andere Hirnregionen nicht infizieren. Es wurde jedoch festgestellt, dass AAV2/8 das Ependym um die Ventrikel herum infizierte, während die AAV2/5-Gruppe keine Infektion aufwies14. Diese Methode hat den Vorteil, dass sie die Einschränkungen beim Erwerb von transgenen Tieren überwindet.
Dieser Artikel beschreibt ein Schritt-für-Schritt-Protokoll für den Gen-Knockdown im ChP mit zwei Methoden: ICV von AAV2/5, das shRNA des Adenosin-A2A-Rezeptors (A 2A R) trägt, und Cre-Rekombinase-Protein, das aus einer TAT-Sequenz (CRE-TAT)-Rekombinase besteht, um einen ChP-spezifischen Knockdown von A2A R zu erreichen. Die Studienergebnisse deuten darauf hin, dass der Abbau von A2AR in der ChP die experimentelle autoimmune Enzephalomyelitis (EAE) lindern kann. Dieses detaillierte Protokoll bietet nützliche Hinweise für ChP-Funktionsstudien und den spezifischen Knockdown von Genen im ChP.
Protokoll
Alle in dieser Studie beschriebenen Tierbehandlungen wurden in Übereinstimmung mit den Richtlinien des NIH-Leitfadens für die Pflege und Verwendung von Labortieren durchgeführt und vom Institutional Animal Care and Use Committee der Wenzhou Medical University genehmigt.
1. Tiere
- Kaufen Sie männliche C57BL/6-Mäuse im Alter von 8-12 Wochen und einem Gewicht von 20-22 g.
- Besorgen Sie sich die transgene Rosa-LSL (Lox-StoP-Lox)-tdTomato (Ai9) Mauslinie und männliche A2AR flox/flox Mäuse.
- Verteilen Sie die Mäuse nach dem Zufallsprinzip auf zwei Gruppen und halten Sie sie 1 Woche lang in Käfigen mit maximal fünf Mäusen pro Käfig unter einem Standardzyklus von 12 Stunden Licht und 12 Stunden Dunkel.
- Versorgen Sie die Mäuse mit ausreichend Futter und Wasser und halten Sie sie auf einer konstanten Temperatur von 25 °C.
2. ChP-spezifischer Knockdown von A2ARs mit AAV2/5-shRNA
- Wiegen Sie jede Maus und notieren Sie sich die Werte.
- Betäuben Sie die Mäuse intraperitoneal mit 1% Pentobarbital-Natrium in einer Dosierung von 6-8 ml/kg, was 60-80 mg/kg Pentobarbital entspricht, und legen Sie die Maus auf ein Heizkissen, um sie warm zu halten.
HINWEIS: Es ist wichtig, die richtige Dosierung von Pentobarbital-Natrium entsprechend dem Gewicht der Maus zu verabreichen, um eine erfolgreiche Operation zu gewährleisten. Die Anästhesie sollte nicht zu tief sein, da dies zur Sterblichkeit führen kann, aber auch nicht zu flach, da die Maus während des Eingriffs aufwachen und die Wirksamkeit der Virusinjektion beeinträchtigen könnte. Überprüfen Sie die richtige Anästhesiedosis, indem Sie die Zehen zusammenkneifen und sicherstellen, dass die Mäuse nicht ansprechen. - Verwenden Sie einen speziellen Mausrasierer, um die oberen Haare der betäubten Mäuse zu trimmen.
- Tragen Sie Augensalbe auf beide Augen auf, um ein Austrocknen zu verhindern, und fixieren Sie die Mäuse auf einem stereotaktischen Apparat, um das Gehirn zu immobilisieren. Decken Sie das Tier mit einem sterilen Tuch ab.
- Sterilisieren Sie die Haut von Kopf und Hals der Mäuse gründlich mit drei Runden Jodophor-Desinfektionsmittel und 75%igem Alkohol, um die postoperative Infektion zu reduzieren. Tragen Sie dann 1% Lidocain topisch auf die Kopfhaut von Mäusen auf und machen Sie einen kleinen Schnitt, um den Schädel unter einem Mikroskop vollständig freizulegen.
HINWEIS: Verwenden Sie während des gesamten Eingriffs sterile Instrumente. - Bereiten Sie zwei 10-μl-Spritzen vor: eine mit gekaufter AAV2/5-A 2A R-shRNA (Titer: 6,27 × 10 9 vg/μl) und die andere mit gekauftem AAV2/5-Scramble (Titer:6,21× 109 vg/μl).
HINWEIS: Bei Verwendung der Spritze muss das vordere Ende an eine Glaskapillare angeschlossen werden, und ein Bereich von 10 μl kann durch Steuerung der Länge der Glaskapillare erreicht werden. - Verwenden Sie das Mikroskop, um das Bregma und das Lambda zu lokalisieren und den Koordinatenpunkt einzustellen (AP: -0,58; ML: ±1,10; DL: -2,20) auf der 10-μl-Spritze (Abbildung 1). Der Koordinatenpunkt basiert auf dem stereotaktischen Atlas15 des Mäusegehirns.
- Bohren Sie am angepassten Koordinatenpunkt ein kleines Loch in den Schädel.
HINWEIS: Unter dem Mikroskop wird mit einem sterilen Mikrobohrer gegen die Oberfläche des Schädels gebohrt. Nach dem Bohren wird durch die Entfernung der Hirnhäute, die das Gehirn bedecken, und die Freilegung des darunter liegenden Hirnparenchyms eine Verletzung der Blutgefäße verhindert. Dieser Schritt verhindert, dass die Spitze der Glaskapillare durch die Hirnhäute abgebrochen wird. Der Durchmesser des Bohrlochs sollte ausreichend sein, damit die Nadelspitze in das Hirngewebe eindringen kann. - Verabreichung von 2 μl AAV2/5-A2AR-shRNA-Virus in die Hirnkammer durch laterale Injektion mit einer konstanten Rate von 100 nL/min. Halten Sie die Nadel 10 Minuten lang an Ort und Stelle, bevor Sie sie zurückziehen. Beachten Sie, dass das Virus mit einseitiger Injektion verabreicht wurde.
- Versiegeln Sie die verletzte Haut umgehend mit medizinischem Biofibrin-Kleber, um Virusverlust zu verhindern, der nach dem Entfernen der Nadel mit Liquor ausgespült werden kann, wenn der Kleber nicht schnell aufgetragen wird. Verwenden Sie auch keine Wattestäbchen, um den Liquor abzuwischen, da dies ebenfalls zu Virenverlust führen kann.
- Um die Regeneration zu erleichtern, legen Sie die Maus auf ein Heizkissen, um die Körpertemperatur bei 37,0 ± 0,5 °C zu halten, und tragen Sie 1% Lidocain topisch auf die Kopfhaut der Maus auf. Lassen Sie die Mäuse 2 Wochen lang erholen, bevor Sie das EAE-Modell induzieren, da dieser Zeitraum für die Expression des AAV2/5-A 2A R-shRNA-Virus und den anschließenden A2AR-Knockdown erforderlich ist.
3. ChP-spezifischer Knockdown von A2AR mit einem Cre/Locus von X-overP1 (Cre/LoxP) System
HINWEIS: Die folgenden Verfahren können mit der zuvor beschriebenen Methode erreicht werden. In den Schritten 2.1 bis 2.11 finden Sie detaillierte Informationen zu den Injektionsmethoden.
- Injizieren Sie 2 μl CRE-TAT-Rekombinase in jeden Seitenventrikel einer Rosa-LSL (Lox-StoP-Lox)-tdTomato-Maus als Versuchsgruppe und 2 μl sterile phosphatgepufferte Kochsalzlösung (PBS) als Kontrollgruppe. Unter Verwendung des gleichen Protokolls wie oben (Abschnitt 2) werden 2 μl CRE-TAT-Rekombinase in jeden der lateralen Ventrikel von A2AR-Flox/Flox-Mäusen zusammen mit 2 μl sterilem PBS als Kontrollgruppe injiziert.
- Bereiten Sie gefrorene Gewebeschnitte vor und führen Sie 2 Wochen nach der CRE-TAT-Rekombinase-Injektion eine Kernfärbung durch. Weitere Informationen finden Sie in den Schritten 4.1 bis 4.3.
4. Transkardiale Perfusion bei Mäusen
- Verabreichen Sie 60-80 mg/kg Pentobarbital-Natrium, um die Mäuse tief zu betäuben. Bestätigen Sie die Anästhesieebene durch eine Zehenkneifung und führen Sie eine transkardiale Perfusion mit 40 ml steriler PBS-Lösung gefolgt von 20 ml 4%igem Paraformaldehyd (PFA) durch.
HINWEIS: Eine erfolgreiche Perfusion wird durch eine weiße Farbe in der Leber angezeigt, während das Vorhandensein einer vergrößerten Lunge oder eines PBS-Abflusses aus dem Mund während der Perfusion auf ein Versagen des Verfahrens hindeutet. - Schnelles Extrahieren des Mäusegehirns, um einen minimalen Proteinabbau zu gewährleisten.
- Tauchen Sie das Mäusegehirn über Nacht zur Nachfixierung in 4 % PFA/PBS ein, gefolgt von einem Ersatz durch 30 % Saccharose-PB-Lösung für 72 Stunden.
HINWEIS: Es ist wichtig, eine übermäßige Dehydrierung des Hirngewebes zu vermeiden, daher sollte das Gehirn nicht zu lange in der Saccharose-PB-Lösung belassen werden.
5. Schneiden und Färben von gefrorenem Gewebe
- Betten Sie das zuvor dehydrierte Mäusegehirn in OCT-Kleber (Optimum Cutting Temperature) ein, frieren Sie das eingebettete Gehirn ein und schneiden Sie mit einem gleitenden Mikrotom koronale Schnitte mit einer Dicke von 20 μm.
- Legen Sie die Hirnabschnitte auf den Objektträger. Sobald die Hirnabschnitte getrocknet sind, lagern Sie sie für nachfolgende Experimente in einem -20 °C heißen Kühlschrank.
- Legen Sie jeden Objektträger in ein Rahmengehäuse und tauchen Sie den Rahmen in einen mit PBS gefüllten Behälter, um den Objektträger gründlich abzuspülen. Spülen Sie die Objektträger dreimal vorsichtig mit PBS-Lösung ab, jeweils 10 Minuten lang.
HINWEIS: Es ist Vorsicht geboten, um zu verhindern, dass die Hirnabschnitte vom Objektträger fallen. - Färben Sie die Objektträger 10 Minuten lang mit 4′,6-Diamidino-2-phenylindol (DAPI)-Lösung.
- Spülen Sie die Objektträger 5 Minuten lang mit PBS-Lösung.
- Tragen Sie einen Tropfen Antifade-Eindeckmittel auf die Gehirnabschnitte auf.
- Legen Sie ein Deckglas auf die Hirnschnitte, versiegeln Sie das Deckglas mit Nagellack und analysieren Sie die Schnitte mit einem herkömmlichen Fluoreszenzmikroskop.
6. EAE-Induktion
HINWEIS: Führen Sie die EAE-Induktion nach 2 Wochen der shRNA- oder CRE-TAT-Rekombinase-Injektiondurch 11.
- Stellen Sie eine wässrige Lösung her, indem Sie 2,5 mg Myelin-Oligodendrozyten-Glykoprotein (MOG35-55) mit 2 ml PBS mischen. Bereiten Sie eine vollständige Freunds-Adjuvans-Öllösung (CFA) vor, indem Sie M. tuberculosis (H37Ra) mit unvollständigem Freunds-Adjuvans (IFA) mischen.
- Mischen Sie die wässrige und die Öllösung im Verhältnis 1:1. Verwende ein T-Rohr, um die Mischung in einen Öl-in-Wasser-Zustand zu bringen.
HINWEIS: Das T-Rohr wird auch als Dreiwegerohr bezeichnet. Es handelt sich um ein Kunststoffrohr, das die Richtung der fließenden Lösung steuern kann, um MOG35-55 und CFA vollständig zu mischen. - Verwenden Sie einen Hochgeschwindigkeits-Homogenisator, um die MOG-Antigen-Emulsion für das EAE-Modell unter Eisbadbedingungen herzustellen.
- Die Mäuse werden intraperitoneal mit 1% Pentobarbital-Natrium in einer Dosierung von 6-8 ml/kg entsprechend 60-80 mg/kg Pentobarbital anästhesiert.
- Subkutan injizieren Sie die MOG-Antigen-Emulsion in vier verschiedene Punkte (Nacken, Rücken, linke und rechte Hüfte) in einem Volumen von 10 ml/kg für jeweils vier Injektionen.
HINWEIS: Es ist wichtig, die Injektionsstelle sorgfältig auszuwählen, da verschiedene Stellen unterschiedliche Auswirkungen auf die Morbidität und Mortalität von Mäusen haben können. Darüber hinaus können wiederholte MOG-Injektionen zu einer Immuntoleranz führen, so dass das Forschungsteam eine einzige Injektionsmethode wählte, um dieses potenzielle Problem zu verhindern. - Nach der MOG-Injektion werden sofort 500 ng/ml Pertussistoxin (PT) intraperitoneal in einer Dosierung von 5 mg/kg injiziert.
HINWEIS: PT erhöht die Durchlässigkeit der Blut-Hirn-Schranke (BHS) und erleichtert die Infiltration von T-Zellen in das Gehirn. - Nach 48 h wird die PT-Lösung im gleichen Volumen intraperitoneal injiziert.
7. Neurologischer Defizit-Score
- Bewerten und bewerten Sie die Mäuse täglich anhand einer Bewertungsskala16 von 0 bis 15, um die Inzidenz und den Schweregrad von EAE anhand der folgenden neurologischen Defizite zu beurteilen:
Schwanz: 0 zeigt keine Anzeichen an, 1 steht für einen halb gelähmten Schwanz und 2 für einen vollständig gelähmten Schwanz.
Gliedmaßen: 0 steht für keine Anzeichen, 1 für einen schwachen oder veränderten Gang, 2 für Parese und 3 für eine vollständig gelähmte Gliedmaße. - Weisen Sie einem querschnittsgelähmten Tier mit vollständiger Lähmung einen Wert von 12 zu und weisen Sie der Mortalität einen Wert von 15 zu.
8. Hämatoxylin-Eosin (H&E)-Färbung
- Nimm das dehydrierte Mäusegehirn und bette es in geschmolzenes Paraffin ein. Lassen Sie den Paraffinblock abkühlen und für die spätere Verwendung fest werden.
HINWEIS: Der Paraffinblock sollte vollständig trocken und kühl sein, um Gewebeschäden zu vermeiden. - Schneiden Sie den Paraffinblock für das Mäusegehirn in 5 μm dicke Objektträger. Den Paraffin-Mäuse-Hirnschnitt auf einen Objektträger legen und im 60 °C heißen Ofen 3 h trocknen.
- Tauchen Sie die Objektträger nacheinander für 10 Minuten in Xylollösung I, Xylollösung II für 10 Minuten, 100% Alkohol I für 3 Minuten, 100% Alkohol II für 3 Minuten, 95% Alkohol für 3 Minuten, 90% Alkohol für 3 Minuten, 80% Alkohol für 3 Minuten, 70% Alkohol für 3 Minuten und destilliertes Wasser für 1 Minute.
9. Quantitative Analyse der Polymerase-Kettenreaktion (qPCR)
- Nachdem Sie die Mäuse mit PBS durchblutet haben, entfernen Sie das ChP aus den Ventrikeln und extrahieren Sie die RNA mit Trizol. Synthetisieren Sie die cDNA mit dem ersten Strang-cDNA-Synthesekit.
- Führen Sie die qPCR-Analyse mit Ex Taq SYBR-green Premix und einem Real-Time-PCR-System durch. Verwenden Sie die folgenden A2AR-Primer: vorwärts - GCCATCCCATTCGCCATCA; umgekehrt - GCAATAGCCAAGAGGCTGAAGA.
Ergebnisse
ChP-spezifischerA2AR-Knockdown durch ICV-Injektion von AAV2/5-shRNA oder CRE-TAT
Die Rolle von A2AR in der ChP als mächtiger Regulator neuronaler Information in der EAE-Pathogenese bleibt unklar. Das Ausschalten der ChP-spezifischen A 2A R-Expression könnte Aufschluss über die regulatorischen Auswirkungen von A2AR auf das zentrale Immunsystem bei EAE und anderen Entzündungen des Nervensystems geben. In dieser Studie wurde die ICV-Injektion von CRE-TAT verwendet, um die A 2A R-Expression im ChP von A2AR-Flox/Flox-Mäusen zu verringern. Um die ChP-Spezifität zu gewährleisten, injizierten wir zunächst CRE-TAT in die lateralen Ventrikel von Rosa-LSL (Lox-StoP-Lox)-tdTomato (Ai9)-Mäusen. Die Bilder deuten darauf hin, dass die spontane tdTomato-Fluoreszenz auf das ChP-Gewebe beschränkt war (Abbildung 2). In ähnlicher Weise verabreichte die Studie C57BL/6-Mäusen AAV2/5-CMV-A2AR-shRNA-CMV-verstärktes grün fluoreszierendes Protein (EGFP) und stellte fest, dass die EGFP-Fluoreszenz auf die Epithelzellschicht des ChP beschränkt war und die umgebenden Parenchymzellen in der Nähe der Seitenventrikel nicht infizierte (Abbildung 3).
EAE-Induktion mit MOG35-55
Um eine stabile EAE zu induzieren, wurde den Mäusen subkutan eine Emulsion aus MOG35-55 und CFA injiziert, gefolgt von einer intraperitonealen Injektion von PT an den Tagen 0 und 2 nach der Immunisierung (Abbildung 4). Die klinische Symptomskala wurde verwendet, um die EAE-Werte täglich auf der Grundlage des Zustands von Schwanz und Gliedmaßen zu bewerten. Der Beginn der EAE wurde als der erste Tag mit einem EAE-Score ≥1 definiert, während die Dauer zwischen Beginn und Höhepunkt der EAE-Werte als progressives Stadium bezeichnet wurde.
ChP-spezifischerA2AR-Knockdown lindert EAE-Pathologie
Um die Beteiligung des A 2A R-Signals an der EAE-Pathologie zu untersuchen, wurde in der Studie ein ChP-spezifischer A2AR-Knockdown verwendet. In der Studie wurde A 2A R im ChP mittels ICV-Injektion von CRE-TAT oder AAV2/5-A2AR-shRNA gezielt abgebaut. 2 Wochen nach dem Knockdown wurde die EAE durch eine MOG35-55-Immunisierung induziert. Die Ergebnisse zeigten, dass Mäuse mit A2AR-Knockdown im Vergleich zur Kontrollgruppe eine mildere EAE-Pathologie entwickelten, was sich in niedrigeren Werten und einer reduzierten Infiltration von Immunzellen im Rückenmark zeigte (Abbildung 5A,B,E,F). Darüber hinaus wurden fünf EAE-induzierte Mäuse aus jeder Gruppe am Tag 20 nach der MOG35-55-Immunisierung nach dem Zufallsprinzip ausgewählt. Nach der Perfusion mit PBS wurden die ChPs für die RNA-Extraktion und qPCR isoliert. Die qPCR-Analyse zeigte, dass die mRNA-Spiegel von A 2A R in den AAV2/5-shRNA- (A2AR-Kd) und CRE-TAT-Gruppen im Vergleich zu jeder Kontrolle deutlich erniedrigt waren (Abbildung 5C,D).

Abbildung 1: Anatomische Lokalisation der Injektionsstelle des lateralen Ventrikels. (A) Ein schematisches Diagramm, das den Zeitpunkt der Virusinjektion zeigt. (B) Die Injektionsstelle des Seitenventrikels befindet sich 0,58 mm unterhalb des Bregmas und 1,1 mm lateral der sagittalen Naht, wie durch den roten Punkt angezeigt. (C) Ein Bild, das die Stelle der Virusinjektion auf einer Maus zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
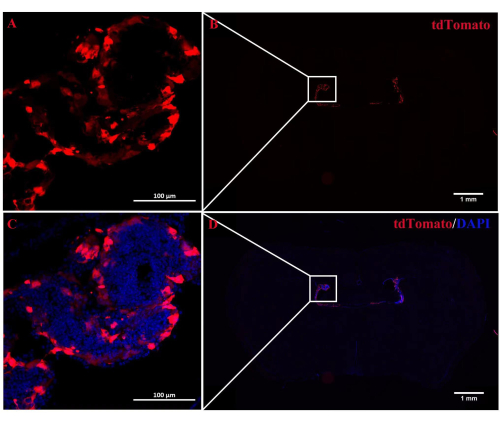
Abbildung 2: Lokalisation der tdTomato-Fluoreszenz in der ChP . (A,B) Repräsentatives Bild von Rosa-LSL (Lox-StoP-Lox)-tdTomato-Mäusen, die mit ICV-Injektion von CRETAT behandelt wurden. 2 Wochen später war die tdTomato-Autofluoreszenz spezifisch im ChP-Gewebe lokalisiert (n = 3/Gruppe). (C,D) Die zusammengeführten Bilder der tdTomato Autofluoreszenz und DAPI. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
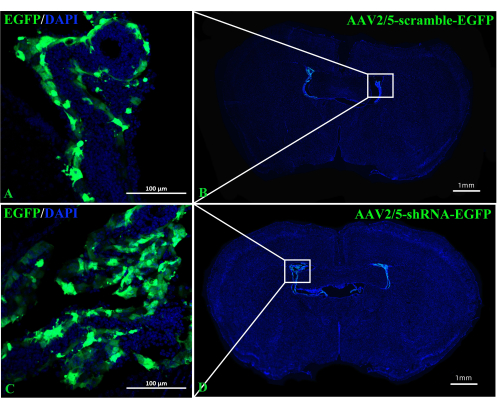
Abbildung 3: Repräsentative Bilder von C57BL/6-Mäusen, aufgenommen 2 Wochen nach ICV-Injektion von AAV2/5-scramble-EGFP oder AAV2/5-shRNA-EGFP. (A,B) Die repräsentativen Bilder von Mäusen, denen AAV2/5-scramble-EGFP injiziert wurde (n = 3/Gruppe). (C,D) Die repräsentativen Bilder von Mäusen, denen AAV2/5-shRNA-EGFP injiziert wurde (n = 3/Gruppe). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Induktion des EAE-Modells. (A) Zunächst wird die MOG-Antigen-Emulsion subkutan an vier verschiedene Stellen (Nacken, Rücken, linke und rechte Hüfte) injiziert, die durch rote Punkte gekennzeichnet sind. (B) PT wird zum Zeitpunkt der Immunisierung intraperitoneal injiziert und 2 Tage später wiederholt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Der ChP-spezifische Knockdown von A 2A R linderte die EAE-Pathologie. (A) Der ChP-spezifischeKnockdown von A 2A R in A 2AR flox/flox Mäusen, der durch ICV-Injektion von CRE-TAT erreicht wurde, führte zu verringerten klinischen EAE-Scores (n = 6-7/Gruppe). Die statistische Analyse wurde mittels Zweiwege-RM-ANOVA durchgeführt, gefolgt von Sidaks multiplem Vergleichstest. (B) ChP-spezifischer Knockdown von A2AR in Wildtyp-Mäusen (WT), der mit ICV-Injektion von AAV2/5-shRNA erreicht wurde, verringerte die klinischen EAE-Werte (n = 7-8/Gruppe). Die statistische Analyse wurde mittels Zweiwege-RM-ANOVA durchgeführt, gefolgt von Sidaks multiplem Vergleichstest. (C,D) Ergebnisse der qPCR-Analyse der A2AR mRNA-Spiegel in ChP-Gewebe (n = 5/Gruppe). Die statistische Analyse wurde mit einem ungepaarten t-Test durchgeführt. (E,F) H&E-Färbung. Der ChP-spezifische A2A RKnockdown dämpfte die Infiltration von Immunzellen in das Rückenmark. Die statistische Signifikanz wird als ###p < 0,001, **p < 0,01 und ***p < 0,001 dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In der Studie wurden zwei unterschiedliche Ansätze für den gezielten Knockdown von ChP-Genen vorgestellt. Der erste Ansatz beinhaltete die ICV-Injektion von CRE-TAT, das Cre-Rekombinase enthält, in A2AR-Flox/Flox-Mäuse. Der zweite Ansatz beinhaltete die ICV-Injektion von AAV2/5, das shRNA von A2AR trägt. Durch die Verwendung dieser beiden Strategien gelang es der selektiven Knockdown von A 2A R innerhalb der ChP und konnte die schützende Wirkung der Hemmung des A2AR-Signalwegs in der ChP auf die EAE-Pathologie nachweisen. Bemerkenswert ist, dass dieses Protokoll zwei entscheidende Schritte umfasst. Erstens ist die stereotaktische Lokalisierungsoperation unerlässlich, und eine signifikante Abweichung von den vorgeschlagenen Koordinaten kann zu zufälligen Fehlern führen. Zweitens ist das Volumen des injizierten Virus entscheidend, da festgestellt wurde, dass die Injektion von weniger als 1 μl Virus (~6 x 1012) ebenfalls eine gewisse Wahrscheinlichkeit des Versagens hat. Dies ist möglicherweise darauf zurückzuführen, dass für eine ausreichende Infektion eine ausreichende Menge an Viruspartikeln benötigt wird.
Die Verwendung des Cre/LoxP-Systems erlaubte es nicht, die genaue Verteilung der CRE-TAT-Rekombinase im Gehirn nach ICV-Injektion zu beobachten. Infolgedessen wurden in der Studie Rosa-LSL (Lox-StoP-Lox)-tdTomato-Mäuse verwendet, um die Verteilung von CRE-TAT anhand der Autofluoreszenz des tdTomato-Proteins zu verfolgen. Die tdTomato-Fluoreszenz wurde 2 Wochen nach intrazerebroventrikulärer Injektion von CRE-TAT ausschließlich in ChP-Geweben lokalisiert, was darauf hindeutet, dass die Rekombinase hauptsächlich vom ChP absorbiert wurde. Als nächstes wurde CRE-TAT an A 2A R flox/flox Mäuse verabreicht, und eine Abnahme der A2AR mRNA-Spiegel wurde im ChP-Gewebe beobachtet. Diese gezielte Knockdown-Strategie wurde verwendet, um die Rolle der Kortikosteroid-Signalübertragung in der ChP bei der Vermittlung von psychischem Stress zu untersuchen17. Alternativ wurde AAV2/5 verwendet, um shRNA zu liefern, die auf ChP-Gene abzielt. Frühere Studien haben die Infektionsfähigkeit verschiedener Serotypen von AAVs und Lentiviren in ChP-Gewebe untersucht und festgestellt, dass AAV2/5 und AAV2/8 am wirksamsten waren14. Die Studie zeigte, dass AAV2/5 in der Lage war, das ChP spezifisch zu infizieren, ohne offensichtliche Infektionen in anderen Hirnregionen zu verursachen. Diese beiden Methoden sind weniger aufwendig als klassische Knockout-Strategien, die zwei transgene Linien (Cre- und Flox-Linien) erfordern6,18. Eine Einschränkung dieser Studie ist das Fehlen eines Gain-of-Function-Experiments mit Genüberexpression. Ein möglicher Ansatz, um dies zu erreichen, wäre jedoch, die vollständige cDNA zu klonen und in das AAV2/5-Virus zu verpacken, das über eine ICV-Infektion verabreicht würde. In einer früheren Studie wurde festgestellt, dass die Überexpression von NKCC1 in der ChP mit AAV2/5 die Liquorclearance fördert und die Ventrikulomegalie in vivo reduziert 9. Es ist wichtig zu beachten, dass entweder die AAV2/5- oder die Cre/LoxP-Strategie ihren eigenen Vorteil haben. Die ICV-Injektion von CRE-TAT in transgene Mäuse sorgt für eine hohe Knockdown-Effizienz, da das Zielgen direkt aus der DNA der Zellen entfernt wird. Diese Methode hängt jedoch von der Produktion und Züchtung von gefloxten Mäusen ab. Auf der anderen Seite vermeidet die ICV-Injektion von AAV2/5 den zeitaufwändigen Prozess der Züchtung transgener Mäuse. Die Knockdown-Effizienz dieser Methode hängt jedoch weitgehend von der Leistung der designten shRNA ab. Daher können die Forscher eine geeignete Methode auf der Grundlage ihrer experimentellen Bedingungen auswählen.
Multiple Sklerose (MS) ist eine Autoimmunerkrankung, die eine Entzündung und Demyelinisierung der weißen Substanz im ZNS verursacht19. Um die pathologischen Mechanismen von MS zu untersuchen, haben Forscher ein EAE-Modell verwendet, das die Symptome der Krankheit wie Demyelinisierung und Immuninfiltration simuliert. Dieses Modell gilt als ideal, um MS zu verstehen. Im Jahr 2009 wurde entdeckt, dass Immunzellen das ZNS durch das ChP infiltrieren, was ein Schlüsselweg für den Eintritt von Immunzellen in der MS-Pathologie ist. Die "erste Welle" von Immunzellen gelangt über das ChP in den Liquor, gefolgt von der "zweiten Welle", die über die BHS20 in das Gehirnparenchym gelangt. Die "erste Welle" von Immunzellen fördert die Entzündung und beschleunigt die Leckage von BHS, so dass die Hemmung der Immuninfiltration am ChP für eine frühzeitige Intervention bei MS nützlich sein könnte. Chemokine und Adhäsionsmoleküle regulieren die Gating-Aktivität von ChP und kontrollieren die Fähigkeit von Lymphozyten, über das ChP zu infiltrieren21,22,23.
Frühere Studien verwendeten Ganzkörper-Knockout oder pharmakologische Technologie (z. B. neutralisierende Antikörper), um Signalmoleküle in der ChP zu untersuchen, aber diese Methoden definierten ihre biologische Funktion im MS-pathologischen Prozess nicht genau. In einer kürzlich durchgeführten Studie schlugen Forscher A 2A R aus, das sich im ChP von A2AR-Flox/Flox-Mäusen befindet, und stellten fest, dass die EAE-Werte und die Immuninfiltration signifikant reduziert waren11. Diese Studie bestätigt die Rolle des A2AR-Signalwegs im ChP während der EAE-Pathologie und zeigt, dass ChP-spezifische Knockdown-Methoden nützliche Werkzeuge für die Untersuchung der ChP-Funktion bei ZNS-Pathologien sind.
Zusammenfassend lässt sich sagen, dass das ChP-spezifische Manipulationsprotokoll ein ideales Werkzeug ist, um die biologische Funktion des ChP zu untersuchen, das an degenerativen Erkrankungen im ZNS wie Parkinson, Alzheimer, MS usw. beteiligt ist.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen oder andere Offenlegungen zu deklarieren haben.
Danksagungen
Wir danken der National Natural Science Foundation of China (Zuschuss Nr. 31800903, vergeben an W. Zheng) und dem Wenzhou Science and Technology Project (Nr. Y2020426, vergeben an Y. Y. Weng) für diese Arbeit.
Materialien
| Name | Company | Catalog Number | Comments |
| A2ARflox/flox mice | State Key Laboratory of Ophthalmology, Optometry and Visual Science, Wenzhou Medical University | ||
| AAV2/5-A2AR-ShRNA virus | Shanghai Heyuan Biotechnology Co. LTD | pt-4828 | |
| antifade mounting medium | Beyotime Biotechnology | 0100-01 | |
| borosilicate glass capillary | Beijing Meiyaxian Technology Co. Ltd | B100-50-10 | |
| brain stereotaxic apparatus | RWD, Shenzhen | 69100 | |
| C57BL/6 mice | Beijing Vital Charles River Laboratory Animal Technology Company | ||
| CRE-TAT recombinase | Millipore | SCR508 | |
| DAPI | Absin | B25A031 | |
| frozen slicing machine | Leica | CM1950 | |
| H37Ra | Becton Dickinson and company | 231141 | |
| Hamilton syringe | Hamilton, American | P/N: 86259 | |
| Incomplete Freunds adjuvant | Sigma | F5506 | |
| Laser confocal microscope | Zeiss | LSM900 | |
| MOG35-55 | Suzhou Qiangyao Biotechnology Co., LTD | 4010006243 | |
| OCT glue | Epredia | 6502p | |
| paraformaldehyde | Chengdu Kelong Chemical Reagent Company | 30525-89-4 | |
| pentobarbital sodium | Boyun Biotech | PC13003 | |
| Pipette gun | Eppendorf | N45014F | |
| PrimeScript 1st Strand cDNA Synthesis Kit | Takara | 6110A | |
| Real- Time PCR System | BioRad | CFX96 | |
| Rosa-LSL (Lox-StoP-Lox)-tdTomato mice | Jackson Laboratory | ||
| sucrose | Sangon Biotech | A502792-0500 | |
| super high speed homogenizer | IKA | 3737025 | |
| Trizol | Invitrogen | 15596026 | |
| xylene solution | Chengdu Kelong Chemical Reagent Company | 1330-20-7 |
Referenzen
- Damkier, H. H., Brown, P. D., Praetorius, J. Cerebrospinal fluid secretion by the choroid plexus. Physiological Reviews. 93 (4), 1847-1892 (2013).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews: Neuroscience. 16 (8), 445-457 (2015).
- Wolburg, H., Paulus, W. Choroid plexus: biology and pathology. Acta Neuropathologica. 119 (1), 75-88 (2010).
- Solar, P., Zamani, A., Kubickova, L., Dubovy, P., Joukal, M. Choroid plexus and the blood-cerebrospinal fluid barrier in disease. Fluids Barriers CNS. 17 (1), 35(2020).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Myung, J., et al. The choroid plexus is an important circadian clock component. Nature Communications. 9 (1), 1062(2018).
- Zhang, Y., et al. A transgenic FOXJ1-Cre system for gene inactivation in ciliated epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 36 (5), 515-519 (2007).
- Johansson, P. A., et al. The transcription factor Otx2 regulates choroid plexus development and function. Development. 140 (5), 1055-1066 (2013).
- Xu, H., et al. Choroid plexus NKCC1 mediates cerebrospinal fluid clearance during mouse early postnatal development. Nature Communications. 12 (1), 447(2021).
- Spatazza, J., et al. Choroid-plexus-derived Otx2 homeoprotein constrains adult cortical plasticity. Cell Reports. 3 (6), 1815-1823 (2013).
- Zheng, W., et al. Choroid plexus-selective inactivation of adenosine A2A receptors protects against T cell infiltration and experimental autoimmune encephalomyelitis. Journal of Neuroinflammation. 19 (1), 52(2022).
- Steffensen, A. B., et al. Cotransporter-mediated water transport underlying cerebrospinal fluid formation. Nature Communications. 9 (1), 2167(2018).
- Zhu, L., et al. Klotho controls the brain-immune system interface in the choroid plexus. Proceedings of the National Academy of Sciences. 115 (48), E11388-E11396 (2018).
- Chen, X., et al. Different serotypes of adeno-associated virus vector- and lentivirus-mediated tropism in choroid plexus by intracerebroventricular delivery. Human Gene Therapy. 31 (7-8), 440-447 (2020).
- Konsman, J. P. The mouse brain in stereotaxic coordinates. Psychoneuroendocrinology. 6 (28), 827-828 (2003).
- Weaver, A., et al. An elevated matrix metalloproteinase (MMP) in an animal model of multiple sclerosis is protective by affecting Th1/Th2 polarization. FASEB J. 19 (12), 1668-1670 (2005).
- Kertser, A., et al. Corticosteroid signaling at the brain-immune interface impedes coping with severe psychological stress. Science Advances. 5 (5), 4111(2019).
- Kaiser, K., et al. MEIS-WNT5A axis regulates development of fourth ventricle choroid plexus. Development. 148 (10), (2021).
- Compston, A., Coles, A. Multiple sclerosis. Lancet. 372 (9648), 1502-1517 (2008).
- Reboldi, A., et al. C-C chemokine receptor 6-regulated entry of TH-17 cells into the CNS through the choroid plexus is required for the initiation of EAE. Nature Immunology. 10 (5), 514-523 (2009).
- Jovanova-Nesic, K., et al. Choroid plexus connexin 43 expression and gap junction flexibility are associated with clinical features of acute EAE. Annals of the New York Academy of Sciences. 1173, 75-82 (2009).
- Jovanova-Nesic, K., Jovicic, S., Sovilj, M., Spector, N. H. Magnetic brain stimulation upregulates adhesion and prevents Eae: MMP-2, ICAM-1, and VCAM-1 in the choroid plexus as a target. International Journal of Neuroscience. 119 (9), 1399-1418 (2009).
- Mills, J. H., Alabanza, L. M., Mahamed, D. A., Bynoe, M. S. Extracellular adenosine signaling induces CX3CL1 expression in the brain to promote experimental autoimmune encephalomyelitis. Journal of Neuroinflammation. 9, 193(2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten