Method Article
Создание, поддержание, дифференциация, генетические манипуляции и трансплантация органоидов слезных желез мыши и человека
В этой статье
Резюме
Этот протокол описывает, как устанавливать, поддерживать, генетически модифицировать, дифференцировать, функционально характеризовать и трансплантировать органоиды слезных желез, полученные из первичных тканей мыши и человека.
Аннотация
Слезная железа является важным органом гомеостаза глазной поверхности. Производя водную часть слезной пленки, он защищает глаз от стресса высыхания и внешних воздействий. Мало что известно о (пато)физиологии слезных желез из-за отсутствия адекватных моделей in vitro . Органоидная технология зарекомендовала себя как полезная экспериментальная платформа для нескольких органов. Здесь мы делимся протоколом для установления и поддержания органоидов слезных желез мыши и человека, начиная с биопсии слезных желез. Изменяя условия культивирования, мы улучшаем функциональность органоидов слезных желез. Функциональность органоидов может быть исследована с помощью «плачущего» анализа, который включает в себя воздействие на органоиды слезных желез выбранных нейротрансмиттеров, чтобы вызвать высвобождение слезы в их просвете. Мы объясняем, как визуализировать и количественно оценить это явление. Чтобы исследовать роль генов, представляющих интерес в гомеостазе слезных желез, они могут быть генетически модифицированы. Мы подробно описываем, как генетически модифицировать органоиды слезных желез с помощью базовых редакторов - от дизайна направляющей РНК до генотипирования клонов органоидов. Наконец, мы покажем, как исследовать регенеративный потенциал органоидов слезных желез человека путем ортотопической имплантации мышью. Вместе этот всеобъемлющий набор инструментов предоставляет ресурсы для использования органоидов слезных желез мыши и человека для изучения (пато)физиологии слезных желез.
Введение
Слезная железа представляет собой железистый эпителий, ответственный за выработку большей части водного слоя слезной пленки1. Водный слой слезной пленки содержит не только воду для смазывания глазной поверхности, но и большой репертуар антимикробных компонентов, которые защищают глазную поверхность от инфекций2. При повреждении или воспалении слезной железы возникает синдром сухого глаза, который вызывает дискомфорт у пациентов и в конечном итоге может привести к потере зрения3. На протяжении многих лет модельные системы для изучения слезной железы, в частности железы человека, были ограничены 4,5,6. Это способствовало пробелу в знаниях о функции слезных желез в физиологических и патологических условиях.
В последнее время были разработаны модели in vitro для исследования слезной железы в чашке 7,8,9. Эти органоиды слезных желез получены из взрослых стволовых клеток, выращенных в виде трехмерных структур во внеклеточном матриксе, дополненных коктейлем факторов роста, который поддерживает их регенеративные способности in vitro7. Преимущество органоидов, полученных из взрослых стволовых клеток (ASC), заключается в том, что они могут сохраняться в течение очень долгого времени, повторяя особенности здоровых тканей. Этот тип органоида состоит исключительно из эпителиальных клеток, в отличие от органоидов, полученных из индуцированных плюрипотентных стволовых клеток (iPSC), которые также могут содержать, например, стромальные клетки. В отличие от органоидов, полученных из плюрипотентных стволовых клеток (PSC), органоиды ASC образуются непосредственно из взрослой ткани и не требуют каких-либо генетических модификаций для расширения. Органоиды ASC выражают характеристики взрослых особей10.
Этот протокол содержит набор инструментов для получения органоидов слезных желез из первичных тканей мыши и человека. Протокол описывает, как еще больше повысить функциональность органоидов путем простого удаления фактора роста и как спровоцировать органоиды на секрецию слезной жидкости путем проведения анализа набухания. Этот протокол дополнительно включает в себя метод трансфекции на основе электропорации для генной инженерии органоидов мыши с использованием базовых редакторов, полученных из CRISPR. В отличие от обычного Cas9, использование редакторов оснований позволяет модифицировать одиночные основания в геноме без генерации двухцепочечного разрыва11,12. Наконец, описана ортотопическая трансплантация органоидов слезных желез человека иммунодефицитным мышам и последующая гистологическая оценка приживления. Этот инструментарий органоидов слезных желез может быть использован в исследованиях регенерации и функции слезных желез, а также для моделирования генетических и воспалительных заболеваний.
протокол
Эксперименты на мышах были одобрены Комитетом по этике животных Королевской академии искусств и наук Нидерландов (KNAW) по лицензии проекта AVD8010020151. Органоиды были получены из излишков материала мышей. Биопсия слезных желез человека была собрана из отходов пациентов, перенесших операцию в Университетском медицинском центре Утрехта (UMCU), после одобрения комитетом по медицинской этике в соответствии с протоколом No 18-740. Протокол содержит несколько разделов, которые показаны на рисунке 1.

Рисунок 1: Обзор протокола. На этом рисунке показаны различные этапы протокола. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
ПРИМЕЧАНИЕ: Все композиции сред и буферов описаны в Дополнительной таблице 1.
1. Создание органоидов из слезных желез мыши и человека
- Рассечение слезной железы мыши
- Подготовьте инструменты для вскрытия, включая ножницы, щипцы и подушечки для вскрытия. Усыпить мышь ингаляцией O2 / CO2 13.
- Положите усыпленную мышь на брюшко на подушечку для вскрытия и прижмите ее конечности. Намочите волосы, расположенные между ушами мыши и на лбу, используя 70% этанол.
- С помощью ножниц для рассечения сделайте отверстие за черепом между ушами. Расширьте это отверстие над лбом до носа. По-прежнему используя ножницы, разрежьте кожу за ушами, чтобы получились два лоскута.
- Сильно потяните лоскуты к носу, пока слезные железы не обнажаются, как показано на рисунке 2A. Пришпытрите створки к диссекционной подушечке. С помощью ножниц сделайте небольшой разрез в мембране, расположенной над слезной железой, чтобы полностью обнажить слезную железу.
- С помощью щипцов потяните слезную железу. Должно быть некоторое сопротивление до тех пор, пока главный слезный проток не разорвется. При желании разрежьте главный слезный проток непосредственно ножницами.
- Поместите слезную железу мыши в PBS для культивирования тканей до дальнейшей обработки. Приступают к обработке слезной железы в течение 2-4 ч, чтобы ограничить гибель клеток. Если это займет больше времени, поместите слезную железу мыши в среду для сбора биопсии (дополнительная таблица 1).
ПРИМЕЧАНИЕ: Несколько слезных желез могут быть объединены, если немедленно требуется большое количество органоидов.
- Сбор биопсий слезных желез человека
- Перед операцией подготовьте 20 мл аликвот среды для сбора биопсии (дополнительная таблица 1) в пробирке объемом 50 мл и передайте ее хирургу перед операцией. Эту среду можно выдерживать при температуре 4 °C в течение нескольких месяцев.
- В день операции позвольте хирургу взять образец кусочка слезной железы (обычно <1 мм3) и хранить его в среде для сбора биопсии (дополнительная таблица 1) при температуре 4 ° C.
- Соберите биопсию, чтобы обработать ее как можно скорее. В идеале это должно быть в тот же день в течение 2 часов после забора биопсии.
- Органоидная деривация
- Заранее подготовьте следующее: размороженный внеклеточный матрикс (ECM), мышь комнатной температуры (RT) или среда расширения человека (Дополнительная таблица 1), размороженная коллагеназа, базовая среда (Дополнительная таблица 1), два скальпеля, одна чашка Петри 10 см, сетчатый фильтр 70 мкм, установленный на пробирке объемом 15 мл, и 12-луночные суспензионные пластины, предварительно нагретые при 37 ° C в течение 30 минут.
- Подготовьте среду для разложения, смешав все компоненты, указанные в дополнительной таблице 1. Предварительно смочите скальпели в этой среде, чтобы кусочки ткани не прилипли к ним.
- Извлеките ткань слезной железы мыши или человека из среды и поместите ее в чашку Петри.
- Используя предварительно смоченные скальпели, пропустите ткань через мясорубку. Как только кусочки ткани станут очень маленькими (т.е. <0,5мм3), поместите их в среду для разложения, соскоблив их с чашки Петри скальпелем. Если биопсия человека уже очень мала, поместите ее непосредственно в среду для пищеварения, не измельчая, чтобы избежать потери ткани.
- Инкубируйте кусочки ткани до 15 минут на водяной бане при температуре 37 °C. Регулярно переворачивайте пробирку объемом 15 мл, чтобы ресуспендировать кусочки. Следите за диссоциацией клеток под настольным микроскопом, чтобы не переварить ткань.
- Тем временем сузьте пипетку Пастера, поместив ее наконечник в пламя во время вращения, и предварительно смочите ее в основной среде. Чтобы эффективно диссоциировать ткань, убедитесь, что отверстие немного меньше, чем самые большие оставшиеся кусочки ткани. Чтобы облегчить процесс диссоциации, каждые 5 минут пипеткой «Пастер» пипеткой вверх и вниз пипеткой Пастера предварительно смачивается.
- Когда под микроскопом видно много одиночных клеток и небольших скоплений, остановите диссоциацию, добавив 10 мл основной среды. Отжимайте при 400 x g в течение 5 минут, чтобы гранулировать ячейки.
- Удалите надосадочную жидкость и ресуспендируйте гранулу в 10 мл основной среды, чтобы повторить стирку. Отфильтруйте его через ситечко 70 мкм, чтобы удалить большие непереваренные кусочки ткани и оставшиеся коллагеновые волокна, что предотвратит адекватную полимеризацию ECM. Отжим элюат при 400 х г в течение 5 мин.
ПРИМЕЧАНИЕ: Гранула эритроцитов указывает на наличие эритроцитов, которые обычно не препятствуют образованию органоидов. Однако для некоторых применений, таких как проточная цитометрия, эритроциты должны быть лизированы. Для этого инкубируйте клетки в 5 мл свежего буфера для лизиса эритроцитов при RT в течение 5 мин и гранулируйте клетки при 400 x g в течение 5 мин. - Удалите надосадочную жидкость и ресуспендируйте клеточную гранулу в 100 мкл холодного ECM для одной слезной железы мыши и в 50 мкл холодного ECM для биопсии человека. При ресуспендировании будьте осторожны, чтобы не образовывать пузырьки, так как это также может повлиять на полимеризацию и стабильность ECM.
- Засевают до 100 мкл клеток в лунку 12-луночной суспензионной пластины. Используйте P200, чтобы сделать ~ 20 мкл капель в лунке. Чем мельче капли, тем лучше диффузия факторов роста и питательных веществ через матрицу.
- Поместите тарелку вверх дном в увлажненный инкубатор при температуре 37 °C на 20-30 минут, чтобы ECM затвердел.
- Как только ECM затвердеет, добавьте ~ 1 мл мыши RT или среды расширения человека на лунку из 12 лунок. Обновляйте среду каждые 2-3 дня, пока органоиды не достигнут размера 300 мкм. Для этого аспирируйте среду в лунку и аккуратно добавьте расширительную среду сбоку лунки, не касаясь капель ECM, чтобы не нарушить их.
ПРИМЕЧАНИЕ: Примоцин (100 мг / мл; 1: 1000 из коммерческих запасов) может быть добавлен при выделении, если происходит бактериальное загрязнение. Однако, поскольку он также замедляет рост органоидов, предпочтительнее не добавлять его или удалять после одного или двух проходов.
2. Расширение органоидов слезных желез мыши и человека
- Через ~7 дней для органоидов мыши и ~10 дней для органоидов человека, когда органоиды достигнут размера ~300 мкм, удаляют питательную среду.
- Ресуспендируйте капли ECM, содержащие органоиды, в 1 мл раствора трипсина, энергично пипетируя вверх и вниз P1,000, пока капли не развалятся. Переложите эту смесь в пробирку объемом 15 мл и ненадолго инкубируйте на водяной бане с температурой 37 °C.
- Через 2-3 минуты с помощью суженной и предварительно смоченной пипетки Пастера пипетка для пипетки органоидной суспензии вверх и вниз в 10-15 раз. Проверить состояние диссоциации органоидов под настольным микроскопом; Следует получить небольшие скопления ~ 20 клеток. Выдерживайте дольше на водяной бане при температуре 37 °C и повторяйте этап пипетирования до тех пор, пока диссоциация не станет удовлетворительной.
ПРИМЕЧАНИЕ: Этот шаг может занять больше времени для органоидов человека, поскольку они многослойные. Будут сгенерированы отдельные ячейки; Это не влияет на органоидный рост, пока большая часть органоидной суспензии состоит из небольших комков. - Остановите диссоциацию, добавив 10 мл основной среды. Затем гранулируйте ячейки в дозе 400 x g в течение 5 минут.
- После удаления надосадочной жидкости и ECM, которые могут лежать поверх органоидов (прозрачный, желеобразный слой без органоидов), ресуспендируют клетки в соответствующем объеме холодного ECM перед нанесением покрытия в суспензионную пластину, как указано на шаге 1.3.10.
ПРИМЕЧАНИЕ: Как правило, слезные органоиды мыши разделяются в соотношении 1:5, а органоиды человека - в соотношении 1:3. Это означает, что при начале работы с органоидами, содержащимися в 100 мкл ECM, их необходимо ресуспендировать в 500 мкл и 300 мкл соответственно после расщепления. - Инкубируйте пластину вверх дном в инкубаторе с температурой 37 °C до затвердевания ECM в течение 30 минут и накройте органоиды средой для расширения мыши или человека при RT.
3. Криоконсервация органоидов слезных желез мыши и человека
- Чтобы криоконсервировать органоиды, сначала разделите органоиды в расширяющей среде в соответствии с инструкциями, приведенными в разделе 2.
- Примерно через 3-4 дня, когда органоиды находятся в фазе роста, удалите среду и ресуспендируйте 100 мкл ECM, содержащих органоиды, в 10 мл среды с холодным основанием. Инкубируйте на льду в течение 10 минут, чтобы помочь диссоциировать ECM. Регулярно переворачивайте трубку, чтобы облегчить этот процесс.
- Гранулируйте органоиды в дозе 500 x g в течение 5 мин. Удалите надосадочную жидкость и ресуспендируйте органоидную гранулу в 1 мл криоконсервирующей среды (остатки ECM не ухудшают криоконсервацию). Перенесите органоидную суспензию в криовальную камеру и сразу же в морозильную камеру с температурой -80 °C.
ПРИМЕЧАНИЕ: При использовании криоконсервационной среды, описанной в Таблице материалов, криовиалы можно хранить неограниченное время в морозильной камере с температурой -80 °C. Если используется другая криоконсервирующая среда, перенесите криовиал в резервуар с жидким азотом через 24 часа, чтобы обеспечить оптимальную сохранность. - Чтобы разморозить органоиды, извлеките криовиал из морозильной камеры и транспортируйте его на сухом льду на водяную баню с температурой 37 °C. Держите криовиал в воде до тех пор, пока большая часть его содержимого не оттает. Перенесите содержимое в пробирку объемом 15 мл, содержащую 10 мл основной среды, и вращайте клетки при 400 x g в течение 5 мин.
- Поместите органоиды в 100 мкл ECM с расширяющей средой, как описано на шагах 2.5 и 2.6.
4. Дифференциация органоидов слезных желез и оценка их функциональности
- Дифференциация органоидов
- Чтобы дифференцировать органоиды слезных желез, сначала разделите органоиды в расширяющей среде в соответствии с инструкциями в разделе 2.
- Через 2 дня замените расширяющую среду мышью или средой для дифференциации человека, как описано в шаге 1.3.12. Обновляйте среду каждые 2-3 дня, чтобы поддерживать органоиды мыши в течение 5 дней в этой среде и органоиды человека в течение 9 дней.
- Чтобы оценить дифференцировку органоидов через 5 дней или 9 дней в дифференцировочной среде, соберите 100 мкл ECM, содержащих органоиды, для извлечения РНК. Для этого ресуспендируют капли ECM в 1 мл среды, содержащейся в лунке, используя P1,000, и переносят органоидную суспензию в 3 мл среды с ледяным основанием. Гранулируйте органоиды в дозе 500 x g в течение 5 мин.
- Выбросьте надосадочную жидкость и ресуспендируйте гранулу в буфере для экстракции РНК. Выполните последующую экстракцию РНК в соответствии с инструкциями набора для выделения РНК. Используйте полученную РНК, например, для анализа экспрессии стволовых клеток (TP63, KRT5, KRT14) и дифференцированных клеточных маркеров (LCN2, WFDC2, AQP5, LTF, ACTA2...) 14.
ПРИМЕЧАНИЕ: Чтобы получить соответствующий анализ экспрессии, измерьте экспрессию выбранных маркеров в одном или нескольких образцах тканей. Органоиды, культивируемые в условиях дифференцировки, как правило, содержат меньше РНК.
- Анализ функционального отека
ПРИМЕЧАНИЕ: Для этой части протокола используйте органоиды слезных желез человека, которые были дифференцированы в течение не менее 7 дней. Минимальное время, необходимое для обеспечения достаточной экспрессии маркера для функционального разрыва, составляет 7 дней. Каждая скважина 12-луночной плиты составляет одно условие. Минимальное количество условий — три: положительный контроль, отрицательный контроль и тестовое условие.- Свежеприготовленный 1 мл среды для дифференцировки человека, содержащей отдельные компоненты, индуцирующие секрецию органоидами слезной железы. Например, добавьте 100 мкМ норадреналина и 1 мкМ форсколина и тщательно перемешайте.
ПРИМЕЧАНИЕ: Форсколин служит положительным контролем, который обычно вызывает максимальный отек. - На автоматизированном покадровом микроскопе светлого поля установите положения для изображения на пластине, временной интервал (5 мин) и продолжительность (4 ч). Убедитесь, что вся капля ECM видна в каждом положении.
- Непосредственно перед началом визуализации, не отрывая пластину от микроскопа, удалите питательную среду из лунок, которые будут визуализированы, и замените ее хорошо ресуспендированной средой, приготовленной на шаге 4.2.1. Включите в качестве отрицательного контроля лунку с дифференцировочной средой, замененной только дифференциирующей средой, так как освежение среды может вызвать некоторое набухание органоидов.
- По прошествии 4 ч анализ на отек заканчивается. Проанализируйте результаты.
ПРИМЕЧАНИЕ: Эти шаги выполняются с помощью микроскопа EVOS M7000, который позволяет автоматически получать покадровую съемку светлого поля. Для этого микроскопа обратитесь к подробному руководству производителя, чтобы настроить покадровую съемку. Следует отметить, что можно использовать любой другой микроскоп с аналогичными характеристиками. - Чтобы количественно оценить набухание органоидов, измерьте диаметр каждого отдельного органоида через 0 ч и 4 ч. Откройте изображения одной органоидной капли через 0 ч и 4 ч в ImageJ.
- Нажмите на значок «Прямая линия » на панели инструментов и сначала нарисуйте диаметр органоида при 0 h. Затем используйте инструмент «Измерение » в ImageJ (Анализ > измерение), чтобы измерить длину этой линии и, следовательно, диаметр органоида перед набуханием. Повторите процесс на том же органоиде через 4 ч, чтобы получить диаметр органоида после набухания.
- Измерьте диаметр органоида ~ 20 органоидов в каждом условии до и после анализа набухания.
- Свежеприготовленный 1 мл среды для дифференцировки человека, содержащей отдельные компоненты, индуцирующие секрецию органоидами слезной железы. Например, добавьте 100 мкМ норадреналина и 1 мкМ форсколина и тщательно перемешайте.
5. Конструирование плазмиды для нокаута Pax6
- Дизайн гРНК для нокаута Pax6 с использованием базовых редакторов C > T
ПРИМЕЧАНИЕ: Существует множество программ для проектирования гРНК. Здесь был использован Benchling, поскольку он позволяет интегрировать дизайн гРНК, аннотацию и выравнивание следов Сэнгера. Таким образом, все последующие шаги также могут быть выполнены с помощью альтернативных программ.- Начните процесс проектирования гРНК, визуализировав ген-мишень в Benchling, нажав « Создать» (+) > «Последовательность ДНК» > «Импортировать последовательности ДНК».
- На вкладке « Импорт из базы данных» введите интересующий ген Pax6 и нажмите «Поиск».
- Выберите новейшую сборку эталонного генома мыши GRCm38 (mm10, Mus musculus) и нажмите Import.
- Выберите экзон, в котором может быть сконструирована нокаутирующая гРНК, придерживаясь следующих правил:
- Избегайте помещения гРНК в первый кодирующий экзон, потому что альтернативные стартовые сайты в последующих экзонах могут использоваться клеткой для обхода раннего индуцированного стоп-кодона.
- Создавайте гРНК в экзонах, которые присутствуют во всех альтернативных транскриптах, которые могут происходить при сплайсинге мРНК Pax6 . Чтобы убедиться в этом, визуализируйте Pax6 в браузере генома Ensembl и выберите экзон, который используется во всех транскриптах.
- Чтобы еще больше обойти альтернативный сплайсинг, нацеливайтесь на экзон, который имеет неполный кодон (одно или два оставшихся основания триплета). Это имеет меньшее значение, но дает большую уверенность в эффектах индуцированных инделов. Для Pax6 экзон от 4 до экзона 11 являются хорошей мишенью. Кроме того, выберите экзон, содержащий остатки триптофана (W), глутамина (Q) или аргинина (R).
ПРИМЕЧАНИЕ: Стандартные редакторы баз C > T, использующие SpCas9, имеют окно редактирования, которое охватывает от нуклеотида 4 до нуклеотида 8 от начала гРНК (наиболее удаленной от PAM). Редакторы C > Т-оснований могут вводить стоп-кодоны на все остатки триптофана (W) (TGG в TGA, TAG или TAA) с гРНК на обратной цепи, на остатках глутамина (Q) (CAG в TAG или CAA в TAA) и, наконец, на остатках аргинина (R) (CGA в TGA) на прямой цепи.
- Выберите экзон + 20 оснований вверх и вниз по течению. Нажмите в правой части экрана на целевой знак CRISPR и нажмите на руководства по проектированию и анализу.
- Во вновь открывшемся меню на вкладке « Тип дизайна» поставьте галочку напротив пункта «Руководства по базовому редактированию» (Komor et al., 2016). Сохраняйте длину направляющей на уровне 20 нуклеотидов и в разделе «Геном для мыши» выберите GRCm38 (mm10, Mus musculus).
- После нажатия на зеленый знак + программа автоматически обнаружит все последовательности смежных мотивов протоспейсера (PAM) и в правой части экрана создаст список всех потенциальных гРНК в области вокруг интересующего экзона.
- Прокрутите список до тех пор, пока в красном поле не появится знак стоп-кодона (*), который сигнализирует о наличии гРНК, которая потенциально может превратить аминокислоту в стоп-кодон и, таким образом, привести к нокауту.
- В первом столбце справа от последовательности гРНК для каждой мишени «C» вокруг окна редактирования вычисляется прогнозируемая эффективность редактирования in silico . Убедитесь, что редактирование C > T, которое приводит к стоп-кодону, имеет эффективность редактирования не менее ~ 10.
- Нажмите на значение в столбце Off-Target , чтобы проверить, с какими нецелевыми локусами может связываться гРНК. Избегайте выбора гРНК, которая связывается с какими-либо дополнительными генами для повышения специфичности. Например, хорошая гРНК для редактирования Pax6 с редактором оснований C > T нацелена на экзон 7 и представляет собой 5'-AAGCAACAGATGGGCGCAGA-3'.
- Создайте аннотацию в файле Benchling, щелкнув значок « Аннотации» в правом верхнем углу экрана, а затем « Новая аннотация». Назовите аннотацию и убедитесь, что в раскрывающемся меню «Цепь » выбрана правильная ориентация гРНК.
- Генерация плазмид гРНК
ПРИМЕЧАНИЕ: Существуют различные векторы, доступные для доставки гРНК в органоиды. В качестве основы для построения гРНК была использована следующая плазмида: pFYF1320 (Addgene #47511, добрый подарок от Кита Джунга).- Чтобы клонировать гРНК в pFYF1320, реализуйте обратную стратегию ПЦР с использованием стандартного прямого праймера: «/5phos/ GTTTTAGAGCTAGAAATAGCAAGTTAAAATAAAGGC. Чтобы разработать обратный праймер, вставьте обратный комплемент последовательности спейсера гРНК (дважды проверьте ориентацию гРНК [+ или - цепь]) перед следующей универсальной частью обратного праймера: CGGTGTTTCGTCCTTTCCACAAG. Чтобы нацелиться на экзон 7 мыши Pax6 с помощью базового редактора C > T, обратный праймер выглядит следующим образом: TCTGCGCCCATCTGTTGCTTCGGTGTTTCGTCCTTTCCACAAG. Закажите оба грунтовки.
- Запустите обратную реакцию ПЦР с использованием 1 нг pFYF1320 в качестве матрицы с использованием высокоточной ДНК-полимеразы в течение 35 циклов при температуре отжига 61 °C.
- Запустите реакцию ПЦР на 1% агарозном геле в буфере TAE при 100 В в течение ~ 45 мин, чтобы визуализировать ожидаемый фрагмент из 2,281 пары оснований (.н.). Выполните очистку гелем с помощью выбранного набора.
- Настройте следующую реакцию лигирования: 100 нг очищенного продукта ПЦР, фермент Dpn1 для удаления исходной матричной ДНК pFYF1320 и Т4-лигаза. Смесь инкубируют в течение 15 мин при 20 °C, 30 мин при 37 °C и 20 мин при 80 °C.
- Превратите реакционную смесь в химически компетентные бактерии DH5α и распределите бактерии по агаровым пластинам, содержащим ампициллин15.
- На следующий день соберите и разверните три отдельные колонии в 3 мл лизогенного бульона (LB) с добавлением 50 мкг / мл ампициллина.
- На следующий день проведите мини-подготовку по 1 мл каждой из трех мини-культур с помощью набора miniprep, а остальные храните при температуре 4 ° C. Подвергните полученную плазмиду секвенированию по Сэнгеру с U6_Forward праймером, чтобы убедиться, что гРНК правильно вставлена в вектор16.
- После идентификации одной бактериальной колонии с правильной плазмидой инокулируют 500 мкл соответствующей мини-культуры в 50 мл LB с добавлением ампициллина для амплификации плазмидной ДНК в течение ночи. Выполните миди-подготовку на следующий день после использования набора мидипреп. Эта плазмида будет использоваться для электропорации в разделе 6.
6. Генерация клонов Pax6 KO
- Электропорация органоидов
- Начните с органоидов мыши, которые были разделены не более чем за 5 дней до этого, чтобы они находились в пролиферативном состоянии. Используйте ~ 300-400 мкл органических капель на нокаут. Включите дополнительное условие для выбора отрицательного контроля, который будет электропорирован без какой-либо плазмиды.
- Выполните шаги 2.1-2.4, чтобы диссоциировать органоиды, но диссоциировать органоиды дольше, чтобы они были единичными клетками. Откажитесь от надосадочной жидкости.
- Ресуспендируют клетки в 80 мкл электропорационного буфера.
- В пробирке объемом 1,5 мл приготовьте следующие плазмиды максимум для 20 мкл: 2,5 мкг плазмиды pFYF1320-гРНК, 2,8 мкг транспозазосодержащей плазмиды, 7,2 мкг транспозонсодержащей плазмиды, резистентной к гигромицину, и 7,5 мкг pCMV_ABEmax_P2A_GFP.
ПРИМЕЧАНИЕ: Плазмида pFYF1320-gRNA кодирует ранее разработанную гРНК, которая направляет редактор оснований к целевому локусу. Плазмида pCMV_ABEmax_P2A_GFP кодирует редактор оснований, а также репортер GFP, который можно использовать для мониторинга клеток, экспрессирующих редактор оснований после электропорации. Плазмида, содержащая транспозазу, кодирует транспозазу, которая случайным образом вставляет в геном кассету, устойчивую к гигромицину, обеспечиваемую транспозонсодержащей плазмидой с устойчивостью к гигромицину. Клетки, которые включили эту кассету в свой геном, становятся устойчивыми к гигромицину и могут быть положительно отобраны путем добавления гигромицина. Поскольку совместное включение нескольких плазмид весьма вероятно, резистентность к гигромицину представляет собой функциональный отбор для обогащения клеток, которые были отредактированы для Pax6. - Добавьте плазмиды в клетки и хорошо перемешайте, пипеткой вверх и вниз.
- Настройте электропоратор со следующими параметрами для порового импульса (напряжение: 175 В; длительность импульса: 5 мс; интервал импульсов: 50 мс; количество импульсов: 2; скорость затухания: 10%; полярность: +) и для передачи импульса (напряжение: 20 В; длина импульса: 50 мс; интервал импульсов: 50 мс; количество импульсов; скорость затухания: 40%; полярность: +/-).
- Поместите клетки с плазмидами в электропорационную кювету. Немедленно измерьте сопротивление (Ω), которое должно составлять от 0,30 А до 0,55 А, и сразу же электропорируйте. Быстрое выполнение этого шага необходимо, чтобы избежать оседания клеток на дне кюветы и снижения эффективности электропорации.
- Перенесите клетки в пробирку объемом 1,5 мл и добавьте 400 мкл электропорационного буфера с добавлением ингибитора Rho-киназы. Дайте клеткам восстановиться при ЛТ в течение 30 минут.
- Гранулируйте клетки в 500 x g в течение 5 мин, выбросьте надосадочную жидкость и поместите клетки в 200 мкл ECM. После застывания добавьте среду для расширения мыши.
- Кистозные органоиды вырастают через 2-3 дня. Ежедневно контролируйте сигнал GFP, который показывает наличие базового редактора C > T.
- Выбор органоидов
- Через ~ 3 дня, когда органоиды восстановятся, добавьте 100 мкг / мл гигромицина в среду расширения мыши, чтобы выбрать органоиды, которые интегрировали кассету резистентности к гигромицину. Существует высокая вероятность того, что клетки, занимающие одну плазмиду, займут несколько плазмид. Путем отбора органоидов, устойчивых к гигромицину, обогащаются отредактированные органоиды на локусе Pax6 .
- Когда все клетки в отрицательном контроле мертвы, а выжившие органоиды имеют размер ~ 300 мкм, выберите устойчивые к гигромицину органоиды.
- Сбор органоидов и генотипирование
- Подготовьте стерильные наконечники P20 рядом с микроскопом и пробирки объемом 1,5 мл, содержащие 100 мкл раствора трипсина на льду.
- Согните наконечник P20 щипцами. Понаблюдайте за пластиной, содержащей уцелевшие органоиды, под настольным микроскопом. Когда уцелевший органоид окажется в фокусе, снимите крышку пластины. Используя изогнутый наконечник P20 и все еще находясь под микроскопом, аспирируйте каждый выживший органоид по отдельности и поместите каждый из них в отдельную пробирку с раствором трипсина.
- Соберите до 20 клонов. Количество клонов, которые должны быть выбраны, зависит от количества клонов, необходимых для каждого экспериментального дизайна, и от эффективности редактирования, которая варьируется в зависимости от каждой гРНК и локуса.
- Когда все клоны будут отобраны, поместите пробирки объемом 1,5 мл на водяную баню с температурой 37 °C на срок до 5 минут. Регулярно вкручивайте каждую трубку, чтобы увеличить скорость диссоциации, и проверяйте органоиды под настольным микроскопом. Когда органоиды диссоциируют на небольшие скопления и/или отдельные клетки, остановите переваривание, добавив 1 мл основной среды.
- Для каждого выбранного клона храните ~ 400 мкл до генотипа в отдельной пробирке объемом 1,5 мл. Отжимите ~ 600 мкл, оставленный при 500 x g в течение 5 мин, удалите надосадочную жидкость, ресуспендируйте клетки в 20 мкл ECM, поместите их в виде одной капли в лунку 24-луночной пластины и добавьте среду для расширения мыши без гигромицина.
- Чтобы генотипировать клоны, раскрутите пробирки, содержащие ~ 400 мкл клеточной суспензии при 500 x g в течение 5 минут, удалите надосадочную жидкость и ресуспендируйте клетки в 50 мкл буфера для экстракции ДНК для извлечения ДНК.
- Сразу же инкубируют клетки следующим образом: 6 мин при 60 °C, вихревых, и 4 мин при 95 °C. Эта ДНК может храниться до 7 дней при -20 ° C, но наиболее оптимальным является немедленное выполнение последующей ПЦР.
- Чтобы амплификировать локус, на который нацелена нуклеаза, проведите ПЦР на 2 мкл экстрагированной ДНК с использованием адекватных праймеров генотипирования, заказанных заранее, и полимеразы с низкой точностью. Праймерами для генотипирования являются AGACTGTTCCAGGATGGCTG (Pax6_C>T_F) и TCTCCTAGGTACTGGAAGCC (Pax6_C>T_R). Ампликон должен начинаться примерно на 100.н. от ожидаемого отредактированного локуса, чтобы обеспечить его эффективное секвенирование.
- Запустите продукт ПЦР на агарозном геле, чтобы оценить эффективность ПЦР, как указано на шаге 5.2.3. Когда будет обнаружена полоса правильного размера, вырежьте ее из геля, чтобы выполнить экстракцию геля ДНК с помощью набора.
- Секвенируйте извлеченную ДНК из каждого органоидного клона, ранее отобранного с помощью праймеров для генотипирования.
- Выровняйте полученные последовательности с геном Pax6 в Benchling. Откройте импортированную последовательность генов из шага 4.1. Нажмите « Выравнивание » справа, а затем « Создать новое выравнивание». Загрузите файлы .ab1, полученные от поставщика секвенирования, выберите ДНК в качестве типа нуклеотида и нажмите «Далее».
- В следующем окне выберите Multisequence и программу выравнивания Auto (MAFFT), прежде чем нажать « Создать выравнивание».
- Определите генотипы, которые имеют гомозиготный преждевременный стоп-кодон (полученный с помощью редакторов оснований) по обоим аллелям. Сохраните соответствующие клоны органоидов для расширения и криоконсервируйте их для дальнейшего анализа. В идеале три различных клонов органоидов должны быть проанализированы бок о бок, чтобы обойти потенциальные нецелевые эффекты нуклеазы.
7. Ортотопическая трансплантация органоидов слезных желез человека у мышей NSG
- Органоидная подготовка
- Органоиды слезных желез человека должны быть расщеплены ~ за 3 дня до дня трансплантации, как описано в разделе 2. В день трансплантации убедитесь, что органоиды находятся в пролиферативной фазе, чтобы увеличить шансы на приживление.
- Чтобы извлечь органоиды из ECM, добавьте диспазу в питательную среду до достижения конечной концентрации 0,125 Ед / мл. Используя P1,000, тщательно ресуспендируйте капли ECM, чтобы разрушить их, и поместите пластину обратно в инкубатор с температурой 37 °C на 30 минут. Объем 100 мкл ECM достаточен для инъекции ~10 слезных желез.
- Ресуспендируют органоиды в 10 мл основной среды, чтобы вымыть фермент. Гранулируйте ячейки в дозе 400 x g в течение 5 мин.
- Ресуспендировать клетки (~ 1 500 000) в 50 мкл холодной среды расширения человека с добавлением 5% ECM. Поместите органоидную суспензию на лед, и приступайте сразу к пересадке.
- Ортотопическая трансплантация у мышей
- В животноводческом помещении держите органоидную суспензию и инсулиновые иглы на льду. Аспирируют органоидную суспензию в холодную инсулиновую иглу.
- Успокойте мышь с иммунодефицитом NOD scid гамма (NSG) 3% изофлураном, чтобы начать анестезию. Когда мышь спит, быстро положите ее на бок так, чтобы основная слезная железа (расположенная на полпути между глазом и ухом) была доступна.
- Вводят 5 мкл органоидной суспензии непосредственно через кожу в слезную железу. Максимальный объем, который может содержать слезная железа мыши, составляет 5 мкл.
- Дайте мышке восстановиться и наблюдайте за мышью каждый день, чтобы оценить наличие любого дискомфорта, связанного с трансплантацией, особенно на глазу.
- Оценить приживление
- Принесите мышь в жертву с ингаляцией O 2 / CO2 через 90 дней в зависимости от того, следует ли оценивать краткосрочное или долгосрочное приживление13.
- Рассеките слезную железу, как описано в разделе 1. Зафиксируйте его в 4% формалине в течение 24 ч при РТ.
- Поместите слезную железу в кассету. Обезвоживают слезную железу, инкубируя ее следующим образом: 2 ч в 70% этаноле, 2 ч в 96% этаноле, 1 ч в 100% этаноле (2x), 2 ч в ксилоле и в течение ночи в жидком парафине при 58 ° C в духовке.
- На следующий день сориентируйте слезную железу по своему усмотрению в металлической форме, долите в нее жидкий парафин и дайте блоку затвердеть на холодной поверхности. Этот процесс лучше всего выполнять с помощью встраивающей машины.
- Когда парафиновый блок станет твердым, разрежьте весь блок на участки размером 4-5 мкм с помощью микротома. Храните все срезы (в форме лент) в сухом месте без сквозняков. Срезы можно хранить неограниченное время при комнатной температуре.
- Выберите один из каждых 10 разделов, охватывающих весь блок.
- Установите секции на предметное стекло следующим образом: нанесите каплю воды на предметное стекло, поместите секцию сверху, дайте ей постоять ~ 2 минуты, чтобы она растянулась на плите с температурой 42 ° C, и аккуратно удалите воду бумагой.
- Поместите предметные стекла сушиться на ночь в духовку при температуре 58 °C. Слайды могут храниться на RT на неопределенный срок после этого этапа.
- Чтобы отличить клетки человека от клеток мыши, выполните окрашивание ядерного антигена человека на этих участках. Увлажните срезы, выполнив следующие промывки: 3 мин в ксилоле (2x), 1 мин в 100% этаноле (2x), по 1 мин в 96% этаноле, 90% этаноле, 80% этаноле, 70% этаноле, 60% этаноле и 25% этаноле и, наконец, 1 мин в демиводе (2x).
- Инкубируйте предметные стекла в течение 15 мин в буфере PO (дополнительная таблица 1). Промойте предметные стекла 3 раза в сверхчистой воде.
- Выполните извлечение антигена на основе цитрата в автоклаве:
- Поместите предметные стекла в держатель слайда, защищенный от автоклава, в корзину, заполненную цитратным буфером (дополнительная таблица 1). Поместите корзину в автоклав и запустите цикл автоклава (давление: 10 фунтов на квадратный дюйм; температура: 121 °C; время: 15 мин).
- Когда в автоклаве разгерметизируется, извлеките корзину с предметными стеклами и поместите ее в водяную баню RT, чтобы довести предметные стекла до RT.
ПРИМЕЧАНИЕ: Стратегия извлечения антигена зависит от используемого антитела. Обратитесь к техническому описанию поставщика, чтобы выполнить наиболее адекватный поиск антигена.
- Поместите предметные стекла горизонтально, секцией вверх, на инкубационный лоток. Добавьте 500 мкл блокирующего буфера, содержащего 1% бычьего сывороточного альбумина (BSA) в PBS сверху, и инкубируйте в течение 1 часа. Удалите блокирующий буфер.
- Приготовьте раствор антитела, добавив 1 мкл человеческого ядрышкового антигена-антитела к 500 мкл блокирующего буфера на предметное стекло, подлежащее окрашиванию. Добавьте раствор антител на каждый слайд. Инкубировать в течение ночи в увлажненном инкубационном лотке при температуре 4 °C.
- На следующий день промойте горки 3 раза в PBS. Инкубируйте предметные стекла с неразбавленным вторичным антителом HRP против мыши в течение 45 минут. Вымойте слайды 3 раза в PBS.
ОСТОРОЖНОСТЬ. В химическом колпаке подготовьте буфер DAB (дополнительная таблица 1). Инкубируйте предметные стекла с буфером DAB в течение 10 минут. Выбросьте все отходы в контейнеры для органических химических жидких отходов. - Промойте предметные стекла водой. Инкубируйте предметные стекла в течение 2 мин в гематоксилине, чтобы противопоставить ядрам. Промойте предметные стекла в проточной водопроводной воде в течение 10 минут.
- Обезвоживайте предметные стекла, инкубируя их в течение 1 минуты каждый в 50% этаноле, 60% этаноле, 70% этаноле, 80% этаноле и 90% этаноле, 1 мин в 96% этаноле (2x), 1 мин в 100% этаноле (2x) и 1 мин в ксилоле (2x).
- Закройте слайды монтажным материалом и покровным стеклом. После высыхания в течение примерно 20 минут наблюдайте за предметными стеклами под микроскопом.
Результаты
После рассечения слезной железы мыши (рис. 2А) ферментативное и механическое пищеварение генерировало небольшие фрагменты ткани, среди которых можно было выделить ацинусы и протоки (рис. 2Б). Оставшиеся большие куски ткани дестабилизируют ECM, что уменьшит первоначальный органоидный рост. Деривация органоидов слезных желез мыши была успешной, когда кистозные органоиды диаметром ~ 500 мкм были обнаружены через ~ 7 дней, стадию, на которой органоиды были готовы к расщеплению (рис. 2C). Даже если общий органоидный вывод будет успешным, некоторые органоиды могут начать расти, прежде чем в конечном итоге остановятся. Органоиды слезных желез человека росли в виде цист в течение 3-4 дней и достигали полноценных размеров через 10-14 дней после выделения тканей (рис. 2D). Как для мышей, так и для людей происхождение органоидов иногда терпело неудачу, при этом органоиды не росли или росли нечасто; Обычно это было вызвано чрезмерным перевариванием ткани. Органоиды слезных желез мыши могут проходить не менее 40 раз, а органоиды человека - не менее 20 раз. Пассаж проводился в среднем каждые 7-10 дней, в зависимости от роста органоидов.

Рисунок 2: Создание органоидов слезных желез мыши и человека. (A) Фотографии различных стадий рассечения слезной железы мыши. Стрелка указывает на слезную железу под ее защитной оболочкой. (B) Изображения светлого поля клеток слезных желез мыши сразу после переваривания тканей со вставками, показывающими ацинус и проток. (C) Яркие изображения успешного и неудачного происхождения органоида слезной железы мыши. (D) Изображения яркого поля органоидов человека в течение 14 дней. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Органоиды слезных желез содержат большую долю стволовых клеток при культивировании в среде расширения. Чтобы повысить уровень их дифференциации, мы установили среду для дифференциации мыши и человека с пониженным содержанием фактора роста. Через 5 и 7 дней соответственно в среде дифференцировки органоиды слезных желез мыши и человека стали более плотными (рис. 3А-Б). Это морфологическое изменение коррелировало с повышением функциональных свойств. Применение циклического активатора АМФ форсколина или нейротрансмиттера норадреналина приводило к набуханию органоидов (т.е. апикальной секреции воды) менее чем за 3 ч (рис. 3C). Когда набухание длилось более 3-4 часов, это свидетельствовало о том, что органоиды были недостаточно дифференцированы и/или не экспрессировали функциональные маркеры, такие как рецепторы нейротрансмиттеров.
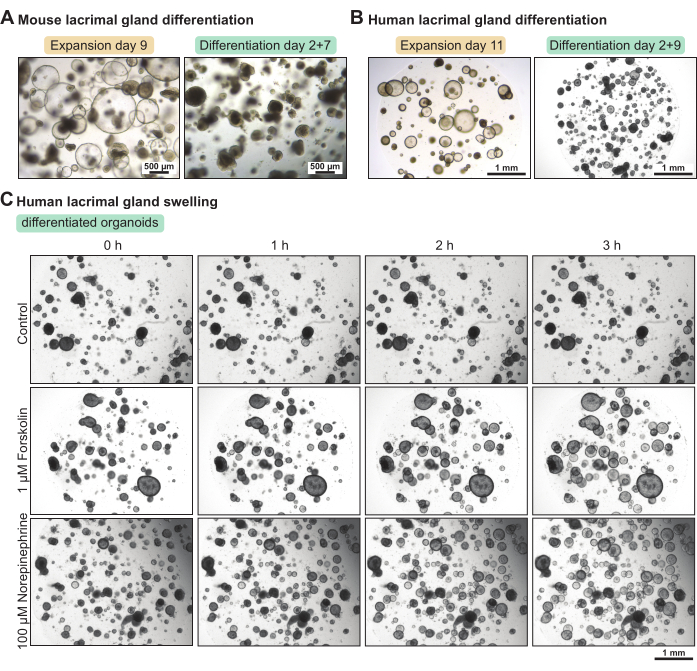
Рисунок 3: Дифференциация органоидов слезных желез мыши и человека и анализ функционального набухания в органоидах человека. (A) Светлые изображения органоидов слезных желез мыши, культивируемых в среде расширения в течение 7 дней и в среде дифференцировки в течение 5 дней после 2 дней в среде расширения. (B) Изображения светлого поля органоидов слезных желез человека, культивируемых в среде расширения в течение 11 дней и в среде дифференцировки в течение 9 дней после 2 дней в среде расширения. (C) Изображения светлого поля дифференцированных органоидов слезных желез человека, подвергшихся воздействию свежей дифференцировочной среды (контроль), до 1 мкМ форсколина и до 100 мкМ норадреналина в течение 3 ч. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Чтобы выбить Pax6 в органоидах слезных желез мыши, с помощью ПЦР и лигирования была получена плазмида, содержащая выбранную гРНК, нацеленную на Pax6 (рис. 4A). Эта гРНК-содержащая плазмида была электропорирована вместе с плазмидами Piggy-Bac (резистентные к гигромицину транспозонсодержащие и транспозазосодержащие плазмиды) и C> T base editor Cas9 в органоидах слезных желез мышей, диссоциированных в отдельные клетки. Через 3 дня, когда органоиды восстановились, они были подвергнуты воздействию гигромицина для отбора клонов, которые включали кассету резистентности к гигромицину. В успешных электропорациях выросли органоиды, устойчивые к гигромицину (рис. 4Б). Растущие клоны органоидов размером более ~ 300 мкм были отобраны, в идеале до того, как они начали спонтанно дифференцироваться (рис. 4C). ДНК была извлечена из части органоида, а остальная часть оставалась в культуре. ПЦР-амплификация локуса Pax6, на который нацелена гРНК, дала полосу 367.н. для каждого из выбранных клонов (рис. 4D). После секвенирования амплифицированного локуса были сохранены клоны, гомозигально отредактированные C > T (n = 1). С другой стороны, клоны, которые не были отредактированы (n = 4), гетерозигально отредактированы или неправильно отредактированы (n = 1), были отброшены (рис. 4E). В целом, используя эту гРНК, нацеленную на Pax6, был получен один гомозиготный нокаутный клон слезной железы мыши из шести секвенированных. Некоторые клоны хорошо росли, но некоторые клоны органоидов были потеряны после сбора или начали дифференцироваться (рис. 4F). Из 10 отобранных клонов органоидов 7 хорошо выросли.
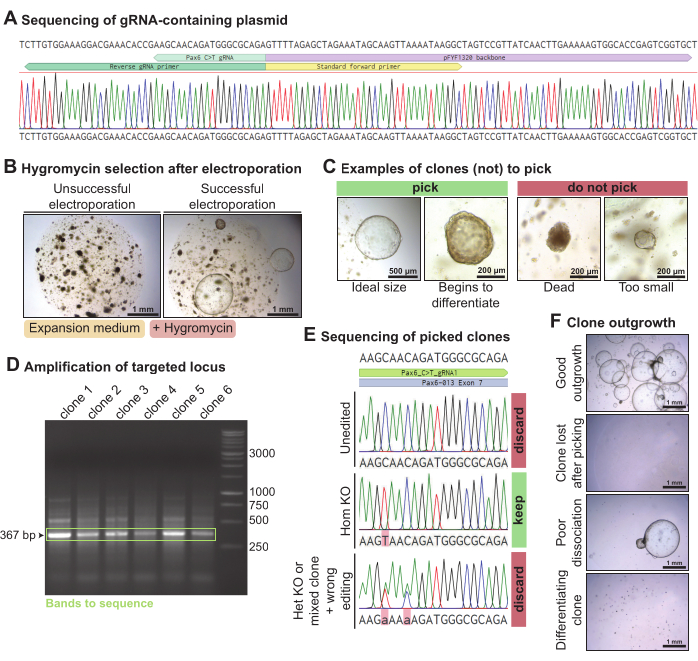
Рисунок 4: Опосредованный редактированием основания нокаут Pax6 в органоидах слезных желез мыши. (A) След секвенирования по Сэнгеру pFYF1320 после правильной интеграции гРНК, нацеленной на локус Pax6. (B) Яркие изображения органоидов слезных желез мыши через 5 дней после воздействия гигромицина после электропорации. Органоиды культивировали в среде размножения мышей. Слева показан пример неудачной электропорации, при которой не вырастает клон, устойчивый к гигромицину. Справа показан пример успешной электропорации, при которой выжили несколько устойчивых к гигромицину клонов органоидов. (C) Яркие изображения клонов, которые должны быть выбраны, и клонов, которые не должны быть выбраны. (D) Агарозный гель, демонстрирующий амплификацию локуса Pax6, на который нацелена гРНК. Зеленым цветом выделена полоса ожидаемого размера 367 б.. (E) След секвенирования Сэнгера трех клонов органоидов, устойчивых к гигромицину. Верхний клон не редактируется. Средний клон является гомозиготным изданием C > T и, следовательно, гомозиготным нокаутом. Нижний клон представляет две гетерозиготные точечные мутации и является либо гетерозиготным нокаутом, либо смешанным клоном и был неправильно отредактирован. (F) Яркие изображения отобранных клонов органоидов с различными уровнями роста. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Наконец, для проведения ортотопической трансплантации органоидов слезной железы человека мышам использовали органоиды, которые были разделены за 3 дня (< 100 мкм в диаметре). Приживление органоидов было подтверждено через 1 месяц после введения органоидов в слезную железу мыши путем окрашивания на специфический для человека маркер, ядрышковый антиген человека (рис. 5). Отсутствие точечного окрашивания на всех участках слезной железы мыши означало отсутствие приживления органоидов человека.
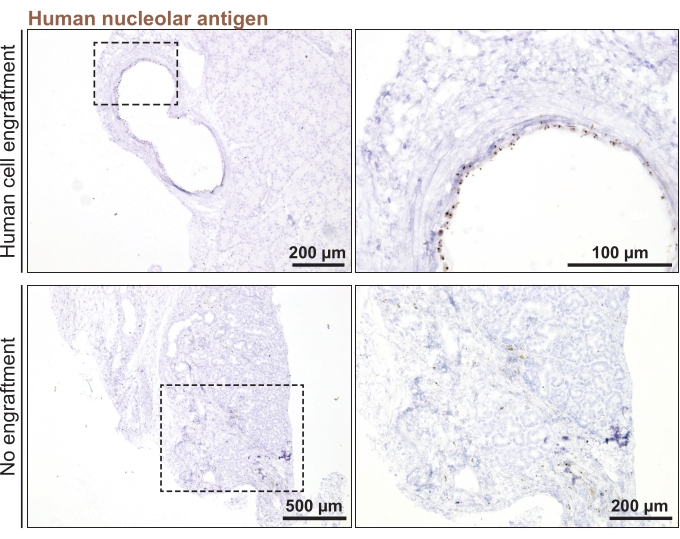
Рисунок 5: Трансплантация органоидов слезной железы человека в слезную железу мыши. Окрашивание трансплантированных слезных желез мыши на ядрышковый маркер человека для мониторинга приживления через 1 месяц после трансплантации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительная таблица 1: Состав сред и буферов. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Этот протокол описывает создание и использование органоидов слезных желез для функциональных анализов, моделирования мутаций и трансплантации. При создании органоидов слезных желез мыши и человека диссоциация тканей имеет решающее значение. Если ткань недостаточно переваривается, выход органоидов будет низким. Если ткань переваривается, клетки погибнут и не вырастут как органоиды. Каждая ткань должна быть переварена определенным ферментом в течение определенного времени, чтобы обеспечить оптимальный органоидный рост14,17,18. Слезная железа представляет собой довольно мягкую ткань, для которой достаточно 5-10-минутного расщепления коллагеназы в сочетании с механической диссоциацией на основе пипетки для выделения небольших кусочков ткани. Если необходимо получить отдельные клетки для таких применений, как секвенирование одноклеточной РНК, диссоциацию можно проводить дольше до тех пор, пока не будет достигнута стадия одной клетки, но диссоциацию следует прекратить, как только будут получены отдельные клетки, чтобы ограничить любое снижение жизнеспособности. Поскольку диссоциация тканей имеет решающее значение, чрезмерное переваривание является наиболее вероятной причиной неудачи создания органоидов слезных желез.
Для их использования важно соответствующее содержание органоидов слезных желез. Долгосрочное поддержание является отличительной чертой органоидов слезных желез, полученных из взрослых стволовых клеток, по сравнению с индуцированными плюрипотентными органоидами, полученными из стволовых клеток 7,17. Для достижения долгосрочного обслуживания следует проводить регулярное расщепление органоидов и смену среды. Без этого органоиды начинают дифференцироваться и развивать сниженный потенциал стволовых клеток, что затрудняет их долгосрочное поддержание7. На этом этапе чрезмерное переваривание может убить стволовые клетки и ухудшить поддержание органоидов. Для регулярного содержания не требуется диссоциация органоидов на отдельные клетки. Однако для создания клональных нокаутных органоидных линий очень важно начинать с отдельных клеток. В противном случае органоиды будут состоять из мозаики клеток с разным генетическим фоном, что сделает невозможным анализ эффекта одной определенной мутации. Здесь мы описываем использование базового редактора C > T для генерации стоп-кодонов. Этот редактор генома основан на наличии кодонов аргинина, глутамина или триптофана в пределах 12-18 оснований NGG PAM. Когда эти условия не соблюдаются при разработке гРНК, можно использовать обычные редакторы оснований Cas9 или C >T с альтернативными PAM 7,18. Тем не менее, обычный Cas9 вводит двухцепочечные разрывы, которые приводят к инделам при ремонте11. Поскольку оба аллеля могут содержать разные инделы, генотипирование клонов требует дополнительной осторожности. Деконволюция введенных модификаций должна быть выполнена, чтобы убедиться, что оба аллеля содержат внекадровые инделы и, следовательно, что клоны органоидов нокаутированы для гена, на который нацелен19. Преимущество редакторов баз C > T заключается в том, что их можно использовать для моделирования точечных мутаций, которые не обязательно приводят к стоп-кодонам. Например, они могут быть использованы для моделирования специфических мутаций Pax6, обнаруженных у пациентов с аниридией, для изучения их влияния на физиологию слезных желез20.
Слезная железа выделяет водную часть слезной пленки1. Секреция слезы может быть повторена в органоидах человека после дифференцировки, опосредованной отменой фактора роста и ингибированием NOTCH. В этих условиях органоиды подвергаются терминальной дифференциации и не могут поддерживаться в дальнейшем. Тем не менее, дифференцированные органоиды слезных желез могут направлять разработку лекарств, вызывающих слезотечение, в контексте синдрома сухого глаза, потенциально в высокопроизводительных экранах. Анализ разрыва, представленный в этом протоколе, в настоящее время дает наибольшее изменение размера органоидов за короткий промежуток времени, что облегчает количественную оценку в контексте скрининга лекарств 7,9,17.
Терапия стволовыми клетками имеет большие перспективы для регенерации слезных желез при синдроме сухого глаза21. Органоиды слезных желез, полученные из взрослых стволовых клеток, могут быть исходным материалом для таких применений. Представленный здесь протокол приводит к приживлению органоида слезной железы человека, в основном в виде кист. Низкое приживление органоидов может возникнуть из-за того, что органоиды вводятся в неправильное место. Обучение процедуре инъекции с помощью красителя позволяет отслеживать место инъекции и, в конечном итоге, повышает точность инъекции. В качестве альтернативы, эпидермис мыши может быть надрезан, чтобы иметь прямой доступ к слезной железе, как это делается у крыс до22 лет. Этот метод занимает больше времени, но может быть более точным. С другой стороны, в соответствии с настоящим протоколом органоиды функционально не интегрировались в слезную железу мыши. Аналогичные результаты наблюдались при приживлении слезной железы, полученном из iPSC22. Метод трансплантации может быть дополнительно улучшен путем предварительного ранения слезной железы, использования модели мыши с сухим глазом и / или введения органоидов в виде отдельных клеток или небольших скоплений. Тем не менее, органоиды слезных желез, полученные из взрослых стволовых клеток, и связанный с ними инструментарий могут стать основой для будущих применений в исследованиях слезных желез и регенеративной медицине.
Раскрытие информации
Ханс Клеверс является главой отдела фармацевтических исследований и ранних разработок в компании «Рош», Базель, и имеет несколько патентов, связанных с органоидной технологией.
Благодарности
Мы благодарим Йорика Поста за первоначальную разработку протокола. Эта работа была частично поддержана наградой от Cancer Research UK Grand Challenge (C6307 / A29058) и Фонда исследований рака Марка команде SPECIFICANCER.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL safe-lock centrifuge tubes | Eppendorf | EP0030 120.094 | |
| 3,3′-Diaminobenzidine tetrahydrochloride hydrate (DAB) | Sigma-Aldrich | D5637 | CAS: 868272-85-9 , CAUTION, 6 g/L solution can be stored aliquotted at -20 °C |
| 5x green GoTaq Flexi buffer | Promega | M891A | Store at -20 °C |
| A83-01 | Tocris | 2939 | Store at -20 °C, stock at 30 mM, 10000x |
| Advanced DMEM/F12 | Invitrogen | 12634-010 | store at 4 °C |
| Agar plates containing Ampicillin | Hubrecht Institute | ||
| Ampicillin sodium salt | Sigma-Aldrich | A9518 | |
| Autoclave VAPOUR-Line lite | VWR chemicals | ||
| B27 supplement | Invitrogen | 17504-044 | Store at -20 °C, 50x |
| BD Micro-Fine insulin needle 1 mL | BD Bioscience | 324825 | |
| Benchtop microscope DMI1 | Leica | ||
| Bovine serum albumine (BSA) | MP biomedicals | 160069 | Store at 4 °C |
| BTXpress | BTX | MDS450805 | |
| C57BL/6 mice | Hubrecht Institute | ||
| Cassettes | Klinipath | 410-02S | |
| CellBanker 1 | amsbio | 11910 | Cryopreservation medium, adhere to instructions |
| Centrifuge | Eppendorf | ||
| Citric acid monohydrate | J.T. Baker | 0088 | CAS: 5949-29-1 |
| Collagenase I | Sigma Aldrich | C9407 | Aliquots at 20 mg/mL, 20x, store at -20 °C |
| Conical tubes 15 mL | Greiner Bio-One | 5618-8271 | |
| Conical tubes 50 mL | Corning | CLS430828-500EA | |
| Coverslips 24 mm x 50 mm | Menzel-Gläzer | BB024050S1 | |
| Cultrex Basement Membrane Extract (BME), Growth Factor Reduced, Type 2 - extracellular matrix | R&D Systems, Bio-Techne | 3533-001-02 | Store at -20 °C, keep at 4 °C for up to 1 month |
| DAPT | Sigma Aldrich | D5942 | Store at -20 °C, stock at 10 mM, 1000x |
| Disodium hydrogen phosphate anhydrous | VWR chemicals | 28026.292 | CAS: 7558-79-4 |
| Di-sodiumhydrogenphosphate dihydrate | Sigma-Aldrich | 71643 | CAS:10028-24-7 |
| Dispase | ThermoFisher Scientific | 17105-041 | Aliquots at 50 U/mL, store at -20 °C until use, 400x |
| Disposable Scalpel Sterile N° 10 | Swann Morton | 3033838 | |
| DM4000 microscope | Leica | ||
| dNTPs 25 mM | Promega | U1420 | Mix all 4 nucleotides together, Store at -20 °C |
| Dpn1 | New England Biolabs | R0176 | |
| Dulbecco's Phosphate-bufferd Saline (DPBS) | Gibco | 14190144 | 1x |
| Easy strainers 70 µm | Greiner | 542170 | |
| Electroporation cuvette | Nepagene | EC002S | |
| EnVision+/HRP mouse | Agilent | K400111-2 | |
| Ethanol 100% | BOOM | 84045206;5000 | CAUTION, Use to prepare other Ethanol dilutions |
| Ethanol 70% | BOOM | 84010059.5000 | CAUTION |
| Ethanol 96% | BOOM | 84050065.5000 | CAUTION |
| EVOS FL Auto 2 Cell Imaging System | ThermoFisher Scientific | Live-imaging brightfield microscrope | |
| FGF10 | Peprotech | 100-26 | Store at -20 °C, stock at 100 mg/mL in base medium, 100x |
| Fiji | NIH, Fiji developers | ||
| Formaldehyde solution 4% | Sigma-Aldrich | 1.00496 | CAS: 50-00-0, CAUTION |
| Forskolin | Tocris | 1099 | Store at -20 °C, stock at 10 mM, 10000x |
| Glutamax | Gibco | 35050-061 | 100x |
| GoTaq G2 Flexi DNA Polymerase | Promega | M7805 | Store at -20 °C |
| Haematoxylin | VWR chemicals | 10047105 | Store at room temperature |
| HEPES | Gibco | 15630-080 | Store at 4 °C, 100x |
| Histocore H and C, Tissue embedding machine | Leica | ||
| Hot plate | Meidax | ||
| Human nucleolar antigen antibody | Abcam | ab-190710 | |
| Hydrochloric acid 5 N | ThermoFisher Scientific | 10605882 | CAS: 7647-01-0, CAUTION |
| Hydrogen peroxyde 30% | Chem-lab | CL00.2308.1000 | CAS: 7722-84-1, CAUTION |
| Hygromycin B-gold | InvivoGen | ant-hg | Stock at 100 mg/µL, 1000x |
| Hygromycin resistance cassette-containing plasmid | Andersson-Rolf et al, Nature Methods, 2017. doi: 10.1038/nmeth.4156 | ||
| IsoFlo 100% | Mecan | 5960501 | |
| LB medium | Hubrecht Institute | ||
| MgCl2 25 mM | Promega | A351H | Store at -20 °C |
| Microtome RM2235 | Leica | ||
| Midiprep DNA isolation kit | ThermoFisher Scientific | K210005 | |
| Miniprep DNA isolation kit | ThermoFisher scientific | K210003 | |
| N-acetylcysteine | Sigma Aldrich | A9165 | Store at -20 °C, stock at 500 mM, 400x |
| NEPA21 electroporator | Nepagene | ||
| Nicotinamide | Sigma Aldrich | N0636 | Store at -20 °C, stock at 1M, 100x |
| NOD Scid Gamma (NSG) mice | Hubrecht Institute colony | ||
| Noggin conditioned medium | U-Protein Express | Custom order | Store at -20 °C |
| Noradrenaline | Sigma Aldrich | A7257 | Store at -20 °C, stock at 100 mM |
| Oven | Memmert | Set at 58 °C | |
| P20, P200 and P1000 pipettes | Gilson | ||
| Paraffin | VWR chemicals | 10048502 | |
| Pasteur pipettes, glass plugged | ThermoFisher Scientific | 1150-6973 | |
| Pax6_C>T_F: AGACTGTTCCAGGATGGCTG | IDT | ||
| Pax6_C>T_R: TCTCCTAGGTACTGGAAGCC | IDT | ||
| pCMV_ABEmax_P2A_GFP | Addgene | 112101 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | Store at -20 °C |
| Pertex | Klinipath | AM-08010 | |
| pFYF1320 | Addgene | 47511 | |
| Primocin | InvivoGen | ant-pm-1 | 1000X, store at -20 °C |
| Prostaglandin E2 (PGE2) | Tocris | 2296 | Store at -20 °C, stock at 10 mM, 10000x |
| Petri dish, 10 cm | Greiner | 633102 | |
| Q5 buffer | New England Biolabs | B9027S | |
| Q5 high-fidelity DNA polymerase | New England Biolabs | M0491S | |
| QIAquick Gel Extraction Kit | Qiagen | 28704 | |
| QuickExtract DNA Extraction Solution | Lucigen | QE09050 | Store aliquots at -20 °C |
| R-spondin 3 conditioned medium | U-Protein Express | Custom order | Store at -20 °C |
| sgRNA Reverse Primer: TCTGCGCCCATCTGTTGCTT CGGTGTTTCGTCCTTTCCACAAG | IDT | ||
| Slides | StarFrost | MBB-0302-55A | Adhesive, ground |
| Sodium azide | Merck | 8.22335.1000 | CAS: 26628-22-8, CAUTION |
| Sodium cytrate dihydrate | J.T. Baker | 0280 | CAS: 6132-04-3 |
| Standard Forward Primer: “/5phos/ GTTTTAGAGCTAGAAATAGCAAG TTAAAATAAGGC | IDT | ||
| Subcloning efficiency competent cells DH5alpha | Invitrogen | 18265-017 | |
| Suspension cell culture plates (24-well) | Greiner Bio-One | 662102 | 24-well |
| Suspension cell culture plates (12-well) | Greiner Bio-One | 665102 | 12-well |
| T4 DNA ligase | New England Biolabs | M0202 | |
| TAE buffer | ThermoFisher Scientific | B49 | Stock at 50x, dilute to 1x with ultrapure water |
| Transposase-containing plasmid | Andersson-Rolf et al, Nature Methods, 2017. doi: 10.1038/nmeth.4156 | ||
| TrypLE Express Enzyme | Invitrogen | 12605-028 | store at 4 °C |
| U6_Forward primer: GGGCAGGAAGAGGGCCTAT | IDT | ||
| UltraPure Agarose 1000 | Invitrogen | 16550 | |
| Water bath | Tulabo | ||
| Xylene | Klinipath | 4055-9005 | CAS: 1330-20-7, CAUTION |
| Y-27632 | Abmole Bioscience | Y-27632 dihydrochloride | Store at -20 °C, stock at 10 mM, 1000x |
Ссылки
- Garg, A., Zhang, X. Lacrimal gland development: From signaling interactions to regenerative medicine. Developmental Dynamics. 246 (12), 970-980 (2017).
- Selinger, D. S., Selinger, R. C., Reed, W. P. Resistance to infection of the external eye: The role of tears. Survey of Ophthalmology. 24 (1), 33-38 (1979).
- Messmer, E. M. The pathophysiology, diagnosis, and treatment of dry eye disease. Deutsches Arzteblatt International. 112 (5), 71-81 (2015).
- Massie, I., et al. Development of lacrimal gland spheroids for lacrimal gland tissue regeneration. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2001-2009 (2018).
- Tiwari, S., et al. Establishing human lacrimal gland cultures with secretory function. PloS One. 7 (1), 29458(2012).
- Nguyen, D. H., Beuerman, R. W., Halbert, C. L., Ma, Q., Sun, G. Characterization of immortalized rabbit lacrimal gland epithelial cells. In Vitro Cellular & Developmental Biology. Animal. 35 (4), 198-204 (1999).
- Bannier-Hélaouët, M., et al. Exploring the human lacrimal gland using organoids and single-cell sequencing. Cell Stem Cell. 28 (7), 1221-1232 (2021).
- Hayashi, R., et al. Generation of 3D lacrimal gland organoids from human pluripotent stem cells. Nature. 605 (7908), 126-131 (2022).
- Jeong, S. Y., et al. Establishment of functional epithelial organoids from human lacrimal glands. Stem Cell Research & Therapy. 12 (1), 247(2021).
- Hofer, M., Lutolf, M. P. Engineering organoids. Nature Reviews Materials. 6 (5), 402-420 (2021).
- Meyenberg, M., Ferreira da Silva, J., Loizou, J. I. Tissue specific DNA repair outcomes shape the landscape of genome editing. Frontiers in Genetics. 12, 728520(2021).
- Geurts, M. H., et al. CRISPR-based adenine editors correct nonsense mutations in a cystic fibrosis organoid biobank. Cell Stem Cell. 26 (4), 503-510 (2020).
- Overmyer, K. A., Thonusin, C., Qi, N. R., Burant, C. F., Evans, C. R. Impact of anesthesia and euthanasia on metabolomics of mammalian tissues: Studies in a C57BL/6J mouse model. PLoS One. 10 (2), 0117232(2015).
- Driehuis, E., et al. Oral mucosal organoids as a potential platform for personalized cancer therapy. Cancer Discovery. 9 (7), 852-871 (2019).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. Journal of Visualized Experiments. (6), e253(2007).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Lian, J., Meng, X., Zhang, X., Hu, H. Establishment and genetic manipulation of murine hepatocyte organoids. Journal of Visualized Experiments. (180), e62438(2022).
- Lõhmussaar, K., et al. Patient-derived organoids model cervical tissue dynamics and viral oncogenesis in cervical cancer. Cell Stem Cell. 28 (8), 1380-1396 (2021).
- Bloh, K., et al. Deconvolution of complex DNA repair (DECODR): Establishing a novel deconvolution algorithm for comprehensive analysis of CRISPR-edited Sanger sequencing data. The CRISPR Journal. 4 (1), 120-131 (2021).
- Latta, L., et al. Pathophysiology of aniridia-associated keratopathy: Developmental aspects and unanswered questions. The Ocular Surface. 22, 245-266 (2021).
- Veernala, I., et al. Lacrimal gland regeneration: The unmet challenges and promise for dry eye therapy. The Ocular Surface. 25, 129-141 (2022).
- Hayashi, R., et al. Generation of 3D lacrimal gland organoids from human pluripotent stem cells. Nature. 605 (7908), 126-131 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены