Method Article
Istituzione, mantenimento, differenziazione, manipolazione genetica e trapianto di organoidi di topo e ghiandola lacrimale umana
In questo articolo
Riepilogo
Questo protocollo descrive come stabilire, mantenere, modificare geneticamente, differenziare, caratterizzare funzionalmente e trapiantare organoidi della ghiandola lacrimale derivati da topi primari e tessuti umani.
Abstract
La ghiandola lacrimale è un organo essenziale per l'omeostasi della superficie oculare. Producendo la parte acquosa del film lacrimale, protegge l'occhio dallo stress da essiccazione e insulti esterni. Poco si sa sulla (patofisiologia della ghiandola lacrimale) a causa della mancanza di adeguati modelli in vitro . La tecnologia degli organoidi si è dimostrata un'utile piattaforma sperimentale per più organi. Qui, condividiamo un protocollo per stabilire e mantenere organoidi di ghiandola lacrimale di topo e umana a partire dalle biopsie delle ghiandole lacrimali. Modificando le condizioni di coltura, miglioriamo la funzionalità organoide della ghiandola lacrimale. La funzionalità organoide può essere sondata attraverso un test "piangente", che comporta l'esposizione degli organoidi della ghiandola lacrimale a neurotrasmettitori selezionati per innescare il rilascio lacrimale nel loro lume. Spieghiamo come immaginare e quantificare questo fenomeno. Per studiare il ruolo dei geni di interesse nell'omeostasi della ghiandola lacrimale, questi possono essere geneticamente modificati. Descriviamo accuratamente come modificare geneticamente gli organoidi della ghiandola lacrimale usando editor di base, dalla progettazione dell'RNA guida alla genotipizzazione del clone organoide. Infine, mostriamo come sondare il potenziale rigenerativo degli organoidi della ghiandola lacrimale umana mediante impianto ortotopico nel topo. Insieme, questo set di strumenti completo fornisce risorse per utilizzare organoidi di topo e ghiandola lacrimale umana per studiare la (patofisiologia) della ghiandola lacrimale.
Introduzione
La ghiandola lacrimale è l'epitelio ghiandolare responsabile della produzione della maggior parte dello strato acquoso del film lacrimale1. Lo strato acquoso del film lacrimale non contiene solo acqua per lubrificare la superficie oculare, ma anche un ampio repertorio di componenti antimicrobici che proteggono la superficie oculare dalle infezioni2. Quando la ghiandola lacrimale è danneggiata o infiammata, si verifica la malattia dell'occhio secco, che si traduce in disagio per i pazienti e può eventualmente portare alla perdita della vista3. Nel corso degli anni, i sistemi modello per studiare la ghiandola lacrimale, in particolare la ghiandola umana, sono stati limitati 4,5,6. Ciò ha contribuito a una lacuna di conoscenza per quanto riguarda la funzione della ghiandola lacrimale in condizioni fisiologiche e patologiche.
Recentemente, sono stati sviluppati modelli in vitro per studiare la ghiandola lacrimale in un piatto 7,8,9. Questi organoidi della ghiandola lacrimale derivano da cellule staminali adulte cresciute come strutture tridimensionali in una matrice extracellulare integrata con un cocktail di fattori di crescita che sostiene le loro capacità rigenerative in vitro7. Il vantaggio degli organoidi derivati dalle cellule staminali adulte (ASC) è che possono essere mantenuti per un tempo molto lungo ricapitolando le caratteristiche del tessuto sano. Questo tipo di organoide consiste esclusivamente di cellule epiteliali, a differenza degli organoidi derivati dalle cellule staminali pluripotenti indotte (iPSC), che possono anche contenere cellule stromali, per esempio. A differenza degli organoidi derivati dalle cellule staminali pluripotenti (PSC), gli organoidi ASC sono stabiliti direttamente dal tessuto adulto e non richiedono alcuna modifica genetica per essere espansi. Gli organoidi ASC esprimono caratteristiche adulte10.
Questo protocollo contiene una cassetta degli attrezzi per derivare organoidi della ghiandola lacrimale dal topo e dal tessuto primario umano. Il protocollo descrive come migliorare ulteriormente la funzionalità degli organoidi con un semplice prelievo del fattore di crescita e come provocare gli organoidi a secernere liquido lacrimale eseguendo un test di gonfiore. Questo protocollo include inoltre un metodo di trasfezione basato sull'elettroporazione per ingegnerizzare geneticamente organoidi di topo utilizzando editor di base derivati da CRISPR. A differenza del Cas9 convenzionale, l'uso di editor di basi consente la modifica di singole basi nel genoma senza generare una rottura a doppio filamento11,12. Infine, viene descritto il trapianto ortotopico di organoidi della ghiandola lacrimale umana in topi immunodeficienti e la successiva valutazione istologica dell'attecchimento. Questo toolkit organoide della ghiandola lacrimale può essere utilizzato nella ricerca sulla rigenerazione e la funzione della ghiandola lacrimale e per la modellazione di malattie genetiche e infiammatorie.
Protocollo
Gli esperimenti sui topi sono stati approvati dal Comitato etico animale della Royal Netherlands Academy of Arts and Sciences (KNAW) con licenza di progetto AVD8010020151. Gli organoidi sono stati derivati da materiale in eccesso di topo. Le biopsie della ghiandola lacrimal umana sono state raccolte dal materiale di scarto dei pazienti sottoposti a intervento chirurgico presso il Centro medico universitario di Utrecht (UMCU) dopo l'approvazione da parte del comitato etico medico sotto il numero di protocollo 18-740. Il protocollo contiene diverse sezioni descritte nella Figura 1.

Figura 1: Panoramica del protocollo. Questa figura evidenzia le diverse fasi del protocollo. Fare clic qui per visualizzare una versione ingrandita di questa figura.
NOTA: Tutte le composizioni del terreno e del tampone sono descritte nella tabella supplementare 1.
1. Costituzione di organoidi da topo e ghiandole lacrimali umane
- Sezionare la ghiandola lacrimale del topo
- Preparare gli strumenti di dissezione, tra cui forbici, pinze e cuscinetti di dissezione. Eutanasia di un topo mediante inalazione di O 2/CO2 13.
- Metti il topo eutanasia sul suo addome sul tampone di dissezione e blocca i suoi arti. Bagnare i capelli situati tra le orecchie del topo e sulla fronte usando il 70% di etanolo.
- Usando le forbici da dissezione, fai un'apertura dietro il cranio tra le orecchie. Estendi questa apertura sulla fronte fino al naso. Sempre usando le forbici, tagliare la pelle dietro le orecchie per generare due lembi.
- Tirare saldamente i lembi verso il naso fino a quando le ghiandole lacrimali sono esposte, come mostrato nella Figura 2A. Appuntare i lembi al tampone di dissezione. Usando le forbici, fare una piccola incisione nella membrana situata sopra la ghiandola lacrimale per esporre completamente la ghiandola lacrimale.
- Usando la pinza, tirare la ghiandola lacrimale. Ci dovrebbe essere una certa resistenza fino a quando il dotto lacrimale principale è strappato. Se si preferisce, tagliare il condotto lacrimale principale direttamente con le forbici.
- Posizionare la ghiandola lacrimale del topo in PBS di grado coltura tissutale fino a ulteriore elaborazione. Procedere con l'elaborazione della ghiandola lacrimale entro 2-4 ore per limitare la morte cellulare. Se questo richiede più tempo, posizionare la ghiandola lacrimale del topo nel mezzo di raccolta della biopsia (Tabella supplementare 1).
NOTA: Diverse ghiandole lacrimali possono essere raggruppate se un gran numero di organoidi sono necessari immediatamente.
- Raccolta di biopsie della ghiandola lacrimale umana
- Prima dell'intervento, preparare 20 ml di aliquote di mezzo di raccolta bioptica (Tabella supplementare 1) in una provetta da 50 mL e consegnarle al chirurgo prima dell'intervento. Questo mezzo può essere mantenuto a 4 °C per diversi mesi.
- Il giorno dell'intervento, lasciare che il chirurgo campioni un pezzo della ghiandola lacrimale (di solito <1 mm3) e lo conservi nel mezzo di raccolta della biopsia (Tabella supplementare 1) a 4 °C.
- Raccogliere la biopsia per elaborarlo il prima possibile. Idealmente, questo dovrebbe essere lo stesso giorno entro 2 ore dal prelievo bioptico.
- Derivazione organoide
- Preparare in anticipo: matrice extracellulare scongelata (ECM), topo a temperatura ambiente (RT) o mezzo di espansione umano (Tabella supplementare 1), collagenasi scongelata, terreno di base (Tabella supplementare 1), due bisturi, una capsula di Petri da 10 cm, un filtro da 70 μm montato su un tubo da 15 ml e piastre di sospensione a 12 pozzetti preriscaldate a 37 °C per 30 minuti.
- Preparare il mezzo di digestione combinando tutti i componenti mostrati nella tabella supplementare 1. Pre-bagnare i bisturi in questo mezzo per evitare che i pezzi di tessuto si attacchino a loro.
- Recuperare il topo o il tessuto della ghiandola lacrimale umana dal mezzo e posizionarlo nella capsula di Petri.
- Usando i bisturi pre-bagnati, tritare il tessuto. Una volta che i pezzi di tessuto sono molto piccoli (cioè <0,5 mm3), metterli nel mezzo di digestione raschiandoli dalla capsula di Petri con il bisturi. Se la biopsia umana è già molto piccola, posizionarla direttamente nel mezzo di digestione senza tritare per evitare la perdita di tessuto.
- Incubare i pezzi di tessuto per un massimo di 15 minuti a bagnomaria a 37 °C. Capovolgere regolarmente il tubo da 15 ml per risospendere i pezzi. Monitorare la dissociazione cellulare al microscopio da banco in modo da non digerire eccessivamente il tessuto.
- Nel frattempo, restringere una pipetta Pasteur mettendo la punta in una fiamma durante la rotazione e pre-bagnarla nel mezzo di base. Per dissociare efficacemente il tessuto, assicurarsi che il foro sia leggermente più piccolo dei pezzi di tessuto più grandi rimasti. Per facilitare il processo di dissociazione, pipettare la miscela su e giù ogni 5 minuti con la pipetta Pasteur ristretta pre-bagnata.
- Quando molte cellule singole e piccoli grumi sono visibili al microscopio, interrompere la dissociazione aggiungendo 10 ml del mezzo di base. Girare verso il basso a 400 x g per 5 minuti per pellettare le celle.
- Rimuovere il surnatante e risospendere il pellet in 10 ml del mezzo base per ripetere il lavaggio. Filtrarlo attraverso un colino da 70 μm per rimuovere i grandi pezzi di tessuto non digeriti e le restanti fibre di collagene, che impedirebbero un'adeguata polimerizzazione dell'ECM. Girare l'eluato a 400 x g per 5 minuti.
NOTA: Un pellet di globuli rossi indica la presenza di globuli rossi, che normalmente non ostacola la derivazione organoide. Tuttavia, per alcune applicazioni, come la citometria a flusso, i globuli rossi dovrebbero essere lisati. Per questo, incubare le cellule in 5 ml di tampone di lisi dei globuli rossi freschi a RT per 5 minuti e pellettare le cellule a 400 x g per 5 minuti. - Rimuovere il surnatante e risospendere il pellet cellulare in 100 μL di ECM fredda per una singola ghiandola lacrimale di topo e in 50 μL di ECM fredda per una biopsia umana. Quando si risospende, fare attenzione a non creare bolle, poiché queste influenzerebbero anche la polimerizzazione e la stabilità dell'ECM.
- Seminare fino a 100 μL di cellule per pozzetto di una piastra di sospensione a 12 pozzetti. Utilizzare un P200 per produrre ~ 20 μL di goccioline nel pozzo. Più piccole sono le goccioline, migliore è la diffusione dei fattori di crescita e dei nutrienti attraverso la matrice.
- Posizionare la piastra capovolta in un incubatore umidificato a 37 °C per 20-30 minuti per consentire all'ECM di solidificarsi.
- Una volta che l'ECM è solidificato, aggiungere ~ 1 mL di mouse RT o mezzo di espansione umana per pozzetto di una piastra a 12 pozzetti. Rinfrescare il terreno ogni 2-3 giorni fino a quando gli organoidi raggiungono una dimensione di 300 μm. Per questo, aspirare il mezzo nel pozzo e aggiungere delicatamente il mezzo di espansione sul lato del pozzetto senza toccare le goccioline ECM in modo da non interromperle.
NOTA: Primocin (100 mg / ml; 1: 1.000 da stock commerciali) può essere aggiunto dopo l'isolamento se si verifica una contaminazione batterica. Tuttavia, poiché rallenta anche la crescita degli organoidi, è preferibile non aggiungerlo o rimuoverlo dopo uno o due passaggi.
2. Espansione degli organoidi del topo e della ghiandola lacrimale umana
- Dopo ~ 7 giorni per gli organoidi di topo e ~ 10 giorni per gli organoidi umani, quando gli organoidi raggiungono una dimensione di ~ 300 μm, rimuovere il terreno di coltura.
- Risospendere le goccioline di ECM contenenti gli organoidi in 1 mL di soluzione di tripsina pipettando vigorosamente su e giù con un P1.000 fino a quando le goccioline si sfaldano. Trasferire questa miscela in una provetta da 15 ml e incubarla brevemente a bagnomaria a 37 °C.
- Dopo 2-3 minuti, utilizzare una pipetta Pasteur ristretta e pre-bagnata per pipettare la sospensione organoide su e giù 10x-15x. Controllare lo stato di dissociazione degli organoidi al microscopio da banco; Dovrebbero essere ottenuti piccoli grumi di ~ 20 cellule. Incubare più a lungo nel bagnomaria a 37 °C e ripetere la fase di pipettaggio fino a quando la dissociazione è soddisfacente.
NOTA: Questo passaggio potrebbe richiedere più tempo per gli organoidi umani in quanto sono multistrato. Verranno generate singole celle; Ciò non influisce sulla crescita organoide finché la maggior parte della sospensione organoide è costituita da piccoli grumi. - Interrompere la dissociazione aggiungendo 10 ml del mezzo di base. Quindi, pellet le cellule a 400 x g per 5 minuti.
- Dopo aver rimosso il surnatante e la MEC che possono trovarsi sopra gli organoidi (strato trasparente gelatinoso senza organoidi), risospendere le cellule in un volume appropriato di ECM fredda prima di placcare in una piastra di sospensione, come indicato al punto 1.3.10.
NOTA: Generalmente, gli organoidi lacrimali di topo sono divisi in un rapporto 1: 5 e gli organoidi umani in un rapporto 1: 3. Ciò significa che, quando si inizia con organoidi contenuti in 100 μL di ECM, devono essere risospesi rispettivamente in 500 μL e 300 μL, dopo la scissione. - Incubare la piastra capovolta in un incubatore a 37 °C fino alla solidificazione dell'ECM per 30 minuti e coprire gli organoidi con il topo o il mezzo di espansione umano a RT.
3. Crioconservazione degli organoidi del topo e della ghiandola lacrimale umana
- Per crioconservare gli organoidi, dividere prima gli organoidi nel mezzo di dilatazione secondo le istruzioni fornite nella sezione 2.
- Circa 3-4 giorni dopo, quando gli organoidi sono in una fase di crescita, rimuovere il terreno e risospendere 100 μL di organoidi contenenti ECM in 10 ml di terreno base freddo. Incubare su ghiaccio per 10 minuti per aiutare a dissociare l'ECM. Capovolgere regolarmente il tubo per facilitare questo processo.
- Pellettare gli organoidi a 500 x g per 5 min. Rimuovere il surnatante e risospendere il pellet organoide in 1 ml di terreno di crioconservazione (la ECM residua non compromette la crioconservazione). Trasferire la sospensione organoide in un crioviale e immediatamente in un congelatore a -80 °C.
NOTA: Quando si utilizza il mezzo di crioconservazione descritto nella Tabella dei Materiali, i crioviali possono essere conservati indefinitamente in un congelatore a -80 °C. Se viene utilizzato un altro mezzo di crioconservazione, trasferire il crioviale in un serbatoio di azoto liquido dopo 24 ore per garantire una conservazione ottimale. - Per scongelare gli organoidi, recuperare il crioviale dal congelatore e trasportarlo su ghiaccio secco a bagnomaria a 37 °C. Tenere il criovial in acqua fino a quando la maggior parte del suo contenuto non si è scongelato. Trasferire il contenuto in un tubo da 15 mL contenente 10 mL di terreno base e far ruotare le cellule a 400 x g per 5 minuti.
- Placcare gli organoidi in 100 μL di ECM con il mezzo di espansione, come descritto nei punti 2.5 e 2.6.
4. Differenziare gli organoidi delle ghiandole lacrimali e valutarne la funzionalità
- Differenziazione organoide
- Per differenziare gli organoidi della ghiandola lacrimale, dividere prima gli organoidi nel mezzo di espansione secondo le istruzioni riportate nella sezione 2.
- Dopo 2 giorni, sostituire il mezzo di espansione con il mouse o il mezzo di differenziazione umano come descritto al punto 1.3.12. Rinfrescare il terreno ogni 2-3 giorni per mantenere gli organoidi di topo per 5 giorni in quel mezzo e gli organoidi umani per 9 giorni.
- Per valutare la differenziazione degli organoidi dopo 5 giorni o 9 giorni nel mezzo di differenziazione, raccogliere 100 μL di organoidi contenenti ECM per estrarre l'RNA. Per fare ciò, risospendere le goccioline di ECM in 1 ml di terreno contenuto nel pozzetto utilizzando un P1.000 e trasferire la sospensione organoide in 3 ml di terreno base ghiacciato. Pellettare gli organoidi a 500 x g per 5 min.
- Scartare il surnatante e risospendere il pellet nel tampone di estrazione dell'RNA. Eseguire l'estrazione dell'RNA a valle secondo le istruzioni del kit di estrazione dell'RNA. Utilizzare l'RNA ottenuto, ad esempio, per l'analisi RT-qPCR dell'espressione di cellule staminali (TP63, KRT5, KRT14) e marcatori cellulari differenziati (LCN2, WFDC2, AQP5, LTF, ACTA2...) 14.
NOTA: Per ottenere l'analisi di espressione pertinente, misurare l'espressione dei marcatori scelti in uno o più campioni di tessuto. Gli organoidi coltivati in condizioni di differenziazione tendono a contenere meno RNA.
- Saggio di gonfiore funzionale
NOTA: Per questa parte del protocollo, utilizzare organoidi della ghiandola lacrimale umana che sono stati differenziati per almeno 7 giorni. Il tempo minimo richiesto è di 7 giorni per garantire un'espressione sufficiente del marcatore per lo strappo funzionale. Ogni pozzetto di una piastra a 12 pozzetti costituisce una condizione. Il numero minimo di condizioni è tre: un controllo positivo, un controllo negativo e una condizione di test.- Preparare appena 1 mL di terreno di differenziazione umana contenente singoli componenti che inducono la secrezione da parte degli organoidi della ghiandola lacrimale. Ad esempio, aggiungere 100 μM di noradrenalina e 1 μM di forskolina e mescolare accuratamente.
NOTA: Forskolin serve come un controllo positivo che di solito induce il massimo gonfiore. - In un microscopio time-lapse a campo chiaro automatizzato, impostare le posizioni da visualizzare nella lastra, l'intervallo di tempo (5 minuti) e la durata (4 ore). Assicurarsi che un'intera goccia ECM sia visibile in ogni posizione.
- Subito prima di iniziare a visualizzare e senza spostare la lastra dal microscopio, rimuovere il terreno di coltura dai pozzetti che verranno ripresi e sostituirlo con il mezzo ben risospeso preparato al punto 4.2.1. Includere come controllo negativo un pozzo con mezzo di differenziazione sostituito dal solo mezzo di differenziazione, poiché il ristoro medio può innescare un certo gonfiore organoide.
- Dopo un massimo di 4 ore, il test di gonfiore è finito. Analizza i risultati.
NOTA: Questi passaggi vengono eseguiti con un microscopio EVOS M7000 che consente l'imaging time-lapse in campo chiaro automatizzato. Per quel microscopio, fare riferimento al manuale dettagliato del produttore per impostare l'imaging time-lapse. Da notare, qualsiasi altro microscopio con caratteristiche simili può essere utilizzato. - Per quantificare il gonfiore organoide, misurare il diametro di ogni singolo organoide a 0 h e 4 h. Apri le immagini di una singola goccia organoide a 0 h e 4 h in ImageJ.
- Fai clic sull'icona Retta nella barra degli strumenti e disegna prima il diametro di un organoide a 0 h. Quindi, utilizzare lo strumento Misura in ImageJ (Analizza > misura) per misurare la lunghezza di questa linea e, quindi, il diametro dell'organoide prima del gonfiore. Ripetere il processo sullo stesso organoide a 4 h per ottenere il diametro organoide dopo il gonfiore.
- Misurare il diametro organoide di ~ 20 organoidi per condizione prima e dopo il test di gonfiore.
- Preparare appena 1 mL di terreno di differenziazione umana contenente singoli componenti che inducono la secrezione da parte degli organoidi della ghiandola lacrimale. Ad esempio, aggiungere 100 μM di noradrenalina e 1 μM di forskolina e mescolare accuratamente.
5. Costruire un plasmide per mettere fuori combattimento Pax6
- Progettazione di gRNA per knockout Pax6 utilizzando editor di base C > T
NOTA: Ci sono molti programmi software disponibili per la progettazione di gRNA. Qui, Benchling è stato utilizzato in quanto consente la progettazione integrata del gRNA, l'annotazione e l'allineamento delle tracce di Sanger. Tutti i passaggi successivi possono, quindi, essere eseguiti anche utilizzando programmi software alternativi.- Avviare il processo di progettazione del gRNA visualizzando il gene bersaglio in Benchling facendo clic su Nuovo (+) > Sequenza di DNA > Importa sequenze di DNA.
- Nella scheda Importa da database, digitare il gene di interesse, Pax6, e premere Cerca.
- Selezionare la build più recente del genoma di riferimento del mouse GRCm38 (mm10, Mus musculus) e premere Importa.
- Selezionare l'esone in cui il gRNA knock-out può essere progettato aderendo alle seguenti regole:
- Evitare di mettere un gRNA nel primo esone codificante, perché siti di inizio alternativi negli esoni successivi possono essere utilizzati dalla cellula per aggirare il codone di stop indotto precocemente.
- Progettare gRNA negli esoni che sono presenti in tutti i trascritti alternativi che possono avvenire mediante splicing dell'mRNA Pax6 . Per garantire ciò, visualizzare Pax6 nel browser del genoma di Ensembl e selezionare l'esone utilizzato in tutte le trascrizioni.
- Per aggirare ulteriormente lo splicing alternativo, colpire un esone che ha un codone incompleto (una o due basi rimanenti di una tripla). Questo è di minore importanza, ma dà maggiore certezza sugli effetti degli indels indotti. Per Pax6, l'esone da 4 a 11 è un buon bersaglio. Inoltre, scegliere un esone che contiene residui di triptofano (W), glutammina (Q) o arginina (R).
NOTA: Gli editor di base standard C > T che utilizzano SpCas9 hanno una finestra di modifica che si estende dal nucleotide 4 al nucleotide 8 dall'inizio del gRNA (più lontano dal PAM). Gli editor di basi C > T possono introdurre codoni di stop su tutti i residui di triptofano (W) (da TGG a TGA, TAG o TAA) con un gRNA sul filamento inverso, sui residui di glutammina (Q) (CAG a TAG o CAA a TAA) e, infine, sui residui di arginina (R) (da CGA a TGA) sul filamento anteriore.
- Seleziona l'esone + 20 basi a monte e a valle. Fai clic sul lato destro dello schermo sul segno di destinazione CRISPR e fai clic su Progetta e analizza guide.
- Nel menu appena aperto, sotto la scheda Tipo di progettazione, spuntare le Guide per "editing di base" (Komor et al., 2016). Mantenere la lunghezza guida a 20 nucleotidi e, sotto Genoma per topo, selezionare GRCm38 (mm10, Mus musculus).
- Dopo aver fatto clic sul segno + verde, il programma software rileverà automaticamente tutte le sequenze di protospaziatori adiacenti (PAM) e, sul lato destro dello schermo, creerà un elenco di tutti i potenziali gRNA nell'area intorno all'esone di interesse.
- Scorri l'elenco fino al segno del codone di stop (*) in una casella rossa, che segnala un gRNA che può potenzialmente trasformare un amminoacido in un codone di stop e, quindi, provocare un knock-out.
- Nella prima colonna a destra della sequenza di gRNA, per ogni target "C" attorno alla finestra di editing, vengono calcolate le efficienze di editing previste in silico . Assicurarsi che la modifica C > T che si traduce nel codone di arresto abbia un'efficienza di modifica di almeno ~ 10.
- Fare clic sul valore nella colonna Off-Target per verificare a quali loci off-target il gRNA potrebbe legarsi. Evitare di scegliere un gRNA che si lega a qualsiasi geni aggiuntivo per aumentare la specificità. Ad esempio, un buon gRNA per modificare Pax6 con un editor di base C > T mira all'esone 7 ed è 5'-AAGCAACAGATGGGCGCAGA-3'.
- Crea un'annotazione nel file Benchling facendo clic sull'icona Annotazioni in alto a destra dello schermo, seguita da Nuova annotazione. Assegna un nome all'annotazione e assicurati che nel menu a discesa Strand sia selezionato l'orientamento corretto del gRNA.
- generazione di plasmidi gRNA
NOTA: Ci sono vari vettori disponibili per la consegna del gRNA negli organoidi. Il seguente plasmide è stato usato come base per la costruzione del gRNA: pFYF1320 (Addgene #47511, un gentile regalo di Keith Joung).- Per clonare i gRNA in pFYF1320, implementare una strategia di PCR inversa utilizzando il primer standard in avanti: "/5phos/ GTTTTAGAGCTAGAAATAGCAAGTTAAAATAAGGC. Per progettare il primer inverso, incollare il complemento inverso della sequenza distanziatrice di gRNA (ricontrollare l'orientamento del gRNA [+ o - filamento]) davanti alla seguente parte universale di primer inverso: CGGTGTTTCGTCCTTTCCACAAG. Per indirizzare l'esone 7 del topo Pax6 usando l'editor di base C > T, il primer inverso è il seguente: TCTGCGCCCATCTGTTGCTTCGGTGTTTCGTCCCCTCCACAAG. Ordina entrambi i primer.
- Eseguire una reazione di PCR inversa utilizzando 1 ng di pFYF1320 come modello utilizzando una DNA polimerasi ad alta fedeltà per 35 cicli a una temperatura di ricottura di 61 °C.
- Eseguire la reazione PCR su un gel di agarosio all'1% in tampone TAE a 100 V per ~ 45 minuti per visualizzare il frammento atteso di 2.281 coppie di basi (bp). Eseguire una pulizia del gel utilizzando il kit preferito.
- Impostare la seguente reazione di legatura: 100 ng di prodotto PCR ripulito, enzima Dpn1 per rimuovere il DNA modello iniziale pFYF1320 e T4 ligasi. Incubare la miscela per 15 min a 20 °C, 30 min a 37 °C e 20 min a 80 °C.
- Trasformare la miscela di reazione in batteri DH5α chimicamente competenti e diffondere i batteri su piastre di agar contenenti ampicillina15.
- Il giorno successivo, raccogliere ed espandere tre singole colonie in 3 ml di terreno di brodo lisogenico (LB) integrato con 50 μg / mL di ampicillina.
- Il giorno dopo, eseguire un miniprep su 1 mL di ciascuna delle tre mini-colture utilizzando un kit miniprep e conservare il resto a 4 °C. Sottoporre il plasmide ottenuto al sequenziamento Sanger con il primer U6_Forward per garantire che il gRNA sia inserito correttamente nel vettore16.
- Dopo aver identificato una singola colonia batterica con il plasmide corretto, inoculare 500 μL della corrispondente mini-coltura in 50 ml di LB integrata con ampicillina per amplificare il DNA plasmidico durante la notte. Eseguire una midi-prep il giorno dopo aver utilizzato un kit midiprep. Questo plasmide sarà utilizzato per l'elettroporazione nella sezione 6.
6. Generazione di cloni di Pax6 KO
- Elettroporazione organoide
- Inizia con organoidi di topo che sono stati divisi al massimo 5 giorni prima in modo che siano in uno stato proliferativo. Utilizzare ~ 300-400 μL di goccioline organoidi per knock-out. Includere una condizione aggiuntiva per la selezione di un controllo negativo che verrà elettropolato senza alcun plasmide.
- Eseguire i passaggi 2.1-2.4 per dissociare gli organoidi, ma dissociare gli organoidi più a lungo in modo che siano singole cellule. Scartare il surnatante.
- Risospendere le celle in 80 μL del tampone di elettroporazione.
- In una provetta da 1,5 ml, preparare i seguenti plasmidi per un massimo di 20 μL: 2,5 μg di plasmide pFYF1320-gRNA, 2,8 μg di plasmide contenente transposasi, 7,2 μg di plasmide contenente trasposoni di resistenza all'igromicina e 7,5 μg di pCMV_ABEmax_P2A_GFP.
NOTA: Il plasmide pFYF1320-gRNA codifica il gRNA precedentemente progettato, che guida l'editor di base verso il locus target. Il plasmide pCMV_ABEmax_P2A_GFP codifica l'editor di base, così come un reporter GFP, che può essere utilizzato per monitorare le cellule che esprimono l'editor di base dopo l'elettroporazione. Il plasmide contenente la trasposasi codifica per la trasposasi, che incolla la cassetta di resistenza all'igromicena fornita dal plasmide contenente trasposoni di resistenza all'igromina da qualche parte casualmente nel genoma. Le cellule che hanno incorporato questa cassetta nel loro genoma diventano resistenti all'igromicina e possono essere selezionate positivamente con l'aggiunta di igromicina. Poiché la co-incorporazione di diversi plasmidi è molto probabile, la resistenza all'igromicina costituisce una selezione funzionale da arricchire per le cellule che sono state modificate per Pax6. - Aggiungere i plasmidi alle cellule e mescolare bene pipettando su e giù.
- Impostare l'elettroporatore con i seguenti parametri per l'impulso di poring (tensione: 175 V; lunghezza dell'impulso: 5 ms; intervallo di impulso: 50 ms; numero di impulsi: 2; tasso di decadimento: 10%; polarità: +) e per l'impulso di trasferimento (tensione: 20 V; lunghezza dell'impulso: 50 ms; intervallo di impulso: 50 ms; numero di impulsi: 5; tasso di decadimento: 40%; polarità: +/-).
- Posizionare le cellule con i plasmidi in una cuvetta di elettroporazione. Misurare immediatamente la resistenza (Ω), che dovrebbe essere compresa tra 0,30 A e 0,55 A, ed elettropolare immediatamente. È necessario eseguire rapidamente questo passaggio per evitare che le celle si depositino sul fondo della cuvetta e ridurre l'efficienza dell'elettroporazione.
- Trasferire le cellule in un tubo da 1,5 ml e aggiungere 400 μL di tampone di elettroporazione integrato con un inibitore della Rho-chinasi. Lasciare che le cellule si riprendano a RT per 30 minuti.
- Pellettare le cellule a 500 x g per 5 minuti, scartare il surnatante e placcare le cellule in 200 μL di ECM. Dopo la solidificazione, aggiungere il mezzo di espansione del mouse.
- Gli organoidi cistici crescono dopo 2-3 giorni. Monitorare quotidianamente il segnale GFP, che rivela la presenza dell'editor di base C > T.
- Selezione degli organoidi
- Dopo ~ 3 giorni, quando gli organoidi si sono ripresi, aggiungere 100 μg / mL di igromicina al mezzo di espansione del topo per selezionare gli organoidi che hanno integrato la cassetta di resistenza all'igromicina. C'è un'alta probabilità che le cellule che assorbono un plasmide occupino diversi plasmidi. Selezionando organoidi resistenti all'igromicina, gli organoidi modificati sul locus Pax6 vengono arricchiti.
- Quando tutte le cellule nel controllo negativo sono morte e gli organoidi sopravvissuti sono ~ 300 μm, scegli gli organoidi resistenti all'igromicina.
- Raccolta e genotipizzazione degli organoidi
- Preparare punte sterili P20 accanto al microscopio e provette da 1,5 ml contenenti 100 μL di soluzione di tripsina ciascuna su ghiaccio.
- Piegare una punta P20 con una pinza. Osservare la piastra contenente gli organoidi sopravvissuti su un microscopio da banco. Quando un organoide sopravvissuto è a fuoco, rimuovere il coperchio del piatto. Utilizzando la punta piegata P20 e ancora al microscopio, aspirare ciascun organoide sopravvissuto individualmente e posizionare ciascuno di questi in una provetta separata contenente soluzione di tripsina.
- Raccogli fino a 20 cloni. Il numero di cloni da scegliere dipende dal numero di cloni richiesti per ogni disegno sperimentale e dall'efficienza di editing, che varia a seconda di ogni gRNA e locus.
- Quando tutti i cloni sono stati raccolti, posizionare i tubi da 1,5 ml in un bagnomaria a 37 °C per un massimo di 5 minuti. Vortice ogni tubo regolarmente per aumentare la velocità di dissociazione e controllare gli organoidi sotto il microscopio da banco. Quando gli organoidi sono dissociati in piccoli grumi e / o singole cellule, interrompere la digestione aggiungendo 1 ml di terreno base.
- Per ogni clone scelto, mantenere ~400 μL per genotipo in una provetta separata da 1,5 ml. Ruotare i ~ 600 μL rimasti a 500 x g per 5 minuti, rimuovere il surnatante, risospendere le cellule in 20 μL di ECM, placcarle come una singola goccia in un pozzetto di una piastra a 24 pozzetti e aggiungere il mezzo di espansione del mouse senza igromina.
- Per genotipizzare i cloni, ruotare i tubi contenenti ~ 400 μL di sospensione cellulare a 500 x g per 5 minuti, rimuovere il surnatante e risospendere le cellule in 50 μL di tampone di estrazione del DNA per estrarre il DNA.
- Incubare immediatamente le cellule come segue: 6 min a 60 °C, vortice e 4 min a 95 °C. Questo DNA può essere conservato fino a 7 giorni a -20 °C, ma l'esecuzione immediata della PCR a valle è ottimale.
- Per amplificare il locus mirato con la nucleasi, eseguire una PCR su 2 μL del DNA estratto utilizzando adeguati primer di genotipizzazione ordinati in precedenza e una polimerasi a bassa fedeltà. I primer di genotipizzazione sono AGACTGTTCCAGGATGGCTG (Pax6_C>T_F) e TCTCCTAGGTACTGGAAGCC (Pax6_C>T_R). L'amplicone dovrebbe iniziare a circa 100 bp dal locus modificato previsto per assicurarsi che sia sequenziato in modo efficiente.
- Eseguire il prodotto PCR su un gel di agarosio per valutare l'efficienza della PCR, come indicato al punto 5.2.3. Quando viene rilevata una fascia della dimensione corretta, tagliarla dal gel per eseguire un'estrazione del gel di DNA utilizzando un kit.
- Sequenziare il DNA estratto da ciascun clone organoide precedentemente prelevato con i primer di genotipizzazione.
- Allineare le sequenze ottenute al gene Pax6 in Benchling. Aprire la sequenza genica importata dal punto 4.1. Fare clic su Allineamenti sul lato destro, quindi su Crea nuovo allineamento. Caricare i file .ab1 ottenuti dal provider di sequenziamento, selezionare DNA come tipo di nucleotide e premere Avanti.
- Nella finestra seguente, selezionare Multisequenza e il programma di allineamento Auto (MAFFT) prima di fare clic su Crea allineamento.
- Identificare i genotipi che hanno un codone di stop prematuro omozigote (come ottenuto con gli editor di base) su entrambi gli alleli. Mantenere i cloni organoidi corrispondenti per espanderli e crioconservarli per ulteriori analisi. Idealmente, tre diversi cloni di organoidi dovrebbero essere analizzati fianco a fianco per aggirare potenziali effetti off-target della nucleasi.
7. Trapianto ortotopico di organoidi della ghiandola lacrimale umana in topi NSG
- Preparazione organoide
- Gli organoidi della ghiandola lacrimale umana devono essere divisi ~3 giorni prima del giorno del trapianto, come descritto nel paragrafo 2. Il giorno del trapianto, assicurarsi che gli organoidi siano in fase proliferativa per aumentare le possibilità di attecchimento.
- Per estrarre gli organoidi dalla ECM, aggiungere dispase al terreno di coltura per raggiungere una concentrazione finale di 0,125 U/mL. Utilizzando un P1.000, risospendere accuratamente le goccioline ECM per interromperle e riposizionare la piastra nell'incubatore a 37 °C per 30 minuti. Un volume di 100 μL di ECM è sufficiente per iniettare ~ 10 ghiandole lacrimali.
- Risospendere gli organoidi in 10 ml di terreno base per lavare l'enzima. Pellettare le celle a 400 x g per 5 min.
- Risospendere le cellule (~1.500.000) in 50 μL di mezzo di espansione umano freddo integrato con ECM al 5%. Posizionare la sospensione organoide sul ghiaccio e procedere immediatamente al trapianto.
- Trapianto ortotopico nei topi
- Nella struttura per animali, avere la sospensione organoide e gli aghi di insulina sul ghiaccio. Aspirare la sospensione organoide in un ago da insulina freddo.
- Sedare un topo immunodeficiente NOD scid gamma (NSG) con isoflurano al 3% per iniziare l'anestesia. Quando il topo dorme, posizionalo rapidamente su un fianco con la ghiandola lacrimale principale (situata a metà strada tra l'occhio e l'orecchio) accessibile.
- Iniettare 5 μL della sospensione organoide direttamente attraverso la pelle nella ghiandola lacrimale. Il volume massimo che una ghiandola lacrimale di topo può contenere è di 5 μL.
- Lasciare che il topo si riprenda e monitorare il topo ogni giorno per valutare la presenza di eventuali fastidi legati al trapianto, soprattutto sull'occhio.
- Valutare l'attecchimento
- Sacrificare il topo con l'inalazione di O 2/CO2 dopo un massimo di 90 giorni a seconda che debba essere valutato l'attecchimento a breve o lungo termine13.
- Sezionare la ghiandola lacrimale come descritto nel paragrafo 1. Fissalo in formalina al 4% per 24 ore a RT.
- Mettere la ghiandola lacrimale in una cassetta. Disidratare la ghiandola lacrimale incubandola come segue: 2 h in etanolo al 70%, 2 ore in etanolo al 96%, 1 ora in etanolo al 100% (2x), 2 ore in xilene e pernottamento in paraffina liquida a 58 °C in forno.
- Il giorno dopo, orientare la ghiandola lacrimale come preferito in uno stampo metallico, rabboccarla con paraffina liquida e lasciare che il blocco si solidifichi su una superficie fredda. Questo processo viene eseguito al meglio con una macchina di incorporamento.
- Quando il blocco di paraffina è solido, tagliare l'intero blocco in sezioni di 4-5 μm usando un microtomo. Conservare tutte le sezioni (a forma di nastri) in un ambiente asciutto e privo di correnti d'aria. Le sezioni possono essere conservate indefinitamente a temperatura ambiente.
- Campiona una sezione su 10 che copre l'intero blocco.
- Montare le sezioni su un vetrino come segue: mettere una goccia d'acqua sul vetrino, posizionare la sezione sopra, lasciarla riposare per ~ 2 minuti per consentirgli di allungarsi su una piastra calda a 42 ° C e rimuovere delicatamente l'acqua con carta.
- Mettere i vetrini ad asciugare per una notte in forno a 58 °C. Le diapositive possono essere conservate indefinitamente a RT oltre questa fase.
- Per distinguere le cellule umane dalle cellule di topo, eseguire la colorazione dell'antigene nucleare umano su queste sezioni. Reidratare le sezioni eseguendo i seguenti lavaggi: 3 min in xilene (2x), 1 min in etanolo al 100% (2x), 1 min ciascuno in etanolo al 96%, etanolo al 90%, etanolo all'80%, etanolo al 70%, etanolo al 60% e etanolo al 25% e, infine, 1 min in acqua demi (2x).
- Incubare i vetrini per 15 minuti nel buffer PO (Tabella supplementare 1). Lavare i vetrini 3 volte in acqua ultrapura.
- Eseguire un prelievo dell'antigene basato su citrato nell'autoclave:
- Posizionare i vetrini in un portavetrini a prova di autoclave in un cestello riempito con tampone citrato (Tabella supplementare 1). Posizionare il cestello nell'autoclave ed eseguire un ciclo di autoclave (pressione: 10 PSI; temperatura: 121 °C; tempo: 15 min).
- Quando l'autoclave è depressurizzata, recuperare il cestello contenente i vetrini e metterlo in un bagno d'acqua RT per portare i vetrini a RT.
NOTA: La strategia di recupero dell'antigene dipende dall'anticorpo utilizzato. Fare riferimento alla scheda tecnica del fornitore per eseguire il recupero dell'antigene più adeguato.
- Posizionare i vetrini orizzontalmente, con il lato rivolto verso l'alto, su un vassoio di incubazione. Aggiungere 500 μL di tampone bloccante contenente l'1% di albumina sierica bovina (BSA) in PBS sulla parte superiore e incubare per 1 ora. Rimuovere il buffer di blocco.
- Preparare la soluzione anticorpale aggiungendo 1 μL di antigene-antigene nucleolare umano a 500 μL di tampone bloccante per vetrino da colorare. Aggiungere la soluzione anticorpale a ciascun vetrino. Incubare per una notte in un vassoio di incubazione umidificato a 4 °C.
- Il giorno dopo, lavare le diapositive 3 volte in PBS. Incubare i vetrini con anticorpo secondario HRP anti-topo non diluito per 45 minuti. Lavare i vetrini 3 volte in PBS.
CAUTELA. In una cappa chimica, preparare il tampone DAB (Tabella supplementare 1). Incubare i vetrini con buffer DAB per 10 min. Eliminare qualsiasi materiale di scarto nei contenitori dei rifiuti liquidi chimici organici. - Lavare i vetrini con acqua. Incubare i vetrini per 2 minuti in ematossilina per contrastare i nuclei. Lavare gli scivoli in acqua corrente del rubinetto per 10 minuti.
- Disidratare i vetrini incubandoli per 1 minuto ciascuno in 50% etanolo, 60% etanolo, 70% etanolo, 80% etanolo e 90% etanolo, 1 min in etanolo al 96% (2x), 1 min in etanolo al 100% (2x) e 1 min in xilene (2x).
- Racchiudere le guide con un supporto di montaggio e una copertina. Dopo l'asciugatura per circa 20 minuti, osservare i vetrini al microscopio.
Risultati
In seguito alla dissezione della ghiandola lacrimale di topo (Figura 2A), la digestione enzimatica e meccanica ha generato piccoli frammenti di tessuto, tra i quali si potevano distinguere gli acini e i dotti (Figura 2B). I restanti grandi pezzi di tessuto destabilizzerebbero l'ECM, il che ridurrebbe la crescita iniziale degli organoidi. La derivazione dell'organoide della ghiandola lacrimale di topo ha avuto successo quando organoidi cistici di ~ 500 μm di diametro sono stati trovati dopo ~ 7 giorni, lo stadio in cui gli organoidi erano pronti per essere divisi (Figura 2C). Anche se la derivazione complessiva degli organoidi ha successo, alcuni organoidi possono iniziare a crescere prima di fermarsi alla fine. Gli organoidi della ghiandola lacrimale umana sono cresciuti come cisti entro 3-4 giorni e hanno raggiunto dimensioni adulte in 10-14 giorni dopo l'isolamento dei tessuti (Figura 2D). Sia per i topi che per gli esseri umani, la derivazione degli organoidi a volte falliva, con nessun o pochi organoidi che crescevano; Ciò è stato generalmente causato da un'eccessiva digestione del tessuto. Gli organoidi della ghiandola lacrimale del topo potrebbero essere fatti passare almeno 40 volte e gli organoidi umani almeno 20 volte. Il passaging è stato fatto in media ogni 7-10 giorni, a seconda della crescita organoide.

Figura 2: Costituzione di organoidi di topo e ghiandola lacrimale umana. (A) Fotografie delle diverse fasi della dissezione della ghiandola lacrimale del topo. La freccia punta alla ghiandola lacrimale sotto la sua membrana protettiva. (B) Immagini in campo chiaro delle cellule della ghiandola lacrimale del topo subito dopo la digestione dei tessuti, con inserti che mostrano un acino e un condotto. (C) Immagini in campo chiaro di una derivazione organoide della ghiandola lacrimale di topo riuscita e non riuscita. (D) Immagini in campo chiaro dell'escrescenza di organoidi umani nel corso di 14 giorni. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Gli organoidi della ghiandola lacrimale contengono una grande percentuale di cellule staminali quando coltivate nel mezzo di espansione. Per aumentare il loro livello di differenziazione, abbiamo impostato un topo e un mezzo di differenziazione umano con un contenuto di fattori di crescita ridotto. Dopo 5 giorni e 7 giorni, rispettivamente, nel mezzo di differenziazione, gli organoidi della ghiandola lacrimale del topo e dell'uomo sono diventati più densi (Figura 3A-B). Questo cambiamento morfologico è correlato con un aumento delle proprietà funzionali. L'applicazione dell'attivatore ciclico AMP forskolin o del neurotrasmettitore noradrenalina ha provocato gonfiore organoide (cioè secrezione acquosa apicale) in meno di 3 ore (Figura 3C). Quando il gonfiore ha richiesto più di 3-4 ore, questo ha suggerito che gli organoidi non erano abbastanza differenziati e / o non esprimevano marcatori funzionali, come i recettori per i neurotrasmettitori.
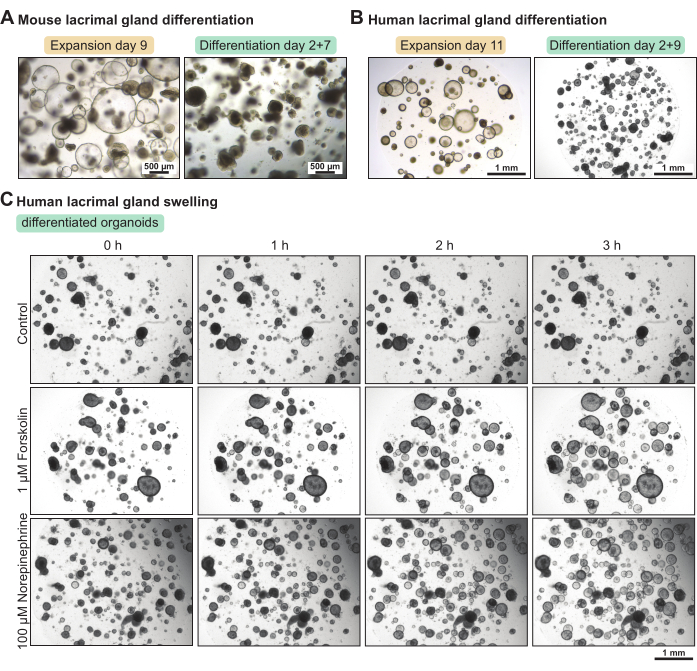
Figura 3: Differenziazione degli organoidi delle ghiandole lacrimali di topo e umane e saggio di gonfiore funzionale negli organoidi umani. (A) Immagini in campo chiaro di organoidi della ghiandola lacrimale di topo coltivati in terreno di espansione per 7 giorni e in terreno di differenziazione per 5 giorni dopo 2 giorni in mezzo di espansione. (B) Immagini in campo chiaro di organoidi umani della ghiandola lacrimale coltivati in terreno di espansione per 11 giorni e in terreno di differenziazione per 9 giorni dopo 2 giorni in terreno di dilatazione. (C) Immagini in campo chiaro di organoidi differenziati della ghiandola lacrimale umana esposti a un nuovo mezzo di differenziazione (controllo), a 1 μM di forskolina e a 100 μM di noradrenalina nel corso di 3 ore. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Per eliminare Pax6 negli organoidi della ghiandola lacrimale di topo, un plasmide contenente il gRNA scelto per Pax6 è stato generato mediante PCR e legatura (Figura 4A). Questo plasmide contenente gRNA è stato elettropolato insieme ai plasmidi Piggy-Bac (plasmidi contenenti trasposoni e trasposasi di resistenza all'igromicina) e all'editor di base C > T Cas9 negli organoidi della ghiandola lacrimale di topo dissociati in singole cellule. Dopo 3 giorni, quando gli organoidi si erano ripresi, sono stati esposti all'igromicina per selezionare i cloni che avevano incorporato la cassetta di resistenza all'igromicina. Nelle elettroporazioni di successo, sono cresciuti organoidi resistenti all'igromicina (Figura 4B). Sono stati raccolti i cloni organoidi in crescita che erano più grandi di ~ 300 μm, idealmente prima che iniziassero a differenziarsi spontaneamente (Figura 4C). Il DNA è stato estratto da una parte dell'organoide mantenendo il resto in coltura. L'amplificazione PCR del locus Pax6 bersaglio del gRNA ha prodotto una banda di 367 bp per ciascuno dei cloni scelti (Figura 4D). Dopo aver sequenziato il locus amplificato, sono stati mantenuti cloni che erano omozigosi C > T modificati (n = 1). D'altra parte, i cloni che non sono stati modificati (n = 4), modificati in modo eterozige o modificati erroneamente (n = 1) sono stati scartati (Figura 4E). Complessivamente, utilizzando questo gRNA mirato a Pax6, è stato ottenuto un clone omozigote della ghiandola lacrimale di topo knock-out su sei sequenziati. Alcuni cloni sono cresciuti bene, ma alcuni cloni organoidi sono andati persi dopo la raccolta o hanno iniziato a differenziarsi (Figura 4F). Dei 10 cloni organoidi scelti, 7 sono cresciuti bene.
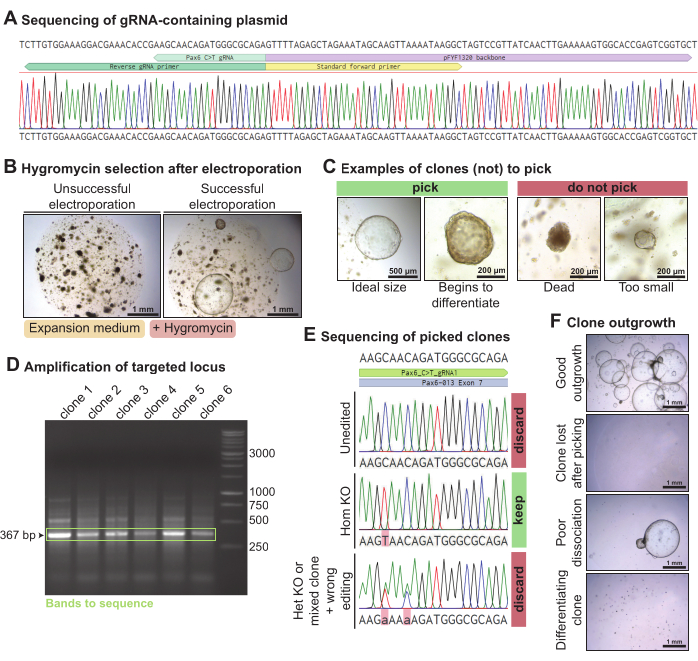
Figura 4: Knock-out mediato dall'editing di base di Pax6 negli organoidi della ghiandola lacrimale di topo. (A) Traccia di sequenziamento Sanger di pFYF1320 dopo corretta integrazione del gRNA che ha come bersaglio il locus Pax6. (B) Immagini in campo chiaro di organoidi della ghiandola lacrimale di topo 5 giorni dopo l'esposizione all'igromicina dopo elettroporazione. Gli organoidi sono stati coltivati in mezzo di espansione del topo. A sinistra c'è un esempio di elettroporazione fallita, con nessun clone resistente all'igromicina che cresce. Sulla destra c'è un esempio di elettroporazione riuscita, con diversi cloni organoidi resistenti all'igromicina sopravvissuti. (C) Immagini in campo chiaro di cloni che dovrebbero essere scelti e cloni che non dovrebbero essere scelti. (D) Gel di agarosio che mostra l'amplificazione del locus Pax6 bersaglio con il gRNA. In verde, viene evidenziata la banda della dimensione prevista di 367 bp. (E) Traccia di sequenziamento Sanger di tre cloni organoidi resistenti all'igromicina. Il clone superiore non è stato modificato. Il clone centrale è un'edizione C > T omozigote e, quindi, un knock-out omozigote. Il clone inferiore presenta due mutazioni puntiformi eterozigoti ed è un knock-out eterozigote o un clone misto ed è stato modificato erroneamente. (F) Immagini in campo chiaro dei cloni organoidi scelti con vari livelli di escrescenza. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Infine, per eseguire il trapianto ortotopico di organoidi della ghiandola lacrimale umana nei topi, sono stati utilizzati organoidi che sono stati divisi con 3 giorni di anticipo (< 100 μm di diametro). L'attecchimento organoide è stato confermato 1 mese dopo l'iniezione degli organoidi nella ghiandola lacrimale del topo mediante colorazione per un marcatore specifico umano, l'antigene nucleolare umano (Figura 5). L'assenza di colorazione punteggiata da tutte le sezioni della ghiandola lacrimale del topo significava una mancanza di attecchimento organoide umano.
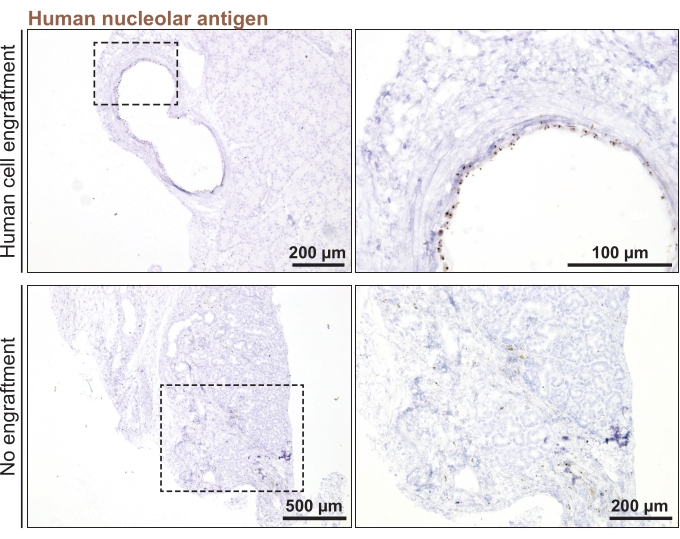
Figura 5: Trapianto di organoidi della ghiandola lacrimale umana nella ghiandola lacrimale del topo. Colorazione delle ghiandole lacrimali di topo trapiantate per il marcatore nucleolare umano per monitorare l'attecchimento 1 mese dopo il trapianto. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Tabella supplementare 1: Composizione dei mezzi e dei buffer. Clicca qui per scaricare questa tabella.
Discussione
Questo protocollo descrive la creazione e l'uso di organoidi della ghiandola lacrimale per saggi funzionali, modelli di mutazione e trapianto. Quando si stabiliscono organoidi di ghiandola lacrimale di topo e umana, la dissociazione dei tessuti è cruciale. Se il tessuto non è sufficientemente digerito, la resa organoide sarà bassa. Se il tessuto è sovra-digerito, le cellule moriranno e non cresceranno come organoidi. Ogni tessuto deve essere digerito con un enzima specifico per un tempo specifico per garantire una crescita organoide ottimale14,17,18. La ghiandola lacrimale è un tessuto piuttosto morbido per il quale una digestione della collagenasi di 5-10 minuti combinata con la dissociazione meccanica basata sul pipettaggio è sufficiente per isolare piccoli pezzi di tessuto. Se è necessario ottenere singole cellule per applicazioni come il sequenziamento dell'RNA a singola cellula, la dissociazione può essere effettuata più a lungo fino al raggiungimento dello stadio di singola cellula, ma la dissociazione deve essere interrotta non appena si ottengono singole cellule per limitare qualsiasi diminuzione della vitalità. Poiché la dissociazione tissutale è così cruciale, l'eccessiva digestione è la ragione più probabile per il fallimento dell'istituzione organoide della ghiandola lacrimale.
Il mantenimento appropriato degli organoidi della ghiandola lacrimale è importante per il loro uso. Il mantenimento a lungo termine è un segno distintivo degli organoidi delle ghiandole lacrimali derivati da cellule staminali adulte, rispetto agli organoidi indotti derivati da cellule staminali pluripotenti 7,17. Per ottenere una manutenzione a lungo termine, è necessario eseguire una regolare scissione degli organoidi e cambiamenti del mezzo. Senza questo, gli organoidi iniziano a differenziarsi e sviluppare un ridotto potenziale delle cellule staminali, che ostacola il loro mantenimento a lungo termine7. Anche in questa fase, l'eccessiva digestione può uccidere le cellule staminali e compromettere il mantenimento degli organoidi. Per una manutenzione regolare, non è richiesta la dissociazione degli organoidi in singole cellule. Tuttavia, per generare linee organoidi knock-out clonali, è fondamentale iniziare con singole cellule. In caso contrario, gli organoidi saranno costituiti da un mosaico di cellule con diversi background genetici, rendendo impossibile analizzare l'effetto di una singola mutazione definita. Qui, descriviamo l'uso di un editor di base C > T per generare codoni di stop. Questo editor del genoma si basa sulla presenza di codoni di arginina, glutammina o triptofano entro 12-18 basi da un NGG PAM. Quando queste condizioni non sono soddisfatte nella progettazione di un gRNA, è possibile utilizzare editor di base Cas9 o C >T convenzionali con PAM alternativi 7,18. Tuttavia, il Cas9 convenzionale introduce rotture a doppio filamento che provocano indels in caso di riparazione11. Poiché entrambi gli alleli possono ospitare indels diversi, la genotipizzazione del clone richiede ulteriore cautela. La deconvoluzione delle modifiche introdotte deve essere eseguita per garantire che entrambi gli alleli contengano indels out-of-frame e, quindi, che i cloni organoidi siano eliminati per il gene bersaglio19. Il vantaggio degli editor di base C > T risiede nel fatto che possono essere utilizzati per modellare mutazioni puntiformi che non necessariamente si traducono in codoni di stop. Ad esempio, possono essere utilizzati per modellare specifiche mutazioni di Pax6 riscontrate in pazienti con aniridia per studiare il loro impatto sulla fisiologia della ghiandola lacrimale20.
La ghiandola lacrimale secerne la parte acquosa del film lacrimale1. La secrezione lacrimale può essere ricapitolata negli organoidi umani dopo differenziazione mediata dal ritiro del fattore di crescita e dall'inibizione di NOTCH. In queste condizioni, gli organoidi subiscono una differenziazione terminale e non possono essere ulteriormente mantenuti. Tuttavia, gli organoidi differenziati della ghiandola lacrimale possono guidare lo sviluppo di farmaci che inducono la lacrimazione nel contesto della malattia dell'occhio secco, potenzialmente in screening ad alto rendimento. Il test di lacerazione presentato in questo protocollo è quello che attualmente dà il più grande cambiamento nella dimensione dell'organoide in un breve lasso di tempo, il che rende più facile quantificare nel contesto di uno screening farmacologico 7,9,17.
La terapia con cellule staminali è molto promettente per la rigenerazione della ghiandola lacrimale nella malattia dell'occhio secco21. Gli organoidi della ghiandola lacrimale derivati dalle cellule staminali adulte potrebbero essere un materiale di partenza per tali applicazioni. Il protocollo qui presentato si traduce nell'attecchimento organoide della ghiandola lacrimale umana, principalmente come cisti. Un basso attecchimento di organoidi può verificarsi a causa di organoidi iniettati nel sito sbagliato. L'addestramento della procedura di iniezione con un colorante consente il monitoraggio del sito di iniezione e, in definitiva, migliora la precisione dell'iniezione. In alternativa, l'epidermide del topo può essere incisa per avere accesso diretto alla ghiandola lacrimale, come fatto nei ratti prima dei22 anni. Questo metodo richiede più tempo, ma potrebbe essere più accurato. D'altra parte, con il presente protocollo, gli organoidi non si sono integrati funzionalmente nella ghiandola lacrimale del topo. Risultati simili sono stati osservati per l'attecchimento della ghiandola lacrimale derivato da iPSC22. Il metodo di trapianto potrebbe essere ulteriormente migliorato ferendo in anticipo la ghiandola lacrimale, utilizzando un modello murino di occhio secco e / o iniettando gli organoidi come singole cellule o piccoli grumi. Tuttavia, gli organoidi delle ghiandole lacrimali derivati dalle cellule staminali adulte e il relativo toolkit possono essere la base di future applicazioni nella ricerca sulle ghiandole lacrimali e nella medicina rigenerativa.
Divulgazioni
Hans Clevers è il capo della ricerca farmaceutica e dello sviluppo precoce presso Roche, Basilea, e detiene diversi brevetti relativi alla tecnologia degli organoidi.
Riconoscimenti
Ringraziamo Yorick Post per lo sviluppo iniziale del protocollo. Questo lavoro è stato in parte supportato da un premio del Cancer Research UK Grand Challenge (C6307/A29058) e della Mark Foundation for Cancer Research al team SPECIFICANCER.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL safe-lock centrifuge tubes | Eppendorf | EP0030 120.094 | |
| 3,3′-Diaminobenzidine tetrahydrochloride hydrate (DAB) | Sigma-Aldrich | D5637 | CAS: 868272-85-9 , CAUTION, 6 g/L solution can be stored aliquotted at -20 °C |
| 5x green GoTaq Flexi buffer | Promega | M891A | Store at -20 °C |
| A83-01 | Tocris | 2939 | Store at -20 °C, stock at 30 mM, 10000x |
| Advanced DMEM/F12 | Invitrogen | 12634-010 | store at 4 °C |
| Agar plates containing Ampicillin | Hubrecht Institute | ||
| Ampicillin sodium salt | Sigma-Aldrich | A9518 | |
| Autoclave VAPOUR-Line lite | VWR chemicals | ||
| B27 supplement | Invitrogen | 17504-044 | Store at -20 °C, 50x |
| BD Micro-Fine insulin needle 1 mL | BD Bioscience | 324825 | |
| Benchtop microscope DMI1 | Leica | ||
| Bovine serum albumine (BSA) | MP biomedicals | 160069 | Store at 4 °C |
| BTXpress | BTX | MDS450805 | |
| C57BL/6 mice | Hubrecht Institute | ||
| Cassettes | Klinipath | 410-02S | |
| CellBanker 1 | amsbio | 11910 | Cryopreservation medium, adhere to instructions |
| Centrifuge | Eppendorf | ||
| Citric acid monohydrate | J.T. Baker | 0088 | CAS: 5949-29-1 |
| Collagenase I | Sigma Aldrich | C9407 | Aliquots at 20 mg/mL, 20x, store at -20 °C |
| Conical tubes 15 mL | Greiner Bio-One | 5618-8271 | |
| Conical tubes 50 mL | Corning | CLS430828-500EA | |
| Coverslips 24 mm x 50 mm | Menzel-Gläzer | BB024050S1 | |
| Cultrex Basement Membrane Extract (BME), Growth Factor Reduced, Type 2 - extracellular matrix | R&D Systems, Bio-Techne | 3533-001-02 | Store at -20 °C, keep at 4 °C for up to 1 month |
| DAPT | Sigma Aldrich | D5942 | Store at -20 °C, stock at 10 mM, 1000x |
| Disodium hydrogen phosphate anhydrous | VWR chemicals | 28026.292 | CAS: 7558-79-4 |
| Di-sodiumhydrogenphosphate dihydrate | Sigma-Aldrich | 71643 | CAS:10028-24-7 |
| Dispase | ThermoFisher Scientific | 17105-041 | Aliquots at 50 U/mL, store at -20 °C until use, 400x |
| Disposable Scalpel Sterile N° 10 | Swann Morton | 3033838 | |
| DM4000 microscope | Leica | ||
| dNTPs 25 mM | Promega | U1420 | Mix all 4 nucleotides together, Store at -20 °C |
| Dpn1 | New England Biolabs | R0176 | |
| Dulbecco's Phosphate-bufferd Saline (DPBS) | Gibco | 14190144 | 1x |
| Easy strainers 70 µm | Greiner | 542170 | |
| Electroporation cuvette | Nepagene | EC002S | |
| EnVision+/HRP mouse | Agilent | K400111-2 | |
| Ethanol 100% | BOOM | 84045206;5000 | CAUTION, Use to prepare other Ethanol dilutions |
| Ethanol 70% | BOOM | 84010059.5000 | CAUTION |
| Ethanol 96% | BOOM | 84050065.5000 | CAUTION |
| EVOS FL Auto 2 Cell Imaging System | ThermoFisher Scientific | Live-imaging brightfield microscrope | |
| FGF10 | Peprotech | 100-26 | Store at -20 °C, stock at 100 mg/mL in base medium, 100x |
| Fiji | NIH, Fiji developers | ||
| Formaldehyde solution 4% | Sigma-Aldrich | 1.00496 | CAS: 50-00-0, CAUTION |
| Forskolin | Tocris | 1099 | Store at -20 °C, stock at 10 mM, 10000x |
| Glutamax | Gibco | 35050-061 | 100x |
| GoTaq G2 Flexi DNA Polymerase | Promega | M7805 | Store at -20 °C |
| Haematoxylin | VWR chemicals | 10047105 | Store at room temperature |
| HEPES | Gibco | 15630-080 | Store at 4 °C, 100x |
| Histocore H and C, Tissue embedding machine | Leica | ||
| Hot plate | Meidax | ||
| Human nucleolar antigen antibody | Abcam | ab-190710 | |
| Hydrochloric acid 5 N | ThermoFisher Scientific | 10605882 | CAS: 7647-01-0, CAUTION |
| Hydrogen peroxyde 30% | Chem-lab | CL00.2308.1000 | CAS: 7722-84-1, CAUTION |
| Hygromycin B-gold | InvivoGen | ant-hg | Stock at 100 mg/µL, 1000x |
| Hygromycin resistance cassette-containing plasmid | Andersson-Rolf et al, Nature Methods, 2017. doi: 10.1038/nmeth.4156 | ||
| IsoFlo 100% | Mecan | 5960501 | |
| LB medium | Hubrecht Institute | ||
| MgCl2 25 mM | Promega | A351H | Store at -20 °C |
| Microtome RM2235 | Leica | ||
| Midiprep DNA isolation kit | ThermoFisher Scientific | K210005 | |
| Miniprep DNA isolation kit | ThermoFisher scientific | K210003 | |
| N-acetylcysteine | Sigma Aldrich | A9165 | Store at -20 °C, stock at 500 mM, 400x |
| NEPA21 electroporator | Nepagene | ||
| Nicotinamide | Sigma Aldrich | N0636 | Store at -20 °C, stock at 1M, 100x |
| NOD Scid Gamma (NSG) mice | Hubrecht Institute colony | ||
| Noggin conditioned medium | U-Protein Express | Custom order | Store at -20 °C |
| Noradrenaline | Sigma Aldrich | A7257 | Store at -20 °C, stock at 100 mM |
| Oven | Memmert | Set at 58 °C | |
| P20, P200 and P1000 pipettes | Gilson | ||
| Paraffin | VWR chemicals | 10048502 | |
| Pasteur pipettes, glass plugged | ThermoFisher Scientific | 1150-6973 | |
| Pax6_C>T_F: AGACTGTTCCAGGATGGCTG | IDT | ||
| Pax6_C>T_R: TCTCCTAGGTACTGGAAGCC | IDT | ||
| pCMV_ABEmax_P2A_GFP | Addgene | 112101 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | Store at -20 °C |
| Pertex | Klinipath | AM-08010 | |
| pFYF1320 | Addgene | 47511 | |
| Primocin | InvivoGen | ant-pm-1 | 1000X, store at -20 °C |
| Prostaglandin E2 (PGE2) | Tocris | 2296 | Store at -20 °C, stock at 10 mM, 10000x |
| Petri dish, 10 cm | Greiner | 633102 | |
| Q5 buffer | New England Biolabs | B9027S | |
| Q5 high-fidelity DNA polymerase | New England Biolabs | M0491S | |
| QIAquick Gel Extraction Kit | Qiagen | 28704 | |
| QuickExtract DNA Extraction Solution | Lucigen | QE09050 | Store aliquots at -20 °C |
| R-spondin 3 conditioned medium | U-Protein Express | Custom order | Store at -20 °C |
| sgRNA Reverse Primer: TCTGCGCCCATCTGTTGCTT CGGTGTTTCGTCCTTTCCACAAG | IDT | ||
| Slides | StarFrost | MBB-0302-55A | Adhesive, ground |
| Sodium azide | Merck | 8.22335.1000 | CAS: 26628-22-8, CAUTION |
| Sodium cytrate dihydrate | J.T. Baker | 0280 | CAS: 6132-04-3 |
| Standard Forward Primer: “/5phos/ GTTTTAGAGCTAGAAATAGCAAG TTAAAATAAGGC | IDT | ||
| Subcloning efficiency competent cells DH5alpha | Invitrogen | 18265-017 | |
| Suspension cell culture plates (24-well) | Greiner Bio-One | 662102 | 24-well |
| Suspension cell culture plates (12-well) | Greiner Bio-One | 665102 | 12-well |
| T4 DNA ligase | New England Biolabs | M0202 | |
| TAE buffer | ThermoFisher Scientific | B49 | Stock at 50x, dilute to 1x with ultrapure water |
| Transposase-containing plasmid | Andersson-Rolf et al, Nature Methods, 2017. doi: 10.1038/nmeth.4156 | ||
| TrypLE Express Enzyme | Invitrogen | 12605-028 | store at 4 °C |
| U6_Forward primer: GGGCAGGAAGAGGGCCTAT | IDT | ||
| UltraPure Agarose 1000 | Invitrogen | 16550 | |
| Water bath | Tulabo | ||
| Xylene | Klinipath | 4055-9005 | CAS: 1330-20-7, CAUTION |
| Y-27632 | Abmole Bioscience | Y-27632 dihydrochloride | Store at -20 °C, stock at 10 mM, 1000x |
Riferimenti
- Garg, A., Zhang, X. Lacrimal gland development: From signaling interactions to regenerative medicine. Developmental Dynamics. 246 (12), 970-980 (2017).
- Selinger, D. S., Selinger, R. C., Reed, W. P. Resistance to infection of the external eye: The role of tears. Survey of Ophthalmology. 24 (1), 33-38 (1979).
- Messmer, E. M. The pathophysiology, diagnosis, and treatment of dry eye disease. Deutsches Arzteblatt International. 112 (5), 71-81 (2015).
- Massie, I., et al. Development of lacrimal gland spheroids for lacrimal gland tissue regeneration. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2001-2009 (2018).
- Tiwari, S., et al. Establishing human lacrimal gland cultures with secretory function. PloS One. 7 (1), 29458(2012).
- Nguyen, D. H., Beuerman, R. W., Halbert, C. L., Ma, Q., Sun, G. Characterization of immortalized rabbit lacrimal gland epithelial cells. In Vitro Cellular & Developmental Biology. Animal. 35 (4), 198-204 (1999).
- Bannier-Hélaouët, M., et al. Exploring the human lacrimal gland using organoids and single-cell sequencing. Cell Stem Cell. 28 (7), 1221-1232 (2021).
- Hayashi, R., et al. Generation of 3D lacrimal gland organoids from human pluripotent stem cells. Nature. 605 (7908), 126-131 (2022).
- Jeong, S. Y., et al. Establishment of functional epithelial organoids from human lacrimal glands. Stem Cell Research & Therapy. 12 (1), 247(2021).
- Hofer, M., Lutolf, M. P. Engineering organoids. Nature Reviews Materials. 6 (5), 402-420 (2021).
- Meyenberg, M., Ferreira da Silva, J., Loizou, J. I. Tissue specific DNA repair outcomes shape the landscape of genome editing. Frontiers in Genetics. 12, 728520(2021).
- Geurts, M. H., et al. CRISPR-based adenine editors correct nonsense mutations in a cystic fibrosis organoid biobank. Cell Stem Cell. 26 (4), 503-510 (2020).
- Overmyer, K. A., Thonusin, C., Qi, N. R., Burant, C. F., Evans, C. R. Impact of anesthesia and euthanasia on metabolomics of mammalian tissues: Studies in a C57BL/6J mouse model. PLoS One. 10 (2), 0117232(2015).
- Driehuis, E., et al. Oral mucosal organoids as a potential platform for personalized cancer therapy. Cancer Discovery. 9 (7), 852-871 (2019).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. Journal of Visualized Experiments. (6), e253(2007).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Lian, J., Meng, X., Zhang, X., Hu, H. Establishment and genetic manipulation of murine hepatocyte organoids. Journal of Visualized Experiments. (180), e62438(2022).
- Lõhmussaar, K., et al. Patient-derived organoids model cervical tissue dynamics and viral oncogenesis in cervical cancer. Cell Stem Cell. 28 (8), 1380-1396 (2021).
- Bloh, K., et al. Deconvolution of complex DNA repair (DECODR): Establishing a novel deconvolution algorithm for comprehensive analysis of CRISPR-edited Sanger sequencing data. The CRISPR Journal. 4 (1), 120-131 (2021).
- Latta, L., et al. Pathophysiology of aniridia-associated keratopathy: Developmental aspects and unanswered questions. The Ocular Surface. 22, 245-266 (2021).
- Veernala, I., et al. Lacrimal gland regeneration: The unmet challenges and promise for dry eye therapy. The Ocular Surface. 25, 129-141 (2022).
- Hayashi, R., et al. Generation of 3D lacrimal gland organoids from human pluripotent stem cells. Nature. 605 (7908), 126-131 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon