Method Article
マウスおよびヒト涙腺オルガノイドの樹立、維持、分化、遺伝子操作、移植
要約
このプロトコルは、初代マウスおよびヒト組織に由来する涙腺オルガノイドを確立、維持、遺伝子改変、分化、機能的に特徴付け、および移植する方法を説明しています。
要約
涙腺は、眼表面の恒常性に不可欠な器官です。涙液膜の水性部分を生成することにより、乾燥ストレスや外部からの侮辱から目を保護します。涙腺(病態)生理学については、適切な in vitro モデルがないため、ほとんど知られていません。オルガノイド技術は、複数の臓器にとって有用な実験プラットフォームとしての地位を証明しています。ここでは、涙腺生検から始まるマウスとヒトの涙腺オルガノイドを確立および維持するためのプロトコルを共有します。培養条件を変更することで、涙腺オルガノイドの機能を高めます。オルガノイドの機能は、涙腺オルガノイドを選択された神経伝達物質にさらして内腔の涙液放出を引き起こす「泣く」アッセイによって調べることができます。この現象を画像化して定量化する方法を説明します。涙腺恒常性における目的の遺伝子の役割を調べるために、これらを遺伝子組み換えすることができる。ガイドRNA設計からオルガノイドクローンジェノタイピングまで、ベースエディターを使用して涙腺オルガノイドを遺伝子改変する方法を徹底的に説明します。最後に、ヒト涙腺オルガノイドの再生能をマウスへの同所性移植により調べる方法を示します。この包括的なツールセットは、マウスとヒトの涙腺オルガノイドを使用して涙腺(病態)生理学を研究するためのリソースを提供します。
概要
涙腺は、涙液膜1の水層の大部分を産生する腺上皮である。涙液膜の水層には、眼の表面を滑らかにする水だけでなく、眼の表面を感染から保護する抗菌成分のレパートリーも多く含まれています2。涙腺が損傷または炎症を起こすと、ドライアイ疾患が発生し、患者に不快感を与え、最終的には視力喪失につながる可能性があります3。何年にもわたって、涙腺、特にヒト腺を研究するためのモデルシステムは制限されてきました4、5、6。これは、生理学的および病理学的条件下での涙腺機能に関する知識のギャップに貢献しています。
最近、皿中の涙腺を研究するためにin vitroモデルが開発されました7,8,9。これらの涙腺オルガノイドは、in vitroで再生能力を維持する成長因子のカクテルを補充した細胞外マトリックス中で三次元構造として増殖した成体幹細胞に由来します7。成体幹細胞(ASC)由来のオルガノイドの利点は、健康な組織の特徴を再現しながら、非常に長期間維持できることです。このタイプのオルガノイドは、例えば間質細胞を含む可能性のある人工多能性幹細胞(iPSC)由来のオルガノイドとは異なり、上皮細胞のみで構成されています。多能性幹細胞(PSC)由来のオルガノイドとは異なり、ASCオルガノイドは成体組織から直接樹立され、拡張のための遺伝子改変を必要としません。ASCオルガノイドは成人の特徴を発現します10。
このプロトコルには、マウスおよびヒトの一次組織から涙腺オルガノイドを導出するためのツールボックスが含まれています。このプロトコルでは、単純な成長因子の回収によってオルガノイドの機能をさらに強化する方法と、膨潤アッセイを実行してオルガノイドを誘発して涙液を分泌させる方法について説明します。このプロトコルには、CRISPR由来のベースエディターを使用してマウスオルガノイドを遺伝子操作するためのエレクトロポレーションベースのトランスフェクション法も含まれています。従来のCas9とは異なり、塩基エディターの使用は、二本鎖切断を生成することなくゲノム中の一塩基の改変を可能にする11,12。最後に、免疫不全マウスへのヒト涙腺オルガノイドの同所性移植とその後の生着の組織学的評価について説明します。この涙腺オルガノイドツールキットは、涙腺の再生と機能に関する研究、および遺伝および炎症性疾患のモデリングに使用できます。
プロトコル
マウス実験は、オランダ王立芸術科学アカデミー(KNAW)の動物倫理委員会によって、プロジェクトライセンスAVD8010020151の下で承認されました。オルガノイドはマウスの余剰物質に由来した。ヒト涙腺生検は、プロトコル番号18-740の下で医療倫理委員会による承認後、ユトレヒト大学医療センター(UMCU)で手術を受けている患者の廃棄物から収集されました。このプロトコルには、 図 1 に概説されているいくつかのセクションが含まれています。

図1:プロトコルの概要。 この図は、プロトコルのさまざまな手順を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
注:すべての培地および緩衝液組成物は 、付録表1に記載されています。
1. マウスおよびヒト涙腺からのオルガノイドの樹立
- マウスの涙腺を解剖する
- はさみ、鉗子、解剖パッドなどの解剖ツールを準備します。マウスをO2 /CO2 吸入で安楽死させる13.
- 安楽死させたマウスを解剖パッドの腹部に置き、手足を固定します。マウスの耳の間と額にある髪を70%エタノールで濡らします。
- 解剖はさみを使用して、耳の間の頭蓋骨の後ろに開口部を作ります。この開口部を額から鼻まで伸ばします。まだハサミを使用して、耳の後ろの皮膚を切り、2つのフラップを生成します。
- 図2Aに示すように、涙腺が露出するまでフラップを鼻に向かってしっかりと引きます。フラップを解剖パッドに固定します。はさみを使用して、涙腺の上にある膜を少し切開して、涙腺を完全に露出させます。
- 鉗子を使用して、涙腺を引っ張ります。主涙管が引き裂かれるまで、ある程度の抵抗があるはずです。必要に応じて、ハサミで主涙管を直接切断します。
- マウスの涙腺を組織培養グレードのPBSに入れて、さらに処理します。細胞死を制限するために、2〜4時間以内に涙腺の処理を進めます。これに時間がかかる場合は、マウスの涙腺を生検採取培地に入れます(補足表1)。
注:多数のオルガノイドがすぐに必要な場合は、いくつかの涙腺をプールすることができます。
- ヒト涙腺生検の収集
- 手術の前に、生検採取培地(補足表1)を50 mLチューブに入れて20 mLアリコートを調製し、手術前に外科医に渡します。この培地は、4°Cで数ヶ月間保つことができます。
- 手術当日、外科医に涙腺の一部(通常<1mm3)をサンプリングさせ、4°Cの生検採取培地(補足表1)に保管します。
- できるだけ早くそれを処理するために生検を収集します。理想的には、これは生検サンプリングの2時間以内の同じ日でなければなりません。
- オルガノイド誘導
- 融解した細胞外マトリックス(ECM)、室温(RT)マウスまたはヒト増殖培地(補足表1)、解凍したコラゲナーゼ、ベース培地(補足表1)、メス2つ、10 cmペトリ皿1つ、15 mLチューブに取り付けた70 μmストレーナー、および37°Cで30分間予温した12ウェル懸濁液を事前に準備します。
- 別表1に示す全ての成分を組み合わせて消化培地を調製する。この培地でメスを事前に濡らして、組織片がメスに付着しないようにします。
- 培地からマウスまたはヒトの涙腺組織を取り出し、ペトリ皿に入れます。
- 事前に濡れたメスを使用して、組織を細かく刻みます。組織片が非常に小さくなったら(すなわち、<0.5 mm3)、メスでペトリ皿からそれらをこすり落とし、消化媒体に入れます。ヒト生検がすでに非常に小さい場合は、組織の損失を避けるために、ミンチせずに消化培地に直接入れます。
- 組織片を37°Cの水浴中で最大15分間インキュベートします。15 mLチューブを定期的に反転させて、ピースを再懸濁します。組織を過剰に消化しないように、ベンチトップ顕微鏡で細胞の解離を監視します。
- それまでの間、パスツールピペットの先端を回転させながら炎にさらして狭くし、ベース培地で事前に湿らせます。組織を効率的に解離するには、穴が残っている最大の組織片よりもわずかに小さいことを確認してください。解離プロセスを容易にするために、事前に湿らせた狭小パスツールピペットで5分ごとに混合物を上下にピペットします。
- 顕微鏡下で多数の単一細胞と小さな塊が見える場合は、10 mLのベース培地を加えて解離を停止します。400 x g で5分間スピンダウンして、細胞をペレット化します。
- 上清を除去し、ペレットを10mLのベース培地に再懸濁して洗浄を繰り返す。70 μmのストレーナーでろ過して、未消化の大きな組織片と残っているコラーゲン繊維を取り除き、ECMの適切な重合を妨げます。溶出液を400 x g で5分間スピンさせます。
注:赤血球ペレットは赤血球の存在を示し、通常はオルガノイドの誘導を妨げません。ただし、フローサイトメトリーなどの一部のアプリケーションでは、赤血球を溶解する必要があります。そのためには、細胞を5 mLの新鮮な赤血球溶解バッファー中でRTで5分間インキュベートし、細胞を400 x g で5分間ペレット化します。 - 上清を除去し、細胞ペレットを1匹のマウス涙腺の場合は100 μLの冷ECMに、ヒト生検の場合は50 μLの冷ECMに再懸濁します。再懸濁の際は、ECMの重合や安定性にも影響しますので、気泡を作らないように注意してください。
- 12ウェル懸濁プレートのウェルあたり最大100 μLの細胞をシードします。P200を使用して、ウェル内に~20 μLの液滴を作ります。液滴が小さいほど、マトリックスを介した成長因子と栄養素の拡散が良くなります。
- プレートを逆さまにして、37°Cの加湿インキュベーターに20〜30分間置き、ECMを固化させます。
- ECMが固まったら、12ウェルプレートのウェルあたり~1 mLのRTマウスまたはヒト増殖培地を追加します。オルガノイドが300 μmのサイズに達するまで、2〜3日ごとに培地を更新します。そのためには、ウェル内の培地を吸引し、ECM液滴に触れずにウェルの側面に膨張培地を静かに追加して、それらを破壊しないようにします。
注:プリモシン(100 mg / mL、市販の在庫から1:1,000)は、細菌汚染が発生した場合、分離時に追加できます。.ただし、オルガノイドの成長も遅くなるため、1〜2回の継代後にオルガノイドを添加しないか、除去することが好ましい。
2. マウスとヒトの涙腺オルガノイドの拡大
- マウスオルガノイドの場合は~7日後、ヒトオルガノイドの場合は~10日後、オルガノイドのサイズが~300 μmに達したら、培地を取り除きます。
- オルガノイドを含むECM液滴を1 mLのトリプシン溶液に再懸濁し、液滴がバラバラになるまでP1,000で激しく上下にピペッティングします。この混合物を15 mLチューブに移し、37°Cの水浴中で短時間インキュベートします。
- 2〜3分後、狭くして事前に湿らせたパスツールピペットを使用して、オルガノイド懸濁液を10倍〜15倍上下にピペッティングします。ベンチトップ顕微鏡でオルガノイドの解離状態を確認します。~20個の細胞の小さな塊が得られるはずです。37°Cの水浴中でより長くインキュベートし、解離が良好になるまでピペッティング工程を繰り返します。
注:ヒトオルガノイドは多層であるため、このステップに時間がかかる場合があります。単一セルが生成されます。これは、ほとんどのオルガノイド懸濁液が小さな塊で構成されている限り、オルガノイドの成長に影響を与えません。 - 10 mLのベース培地を加えて解離を停止します。次に、細胞を400 x g で5分間ペレット化します。
- 上清とオルガノイド(オルガノイドのない透明なゼリー状の層)の上に横たわる可能性のあるECMを除去した後、ステップ1.3.10に示すように、懸濁プレートにプレーティングする前に、細胞を適切な量の冷たいECMに再懸濁します。
注:一般的に、マウスの涙液オルガノイドは1:5の比率で分割され、ヒトのオルガノイドは1:3の比率で分割されます。つまり、100 μLのECMに含まれるオルガノイドから始める場合、分割後にそれぞれ500 μLと300 μLに再懸濁する必要があります。 - ECMが固化するまで37°Cのインキュベーター内でプレートを逆さまにインキュベートし、RTでマウスまたはヒト増殖培地でオルガノイドを覆います。
3. マウスおよびヒト涙腺オルガノイドの凍結保存
- オルガノイドを凍結保存するには、まずセクション2の指示に従ってオルガノイドを増殖培地で分割します。
- 約3〜4日後、オルガノイドが成長期にあるときに培地を除去し、100 μLのECM含有オルガノイドを10 mLの低温ベース培地に再懸濁します。氷上で10分間インキュベートして、ECMの解離を助けます。このプロセスを容易にするために、定期的にチューブを裏返してください。
- オルガノイドを500 x g で5分間ペレット化します。上清を除去し、オルガノイドペレットを1 mLの凍結保存培地に再懸濁します(残りのECMは凍結保存を損なわない)。オルガノイド懸濁液をクライオバイアルに移し、直ちに-80°Cの冷凍庫に移します。
注: 材料の表に記載されている凍結保存培地を使用する場合、クライオバイアルは-80°Cの冷凍庫に無期限に保管できます。別の凍結保存培地を使用する場合は、最適な保存を確保するために、24時間後にクライオバイアルを液体窒素タンクに移します。 - オルガノイドを解凍するには、冷凍庫からクライオバイアルを取り出し、ドライアイスで37°Cの水浴に輸送します。内容物のほとんどが解凍されるまで、クライオバイアルを水中に保持します。内容物を10 mLのベース培地を含む15 mLチューブに移し、細胞を400 x g で5分間スピンダウンします。
- ステップ2.5およびステップ2.6に記載されているように、拡張媒体を含む100 μLのECM中のオルガノイドをプレートします。
4. 涙腺オルガノイドの鑑別と機能性評価
- オルガノイド分化
- 涙腺オルガノイドを区別するには、まずセクション2の指示に従って拡張培地中のオルガノイドを分割します。
- 2日後、ステップ1.3.12に記載されているように、増殖培地をマウスまたはヒト分化培地と交換します。2〜3日ごとに培地を更新して、マウスオルガノイドをその培地で5日間、ヒトオルガノイドを9日間維持します。
- 分化培地中で5日後または9日後のオルガノイド分化を評価するには、ECM含有オルガノイドを100 μL採取してRNAを抽出します。これを行うには、P1,000を使用してウェルに含まれる1 mLの培地にECM液滴を再懸濁し、3 mLの氷冷ベース培地にオルガノイド懸濁液を移します。オルガノイドを500 x g で5分間ペレット化します。
- 上清を捨て、ペレットをRNA抽出バッファーに再懸濁する。RNA抽出キットの指示に従って下流のRNA抽出を実行します。得られたRNAは、例えば、幹細胞(TP63、KRT5、KRT14)および分化細胞マーカー(LCN2、WFDC2、AQP5、LTF、ACTA2など)の発現のRT-qPCR分析に使用します。 14.
注:関連する発現分析を取得するには、1つまたは複数の組織サンプルで選択したマーカーの発現を測定します。分化条件下で培養されたオルガノイドは、RNAの含有量が少ない傾向があります。
- 機能性膨潤アッセイ
注:プロトコルのこの部分では、少なくとも7日間分化したヒト涙腺オルガノイドを使用してください。機能的な裂傷に十分なマーカー発現を確保するために必要な最小時間は7日です。12ウェルプレートの各ウェルは1つの条件を構成する。条件の最小数は、ポジティブ コントロール、ネガティブ コントロール、およびテスト条件の 3 つです。- 涙腺オルガノイドによる分泌を誘導する個々の成分を含むヒト分化培地1mLを新たに調製する。例えば、100 μMのノルアドレナリンと1 μMのフォルスコリンを加え、よく混ぜます。
注:フォルスコリンは、通常最大の腫れを誘発するポジティブコントロールとして機能します。 - 自動明視野タイムラプス顕微鏡で、プレート内の画像化する位置、時間間隔(5分)、および持続時間(4時間)を設定します。ECM液滴全体が各位置に表示されていることを確認します。
- イメージングを開始する直前に、顕微鏡からプレートを動かさずに、イメージングするウェルから培養液を取り出し、ステップ4.2.1で準備したウェル再懸濁培地と交換します。分化培地を分化培地のみに置き換えたウェルをネガティブコントロールとして含め、培地のリフレッシュメントがオルガノイドの腫れを引き起こす可能性があるためです。
- 最大4時間後、膨潤アッセイは終了する。結果を分析します。
注意: これらの手順は、自動明視野タイムラプスイメージングを可能にするEVOS M7000顕微鏡で実行されます。その顕微鏡については、詳細な製造元のマニュアルを参照して、タイムラプスイメージングを設定してください。注目すべきことに、同様の特性を持つ他の顕微鏡を使用することができます。 - オルガノイドの膨潤を定量化するには、0時間および4時間で個々のオルガノイドの直径を測定します。ImageJで0時間および4時間後の単一のオルガノイド液滴の画像を開きます。
- ツールバーの直線アイコンをクリックし、最初に0時間でオルガノイドの直径を描きます。次に、ImageJ(分析>測定)の測定ツールを使用して、この線の長さを測定し、膨潤前のオルガノイド直径を測定します。同じオルガノイドに対してこのプロセスを4時間で繰り返し、膨潤後のオルガノイド径を求めた。
- 膨潤アッセイの前後で、条件ごとに~20個のオルガノイドのオルガノイド直径を測定します。
- 涙腺オルガノイドによる分泌を誘導する個々の成分を含むヒト分化培地1mLを新たに調製する。例えば、100 μMのノルアドレナリンと1 μMのフォルスコリンを加え、よく混ぜます。
5. Pax6をノックアウトするプラスミドの構築
- ノックアウトするgRNAデザイン Pax6 C > T ベースエディタの使用
注:gRNA設計に利用できるソフトウェアプログラムはたくさんあります。ここでは、統合されたgRNA設計、アノテーション、およびサンガートレースのアライメントを可能にするために、ベンチリングを使用しました。したがって、後続のすべてのステップは、代替ソフトウェアプログラムを使用して実行することもできます。- gRNA設計プロセスを開始するには 、新規(+)>DNA配列>インポートDNA配列をクリックして、ベンチリングでターゲット遺伝子を視覚化します。
- [ データベースからインポート]タブで、目的の遺伝子 Pax6を入力し、[ 検索]を押します。
- マウス参照ゲノムGRCm38(mm10、 Mus musculus)の最新ビルドを選択し、[ インポート]を押します。
- 以下の規則に従って、ノックアウトgRNAを設計できるエクソンを選択します。
- 後続エキソンの代替開始部位が、早期誘導終止コドンを回避するために細胞によって使用され得るので、最初のコードエクソンにgRNAを入れることは避けてください。
- Pax6 mRNAのスプライシングによって起こり得るすべての代替転写物に存在するエクソンのgRNAを設計します。これを確実にするために、EnsemblゲノムブラウザーでPax6を視覚化し、すべての転写物で使用されるエクソンを選択します。
- 選択的スプライシングをさらに回避するには、不完全なコドン(トリプレットの残りの1つまたは2つの塩基)を持つエクソンを標的にします。これはそれほど重要ではありませんが、誘導インデルの効果についてより確実です。 Pax6の場合、エクソン4からエクソン11が適切なターゲットです。さらに、トリプトファン(W)、グルタミン(Q)、またはアルギニン(R)残基を含むエクソンを選択します。
注:SpCas9を使用する標準C>Tベースエディターには、gRNAの先頭(PAMから最も遠い場所)からヌクレオチド4からヌクレオチド8までの編集ウィンドウがあります。C>T塩基エディターは、すべてのトリプトファン(W)残基(TGGからTGA、TAGまたはTAA)に終止コドンを導入し、逆鎖にgRNA、グルタミン(Q)残基(CAGからTAGまたはCAAからTAA)、そして最後に、前方鎖上のアルギニン(R)残基(CGAからTGA)にストップコドンを導入することができます。
- 上流と下流のエクソン+20塩基を選択します。ターゲットサイン CRISPRの画面右側をクリックし、ガイドの設計 と分析をクリックします。
- 新しく開いたメニューの[デザインタイプ]タブで、[ベース編集]のガイドにチェックマークを付けます(Komor et al.、2016)。ガイド長を20ヌクレオチドに保ち、[マウスのゲノム]でGRCm38(mm10、Mus musculus)を選択します。
- 緑色の + 記号をクリックすると、ソフトウェアプログラムはすべてのプロトスペーサー隣接モチーフ(PAM)配列を自動的に検出し、画面の右側に、目的のエクソンの周囲の領域にあるすべての潜在的なgRNAのリストを作成します。
- 赤いボックス内の終止コドン記号(*)までリストをスクロールすると、アミノ酸を終止コドンに変えてノックアウトを引き起こす可能性のあるgRNAのシグナルを示します。
- gRNA配列の右側の第1列では、編集ウィンドウの周りの各ターゲット「C」について、 インシリコ 予測編集効率が計算される。終止コドンをもたらすC>T編集の編集効率が少なくとも~10であることを確認してください。
- オフターゲット列の値をクリックして、gRNAが結合できる オフターゲット 遺伝子座を確認します。特異性を高めるために、追加の遺伝子に結合するgRNAを選択することは避けてください。例えば、C > T塩基エディターで Pax6 を編集するための優れたgRNAは、エクソン7を標的とし、5'-AAGCAACAGATGGGCGCAGA-3'である。
- ベンチリングファイルに注釈を作成するには、画面の右上にある 注釈 アイコンをクリックしてから、[ 新しい注釈]をクリックします。アノテーションに名前を付け、 Strand ドロップダウンメニューで正しいgRNA配向が選択されていることを確認します。
- gRNAプラスミドの生成
注:オルガノイドへのgRNA送達にはさまざまなベクターがあります。以下のプラスミドをgRNA構築のベースとして使用した:pFYF1320(Addgene #47511、Keith Joungからの親切な贈り物)。- pFYF1320でgRNAをクローニングするには、標準的なフォワードプライマー「/5phos/ GTTTTAGAGCTAGAAATAGCAAGTTAAATAAGGC」を利用したインバースPCR戦略を実施します。リバースプライマーを設計するには、gRNAスペーサー配列の逆補体を次のユニバーサルリバースプライマー部分の前に貼り付けます(+または-鎖]を再確認してください)。C > T塩基エディターを用いてマウス Pax6 のエクソン7を標的とするために、リバースプライマーは以下の通りである:TCTGCGCCCATCTGTTGCTTCGGTTTTCGTCCTTTCCAAG。両方のプライマーを注文します。
- ハイフィデリティDNAポリメラーゼを用いて、1 ngのpFYF1320を鋳型として、アニーリング温度61°Cで35サイクルの逆PCR反応を実行します。
- 1%アガロースゲルを TAE バッファー中で 100 V で ~45 分間 PCR反応を行い、予想される 2,281 塩基対 (bp) のフラグメントを可視化します。選択したキットを使用してゲルクリーンアップを実行します。
- 次のライゲーション反応を設定します:100 ngのクリーンアップPCR産物、最初のpFYF1320テンプレートDNAを除去するためのDpn1酵素、およびT4リガーゼ。混合物を20°Cで15分間、37°Cで30分間、および80°Cで20分間インキュベートします。
- 反応混合物を化学的に有能なDH5α細菌に変換し、アンピシリン15を含む寒天プレート上に細菌を広げます。
- 翌日、50 μg/mLのアンピシリンを添加した3 mLのリソジェニーブロス(LB)培地で3つの個々のコロニーを選択して展開します。
- 翌日、ミニプレップキットを用いて3つのミニ培養液のそれぞれ1 mLに対してミニプレップを行い、残りは4°Cで保存しました。 得られたプラスミドをU6_Forwardプライマーを用いたサンガーシーケンシングに供し、gRNAがベクター16に正しく挿入されていることを確認する。
- 正しいプラスミドで単一の細菌コロニーを特定した後、アンピシリンを添加した50 mLのLBに500 μLの対応するミニカルチャーを接種し、プラスミドDNAを一晩増幅します。ミディプレップキットを使用した翌日にMIDIプレップを実行します。このプラスミドは、セクション6のエレクトロポレーションに使用されます。
6. Pax6 KOクローンの生成
- オルガノイドエレクトロポレーション
- マウスオルガノイドは、最大5日前に分裂して増殖状態にあることから始めます。ノックアウトごとに~300-400 μLのオルガノイド液滴を使用します。プラスミドなしでエレクトロポレーションされるネガティブコントロールを選択するための追加の条件を含めます。
- 手順2.1〜2.4を実行してオルガノイドを解離しますが、オルガノイドを解離して単一細胞にします。上澄み液を捨てる。
- 細胞を80 μLのエレクトロポレーションバッファーに再懸濁します。
- 1.5 mLチューブで、最大20 μLのプラスミドを調製します:pFYF1320-gRNAプラスミド2.5 μg、トランスポザーゼ含有プラスミド2.8 μg、ハイグロマイシン耐性トランスポゾン含有プラスミド7.2 μg、およびpCMV_ABEmax_P2A_GFP 7.5 μg。
注:pFYF1320-gRNAプラスミドは、以前に設計されたgRNAをコードしており、ベースエディターを標的遺伝子座に導きます。pCMV_ABEmax_P2A_GFPプラスミドは、エレクトロポレーション後にベースエディターを発現する細胞をモニターするために使用することができるGFPレポーターと同様に、ベースエディターをコードする。トランスポザーゼ含有プラスミドはトランスポザーゼをコードしており、トランスポザーゼは、ハイグロマイシン耐性トランスポゾン含有プラスミドによって提供されるハイグロマイシン耐性カセットをゲノムのどこかにランダムに貼り付ける。このカセットをゲノムに組み込んだ細胞は、ハイグロマイシンに耐性になり、ハイグロマイシンを添加することで積極的に選択することができます。複数のプラスミドの同時取り込みが非常に可能性が高いため、ハイグロマイシン耐性は、 Pax6用に編集された細胞を濃縮するための機能選択を構成します。 - プラスミドを細胞に加え、上下にピペッティングしてよく混ぜます。
- ポアリングパルス(電圧:175V、パルス長:5ms、パルス間隔:50ms、パルス数:2、減衰率:10%、極性:+)とトランスファーパルス(電圧:20V、パルス長:50ms、パルス間隔:50ms、パルス数:50ms、減衰率:40%、極性:+/-)のパラメータでエレクトロポレーターをセットアップします。
- プラスミドを含む細胞をエレクトロポレーションキュベットに入れます。すぐに0.30 Aから0.55 Aの間の抵抗(Ω)を測定し、すぐにエレクトロポアします。この工程を迅速に行うことは、細胞がキュベットの底部に沈降し、エレクトロポレーション効率を低下させることを避けるために必要である。
- 細胞を1.5 mLチューブに移し、Rho-キナーゼ阻害剤を添加した400 μLのエレクトロポレーションバッファーを加えます。細胞をRTで30分間回復させます。
- 細胞を500 x g で5分間ペレット化し、上清を廃棄し、細胞を200 μLのECMにプレートします。固化後、マウス膨張培地を追加します。
- 嚢胞性オルガノイドは2〜3日後に成長します。GFP信号を毎日監視し、C>Tベースエディターの存在を明らかにします。
- オルガノイドの選択
- ~3日後、オルガノイドが回復したら、マウス増殖培地に100 μg/mLのハイグロマイシンを添加し、ハイグロマイシン耐性カセットを統合したオルガノイドを選択します。1つのプラスミドを取り込む細胞が複数のプラスミドを取り込む可能性が高いです。ハイグロマイシン耐性オルガノイドを選択することにより、 Pax6 遺伝子座上の編集されたオルガノイドが濃縮されます。
- ネガティブコントロールのすべての細胞が死んでいて、生き残ったオルガノイドが~300 μmの場合、ハイグロマイシン耐性オルガノイドを選択します。
- オルガノイドピッキングとジェノタイピング
- 顕微鏡の横に滅菌P20チップを用意し、氷上でそれぞれ100 μLのトリプシン溶液を含む1.5 mLチューブを準備します。
- P20チップを鉗子で曲げます。生き残ったオルガノイドを含むプレートをベンチトップ顕微鏡で観察します。生き残ったオルガノイドに焦点が合ったら、プレートの蓋を取り外します。曲げたP20チップを顕微鏡下で使用して、生き残った各オルガノイドを個別に吸引し、これらのそれぞれをトリプシン溶液を含む別々のチューブに入れます。
- 最大20個のクローンを選択します。選択するクローンの数は、各実験デザインに必要なクローンの数と、各gRNAと遺伝子座に応じて変化する編集効率に依存します。
- すべてのクローンをピックしたら、1.5 mLチューブを37°Cの水浴に最大5分間入れます。各チューブを定期的に渦巻して解離速度を上げ、ベンチトップ顕微鏡でオルガノイドを確認します。オルガノイドが小さな塊や単一細胞に解離したら、1 mLのベース培地を加えて消化を停止します。
- 選択したクローンごとに、~400 μLの遺伝子型を別々の1.5 mLチューブに保管します。500 x g で5分間残した~600 μLをスピンし、上清を除去し、細胞を20 μLのECMに再懸濁し、24ウェルプレートのウェルに単一液滴としてプレートし、ハイグロマイシンを含まないマウス増殖培地を加えます。
- クローンを遺伝子型決定するには、~400 μLの細胞懸濁液を含むチューブを500 x g で5分間スピンダウンし、上清を除去し、細胞を50 μLのDNA抽出バッファーに再懸濁してDNAを抽出します。
- 細胞を直ちにインキュベートします:60°Cで6分間、ボルテックス、および95°Cで4分間。 このDNAは-20°Cで最大7日間保存できますが、すぐにダウンストリームPCRを実行するのが最適です。
- ヌクレアーゼで標的とする遺伝子座を増幅するには、事前に注文した適切なジェノタイピングプライマーと低フィデリティポリメラーゼを使用して、抽出したDNAの2 μLでPCRを実行します。ジェノタイピングプライマーは、AGACTGTTCCAGGATGGCTG(Pax6_C>T_F)およびTCTCCTAGGTACTGGAAGCC(Pax6_C>T_R)です。アンプリコンは、効率的に配列決定されるように、予想される編集遺伝子座から約100 bpを開始する必要があります。
- アガロースゲル上でPCR産物を実行し、ステップ5.2.3で説明したようにPCR効率を評価します。正しいサイズのバンドが検出されたら、それをゲルから切り取り、キットを使用してDNAゲル抽出を実行します。
- ジェノタイピングプライマーを使用して、以前に選択した各オルガノイドクローンから抽出したDNAを配列決定します。
- 得られた配列をベンチリングの Pax6 遺伝子にアラインメントします。ステップ4.1からインポートした遺伝子配列を開きます。右側の [ 配置 ] をクリックし、[ 新しい配置の作成] をクリックします。シーケンシングプロバイダーから取得した.ab1ファイルをアップロードし、ヌクレオチドタイプとして DNA を選択して、[ 次へ]を押します。
- 次のウィンドウで、[マルチ シーケンス ]と[アライメントプログラム Auto(MAFFT) ]を選択してから、[ アライメントの作成]をクリックします。
- 両方の対立遺伝子にホモ接合性の時期尚早終止コドン(塩基エディターで得られたもの)を持つ遺伝子型を特定します。対応するオルガノイドクローンを増殖させ、さらなる分析のためにこれらを凍結保存します。理想的には、3つの異なるオルガノイドクローンを並べて分析して、潜在的なヌクレアーゼのオフターゲット効果を回避する必要があります。
7. NSGマウスにおけるヒト涙腺オルガノイドの同所移植
- オルガノイド調製
- ヒト涙腺オルガノイドは、セクション2に記載されているように、移植日の~3日前に分割する必要があります。移植当日は、生着の可能性を高めるためにオルガノイドが増殖期にあることを確認してください。
- ECMからオルガノイドを抽出するには、ディスパーゼを培地に添加して最終濃度0.125 U/mLにします。P1,000を使用して、ECM液滴を完全に再懸濁して破壊し、プレートを37°Cのインキュベーターに30分間戻します。100μLのECMの容量は、~10個の涙腺を注入するのに十分です。
- オルガノイドを10 mLのベース培地に再懸濁して、酵素を洗い流します。細胞を400 x g で5分間ペレット化します。
- 細胞(~1,500,000)を、5%ECMを添加した50 μLの低温ヒト増殖培地に再懸濁します。オルガノイド懸濁液を氷上に置き、直ちに移植に進む。
- マウスにおける同所性移植
- 動物施設では、オルガノイド懸濁液とインスリン針を氷上に置いてください。オルガノイド懸濁液を冷たいインスリン針で吸引します。
- NODシドガンマ(NSG)免疫不全マウスを3%イソフルランで鎮静させ、麻酔を開始します。マウスが眠っているときは、メインの涙腺(目と耳の中間にあります)にアクセスできるように、マウスをすばやく横に置きます。
- 5 μLのオルガノイド懸濁液を皮膚から直接涙腺に注入します。マウスの涙腺に含めることができる最大容量は5μLです。
- マウスが回復するのを待ち、マウスを毎日監視して、移植に関連する不快感、特に眼の不快感の存在を評価します。
- 生着を評価する
- 生着を短期または長期のどちらで評価すべきかに応じて、最大90日後にO2 / CO2 吸入でマウスを屠殺します13。
- セクション1で説明されているように涙腺を解剖します。RTで24時間4%ホルマリンで固定します。
- 涙腺をカセットに入れます。次のように涙腺をインキュベートして脱水します:70%エタノール中で2時間、96%エタノール中で2時間、100%エタノール中で1時間(2x)、キシレン中で2時間、およびオーブンで58°Cの流動パラフィン中で一晩。
- 翌日、涙腺を金型で好みどおりに向きを変え、流動パラフィンを補充し、ブロックを冷たい表面で固化させます。このプロセスは、埋め込みマシンで実行するのが最適です。
- パラフィンブロックが固体になったら、ミクロトームを使用してブロック全体を4〜5μmの切片に切断します。すべてのセクション(リボンの形)を乾燥したドラフトのない環境に保管してください。切片は室温で無期限に保管することができます。
- ブロック全体にまたがる10セクションごとに1つをサンプリングします。
- スライドに水滴をのせ、その上に置き、42°Cのホットプレートで伸ばすように~2分間休ませ、紙でやさしく水を取り除きます。
- スライドを58°Cのオーブンで一晩乾燥させます。スライドは、この段階を過ぎてもRTで無期限に保持できます。
- ヒト細胞とマウス細胞を区別するために、これらの切片に対してヒト核抗原染色を行う。次の洗浄を実行して切片をリハイドレートします:キシレン中で3分(2x)、100%エタノール中で1分(2x)、96%エタノール、90%エタノール、80%エタノール、70%エタノール、60%エタノール、および25%エタノールでそれぞれ1分、そして最後に、デミ水中で1分(2x)。
- スライドをPOバッファー中で15分間インキュベートします(補足表1)。スライドを超純水で3回洗浄します。
- オートクレーブ内でクエン酸塩ベースの抗原賦活化を実行します。
- クエン酸塩バッファーで満たされたバスケット内のオートクレーブ防止スライドホルダーにスライドを置きます(補足表1)。バスケットをオートクレーブに入れ、オートクレーブサイクルを実行します(圧力:10 PSI、温度:121°C、時間:15分)。
- オートクレーブが減圧されたら、スライドが入っているバスケットを取り出し、RTウォーターバスに入れてスライドをRTに運びます。
注:抗原賦活化戦略は、使用する抗体によって異なります。プロバイダーのデータシートを参照して、最も適切な抗原検索を実行してください。
- スライドをセクション側を上にして、インキュベーショントレイに水平に置きます。PBS中の1%ウシ血清アルブミン(BSA)を含むブロッキングバッファー500 μLを上に加え、1時間インキュベートします。ブロッキング バッファーを削除します。
- 染色するスライドごとに500 μLのブロッキングバッファーに1 μLのヒト核小体抗原抗体を加えて抗体溶液を調製します。各スライドに抗体溶液を追加します。4°Cの加湿インキュベーショントレイで一晩インキュベートします。
- 翌日、スライドをPBSで3回洗います。希釈していないHRP抗マウス二次抗体でスライドを45分間インキュベートします。スライドをPBSで3回洗浄します。
注意。ケミカルフードで、DABバッファーを準備します(補足表1)。スライドをDABバッファーで10分間インキュベートします。有機化学液体廃棄物容器に廃棄物を廃棄します。 - スライドを水で洗います。スライドをヘマトキシリン中で2分間インキュベートして、核を対比染色します。スライドを水道水で10分間洗います。
- スライドを50%エタノール、60%エタノール、70%エタノール、80%エタノール、90%エタノールでそれぞれ1分間、96%エタノール中で1分間(2x)、100%エタノール中で1分間(2x)、キシレン中で1分間(2x)インキュベートして脱水します。
- スライドを封入剤とカバーガラスで囲みます。約20分間乾燥させた後、顕微鏡下でスライドを観察します。
結果
マウスの涙腺の解剖(図2A)に続いて、酵素的および機械的消化により小さな組織断片が生成され、その中で腺房と管を区別することができました(図2B)。残りの大きな組織片はECMを不安定にし、初期のオルガノイドの成長を減少させます。マウスの涙腺オルガノイドの誘導は、オルガノイドが分割できる段階である~7日後に~500 μmの嚢胞性オルガノイドが見つかったときに成功しました(図2C)。全体的なオルガノイド誘導が成功したとしても、一部のオルガノイドは最終的に停止する前に成長し始める可能性があります。ヒト涙腺オルガノイドは、3〜4日以内に嚢胞として成長し、組織分離後10〜14日で完全に成長したサイズに達しました(図2D)。マウスとヒトの両方で、オルガノイドの誘導が失敗し、オルガノイドがまったくまたはほとんど成長しないことがありました。これは一般的に組織の過剰消化によって引き起こされました。マウスの涙腺オルガノイドは少なくとも40倍、ヒトオルガノイドは少なくとも20倍継代することができました。継代は、オルガノイドの成長に応じて、平均して7〜10日ごとに行われました。

図2:マウスとヒトの涙腺オルガノイドの樹立。 (A)マウス涙腺解離のさまざまな段階の写真。矢印は、その保護膜の下の涙腺を指しています。(B)組織消化直後のマウス涙腺細胞の明視野画像で、挿入図には腺房と管が示されています。(C)マウス涙腺オルガノイド誘導の成功と失敗の明視野画像。(D)14日間のヒトオルガノイド成長の明視野画像。この図の拡大版を表示するには、ここをクリックしてください。
涙腺オルガノイドは、増殖培地で培養すると幹細胞を多く含みます。分化レベルを高めるために、成長因子含有量を減らしたマウスとヒトの分化培地をセットアップしました。5日後および7日後、それぞれ、分化培地において、マウスおよびヒトの涙腺オルガノイドはより密度が高くなった(図3A-B)。この形態学的変化は、機能特性の増加と相関していました。サイクリックAMPアクチベーターフォルスコリンまたは神経伝達物質ノルエピネフリンを適用すると、3時間以内にオルガノイドの腫脹(すなわち、頂端水分分泌)がもたらされました(図3C)。腫脹が3〜4時間以上かかった場合、これはオルガノイドが十分に分化していないか、および/または神経伝達物質の受容体などの機能マーカーを発現していないことを示唆しました。
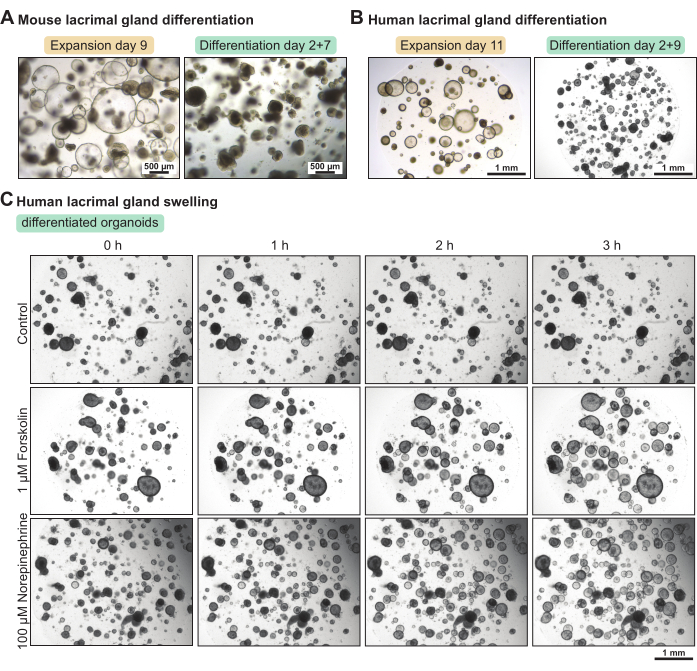
図3:マウスとヒトの涙腺オルガノイドの分化とヒトオルガノイドの機能的腫脹アッセイ。 (A)マウス涙腺オルガノイドを増殖培地で7日間培養し、分化培地で2日間培養した後、増殖培地で2日間培養したマウス涙腺オルガノイドの明視野画像。(B)拡大培地で11日間培養し、分化培地で2日間増殖培地で2日間培養したヒト涙腺オルガノイドの明視野画像。(C)新鮮な分化培地(コントロール)、1 μMフォルスコリン、および100 μMノルエピネフリンに3時間にわたって曝露された分化したヒト涙腺オルガノイドの明視野画像。 この図の拡大版を表示するには、ここをクリックしてください。
マウス涙腺オルガノイド中のPax6をノックアウトするために、選択したPax6標的化gRNAを含むプラスミドをPCRおよびライゲーションにより作製した(図4A)。このgRNA含有プラスミドを、Piggy-Bacプラスミド(ハイグロマイシン耐性トランスポゾン含有およびトランスポザーゼ含有プラスミド)およびC > T塩基エディターCas9とともにマウス涙腺オルガノイドに解離させて単一細胞にエレクトロポレーションした。3日後、オルガノイドが回復したとき、それらをハイグロマイシンに曝露し、ハイグロマイシン耐性カセットを組み込んだクローンについて選択した。エレクトロポレーションの成功では、ハイグロマイシンに耐性のあるオルガノイドが成長しました(図4B)。~300 μmを超える成長中のオルガノイドクローンを、理想的には自発的に分化し始める前にピックしました(図4C)。DNAは、オルガノイドの一部から抽出され、残りは培養中に保持されました。gRNAによって標的とされたPax6遺伝子座のPCR増幅により、選択された各クローンについて367 bpバンドが得られました(図4D)。増幅遺伝子座を配列決定した後、ホモ接合的にC>T編集されたクローン(n=1)を保持した。一方、編集されていないクローン(n = 4)、ヘテロ接合的に編集されたクローン、または誤って編集されたクローン(n = 1)は破棄されました(図4E)。全体として、Pax6を標的とするこのgRNAを用いて、配列決定された6個のうち1個のホモ接合型ノックアウトマウス涙腺クローンが得られた。一部のクローンはよく成長しましたが、一部のオルガノイドクローンはピッキング後に失われたり、分化し始めたりしました(図4F)。選ばれた10個のオルガノイドクローンのうち、7個は順調に成長しました。
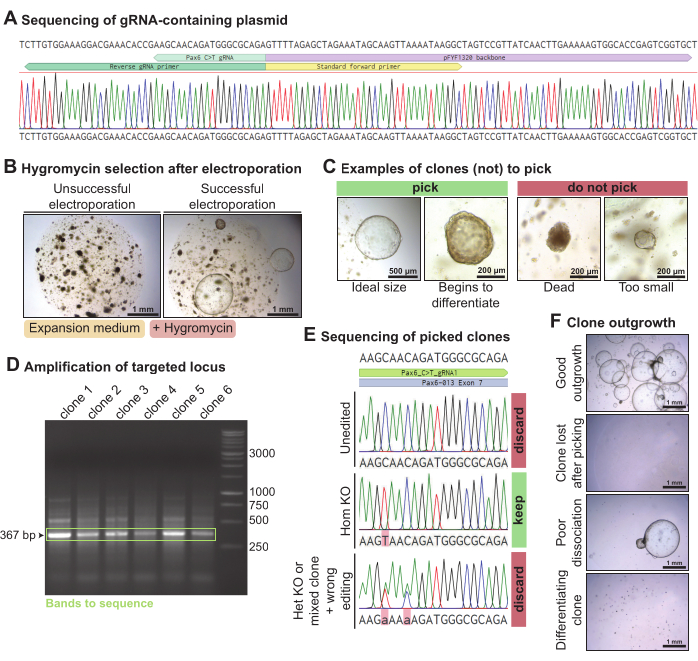
図4:マウス涙腺オルガノイドにおけるPax6の塩基編集を介したノックアウト。 (A)Pax6遺伝子座を標的とするgRNAが正しく統合された後のpFYF1320のサンガーシーケンシングトレース。(B)エレクトロポレーション後のハイグロマイシン曝露後5日後のマウス涙腺オルガノイドの明視野画像。オルガノイドをマウス増殖培地で培養した。左側はエレクトロポレーションの失敗例で、ハイグロマイシンに耐性のあるクローンは成長していません。右側はエレクトロポレーションの成功例で、いくつかのハイグロマイシン耐性オルガノイドクローンが生き残っています。(C)選択すべきクローンと選択すべきでないクローンの明視野画像。(D)gRNAを標的としたPax6遺伝子座の増幅を示すアガロースゲル。緑色では、予想されるサイズの 367 bp のバンドが強調表示されます。(E)ハイグロマイシンに耐性を示した3つのオルガノイドクローンのサンガーシーケンシングトレース。一番上のクローンは未編集です。真ん中のクローンはホモ接合性のC > T版であり、したがってホモ接合型のノックアウトです。一番下のクローンは、2つのヘテロ接合点突然変異を示し、ヘテロ接合型ノックアウトまたは混合クローンのいずれかであり、誤って編集されています。(F)さまざまなレベルの成長を伴うピックされたオルガノイドクローンの明視野画像。この図の拡大版を表示するには、ここをクリックしてください。
最後に、マウスにヒト涙腺オルガノイド同所移植を行うために、3日前に分割したオルガノイド(直径<100μm)を用いた。オルガノイドの生着は、マウス涙腺にオルガノイドを注入してから1ヶ月後にヒト特異的マーカーであるヒト核小体抗原について染色することにより確認した(図5)。マウスの涙腺のすべてのセクションからの点状染色の欠如は、ヒトオルガノイド生着の欠如を意味していました。
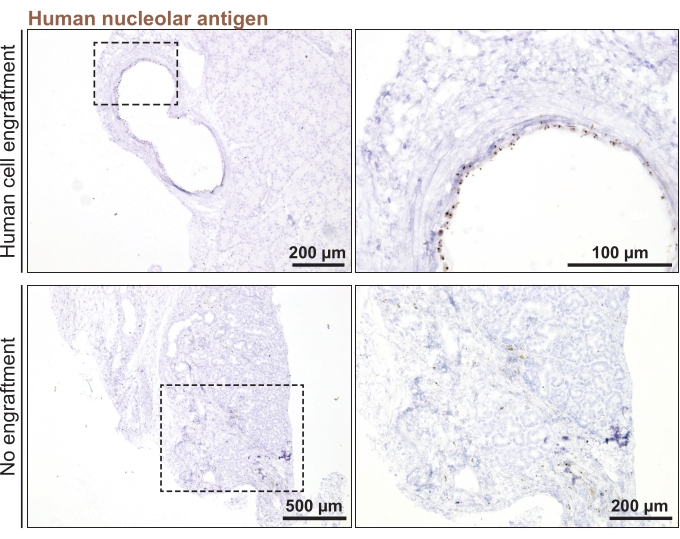
図5:ヒト涙腺オルガノイドのマウス涙腺への移植。 移植後1ヶ月の生着を監視するためのヒト核小体マーカーに対する移植マウス涙腺の染色。 この図の拡大版を表示するには、ここをクリックしてください。
補足表1:培地および緩衝液の組成。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルは、機能アッセイ、突然変異モデリング、および移植のための涙腺オルガノイドの確立と使用について説明しています。マウスとヒトの涙腺オルガノイドを確立する場合、組織の解離は非常に重要です。組織が十分に消化されない場合、オルガノイド収量は低くなります。組織が過剰に消化されると、細胞は死に、オルガノイドとして成長しません。各組織は、最適なオルガノイドの伸長を確実にするために、特定の時間、特定の酵素で消化されるべきである14、17、18。涙腺は、ピペッティングベースの機械的解離と組み合わせた5〜10分のコラゲナーゼ消化が組織の小片を単離するのに十分である、かなり柔らかい組織である。シングルセルRNAシーケンシングなどのアプリケーションでシングルセルを取得する必要がある場合は、シングルセルステージに達するまで解離をより長く実行できますが、生存率の低下を制限するために、シングルセルが得られたらすぐに解離を停止する必要があります。組織の解離は非常に重要であるため、過剰消化が涙腺オルガノイドの確立の失敗の最も可能性の高い理由です。
涙腺オルガノイドの適切な維持は、それらの使用にとって重要である。長期維持は、人工多能性幹細胞由来オルガノイドと比較して、成体幹細胞由来涙腺オルガノイドの特徴である7,17。長期的なメンテナンスを達成するには、定期的なオルガノイド分割と培地交換を行う必要があります。これがないと、オルガノイドは分化し始め、幹細胞の可能性が低下し、長期的な維持を妨げます7。このステップでも、過剰消化は幹細胞を殺し、オルガノイドの維持を損なう可能性があります。定期的なメンテナンスのために、単一細胞へのオルガノイド解離は必要とされない。しかし、クローンノックアウトオルガノイド株を作製するには、まず単一細胞から始めることが重要です。そうでない場合、オルガノイドは異なる遺伝的背景を持つ細胞のモザイクで構成され、単一の定義された突然変異の影響を分析することは不可能です。ここでは、終止コドンを生成するためのC > Tベースエディタの使用について説明します。このゲノムエディターは、NGG PAMから12〜18塩基以内にアルギニン、グルタミン、またはトリプトファンコドンが存在することに依存しています。gRNAの設計においてこれらの条件が満たされない場合、代替PAMを有する従来のCas9またはC >T塩基エディターを使用することができる7,18。しかし、従来のCas9では、修理時にインデルが発生する二本鎖断線が導入されています11。両方の対立遺伝子が異なるインデルを持っている可能性があるため、クローンジェノタイピングには追加の注意が必要です。導入された修飾のデコンボリューションは、両方の対立遺伝子がフレーム外のインデルを含み、したがって、オルガノイドクローンが標的遺伝子に対してノックアウトされることを確実にするために実行する必要があります19。C > Tベースエディターの利点は、必ずしも終止コドンをもたらさない点突然変異をモデル化するために使用できるという事実にあります。たとえば、アニリジア患者に見られる特定のPax6変異をモデル化して、涙腺生理学への影響を研究するために使用できます20。
涙腺は涙液膜1の水性部分を分泌する。涙液分泌は、成長因子の離脱およびNOTCH阻害によって媒介される分化後のヒトオルガノイドにおいて再現され得る。これらの条件下では、オルガノイドは最終分化を受け、それ以上維持することはできません。しかし、分化した涙腺オルガノイドは、ドライアイ疾患の状況で、潜在的にハイスループットスクリーニングで涙を誘発する薬物の開発を導くことができます。このプロトコルで提示される引き裂きアッセイは、現在、短時間でオルガノイドサイズの最大の変化を与えるものであり、これにより、薬物スクリーニングのコンテキストで定量化することが容易になります7、9、17。
幹細胞療法は、ドライアイ疾患における涙腺再生に大きな期待を寄せています21。成体幹細胞由来の涙腺オルガノイドは、そのような用途の原料となる可能性があります。ここで提示されたプロトコルは、主に嚢胞として、ヒト涙腺オルガノイド生着をもたらします。オルガノイドの生着が低いのは、オルガノイドが間違った部位に注入されているためです。染料で注入手順をトレーニングすることで、注射部位の追跡が可能になり、最終的には注入精度が向上します。あるいは、マウスの表皮を切開して、22歳より前のラットで行われたように、涙腺に直接アクセスすることができます。この方法は時間がかかりますが、より正確になる場合があります。一方、本プロトコールでは、オルガノイドはマウスの涙腺に機能的に統合されなかった。同様の結果がiPS細胞由来涙腺生着についても観察されている22。移植方法は、事前に涙腺を創傷し、ドライアイマウスモデルを使用し、および/またはオルガノイドを単一細胞または小さな塊として注入することによってさらに改善される可能性があります。それにもかかわらず、成体幹細胞由来の涙腺オルガノイドおよび関連ツールキットは、涙腺研究および再生医療における将来の応用の基礎となる可能性があります。
開示事項
Hans Cleversは、バーゼルのロシュで製薬研究開発の責任者であり、オルガノイド技術に関連するいくつかの特許を保有しています。
謝辞
プロトコルの初期開発についてYorick Postに感謝します。この研究の一部は、Cancer Research UK Grand Challenge(C6307/A29058)およびMark Foundation for Cancer ResearchからSPECIFICANCERチームへの賞によって支えられた。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL safe-lock centrifuge tubes | Eppendorf | EP0030 120.094 | |
| 3,3′-Diaminobenzidine tetrahydrochloride hydrate (DAB) | Sigma-Aldrich | D5637 | CAS: 868272-85-9 , CAUTION, 6 g/L solution can be stored aliquotted at -20 °C |
| 5x green GoTaq Flexi buffer | Promega | M891A | Store at -20 °C |
| A83-01 | Tocris | 2939 | Store at -20 °C, stock at 30 mM, 10000x |
| Advanced DMEM/F12 | Invitrogen | 12634-010 | store at 4 °C |
| Agar plates containing Ampicillin | Hubrecht Institute | ||
| Ampicillin sodium salt | Sigma-Aldrich | A9518 | |
| Autoclave VAPOUR-Line lite | VWR chemicals | ||
| B27 supplement | Invitrogen | 17504-044 | Store at -20 °C, 50x |
| BD Micro-Fine insulin needle 1 mL | BD Bioscience | 324825 | |
| Benchtop microscope DMI1 | Leica | ||
| Bovine serum albumine (BSA) | MP biomedicals | 160069 | Store at 4 °C |
| BTXpress | BTX | MDS450805 | |
| C57BL/6 mice | Hubrecht Institute | ||
| Cassettes | Klinipath | 410-02S | |
| CellBanker 1 | amsbio | 11910 | Cryopreservation medium, adhere to instructions |
| Centrifuge | Eppendorf | ||
| Citric acid monohydrate | J.T. Baker | 0088 | CAS: 5949-29-1 |
| Collagenase I | Sigma Aldrich | C9407 | Aliquots at 20 mg/mL, 20x, store at -20 °C |
| Conical tubes 15 mL | Greiner Bio-One | 5618-8271 | |
| Conical tubes 50 mL | Corning | CLS430828-500EA | |
| Coverslips 24 mm x 50 mm | Menzel-Gläzer | BB024050S1 | |
| Cultrex Basement Membrane Extract (BME), Growth Factor Reduced, Type 2 - extracellular matrix | R&D Systems, Bio-Techne | 3533-001-02 | Store at -20 °C, keep at 4 °C for up to 1 month |
| DAPT | Sigma Aldrich | D5942 | Store at -20 °C, stock at 10 mM, 1000x |
| Disodium hydrogen phosphate anhydrous | VWR chemicals | 28026.292 | CAS: 7558-79-4 |
| Di-sodiumhydrogenphosphate dihydrate | Sigma-Aldrich | 71643 | CAS:10028-24-7 |
| Dispase | ThermoFisher Scientific | 17105-041 | Aliquots at 50 U/mL, store at -20 °C until use, 400x |
| Disposable Scalpel Sterile N° 10 | Swann Morton | 3033838 | |
| DM4000 microscope | Leica | ||
| dNTPs 25 mM | Promega | U1420 | Mix all 4 nucleotides together, Store at -20 °C |
| Dpn1 | New England Biolabs | R0176 | |
| Dulbecco's Phosphate-bufferd Saline (DPBS) | Gibco | 14190144 | 1x |
| Easy strainers 70 µm | Greiner | 542170 | |
| Electroporation cuvette | Nepagene | EC002S | |
| EnVision+/HRP mouse | Agilent | K400111-2 | |
| Ethanol 100% | BOOM | 84045206;5000 | CAUTION, Use to prepare other Ethanol dilutions |
| Ethanol 70% | BOOM | 84010059.5000 | CAUTION |
| Ethanol 96% | BOOM | 84050065.5000 | CAUTION |
| EVOS FL Auto 2 Cell Imaging System | ThermoFisher Scientific | Live-imaging brightfield microscrope | |
| FGF10 | Peprotech | 100-26 | Store at -20 °C, stock at 100 mg/mL in base medium, 100x |
| Fiji | NIH, Fiji developers | ||
| Formaldehyde solution 4% | Sigma-Aldrich | 1.00496 | CAS: 50-00-0, CAUTION |
| Forskolin | Tocris | 1099 | Store at -20 °C, stock at 10 mM, 10000x |
| Glutamax | Gibco | 35050-061 | 100x |
| GoTaq G2 Flexi DNA Polymerase | Promega | M7805 | Store at -20 °C |
| Haematoxylin | VWR chemicals | 10047105 | Store at room temperature |
| HEPES | Gibco | 15630-080 | Store at 4 °C, 100x |
| Histocore H and C, Tissue embedding machine | Leica | ||
| Hot plate | Meidax | ||
| Human nucleolar antigen antibody | Abcam | ab-190710 | |
| Hydrochloric acid 5 N | ThermoFisher Scientific | 10605882 | CAS: 7647-01-0, CAUTION |
| Hydrogen peroxyde 30% | Chem-lab | CL00.2308.1000 | CAS: 7722-84-1, CAUTION |
| Hygromycin B-gold | InvivoGen | ant-hg | Stock at 100 mg/µL, 1000x |
| Hygromycin resistance cassette-containing plasmid | Andersson-Rolf et al, Nature Methods, 2017. doi: 10.1038/nmeth.4156 | ||
| IsoFlo 100% | Mecan | 5960501 | |
| LB medium | Hubrecht Institute | ||
| MgCl2 25 mM | Promega | A351H | Store at -20 °C |
| Microtome RM2235 | Leica | ||
| Midiprep DNA isolation kit | ThermoFisher Scientific | K210005 | |
| Miniprep DNA isolation kit | ThermoFisher scientific | K210003 | |
| N-acetylcysteine | Sigma Aldrich | A9165 | Store at -20 °C, stock at 500 mM, 400x |
| NEPA21 electroporator | Nepagene | ||
| Nicotinamide | Sigma Aldrich | N0636 | Store at -20 °C, stock at 1M, 100x |
| NOD Scid Gamma (NSG) mice | Hubrecht Institute colony | ||
| Noggin conditioned medium | U-Protein Express | Custom order | Store at -20 °C |
| Noradrenaline | Sigma Aldrich | A7257 | Store at -20 °C, stock at 100 mM |
| Oven | Memmert | Set at 58 °C | |
| P20, P200 and P1000 pipettes | Gilson | ||
| Paraffin | VWR chemicals | 10048502 | |
| Pasteur pipettes, glass plugged | ThermoFisher Scientific | 1150-6973 | |
| Pax6_C>T_F: AGACTGTTCCAGGATGGCTG | IDT | ||
| Pax6_C>T_R: TCTCCTAGGTACTGGAAGCC | IDT | ||
| pCMV_ABEmax_P2A_GFP | Addgene | 112101 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | Store at -20 °C |
| Pertex | Klinipath | AM-08010 | |
| pFYF1320 | Addgene | 47511 | |
| Primocin | InvivoGen | ant-pm-1 | 1000X, store at -20 °C |
| Prostaglandin E2 (PGE2) | Tocris | 2296 | Store at -20 °C, stock at 10 mM, 10000x |
| Petri dish, 10 cm | Greiner | 633102 | |
| Q5 buffer | New England Biolabs | B9027S | |
| Q5 high-fidelity DNA polymerase | New England Biolabs | M0491S | |
| QIAquick Gel Extraction Kit | Qiagen | 28704 | |
| QuickExtract DNA Extraction Solution | Lucigen | QE09050 | Store aliquots at -20 °C |
| R-spondin 3 conditioned medium | U-Protein Express | Custom order | Store at -20 °C |
| sgRNA Reverse Primer: TCTGCGCCCATCTGTTGCTT CGGTGTTTCGTCCTTTCCACAAG | IDT | ||
| Slides | StarFrost | MBB-0302-55A | Adhesive, ground |
| Sodium azide | Merck | 8.22335.1000 | CAS: 26628-22-8, CAUTION |
| Sodium cytrate dihydrate | J.T. Baker | 0280 | CAS: 6132-04-3 |
| Standard Forward Primer: “/5phos/ GTTTTAGAGCTAGAAATAGCAAG TTAAAATAAGGC | IDT | ||
| Subcloning efficiency competent cells DH5alpha | Invitrogen | 18265-017 | |
| Suspension cell culture plates (24-well) | Greiner Bio-One | 662102 | 24-well |
| Suspension cell culture plates (12-well) | Greiner Bio-One | 665102 | 12-well |
| T4 DNA ligase | New England Biolabs | M0202 | |
| TAE buffer | ThermoFisher Scientific | B49 | Stock at 50x, dilute to 1x with ultrapure water |
| Transposase-containing plasmid | Andersson-Rolf et al, Nature Methods, 2017. doi: 10.1038/nmeth.4156 | ||
| TrypLE Express Enzyme | Invitrogen | 12605-028 | store at 4 °C |
| U6_Forward primer: GGGCAGGAAGAGGGCCTAT | IDT | ||
| UltraPure Agarose 1000 | Invitrogen | 16550 | |
| Water bath | Tulabo | ||
| Xylene | Klinipath | 4055-9005 | CAS: 1330-20-7, CAUTION |
| Y-27632 | Abmole Bioscience | Y-27632 dihydrochloride | Store at -20 °C, stock at 10 mM, 1000x |
参考文献
- Garg, A., Zhang, X. Lacrimal gland development: From signaling interactions to regenerative medicine. Developmental Dynamics. 246 (12), 970-980 (2017).
- Selinger, D. S., Selinger, R. C., Reed, W. P. Resistance to infection of the external eye: The role of tears. Survey of Ophthalmology. 24 (1), 33-38 (1979).
- Messmer, E. M. The pathophysiology, diagnosis, and treatment of dry eye disease. Deutsches Arzteblatt International. 112 (5), 71-81 (2015).
- Massie, I., et al. Development of lacrimal gland spheroids for lacrimal gland tissue regeneration. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2001-2009 (2018).
- Tiwari, S., et al. Establishing human lacrimal gland cultures with secretory function. PloS One. 7 (1), 29458(2012).
- Nguyen, D. H., Beuerman, R. W., Halbert, C. L., Ma, Q., Sun, G. Characterization of immortalized rabbit lacrimal gland epithelial cells. In Vitro Cellular & Developmental Biology. Animal. 35 (4), 198-204 (1999).
- Bannier-Hélaouët, M., et al. Exploring the human lacrimal gland using organoids and single-cell sequencing. Cell Stem Cell. 28 (7), 1221-1232 (2021).
- Hayashi, R., et al. Generation of 3D lacrimal gland organoids from human pluripotent stem cells. Nature. 605 (7908), 126-131 (2022).
- Jeong, S. Y., et al. Establishment of functional epithelial organoids from human lacrimal glands. Stem Cell Research & Therapy. 12 (1), 247(2021).
- Hofer, M., Lutolf, M. P. Engineering organoids. Nature Reviews Materials. 6 (5), 402-420 (2021).
- Meyenberg, M., Ferreira da Silva, J., Loizou, J. I. Tissue specific DNA repair outcomes shape the landscape of genome editing. Frontiers in Genetics. 12, 728520(2021).
- Geurts, M. H., et al. CRISPR-based adenine editors correct nonsense mutations in a cystic fibrosis organoid biobank. Cell Stem Cell. 26 (4), 503-510 (2020).
- Overmyer, K. A., Thonusin, C., Qi, N. R., Burant, C. F., Evans, C. R. Impact of anesthesia and euthanasia on metabolomics of mammalian tissues: Studies in a C57BL/6J mouse model. PLoS One. 10 (2), 0117232(2015).
- Driehuis, E., et al. Oral mucosal organoids as a potential platform for personalized cancer therapy. Cancer Discovery. 9 (7), 852-871 (2019).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. Journal of Visualized Experiments. (6), e253(2007).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Lian, J., Meng, X., Zhang, X., Hu, H. Establishment and genetic manipulation of murine hepatocyte organoids. Journal of Visualized Experiments. (180), e62438(2022).
- Lõhmussaar, K., et al. Patient-derived organoids model cervical tissue dynamics and viral oncogenesis in cervical cancer. Cell Stem Cell. 28 (8), 1380-1396 (2021).
- Bloh, K., et al. Deconvolution of complex DNA repair (DECODR): Establishing a novel deconvolution algorithm for comprehensive analysis of CRISPR-edited Sanger sequencing data. The CRISPR Journal. 4 (1), 120-131 (2021).
- Latta, L., et al. Pathophysiology of aniridia-associated keratopathy: Developmental aspects and unanswered questions. The Ocular Surface. 22, 245-266 (2021).
- Veernala, I., et al. Lacrimal gland regeneration: The unmet challenges and promise for dry eye therapy. The Ocular Surface. 25, 129-141 (2022).
- Hayashi, R., et al. Generation of 3D lacrimal gland organoids from human pluripotent stem cells. Nature. 605 (7908), 126-131 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved