Method Article
הקמה, תחזוקה, בידול, מניפולציה גנטית והשתלה של אורגנואידים של עכבר ובלוטת הדמעות האנושית
In This Article
Summary
פרוטוקול זה מתאר כיצד להקים, לתחזק, לשנות גנטית, להבדיל, לאפיין תפקודית ולהשתיל אורגנואידים של בלוטת הדמעות שמקורם ברקמת עכבר ראשונית ורקמה אנושית.
Abstract
בלוטת הדמעות היא איבר חיוני להומאוסטזיס פני העין. על ידי ייצור החלק המימי של סרט הדמעות, הוא מגן על העין מפני לחץ התייבשות ועלבונות חיצוניים. מעט ידוע על פיזיולוגיה של בלוטת הדמעות (פתו) בגלל היעדר מודלים מתאימים במבחנה . טכנולוגיית אורגנואיד הוכיחה את עצמה כפלטפורמה ניסיונית שימושית עבור איברים מרובים. כאן, אנו חולקים פרוטוקול כדי לקבוע ולתחזק אורגנואידים של בלוטת הדמעות של עכברים ובני אדם החל מביופסיות של בלוטת הדמעות. על ידי שינוי תנאי התרבית, אנו משפרים את פונקציונליות האורגנואידים של בלוטת הדמעות. ניתן לחקור את הפונקציונליות של אורגנואידים באמצעות בדיקת "בכי", הכוללת חשיפת אורגנואידים של בלוטת הדמעות למוליכים עצביים נבחרים כדי לגרום לשחרור דמעות בלומן שלהם. אנו מסבירים כיצד לדמיין ולכמת את התופעה. כדי לחקור את תפקידם של גנים מעניינים בהומאוסטזיס של בלוטת הדמעות, אלה יכולים להיות מהונדסים גנטית. אנו מתארים ביסודיות כיצד לשנות גנטית אורגנואידים של בלוטת הדמעות באמצעות עורכי בסיס - החל מתכנון RNA מנחה ועד גנוטיפ שיבוט אורגנואידים. לבסוף, אנו מראים כיצד לחקור את פוטנציאל ההתחדשות של אורגנואידים של בלוטת הדמעות האנושית על ידי השתלה אורתוטופית בעכבר. יחד, ערכת כלים מקיפה זו מספקת משאבים לשימוש באורגנואידים של עכבר ובלוטת הדמעות האנושית כדי לחקור פיזיולוגיה של בלוטת הדמעות (פתו).
Introduction
בלוטת הדמעות היא אפיתל הבלוטות האחראי לייצור רוב השכבה המימית של סרט הדמעות1. השכבה המימית של סרט הדמעות מכילה לא רק מים כדי לשמן את פני השטח של העין, אלא גם רפרטואר גדול של רכיבים מיקרוביאליים המגנים על פני השטח של העין מפני זיהומים2. כאשר בלוטת הדמעות ניזוקה או דלקתית, מתרחשת מחלת עין יבשה, אשר גורמת לאי נוחות לחולים ויכולה בסופו של דבר להוביל לאובדן ראייה3. במהלך השנים, מערכות מודל לחקר בלוטת הדמעות, במיוחד בלוטת האדם, היו מוגבלות 4,5,6. זה תרם לפער ידע לגבי תפקוד בלוטת הדמעות בתנאים פיזיולוגיים ופתולוגיים.
לאחרונה, מודלים במבחנה פותחו כדי לחקור את בלוטת הדמעות בצלחת 7,8,9. אורגנואידים אלה של בלוטת הדמעות נגזרים מתאי גזע בוגרים הגדלים כמבנים תלת-ממדיים במטריצה חוץ-תאית בתוספת קוקטייל של גורמי גדילה המקיימים את יכולות ההתחדשות שלהם במבחנה7. היתרון של אורגנואידים שמקורם בתאי גזע בוגרים (ASC) הוא שניתן לשמור עליהם במשך זמן רב מאוד תוך שחזור תכונות רקמות בריאות. סוג זה של אורגנואיד מורכב אך ורק מתאי אפיתל, בניגוד לאורגנואידים שמקורם בתאי גזע פלוריפוטנטיים מושרים (iPSC), אשר עשויים להכיל גם תאי סטרומה, למשל. שלא כמו אורגנואידים שמקורם בתאי גזע פלוריפוטנטיים (PSC), אורגנואידים של ASC נוצרים ישירות מרקמה בוגרת ואינם דורשים שינויים גנטיים כלשהם כדי להיות מורחבים. אורגנואידים ASC מבטאים מאפיינים בוגרים10.
פרוטוקול זה מכיל ארגז כלים להפקת אורגנואידים של בלוטת הדמעות מרקמה ראשונית של עכבר ואדם. הפרוטוקול מתאר כיצד לשפר עוד יותר את הפונקציונליות של האורגנואידים על ידי נסיגה פשוטה של גורם גדילה וכיצד לעורר את האורגנואידים להפריש נוזל דמעות על ידי ביצוע בדיקת נפיחות. פרוטוקול זה כולל בנוסף שיטת טרנספקציה מבוססת אלקטרופורציה להנדסה גנטית של אורגנואידים עכבריים באמצעות עורכי בסיס הנגזרים מקריספר. שלא כמו Cas9 קונבנציונאלי, השימוש בעורכי בסיסים מאפשר שינוי של בסיסים בודדים בגנום מבלי ליצור שבר דו-גדילי11,12. לבסוף, מתוארת השתלה אורתוטופית של אורגנואידים של בלוטת הדמעות האנושית בעכברים מדוכאי חיסון וההערכה ההיסטולוגית שלאחר מכן של ההשתלה. ערכת כלים זו לאורגנואיד בלוטת הדמעות יכולה לשמש במחקר על התחדשות ותפקוד בלוטת הדמעות ולמידול מחלות גנטיות ודלקתיות.
Protocol
הניסויים בעכברים אושרו על ידי ועדת האתיקה של בעלי חיים של האקדמיה המלכותית ההולנדית לאמנויות ולמדעים (KNAW) תחת רישיון הפרויקט AVD8010020151. האורגנואידים הופקו מעודפי חומר של עכברים. ביופסיות בלוטת הדמעות האנושיות נאספו מחומר הפסולת של חולים שעברו ניתוח במרכז הרפואי האוניברסיטאי אוטרכט (UMCU) לאחר אישור הוועדה האתית הרפואית תחת פרוטוקול מספר 18-740. הפרוטוקול מכיל מספר סעיפים המתוארים באיור 1.

איור 1: סקירה כללית של הפרוטוקול. איור זה מדגיש את השלבים השונים של הפרוטוקול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
הערה: כל הרכבי המדיום והמאגר מתוארים בטבלה משלימה 1.
1. הקמת אורגנואידים מבלוטות הדמעות של העכבר והאדם
- ניתוח בלוטת הדמעות של העכבר
- הכינו את כלי הדיסקציה, כולל מספריים, מלקחיים ומשטחי דיסקציה. המתת עכבר על ידי שאיפת O 2/CO2 13.
- הניחו את העכבר המורדם על בטנו על כרית הדיסקציה, וננעצו את איבריו. יש להרטיב את השיער הממוקם בין אוזני העכבר ועל המצח באמצעות אתנול 70%.
- בעזרת מספריים דיסקציה, לעשות פתח מאחורי הגולגולת בין האוזניים. מרחיבים פתח זה מעל המצח עד לאף. עדיין באמצעות מספריים, לחתוך את העור מאחורי האוזניים כדי ליצור שני דשים.
- משכו את הדשים לכיוון האף בחוזקה עד שבלוטות הדמעות נחשפות, כפי שמוצג באיור 2A. הצמד את הדשים לכרית הנתיחה. באמצעות מספריים, לעשות חתך קטן בקרום הממוקם מעל בלוטת הדמעות כדי לחשוף לחלוטין את בלוטת הדמעות.
- באמצעות המלקחיים, למשוך את בלוטת הדמעות. צריכה להיות התנגדות מסוימת עד שצינור הדמעות הראשי נקרע. אם אתה מעדיף, לחתוך את צינור הדמעות הראשי ישירות עם מספריים.
- הניחו את בלוטת הדמעות של העכבר לתוך PBS ברמת תרבית רקמה עד לעיבוד נוסף. המשך עם עיבוד בלוטת הדמעות בתוך 2-4 שעות כדי להגביל מוות תאי. אם פעולה זו נמשכת זמן רב יותר, מקם את בלוטת הדמעות של העכבר במדיום איסוף הביופסיה (טבלה משלימה 1).
הערה: ניתן לאגד מספר בלוטות דמעות אם יש צורך במספר גדול של אורגנואידים באופן מיידי.
- איסוף ביופסיות של בלוטת הדמעות האנושית
- לפני הניתוח יש להכין 20 מ"ל אליציטוטים של מדיום איסוף ביופסיה (טבלה משלימה 1) בצינור של 50 מ"ל, ולתת זאת למנתח לפני הניתוח. מדיום זה יכול להישמר ב 4 °C (75 °F) במשך מספר חודשים.
- ביום הניתוח, תן למנתח לדגום חתיכה מבלוטת הדמעות (בדרך כלל <1 מ"מ3), ואחסן אותה במדיום איסוף הביופסיה (טבלה משלימה 1) ב 4 מעלות צלזיוס.
- לאסוף את הביופסיה כדי לעבד אותה בהקדם האפשרי. באופן אידיאלי, זה צריך להיות באותו יום בתוך 2 שעות של דגימת ביופסיה.
- גזירת אורגנואידים
- הכינו מראש את הפריטים הבאים: מטריצה חוץ-תאית מופשרת (ECM), עכבר בטמפרטורת החדר (RT) או מדיום התפשטות אנושי (טבלה משלימה 1), קולגנאז מופשר, מדיום בסיס (טבלה משלימה 1), שני אזמלים, צלחת פטרי אחת בקוטר 10 ס"מ, מסננת בגודל 70 מיקרומטר המותקנת על צינור בנפח 15 מ"ל וצלחות תלייה בנות 12 בארות שחוממו מראש בטמפרטורה של 37°C למשך 30 דקות.
- הכינו את מדיום העיכול על ידי שילוב כל המרכיבים המוצגים בטבלה משלימה 1. הרטיבו מראש את האזמלים בתווך זה כדי למנוע חתיכות רקמה להידבק אליהם.
- שלפו את רקמת העכבר או בלוטת הדמעות האנושית מהמדיום, והניחו אותה בצלחת הפטרי.
- בעזרת אזמלים שהורטבו מראש, טוחנים את הרקמה. ברגע שחתיכות הרקמה קטנות מאוד (כלומר, <0.5 מ"מ3), הניחו אותן במדיום העיכול על ידי גירודן שלהן מצלחת הפטרי עם האזמל. אם הביופסיה האנושית כבר קטנה מאוד, הניחו אותה ישירות במדיום העיכול ללא טחינה כדי למנוע אובדן רקמות.
- לדגור את חתיכות הרקמה עד 15 דקות באמבט מים 37 מעלות צלזיוס. הפוך את הצינור 15 מ"ל באופן קבוע כדי להשעות מחדש את החלקים. עקוב אחר הדיסוציאציה התאית תחת מיקרוסקופ ספסל כדי לא לעכל יתר על המידה את הרקמה.
- בינתיים, צמצמו פיפטה של פסטר על ידי הנחת קצהו בלהבה תוך כדי סיבוב, והרטיבו אותה מראש בתווך הבסיס. כדי לנתק ביעילות את הרקמה, ודא שהחור קטן מעט יותר מחתיכות הרקמה הגדולות ביותר שנותרו. כדי להקל על תהליך הדיסוציאציה, מזלפים את התערובת מעלה ומטה כל 5 דקות עם פיפטת פסטר צרה שהורטבה מראש.
- כאשר תאים בודדים רבים וגושים קטנים נראים מתחת למיקרוסקופ, עצור את הדיסוציאציה על ידי הוספת 10 מ"ל של תווך הבסיס. סובב למטה ב 400 x גרם במשך 5 דקות כדי pellet את התאים.
- הסר את supernatant, ו resuspend את הגלולה ב 10 מ"ל של מדיום הבסיס כדי לחזור על הכביסה. סנן אותו דרך מסננת של 70 מיקרומטר כדי להסיר את חתיכות הרקמה הגדולות והלא מעוכלות ואת סיבי הקולגן שנותרו, מה שימנע פילמור נאות של ECM. סובב את הפולט ב 400 x גרם במשך 5 דקות.
הערה: כדורית כדורית אדומה מציינת נוכחות של תאי דם אדומים, אשר בדרך כלל אינו מעכב גזירת אורגנואידים. עם זאת, עבור יישומים מסוימים, כגון ציטומטריית זרימה, תאי הדם האדומים צריכים להיות lysed. לשם כך, לדגור על התאים ב 5 מ"ל של חיץ דם אדום טרי ליזה ב RT במשך 5 דקות, ו pellet את התאים ב 400 x גרם במשך 5 דקות. - הסר את supernatant, ולהשהות מחדש את גלולת התא ב 100 μL של ECM קר עבור בלוטת דמעות עכבר יחיד וב 50 μL של ECM קר עבור ביופסיה אנושית. בעת השעיה מחדש, היזהר לא ליצור בועות, שכן אלה ישפיעו גם על פילמור ECM ויציבות.
- זרע עד 100 μL של תאים לכל באר של צלחת השעיה 12 באר. השתמש P200 כדי ליצור ~ 20 μL טיפות בבאר. ככל שהטיפות קטנות יותר, כך הדיפוזיה של גורמי הגדילה והחומרים המזינים דרך המטריקס טובה יותר.
- הניחו את הצלחת הפוכה באינקובטור לח בטמפרטורה של 37°C למשך 20-30 דקות כדי לאפשר ל-ECM להתמצק.
- לאחר מיצוי ה- ECM, הוסף ~ 1 מ"ל של עכבר RT או אמצעי הרחבה אנושי לכל באר של צלחת באר 12. רענן את המדיום כל 2-3 ימים עד שהאורגנואידים מגיעים לגודל של 300 מיקרומטר. לשם כך, שאפו את התווך שבבאר, והוסיפו בעדינות מדיום התפשטות בצד הבאר מבלי לגעת בטיפות ה-ECM כדי לא להפריע להן.
הערה: ניתן להוסיף פרימוצין (100 מ"ג/מ"ל; 1:1,000 מהמלאי המסחרי) עם בידוד אם מתרחש זיהום חיידקי. עם זאת, מכיוון שהוא מאט גם את צמיחת האורגנואידים, עדיף לא להוסיף אותו או להסיר אותו לאחר מעבר אחד או שניים.
2. הרחבת אורגנואידים של עכבר ובלוטת הדמעות האנושית
- לאחר ~7 ימים עבור אורגנואידים של עכברים ו~10 ימים עבור אורגנואידים אנושיים, כאשר האורגנואידים מגיעים לגודל של ~300 מיקרומטר, הסר את מדיום התרבית.
- השהה מחדש את טיפות ה-ECM המכילות את האורגנואידים ב-1 מ"ל של תמיסת טריפסין על ידי פיטום נמרץ מעלה ומטה עם P1,000 עד שהטיפות מתפרקות. מעבירים את התערובת לצינור של 15 מ"ל, ודורים עליה לזמן קצר באמבט מים של 37 מעלות צלזיוס.
- לאחר 2-3 דקות, השתמשו בפיפטת פסטר צרה ורטובה מראש כדי לזלף את מתלה האורגנואיד מעלה ומטה פי 10-15. בדוק את מצב הדיסוציאציה של האורגנואידים תחת מיקרוסקופ ספסל; יש להשיג גושים קטנים של ~20 תאים. יש לדגור זמן רב יותר באמבט המים בטמפרטורה של 37 מעלות צלזיוס, ולחזור על שלב הפיטינג עד לדיסוציאציה משביעת רצון.
הערה: שלב זה עשוי להימשך זמן רב יותר עבור אורגנואידים אנושיים מכיוון שהם רב-שכבתיים. תאים בודדים ייווצרו; זה לא משפיע על צמיחת אורגנואידים כל עוד רוב התרחיף האורגנואידי מורכב מגושים קטנים. - עצור את הדיסוציאציה על ידי הוספת 10 מ"ל של מדיום הבסיס. לאחר מכן, גלולה את התאים ב 400 x גרם במשך 5 דקות.
- לאחר הסרת הסופרנאטנט וה-ECM שעשויים לשכב על גבי האורגנואידים (שכבה שקופה, דמוית ג'לי ללא אורגנואידים), יש להשהות מחדש את התאים בנפח מתאים של ECM קר לפני הציפוי בצלחת תלייה, כפי שמצוין בשלב 1.3.10.
הערה: באופן כללי, אורגנואידים של דמעות עכבר מפוצלים ביחס של 1:5 ואורגנואידים אנושיים ביחס של 1:3. משמעות הדבר היא כי, כאשר מתחילים עם אורגנואידים הכלולים 100 μL של ECM, הם צריכים להיות resuspended ב 500 μL ו 300 μL, בהתאמה, לאחר פיצול. - דוגרים על הצלחת הפוכה באינקובטור של 37 מעלות צלזיוס עד להתמצקות ה-ECM למשך 30 דקות, ומכסים את האורגנואידים בעכבר או בתווך ההתפשטות האנושי ב-RT.
3. Cryoשימור העכבר ואורגנואידים של בלוטת הדמעות האנושית
- כדי לשמר את האורגנואידים, יש לפצל תחילה את האורגנואידים בתווך ההתפשטות בהתאם להוראות שניתנו בסעיף 2.
- כ 3-4 ימים לאחר מכן, כאשר האורגנואידים נמצאים בשלב צמיחה, להסיר את המדיום, ולהשהות מחדש 100 μL של ECM המכיל אורגנואידים ב 10 מ"ל של תווך בסיס קר. יש לדגור על קרח במשך 10 דקות כדי לסייע בניתוק ה-ECM. הפוך את הצינור באופן קבוע כדי להקל על תהליך זה.
- מטילים את האורגנואידים על 500 x גרם במשך 5 דקות. הסר את הסופרנטנט, והשהה מחדש את גלולת האורגנואיד ב -1 מ"ל של מדיום שימור קריוגני (שאריות ECM אינן פוגעות בשימור הקפאה). מעבירים את תרחיף האורגנואיד לקריביאל ומיד למקפיא בטמפרטורה של -80°C.
הערה: בעת שימוש באמצעי השימור הקריוגני המתואר בטבלת החומרים, ניתן לשמור את הקריובלים ללא הגבלת זמן במקפיא של -80°C. אם נעשה שימוש באמצעי שימור קריוגני אחר, העבירו את הקריוביאל למיכל חנקן נוזלי לאחר 24 שעות כדי להבטיח שימור אופטימלי. - כדי להפשיר את האורגנואידים, שלפו את הקריוביאל מהמקפיא, והעבירו אותו על קרח יבש לאמבט מים בטמפרטורה של 37 מעלות צלזיוס. החזיקו את הקריוויאל במים עד שרוב תכולתו מופשרת. מעבירים את התוכן לצינור של 15 מ"ל המכיל 10 מ"ל של תווך בסיס, ומסובבים את התאים במהירות של 400 x גרם למשך 5 דקות.
- לוחית את האורגנואידים ב 100 μL של ECM עם מדיום הרחבה, כמתואר בשלב 2.5 ושלב 2.6.
4. הבחנה בין אורגנואידים של בלוטת הדמעות והערכת הפונקציונליות שלהם
- התמיינות אורגנואידים
- כדי להבדיל בין אורגנואידים של בלוטת הדמעות, יש לפצל תחילה את האורגנואידים בתווך ההתפשטות בהתאם להוראות בסעיף 2.
- לאחר יומיים, החלף את מדיום ההרחבה במדיום בידול עכבר או אנושי כמתואר בשלב 1.3.12. רענן את המדיום כל 2-3 ימים כדי לשמור על אורגנואידים עכבר במשך 5 ימים באותו מדיום ואת אורגנואידים אנושיים במשך 9 ימים.
- כדי להעריך התמיינות אורגנואידים לאחר 5 ימים או 9 ימים בתווך ההתמיינות, לאסוף 100 μL של ECM המכיל אורגנואידים כדי לחלץ את RNA. לשם כך, יש להשהות מחדש את טיפות ה-ECM ב-1 מ"ל של תווך הכלול בבאר באמצעות P1,000, ולהעביר את תרחיף האורגנואיד ב-3 מ"ל של תווך בסיס קר כקרח. מטילים את האורגנואידים על 500 x גרם במשך 5 דקות.
- השליכו את הסופרנטנט, והשעו מחדש את הגלולה במאגר מיצוי RNA. בצע את מיצוי ה- RNA במורד הזרם בהתאם להוראות ערכת מיצוי ה- RNA. השתמש ב- RNA המתקבל, למשל, לניתוח RT-qPCR של ביטוי תאי גזע (TP63, KRT5, KRT14) וסמני תאים ממוינים (LCN2, WFDC2, AQP5, LTF, ACTA2...) 14.
הערה: כדי לקבל את ניתוח הביטויים הרלוונטי, מדוד את הביטוי של הסמנים שנבחרו בדגימת רקמה אחת או יותר. אורגנואידים המתורבתים בתנאי התמיינות נוטים להכיל פחות RNA.
- בדיקת נפיחות פונקציונלית
הערה: עבור חלק זה של הפרוטוקול, השתמש באורגנואידים של בלוטת הדמעות האנושית שהובחנו במשך 7 ימים לפחות. הזמן המינימלי הנדרש הוא 7 ימים כדי להבטיח ביטוי סמן מספיק לקריעה פונקציונלית. כל באר של צלחת בת 12 בארות מהווה תנאי אחד. מספר התנאים המינימלי הוא שלושה: בקרה חיובית, בקרה שלילית ותנאי בדיקה.- להכין טרי 1 מ"ל של מדיום התמיינות אנושי המכיל רכיבים בודדים המעודדים הפרשה על ידי אורגנואידים בלוטת הדמעות. לדוגמה, להוסיף 100 מיקרומטר נוראדרנלין ו 1 מיקרומטר forskolin, ולערבב היטב.
הערה: פורסקולין משמש כבקרה חיובית שבדרך כלל גורמת לנפיחות מקסימלית. - במיקרוסקופ אוטומטי של קיטועי זמן של שדה בהיר, הגדר את המיקומים לצילום בלוח, את מרווח הזמן (5 דקות) ואת משך הזמן (4 שעות). ודא כי טיפת ECM שלמה גלויה בכל מיקום.
- ממש לפני תחילת התמונה ומבלי להזיז את הצלחת מהמיקרוסקופ, הסר את מדיום התרבית מהבארות שיצולם, והחלף אותו בתווך התלוי היטב שהוכן בשלב 4.2.1. כלול כבקרה שלילית באר עם מדיום בידול מוחלף במדיום בידול בלבד, שכן רענון בינוני עלול לעורר נפיחות אורגנואידית מסוימת.
- לאחר עד 4 שעות, בדיקת הנפיחות הסתיימה. נתח את התוצאות.
הערה: שלבים אלה מבוצעים באמצעות מיקרוסקופ EVOS M7000 המאפשר הדמיה אוטומטית של הילוך מהיר בשדה בהיר. עבור מיקרוסקופ זה, עיין במדריך היצרן המפורט כדי להגדיר את ההדמיה בהילוך מהיר. יש לציין, כל מיקרוסקופ אחר עם מאפיינים דומים ניתן להשתמש. - כדי לכמת נפיחות אורגנואידים, מדדו את הקוטר של כל אורגנואיד בודד ב-0 שעות וב-4 שעות. פתח את התמונות של טיפת אורגנואיד בודדת ב- 0 שעות וב- 4 שעות ב- ImageJ.
- לחץ על סמל הקו הישר בסרגל הכלים, וצייר תחילה את קוטר האורגנואיד בשעה 0. לאחר מכן, השתמש בכלי מדידה ב- ImageJ (ניתוח > מדידה) כדי למדוד את אורך הקו הזה, ומכאן את קוטר האורגנואיד לפני הנפיחות. חזור על התהליך על אותו אורגנואיד לאחר 4 שעות כדי לקבל את קוטר האורגנואיד לאחר נפיחות.
- מדוד את קוטר האורגנואיד של ~ 20 אורגנואידים לכל מצב לפני ואחרי בדיקת הנפיחות.
- להכין טרי 1 מ"ל של מדיום התמיינות אנושי המכיל רכיבים בודדים המעודדים הפרשה על ידי אורגנואידים בלוטת הדמעות. לדוגמה, להוסיף 100 מיקרומטר נוראדרנלין ו 1 מיקרומטר forskolin, ולערבב היטב.
5. בניית פלסמיד כדי להפיל את Pax6
- תכנון gRNA לנוקאאוט Pax6 שימוש בעורכי בסיס C > T
הערה: יש הרבה תוכנות זמינות לתכנון gRNA. כאן, Benchling שימש כמו זה מאפשר עיצוב gRNA משולב, ביאור, ואת היישור של עקבות Sanger. כל השלבים הבאים יכולים, אם כן, להתבצע גם באמצעות תוכנות חלופיות.- התחל את תהליך עיצוב ה- gRNA על ידי הדמיה של גן היעד ב- Benchling על ידי לחיצה על רצף DNA חדש (+) > > ייבוא רצפי DNA.
- בכרטיסיה ייבוא ממסד נתונים, הקלד את הגן המעניין, Pax6 והקש חיפוש.
- בחר את גירסת ה- build החדשה ביותר של גנום הייחוס לעכבר GRCm38 (mm10, Mus musculus) ולחץ על ייבוא.
- בחר את האקסון שבו ניתן לעצב את gRNA ההסתרה על-ידי הקפדה על הכללים הבאים:
- הימנע מהצבת gRNA באקסון הקידוד הראשון, מכיוון שאתרי התחלה חלופיים באקסונים הבאים עשויים לשמש את התא כדי לעקוף את קודון העצירה המושרה המוקדם.
- תכנן gRNA באקסונים הנמצאים בכל התעתיקים החלופיים שיכולים להתרחש על ידי שחבור של Pax6 mRNA. כדי להבטיח זאת, הצג את Pax6 באופן חזותי בדפדפן הגנום של Ensembl , ובחר את האקסון המשמש בכל התמלילים.
- כדי לעקוף עוד יותר שחבור חלופי, התמקדו באקסון שיש לו קודון לא שלם (בסיס אחד או שניים שנותרו משלישייה). זה פחות חשוב אבל נותן יותר ודאות לגבי ההשפעות של indels מושרה. עבור Pax6, אקסון 4 עד אקסון 11 הם מטרה טובה. בנוסף, בחרו אקסון שמכיל שאריות טריפטופן (W), גלוטמין (Q) או ארגינין (R).
הערה: לעורכי בסיס סטנדרטיים C > T המשתמשים ב- SpCas9 יש חלון עריכה המשתרע מנוקלאוטיד 4 לנוקלאוטיד 8 מתחילת ה- gRNA (הרחוק ביותר מה- PAM). עורכי הבסיס C > T יכולים להציג קודוני עצירה על כל שאריות הטריפטופן (W) (TGG ל-TGA, TAG או TAA) עם gRNA על הגדיל ההפוך, על שאריות גלוטמין (Q) (CAG ל-TAG או CAA ל-TAA), ולבסוף, על שאריות ארגינין (R) (CGA ל-TGA) על הגדיל הקדמי.
- בחר את האקסון + 20 בסיסים במעלה ובמורד. לחץ בצד ימין של המסך על סימן היעד CRISPR, ולחץ על Design and Analyze guides.
- בתפריט החדש שנפתח, תחת הכרטיסייה סוג עיצוב, סמן את קווי עזר עבור "עריכת בסיס" (Komor et al., 2016). שמור על אורך המדריך על 20 נוקלאוטידים, ותחת גנום לעכבר, בחר GRCm38 (mm10, Mus musculus).
- לאחר לחיצה על הסימן הירוק + , התוכנה תזהה באופן אוטומטי את כל רצפי המוטיב הסמוך של פרוטוספייסר (PAM), ובצד ימין של המסך, תיצור רשימה של כל ה-gRNA הפוטנציאליים באזור סביב אקסון העניין.
- גלול ברשימה עד לסימן קודון העצירה (*) בתיבה אדומה, אשר מסמן עבור gRNA שיכול להפוך חומצת אמינו לקודון עצירה, ובכך לגרום לנוק-אאוט.
- בעמודה הראשונה מימין לרצף ה-gRNA, עבור כל יעד "C" סביב חלון העריכה, מחושבת יעילות העריכה החזויה בסיליקו . ודא שלעריכת C > T שתוצאתה קודון עצירה יש יעילות עריכה של לפחות ~10.
- לחץ על הערך בעמודה Off-Target כדי לבדוק לאילו אתרים מחוץ למטרה ה-gRNA יכול להיקשר. הימנעו מבחירת gRNA שנקשר לגנים נוספים כדי להגביר את הספציפיות. לדוגמה, gRNA טוב לעריכת Pax6 עם עורך בסיס C > T מכוון לאקסון 7 והוא 5'-AAGCAACAGATGGGCGCAGA-3'.
- צור ביאור בקובץ Benchling על ידי לחיצה על סמל ביאורים בפינה השמאלית העליונה של המסך, ואחריו ביאור חדש. תן שם לביאור, וודא שכיוון ה- gRNA הנכון נבחר בתפריט הנפתח Strand .
- ייצור פלסמיד gRNA
הערה: ישנם וקטורים שונים זמינים להעברת gRNA לאורגנואידים. הפלסמיד הבא שימש כבסיס לבניית gRNA: pFYF1320 (Addgene #47511, מתנה חביבה מקית' ג'ונג).- כדי לשכפל את gRNAs ב- pFYF1320, יישם אסטרטגיית PCR הפוכה תוך שימוש בפריימר הקדמי הסטנדרטי: "/5phos/ GTTTTAGAGCTAGAAATAGCAAGTTAAAATAAGGC. כדי לעצב את הפריימר ההפוך, הדבק את המשלים ההפוך של רצף המרווח gRNA (בדוק שוב את כיוון gRNA [+ או - גדיל]) לפני חלק הפריימר ההפוך האוניברסלי הבא: CGGTGTTTCGTCCTTTCCACAAG. כדי להתמקד באקסון 7 של העכבר Pax6 באמצעות עורך הבסיס C > T, הפריימר ההפוך הוא כדלקמן: TCTGCGCCCATCTGTTGCTTCGGTGTTTCGTCCTTTCCACAAG. הזמינו את שני הפריימרים.
- הפעל תגובת PCR הפוכה באמצעות 1 ng של pFYF1320 כתבנית באמצעות DNA פולימראז באיכות גבוהה במשך 35 מחזורים בטמפרטורת חישול של 61 ° C.
- הפעל את תגובת ה- PCR על ג'ל אגרוז 1% במאגר TAE ב- 100 V למשך ~ 45 דקות כדי לדמיין את הקטע הצפוי של 2,281 זוגות בסיסים (bp). בצעו ניקוי ג'ל באמצעות הערכה שבחרתם.
- הגדר את תגובת הקשירה הבאה: 100 ננוגרם של מוצר PCR מנוקה, אנזים Dpn1 להסרת הדנ"א הראשוני של תבנית pFYF1320 וליגאז T4. לדגור את התערובת במשך 15 דקות ב 20 ° C, 30 דקות ב 37 ° C, ו 20 דקות ב 80 ° C.
- הפכו את תערובת התגובה לחיידקי DH5α בעלי יכולת כימית, והפיצו את החיידקים על צלחות אגר המכילות אמפיצילין15.
- למחרת, בחרו והרחיבו שלוש מושבות נפרדות ב-3 מ"ל של מרק ליזוגני (LB) בינוני בתוספת אמפיצילין של 50 מיקרוגרם/מ"ל.
- ביום שאחרי, בצע miniprep על 1 מ"ל של כל אחת משלוש תרביות מיני באמצעות ערכת miniprep, ולאחסן את השאר ב 4 ° C. העבירו את הפלסמיד המתקבל לריצוף סנגר עם פריימר U6_Forward כדי לוודא שה-gRNA מוכנס כראוי לווקטור16.
- לאחר זיהוי מושבת חיידקים אחת עם הפלסמיד הנכון, לחסן 500 μL של מיני תרבית המתאימה ב 50 מ"ל של LB בתוספת אמפיצילין כדי להגביר את DNA פלסמיד בן לילה. בצעו הכנת midi יום לאחר השימוש בערכת midiprep. פלסמיד זה ישמש להתחשמלות בסעיף 6.
6. דור של שיבוטים של Pax6 KO
- אלקטרופורציה אורגנואידית
- התחל עם אורגנואידים עכבר שהיו מפוצלים לכל היותר 5 ימים לפני כן, כך שהם במצב שגשוג. השתמש ~ 300-400 μL של טיפות אורגנואיד לכל נוק-אאוט. כלול תנאי נוסף לבחירת בקרה שלילית שתתחשמל ללא כל פלסמיד.
- בצע שלבים 2.1-2.4 כדי לנתק את האורגנואידים, אך לנתק את האורגנואידים זמן רב יותר כך שהם תאים בודדים. השליכו את הסופרנטנט.
- להשהות מחדש את התאים ב 80 μL של מאגר electroporation.
- בצינור של 1.5 מ"ל, הכינו את הפלסמידים הבאים למקסימום של 20 מיקרוליטר: 2.5 מיקרוגרם של פלסמיד pFYF1320-gRNA, 2.8 מיקרוגרם פלסמיד המכיל טרנספוזאז, 7.2 מיקרוגרם פלסמיד המכיל טרנספוזון התנגדות להיגרומיצין, ו-7.5 מיקרוגרם pCMV_ABEmax_P2A_GFP.
הערה: פלסמיד pFYF1320-gRNA מקודד את ה-gRNA שתוכנן קודם לכן, מה שמנחה את עורך הבסיס למוקד המטרה. פלסמיד pCMV_ABEmax_P2A_GFP מקודד את עורך הבסיס, כמו גם כתב GFP, אשר ניתן להשתמש בו כדי לפקח על התאים המבטאים את עורך הבסיס לאחר electroporation. הפלסמיד המכיל טרנספוזאז מקודד את הטרנספוזון, אשר מדביק את קלטת ההתנגדות להיגרומיצין המסופקת על ידי פלסמיד המכיל טרנספוזון התנגדות היגרומיצין איפשהו באופן אקראי לתוך הגנום. תאים ששילבו קלטת זו בגנום שלהם הופכים עמידים להיגרומיצין וניתן לבחור אותם באופן חיובי על ידי תוספת של היגרומיצין. מכיוון ששילוב משותף של מספר פלסמידים סביר מאוד, עמידות להיגרומיצין מהווה ברירה פונקציונלית להעשרה עבור תאים שנערכו עבור Pax6. - מוסיפים את הפלסמידים לתאים, ומערבבים היטב על ידי פיפטינג למעלה ולמטה.
- הגדר את האלקטרופורטור עם הפרמטרים הבאים עבור דופק נקבוב (מתח: 175 V; אורך פולס: 5 ms; מרווח פולס: 50 ms; מספר פעימות: 2; שיעור ריקבון: 10%; קוטביות: +) ועבור פולס העברה (מתח: 20 V; אורך פולס: 50 ms; מרווח פעימה: 50 ms; מספר פעימות: 5; שיעור ריקבון: 40%; קוטביות: +/-).
- מניחים את התאים עם הפלסמידים בקובט אלקטרופורציה. מיד למדוד את ההתנגדות (Ω), אשר צריך להיות בין 0.30 A ו 0.55 A, electroporate מיד. ביצוע שלב זה במהירות נדרש כדי למנוע מהתאים להתיישב בתחתית הקובט ולהפחית את יעילות האלקטרופורציה.
- מעבירים את התאים לצינור של 1.5 מ"ל, ומוסיפים 400 מיקרוליטר של חיץ אלקטרופורציה בתוספת מעכב רו-קינאז. אפשר לתאים להתאושש ב- RT למשך 30 דקות.
- גלול את התאים ב 500 x גרם במשך 5 דקות, להשליך את supernatant, ואת צלחת התאים ב 200 μL של ECM. לאחר התמצקות, הוסף את מדיום הרחבת העכבר.
- אורגנואידים ציסטיים גדלים לאחר 2-3 ימים. עקוב אחר אות GFP, החושף את נוכחותו של עורך הבסיס C > T, מדי יום.
- בחירת אורגנואידים
- לאחר ~3 ימים, כאשר האורגנואידים התאוששו, הוסף 100 מיקרוגרם / מ"ל היגרומיצין למדיום הרחבת העכבר כדי לבחור אורגנואידים ששילבו את קלטת התנגדות ההיגרומיצין. קיימת סבירות גבוהה כי תאים התופסים פלסמיד אחד יספגו מספר פלסמידים. על ידי בחירה באורגנואידים עמידים להיגרומיצין, אורגנואידים ערוכים בלוקוס Pax6 מועשרים.
- כאשר כל התאים בבקרה השלילית מתים והאורגנואידים ששרדו הם ~300 מיקרומטר, בחרו את האורגנואידים העמידים להיגרומיצין.
- קטיף אורגנואידים וגנוטיפ
- הכינו קצוות P20 סטריליים ליד המיקרוסקופ וצינורות 1.5 מ"ל המכילים 100 מיקרוליטר של תמיסת טריפסין כל אחד על קרח.
- כופפו קצה P20 בעזרת מלקחיים. התבוננו בצלחת המכילה את האורגנואידים ששרדו במיקרוסקופ ספסל. כאשר אורגנואיד ששרד נמצא בפוקוס, הסירו את מכסה הצלחת. באמצעות קצה P20 כפוף ועדיין מתחת למיקרוסקופ, שואפים כל אורגנואיד ששרד בנפרד, ומניחים כל אחד מהם בצינור נפרד המכיל תמיסת טריפסין.
- בחר עד 20 שיבוטים. מספר השיבוטים שייבחרו תלוי במספר השיבוטים הנדרש לכל תכנון ניסוי וביעילות העריכה, המשתנה בהתאם לכל gRNA ולוקוס.
- לאחר שכל השיבוטים נקטפו, הניחו את צינורות 1.5 מ"ל באמבט מים של 37 מעלות צלזיוס למשך עד 5 דקות. מערבלים כל צינור באופן קבוע כדי להגביר את מהירות הדיסוציאציה, ובודקים את האורגנואידים מתחת למיקרוסקופ הספסל. כאשר האורגנואידים מנותקים לגושים קטנים ו / או תאים בודדים, עצרו את העיכול על ידי הוספת 1 מ"ל של מדיום בסיס.
- עבור כל שיבוט שנבחר, שמור ~ 400 μL לגנוטיפ בצינור נפרד של 1.5 מ"ל. סובב את ~ 600 μL שנשאר ב 500 x גרם במשך 5 דקות, להסיר את supernatant, להשעות מחדש את התאים ב 20 μL של ECM, צלחת אותם כמו טיפה אחת בבאר של צלחת 24 באר, ולהוסיף מדיום הרחבת העכבר ללא היגרומיצין.
- כדי לבצע גנוטיפ של השיבוטים, סובבו את הצינורות המכילים ~400 μL של תרחיף תאים ב 500 x גרם למשך 5 דקות, הסירו את הסופרנטנט, והשהו מחדש את התאים ב 50 μL של מאגר מיצוי DNA כדי לחלץ את הדנ"א.
- מיד לדגור על התאים כדלקמן: 6 דקות ב 60 ° C, מערבולת, ו 4 דקות ב 95 ° C. DNA זה יכול להישמר עד 7 ימים ב -20 ° C, אבל ביצוע PCR במורד הזרם מיד הוא האופטימלי ביותר.
- כדי להגביר את הלוקוס הממוקד עם הנוקלאז, בצע PCR על 2 μL של ה- DNA שחולץ באמצעות פריימרים גנוטיפ נאותים שהוזמנו מראש ופולימראז בנאמנות נמוכה. פריימרים גנוטיפ הם AGACTGTTCCAGGATGGCTG (Pax6_C>T_F) ו TCTCCTAGGTACTGGAAGCC (Pax6_C>T_R). האמפליקון צריך להתחיל בערך 100 bp מהמוקד הערוך הצפוי כדי להבטיח שהוא מרוצף ביעילות.
- הפעל את מוצר ה- PCR על ג'ל אגרוז כדי להעריך את יעילות ה- PCR, כאמור בשלב 5.2.3. כאשר מזוהה רצועה בגודל הנכון, חתכו אותה מהג'ל כדי לבצע מיצוי ג'ל DNA באמצעות ערכה.
- רצף את הדנ"א המופק מכל שיבוט אורגנואיד שנבחר בעבר באמצעות פריימרים גנוטיפיים.
- יישר את הרצפים המתקבלים לגן Pax6 ב- Benchling. פתח את רצף הגן המיובא משלב 4.1. לחץ על יישור בצד ימין ולאחר מכן על צור יישור חדש. העלה את קבצי ה- .ab1 שהתקבלו מספק הריצוף, בחר DNA כסוג נוקלאוטיד ולחץ על הבא.
- בחלון הבא, בחר Multisequence ואת תוכנית היישור אוטומטי (MAFFT) לפני לחיצה על צור יישור.
- זהה את הגנוטיפים שיש להם קודון עצירה הומוזיגוטי מוקדם (כפי שמתקבל עם עורכי בסיס) על שני האללים. שמור את שיבוטי האורגנואידים המתאימים כדי להרחיב, ושמור אותם בהקפאה לניתוח נוסף. באופן אידיאלי, יש לנתח שלושה שיבוטים אורגנואידים שונים זה לצד זה כדי לעקוף השפעות נוקלאז פוטנציאליות מחוץ למטרה.
7. השתלה אורתוטופית של אורגנואידים של בלוטת הדמעות האנושית בעכברי NSG
- הכנת אורגנואידים
- אורגנואידים של בלוטת הדמעות האנושית חייבים להיות מפוצלים ~ 3 ימים לפני יום ההשתלה, כמתואר בסעיף 2. ביום ההשתלה, ודא כי האורגנואידים נמצאים בשלב השגשוג כדי להגדיל את הסיכויים של קליטה.
- כדי לחלץ את האורגנואידים מה-ECM, הוסיפו דיספאס למדיום התרבית כדי להגיע לריכוז סופי של 0.125 U/mL. באמצעות P1,000, השהה מחדש ביסודיות את טיפות ה-ECM כדי לשבש אותן, והחזיר את הצלחת לאינקובטור של 37°C למשך 30 דקות. נפח של 100 μL של ECM מספיק כדי להזריק ~ 10 בלוטות דמעות.
- השהה מחדש את האורגנואידים ב -10 מ"ל של מדיום הבסיס כדי לשטוף את האנזים. גלולה את התאים ב 400 x גרם במשך 5 דקות.
- להשהות מחדש את התאים (~ 1,500,000) ב 50 μL של מדיום התפשטות אנושי קר בתוספת 5% ECM. מניחים את תרחיף האורגנואיד על קרח, וממשיכים מיד להשתלה.
- השתלה אורתוטופית בעכברים
- במתקן בעלי החיים, יש את תרחיף האורגנואיד ומחטי אינסולין על קרח. שאפו את תרחיף האורגנואיד במחט אינסולין קרה.
- הרגיעו עכבר NOD scid gamma (NSG) עם 3% isoflurane כדי להתחיל הרדמה. כאשר העכבר ישן, הניחו אותו במהירות על צדו כאשר בלוטת הדמעות הראשית (הממוקמת באמצע הדרך בין העין לאוזן) נגישה.
- יש להזריק 5 μL של תרחיף האורגנואידים ישירות דרך העור לתוך בלוטת הדמעות. הנפח המרבי שבלוטת דמעות עכבר יכולה להכיל הוא 5 μL.
- אפשר לעכבר להתאושש, ולפקח על העכבר כל יום כדי להעריך את נוכחותה של כל אי נוחות הקשורה להשתלה, במיוחד על העין.
- הערכת קליטה
- הקריבו את העכבר עם שאיפת O 2/CO2 לאחר עד 90 יום, תלוי אם יש להעריך קליטה לטווח קצר או ארוך13.
- נתחו את בלוטת הדמעות כמתואר בסעיף 1. תקן את זה ב 4% פורמלין במשך 24 שעות ב RT.
- מניחים את בלוטת הדמעות בקלטת. יש לייבש את בלוטת הדמעות על ידי דגירה באופן הבא: 2 שעות באתנול 70%, שעתיים באתנול 96%, שעה באתנול 100% (2x), שעתיים בקסילן, ולילה בפרפין נוזלי ב-58 מעלות צלזיוס בתנור.
- למחרת, כוונו את בלוטת הדמעות לפי העדפה בתבנית מתכתית, מלאו אותה בפרפין נוזלי ואפשרו לבלוק להתמצק על משטח קר. תהליך זה מבוצע בצורה הטובה ביותר עם מכונת הטבעה.
- כאשר גוש הפרפין מוצק, חותכים את כל הבלוק למקטעים של 4-5 מיקרומטר באמצעות מיקרוטום. שמור את כל המקטעים (בצורת סרטים) בסביבה יבשה ונטולת טיוטות. ניתן לשמור את החלקים ללא הגבלת זמן בטמפרטורת החדר.
- דגמו אחד מכל 10 מקטעים המשתרעים על פני כל הבלוק.
- הרכיבו את החלקים על שקופית באופן הבא: הניחו טיפת מים על המגלשה, הניחו את החלק למעלה, תנו לו לנוח ~ 2 דקות כדי לאפשר לו להימתח על פלטה חמה של 42 מעלות צלזיוס, והוציאו את המים בעדינות עם נייר.
- מניחים את המגלשות לייבוש למשך לילה בתנור בטמפרטורה של 58°C. ניתן לשמור את השקופיות ללא הגבלת זמן ב- RT מעבר לשלב זה.
- כדי להבדיל בין תאים אנושיים לתאי עכבר, בצע צביעת אנטיגן גרעיני אנושי על חלקים אלה. יש להחזיר לחות לחלקים על ידי ביצוע השטיפות הבאות: 3 דקות בקסילן (2x), דקה אחת ב-100% אתנול (2x), דקה אחת כל אחת ב-96% אתנול, 90% אתנול, 80% אתנול, 70% אתנול, 60% אתנול ו-25% אתנול, ולבסוף, דקה אחת במי דמי (2x).
- דגרו על המגלשות במשך 15 דקות במאגר PO (טבלה משלימה 1). שטפו את המגלשות 3x במים טהורים במיוחד.
- בצע שליפת אנטיגן מבוססת ציטראט באוטוקלאב:
- מקם את המגלשות במחזיק שקופיות חסין אוטוקלאבה בסל מלא במאגר ציטראט (טבלה משלימה 1). מניחים את הסל באוטוקלאב, ומבצעים מחזור אוטוקלאבה (לחץ: 10 PSI; טמפרטורה: 121 מעלות צלזיוס; זמן: 15 דקות).
- כאשר האוטוקלאבה מדוכאת, אחזר את הסלסלה המכילה את המגלשות, והנח אותה באמבט מים RT כדי להביא את המגלשות ל- RT.
הערה: אסטרטגיית אחזור האנטיגן תלויה בנוגדן בו נעשה שימוש. עיין בגליון הנתונים של הספק כדי לבצע את אחזור האנטיגן המתאים ביותר.
- מקם את השקופיות בצורה אופקית, בצד המקטע כלפי מעלה, על מגש דגירה. הוסף 500 μL של חיץ חוסם המכיל 1% אלבומין בסרום בקר (BSA) ב- PBS למעלה, ודגר במשך 1 שעות. הסר את מאגר החסימה.
- הכן את תמיסת הנוגדנים על ידי הוספת 1 μL של נוגדן אנטיגן גרעין אנושי ל 500 μL של חיץ חוסם לכל שקופית להיות מוכתם. הוסף את תמיסת הנוגדנים לכל שקופית. יש לדגור למשך הלילה במגש דגירה לח בטמפרטורה של 4°C.
- למחרת, שטפו את המגלשות 3x ב-PBS. דגרו על המגלשות עם נוגדן משני נגד עכבר HRP לא מדולל למשך 45 דקות. שטפו את המגלשות 3x ב-PBS.
זהירות. במכסה מנוע כימי, הכינו את חיץ DAB (טבלה משלימה 1). דגרו על המגלשות עם מאגר DAB למשך 10 דקות. יש להשליך כל חומר פסולת למיכלי פסולת נוזלית כימית אורגנית. - שטפו את המגלשות במים. דוגרים על המגלשות במשך 2 דקות בהמטוקסילין כדי להכתים את הגרעינים. שטפו את המגלשות במי ברז זורמים למשך 10 דקות.
- יש לייבש את המגלשות על ידי דגירה למשך דקה אחת כל אחת ב-50% אתנול, 60% אתנול, 70% אתנול, 80% אתנול ו-90% אתנול, דקה אחת ב-96% אתנול (2x), דקה אחת ב-100% אתנול (2x) ודקה אחת בקסילן (2x).
- סגור את המגלשות עם אמצעי הרכבה וכיסוי. לאחר ייבוש של כ-20 דקות, התבוננו בשקופיות תחת מיקרוסקופ.
תוצאות
בעקבות הדיסקציה של בלוטת הדמעות של העכבר (איור 2A), העיכול האנזימטי והמכני יצר שברי רקמות קטנים, שביניהם ניתן היה להבחין בין האסיני לתעלות (איור 2B). חתיכות הרקמה הגדולות הנותרות יערערו את יציבות ה- ECM, מה שיפחית את צמיחת האורגנואידים הראשונית. הפקת אורגנואיד בלוטת הדמעות של העכבר הייתה מוצלחת כאשר אורגנואידים ציסטיים בקוטר ~500 מיקרומטר נמצאו לאחר ~7 ימים, השלב שבו האורגנואידים היו מוכנים לפיצול (איור 2C). אפילו אם הנגזרת הכוללת של אורגנואידים מוצלחת, חלק מהאורגנואידים עשויים להתחיל לגדול לפני שיפסיקו בסופו של דבר. אורגנואידים של בלוטת הדמעות האנושית גדלו כציסטות תוך 3-4 ימים והגיעו לגודל מלא תוך 10-14 יום לאחר בידוד רקמות (איור 2D). הן עבור עכברים והן עבור בני אדם, גזירת אורגנואידים נכשלה לעתים, ללא אורגנואידים או מעטים שצמחו החוצה; זה נגרם בדרך כלל על ידי עיכול יתר של הרקמה. אורגנואידים של בלוטת הדמעות של העכבר יכולים לעבור לפחות פי 40 והאורגנואידים האנושיים לפחות פי 20. המעבר נעשה כל 7-10 ימים בממוצע, בהתאם לגידול האורגנואידים.

איור 2: התבססות אורגנואידים של עכבר ובלוטת הדמעות האנושית. (A) תצלומים של השלבים השונים של דיסקציה של בלוטת הדמעות בעכבר. החץ מצביע על בלוטת הדמעות שמתחת לקרום המגן שלה. (B) תמונות ברייטפילד של תאי בלוטת הדמעות של עכבר מיד לאחר עיכול הרקמות, עם כניסות המציגות אסינוס וצינור. (C) תמונות ברייטפילד של נגזרת אורגנואיד מוצלחת ולא מוצלחת של בלוטת הדמעות של עכבר. (D) תמונות ברייטפילד של צמיחת אורגנואידים אנושיים במשך 14 יום. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
אורגנואידים בלוטת הדמעות מכילים חלק גדול של תאי גזע כאשר הם מתורבתים בתווך ההתפשטות. כדי להגדיל את רמת הבידול שלהם, הקמנו עכבר ומדיום בידול אנושי עם תוכן מופחת של גורם גדילה. לאחר 5 ימים ו-7 ימים, בהתאמה, במדיום ההתמיינות, אורגנואידים של העכבר ובלוטת הדמעות האנושית נעשו צפופים יותר (איור 3A-B). שינוי מורפולוגי זה היה בקורלציה עם תכונות פונקציונליות מוגברות. הפעלת AMP מחזורית פורסקולין או המוליך העצבי נוראפינפרין גרמה לנפיחות אורגנואידים (כלומר, הפרשת מים אפיים) תוך פחות מ-3 שעות (איור 3C). כאשר הנפיחות נמשכה יותר מ 3-4 שעות, זה הציע כי האורגנואידים לא היו מובחנים מספיק ו / או לא ביטאו סמנים פונקציונליים, כגון קולטנים עבור נוירוטרנסמיטורים.
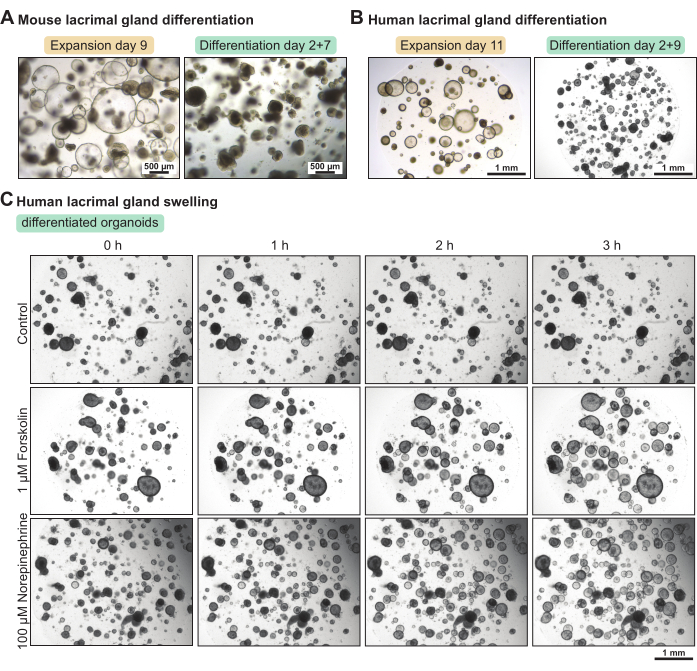
איור 3: התמיינות בין אורגנואידים של בלוטת הדמעות של עכבר ושל בני אדם ובדיקת נפיחות תפקודית באורגנואידים אנושיים. (A) תמונות ברייטפילד של אורגנואידים של בלוטת הדמעות של עכבר שגודלו בתרבית בתווך התפשטות במשך 7 ימים ובמדיום התמיינות במשך 5 ימים לאחר יומיים בתווך התפשטות. (B) תמונות שדה בהיר של אורגנואידים של בלוטת הדמעות האנושית שגודלו בתרבית בתווך התפשטות במשך 11 יום ובתווך התמיינות במשך 9 ימים לאחר יומיים בתווך התפשטות. (C) תמונות ברייטפילד של אורגנואידים מובחנים של בלוטת הדמעות האנושית שנחשפו למדיום התמיינות טרי (בקרה), ל-1 מיקרומטר פורסקולין ול-100 מיקרומטר נוראפינפרין במשך 3 שעות. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כדי לחסל את Pax6 באורגנואידים של בלוטת הדמעות של עכברים, פלסמיד שהכיל את ה-gRNA המכוון ל-Pax6 שנבחר נוצר על-ידי PCR וקשירה (איור 4A). פלסמיד זה המכיל gRNA התחשמל יחד עם פלסמידים Piggy-Bac (פלסמידים המכילים טרנספוזון התנגדות היגרומיצין ופלסמידים המכילים טרנספוזאז) ועורך הבסיס C > T Cas9 באורגנואידים של בלוטת הדמעות של עכברים שנותקו לתאים בודדים. לאחר 3 ימים, כאשר האורגנואידים החלימו, הם נחשפו להיגרומיצין כדי לבחור שיבוטים ששילבו את קלטת העמידות להיגרומיצין. באלקטרופורציות מוצלחות צמחו אורגנואידים עמידים להיגרומיצין (איור 4B). השיבוטים האורגנואידים הגדלים שהיו גדולים מ~300 מיקרומטר נקטפו, באופן אידיאלי לפני שהם התחילו להתמיין באופן ספונטני (איור 4C). DNA הופק מחלק מהאורגנואיד תוך שמירה על השאר בתרבית. הגברת ה-PCR של מוקד Pax6 שאליו מכוון ה-gRNA הניבה פס של 367 bp עבור כל אחד מהשיבוטים שנבחרו (איור 4D). לאחר ריצוף הלוקוס המוגבר, נשמרו שיבוטים שהיו הומוזיגוטיים C > T ערוכים (n = 1). מצד שני, שיבוטים שלא נערכו (n = 4), נערכו באופן הטרוזיגוטי או נערכו באופן שגוי (n = 1) הושלכו (איור 4E). בסך הכל, באמצעות gRNA זה המכוון ל-Pax6, התקבל שיבוט הומוזיגוטי אחד של בלוטת הדמעות של עכבר מתוך שישה רצפים. חלק מהשיבוטים גדלו היטב, אולם חלק משיבוטי האורגנואידים אבדו לאחר שנקטפו או החלו להתמיין (איור 4F). מתוך 10 שיבוטים אורגנואידים שנבחרו, 7 צמחו היטב.
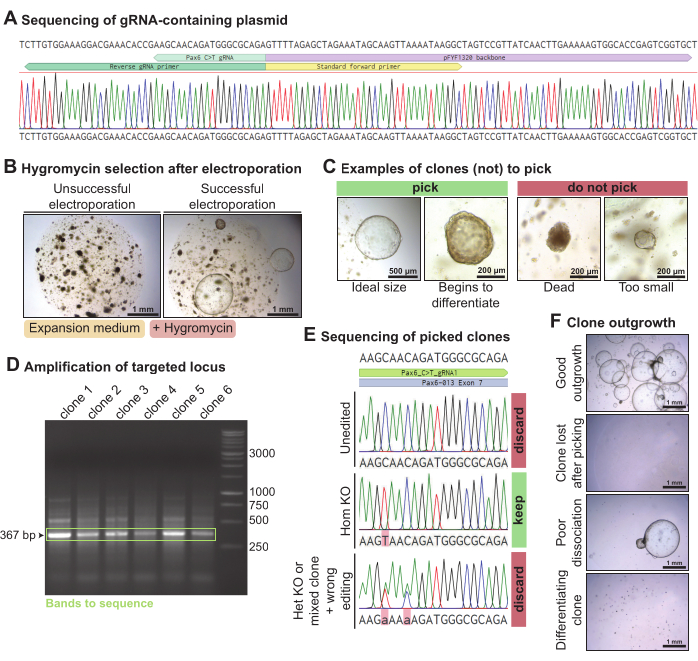
איור 4: נוק-אאוט בתיווך עריכה בסיסית של Pax6 באורגנואידים של בלוטת הדמעות של עכבר. (A) מעקב ריצוף סנגר של pFYF1320 לאחר אינטגרציה נכונה של ה-gRNA המכוון למוקד Pax6. (B) תמונות ברייטפילד של אורגנואידים של בלוטת הדמעות של עכבר 5 ימים לאחר החשיפה להיגרומיצין בעקבות אלקטרופורציה. האורגנואידים גודלו בתרבית במדיום התפשטות עכבר. משמאל דוגמה להתחשמלות כושלת, ללא שיבוט עמיד להיגרומיצין. מימין דוגמה להתחשמלות מוצלחת, עם כמה שיבוטים אורגנואידים עמידים להיגרומיצין ששרדו. (C) תמונות ברייטפילד של שיבוטים שיש לבחור ושיבוטים שאין לקטוף. (D) ג'ל אגרוז המראה את ההגברה של מוקד Pax6 הממוקד עם gRNA. בירוק, הרצועה בגודל הצפוי של 367 bp מודגשת. (E) מעקב אחר ריצוף סנגר של שלושה שיבוטים אורגנואידים שהיו עמידים להיגרומיצין. השיבוט העליון אינו ערוך. השיבוט האמצעי הוא מהדורת C > T הומוזיגוטית, ומכאן נוק-אאוט הומוזיגוטי. השיבוט התחתון מציג שתי מוטציות נקודתיות הטרוזיגוטיות והוא נוק-אאוט הטרוזיגוטי או שיבוט מעורב ונערך באופן שגוי. (F) תמונות ברייטפילד של שיבוטים אורגנואידים שנבחרו עם רמות שונות של גידול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
לבסוף, כדי לבצע השתלה אורתוטופית אורתוטופית של בלוטת הדמעות האנושית בעכברים, נעשה שימוש באורגנואידים שפוצלו 3 ימים מראש (< בקוטר 100 מיקרומטר). קליטת אורגנואידים אושרה חודש לאחר הזרקת האורגנואידים לבלוטת הדמעות של העכבר על-ידי צביעה של סמן ספציפי לאדם, האנטיגן הגרעין האנושי (איור 5). היעדר כתמי ניקוב מכל חלקי בלוטת הדמעות של העכבר סימל חוסר בקליטת אורגנואידים אנושיים.
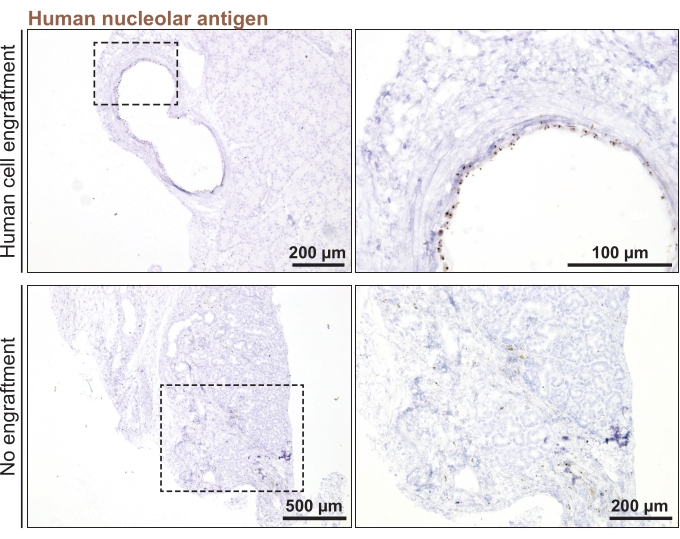
איור 5: השתלת אורגנואידים של בלוטת הדמעות האנושית בבלוטת הדמעות של העכבר. צביעה של בלוטות דמעות עכבר מושתלות עבור סמן הגרעין האנושי כדי לפקח על קליטה 1 חודש לאחר ההשתלה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה משלימה 1: הרכב המדיה והחוצצים. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
פרוטוקול זה מתאר את ההקמה והשימוש באורגנואידים של בלוטת הדמעות לבדיקות תפקודיות, מידול מוטציות והשתלות. בעת הקמת אורגנואידים של עכבר ובלוטת הדמעות האנושית, דיסוציאציה של רקמות היא קריטית. אם הרקמה אינה מתעכלת מספיק, תפוקת האורגנואידים תהיה נמוכה. אם הרקמה מתעכלת יתר על המידה, התאים ימותו ולא יגדלו כאורגנואידים. כל רקמה צריכה להיות מעוכלת עם אנזים מסוים לזמן מסוים כדי להבטיח צמיחה אופטימלית של אורגנואידים14,17,18. בלוטת הדמעות היא רקמה רכה למדי שעיכול collagenase של 5-10 דקות בשילוב עם דיסוציאציה מכנית מבוססת פיפטינג מספיק כדי לבודד חתיכות קטנות של רקמה. אם יש צורך להשיג תאים בודדים עבור יישומים כגון ריצוף RNA של תא בודד, הדיסוציאציה יכולה להתבצע למשך זמן רב יותר עד שמגיעים לשלב התא הבודד, אך יש להפסיק את הדיסוציאציה ברגע שמתקבלים תאים בודדים כדי להגביל כל ירידה בכדאיות. מכיוון שדסוציאציה של רקמות היא כה חיונית, עיכול יתר הוא הסיבה הסבירה ביותר לכישלון של הקמת אורגנואידים של בלוטת הדמעות.
תחזוקה מתאימה של אורגנואידים בלוטת הדמעות חשוב לשימוש בהם. תחזוקה לטווח ארוך היא סימן ההיכר של אורגנואידים של בלוטת הדמעות שמקורם בתאי גזע בוגרים, בהשוואה לאורגנואידים שמקורם בתאי גזע פלוריפוטנטיים מושרים 7,17. כדי להשיג תחזוקה לטווח ארוך, יש לבצע פיצול אורגנואידים קבוע ושינויים בינוניים. ללא זאת, אורגנואידים מתחילים להתמיין ולפתח פוטנציאל תאי גזע מופחת, מה שפוגע בתחזוקתם לטווח ארוך7. בשלב זה שוב, עיכול יתר עלול להרוג את תאי הגזע ולפגוע בתחזוקת האורגנואידים. לתחזוקה שוטפת, אין צורך בדיסוציאציה אורגנואידית לתאים בודדים. עם זאת, כדי ליצור קווי אורגנואיד נוק-אאוט משובטים, חיוני להתחיל עם תאים בודדים. אם לא, האורגנואידים יהיו מורכבים מפסיפס של תאים בעלי רקע גנטי שונה, מה שהופך את ניתוח ההשפעה של מוטציה אחת מוגדרת לבלתי אפשרית. כאן, אנו מתארים את השימוש בעורך בסיס C > T כדי ליצור קודוני עצירה. עורך גנום זה מסתמך על נוכחות קודונים של ארגינין, גלוטמין או טריפטופן בטווח של 12-18 בסיסים מ-NGG PAM. כאשר תנאים אלה אינם מתקיימים בתכנון gRNA,ניתן להשתמש בעורכי בסיס Cas9 או C >T קונבנציונליים עם PAMs חלופיים 7,18. עם זאת, Cas9 קונבנציונאלי מציג הפסקות דו-גדיליות הגורמות לאינדלים עם תיקון11. מכיוון ששני האללים עשויים להכיל אינדל שונה, גנוטיפ שיבוט דורש זהירות נוספת. יש לבצע דה-קונבולוציה של השינויים שהוכנסו כדי להבטיח ששני האללים יכילו אינדלים מחוץ למסגרת, ומכאן, ששיבוטי האורגנואידים ייעלמו עבור הגן הממוקד19. היתרון של עורכי בסיס C > T טמון בעובדה שניתן להשתמש בהם כדי למדל מוטציות נקודתיות שאינן בהכרח גורמות לקודוני עצירה. לדוגמה, ניתן להשתמש בהם כדי למדל מוטציות Pax6 ספציפיות שנמצאו בחולים עם אנירידיה כדי לחקור את השפעתן על הפיזיולוגיה של בלוטת הדמעות20.
בלוטת הדמעות מפרישה את החלק המימי של סרט הדמעות1. הפרשת דמעות יכולה להיות reapitulated באורגנואידים אנושיים לאחר התמיינות בתיווך נסיגה גורם גדילה עיכוב NOTCH. בתנאים אלה, אורגנואידים עוברים התמיינות סופנית ולא ניתן להמשיך ולתחזק אותם. עם זאת, אורגנואידים מובחנים של בלוטת הדמעות יכולים להנחות את הפיתוח של תרופות הגורמות לקריעה בהקשר של מחלת העין היבשה, באופן פוטנציאלי במסכים בעלי תפוקה גבוהה. בדיקת הקריעה המוצגת בפרוטוקול זה היא זו שנותנת כרגע את השינוי הגדול ביותר בגודל האורגנואידים בזמן קצר, מה שמקל על הכימות בהקשר של מסך סמים 7,9,17.
טיפול בתאי גזע טומן בחובו הבטחה גדולה להתחדשות בלוטת הדמעות במחלת העין היבשה21. אורגנואידים של בלוטת הדמעות שמקורם בתאי גזע בוגרים יכולים להיות חומר מקור ליישומים כאלה. הפרוטוקול המוצג כאן גורם לקליטת אורגנואידים של בלוטת הדמעות האנושית, בעיקר כציסטות. קליטת אורגנואידים נמוכה יכולה להיווצר עקב הזרקת אורגנואידים לאתר הלא נכון. אימון הליך ההזרקה עם צבע מאפשר מעקב אחר אתר ההזרקה, ובסופו של דבר, משפר את דיוק ההזרקה. לחלופין, ניתן לחרוט את האפידרמיס של העכבר כך שתהיה לו גישה ישירה לבלוטת הדמעות, כפי שנעשה בחולדות לפניגיל 22. שיטה זו אורכת זמן רב יותר אך עשויה להיות מדויקת יותר. מצד שני, בפרוטוקול הנוכחי, האורגנואידים לא השתלבו באופן פונקציונלי בבלוטת הדמעות של העכבר. תוצאות דומות נצפו עבור השתלת בלוטת הדמעות שמקורה ב- iPSC22. ניתן לשפר עוד יותר את שיטת ההשתלה על ידי פציעה מראש של בלוטת הדמעות, שימוש במודל עכבר עין יבשה, ו / או הזרקת האורגנואידים כתאים בודדים או גושים קטנים. עם זאת, אורגנואידים של בלוטת הדמעות שמקורם בתאי גזע בוגרים וערכת הכלים הקשורה אליהם יכולים להיות הבסיס ליישומים עתידיים במחקר בלוטת הדמעות וברפואה רגנרטיבית.
Disclosures
הנס קלברס הוא ראש מחקר פארמה ופיתוח מוקדם ברוש, בזל, ומחזיק במספר פטנטים הקשורים לטכנולוגיית אורגנואידים.
Acknowledgements
אנו מודים ליוריק פוסט על הפיתוח הראשוני של הפרוטוקול. עבודה זו נתמכה בחלקה על ידי פרס של האתגר הגדול של חקר הסרטן בבריטניה (C6307/A29058) וקרן מארק לחקר הסרטן לצוות SPECIFICANCER.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL safe-lock centrifuge tubes | Eppendorf | EP0030 120.094 | |
| 3,3′-Diaminobenzidine tetrahydrochloride hydrate (DAB) | Sigma-Aldrich | D5637 | CAS: 868272-85-9 , CAUTION, 6 g/L solution can be stored aliquotted at -20 °C |
| 5x green GoTaq Flexi buffer | Promega | M891A | Store at -20 °C |
| A83-01 | Tocris | 2939 | Store at -20 °C, stock at 30 mM, 10000x |
| Advanced DMEM/F12 | Invitrogen | 12634-010 | store at 4 °C |
| Agar plates containing Ampicillin | Hubrecht Institute | ||
| Ampicillin sodium salt | Sigma-Aldrich | A9518 | |
| Autoclave VAPOUR-Line lite | VWR chemicals | ||
| B27 supplement | Invitrogen | 17504-044 | Store at -20 °C, 50x |
| BD Micro-Fine insulin needle 1 mL | BD Bioscience | 324825 | |
| Benchtop microscope DMI1 | Leica | ||
| Bovine serum albumine (BSA) | MP biomedicals | 160069 | Store at 4 °C |
| BTXpress | BTX | MDS450805 | |
| C57BL/6 mice | Hubrecht Institute | ||
| Cassettes | Klinipath | 410-02S | |
| CellBanker 1 | amsbio | 11910 | Cryopreservation medium, adhere to instructions |
| Centrifuge | Eppendorf | ||
| Citric acid monohydrate | J.T. Baker | 0088 | CAS: 5949-29-1 |
| Collagenase I | Sigma Aldrich | C9407 | Aliquots at 20 mg/mL, 20x, store at -20 °C |
| Conical tubes 15 mL | Greiner Bio-One | 5618-8271 | |
| Conical tubes 50 mL | Corning | CLS430828-500EA | |
| Coverslips 24 mm x 50 mm | Menzel-Gläzer | BB024050S1 | |
| Cultrex Basement Membrane Extract (BME), Growth Factor Reduced, Type 2 - extracellular matrix | R&D Systems, Bio-Techne | 3533-001-02 | Store at -20 °C, keep at 4 °C for up to 1 month |
| DAPT | Sigma Aldrich | D5942 | Store at -20 °C, stock at 10 mM, 1000x |
| Disodium hydrogen phosphate anhydrous | VWR chemicals | 28026.292 | CAS: 7558-79-4 |
| Di-sodiumhydrogenphosphate dihydrate | Sigma-Aldrich | 71643 | CAS:10028-24-7 |
| Dispase | ThermoFisher Scientific | 17105-041 | Aliquots at 50 U/mL, store at -20 °C until use, 400x |
| Disposable Scalpel Sterile N° 10 | Swann Morton | 3033838 | |
| DM4000 microscope | Leica | ||
| dNTPs 25 mM | Promega | U1420 | Mix all 4 nucleotides together, Store at -20 °C |
| Dpn1 | New England Biolabs | R0176 | |
| Dulbecco's Phosphate-bufferd Saline (DPBS) | Gibco | 14190144 | 1x |
| Easy strainers 70 µm | Greiner | 542170 | |
| Electroporation cuvette | Nepagene | EC002S | |
| EnVision+/HRP mouse | Agilent | K400111-2 | |
| Ethanol 100% | BOOM | 84045206;5000 | CAUTION, Use to prepare other Ethanol dilutions |
| Ethanol 70% | BOOM | 84010059.5000 | CAUTION |
| Ethanol 96% | BOOM | 84050065.5000 | CAUTION |
| EVOS FL Auto 2 Cell Imaging System | ThermoFisher Scientific | Live-imaging brightfield microscrope | |
| FGF10 | Peprotech | 100-26 | Store at -20 °C, stock at 100 mg/mL in base medium, 100x |
| Fiji | NIH, Fiji developers | ||
| Formaldehyde solution 4% | Sigma-Aldrich | 1.00496 | CAS: 50-00-0, CAUTION |
| Forskolin | Tocris | 1099 | Store at -20 °C, stock at 10 mM, 10000x |
| Glutamax | Gibco | 35050-061 | 100x |
| GoTaq G2 Flexi DNA Polymerase | Promega | M7805 | Store at -20 °C |
| Haematoxylin | VWR chemicals | 10047105 | Store at room temperature |
| HEPES | Gibco | 15630-080 | Store at 4 °C, 100x |
| Histocore H and C, Tissue embedding machine | Leica | ||
| Hot plate | Meidax | ||
| Human nucleolar antigen antibody | Abcam | ab-190710 | |
| Hydrochloric acid 5 N | ThermoFisher Scientific | 10605882 | CAS: 7647-01-0, CAUTION |
| Hydrogen peroxyde 30% | Chem-lab | CL00.2308.1000 | CAS: 7722-84-1, CAUTION |
| Hygromycin B-gold | InvivoGen | ant-hg | Stock at 100 mg/µL, 1000x |
| Hygromycin resistance cassette-containing plasmid | Andersson-Rolf et al, Nature Methods, 2017. doi: 10.1038/nmeth.4156 | ||
| IsoFlo 100% | Mecan | 5960501 | |
| LB medium | Hubrecht Institute | ||
| MgCl2 25 mM | Promega | A351H | Store at -20 °C |
| Microtome RM2235 | Leica | ||
| Midiprep DNA isolation kit | ThermoFisher Scientific | K210005 | |
| Miniprep DNA isolation kit | ThermoFisher scientific | K210003 | |
| N-acetylcysteine | Sigma Aldrich | A9165 | Store at -20 °C, stock at 500 mM, 400x |
| NEPA21 electroporator | Nepagene | ||
| Nicotinamide | Sigma Aldrich | N0636 | Store at -20 °C, stock at 1M, 100x |
| NOD Scid Gamma (NSG) mice | Hubrecht Institute colony | ||
| Noggin conditioned medium | U-Protein Express | Custom order | Store at -20 °C |
| Noradrenaline | Sigma Aldrich | A7257 | Store at -20 °C, stock at 100 mM |
| Oven | Memmert | Set at 58 °C | |
| P20, P200 and P1000 pipettes | Gilson | ||
| Paraffin | VWR chemicals | 10048502 | |
| Pasteur pipettes, glass plugged | ThermoFisher Scientific | 1150-6973 | |
| Pax6_C>T_F: AGACTGTTCCAGGATGGCTG | IDT | ||
| Pax6_C>T_R: TCTCCTAGGTACTGGAAGCC | IDT | ||
| pCMV_ABEmax_P2A_GFP | Addgene | 112101 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | Store at -20 °C |
| Pertex | Klinipath | AM-08010 | |
| pFYF1320 | Addgene | 47511 | |
| Primocin | InvivoGen | ant-pm-1 | 1000X, store at -20 °C |
| Prostaglandin E2 (PGE2) | Tocris | 2296 | Store at -20 °C, stock at 10 mM, 10000x |
| Petri dish, 10 cm | Greiner | 633102 | |
| Q5 buffer | New England Biolabs | B9027S | |
| Q5 high-fidelity DNA polymerase | New England Biolabs | M0491S | |
| QIAquick Gel Extraction Kit | Qiagen | 28704 | |
| QuickExtract DNA Extraction Solution | Lucigen | QE09050 | Store aliquots at -20 °C |
| R-spondin 3 conditioned medium | U-Protein Express | Custom order | Store at -20 °C |
| sgRNA Reverse Primer: TCTGCGCCCATCTGTTGCTT CGGTGTTTCGTCCTTTCCACAAG | IDT | ||
| Slides | StarFrost | MBB-0302-55A | Adhesive, ground |
| Sodium azide | Merck | 8.22335.1000 | CAS: 26628-22-8, CAUTION |
| Sodium cytrate dihydrate | J.T. Baker | 0280 | CAS: 6132-04-3 |
| Standard Forward Primer: “/5phos/ GTTTTAGAGCTAGAAATAGCAAG TTAAAATAAGGC | IDT | ||
| Subcloning efficiency competent cells DH5alpha | Invitrogen | 18265-017 | |
| Suspension cell culture plates (24-well) | Greiner Bio-One | 662102 | 24-well |
| Suspension cell culture plates (12-well) | Greiner Bio-One | 665102 | 12-well |
| T4 DNA ligase | New England Biolabs | M0202 | |
| TAE buffer | ThermoFisher Scientific | B49 | Stock at 50x, dilute to 1x with ultrapure water |
| Transposase-containing plasmid | Andersson-Rolf et al, Nature Methods, 2017. doi: 10.1038/nmeth.4156 | ||
| TrypLE Express Enzyme | Invitrogen | 12605-028 | store at 4 °C |
| U6_Forward primer: GGGCAGGAAGAGGGCCTAT | IDT | ||
| UltraPure Agarose 1000 | Invitrogen | 16550 | |
| Water bath | Tulabo | ||
| Xylene | Klinipath | 4055-9005 | CAS: 1330-20-7, CAUTION |
| Y-27632 | Abmole Bioscience | Y-27632 dihydrochloride | Store at -20 °C, stock at 10 mM, 1000x |
References
- Garg, A., Zhang, X. Lacrimal gland development: From signaling interactions to regenerative medicine. Developmental Dynamics. 246 (12), 970-980 (2017).
- Selinger, D. S., Selinger, R. C., Reed, W. P. Resistance to infection of the external eye: The role of tears. Survey of Ophthalmology. 24 (1), 33-38 (1979).
- Messmer, E. M. The pathophysiology, diagnosis, and treatment of dry eye disease. Deutsches Arzteblatt International. 112 (5), 71-81 (2015).
- Massie, I., et al. Development of lacrimal gland spheroids for lacrimal gland tissue regeneration. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2001-2009 (2018).
- Tiwari, S., et al. Establishing human lacrimal gland cultures with secretory function. PloS One. 7 (1), 29458(2012).
- Nguyen, D. H., Beuerman, R. W., Halbert, C. L., Ma, Q., Sun, G. Characterization of immortalized rabbit lacrimal gland epithelial cells. In Vitro Cellular & Developmental Biology. Animal. 35 (4), 198-204 (1999).
- Bannier-Hélaouët, M., et al. Exploring the human lacrimal gland using organoids and single-cell sequencing. Cell Stem Cell. 28 (7), 1221-1232 (2021).
- Hayashi, R., et al. Generation of 3D lacrimal gland organoids from human pluripotent stem cells. Nature. 605 (7908), 126-131 (2022).
- Jeong, S. Y., et al. Establishment of functional epithelial organoids from human lacrimal glands. Stem Cell Research & Therapy. 12 (1), 247(2021).
- Hofer, M., Lutolf, M. P. Engineering organoids. Nature Reviews Materials. 6 (5), 402-420 (2021).
- Meyenberg, M., Ferreira da Silva, J., Loizou, J. I. Tissue specific DNA repair outcomes shape the landscape of genome editing. Frontiers in Genetics. 12, 728520(2021).
- Geurts, M. H., et al. CRISPR-based adenine editors correct nonsense mutations in a cystic fibrosis organoid biobank. Cell Stem Cell. 26 (4), 503-510 (2020).
- Overmyer, K. A., Thonusin, C., Qi, N. R., Burant, C. F., Evans, C. R. Impact of anesthesia and euthanasia on metabolomics of mammalian tissues: Studies in a C57BL/6J mouse model. PLoS One. 10 (2), 0117232(2015).
- Driehuis, E., et al. Oral mucosal organoids as a potential platform for personalized cancer therapy. Cancer Discovery. 9 (7), 852-871 (2019).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. Journal of Visualized Experiments. (6), e253(2007).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Lian, J., Meng, X., Zhang, X., Hu, H. Establishment and genetic manipulation of murine hepatocyte organoids. Journal of Visualized Experiments. (180), e62438(2022).
- Lõhmussaar, K., et al. Patient-derived organoids model cervical tissue dynamics and viral oncogenesis in cervical cancer. Cell Stem Cell. 28 (8), 1380-1396 (2021).
- Bloh, K., et al. Deconvolution of complex DNA repair (DECODR): Establishing a novel deconvolution algorithm for comprehensive analysis of CRISPR-edited Sanger sequencing data. The CRISPR Journal. 4 (1), 120-131 (2021).
- Latta, L., et al. Pathophysiology of aniridia-associated keratopathy: Developmental aspects and unanswered questions. The Ocular Surface. 22, 245-266 (2021).
- Veernala, I., et al. Lacrimal gland regeneration: The unmet challenges and promise for dry eye therapy. The Ocular Surface. 25, 129-141 (2022).
- Hayashi, R., et al. Generation of 3D lacrimal gland organoids from human pluripotent stem cells. Nature. 605 (7908), 126-131 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved