Method Article
마우스 및 인간 눈물샘 오가노이드의 확립, 유지, 분화, 유전자 조작 및 이식
요약
이 프로토콜은 일차 마우스 및 인간 조직에서 유래한 눈물샘 오가노이드를 확립, 유지, 유전적으로 변형, 분화, 기능적으로 특성화 및 이식하는 방법을 설명합니다.
초록
눈물샘은 안구 표면 항상성에 필수적인 기관입니다. 눈물막의 수성 부분을 생성함으로써 건조 스트레스와 외부 손상으로부터 눈을 보호합니다. 적절한 시험관 내 모델이 없기 때문에 눈물샘(병리) 생리학에 대해서는 알려진 바가 거의 없습니다. 오가노이드 기술은 여러 장기에 유용한 실험 플랫폼으로 입증되었습니다. 여기에서 우리는 눈물샘 생검에서 시작하여 마우스 및 인간 눈물샘 오가노이드를 확립하고 유지하기 위한 프로토콜을 공유합니다. 배양 조건을 수정하여 눈물샘 오가노이드 기능을 향상시킵니다. 오가노이드 기능은 눈물샘 오가노이드를 선택된 신경 전달 물질에 노출시켜 내강에서 눈물 방출을 유발하는 "울음" 분석을 통해 조사할 수 있습니다. 이 현상을 이미지화하고 정량화하는 방법을 설명합니다. 눈물샘 항상성에서 관심 유전자의 역할을 조사하기 위해 유전자 변형이 가능합니다. 우리는 가이드 RNA 설계에서 오가노이드 클론 유전형 분석에 이르기까지 기본 편집기를 사용하여 눈물샘 오가노이드를 유전적으로 변형하는 방법을 철저히 설명합니다. 마지막으로, 우리는 마우스에 동소 이식을 통해 인간 눈물샘 오가노이드의 재생 가능성을 조사하는 방법을 보여줍니다. 이 포괄적인 도구 세트는 마우스와 인간 눈물샘 오가노이드를 사용하여 눈물샘(병리) 생리학을 연구할 수 있는 리소스를 제공합니다.
서문
눈물샘은 눈물막1의 수성층의 대부분을 생성하는 선 상피이다. 눈물막의 수층에는 안구 표면을 윤활하는 물뿐만 아니라 감염으로부터 안구 표면을 보호하는 다양한 항균 성분이 포함되어 있다2. 눈물샘이 손상되거나 염증이 생기면 안구건조증이 발생하여 환자에게 불편함을 주고 결국 시력 상실로 이어질 수 있다3. 수년에 걸쳐, 눈물샘, 특히 인간의 샘을 연구하는 모델 시스템은 제한적이었다 4,5,6. 이것은 생리학적 및 병리학적 조건에서 눈물샘 기능에 관한 지식 격차에 기여했습니다.
최근에, 시험관 내 모델은 접시 7,8,9에서 눈물샘을 연구하기 위해 개발되었다. 이 눈물샘 오가노이드는 세포외 기질에서 3차원 구조로 성장한 성체 줄기 세포에서 유래하며, 시험관 내에서 재생 능력을 유지하는 성장 인자 칵테일이 보충됩니다 7. 성체줄기세포(ASC) 유래 오가노이드의 장점은 건강한 조직 특징을 재현하면서 매우 오랫동안 유지될 수 있다는 것입니다. 이러한 유형의 오가노이드는 예를 들어 기질 세포를 포함할 수 있는 유도만능줄기세포(iPSC) 유래 오가노이드와 달리 상피 세포로만 구성됩니다. 만능줄기세포(PSC) 유래 오가노이드와 달리 ASC 오가노이드는 성체 조직에서 직접 형성되며 확장하기 위해 유전자 변형이 필요하지 않습니다. ASC 오가노이드는 성인의 특성을 나타낸다10.
이 프로토콜에는 마우스 및 인간 일차 조직에서 눈물샘 오가노이드를 추출하기 위한 도구 상자가 포함되어 있습니다. 이 프로토콜은 간단한 성장 인자 회수를 통해 오가노이드의 기능을 더욱 향상시키는 방법과 팽창 분석을 수행하여 오가노이드가 누액을 분비하도록 자극하는 방법을 설명합니다. 이 프로토콜에는 CRISPR 유래 염기 편집기를 사용하여 마우스 오가노이드를 유전적으로 조작하기 위한 전기천공 기반 형질주입 방법이 추가로 포함되어 있습니다. 기존의 Cas9와 달리 염기 편집기를 사용하면 이중 가닥 절단을 생성하지 않고 게놈의 단일 염기를 수정할 수 있습니다11,12. 마지막으로, 인간 눈물샘 오가노이드를 면역결핍 마우스에 이식하고 생착에 대한 후속 조직학적 평가를 설명합니다. 이 눈물샘 오가노이드 툴킷은 눈물샘 재생 및 기능에 대한 연구와 유전 및 염증성 질환 모델링에 사용할 수 있습니다.
프로토콜
마우스 실험은 프로젝트 라이센스 AVD8010020151에 따라 네덜란드 왕립 예술 과학 아카데미 (KNAW)의 동물 윤리위원회의 승인을 받았습니다. 오가노이드는 마우스 잉여 물질에서 파생되었습니다. 인간 눈물샘 생검은 프로토콜 번호 18-740에 따라 의료 윤리 위원회의 승인을 받은 후 위트레흐트 대학 의료 센터(UMCU)에서 수술을 받는 환자의 폐기물에서 수집되었습니다. 이 프로토콜에는 그림 1에 설명된 여러 섹션이 포함되어 있습니다.

그림 1: 프로토콜 개요. 이 그림은 프로토콜의 여러 단계를 강조 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
참고: 모든 배지 및 완충액 조성은 보충 표 1에 기재되어 있다.
1. 마우스와 인간 눈물샘에서 오가노이드 확립
- 쥐의 눈물샘 해부
- 가위, 집게, 해부 패드를 포함한 해부 도구를 준비합니다. O2/CO2 흡입으로 마우스를 안락사시킨다13.
- 안락사된 마우스를 복부의 해부 패드에 놓고 팔다리를 고정합니다. 마우스 귀 사이와 이마에 위치한 머리카락을 70 % 에탄올을 사용하여 적시십시오.
- 해부 가위를 사용하여 귀 사이의 두개골 뒤에 구멍을 뚫습니다. 이 구멍을 이마 위로 코까지 확장하십시오. 여전히 가위를 사용하여 귀 뒤의 피부를 잘라 두 개의 플랩을 만듭니다.
- 그림 2A와 같이 눈물샘이 노출될 때까지 플랩을 코 쪽으로 단단히 당깁니다. 플랩을 해부 패드에 고정합니다. 가위를 사용하여 눈물샘 위에 위치한 막을 작게 절개하여 눈물샘을 완전히 노출시킵니다.
- 집게를 사용하여 눈물샘을 당깁니다. 주 눈물관이 찢어 질 때까지 약간의 저항이 있어야합니다. 원하는 경우 주 눈물관을 가위로 직접 자릅니다.
- 추가 처리가 있을 때까지 마우스 눈물샘을 조직 배양 등급 PBS에 넣습니다. 세포 사멸을 제한하기 위해 2-4 시간 내에 눈물샘 처리를 진행하십시오. 시간이 더 오래 걸리면 마우스 눈물샘을 생검 수집 배지에 넣습니다(보충 표 1).
참고: 많은 수의 오가노이드가 즉시 필요한 경우 여러 눈물샘을 풀링할 수 있습니다.
- 인간 눈물샘 생검 수집
- 수술 전에 생검 수집 배지 20mL 분취량(보충 표 1)을 50mL 튜브에 준비하여 수술 전에 외과의에게 제공합니다. 이 배지는 4°C에서 몇 달 동안 보관할 수 있습니다.
- 수술 당일에, 외과의가 눈물샘 조각(보통 <1mm3)을 샘플링하게 하고, 이를 4°C에서 생검 수집 배지(보충 표 1)에 보관한다.
- 가능한 한 빨리 처리하기 위해 생검을 수집하십시오. 이상적으로는 생검 샘플링 후 2시간 이내에 같은 날이어야 합니다.
- 오가노이드 유도
- 다음을 미리 준비한다: 해동된 세포외 기질(ECM), 실온(RT) 마우스 또는 인간 확장 배지(보충 표 1), 해동된 콜라게나제, 기본 배지(보충 표 1), 메스 2개, 10cm 페트리 접시 1개, 15mL 튜브에 장착된 70μm 스트레이너, 37°C에서 30분 동안 예열된 12웰 현탁액 플레이트.
- 보충 표 1에 제시된 모든 성분을 조합하여 소화 배지를 준비한다. 티슈 조각이 메스에 달라붙지 않도록 이 매체에 메스를 미리 적십니다.
- 배지에서 마우스 또는 인간 눈물샘 조직을 회수하여 페트리 접시에 넣습니다.
- 미리 젖은 메스를 사용하여 조직을 다듬습니다. 조직 조각이 매우 작아지면(즉, <0.5mm3) 메스로 페트리 접시에서 긁어내어 소화 배지에 넣습니다. 인간 생검이 이미 매우 작은 경우 조직 손실을 피하기 위해 다지지 않고 소화 배지에 직접 넣으십시오.
- 조직 조각을 37°C 수조에서 최대 15분 동안 배양합니다. 15mL 튜브를 정기적으로 뒤집어 조각을 다시 매달아 놓습니다. 조직이 과도하게 소화되지 않도록 탁상용 현미경으로 세포 해리를 모니터링합니다.
- 그 동안 파스퇴르 피펫의 끝을 돌리면서 화염에 넣어 좁히고 기본 매체에 미리 적십니다. 조직을 효율적으로 분리하려면 구멍이 남아 있는 가장 큰 조직 조각보다 약간 작아야 합니다. 해리 과정을 용이하게 하기 위해 미리 적신 좁아진 파스퇴르 피펫으로 5분마다 혼합물을 위아래로 피펫팅합니다.
- 현미경으로 많은 단일 세포와 작은 덩어리가 보이면 기본 배지 10mL를 추가하여 해리를 중지합니다. 400 x g 에서 5분 동안 회전시켜 세포를 펠릿화합니다.
- 상청액을 제거하고, 펠릿을 10 mL의 기본 배지에 재현탁하여 세척을 반복한다. 70μm 여과기를 통해 여과하여 소화되지 않은 큰 조직 조각과 남은 콜라겐 섬유를 제거하여 ECM의 적절한 중합을 방지합니다. 용리액을 400 x g 에서 5분 동안 회전시킵니다.
참고: 적혈구 펠릿은 일반적으로 오가노이드 유도를 방해하지 않는 적혈구의 존재를 나타냅니다. 그러나 유세포 분석과 같은 일부 응용 분야의 경우 적혈구를 용해해야 합니다. 이를 위해 RT에서 5 분 동안 신선한 적혈구 용해 완충액 5mL에 세포를 배양하고 400 x g 에서 5 분 동안 세포를 펠렛으로 만듭니다. - 상청액을 제거하고 단일 마우스 눈물샘의 경우 100μL의 차가운 ECM에, 인간 생검의 경우 50μL의 차가운 ECM에 세포 펠릿을 재현탁합니다. 재현탁할 때 기포가 생기지 않도록 주의하세요., ECM 중합 및 안정성에도 영향을 미치기 때문입니다.
- 12-웰 현탁액 플레이트의 웰 당 최대 100 μL의 세포를 시딩합니다. P200을 사용하여 웰에 ~20μL 물방울을 만듭니다. 물방울이 작을수록 매트릭스를 통한 성장 인자와 영양소의 확산이 잘됩니다.
- ECM이 응고될 수 있도록 37°C에서 20-30분 동안 가습된 인큐베이터에 플레이트를 거꾸로 놓습니다.
- ECM이 고형화되면 12웰 플레이트의 웰당 ~1mL의 RT 마우스 또는 인간 확장 배지를 추가합니다. 오가노이드가 300μm 크기에 도달할 때까지 2-3일마다 배지를 새로 고칩니다. 이를 위해 우물 안의 배지를 흡인하고 ECM 방울을 건드리지 않고 우물 측면에 팽창 매체를 부드럽게 추가하여 방해하지 않도록 합니다.
참고: 박테리아 오염이 발생하는 경우 Primocin(100mg/mL, 상업용 재고에서 1:1,000)을 분리 시 추가할 수 있습니다. 그러나 오가노이드 성장도 느려지기 때문에 한두 번의 계대 후에 추가하거나 제거하지 않는 것이 좋습니다.
2. 마우스와 인간 눈물샘 오가노이드 확장
- 마우스 오가노이드의 경우 ~7일, 인간 오가노이드의 경우 ~10일 후 오가노이드의 크기가 ~300μm에 도달하면 배양 배지를 제거합니다.
- 오가노이드가 포함된 ECM 방울을 트립신 용액 1mL에 재현탁하여 액적이 분리될 때까지 P1,000으로 위아래로 세게 피펫팅합니다. 이 혼합물을 15 mL 튜브로 옮기고, 37°C 수조에서 잠깐 배양한다.
- 2-3분 후, 좁고 미리 적신 파스퇴르 피펫을 사용하여 오가노이드 현탁액을 위아래로 10x-15x 피펫팅합니다. 탁상용 현미경으로 오가노이드의 해리 상태를 확인합니다. ~20개의 세포로 구성된 작은 덩어리를 얻어야 합니다. 37°C 수조에서 더 오래 인큐베이션하고, 해리가 만족스러울 때까지 피펫팅 단계를 반복한다.
참고: 이 단계는 인간 오가노이드가 다층이기 때문에 더 오래 걸릴 수 있습니다. 단일 세포가 생성됩니다. 이것은 대부분의 오가노이드 현탁액이 작은 덩어리로 구성되어 있는 한 오가노이드 성장에 영향을 미치지 않습니다. - 기본 배지 10mL를 추가하여 해리를 중지합니다. 그런 다음 세포를 400 x g 에서 5분 동안 펠렛화합니다.
- 오가노이드 위에 놓일 수 있는 상청액과 ECM(오가노이드가 없는 투명한 젤리 같은 층)을 제거한 후, 단계 1.3.10에 표시된 대로 현탁액 플레이트에 플레이팅하기 전에 적절한 부피의 차가운 ECM에 세포를 재현탁합니다.
참고: 일반적으로 마우스 눈물 오가노이드는 1:5 비율로, 인간 오가노이드는 1:3 비율로 분할됩니다. 즉, ECM 100μL에 포함된 오가노이드로 시작할 때 분할 후 각각 500μL 및 300μL로 재현탁해야 합니다. - ECM이 고형화될 때까지 플레이트를 37°C 인큐베이터에서 30분 동안 거꾸로 인큐베이션하고, RT에서 마우스 또는 인간 확장 배지로 오가노이드를 덮었다.
3. 마우스와 인간 눈물샘 오가노이드를 냉동 보존합니다.
- 오가노이드를 냉동보존하려면 먼저 섹션 2에 제공된 지침에 따라 확장 배지에서 오가노이드를 분할합니다.
- 약 3-4일 후 오가노이드가 성장기에 이르면 배지를 제거하고 오가노이드가 포함된 ECM 100μL를 10mL의 저온 염기 배지에 재현탁합니다. ECM을 해리하는 데 도움이 되도록 얼음에서 10분 동안 배양합니다. 이 과정을 용이하게 하기 위해 튜브를 정기적으로 뒤집습니다.
- 오가노이드를 500 x g 에서 5분 동안 펠렛화합니다. 상층액을 제거하고 오가노이드 펠릿을 1mL의 냉동보존 배지에 재현탁합니다(남은 ECM은 냉동보존을 손상시키지 않음). 오가노이드 현탁액을 극저온 상태로 옮기고 즉시 -80°C 냉동고로 옮깁니다.
참고: 재료 표에 설명된 냉동 보존 배지를 사용할 때 극저온 보존을 -80°C 냉동고에 무기한 보관할 수 있습니다. 다른 냉동 보존 매체를 사용하는 경우 최적의 보존을 위해 24시간 후에 극저온 이온을 액체 질소 탱크로 옮깁니다. - 오가노이드를 해동하려면 냉동실에서 극저온 액체를 꺼내 드라이아이스로 37°C 수조로 운반합니다. 대부분의 내용물이 해동될 때까지 냉동 혼합물을 물에 담가둡니다. 내용물을 10mL의 기본 배지가 들어 있는 15mL 튜브로 옮기고 400 x g 에서 5분 동안 세포를 회전시킵니다.
- 100 μL의 ECM에 있는 오가노이드를 단계 2.5 및 단계 2.6에 설명된 대로 팽창 배지로 플레이트합니다.
4. 눈물샘 오가노이드의 감별 및 기능 평가
- 오가노이드 분화
- 눈물샘 오가노이드를 구별하려면 먼저 섹션 2의 지침에 따라 확장 배지에서 오가노이드를 분할합니다.
- 2일 후, 1.3.12 단계에 기술된 바와 같이 확장 배지를 마우스 또는 인간 분화 배지로 교체한다. 2-3일마다 배지를 새로 고쳐 마우스 오가노이드를 그 배지에서 5일 동안 유지하고 인간 오가노이드를 9일 동안 유지한다.
- 분화 배지에서 5일 또는 9일 후 오가노이드 분화를 평가하려면 오가노이드가 포함된 ECM 100μL를 수집하여 RNA를 추출합니다. 이렇게 하려면 P1,000을 사용하여 웰에 포함된 배지 1mL에 ECM 방울을 재현탁하고 오가노이드 현탁액을 얼음처럼 차가운 기본 배지 3mL에 옮깁니다. 오가노이드를 500 x g 에서 5분 동안 펠렛화합니다.
- 상청액을 버리고 펠릿을 RNA 추출 완충액에 재현탁합니다. RNA 추출 키트의 지침에 따라 다운스트림 RNA 추출을 수행합니다. 예를 들어, 줄기세포(TP63, KRT5, KRT14) 및 분화된 세포 마커(LCN2, WFDC2, AQP5, LTF, ACTA2...)의 발현에 대한 RT-qPCR 분석에 수득한 RNA를 사용하십시오. 14입니다.
참고: 관련 발현 분석을 얻으려면 하나 또는 여러 조직 샘플에서 선택한 마커의 발현을 측정하십시오. 분화 조건에서 배양된 오가노이드는 RNA를 더 적게 함유하는 경향이 있습니다.
- 기능적 팽창 분석
참고: 프로토콜의 이 부분에서는 최소 7일 동안 분화된 인간 눈물샘 오가노이드를 사용하십시오. 기능적 찢어짐을 위한 충분한 마커 발현을 보장하기 위해 필요한 최소 시간은 7일입니다. 12-웰 플레이트의 각 웰은 하나의 조건을 구성한다. 최소 조건 수는 양성 대조군, 음성 대조군 및 테스트 조건의 세 가지입니다.- 눈물샘 오가노이드에 의한 분비를 유도하는 개별 성분이 포함된 인간 분화 배지 1mL를 새로 준비합니다. 예를 들어, 노르아드레날린 100μM과 포스콜린 1μM을 넣고 잘 섞는다.
참고: 포스콜린은 일반적으로 최대 부종을 유도하는 양성 대조군 역할을 합니다. - 자동 명시야 타임랩스 현미경에서 플레이트에서 이미지화할 위치, 시간 간격(5분) 및 지속 시간(4시간)을 설정합니다. 각 위치에서 전체 ECM 드롭릿이 보이는지 확인합니다.
- 이미징을 시작하기 직전에 현미경으로부터 플레이트를 이동시키지 않고, 이미징될 웰로부터 배양 배지를 제거하고, 이를 단계 4.2.1에서 제조된 웰-재현탁 배지로 교체한다. 배지 다과가 일부 오가노이드 부종을 유발할 수 있으므로 분화 배지로만 대체된 분화 배지가 있는 웰을 음성 대조군으로 포함합니다.
- 최대 4시간 후에 팽윤 분석이 종료됩니다. 결과를 분석합니다.
참고: 이 단계는 자동 명시야 타임랩스 이미징을 허용하는 EVOS M7000 현미경으로 수행됩니다. 해당 현미경의 경우 자세한 제조업체의 설명서를 참조하여 타임랩스 이미징을 설정하십시오. 참고로, 유사한 특성을 가진 다른 현미경을 사용할 수 있습니다. - 오가노이드 팽창을 정량화하려면 0시간 및 4시간에서 각 개별 오가노이드의 직경을 측정합니다. ImageJ에서 0시간 및 4시간에 단일 오가노이드 방울의 이미지를 엽니다.
- 도구 모음에서 직선(Straight line) 아이콘을 클릭하고 먼저 오가노이드의 지름을 0h로 그립니다. 그런 다음 ImageJ의 측정 도구(분석 > 측정)를 사용하여 이 선의 길이와 팽창 전의 오가노이드 직경을 측정합니다. 동일한 오가노이드에 대해 4시간 동안 이 과정을 반복하여 팽창 후 오가노이드 직경을 얻습니다.
- 팽창 분석 전후에 조건당 ~20 오가노이드의 오가노이드 직경을 측정합니다.
- 눈물샘 오가노이드에 의한 분비를 유도하는 개별 성분이 포함된 인간 분화 배지 1mL를 새로 준비합니다. 예를 들어, 노르아드레날린 100μM과 포스콜린 1μM을 넣고 잘 섞는다.
5. Pax6를 녹아웃시키기 위한 플라스미드 구성
- 녹아웃에 대한 gRNA 설계 Pax6 C > T 기본 편집기 사용
참고: gRNA 설계에 사용할 수 있는 소프트웨어 프로그램이 많이 있습니다. 여기서 Benchling은 통합 gRNA 설계, 주석 및 Sanger 트레이스의 정렬을 가능하게 하기 때문에 사용되었습니다. 따라서 모든 후속 단계는 대체 소프트웨어 프로그램을 사용하여 수행할 수도 있습니다.- DNA 시퀀스 가져오기(Import DNA Sequences)에서 New(+)> DNA Sequences를 클릭하여 Benchling에서 타겟 유전자를 시각화하여 gRNA 설계 프로세스를 시작합니다>
- 데이터베이스에서 가져오기 탭에서 관심 유전자 Pax6를 입력하고 검색을 누릅니다.
- 마우스 참조 게놈 GRCm38(mm10, Mus musculus)의 최신 빌드를 선택하고 가져오기를 누릅니다.
- 다음 규칙을 준수하여 knock-out gRNA를 설계할 수 있는 엑손을 선택합니다.
- 첫 번째 코딩 엑손에 gRNA를 넣는 것을 피하십시오, 후속 엑손의 대체 시작 부위는 초기 유도된 정지 코돈을 우회하기 위해 세포에 의해 사용될 수 있습니다.
- Pax6 mRNA의 스플라이싱에 의해 발생할 수 있는 모든 대체 전사체에 존재하는 엑손의 gRNA를 설계합니다. 이를 위해 Ensembl 게놈 브라우저에서 Pax6를 시각화하고 모든 전사체에 사용되는 엑손을 선택합니다.
- 대체 스플라이싱을 더 우회하려면 불완전한 코돈(삼중항의 나머지 염기 1개 또는 2개)이 있는 엑손을 표적으로 삼습니다. 이것은 덜 중요하지만 유도 된 인델의 효과에 대해 더 확실합니다. Pax6의 경우 엑손 4에서 엑손 11이 좋은 표적입니다. 또한 트립토판(W), 글루타민(Q) 또는 아르기닌(R) 잔기가 포함된 엑손을 선택하십시오.
참고: SpCas9를 사용하는 표준 C > T 염기 편집기에는 gRNA의 시작부터 뉴클레오티드 4에서 뉴클레오티드 8까지 이르는 편집 창이 있습니다(PAM에서 가장 멀리 떨어져 있음). C > T 염기 편집기는 역가닥의 gRNA와 함께 모든 트립토판(W) 잔기(TGG에서 TGA, TAG 또는 TAA)에 정지 코돈을 도입할 수 있으며, 글루타민(Q) 잔기(CAG에서 TAG 또는 CAA에서 TAA)에, 마지막으로 정방향 가닥의 아르기닌(R) 잔기(CGA에서 TGA)에 정지 코돈을 도입할 수 있습니다.
- 엑손 + 20 염기 업스트림 및 다운스트림을 선택합니다. 화면 오른쪽의 대상 기호 CRISPR을 클릭하고 가이드 설계 및 분석을 클릭합니다.
- 새로 열린 메뉴의 디자인 유형 탭에서 "기본 편집"가이드 (Komor et al., 2016)를 선택하십시오. 가이드 길이를 20 뉴클레오티드로 유지하고 마우스의 게놈 에서 GRCm38 (mm10, Mus musculus)을 선택합니다.
- 녹색 + 기호를 클릭하면 소프트웨어 프로그램이 모든 PAM(protospacer adjacent motif) 염기서열을 자동으로 감지하고 화면 오른쪽에 관심 엑손 주변 영역에 있는 모든 잠재적 gRNA 목록을 생성합니다.
- 빨간색 상자에 정지 코돈 기호(*)가 나타날 때까지 목록을 스크롤하여 잠재적으로 아미노산을 정지 코돈으로 전환하여 녹아웃을 초래할 수 있는 gRNA에 대한 신호를 보냅니다.
- gRNA 염기서열 우측의 첫 번째 열에서, 편집 창 주위의 각 타겟 "C"에 대해, 인실리코(in silico ) 예측 편집 효율이 계산된다. 정지 코돈을 초래하는 C > T 편집의 편집 효율이 최소 ~10인지 확인합니다.
- Off-Target 열의 값을 클릭하여 gRNA가 결합할 수 있는 off-target 유전자좌를 확인합니다. 특이성을 높이기 위해 추가 유전자에 결합하는 gRNA를 선택하지 마십시오. 예를 들어, C > T 염기 편집기로 Pax6을 편집하는 데 적합한 gRNA는 엑손 7을 표적으로 하며 5'-AAGCAACAGATGGGCGCAGA-3'입니다.
- 화면 오른쪽 상단의 주석 아이콘을 클릭한 다음 새 주석을 클릭하여 Benchling 파일에 주석을 만듭니다. 주석의 이름을 지정하고 Strand 드롭다운 메뉴에서 올바른 gRNA 방향이 선택되었는지 확인합니다.
- gRNA 플라스미드 생성
참고: gRNA를 오가노이드로 전달하는 데 사용할 수 있는 다양한 벡터가 있습니다. 다음 플라스미드를 gRNA 구축을 위한 염기로서 사용하였다: pFYF1320 (Addgene #47511, Keith Joung으로부터 종류 선물).- pFYF1320에서 gRNA를 클로닝하려면 표준 정방향 프라이머를 사용하여 역 PCR 전략을 구현합니다: "/5phos/ GTTTTAGAGCTAGAAATAGCAAGTTAAAATAAGGC. 역방향 프라이머를 설계하려면 gRNA 스페이서 서열의 역방향 보체(gRNA 방향[+ 또는 - 가닥]을 다시 확인)를 범용 역방향 프라이머 부분 CGGTGTTTCGTCCTTTCCACAAG 앞에 붙여넣습니다. C > T 염기 편집기를 사용하여 마우스 Pax6 의 엑손 7을 표적화하기 위해 역 프라이머는 다음과 같습니다: TCTGCGCCCATCTGTTGCTTCGGTGTTTCGTCCTTTCCACAAG. 두 프라이머를 모두 주문하십시오.
- 61°C의 어닐링 온도에서 35사이클 동안 고충실도 DNA 중합효소를 사용하여 1ng의 pFYF1320을 주형으로 사용하여 역 PCR 반응을 실행합니다.
- TAE 완충액의 1% 아가로스 겔에서 100V에서 ~45분 동안 PCR 반응을 실행하여 2,281 염기쌍(bp)의 예상 단편을 시각화합니다. 선택한 키트를 사용하여 젤 청소를 수행합니다.
- 다음 결찰 반응을 설정합니다: 100ng의 세척된 PCR 산물, 초기 pFYF1320 주형 DNA를 제거하기 위한 Dpn1 효소 및 T4 리가아제. 혼합물을 20°C에서 15분, 37°C에서 30분, 및 80°C에서 20분 동안 인큐베이션한다.
- 반응 혼합물을 화학적으로 유능한 DH5α 박테리아로 변환하고 암피실린15가 포함된 한천 플레이트에 박테리아를 퍼뜨립니다.
- 다음날, 50μg/mL 암피실린이 보충된 3mL의 용원성 액체(LB) 배지에서 3개의 개별 콜로니를 선택하고 확장합니다.
- 그 다음날, 미니프렙 키트를 사용하여 3개의 미니배양물 각각에 대해 1 mL의 미니프렙을 수행하고, 나머지는 4°C에서 보관하였다. 수득한 플라스미드를 U6_Forward 프라이머로 Sanger하여 gRNA가 벡터16에 정확하게 삽입되었는지 확인한다.
- 올바른 플라스미드로 단일 박테리아 콜로니를 확인한 후 암피실린이 보충된 LB 50mL에 해당 미니 배양액 500μL를 접종하여 플라스미드 DNA를 밤새 증폭합니다. midiprep 키트를 사용한 다음 날 midi-prep을 수행하십시오. 이 플라스미드는 섹션 6의 전기천공에 사용됩니다.
6. Pax6 KO 클론 생성
- 오가노이드 전기천공법
- 최대 5일 전에 분할된 마우스 오가노이드로 시작하여 증식 상태가 됩니다. 녹아웃당 ~300-400 μL의 오가노이드 방울을 사용하십시오. 플라스미드 없이 전기천공될 음성 대조군을 선택하기 위한 추가 조건을 포함합니다.
- 2.1-2.4단계를 수행하여 오가노이드를 해리하되 오가노이드를 더 오래 해리하여 단일 세포가 되도록 합니다. 상청액을 버리십시오.
- 80 μL의 전기천공 완충액에 세포를 재현탁합니다.
- 1.5 mL 튜브에서 최대 20 μL의 플라스미드를 준비합니다: 2.5 μg의 pFYF1320-gRNA 플라스미드, 2.8 μg의 트랜스포사제-함유 플라스미드, 7.2 μg의 하이그로마이신-내성 트랜스포존-함유 플라스미드, 및 7.5 μg의 pCMV_ABEmax_P2A_GFP.
참고: pFYF1320-gRNA 플라스미드는 이전에 설계된 gRNA를 암호화하여 염기 편집기를 표적 유전자좌로 안내합니다. pCMV_ABEmax_P2A_GFP 플라스미드는 염기 편집기와 GFP 리포터를 인코딩하며, 이는 전기천공 후 염기 편집기를 발현하는 세포를 모니터링하는 데 사용할 수 있습니다. 트랜스포사제-함유 플라스미드는 트랜스포사제를 암호화하고, 이는 하이그로마이신 내성 트랜스포존-함유 플라스미드에 의해 제공된 하이그로마이신-내성 카세트를 게놈 내로 무작위로 페이스트한다. 이 카세트를 게놈에 통합한 세포는 하이그로마이신에 내성을 갖게 되며 하이그로마이신을 첨가하여 양성으로 선택할 수 있습니다. 여러 플라스미드의 공동 혼입 가능성이 매우 높기 때문에 하이그로마이신 내성은 Pax6에 대해 편집된 세포를 풍부하게 하기 위한 기능적 선택을 구성합니다. - 플라스미드를 세포에 넣고 위아래로 피펫팅하여 잘 섞습니다.
- 포링 펄스(전압: 175V, 펄스 길이: 5ms, 펄스 간격: 50ms, 펄스 수: 2, 감쇠율: 10%, 극성: +) 및 전송 펄스(전압: 20V, 펄스 길이: 50ms, 펄스 간격: 50ms, 펄스 수: 5, 감쇠율: 40%, 극성: +/-).
- 플라스미드가 있는 세포를 전기천공 큐벳에 넣습니다. 0.30A에서 0.55A 사이여야 하는 저항(Ω)을 즉시 측정하고 즉시 전기를 주입합니다. 이 단계를 신속하게 수행하는 것은 셀이 큐벳의 바닥에 침전되어 전기천공 효율을 감소시키는 것을 방지하기 위해 필요합니다.
- 세포를 1.5mL 튜브로 옮기고 Rho-kinase 억제제가 보충된 400μL의 전기천공 완충액을 추가합니다. 세포가 RT에서 30분 동안 회복되도록 합니다.
- 세포를 500 x g 에서 5분 동안 펠렛화하고, 상층액을 버리고, 200 μL의 ECM에 세포를 플레이트한다. 응고 후 마우스 확장 매체를 추가합니다.
- 낭성 오가노이드는 2-3일 후에 자랍니다. 매일 C > T 베이스 편집기의 존재를 나타내는 GFP 신호를 모니터링합니다.
- 오가노이드 선택
- ~3일 후 오가노이드가 회복되면 마우스 확장 배지에 100μg/mL 하이그로마이신을 추가하여 하이그로마이신 내성 카세트가 통합된 오가노이드를 선택합니다. 하나의 플라스미드를 차지하는 세포가 여러 플라스미드를 차지할 가능성이 높습니다. 하이그로마이신 내성 오가노이드를 선택함으로써 Pax6 유전자좌에서 편집된 오가노이드가 풍부해집니다.
- 음성 대조군의 모든 세포가 죽고 살아남은 오가노이드가 ~300μm일 때 하이그로마이신 내성 오가노이드를 선택합니다.
- 오가노이드 선별 및 유전형 분석
- 현미경 옆에 멸균 P20 팁과 얼음 위에 각각 100μL의 트립신 용액이 들어 있는 1.5mL 튜브를 준비합니다.
- 집게로 P20 팁을 구부립니다. 벤치탑 현미경으로 살아남은 오가노이드가 들어 있는 플레이트를 관찰합니다. 살아남은 오가노이드에 초점이 맞춰지면 플레이트의 뚜껑을 제거합니다. 구부러진 P20 팁을 사용하여 현미경으로 생존한 각 오가노이드를 개별적으로 흡인하고 트립신 용액이 들어 있는 별도의 튜브에 각각을 넣습니다.
- 최대 20개의 클론을 선택할 수 있습니다. 선택할 클론의 수는 각 실험 설계에 필요한 클론의 수와 각 gRNA 및 유전자좌에 따라 달라지는 편집 효율성에 따라 달라집니다.
- 모든 클론이 선택되면 1.5mL 튜브를 37°C 수조에 최대 5분 동안 넣습니다. 해리 속도를 높이기 위해 각 튜브를 정기적으로 소용돌이하고 탁상용 현미경으로 오가노이드를 확인합니다. 오가노이드가 작은 덩어리 및/또는 단일 세포로 해리되면 기본 배지 1mL를 추가하여 분해를 중지합니다.
- 선택된 각 클론에 대해 별도의 1.5mL 튜브에 유전자형을 위해 ~400μL를 보관합니다. 500 x g 에서 5분 동안 방치된 ~600 μL를 회전시키고, 상층액을 제거하고, ECM 20 μL에 세포를 재현탁하고, 24-웰 플레이트의 웰에 단일 방울로 플레이트하고, 하이그로마이신 없이 마우스 확장 배지를 추가합니다.
- 클론을 유전자형화하기 위해 500 x g 에서 ~400 μL의 세포 현탁액이 들어 있는 튜브를 5분 동안 회전시키고, 상층액을 제거하고, 50 μL의 DNA 추출 완충액에 세포를 재현탁하여 DNA를 추출합니다.
- 즉시 다음과 같이 세포를 배양한다: 60°C에서 6분, 와동, 및 95°C에서 4분. 이 DNA는 -20°C에서 최대 7일 동안 보관할 수 있지만 다운스트림 PCR을 즉시 수행하는 것이 가장 적합합니다.
- 뉴클레아제로 표적화된 유전자좌를 증폭하려면 미리 주문한 적절한 유전형 분석 프라이머와 저충실도 중합효소를 사용하여 추출된 DNA 2μL에 대해 PCR을 수행합니다. 유전자형 분석 프라이머는 AGACTGTTCCAGGATGGCTG (Pax6_C>T_F) 및 TCTCCTAGGTACTGGAAGCC (Pax6_C>T_R)입니다. 앰플리콘은 효율적으로 시퀀싱되도록 예상되는 편집된 유전자좌에서 약 100bp에서 시작해야 합니다.
- PCR 생성물을 아가로스 겔 상에서 실행하여, 단계 5.2.3에서 언급한 바와 같이 PCR 효율을 평가한다. 정확한 크기의 밴드가 검출되면 이를 겔에서 잘라내어 키트를 이용하여 DNA 겔 추출을 수행한다.
- 유전자형 분석 프라이머로 이전에 선택한 각 오가노이드 클론에서 추출된 DNA를 시퀀싱합니다.
- 얻은 서열을 Benchling의 Pax6 유전자에 맞춥니다. 4.1단계에서 가져온 유전자 염기서열을 엽니다. 오른쪽의 Alignments (정렬)를 클릭한 다음 Create new alignment(새 정렬 만들기)를 클릭합니다. 염기서열 분석 제공자로부터 얻은 .ab1 파일을 업로드하고 DNA 를 뉴클레오티드 유형으로 선택한 후 다음을 누릅니다.
- 다음 창에서 멀티시퀀스(Multisequence )와 정렬 프로그램 자동(MAFFT) 을 선택한 후 정렬 생성(Create alignment)을 클릭합니다.
- 두 대립 유전자에 동형 접합 조기 정지 코돈 (기본 편집자로 얻은 바와 같이)을 갖는 유전자형을 확인하십시오. 해당 오가노이드 클론이 확장되도록 유지하고 추가 분석을 위해 이를 냉동 보존합니다. 이상적으로는 잠재적인 뉴클레아제 off-target 효과를 피하기 위해 세 가지 서로 다른 오가노이드 클론을 나란히 분석해야 합니다.
7. NSG 마우스에서 인간 눈물샘 오가노이드의 동소 이식
- 오가노이드 준비
- 인간 눈물샘 오가노이드는 섹션 3에 설명된 대로 이식일 ~2일 전에 분할해야 합니다. 이식 당일에는 오가노이드가 증식 단계에 있는지 확인하여 생착 가능성을 높입니다.
- ECM에서 오가노이드를 추출하려면 배양 배지에 디파아제를 첨가하여 최종 농도가 0.125U/mL가 되도록 합니다. P1,000을 사용하여 ECM 액적을 완전히 재현탁하여 파쇄하고 플레이트를 다시 37°C 인큐베이터에 30분 동안 놓습니다. 100μL의 ECM은 ~10개의 눈물샘을 주입하기에 충분합니다.
- 오가노이드를 10mL의 기본 배지에 재현탁하여 효소를 씻어냅니다. 세포를 400 x g 에서 5분 동안 펠렛화합니다.
- 세포(~1,500,000)를 5% ECM이 보충된 50μL의 차가운 인간 확장 배지에 재현탁합니다. 오가노이드 현탁액을 얼음 위에 놓고 즉시 이식을 진행합니다.
- 생쥐의 동소 이식
- 동물 시설에서는 오가노이드 현탁액과 인슐린 바늘을 얼음 위에 올려 놓습니다. 차가운 인슐린 바늘에 오가노이드 현탁액을 흡인합니다.
- NOD scid 감마(NSG) 면역결핍 마우스를 3% 이소플루란으로 진정시켜 마취를 시작합니다. 마우스가 잠 들어있을 때 주요 눈물샘 (눈과 귀 사이의 중간에 위치)에 접근 할 수 있도록 빠르게 옆으로 눕습니다.
- 오가노이드 현탁액 5μL를 피부를 통해 직접 눈물샘에 주입합니다. 쥐 눈물샘이 포함할 수 있는 최대 부피는 5μL입니다.
- 마우스가 회복되도록 하고 매일 마우스를 모니터링하여 이식과 관련된 불편함, 특히 눈의 존재를 평가합니다.
- 생착 평가
- 단기 또는 장기 생착을 평가해야 하는지 여부에 따라 최대 90일 후에 O 2/CO2 흡입으로 마우스를 희생시킨다13.
- 섹션 1에 설명된 대로 눈물샘을 해부합니다. RT에서 24 시간 동안 4 % 포르말린으로 고정하십시오.
- 눈물샘을 카세트에 넣습니다. 눈물샘을 70% 에탄올에서 2시간, 96% 에탄올에서 2시간, 100% 에탄올(2x)에서 1시간, 자일렌에서 2시간, 오븐에서 58°C의 액체 파라핀에서 밤새 배양하여 탈수합니다.
- 다음날, 금속 주형에서 원하는대로 눈물샘의 방향을 정하고 액체 파라핀으로 채우고 블록이 차가운 표면에서 굳을 수 있도록합니다. 이 프로세스는 임베딩 머신을 사용하는 것이 가장 좋습니다.
- 파라핀 블록이 고체이면 마이크로톰을 사용하여 전체 블록을 4-5μm 섹션으로 자릅니다. 모든 섹션(리본 모양)을 건조하고 통풍이 없는 환경에 보관하십시오. 섹션은 실온에서 무기한 보관할 수 있습니다.
- 전체 블록에 걸쳐 있는 10개 섹션 중 하나를 샘플링합니다.
- 다음과 같이 슬라이드에 섹션을 장착합니다: 슬라이드에 물 한 방울을 떨어뜨리고 섹션을 맨 위에 놓고 2°C 핫 플레이트에서 늘어나도록 ~42분 동안 그대로 둔 다음 종이로 물을 부드럽게 제거합니다.
- 슬라이드를 58°C 오븐에서 밤새 건조시킵니다. 슬라이드는 이 단계를 지나 RT에서 무기한 보관할 수 있습니다.
- 인간 세포와 마우스 세포를 구별하기 위해 이 섹션에서 인간 핵 항원 염색을 수행합니다. 자일렌(2x)에서 3분, 100% 에탄올(2x)에서 1분, 96% 에탄올, 90% 에탄올, 80% 에탄올, 70% 에탄올, 60% 에탄올 및 25% 에탄올에서 각각 1분, 마지막으로 데미물(2x)에서 1분.
- 슬라이드를 PO 완충액에서 15분 동안 인큐베이션한다(보충 표 1). 초순수로 슬라이드를 3번 세척합니다.
- 오토클레이브에서 구연산염 기반 항원 검색을 수행합니다.
- 슬라이드를 구연산염 완충액으로 채워진 바구니의 오토클레이브 방지 슬라이드 홀더에 넣습니다(보충 표 1). 바스켓을 오토클레이브에 넣고 오토클레이브 사이클(압력: 10PSI, 온도: 121°C, 시간: 15분)을 실행합니다.
- 오토클레이브가 감압되면 슬라이드가 들어 있는 바구니를 회수하고 RT 수조에 넣어 슬라이드를 RT로 가져옵니다.
참고: 항원 검색 전략은 사용된 항체에 따라 다릅니다. 공급자의 데이터시트를 참조하여 가장 적절한 항원 검색을 수행합니다.
- 슬라이드를 단면이 위로 향하게 하여 배양 트레이에 수평으로 놓습니다. PBS에 1% 소혈청알부민(BSA)을 함유한 블로킹 완충액 500μL를 위에 추가하고 1시간 동안 배양합니다. 차단 버퍼를 제거합니다.
- 염색하고자 하는 슬라이드 당 500 μL의 블로킹 완충액에 1 μL의 인간 뉴클레오라 항원-항체를 첨가하여 항체 용액을 준비한다. 각 슬라이드에 항체 용액을 추가합니다. 4°C의 가습된 배양 트레이에서 밤새 배양합니다.
- 다음날, 슬라이드를 PBS로 3배 세척한다. 희석되지 않은 HRP 항-마우스 2차 항체와 함께 슬라이드를 45분 동안 배양합니다. 슬라이드를 PBS에서 3배 세척한다.
주의. 케미컬 후드에서 DAB 버퍼를 준비합니다(보충 표 1). 슬라이드를 DAB 버퍼로 10분 동안 배양합니다. 유기 약액 폐기물 용기에 있는 모든 폐기물을 폐기하십시오. - 슬라이드를 물로 씻으십시오. 헤마톡실린에서 2분 동안 슬라이드를 배양하여 핵을 대조합니다. 흐르는 수돗물에 슬라이드를 10분 동안 씻습니다.
- 슬라이드를 50% 에탄올, 60% 에탄올, 70% 에탄올, 80% 에탄올, 90% 에탄올에서 각각 1분, 96% 에탄올(2x)에서 1분, 100% 에탄올(2x)에서 1분, 자일렌(2x)에서 1분 동안 배양하여 탈수합니다.
- 슬라이드를 장착 매체와 커버슬립으로 둘러쌉니다. 약 20분 동안 건조시킨 후 현미경으로 슬라이드를 관찰합니다.
결과
마우스 눈물샘을 해부한 후(그림 2A), 효소 및 기계적 소화는 작은 조직 조각을 생성했으며, 그 중 아시니와 덕트를 구별할 수 있었습니다(그림 2B). 나머지 큰 조직 조각은 ECM을 불안정하게 만들어 초기 오가노이드 성장을 감소시킵니다. 마우스 눈물샘 오가노이드 유도는 오가노이드가 분리될 준비가 된 단계인 ~7일 후에 ~500μm 직경의 낭성 오가노이드가 발견되었을 때 성공적이었습니다(그림 2C). 전체 오가노이드 유도가 성공적이더라도 일부 오가노이드는 결국 중단되기 전에 성장하기 시작할 수 있습니다. 인간 눈물샘 오가노이드는 3-4일 이내에 낭종으로 성장했고 조직 분리 후 10-14일 이내에 완전히 자란 크기에 도달했습니다(그림 2D). 생쥐와 인간 모두에서 오가노이드 유도가 실패하는 경우가 있었으며 오가노이드가 자라지 않거나 거의 자라지 않았습니다. 이것은 일반적으로 조직의 과소화로 인해 발생했습니다. 마우스 눈물샘 오가노이드는 최소 40배, 인간 오가노이드는 최소 20배 계대할 수 있습니다. 계대배양은 오가노이드 성장에 따라 평균 7-10일마다 수행되었습니다.

그림 2: 마우스 및 인간 눈물샘 오가노이드의 확립. (A) 쥐 눈물샘 절제의 여러 단계 사진. 화살표는 보호막 아래의 눈물샘을 가리킵니다. (B) 조직 소화 직후 마우스 눈물샘 세포의 명시야 이미지, 삽입물은 acinus와 duct를 보여줍니다. (C) 성공적인 마우스 눈물샘 오가노이드 유도의 명시야 이미지. (D) 14일 동안 인간 오가노이드 성장의 명시야 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
눈물샘 오가노이드는 확장 배지에서 배양할 때 많은 비율의 줄기 세포를 포함합니다. 그들의 분화 수준을 높이기 위해, 우리는 성장 인자 함량이 감소된 마우스와 인간 분화 배지를 설정했습니다. 분화 배지에서 각각 5일 및 7일 후, 마우스 및 인간 눈물샘 오가노이드는 더 조밀해졌다(도 3A-B). 이러한 형태학적 변화는 기능적 특성의 증가와 상관관계가 있습니다. 순환 AMP 활성제인 포스콜린 또는 신경전달물질인 노르에피네프린을 적용하면 3시간 이내에 오가노이드 부종(즉, 정단 수분 분비)이 발생했습니다(그림 3C). 부종이 3-4시간 이상 걸렸을 때, 이는 오가노이드가 충분히 분화되지 않았거나 신경전달물질에 대한 수용체와 같은 기능적 마커를 발현하지 않았음을 시사했습니다.
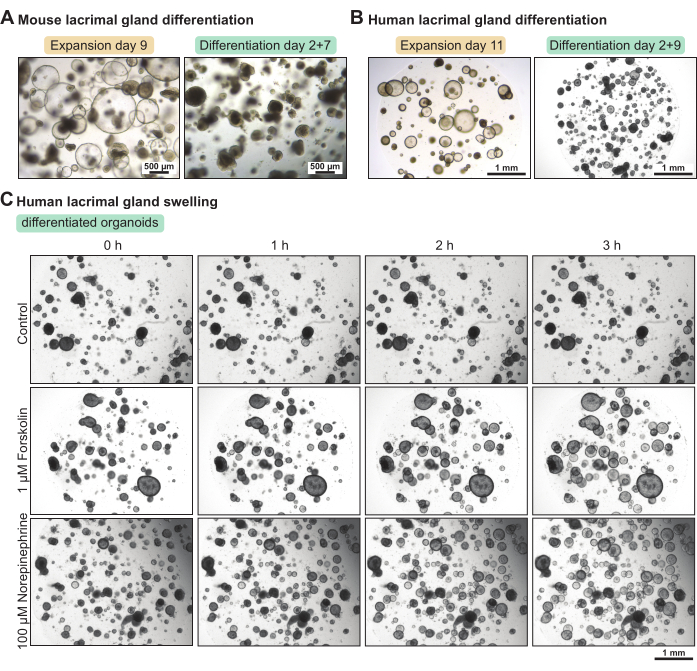
그림 3: 마우스 및 인간 눈물샘 오가노이드의 분화 및 인간 오가노이드의 기능적 부종 분석. (A) 팽창 배지에서 7일, 분화 배지에서 5일 동안 배양한 마우스 눈물샘 오가노이드의 명시야 이미지, 확장 배지에서 2일 후. (B) 팽창 배지에서 11일 동안 배양하고 확장 배지에서 2일 후 분화 배지에서 9일 동안 배양한 인간 눈물샘 오가노이드의 명시야 이미지. (C) 3시간 동안 신선한 분화 배지(대조군), 1μM 포스콜린 및 100μM 노르에피네프린에 노출된 분화된 인간 눈물샘 오가노이드의 명시야 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
마우스 눈물샘 오가노이드에서 Pax6를 녹아웃하기 위해 선택한 Pax6 표적 gRNA를 포함하는 플라스미드를 PCR 및 결찰에 의해 생성했습니다(그림 4A). 이 gRNA 함유 플라스미드는 단일 세포로 해리된 마우스 눈물샘 오가노이드에서 Piggy-Bac 플라스미드(하이그로마이신 내성 트랜스포존 함유 및 트랜스포사제 함유 플라스미드) 및 C> T 염기 편집기 Cas9와 함께 전기천공되었습니다. 3일 후, 오가노이드가 회복되었을 때, 그들은 하이그로마이신 내성 카세트를 통합한 클론을 선택하기 위해 하이그로마이신에 노출되었습니다. 성공적인 전기천공법에서 하이그로마이신에 내성이 있는 오가노이드가 성장했습니다(그림 4B). ~300μm보다 큰 성장하는 오가노이드 클론은 이상적으로는 자발적으로 분화되기 전에 선택되었습니다(그림 4C). DNA는 오가노이드의 일부에서 추출하고 나머지는 배양에 유지하였다. gRNA에 의해 표적화된 Pax6 유전자좌의 PCR 증폭은 선택된 각 클론에 대해 367bp 밴드를 생성했습니다(그림 4D). 증폭된 유전자좌를 시퀀싱한 후, 동형접합적으로 C > T 편집된(n = 1) 클론을 유지하였다. 반면에, 편집되지 않았거나(n=4), 이형접합적으로 편집되었거나, 잘못 편집된(n=1) 클론은 폐기되었다(도 4E). 전반적으로, Pax6를 표적으로 하는 이 gRNA를 사용하여 6개의 염기서열 중 하나의 동형접합 녹아웃 마우스 눈물샘 클론을 얻었습니다. 일부 클론은 잘 자랐지만 일부 오가노이드 클론은 채취 후 손실되거나 분화되기 시작했습니다(그림 4F). 선별된 10개의 오가노이드 클론 중 7개가 잘 자랐습니다.
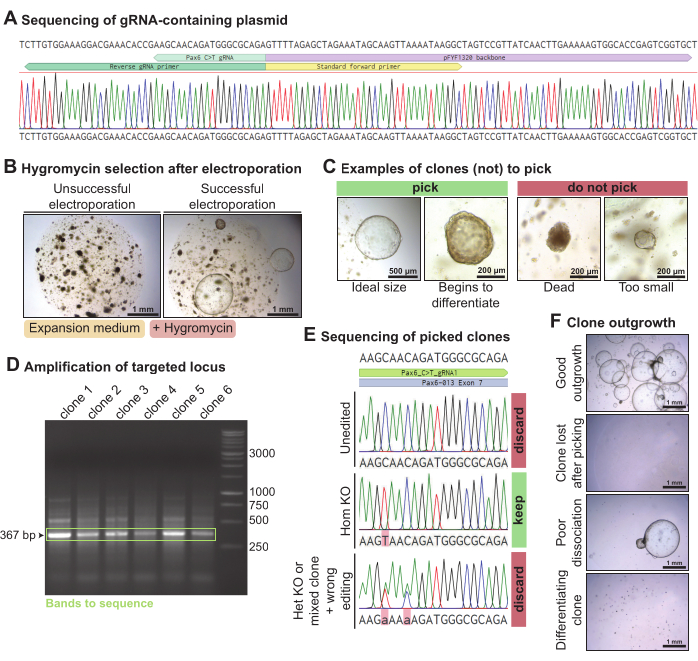
그림 4: 마우스 눈물샘 오가노이드에서 Pax6의 염기 편집 매개 녹아웃. (A) Pax6 유전자좌를 표적으로 하는 gRNA의 올바른 통합 후 pFYF1320의 Sanger 시퀀싱 추적. (B) 전기천공 후 하이그로마이신에 노출된 지 5일 후 마우스 눈물샘 오가노이드의 명시야 이미지. 오가노이드는 마우스 확장 배지에서 배양하였다. 왼쪽은 하이그로마이신에 내성이 있는 클론이 자라지 않는 실패한 전기천공의 예입니다. 오른쪽은 여러 개의 하이그로마이신 내성 오가노이드 클론이 살아남은 성공적인 전기천공의 예입니다. (C) 선택해야 하는 클론과 선택하지 말아야 하는 클론의 명시야 이미지. (D) gRNA로 표적화된 Pax6 유전자좌의 증폭을 보여주는 아가로스 겔. 녹색에서는 예상 크기인 367bp의 밴드가 강조 표시됩니다. (E) 하이그로마이신에 내성이 있는 3개의 오가노이드 클론의 Sanger 시퀀싱 추적. 최상위 클론은 편집되지 않습니다. 중간 클론은 동형 접합 C > T 에디션이므로 동형 접합 녹아웃입니다. 하단 클론은 두 개의 이형 접합 점 돌연변이를 나타내며 이형 접합 녹아웃 또는 혼합 클론이며 잘못 편집되었습니다. (F) 다양한 수준의 성장을 가진 선별된 오가노이드 클론의 명시야 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
마지막으로, 마우스에 인간 눈물샘 오가노이드 오가노이드 동소 이식술을 시행하기 위하여, 3일 전에 분할된 오가노이드(직경 100μm <)를 사용하였다. 오가노이드 생착은 마우스 눈물샘에 오가노이드를 주입한 지 1개월 후에 인간 특이적 마커인 인간 뉴클레오라 항원에 대한 염색을 통해 확인되었다(도 5). 마우스 눈물샘의 모든 부분에서 점상 염색이 없다는 것은 인간 오가노이드 생착이 부족함을 의미했습니다.
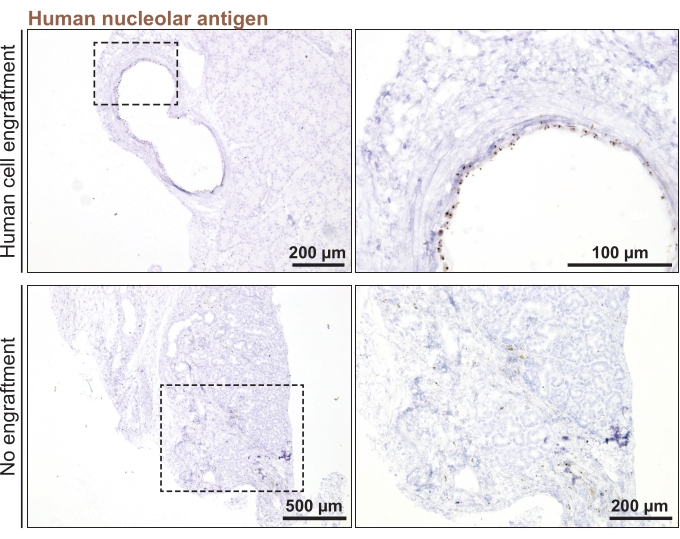
그림 5: 인간 눈물샘 오가노이드를 마우스 눈물샘에 이식. 이식 1개월 후 생착을 모니터링하기 위해 인간 핵핵 마커에 대한 이식된 마우스 눈물샘의 염색. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 표 1: 배지 및 완충액의 구성. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
이 프로토콜은 기능 분석, 돌연변이 모델링 및 이식을 위한 눈물샘 오가노이드의 설정 및 사용을 설명합니다. 마우스와 인간 눈물샘 오가노이드를 확립할 때 조직 해리가 중요합니다. 조직이 충분히 소화되지 않으면 오가노이드 수율이 낮아집니다. 조직이 과도하게 소화되면 세포가 죽고 오가노이드로 자라지 않습니다. 각 조직은 최적의 오가노이드 성장을 보장하기 위해 특정 시간 동안 특정 효소로 소화되어야 합니다14,17,18. 눈물샘은 피펫팅 기반의 기계적 해리와 결합된 5-10분의 콜라게나제 소화가 작은 조직 조각을 분리하기에 충분한 다소 부드러운 조직입니다. 단일 세포 RNA 시퀀싱과 같은 응용 분야를 위해 단일 세포를 얻어야 하는 경우, 단일 세포 단계에 도달할 때까지 해리를 더 오래 수행할 수 있지만, 생존력 감소를 제한하기 위해 단일 세포를 얻는 즉시 해리를 중지해야 합니다. 조직 해리가 매우 중요하기 때문에 과소화는 눈물샘 오가노이드 형성 실패의 가장 큰 원인입니다.
눈물샘 오가노이드의 적절한 유지는 사용에 중요합니다. 장기 유지는 유도만능줄기세포 유래 오가노이드와 비교하여 성체줄기세포 유래 눈물샘 오가노이드의 특징입니다 7,17. 장기적인 유지 관리를 위해서는 정기적인 오가노이드 분할 및 중간 교체를 수행해야 합니다. 이것이 없으면 오가노이드는 분화하기 시작하고 줄기 세포 잠재력이 감소하여 장기적인 유지를 방해합니다7. 이 단계에서 다시 말하지만, 과소화는 줄기 세포를 죽이고 오가노이드 유지를 손상시킬 수 있습니다. 정기적인 유지 관리를 위해 단일 세포로의 오가노이드 해리가 필요하지 않습니다. 그러나 클론 녹아웃 오가노이드 라인을 생성하려면 단일 세포로 시작하는 것이 중요합니다. 그렇지 않은 경우 오가노이드는 서로 다른 유전적 배경을 가진 세포의 모자이크로 구성되어 정의된 단일 돌연변이의 효과를 분석하는 것이 불가능합니다. 여기에서는 정지 코돈을 생성하기 위해 C > T 베이스 편집기를 사용하는 방법을 설명합니다. 이 게놈 편집기는 NGG PAM의 12-18개 염기 내에서 아르기닌, 글루타민 또는 트립토판 코돈의 존재에 의존합니다. gRNA 설계에서 이러한 조건이 충족되지 않는 경우, 대체 PAM이 있는 기존 Cas9 또는 C>T base editor를 사용할 수 있습니다 7,18. 그러나 기존의 Cas9는 수리 시 인델을 초래하는 이중 가닥 파손을 도입합니다(11). 두 대립 유전자 모두 서로 다른 인델을 가질 수 있으므로 클론 유전형 분석에는 추가적인 주의가 필요합니다. 도입된 변형의 디콘볼루션은 두 대립 유전자 모두 프레임 밖 인델을 포함하도록 수행되어야 하며, 따라서 오가노이드 클론이 표적 유전자에 대해 녹아웃되도록 해야 합니다19. C > T 염기 편집기의 장점은 반드시 정지 코돈을 초래하지 않는 점 돌연변이를 모델링하는 데 사용할 수 있다는 사실에 있습니다. 예를 들어, 홍채증 환자에서 발견되는 특정 Pax6 돌연변이를 모델링하여 눈물샘 생리학에 미치는 영향을 연구하는 데 사용할 수 있다20.
눈물샘은 눈물막1의 수성 부분을 분비합니다. 눈물 분비는 성장 인자 철회 및 NOTCH 억제에 의해 매개되는 분화 후 인간 오가노이드에서 요약될 수 있습니다. 이러한 조건에서 오가노이드는 말단 분화를 거쳐 더 이상 유지될 수 없습니다. 그러나 차별화된 눈물샘 오가노이드는 잠재적으로 고처리량 스크리닝에서 안구 건조증의 맥락에서 눈물을 유발하는 약물의 개발을 안내할 수 있습니다. 이 프로토콜에 제시된 찢어짐 분석은 현재 짧은 시간 내에 오가노이드 크기의 가장 큰 변화를 제공하는 분석법으로, 약물 스크리닝 7,9,17의 맥락에서 더 쉽게 정량화할 수 있습니다.
줄기세포 치료는 안구건조증에서 눈물샘 재생에 큰 가능성을 가지고 있다21. 성체 줄기 세포 유래 눈물샘 오가노이드는 이러한 응용 분야의 원료가 될 수 있습니다. 여기에 제시된 프로토콜은 대부분 낭종으로 인간 눈물샘 오가노이드 생착을 초래합니다. 낮은 오가노이드 생착은 잘못된 부위에 오가노이드가 주입되어 발생할 수 있습니다. 염료로 주입 절차를 훈련하면 주입 부위를 추적할 수 있으며 궁극적으로 주입 정확도가 향상됩니다. 대안적으로, 마우스 표피는22세 이전의 쥐에서와 같이 눈물샘에 직접 접근할 수 있도록 절개될 수 있다. 이 방법은 시간이 더 오래 걸리지만 더 정확할 수 있습니다. 반면에, 본 프로토콜에서는 오가노이드가 마우스 눈물샘에 기능적으로 통합되지 않았습니다. iPSC 유래 눈물샘 생착에 대해서도 유사한 결과가 관찰되었다22. 이식 방법은 눈물샘을 미리 상처를 입히거나, 안구건조증 마우스 모델을 사용하거나, 오가노이드를 단세포 또는 작은 덩어리로 주입함으로써 더욱 개선될 수 있습니다. 그럼에도 불구하고 성체 줄기 세포 유래 눈물샘 오가노이드 및 관련 툴킷은 눈물샘 연구 및 재생 의학에서 향후 응용 분야의 기초가 될 수 있습니다.
공개
Hans Clevers는 바젤 로슈의 제약 연구 및 초기 개발 책임자이며 오가노이드 기술과 관련된 여러 특허를 보유하고 있습니다.
감사의 말
프로토콜의 초기 개발에 대해 Yorick Post에 감사드립니다. 이 연구는 Cancer Research UK Grand Challenge(C6307/A29058)와 Mark Foundation for Cancer Research에서 SPECIFICANCER 팀에 수여하는 상으로 부분적으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL safe-lock centrifuge tubes | Eppendorf | EP0030 120.094 | |
| 3,3′-Diaminobenzidine tetrahydrochloride hydrate (DAB) | Sigma-Aldrich | D5637 | CAS: 868272-85-9 , CAUTION, 6 g/L solution can be stored aliquotted at -20 °C |
| 5x green GoTaq Flexi buffer | Promega | M891A | Store at -20 °C |
| A83-01 | Tocris | 2939 | Store at -20 °C, stock at 30 mM, 10000x |
| Advanced DMEM/F12 | Invitrogen | 12634-010 | store at 4 °C |
| Agar plates containing Ampicillin | Hubrecht Institute | ||
| Ampicillin sodium salt | Sigma-Aldrich | A9518 | |
| Autoclave VAPOUR-Line lite | VWR chemicals | ||
| B27 supplement | Invitrogen | 17504-044 | Store at -20 °C, 50x |
| BD Micro-Fine insulin needle 1 mL | BD Bioscience | 324825 | |
| Benchtop microscope DMI1 | Leica | ||
| Bovine serum albumine (BSA) | MP biomedicals | 160069 | Store at 4 °C |
| BTXpress | BTX | MDS450805 | |
| C57BL/6 mice | Hubrecht Institute | ||
| Cassettes | Klinipath | 410-02S | |
| CellBanker 1 | amsbio | 11910 | Cryopreservation medium, adhere to instructions |
| Centrifuge | Eppendorf | ||
| Citric acid monohydrate | J.T. Baker | 0088 | CAS: 5949-29-1 |
| Collagenase I | Sigma Aldrich | C9407 | Aliquots at 20 mg/mL, 20x, store at -20 °C |
| Conical tubes 15 mL | Greiner Bio-One | 5618-8271 | |
| Conical tubes 50 mL | Corning | CLS430828-500EA | |
| Coverslips 24 mm x 50 mm | Menzel-Gläzer | BB024050S1 | |
| Cultrex Basement Membrane Extract (BME), Growth Factor Reduced, Type 2 - extracellular matrix | R&D Systems, Bio-Techne | 3533-001-02 | Store at -20 °C, keep at 4 °C for up to 1 month |
| DAPT | Sigma Aldrich | D5942 | Store at -20 °C, stock at 10 mM, 1000x |
| Disodium hydrogen phosphate anhydrous | VWR chemicals | 28026.292 | CAS: 7558-79-4 |
| Di-sodiumhydrogenphosphate dihydrate | Sigma-Aldrich | 71643 | CAS:10028-24-7 |
| Dispase | ThermoFisher Scientific | 17105-041 | Aliquots at 50 U/mL, store at -20 °C until use, 400x |
| Disposable Scalpel Sterile N° 10 | Swann Morton | 3033838 | |
| DM4000 microscope | Leica | ||
| dNTPs 25 mM | Promega | U1420 | Mix all 4 nucleotides together, Store at -20 °C |
| Dpn1 | New England Biolabs | R0176 | |
| Dulbecco's Phosphate-bufferd Saline (DPBS) | Gibco | 14190144 | 1x |
| Easy strainers 70 µm | Greiner | 542170 | |
| Electroporation cuvette | Nepagene | EC002S | |
| EnVision+/HRP mouse | Agilent | K400111-2 | |
| Ethanol 100% | BOOM | 84045206;5000 | CAUTION, Use to prepare other Ethanol dilutions |
| Ethanol 70% | BOOM | 84010059.5000 | CAUTION |
| Ethanol 96% | BOOM | 84050065.5000 | CAUTION |
| EVOS FL Auto 2 Cell Imaging System | ThermoFisher Scientific | Live-imaging brightfield microscrope | |
| FGF10 | Peprotech | 100-26 | Store at -20 °C, stock at 100 mg/mL in base medium, 100x |
| Fiji | NIH, Fiji developers | ||
| Formaldehyde solution 4% | Sigma-Aldrich | 1.00496 | CAS: 50-00-0, CAUTION |
| Forskolin | Tocris | 1099 | Store at -20 °C, stock at 10 mM, 10000x |
| Glutamax | Gibco | 35050-061 | 100x |
| GoTaq G2 Flexi DNA Polymerase | Promega | M7805 | Store at -20 °C |
| Haematoxylin | VWR chemicals | 10047105 | Store at room temperature |
| HEPES | Gibco | 15630-080 | Store at 4 °C, 100x |
| Histocore H and C, Tissue embedding machine | Leica | ||
| Hot plate | Meidax | ||
| Human nucleolar antigen antibody | Abcam | ab-190710 | |
| Hydrochloric acid 5 N | ThermoFisher Scientific | 10605882 | CAS: 7647-01-0, CAUTION |
| Hydrogen peroxyde 30% | Chem-lab | CL00.2308.1000 | CAS: 7722-84-1, CAUTION |
| Hygromycin B-gold | InvivoGen | ant-hg | Stock at 100 mg/µL, 1000x |
| Hygromycin resistance cassette-containing plasmid | Andersson-Rolf et al, Nature Methods, 2017. doi: 10.1038/nmeth.4156 | ||
| IsoFlo 100% | Mecan | 5960501 | |
| LB medium | Hubrecht Institute | ||
| MgCl2 25 mM | Promega | A351H | Store at -20 °C |
| Microtome RM2235 | Leica | ||
| Midiprep DNA isolation kit | ThermoFisher Scientific | K210005 | |
| Miniprep DNA isolation kit | ThermoFisher scientific | K210003 | |
| N-acetylcysteine | Sigma Aldrich | A9165 | Store at -20 °C, stock at 500 mM, 400x |
| NEPA21 electroporator | Nepagene | ||
| Nicotinamide | Sigma Aldrich | N0636 | Store at -20 °C, stock at 1M, 100x |
| NOD Scid Gamma (NSG) mice | Hubrecht Institute colony | ||
| Noggin conditioned medium | U-Protein Express | Custom order | Store at -20 °C |
| Noradrenaline | Sigma Aldrich | A7257 | Store at -20 °C, stock at 100 mM |
| Oven | Memmert | Set at 58 °C | |
| P20, P200 and P1000 pipettes | Gilson | ||
| Paraffin | VWR chemicals | 10048502 | |
| Pasteur pipettes, glass plugged | ThermoFisher Scientific | 1150-6973 | |
| Pax6_C>T_F: AGACTGTTCCAGGATGGCTG | IDT | ||
| Pax6_C>T_R: TCTCCTAGGTACTGGAAGCC | IDT | ||
| pCMV_ABEmax_P2A_GFP | Addgene | 112101 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | Store at -20 °C |
| Pertex | Klinipath | AM-08010 | |
| pFYF1320 | Addgene | 47511 | |
| Primocin | InvivoGen | ant-pm-1 | 1000X, store at -20 °C |
| Prostaglandin E2 (PGE2) | Tocris | 2296 | Store at -20 °C, stock at 10 mM, 10000x |
| Petri dish, 10 cm | Greiner | 633102 | |
| Q5 buffer | New England Biolabs | B9027S | |
| Q5 high-fidelity DNA polymerase | New England Biolabs | M0491S | |
| QIAquick Gel Extraction Kit | Qiagen | 28704 | |
| QuickExtract DNA Extraction Solution | Lucigen | QE09050 | Store aliquots at -20 °C |
| R-spondin 3 conditioned medium | U-Protein Express | Custom order | Store at -20 °C |
| sgRNA Reverse Primer: TCTGCGCCCATCTGTTGCTT CGGTGTTTCGTCCTTTCCACAAG | IDT | ||
| Slides | StarFrost | MBB-0302-55A | Adhesive, ground |
| Sodium azide | Merck | 8.22335.1000 | CAS: 26628-22-8, CAUTION |
| Sodium cytrate dihydrate | J.T. Baker | 0280 | CAS: 6132-04-3 |
| Standard Forward Primer: “/5phos/ GTTTTAGAGCTAGAAATAGCAAG TTAAAATAAGGC | IDT | ||
| Subcloning efficiency competent cells DH5alpha | Invitrogen | 18265-017 | |
| Suspension cell culture plates (24-well) | Greiner Bio-One | 662102 | 24-well |
| Suspension cell culture plates (12-well) | Greiner Bio-One | 665102 | 12-well |
| T4 DNA ligase | New England Biolabs | M0202 | |
| TAE buffer | ThermoFisher Scientific | B49 | Stock at 50x, dilute to 1x with ultrapure water |
| Transposase-containing plasmid | Andersson-Rolf et al, Nature Methods, 2017. doi: 10.1038/nmeth.4156 | ||
| TrypLE Express Enzyme | Invitrogen | 12605-028 | store at 4 °C |
| U6_Forward primer: GGGCAGGAAGAGGGCCTAT | IDT | ||
| UltraPure Agarose 1000 | Invitrogen | 16550 | |
| Water bath | Tulabo | ||
| Xylene | Klinipath | 4055-9005 | CAS: 1330-20-7, CAUTION |
| Y-27632 | Abmole Bioscience | Y-27632 dihydrochloride | Store at -20 °C, stock at 10 mM, 1000x |
참고문헌
- Garg, A., Zhang, X. Lacrimal gland development: From signaling interactions to regenerative medicine. Developmental Dynamics. 246 (12), 970-980 (2017).
- Selinger, D. S., Selinger, R. C., Reed, W. P. Resistance to infection of the external eye: The role of tears. Survey of Ophthalmology. 24 (1), 33-38 (1979).
- Messmer, E. M. The pathophysiology, diagnosis, and treatment of dry eye disease. Deutsches Arzteblatt International. 112 (5), 71-81 (2015).
- Massie, I., et al. Development of lacrimal gland spheroids for lacrimal gland tissue regeneration. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2001-2009 (2018).
- Tiwari, S., et al. Establishing human lacrimal gland cultures with secretory function. PloS One. 7 (1), 29458(2012).
- Nguyen, D. H., Beuerman, R. W., Halbert, C. L., Ma, Q., Sun, G. Characterization of immortalized rabbit lacrimal gland epithelial cells. In Vitro Cellular & Developmental Biology. Animal. 35 (4), 198-204 (1999).
- Bannier-Hélaouët, M., et al. Exploring the human lacrimal gland using organoids and single-cell sequencing. Cell Stem Cell. 28 (7), 1221-1232 (2021).
- Hayashi, R., et al. Generation of 3D lacrimal gland organoids from human pluripotent stem cells. Nature. 605 (7908), 126-131 (2022).
- Jeong, S. Y., et al. Establishment of functional epithelial organoids from human lacrimal glands. Stem Cell Research & Therapy. 12 (1), 247(2021).
- Hofer, M., Lutolf, M. P. Engineering organoids. Nature Reviews Materials. 6 (5), 402-420 (2021).
- Meyenberg, M., Ferreira da Silva, J., Loizou, J. I. Tissue specific DNA repair outcomes shape the landscape of genome editing. Frontiers in Genetics. 12, 728520(2021).
- Geurts, M. H., et al. CRISPR-based adenine editors correct nonsense mutations in a cystic fibrosis organoid biobank. Cell Stem Cell. 26 (4), 503-510 (2020).
- Overmyer, K. A., Thonusin, C., Qi, N. R., Burant, C. F., Evans, C. R. Impact of anesthesia and euthanasia on metabolomics of mammalian tissues: Studies in a C57BL/6J mouse model. PLoS One. 10 (2), 0117232(2015).
- Driehuis, E., et al. Oral mucosal organoids as a potential platform for personalized cancer therapy. Cancer Discovery. 9 (7), 852-871 (2019).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. Journal of Visualized Experiments. (6), e253(2007).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Lian, J., Meng, X., Zhang, X., Hu, H. Establishment and genetic manipulation of murine hepatocyte organoids. Journal of Visualized Experiments. (180), e62438(2022).
- Lõhmussaar, K., et al. Patient-derived organoids model cervical tissue dynamics and viral oncogenesis in cervical cancer. Cell Stem Cell. 28 (8), 1380-1396 (2021).
- Bloh, K., et al. Deconvolution of complex DNA repair (DECODR): Establishing a novel deconvolution algorithm for comprehensive analysis of CRISPR-edited Sanger sequencing data. The CRISPR Journal. 4 (1), 120-131 (2021).
- Latta, L., et al. Pathophysiology of aniridia-associated keratopathy: Developmental aspects and unanswered questions. The Ocular Surface. 22, 245-266 (2021).
- Veernala, I., et al. Lacrimal gland regeneration: The unmet challenges and promise for dry eye therapy. The Ocular Surface. 25, 129-141 (2022).
- Hayashi, R., et al. Generation of 3D lacrimal gland organoids from human pluripotent stem cells. Nature. 605 (7908), 126-131 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유