Method Article
Establecimiento, mantenimiento, diferenciación, manipulación genética y trasplante de organoides de ratón y glándula lagrimal humana
En este artículo
Resumen
Este protocolo describe cómo establecer, mantener, modificar genéticamente, diferenciar, caracterizar funcionalmente y trasplantar organoides de la glándula lagrimal derivados de tejido primario de ratón y humano.
Resumen
La glándula lagrimal es un órgano esencial para la homeostasis de la superficie ocular. Al producir la parte acuosa de la película lagrimal, protege el ojo del estrés de desecación y los insultos externos. Poco se sabe sobre la (fisio)fisiología de la glándula lagrimal debido a la falta de modelos in vitro adecuados. La tecnología de organoides ha demostrado ser una plataforma experimental útil para múltiples órganos. Aquí, compartimos un protocolo para establecer y mantener organoides de la glándula lagrimal humana y de ratón a partir de biopsias de glándulas lagrimales. Al modificar las condiciones de cultivo, mejoramos la funcionalidad organoide de la glándula lagrimal. La funcionalidad del organoide se puede probar a través de un ensayo de "llanto", que implica exponer los organoides de la glándula lagrimal a neurotransmisores seleccionados para desencadenar la liberación de lágrimas en su luz. Explicamos cómo visualizar y cuantificar este fenómeno. Para investigar el papel de los genes de interés en la homeostasis de las glándulas lagrimales, estos pueden ser modificados genéticamente. Describimos a fondo cómo modificar genéticamente los organoides de la glándula lagrimal utilizando editores de bases, desde el diseño del ARN guía hasta el genotipado de clones de organoides. Por último, mostramos cómo probar el potencial regenerativo de los organoides de la glándula lagrimal humana mediante la implantación ortotópica en el ratón. En conjunto, este conjunto completo de herramientas proporciona recursos para utilizar organoides de ratón y glándula lagrimal humana para estudiar la (fisio)fisiología de la glándula lagrimal.
Introducción
La glándula lagrimal es el epitelio glandular responsable de producir la mayor parte de la capa acuosa de la película lagrimal1. La capa acuosa de la película lagrimal no sólo contiene agua para lubricar la superficie ocular, sino también un gran repertorio de componentes antimicrobianos que protegen la superficie ocular de infecciones2. Cuando la glándula lagrimal está dañada o inflamada, se produce la enfermedad del ojo seco, lo que resulta en molestias para los pacientes y eventualmente puede conducir a la pérdida de la visión3. A lo largo de los años, los sistemas modelo para estudiar la glándula lagrimal, en particular la glándula humana, se han limitado 4,5,6. Esto ha contribuido a una brecha de conocimiento sobre la función de la glándula lagrimal en condiciones fisiológicas y patológicas.
Recientemente, se han desarrollado modelos in vitro para estudiar la glándula lagrimal en una placa 7,8,9. Estos organoides de la glándula lagrimal se derivan de células madre adultas cultivadas como estructuras tridimensionales en una matriz extracelular complementada con un cóctel de factores de crecimiento que sostiene sus capacidades regenerativas in vitro7. La ventaja de los organoides derivados de células madre adultas (ASC) es que se pueden mantener durante mucho tiempo mientras recapitulan las características del tejido sano. Este tipo de organoide consiste únicamente en células epiteliales, a diferencia de los organoides derivados de células madre pluripotentes inducidas (iPSC), que también pueden contener células del estroma, por ejemplo. A diferencia de los organoides derivados de células madre pluripotentes (PSC), los organoides ASC se establecen directamente a partir de tejido adulto y no requieren ninguna modificación genética para expandirse. Los organoides ASC expresan características adultas10.
Este protocolo contiene una caja de herramientas para derivar organoides de la glándula lagrimal a partir de tejido primario de ratón y humano. El protocolo describe cómo mejorar aún más la funcionalidad de los organoides mediante la simple retirada del factor de crecimiento y cómo provocar que los organoides secreten líquido lagrimal mediante la realización de un ensayo de hinchazón. Este protocolo también incluye un método de transfección basado en electroporación para diseñar genéticamente organoides de ratón utilizando editores de bases derivados de CRISPR. A diferencia del Cas9 convencional, el uso de editores de bases permite la modificación de bases simples en el genoma sin generar una ruptura de doble cadena11,12. Por último, se describe el trasplante ortotópico de organoides de la glándula lagrimal humana en ratones inmunodeficientes y la posterior evaluación histológica del injerto. Este kit de herramientas organoides de la glándula lagrimal se puede utilizar en la investigación sobre la regeneración y función de la glándula lagrimal y para el modelado de enfermedades genéticas e inflamatorias.
Protocolo
Los experimentos con ratones fueron aprobados por el Comité de Ética Animal de la Real Academia de Artes y Ciencias de los Países Bajos (KNAW) bajo la licencia del proyecto AVD8010020151. Los organoides se derivaron del material excedente de ratón. Las biopsias de la glándula lagrimal humana se recogieron del material de desecho de pacientes sometidos a cirugía en el Centro Médico Universitario de Utrecht (UMCU) después de la aprobación del comité de ética médica bajo el protocolo número 18-740. El protocolo contiene varias secciones que se describen en la figura 1.

Figura 1: Descripción general del protocolo. Esta figura destaca los diferentes pasos del protocolo. Haga clic aquí para ver una versión más grande de esta figura.
NOTA: Todas las composiciones de medios y tampones se describen en la Tabla Suplementaria 1.
1. Establecimiento de organoides a partir de glándulas lagrimales humanas y de ratón
- Diseccionando la glándula lagrimal del ratón
- Prepare las herramientas de disección, incluidas las tijeras, los fórceps y las almohadillas de disección. Eutanasia de un ratón por inhalación deO2/CO2 13.
- Coloque el ratón sacrificado en su abdomen en la almohadilla de disección y fije sus extremidades. Mojar el pelo situado entre las orejas del ratón y en la frente con etanol al 70%.
- Usando tijeras de disección, haga una abertura detrás del cráneo entre las orejas. Extienda esta abertura sobre la frente hasta la nariz. Aún usando tijeras, corta la piel detrás de las orejas para generar dos colgajos.
- Tire de los colgajos hacia la nariz firmemente hasta que las glándulas lagrimales estén expuestas, como se muestra en la Figura 2A. Fije las solapas a la almohadilla de disección. Usando tijeras, haga una pequeña incisión en la membrana ubicada sobre la glándula lagrimal para exponer completamente la glándula lagrimal.
- Usando los fórceps, tire de la glándula lagrimal. Debe haber cierta resistencia hasta que se rompa el conducto lagrimal principal. Si lo prefiere, corte el conducto lagrimal principal directamente con tijeras.
- Coloque la glándula lagrimal del ratón en PBS de grado de cultivo tisular hasta su posterior procesamiento. Proceda con el procesamiento de la glándula lagrimal dentro de 2-4 h para limitar la muerte celular. Si esto toma más tiempo, coloque la glándula lagrimal del ratón en el medio de recolección de biopsia (Tabla suplementaria 1).
NOTA: Se pueden agrupar varias glándulas lagrimales si se necesita un gran número de organoides de inmediato.
- Recolección de biopsias de glándulas lagrimales humanas
- Antes de la cirugía, prepare 20 ml de alícuotas de medio de recolección de biopsia (Tabla suplementaria 1) en un tubo de 50 ml, y déselo al cirujano antes de la cirugía. Este medio puede mantenerse a 4 °C durante varios meses.
- El día de la cirugía, deje que el cirujano tome una muestra de un pedazo de la glándula lagrimal (generalmente <1 mm3) y guárdelo en el medio de recolección de biopsia (Tabla suplementaria 1) a 4 °C.
- Recoger la biopsia para procesarla lo antes posible. Idealmente, esto debe ser el mismo día dentro de las 2 h de la muestra de biopsia.
- Derivación organoide
- Prepare de antemano lo siguiente: matriz extracelular (MCE) descongelada, ratón o medio de expansión humano (Tabla suplementaria 1) a temperatura ambiente (RT), colagenasa descongelada, medio base (Tabla suplementaria 1), dos bisturíes, una placa de Petri de 10 cm, un colador de 70 μm instalado en un tubo de 15 ml y placas de suspensión de 12 pocillos precalentadas a 37 °C durante 30 min.
- Preparar el medio de digestión combinando todos los componentes que se muestran en la Tabla Suplementaria 1. Moje previamente los bisturíes en este medio para evitar que las piezas de tejido se peguen a ellos.
- Recupere el tejido de la glándula lagrimal humana o del ratón del medio y colóquelo en la placa de Petri.
- Usando los bisturís prehumedecidos, pica el tejido. Una vez que las piezas de tejido sean muy pequeñas (es decir, <0.5 mm3), colóquelas en el medio de digestión raspándolas de la placa de Petri con el bisturí. Si la biopsia humana ya es muy pequeña, colóquela directamente en el medio de digestión sin picar para evitar la pérdida de tejido.
- Incubar las piezas de tejido durante un máximo de 15 minutos en un baño maría a 37 °C. Invierta el tubo de 15 ml regularmente para resuspender las piezas. Controle la disociación celular bajo un microscopio de sobremesa para no digerir demasiado el tejido.
- Mientras tanto, estrecha una pipeta Pasteur colocando su punta en una llama mientras gira, y humedécela previamente en el medio base. Para disociar eficientemente el tejido, asegúrese de que el orificio sea ligeramente más pequeño que las piezas más grandes de tejido que quedan. Para facilitar el proceso de disociación, pipetear la mezcla hacia arriba y hacia abajo cada 5 minutos con la pipeta Pasteur estrechada prehumedecida.
- Cuando muchas células individuales y grupos pequeños son visibles bajo el microscopio, detenga la disociación agregando 10 ml del medio base. Girar a 400 x g durante 5 minutos para granular las células.
- Retire el sobrenadante y vuelva a suspender el pellet en 10 ml del medio base para repetir el lavado. Filtrarlo a través de un colador de 70 μm para eliminar las grandes piezas de tejido no digerido y las fibras de colágeno restantes, lo que evitaría la polimerización adecuada de la ECM. Girar el eluido a 400 x g durante 5 min.
NOTA: Un pellet de glóbulos rojos indica la presencia de glóbulos rojos, lo que normalmente no dificulta la derivación de organoides. Sin embargo, para algunas aplicaciones, como la citometría de flujo, los glóbulos rojos deben ser lisados. Para eso, incubar las células en 5 ml de tampón de lisis de glóbulos rojos frescos en RT durante 5 min, y granular las células a 400 x g durante 5 min. - Retire el sobrenadante y resuspenda el pellet celular en 100 μL de ECM fría para una sola glándula lagrimal de ratón y en 50 μL de ECM fría para una biopsia humana. Al resuspender, tenga cuidado de no hacer burbujas, ya que estas también afectarían la polimerización y estabilidad de ECM.
- Sembrar hasta 100 μL de células por pocillo de una placa de suspensión de 12 pocillos. Use un P200 para hacer gotitas de ~ 20 μL en el pozo. Cuanto más pequeñas sean las gotas, mejor será la difusión de los factores de crecimiento y nutrientes a través de la matriz.
- Coloque la placa boca abajo en una incubadora humidificada a 37 °C durante 20-30 min para permitir que la ECM se solidifique.
- Una vez que la ECM esté solidificada, agregue ~ 1 ml de ratón RT o medio de expansión humano por pocillo de una placa de 12 pocillos. Refresque el medio cada 2-3 días hasta que los organoides alcancen un tamaño de 300 μm. Para eso, aspire el medio en el pozo y agregue suavemente el medio de expansión en el lado del pozo sin tocar las gotas de ECM para no interrumpirlas.
NOTA: La primocina (100 mg/ml; 1:1.000 de stock comercial) se puede añadir tras el aislamiento si se produce contaminación bacteriana. Sin embargo, debido a que también ralentiza el crecimiento de los organoides, es preferible no agregarlo o eliminarlo después de uno o dos pasajes.
2. Expansión de los organoides de ratón y glándula lagrimal humana
- Después de ~7 días para organoides de ratón y ~10 días para organoides humanos, cuando los organoides alcancen un tamaño de ~300 μm, retire el medio de cultivo.
- Resuspender las gotitas de ECM que contienen los organoides en 1 ml de solución de tripsina pipeteando vigorosamente hacia arriba y hacia abajo con un P1,000 hasta que las gotitas se desmoronen. Transfiera esta mezcla a un tubo de 15 ml e incube brevemente en un baño de agua a 37 °C.
- Después de 2-3 minutos, utilice una pipeta Pasteur estrecha y prehumedecida para subir y bajar la suspensión organoide 10x-15x. Verifique el estado de disociación de los organoides bajo un microscopio de sobremesa; Se deben obtener pequeños grupos de ~ 20 células. Incubar más tiempo en el baño maría a 37 °C y repetir el paso de pipeteo hasta que la disociación sea satisfactoria.
NOTA: Este paso puede tomar más tiempo para los organoides humanos, ya que son de varias capas. Se generarán células individuales; Esto no afecta el crecimiento de organoides siempre que la mayor parte de la suspensión de organoides consista en pequeños grupos. - Detenga la disociación agregando 10 ml del medio base. Luego, pellet las celdas a 400 x g durante 5 min.
- Después de retirar el sobrenadante y la MCE que pueda estar encima de los organoides (capa transparente, gelatinosa, sin organoides), resuspender las células en un volumen adecuado de MCE fría antes de colocarlas en una placa de suspensión, como se indica en el paso 1.3.10.
NOTA: Generalmente, los organoides lagrimales de ratón se dividen en una proporción de 1:5 y los organoides humanos en una proporción de 1:3. Esto significa que, cuando se comienza con organoides contenidos en 100 μL de MEC, deben resuspenderse en 500 μL y 300 μL, respectivamente, después de la división. - Incubar la placa boca abajo en una incubadora a 37 °C hasta la solidificación de la ECM durante 30 min, y cubrir los organoides con el ratón o el medio de expansión humano en RT.
3. Criopreservación de los organoides del ratón y de la glándula lagrimal humana
- Para criopreservar los organoides, primero divida los organoides en el medio de expansión de acuerdo con las instrucciones dadas en la sección 2.
- Aproximadamente 3-4 días después, cuando los organoides estén en una fase de crecimiento, retire el medio y resuspenda 100 μL de los organoides que contienen ECM en 10 ml de medio base frío. Incubar en hielo durante 10 minutos para ayudar a disociar la ECM. Voltee el tubo regularmente para facilitar este proceso.
- Pellet los organoides a 500 x g durante 5 min. Retire el sobrenadante y vuelva a suspender el pellet organoide en 1 ml de medio de criopreservación (la ECM sobrante no perjudica la criopreservación). Transfiera la suspensión organoide a un criovial e inmediatamente a un congelador a -80 °C.
NOTA: Cuando se utiliza el medio de criopreservación descrito en la Tabla de materiales, los crioviales se pueden mantener indefinidamente en un congelador de -80 °C. Si se utiliza otro medio de criopreservación, transfiera el criovial a un tanque de nitrógeno líquido después de 24 h para garantizar una conservación óptima. - Para descongelar los organoides, recupere el criovial del congelador y transpótelo en hielo seco a un baño maría a 37 °C. Mantenga el criovial en el agua hasta que la mayor parte de su contenido se descongele. Transfiera el contenido a un tubo de 15 ml que contenga 10 ml de medio base y gire las células a 400 x g durante 5 min.
- Colocar los organoides en placa 100 μL de ECM con el medio de expansión, como se describe en los pasos 2.5 y 2.6.
4. Diferenciar los organoides de las glándulas lagrimales y evaluar su funcionalidad
- Diferenciación organoide
- Para diferenciar los organoides de la glándula lagrimal, primero divida los organoides en el medio de expansión de acuerdo con las instrucciones de la sección 2.
- Después de 2 días, sustituya el medio de expansión por un medio de diferenciación humano o de ratón, tal como se describe en el paso 1.3.12. Actualice el medio cada 2-3 días para mantener los organoides de ratón durante 5 días en ese medio y los organoides humanos durante 9 días.
- Para evaluar la diferenciación de organoides después de 5 días o 9 días en el medio de diferenciación, recolecte 100 μL de ECM que contenga organoides para extraer el ARN. Para ello, resuspenda las gotitas de ECM en 1 ml de medio contenido en el pozo utilizando un P1,000, y transfiera la suspensión organoide en 3 ml de medio base helado. Pellet los organoides a 500 x g durante 5 min.
- Deseche el sobrenadante y vuelva a suspender el pellet en el tampón de extracción de ARN. Realice la extracción de ARN aguas abajo de acuerdo con las instrucciones del kit de extracción de ARN. Utilizar el ARN obtenido, por ejemplo, para el análisis RT-qPCR de la expresión de células madre (TP63, KRT5, KRT14) y marcadores celulares diferenciados (LCN2, WFDC2, AQP5, LTF, ACTA2...) 14.
NOTA: Para obtener el análisis de expresión pertinente, mida la expresión de los marcadores elegidos en una o varias muestras de tejido. Los organoides cultivados en condiciones de diferenciación tienden a contener menos ARN.
- Ensayo de hinchazón funcional
NOTA: Para esta parte del protocolo, use organoides de glándulas lagrimales humanas que se hayan diferenciado durante al menos 7 días. El tiempo mínimo requerido es de 7 días para garantizar una expresión suficiente del marcador para el desgarro funcional. Cada pocillo de una placa de 12 pocillos constituye una condición. El número mínimo de condiciones es tres: un control positivo, un control negativo y una condición de prueba.- Preparar 1 ml de medio de diferenciación humano que contenga componentes individuales que induzcan la secreción por los organoides de la glándula lagrimal. Por ejemplo, agregue 100 μM de noradrenalina y 1 μM de forskolina, y mezcle bien.
NOTA: La forskoline sirve como un control positivo que generalmente induce la hinchazón máxima. - En un microscopio automatizado de lapso de tiempo de campo claro, configure las posiciones que se tomarán en la placa, el intervalo de tiempo (5 min) y la duración (4 h). Asegúrese de que una gota completa de ECM sea visible en cada posición.
- Inmediatamente antes de empezar a tomar imágenes y sin mover la placa del microscopio, retire el medio de cultivo de los pocillos de los que se tomará la imagen y sustitúyalo por el medio bien resuspendido preparado en el paso 4.2.1. Incluya como control negativo un pozo con medio de diferenciación reemplazado por medio de diferenciación solamente, ya que el refresco medio puede desencadenar cierta hinchazón organoide.
- Después de hasta 4 h, el ensayo de hinchazón ha terminado. Analizar los resultados.
NOTA: Estos pasos se realizan con un microscopio EVOS M7000 que permite obtener imágenes automatizadas de lapso de tiempo de campo claro. Para ese microscopio, consulte el manual detallado del fabricante para configurar las imágenes de lapso de tiempo. Cabe destacar que se puede utilizar cualquier otro microscopio con características similares. - Para cuantificar la hinchazón del organoide, medir el diámetro de cada organoide individual a las 0 h y 4 h. Abra las imágenes de una sola gota de organoide a las 0 h y 4 h en ImageJ.
- Haga clic en el icono Línea recta de la barra de herramientas y primero dibuje el diámetro de un organoide a las 0 h. A continuación, utilice la herramienta Medir en ImageJ (Analizar > medir) para medir la longitud de esta línea y, por lo tanto, el diámetro del organoide antes de hincharse. Repita el proceso en el mismo organoide a las 4 h para obtener el diámetro del organoide después de la hinchazón.
- Mida el diámetro del organoide de ~20 organoides por condición antes y después del ensayo de hinchazón.
- Preparar 1 ml de medio de diferenciación humano que contenga componentes individuales que induzcan la secreción por los organoides de la glándula lagrimal. Por ejemplo, agregue 100 μM de noradrenalina y 1 μM de forskolina, y mezcle bien.
5. Construir un plásmido para noquear a Pax6
- Diseño de ARNg a knockout Pax6 usando editores base C > T
NOTA: Hay muchos programas de software disponibles para el diseño de ARNg. Aquí, se utilizó Benchling, ya que esto permite el diseño integrado de ARNg, la anotación y la alineación de las trazas de Sanger. Por lo tanto, todos los pasos posteriores también se pueden realizar utilizando programas de software alternativos.- Inicie el proceso de diseño de ARNg visualizando el gen objetivo en Benchling haciendo clic en Nuevo (+) > Secuencia de ADN > Importar secuencias de ADN.
- En la pestaña Importar desde base de datos, escriba el gen de interés, Pax6, y presione Buscar.
- Seleccione la compilación más reciente del genoma de referencia del ratón GRCm38 (mm10, Mus musculus) y pulse Importar.
- Seleccione el exón donde se puede diseñar el ARNg knock-out siguiendo las siguientes reglas:
- Evite poner un ARNg en el primer exón codificante, porque la célula puede usar sitios de inicio alternativos en exones posteriores para eludir el codón de parada inducido temprano.
- Diseñar ARNg en exones que estén presentes en todas las transcripciones alternativas que pueden ocurrir al empalmar el ARNm de Pax6 . Para garantizar esto, visualice Pax6 en el navegador del genoma Ensembl y seleccione el exón que se utiliza en todas las transcripciones.
- Para evitar aún más el empalme alternativo, apunte a un exón que tenga un codón incompleto (una o dos bases restantes de un triplete). Esto es de menor importancia, pero da más certeza sobre los efectos de los indeles inducidos. Para Pax6, el exón 4 al exón 11 son un buen objetivo. Además, elija un exón que contenga residuos de triptófano (W), glutamina (Q) o arginina (R).
NOTA: Los editores de bases estándar C > T que utilizan SpCas9 tienen una ventana de edición que abarca desde el nucleótido 4 hasta el nucleótido 8 desde el inicio del ARNg (más lejos del PAM). Los editores de bases C > T pueden introducir codones de parada en todos los residuos de triptófano (W) (TGG a TGA, TAG o TAA) con un ARNg en la cadena inversa, en residuos de glutamina (Q) (CAG a TAG o CAA a TAA) y, por último, en residuos de arginina (R) (CGA a TGA) en la cadena delantera.
- Seleccione el exón + 20 bases aguas arriba y aguas abajo. Haga clic en el lado derecho de la pantalla en el signo de destino CRISPR y haga clic en Diseñar y Analizar guías.
- En el menú recién abierto, en la pestaña Tipo de diseño, marque las Guías para "edición base" (Komor et al., 2016). Mantenga la longitud de la guía en 20 nucleótidos y, en Genoma para ratón, seleccione GRCm38 (mm10, Mus musculus).
- Después de hacer clic en el signo verde + , el programa de software detectará automáticamente todas las secuencias de motivos adyacentes al protoespaciador (PAM) y, en el lado derecho de la pantalla, creará una lista de todos los ARNg potenciales en el área alrededor del exón de interés.
- Desplácese por la lista hasta el signo de codón de parada (*) en un cuadro rojo, que indica un ARNg que potencialmente puede convertir un aminoácido en un codón de parada y, por lo tanto, resultar en un knock-out.
- En la primera columna a la derecha de la secuencia de ARNg, para cada objetivo "C" alrededor de la ventana de edición, se calculan las eficiencias de edición predichas in silico . Asegúrese de que la edición C > T que da como resultado el codón stop tenga una eficiencia de edición de al menos ~10.
- Haga clic en el valor de la columna Off-Target para comprobar a qué loci fuera del objetivo podría unirse el ARNg. Evite elegir un ARNg que se una a cualquier gen adicional para aumentar la especificidad. Por ejemplo, un buen gRNA para editar Pax6 con un editor base C > T apunta al exón 7 y es 5'-AAGCAACAGATGGGCGCAGA-3'.
- Cree una anotación en el archivo Benchling haciendo clic en el icono Anotaciones en la parte superior derecha de la pantalla, seguido de Nueva anotación. Asigne un nombre a la anotación y asegúrese de seleccionar la orientación correcta de ARNg en el menú desplegable Cadena.
- Generación de plásmidos de ARNg
NOTA: Hay varios vectores disponibles para la entrega de ARNg en organoides. El siguiente plásmido se utilizó como base para la construcción de ARNg: pFYF1320 (Addgene #47511, un amable regalo de Keith Joung).- Para clonar los gRNAs en pFYF1320, implemente una estrategia de PCR inversa utilizando el cebador directo estándar: "/5phos/ GTTTTAGAGCTAGAAATAGCAAGTTAAAATAAGGC. Para diseñar el cebador inverso, pegue el complemento inverso de la secuencia espaciadora de ARNg (verifique dos veces la orientación del ARNg [+ o - hebra]) delante de la siguiente parte universal del cebador inverso: CGGTGTGTGTCGTCCTTTCCACAAG. Para apuntar al exón 7 del ratón Pax6 usando el editor base C > T, el cebador inverso es el siguiente: TCTGCGCCCATCTGTTGCTTCGGTGTGTGTCCTTTCCCCACAAG. Ordene ambas imprimaciones.
- Ejecute una reacción de PCR inversa utilizando 1 ng de pFYF1320 como plantilla utilizando una ADN polimerasa de alta fidelidad durante 35 ciclos a una temperatura de recocido de 61 °C.
- Ejecute la reacción de PCR en un gel de agarosa al 1% en tampón TAE a 100 V durante ~ 45 min para visualizar el fragmento esperado de 2.281 pares de bases (pb). Realice una limpieza en gel utilizando el kit de su elección.
- Configure la siguiente reacción de ligadura: 100 ng de producto de PCR limpio, enzima Dpn1 para eliminar el ADN de plantilla inicial de pFYF1320 y ligasa T4. Incubar la mezcla durante 15 min a 20 °C, 30 min a 37 °C y 20 min a 80 °C.
- Transformar la mezcla de reacción en bacterias DH5α químicamente competentes y esparcir las bacterias en placas de agar que contienen ampicilina15.
- Al día siguiente, escoja y expanda tres colonias individuales en 3 ml de caldo de lisogenia (LB) medio suplementado con 50 μg/ml de ampicilina.
- Al día siguiente, realice una minipreparación en 1 ml de cada uno de los tres minicultivos utilizando un kit de minipreparación y almacene el resto a 4 °C. Someter el plásmido obtenido a la secuenciación de Sanger con el cebador U6_Forward para asegurarse de que el ARNg se inserta correctamente en el vector16.
- Después de identificar una sola colonia bacteriana con el plásmido correcto, inocular 500 μL del minicultivo correspondiente en 50 ml de LB suplementado con ampicilina para amplificar el ADN plásmido durante la noche. Realice una preparación midi el día después de usar un kit de midiprep. Este plásmido se utilizará para la electroporación en la sección 6.
6. Generación de clones de Pax6 KO
- Electroporación organoide
- Comience con organoides de ratón que se dividieron como máximo 5 días antes para que estén en un estado proliferativo. Use ~ 300-400 μL de gotas de organoides por knock-out. Incluya una condición adicional para seleccionar un control negativo que se electroporará sin ningún plásmido.
- Realice los pasos 2.1-2.4 para disociar los organoides, pero disocie los organoides por más tiempo para que sean células individuales. Deseche el sobrenadante.
- Resuspender las células en 80 μL del tampón de electroporación.
- En un tubo de 1,5 ml, preparar los siguientes plásmidos para un máximo de 20 μL: 2,5 μg de plásmido pFYF1320-gRNA, 2,8 μg de plásmido que contiene transposasa, 7,2 μg de plásmido que contiene transposón resistente a la higrogicina y 7,5 μg de pCMV_ABEmax_P2A_GFP.
NOTA: El plásmido pFYF1320-gRNA codifica el gRNA previamente diseñado, que guía el editor de bases al locus objetivo. El plásmido pCMV_ABEmax_P2A_GFP codifica el editor de bases, así como un reportero GFP, que se puede utilizar para monitorear las células que expresan el editor de bases después de la electroporación. El plásmido que contiene transposasa codifica la transposasa, que pega el casete de resistencia a la higromicina proporcionado por el plásmido que contiene transposón de resistencia a la higromicina en algún lugar al azar en el genoma. Las células que han incorporado este casete en su genoma se vuelven resistentes a la higromicina y pueden seleccionarse positivamente mediante la adición de higromicina. Como la co-incorporación de varios plásmidos es muy probable, la resistencia a la higrogicina constituye una selección funcional para enriquecer las células que han sido editadas para Pax6. - Agregue los plásmidos a las células y mezcle bien pipeteando hacia arriba y hacia abajo.
- Configure el electroporador con los siguientes parámetros para el pulso de poro (voltaje: 175 V; longitud del pulso: 5 ms; intervalo de pulso: 50 ms; número de pulsos: 2; tasa de desintegración: 10%; polaridad: +) y para el pulso de transferencia (voltaje: 20 V; longitud del pulso: 50 ms; intervalo de pulso: 50 ms; número de pulsos: 5; tasa de desintegración: 40%; polaridad: +/-).
- Coloque las células con los plásmidos en una cubeta de electroporación. Mida inmediatamente la resistencia (Ω), que debe estar entre 0.30 A y 0.55 A, y electroporate de inmediato. Realizar este paso rápidamente es necesario para evitar que las células se asienten en la parte inferior de la cubeta y reduzcan la eficiencia de electroporación.
- Transfiera las células a un tubo de 1,5 ml y agregue 400 μL de tampón de electroporación complementado con un inhibidor de la Rho-quinasa. Permita que las células se recuperen a RT durante 30 minutos.
- Granular las células a 500 x g durante 5 min, desechar el sobrenadante y colocar las células en 200 μL de ECM. Después de la solidificación, agregue el medio de expansión del mouse.
- Los organoides quísticos crecen después de 2-3 días. Monitoree diariamente la señal GFP, que revela la presencia del editor base C > T.
- Selección de organoides
- Después de ~ 3 días, cuando los organoides se hayan recuperado, agregue 100 μg / ml de higromicina al medio de expansión del ratón para seleccionar los organoides que han integrado el casete de resistencia a la higromicina. Existe una alta probabilidad de que las células que absorben un plásmido absorban varios plásmidos. Al seleccionar organoides resistentes a la higromicina, se enriquecen los organoides editados en el locus Pax6 .
- Cuando todas las células en el control negativo están muertas y los organoides sobrevivientes son ~ 300 μm, elija los organoides resistentes a la higromicina.
- Selección de organoides y genotipado
- Prepare puntas P20 estériles junto al microscopio y tubos de 1,5 ml que contengan 100 μL de solución de tripsina cada uno en hielo.
- Dobla una punta P20 con fórceps. Observe la placa que contiene los organoides sobrevivientes en un microscopio de sobremesa. Cuando un organoide sobreviviente esté enfocado, retire la tapa de la placa. Usando la punta P20 doblada y aún bajo el microscopio, aspire cada organoide sobreviviente individualmente y coloque cada uno de estos en un tubo separado que contenga solución de tripsina.
- Recoge hasta 20 clones. El número de clones a recoger depende del número de clones necesarios para cada diseño experimental y de la eficiencia de edición, que varía según cada ARNg y locus.
- Cuando se hayan recogido todos los clones, coloque los tubos de 1,5 ml en un baño maría a 37 °C durante un máximo de 5 minutos. Vortex cada tubo regularmente para aumentar la velocidad de disociación, y compruebe los organoides bajo el microscopio de sobremesa. Cuando los organoides se disocian en pequeños grupos y/o células individuales, detenga la digestión agregando 1 ml de medio base.
- Para cada clon seleccionado, mantenga ~ 400 μL para genotipar en un tubo separado de 1.5 ml. Girar los ~600 μL que quedan a 500 x g durante 5 min, retirar el sobrenadante, resuspender las células en 20 μL de ECM, colocarlas como una sola gota en un pocillo de una placa de 24 pocillos y añadir medio de expansión de ratón sin higromicina.
- Para genotipar los clones, gire hacia abajo los tubos que contienen ~ 400 μL de suspensión celular a 500 x g durante 5 min, retire el sobrenadante y resuspenda las células en 50 μL de tampón de extracción de ADN para extraer el ADN.
- Incubar inmediatamente las células de la siguiente manera: 6 min a 60 °C, vórtice, y 4 min a 95 °C. Este ADN se puede mantener hasta 7 días a -20 °C, pero realizar la PCR posterior inmediatamente es lo más óptimo.
- Para amplificar el locus objetivo con la nucleasa, realice una PCR en 2 μL del ADN extraído utilizando cebadores de genotipado adecuados ordenados de antemano y una polimerasa de baja fidelidad. Los cebadores de genotipado son AGACTGTTCCAGGATGGCTG (Pax6_C>T_F) y TCTCCTAGGTACTGGAAGCC (Pax6_C>T_R). El amplicón debe comenzar aproximadamente 100 pb desde el locus editado esperado para garantizar que se secuencie de manera eficiente.
- Ejecute el producto de PCR en un gel de agarosa para evaluar la eficacia de la PCR, como se mencionó en el paso 5.2.3. Cuando se detecte una banda del tamaño correcto, córtela del gel para realizar una extracción de gel de ADN utilizando un kit.
- Secuencie el ADN extraído de cada clon de organoide previamente recogido con los cebadores de genotipado.
- Alinear las secuencias obtenidas con el gen Pax6 en Benchling. Abra la secuencia de genes importados del paso 4.1. Haga clic en Alineaciones en el lado derecho y, a continuación, en Crear nueva alineación. Cargue los archivos .ab1 obtenidos del proveedor de secuenciación, seleccione ADN como tipo de nucleótido y pulse Siguiente.
- En la siguiente ventana, seleccione Multisecuencia y el programa de alineación Auto (MAFFT) antes de hacer clic en Crear alineación.
- Identificar los genotipos que tienen un codón de parada prematura homocigótica (como se obtiene con editores de base) en ambos alelos. Mantenga los clones de organoides correspondientes para expandirlos y criopreservarlos para su posterior análisis. Idealmente, se deben analizar tres clones de organoides diferentes uno al lado del otro para eludir los posibles efectos de nucleasa fuera del objetivo.
7. Trasplante ortotópico de organoides de la glándula lagrimal humana en ratones NSG
- Preparación de organoides
- Los organoides de la glándula lagrimal humana deben dividirse ~ 3 días antes del día del trasplante, como se describe en la sección 2. El día del trasplante, asegúrese de que los organoides estén en la fase proliferativa para aumentar las posibilidades de injerto.
- Para extraer los organoides de la ECM, añadir dispasa al medio de cultivo para alcanzar una concentración final de 0,125 U/mL. Con un P1.000, resuspenda completamente las gotas de ECM para interrumpirlas y vuelva a colocar la placa en la incubadora de 37 °C durante 30 min. Un volumen de 100 μL de ECM es suficiente para inyectar ~10 glándulas lagrimales.
- Resuspender los organoides en 10 ml de medio base para lavar la enzima. Granular las células a 400 x g durante 5 min.
- Resuspender las células (~1,500,000) en 50 μL de medio de expansión humano frío suplementado con 5% de ECM. Coloque la suspensión organoide sobre hielo y proceda inmediatamente al trasplante.
- Trasplante ortotópico en ratones
- En la instalación para animales, coloque la suspensión organoide y las agujas de insulina en hielo. Aspirar la suspensión organoide en una aguja de insulina fría.
- Sedar un ratón inmunodeficiente con gamma (NSG) NOD con isoflurano al 3% para iniciar la anestesia. Cuando el ratón esté dormido, colóquelo rápidamente de lado con la glándula lagrimal principal (ubicada a medio camino entre el ojo y el oído) accesible.
- Inyecte 5 μL de la suspensión organoide directamente a través de la piel en la glándula lagrimal. El volumen máximo que puede contener una glándula lagrimal de ratón es de 5 μL.
- Permita que el ratón se recupere y monitoree el ratón todos los días para evaluar la presencia de cualquier molestia relacionada con el trasplante, especialmente en el ojo.
- Evaluar el injerto
- Sacrificar el ratón con inhalación deO2/CO2 después de hasta 90 días, dependiendo de si se debe evaluar el injerto a corto o largo plazo13.
- Diseccionar la glándula lagrimal como se describe en la sección 1. Fijar en formalina al 4% durante 24 h en RT.
- Coloque la glándula lagrimal en un cassette. Deshidratar la glándula lagrimal incubándola de la siguiente manera: 2 h en etanol al 70%, 2 h en etanol al 96%, 1 h en etanol al 100% (2x), 2 h en xileno y durante la noche en parafina líquida a 58 °C en el horno.
- Al día siguiente, oriente la glándula lagrimal como se prefiera en un molde metálico, reméntela con parafina líquida y permita que el bloque se solidifique sobre una superficie fría. Este proceso se realiza mejor con una máquina de incrustación.
- Cuando el bloque de parafina esté sólido, corte todo el bloque en secciones de 4-5 μm con un micrótomo. Mantenga todas las secciones (en forma de cintas) en un ambiente seco y sin corrientes de aire. Las secciones se pueden mantener indefinidamente a temperatura ambiente.
- Muestree una de cada 10 secciones que abarcan todo el bloque.
- Monte las secciones en un tobogán de la siguiente manera: coloque una gota de agua en el tobogán, coloque la sección en la parte superior, déjela reposar durante ~ 2 minutos para permitir que se estire en una placa caliente a 42 ° C y retire el agua suavemente con papel.
- Colocar los portaobjetos a secar durante la noche en un horno a 58 °C. Las diapositivas se pueden mantener indefinidamente en RT más allá de esta etapa.
- Para distinguir las células humanas de las células de ratón, realice la tinción de antígenos nucleares humanos en estas secciones. Rehidratar las secciones realizando los siguientes lavados: 3 min en xileno (2x), 1 min en etanol al 100% (2x), 1 min cada uno en etanol al 96%, etanol al 90%, etanol al 80%, etanol al 70%, etanol al 60% y etanol al 25%, y finalmente, 1 min en agua demi (2x).
- Incubar las diapositivas durante 15 minutos en el búfer PO (Tabla suplementaria 1). Lave los toboganes 3 veces en agua ultrapura.
- Realizar una recuperación de antígenos basada en citrato en el autoclave:
- Coloque los portaobjetos en un portaportaobjetos a prueba de autoclave en una cesta llena de tampón de citrato (Tabla suplementaria 1). Coloque la cesta en el autoclave y ejecute un ciclo de autoclave (presión: 10 PSI; temperatura: 121 °C; tiempo: 15 min).
- Cuando el autoclave esté despresurizado, recupere la cesta que contiene los portaobjetos y colóquela en un baño de agua RT para llevar los portaobjetos a RT.
NOTA: La estrategia de recuperación de antígenos depende del anticuerpo utilizado. Consulte la hoja de datos del proveedor para realizar la recuperación de antígenos más adecuada.
- Coloque los portaobjetos horizontalmente, con el lado de la sección hacia arriba, en una bandeja de incubación. Añadir 500 μL de tampón de bloqueo que contenga 1% de albúmina sérica bovina (BSA) en PBS en la parte superior, e incubar durante 1 h. Retire el búfer de bloqueo.
- Preparar la solución de anticuerpos añadiendo 1 μL de antígeno-anticuerpo nucleolar humano a 500 μL de tampón de bloqueo por portaobjetos a teñir. Agregue la solución de anticuerpos a cada portaobjetos. Incubar durante la noche en una bandeja de incubación humidificada a 4 °C.
- Al día siguiente, lave las diapositivas 3 veces en PBS. Incubar los portaobjetos con el anticuerpo secundario HRP anti-ratón sin diluir durante 45 min. Lave las diapositivas 3 veces en PBS.
CAUTELA. En una campana química, prepare el tampón DAB (Tabla suplementaria 1). Incubar las diapositivas con el búfer DAB durante 10 minutos. Deseche cualquier material de desecho en contenedores de desechos líquidos químicos orgánicos. - Lave los toboganes con agua. Incubar los portaobjetos durante 2 min en hematoxilina para contrarrestar los núcleos. Lave los toboganes con agua corriente del grifo durante 10 minutos.
- Deshidrate los portaobjetos incubándolos durante 1 minuto cada uno en etanol al 50%, etanol al 60%, etanol al 70%, etanol al 80% y etanol al 90%, 1 minuto al etanol al 96% (2x), 1 minuto al etanol al 100% (2x) y 1 minuto al xileno (2x).
- Encierre las guías con un medio de montaje y un cubreobjetos. Después de secar durante unos 20 minutos, observe los portaobjetos bajo un microscopio.
Resultados
Tras la disección de la glándula lagrimal del ratón (Figura 2A), la digestión enzimática y mecánica generó pequeños fragmentos de tejido, entre los que se podían distinguir los acinos y los conductos (Figura 2B). Los pedazos grandes restantes de tejido desestabilizarían la ECM, lo que reduciría el crecimiento inicial de los organoides. La derivación del organoide de la glándula lagrimal de ratón fue exitosa cuando se encontraron organoides quísticos de ~ 500 μm de diámetro después de ~ 7 días, la etapa en la que los organoides estaban listos para ser divididos (Figura 2C). Incluso si la derivación general del organoide es exitosa, algunos organoides pueden comenzar a crecer antes de detenerse eventualmente. Los organoides de la glándula lagrimal humana crecieron como quistes en 3-4 días y alcanzaron su tamaño completo en 10-14 días después del aislamiento del tejido (Figura 2D). Tanto para ratones como para humanos, la derivación de organoides a veces fallaba, con ningún o pocos organoides creciendo; Esto generalmente fue causado por la digestión excesiva del tejido. Los organoides de la glándula lagrimal del ratón podrían pasar al menos 40x y los organoides humanos al menos 20x. El paso se realizó cada 7-10 días en promedio, dependiendo del crecimiento del organoide.

Figura 2: Establecimiento de organoides de ratón y glándula lagrimal humana. (A) Fotografías de las diferentes etapas de la disección de la glándula lagrimal del ratón. La flecha apunta a la glándula lagrimal debajo de su membrana protectora. (B) Imágenes de campo claro de células de la glándula lagrimal del ratón justo después de la digestión del tejido, con recuadros que muestran un acino y un conducto. (C) Imágenes de campo claro de una derivación exitosa y fallida del organoide de la glándula lagrimal del ratón. (D) Imágenes de campo claro del crecimiento de organoides humanos en el transcurso de 14 días. Haga clic aquí para ver una versión más grande de esta figura.
Los organoides de la glándula lagrimal contienen una gran proporción de células madre cuando se cultivan en el medio de expansión. Para aumentar su nivel de diferenciación, configuramos un ratón y un medio de diferenciación humano con un contenido reducido de factor de crecimiento. Después de 5 días y 7 días, respectivamente, en el medio de diferenciación, los organoides de la glándula lagrimal humana y del ratón se volvieron más densos (Figura 3A-B). Este cambio morfológico se correlacionó con el aumento de las propiedades funcionales. La aplicación del activador cíclico de AMP forskolina o el neurotransmisor norepinefrina resultó en hinchazón organoide (es decir, secreción de agua apical) en menos de 3 h (Figura 3C). Cuando la hinchazón tomó más de 3-4 h, esto sugirió que los organoides no estaban lo suficientemente diferenciados y / o no expresaban marcadores funcionales, como receptores para neurotransmisores.
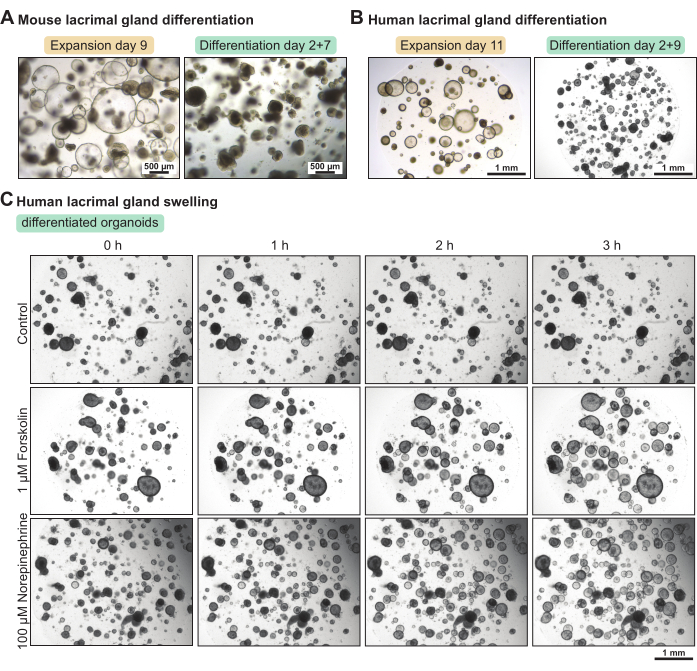
Figura 3: Diferenciación de organoides de ratón y glándula lagrimal humana y ensayo de hinchazón funcional en organoides humanos. (A) Imágenes de campo claro de organoides de glándula lagrimal de ratón cultivados en medio de expansión durante 7 días y en medio de diferenciación durante 5 días después de 2 días en medio de expansión. (B) Imágenes de campo claro de organoides de glándulas lagrimales humanas cultivadas en medio de expansión durante 11 días y en medio de diferenciación durante 9 días después de 2 días en medio de expansión. (C) Imágenes de campo claro de organoides diferenciados de la glándula lagrimal humana expuestos a medio de diferenciación fresco (control), a 1 μM de forskolina y a 100 μM de norepinefrina en el transcurso de 3 h. Haga clic aquí para ver una versión más grande de esta figura.
Para eliminar Pax6 en organoides de glándulas lagrimales de ratón, se generó un plásmido que contenía el ARNg dirigido a Pax6 elegido mediante PCR y ligadura (Figura 4A). Este plásmido que contiene ARNg se electropórrió junto con los plásmidos Piggy-Bac (plásmidos que contienen transposones y transposasa de resistencia a la higrogicina) y el editor de bases C > T Cas9 en organoides de glándulas lagrimales de ratón disociados en células individuales. Después de 3 días, cuando los organoides se habían recuperado, fueron expuestos a la higrogicina para seleccionar clones que habían incorporado el casete de resistencia a la higrogicina. En electroporaciones exitosas, los organoides resistentes a la higrogicina crecieron (Figura 4B). Los clones de organoides en crecimiento que eran mayores de ~ 300 μm fueron escogidos, idealmente antes de que comenzaran a diferenciarse espontáneamente (Figura 4C). El ADN se extrajo de parte del organoide mientras se mantenía el resto en cultivo. La amplificación por PCR del locus Pax6 al que se dirige el ARNg produjo una banda de 367 pb para cada uno de los clones seleccionados (Figura 4D). Después de secuenciar el locus amplificado, se mantuvieron clones que fueron homocigóticamente C > T editados (n = 1). Por otro lado, los clones que no fueron editados (n = 4), editados heterocígicamente o mal editados (n = 1) fueron descartados (Figura 4E). En general, utilizando este ARNg dirigido a Pax6, se obtuvo un clon homocigótico de la glándula lagrimal de ratón knock-out de seis secuenciados. Algunos clones crecieron bien, pero algunos clones de organoides se perdieron después de la recolección o comenzaron a diferenciarse (Figura 4F). De los 10 clones de organoides elegidos, 7 crecieron bien.
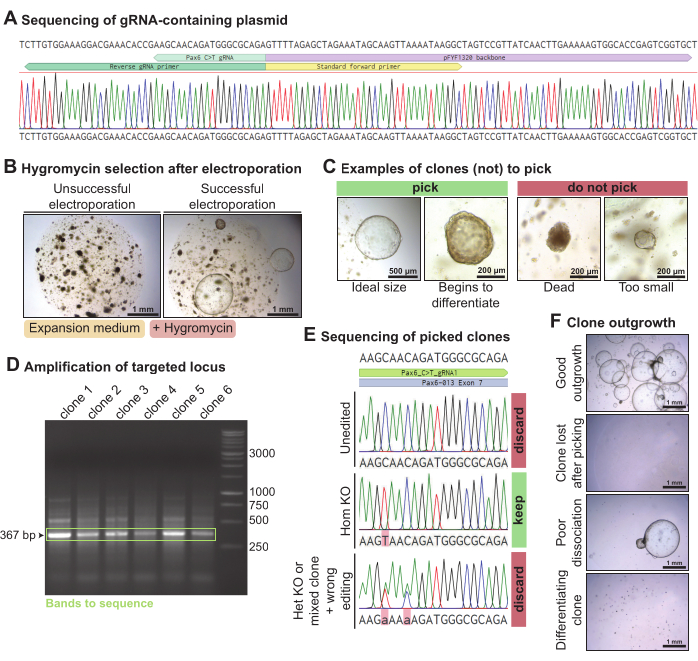
Figura 4: Knock-out mediado por edición de base de Pax6 en organoides de glándula lagrimal de ratón. (A) Traza de secuenciación de Sanger de pFYF1320 después de la correcta integración del ARNg dirigido al locus Pax6. (B) Imágenes de campo claro de organoides de la glándula lagrimal de ratón 5 días después de la exposición a la higromicina después de la electroporación. Los organoides fueron cultivados en medio de expansión de ratón. A la izquierda hay un ejemplo de una electroporación fallida, sin ningún clon resistente a la higromicina en crecimiento. A la derecha hay un ejemplo de una electroporación exitosa, con varios clones de organoides resistentes a la higromicina que sobreviven. (C) Imágenes de campo claro de clones que deben ser recogidos y clones que no deben ser recogidos. (D) Gel de agarosa que muestra la amplificación del locus Pax6 dirigido con el ARNg. En verde, se resalta la banda del tamaño esperado de 367 pb. (E) Rastro de secuenciación de Sanger de tres clones de organoides que eran resistentes a la higromicina. El clon superior no está editado. El clon del medio es una edición homocigótica C > T y, por lo tanto, un knock-out homocigoto. El clon inferior presenta dos mutaciones puntuales heterocigotas y es un knock-out heterocigótico o un clon mixto y ha sido editado erróneamente. (F) Imágenes de campo claro de los clones de organoides seleccionados con varios niveles de crecimiento. Haga clic aquí para ver una versión más grande de esta figura.
Por último, para realizar el trasplante ortotópico de organoides de la glándula lagrimal humana en ratones, se utilizaron organoides que se dividieron con 3 días de anticipación (< 100 μm de diámetro). El injerto de organoides se confirmó 1 mes después de inyectar los organoides en la glándula lagrimal del ratón mediante tinción de un marcador específico para humanos, el antígeno nucleolar humano (Figura 5). La ausencia de tinción puntiaguda de todas las secciones de la glándula lagrimal del ratón significó una falta de injerto de organoide humano.
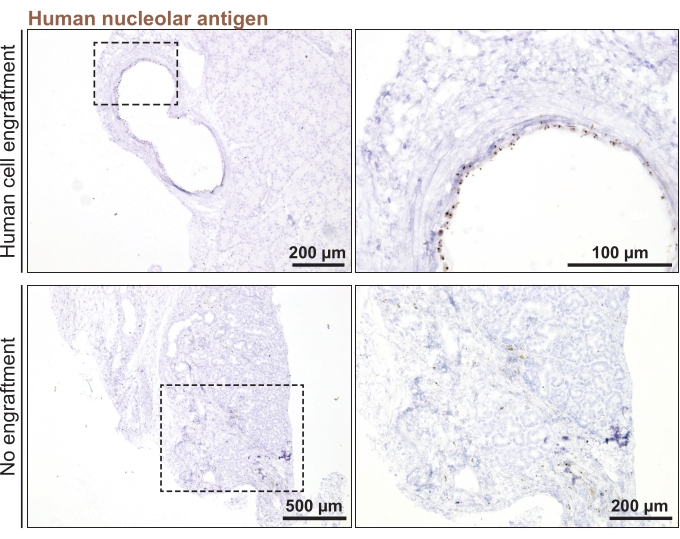
Figura 5: Trasplante de organoides de la glándula lagrimal humana en la glándula lagrimal del ratón. Tinción de glándulas lagrimales de ratón trasplantadas para el marcador nucleolar humano para monitorear el injerto 1 mes después del trasplante. Haga clic aquí para ver una versión más grande de esta figura.
Cuadro complementario 1: Composición de los medios y buffers. Haga clic aquí para descargar esta tabla.
Discusión
Este protocolo describe el establecimiento y uso de organoides de la glándula lagrimal para ensayos funcionales, modelado de mutaciones y trasplante. Al establecer organoides de ratón y glándula lagrimal humana, la disociación tisular es crucial. Si el tejido no se digiere lo suficiente, el rendimiento del organoide será bajo. Si el tejido se digiere en exceso, las células morirán y no crecerán como organoides. Cada tejido debe ser digerido con una enzima específica durante un tiempo específico para asegurar un crecimiento óptimo de los organoides14,17,18. La glándula lagrimal es un tejido bastante blando para el cual una digestión de colagenasa de 5-10 min combinada con disociación mecánica basada en pipeteo es suficiente para aislar pequeños trozos de tejido. Si es necesario obtener células individuales para aplicaciones como la secuenciación de ARN de una sola célula, la disociación puede llevarse a cabo durante más tiempo hasta que se alcance la etapa de una sola célula, pero la disociación debe detenerse tan pronto como se obtengan células individuales para limitar cualquier disminución en la viabilidad. Como la disociación tisular es tan crucial, la digestión excesiva es la razón más probable del fracaso del establecimiento de organoides de la glándula lagrimal.
El mantenimiento adecuado de los organoides de la glándula lagrimal es importante para su uso. El mantenimiento a largo plazo es un sello distintivo de los organoides de la glándula lagrimal derivados de células madre adultas, en comparación con los organoides derivados de células madre pluripotentes inducidas 7,17. Para lograr un mantenimiento a largo plazo, se debe realizar una división regular de organoides y cambios medios. Sin esto, los organoides comienzan a diferenciarse y desarrollar un potencial de células madre disminuido, lo que dificulta su mantenimiento a largo plazo7. En este paso nuevamente, la digestión excesiva puede matar las células madre y perjudicar el mantenimiento de los organoides. Para el mantenimiento regular, no se requiere la disociación de organoides en células individuales. Sin embargo, para generar líneas de organoides clonales knock-out, es fundamental comenzar con células individuales. De lo contrario, los organoides estarán constituidos por un mosaico de células con diferentes antecedentes genéticos, lo que imposibilita analizar el efecto de una única mutación definida. Aquí, describimos el uso de un editor base C > T para generar codones de parada. Este editor del genoma se basa en la presencia de codones de arginina, glutamina o triptófano dentro de 12-18 bases de un NGG PAM. Cuando estas condiciones no se cumplen en el diseño de un ARNg, se pueden utilizar editores de bases Cas9 o C >T convencionales con PAM alternativos 7,18. Sin embargo, el Cas9 convencional introduce roturas de doble cadena que resultan en indeles al reparar11. Como ambos alelos pueden albergar diferentes indeles, el genotipado de clones requiere precaución adicional. La deconvolución de las modificaciones introducidas debe realizarse para asegurar que ambos alelos contienen indeles fuera de marco y, por lo tanto, que los clones organoides son eliminados para el gen objetivo19. La ventaja de los editores de bases C > T radica en el hecho de que pueden usarse para modelar mutaciones puntuales que no necesariamente resultan en codones de parada. Por ejemplo, se pueden utilizar para modelar mutaciones específicas de Pax6 encontradas en pacientes con aniridia para estudiar su impacto en la fisiología de la glándula lagrimal20.
La glándula lagrimal secreta la parte acuosa de la película lagrimal1. La secreción lagrimal puede recapitularse en organoides humanos después de la diferenciación mediada por la retirada del factor de crecimiento y la inhibición de NOTCH. En estas condiciones, los organoides experimentan diferenciación terminal y no pueden mantenerse más. Sin embargo, los organoides diferenciados de la glándula lagrimal pueden guiar el desarrollo de fármacos inductores de lagrimeo en el contexto de la enfermedad del ojo seco, potencialmente en pantallas de alto rendimiento. El ensayo de desgarro presentado en este protocolo es el que actualmente da el mayor cambio en el tamaño del organoide en un corto período de tiempo, lo que facilita su cuantificación en el contexto de un cribado de drogas 7,9,17.
La terapia con células madre es muy prometedora para la regeneración de la glándula lagrimal en la enfermedad del ojo seco21. Los organoides de glándulas lagrimales derivados de células madre adultas podrían ser un material de origen para tales aplicaciones. El protocolo presentado aquí da como resultado un injerto de organoides de la glándula lagrimal humana, principalmente como quistes. El injerto de organoides bajo puede surgir debido a que los organoides se inyectan en el sitio equivocado. El entrenamiento del procedimiento de inyección con un tinte permite el seguimiento del lugar de inyección y, en última instancia, mejora la precisión de la inyección. Alternativamente, la epidermis del ratón puede ser incisa para tener acceso directo a la glándula lagrimal, como se hizo en ratas antes de los22 años. Este método lleva más tiempo, pero puede ser más preciso. Por otro lado, con el protocolo actual, los organoides no se integraron funcionalmente en la glándula lagrimal del ratón. Se han observado resultados similares para el injerto de glándula lagrimal derivado de iPSC22. El método de trasplante podría mejorarse aún más hiriendo la glándula lagrimal por adelantado, utilizando un modelo de ratón de ojo seco y / o inyectando los organoides como células individuales o pequeños grupos. Sin embargo, los organoides de la glándula lagrimal derivados de células madre adultas y el conjunto de herramientas relacionado pueden ser la base de futuras aplicaciones en la investigación de la glándula lagrimal y la medicina regenerativa.
Divulgaciones
Hans Clevers es el jefe de Investigación Farmacéutica y Desarrollo Temprano en Roche, Basilea, y posee varias patentes relacionadas con la tecnología de organoides.
Agradecimientos
Agradecemos a Yorick Post por el desarrollo inicial del protocolo. Este trabajo fue apoyado en parte por un premio del Cancer Research UK Grand Challenge (C6307 / A29058) y la Fundación Mark para la Investigación del Cáncer al equipo de SPECIFICANCER.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL safe-lock centrifuge tubes | Eppendorf | EP0030 120.094 | |
| 3,3′-Diaminobenzidine tetrahydrochloride hydrate (DAB) | Sigma-Aldrich | D5637 | CAS: 868272-85-9 , CAUTION, 6 g/L solution can be stored aliquotted at -20 °C |
| 5x green GoTaq Flexi buffer | Promega | M891A | Store at -20 °C |
| A83-01 | Tocris | 2939 | Store at -20 °C, stock at 30 mM, 10000x |
| Advanced DMEM/F12 | Invitrogen | 12634-010 | store at 4 °C |
| Agar plates containing Ampicillin | Hubrecht Institute | ||
| Ampicillin sodium salt | Sigma-Aldrich | A9518 | |
| Autoclave VAPOUR-Line lite | VWR chemicals | ||
| B27 supplement | Invitrogen | 17504-044 | Store at -20 °C, 50x |
| BD Micro-Fine insulin needle 1 mL | BD Bioscience | 324825 | |
| Benchtop microscope DMI1 | Leica | ||
| Bovine serum albumine (BSA) | MP biomedicals | 160069 | Store at 4 °C |
| BTXpress | BTX | MDS450805 | |
| C57BL/6 mice | Hubrecht Institute | ||
| Cassettes | Klinipath | 410-02S | |
| CellBanker 1 | amsbio | 11910 | Cryopreservation medium, adhere to instructions |
| Centrifuge | Eppendorf | ||
| Citric acid monohydrate | J.T. Baker | 0088 | CAS: 5949-29-1 |
| Collagenase I | Sigma Aldrich | C9407 | Aliquots at 20 mg/mL, 20x, store at -20 °C |
| Conical tubes 15 mL | Greiner Bio-One | 5618-8271 | |
| Conical tubes 50 mL | Corning | CLS430828-500EA | |
| Coverslips 24 mm x 50 mm | Menzel-Gläzer | BB024050S1 | |
| Cultrex Basement Membrane Extract (BME), Growth Factor Reduced, Type 2 - extracellular matrix | R&D Systems, Bio-Techne | 3533-001-02 | Store at -20 °C, keep at 4 °C for up to 1 month |
| DAPT | Sigma Aldrich | D5942 | Store at -20 °C, stock at 10 mM, 1000x |
| Disodium hydrogen phosphate anhydrous | VWR chemicals | 28026.292 | CAS: 7558-79-4 |
| Di-sodiumhydrogenphosphate dihydrate | Sigma-Aldrich | 71643 | CAS:10028-24-7 |
| Dispase | ThermoFisher Scientific | 17105-041 | Aliquots at 50 U/mL, store at -20 °C until use, 400x |
| Disposable Scalpel Sterile N° 10 | Swann Morton | 3033838 | |
| DM4000 microscope | Leica | ||
| dNTPs 25 mM | Promega | U1420 | Mix all 4 nucleotides together, Store at -20 °C |
| Dpn1 | New England Biolabs | R0176 | |
| Dulbecco's Phosphate-bufferd Saline (DPBS) | Gibco | 14190144 | 1x |
| Easy strainers 70 µm | Greiner | 542170 | |
| Electroporation cuvette | Nepagene | EC002S | |
| EnVision+/HRP mouse | Agilent | K400111-2 | |
| Ethanol 100% | BOOM | 84045206;5000 | CAUTION, Use to prepare other Ethanol dilutions |
| Ethanol 70% | BOOM | 84010059.5000 | CAUTION |
| Ethanol 96% | BOOM | 84050065.5000 | CAUTION |
| EVOS FL Auto 2 Cell Imaging System | ThermoFisher Scientific | Live-imaging brightfield microscrope | |
| FGF10 | Peprotech | 100-26 | Store at -20 °C, stock at 100 mg/mL in base medium, 100x |
| Fiji | NIH, Fiji developers | ||
| Formaldehyde solution 4% | Sigma-Aldrich | 1.00496 | CAS: 50-00-0, CAUTION |
| Forskolin | Tocris | 1099 | Store at -20 °C, stock at 10 mM, 10000x |
| Glutamax | Gibco | 35050-061 | 100x |
| GoTaq G2 Flexi DNA Polymerase | Promega | M7805 | Store at -20 °C |
| Haematoxylin | VWR chemicals | 10047105 | Store at room temperature |
| HEPES | Gibco | 15630-080 | Store at 4 °C, 100x |
| Histocore H and C, Tissue embedding machine | Leica | ||
| Hot plate | Meidax | ||
| Human nucleolar antigen antibody | Abcam | ab-190710 | |
| Hydrochloric acid 5 N | ThermoFisher Scientific | 10605882 | CAS: 7647-01-0, CAUTION |
| Hydrogen peroxyde 30% | Chem-lab | CL00.2308.1000 | CAS: 7722-84-1, CAUTION |
| Hygromycin B-gold | InvivoGen | ant-hg | Stock at 100 mg/µL, 1000x |
| Hygromycin resistance cassette-containing plasmid | Andersson-Rolf et al, Nature Methods, 2017. doi: 10.1038/nmeth.4156 | ||
| IsoFlo 100% | Mecan | 5960501 | |
| LB medium | Hubrecht Institute | ||
| MgCl2 25 mM | Promega | A351H | Store at -20 °C |
| Microtome RM2235 | Leica | ||
| Midiprep DNA isolation kit | ThermoFisher Scientific | K210005 | |
| Miniprep DNA isolation kit | ThermoFisher scientific | K210003 | |
| N-acetylcysteine | Sigma Aldrich | A9165 | Store at -20 °C, stock at 500 mM, 400x |
| NEPA21 electroporator | Nepagene | ||
| Nicotinamide | Sigma Aldrich | N0636 | Store at -20 °C, stock at 1M, 100x |
| NOD Scid Gamma (NSG) mice | Hubrecht Institute colony | ||
| Noggin conditioned medium | U-Protein Express | Custom order | Store at -20 °C |
| Noradrenaline | Sigma Aldrich | A7257 | Store at -20 °C, stock at 100 mM |
| Oven | Memmert | Set at 58 °C | |
| P20, P200 and P1000 pipettes | Gilson | ||
| Paraffin | VWR chemicals | 10048502 | |
| Pasteur pipettes, glass plugged | ThermoFisher Scientific | 1150-6973 | |
| Pax6_C>T_F: AGACTGTTCCAGGATGGCTG | IDT | ||
| Pax6_C>T_R: TCTCCTAGGTACTGGAAGCC | IDT | ||
| pCMV_ABEmax_P2A_GFP | Addgene | 112101 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | Store at -20 °C |
| Pertex | Klinipath | AM-08010 | |
| pFYF1320 | Addgene | 47511 | |
| Primocin | InvivoGen | ant-pm-1 | 1000X, store at -20 °C |
| Prostaglandin E2 (PGE2) | Tocris | 2296 | Store at -20 °C, stock at 10 mM, 10000x |
| Petri dish, 10 cm | Greiner | 633102 | |
| Q5 buffer | New England Biolabs | B9027S | |
| Q5 high-fidelity DNA polymerase | New England Biolabs | M0491S | |
| QIAquick Gel Extraction Kit | Qiagen | 28704 | |
| QuickExtract DNA Extraction Solution | Lucigen | QE09050 | Store aliquots at -20 °C |
| R-spondin 3 conditioned medium | U-Protein Express | Custom order | Store at -20 °C |
| sgRNA Reverse Primer: TCTGCGCCCATCTGTTGCTT CGGTGTTTCGTCCTTTCCACAAG | IDT | ||
| Slides | StarFrost | MBB-0302-55A | Adhesive, ground |
| Sodium azide | Merck | 8.22335.1000 | CAS: 26628-22-8, CAUTION |
| Sodium cytrate dihydrate | J.T. Baker | 0280 | CAS: 6132-04-3 |
| Standard Forward Primer: “/5phos/ GTTTTAGAGCTAGAAATAGCAAG TTAAAATAAGGC | IDT | ||
| Subcloning efficiency competent cells DH5alpha | Invitrogen | 18265-017 | |
| Suspension cell culture plates (24-well) | Greiner Bio-One | 662102 | 24-well |
| Suspension cell culture plates (12-well) | Greiner Bio-One | 665102 | 12-well |
| T4 DNA ligase | New England Biolabs | M0202 | |
| TAE buffer | ThermoFisher Scientific | B49 | Stock at 50x, dilute to 1x with ultrapure water |
| Transposase-containing plasmid | Andersson-Rolf et al, Nature Methods, 2017. doi: 10.1038/nmeth.4156 | ||
| TrypLE Express Enzyme | Invitrogen | 12605-028 | store at 4 °C |
| U6_Forward primer: GGGCAGGAAGAGGGCCTAT | IDT | ||
| UltraPure Agarose 1000 | Invitrogen | 16550 | |
| Water bath | Tulabo | ||
| Xylene | Klinipath | 4055-9005 | CAS: 1330-20-7, CAUTION |
| Y-27632 | Abmole Bioscience | Y-27632 dihydrochloride | Store at -20 °C, stock at 10 mM, 1000x |
Referencias
- Garg, A., Zhang, X. Lacrimal gland development: From signaling interactions to regenerative medicine. Developmental Dynamics. 246 (12), 970-980 (2017).
- Selinger, D. S., Selinger, R. C., Reed, W. P. Resistance to infection of the external eye: The role of tears. Survey of Ophthalmology. 24 (1), 33-38 (1979).
- Messmer, E. M. The pathophysiology, diagnosis, and treatment of dry eye disease. Deutsches Arzteblatt International. 112 (5), 71-81 (2015).
- Massie, I., et al. Development of lacrimal gland spheroids for lacrimal gland tissue regeneration. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2001-2009 (2018).
- Tiwari, S., et al. Establishing human lacrimal gland cultures with secretory function. PloS One. 7 (1), 29458(2012).
- Nguyen, D. H., Beuerman, R. W., Halbert, C. L., Ma, Q., Sun, G. Characterization of immortalized rabbit lacrimal gland epithelial cells. In Vitro Cellular & Developmental Biology. Animal. 35 (4), 198-204 (1999).
- Bannier-Hélaouët, M., et al. Exploring the human lacrimal gland using organoids and single-cell sequencing. Cell Stem Cell. 28 (7), 1221-1232 (2021).
- Hayashi, R., et al. Generation of 3D lacrimal gland organoids from human pluripotent stem cells. Nature. 605 (7908), 126-131 (2022).
- Jeong, S. Y., et al. Establishment of functional epithelial organoids from human lacrimal glands. Stem Cell Research & Therapy. 12 (1), 247(2021).
- Hofer, M., Lutolf, M. P. Engineering organoids. Nature Reviews Materials. 6 (5), 402-420 (2021).
- Meyenberg, M., Ferreira da Silva, J., Loizou, J. I. Tissue specific DNA repair outcomes shape the landscape of genome editing. Frontiers in Genetics. 12, 728520(2021).
- Geurts, M. H., et al. CRISPR-based adenine editors correct nonsense mutations in a cystic fibrosis organoid biobank. Cell Stem Cell. 26 (4), 503-510 (2020).
- Overmyer, K. A., Thonusin, C., Qi, N. R., Burant, C. F., Evans, C. R. Impact of anesthesia and euthanasia on metabolomics of mammalian tissues: Studies in a C57BL/6J mouse model. PLoS One. 10 (2), 0117232(2015).
- Driehuis, E., et al. Oral mucosal organoids as a potential platform for personalized cancer therapy. Cancer Discovery. 9 (7), 852-871 (2019).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. Journal of Visualized Experiments. (6), e253(2007).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Lian, J., Meng, X., Zhang, X., Hu, H. Establishment and genetic manipulation of murine hepatocyte organoids. Journal of Visualized Experiments. (180), e62438(2022).
- Lõhmussaar, K., et al. Patient-derived organoids model cervical tissue dynamics and viral oncogenesis in cervical cancer. Cell Stem Cell. 28 (8), 1380-1396 (2021).
- Bloh, K., et al. Deconvolution of complex DNA repair (DECODR): Establishing a novel deconvolution algorithm for comprehensive analysis of CRISPR-edited Sanger sequencing data. The CRISPR Journal. 4 (1), 120-131 (2021).
- Latta, L., et al. Pathophysiology of aniridia-associated keratopathy: Developmental aspects and unanswered questions. The Ocular Surface. 22, 245-266 (2021).
- Veernala, I., et al. Lacrimal gland regeneration: The unmet challenges and promise for dry eye therapy. The Ocular Surface. 25, 129-141 (2022).
- Hayashi, R., et al. Generation of 3D lacrimal gland organoids from human pluripotent stem cells. Nature. 605 (7908), 126-131 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados