Method Article
Выделение популяций стволовых клеток в состоянии покоя из отдельных скелетных мышц
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает выделение мышечных стволовых клеток и фиброзно-адипогенных предшественников из отдельных скелетных мышц у мышей. Протокол включает в себя рассечение одной мышцы, выделение стволовых клеток путем сортировки клеток, активированных флуоресценцией, оценку чистоты путем иммунофлуоресцентного окрашивания и количественное измерение входа в S-фазу с помощью анализа включения 5-этинил-2'-дезоксиуридина.
Аннотация
Скелетные мышцы содержат различные популяции взрослых стволовых клеток, которые способствуют гомеостазу и восстановлению ткани. Стволовые клетки скелетных мышц (MuSC) обладают способностью создавать новые мышцы, тогда как фиброзно-адипогенные предшественники (FAP) вносят свой вклад в стромальные поддерживающие ткани и обладают способностью создавать фибробласты и адипоциты. Как MuSC, так и FAP находятся в состоянии длительного обратимого выхода из клеточного цикла, называемого покоем. Состояние покоя является ключом к их функции. Спокойные стволовые клетки обычно очищаются от нескольких мышечных тканей, объединенных вместе в одном образце. Однако недавние исследования выявили явные различия в молекулярных профилях и глубине покоя MuSC, выделенных из разных мышц. В настоящем протоколе описывается выделение и изучение MuSC и FAP из отдельных скелетных мышц и представлены стратегии проведения молекулярного анализа активации стволовых клеток. В нем подробно описывается, как изолировать и переваривать мышцы различного происхождения развития, толщины и функций, такие как диафрагма, трицепс, грацилис, передняя большеберцовая кость (TA), икроножная мышца (GA), камбаловидная мышца, длинный разгибатель пальцев (EDL) и жевательные мышцы. MuSC и FAP очищают с помощью флуоресцентно-активированной сортировки клеток (FACS) и анализируют с помощью иммунофлуоресцентного окрашивания и анализа включения 5-этинил-2'-дезоксиуридина (EdU).
Введение
Скелетные мышцы обладают высокой способностью к регенерации благодаря наличию мышечных стволовых клеток (MuSC). MuSC расположены на миофибрах, под базальной пластинкой, и находятся в состоянии покоя с длительным обратимым выходомиз клеточного цикла 1,2,3,4. При повреждении MuSC активируются и вступают в клеточный цикл, образуя амплифицирующие предшественники, которые могут дифференцироваться и сливаться с образованием новых миоволокон 2,5. Предыдущая работа показала, что MuSC абсолютно необходимы для регенерации мышц 6,7,8. Более того, один MuSC может приживаться и генерировать как новые стволовые клетки, так и новые миоволокна9. Скелетные мышцы также содержат популяцию мезенхимальных стромальных клеток, называемых фиброадипогенными предшественниками (FAP), которые играют решающую роль в поддержке функции MuSC во время регенерации мышц 6,10,11,12.
Из-за их способности координировать регенерацию мышц существует огромный интерес к пониманию того, как работают MuSC и FAP. Покоившиеся MuSC отмечены экспрессией транскрипционных факторов Pax7 и Sprouty1, а также рецептора кальцитонина белка клеточной поверхности, тогда как покоящиеся FAP отмечены рецептором альфа-фактора роста, полученным из тромбоцитов белка клеточной поверхности (PDGFRa)10,12,13,14,15. Предыдущие исследования показали, что MuSC и FAP могут быть очищены от скелетных мышц с использованием маркеров клеточной поверхности и флуоресцентно-активированной сортировки клеток (FACS)9,15,16,17,18,19,20,21. Несмотря на то, что эти протоколы значительно расширили возможности изучения MuSC и FAP, одним из недостатков является то, что большинство этих протоколов требуют выделения MuSC из пула различных мышечных тканей. Недавняя работа, проведенная нами и другими, выявила различия в фенотипе клеток и уровнях экспрессии генов между MuSC, выделенными из разных тканей22,23. MuSC диафрагмы, трицепса и грацилиса демонстрируют более быструю активацию, чем MuSC из мышц нижних задних конечностей 22, в то время как MuSC из экстраокулярной мышцы демонстрируют более быструю дифференцировку, чем MuSC из мышц диафрагмы и нижних мышцзадних конечностей23.
Этот протокол описывает выделение MuSC и FAP из отдельных скелетных мышц (рис. 1). Это включает в себя рассечение диафрагмы, трицепса, грацилиса, передней большеберцовой кости (ТА), камбаловидной мышцы, длинного разгибателя пальцев (EDL), икроножной мышцы (GA) и жевательных мышц. Рассеченные мышцы впоследствии диссоциируют путем ферментативного расщепления с использованием коллагеназы II (протеаза, которая специфически нацелена на аминокислотную последовательность Pro-X-Gly-Pro в коллагене, обеспечивая деградацию соединительной ткани и диссоциациютканей 24) и диспазу (протеаза, которая расщепляет фибронектин и коллаген IV, обеспечивая дальнейшую диссоциациюклеток 25). MuSC и FAP выделяются из одноклеточных суспензий с помощью FACS. В качестве примеров последующих анализов для клеточного анализа активация стволовых клеток определяется путем анализа включения 5-этинил-2'-дезоксиуридина (EdU), в то время как чистота клеток определяется иммунофлуоресцентным окрашиванием для специфических маркеров клеточного типа Pax7 и PDGFRa.
протокол
Настоящий протокол был выполнен в соответствии с руководящими принципами по уходу за животными в Орхусском университете и местными правилами этики.
ПРИМЕЧАНИЕ: Обязательно соблюдайте правила местного этического комитета по экспериментам на животных и обращению с посмертными образцами грызунов. Мыши являются потенциальным источником аллергенов; Если возможно, включите вытяжную вентиляцию и разместите ее над рабочим местом, чтобы избежать чрезмерного воздействия аллергенов. В качестве альтернативы наденьте маску для лица, если эксперимент проводится регулярно. Этот протокол предполагает работу с острыми предметами, и исследователям рекомендуется ознакомиться с процедурами и логистикой оказания первой помощи в случае пореза.
1. Подготовка (1-2 ч; за день до вскрытия)
ПРИМЕЧАНИЕ: Растворы, планшеты и среды готовятся в стерильных условиях и фильтруются (0,45 мкм) перед использованием, если не указано иное. Приготовьте исходные растворы диспазы (11 ЕД/мл в PBS) и коллагеназы II (1.000 ЕД/мл в PBS) и храните их при -20 °C (таблица 1). Запасы размораживают и используют для вторичного сбраживания на этапе 4.2.6.
- Коллагеновое покрытие 96-луночной половинной пластины
- Приготовьте кислую воду. Добавьте 5,15 мл ледяной уксусной кислоты к 895 мл автоклавной воды в стакане объемом 2 л.
- Отфильтруйте раствор с помощью фильтрующего блока 0,45 мкм объемом 500 мл. Перелейте 800 мл фильтрованной кислой воды в бутылку объемом 1 л.
- Добавьте во флакон 40 мл стерильного раствора коллагена. Аккуратно перемешайте раствор, взбалтывая, и храните при температуре 4 °C в защищенном от света месте до использования.
- Покройте коллагеном одну или несколько пластин с 96 лунками. Добавьте 50 мкл раствора коллагенового покрытия в каждую лунку и покройте пластину на ночь (ON) при 4 ° C.
- На следующий день аспирируйте раствор коллагена с помощью вакуумного аспиратора и вымойте пластину 2 раза, добавив 100 мкл автоклавной воды и аспирируя.
- Наклоните крышку тарелки и дайте тарелке высохнуть в капюшоне в течение 20-30 минут.
- Когда пластина полностью высохнет, заверните ее в алюминиевую фольгу и храните при температуре 4 °C до использования. Пластины с покрытием могут храниться до 4 недель.
ПРИМЕЧАНИЕ: Коллагеновое покрытие обеспечивает адгезию клеток. Важно смыть свободный коллаген, так как он может повлиять на функцию клеток и передачу сигналов (например, связывание коллагена V с рецепторами кальцитонина на MuSC)26.
2. Подготовка (0,5 ч; день вскрытия):
- Подготовка дополнительных решений и рабочего пространства
- Приготовьте стерильную среду для стирки, добавив 50 мл лошадиной сыворотки и 5 мл ручки/стрептококка к 445 мл среды F10 от HAM. Работайте в вытяжном шкафу с ламинарным потоком, чтобы предотвратить загрязнение.
- Рассчитайте и взвесьте соответствующее количество коллагеназы II, необходимое для приготовления диссоциативного буфера. (Для каждой мыши используется 26 000 единиц коллагеназы II для создания 40 мл диссоциативного буфера при 650 ЕД / мл коллагеназы II). Добавьте взвешенный порошок в коническую пробирку объемом 50 мл и храните на льду.
- Подготовьте две 10-сантиметровые посуды для изоляции мышц. Налейте 3 мл промывочной среды (таблица 1) в каждую чашку Петри. Вынесите 10-сантиметровую посуду за пределы вытяжки с ламинарным потоком для последующего использования.
- Подготовьте материалы для мышечного переваривания. В зависимости от количества образцов наметьте соответствующее количество конических пробирок объемом 50 мл (восемь на мышь, по одной на каждую мышцу) и оставьте их на скамейке. Распылите на иглы, шприцы объемом 10 мл и клеточные сетчатые фильтры размером 40 мкм 70% этанола (по восемь на мышь, по одному на каждую мышцу) и поместите их внутрь вытяжки с ламинарным потоком. Приложите иглы к шприцам.
- Подготовьте материалы к сортировке. Маркируйте пробирки с круглым дном объемом 5 мл крышками для клеточных фильтров в зависимости от количества образцов. Накройте трубки алюминиевой фольгой и оставьте их в колпаке с ламинарным потоком.
- В соответствии с количеством сортируемых образцов и популяций подготовьте микроцентрифужные пробирки объемом 1,5 мл с 500 мкл промывочной среды для сбора клеток (16 на мышь, по одной пробирке на каждую клеточную популяцию на мышечную ткань). Храните эти тюбики на льду.
3. Рассечение мышц (20-30 мин)
ПРИМЕЧАНИЕ: Этот раздел протокола проводится в нестерильной среде. Процедуру можно проводить с помощью одной или нескольких мышей. Тем не менее, одной мыши достаточно, чтобы подготовить как образцы к сортировке, так и элементы управления для настройки компенсационных и FACS-вентилей.
- Инициация мышечной изоляции
- Подготовьте нестерильное рабочее пространство к рассечению и изоляции мышц. Продезинфицируйте рабочее место 70% этанолом. Поместите стерильную защитную одноразовую прокладку на рабочее место.
- Используя перманентный маркер, нарисуйте рамку для каждой мышцы поверх крышки чашки Петри, чтобы позже поместить изолированную мышцу.
- Опрыскайте хирургические инструменты 70% этанолом.
- Усыпьте мышь путем вдыхания CO2 и/или вывиха шейки матки.
- Изолируйте отдельные мышцы (от одной мыши за раз, если используется несколько мышей). Сбрызните мышь 70% этанолом, чтобы намочить мех и продезинфицировать кожу. Положите мышь на подкладку животом вверх. Обзор всех восьми мышц и их анатомического расположения показан на рисунке 2A.
- Изоляция грацилисных мышц
- С помощью ножниц сделайте горизонтальный разрез на коже живота толщиной 0,5 см.
- Удалите кожу: обеими руками большим и указательным пальцами возьмитесь за верхнюю и нижнюю части разреза. Потяните за каждую сторону разреза, чтобы разорвать и раздвинуть кожу туловища и нижних конечностей. Потяните вниз кожу нижней конечности, чтобы обнажить обе задние конечности (вниз от бедра до пальцев ног). Точно так же потяните вверх, чтобы обнажить туловище.
- Найдите грацилисную мышцу (внутренняя поверхность бедра). С помощью изогнутых щипцов возьмитесь за грацилис и слегка приподнимите мышцу (рис. 2B). Ножницами делают разрез 0,5 см (рис. 2В), из которого вырезается грацилис и полностью изолируется (рис. 2D). Повторите это для другой ноги, чтобы изолировать вторую грацилисную мышцу.
- Изоляция мышц ТА и ЭДЛ (нижняя задняя конечность, брюшная сторона)
- С помощью скальпеля разрежьте фасцию, сделав разрез 0,5 см вдоль боковой стороны большеберцовой кости (самая толстая нижняя кость задней конечности). Используйте изогнутые щипцы, чтобы захватить фасцию и потянуть, чтобы удалить ее.
ПРИМЕЧАНИЕ: Когда фасция полностью удалена, сухожилия на дистальном конце задней ноги видны и могут быть разделены. - Используйте прямые щипцы со сверхтонкими наконечниками, чтобы пройти между дистальным сухожилием TA (боковая сторона большеберцовой кости) и EDL (ниже TA) (рис. 2E-G).
ПРИМЕЧАНИЕ: С опытом можно использовать тупой конец лезвия скальпеля вместо прямых щипцов. - Сдвиньте щипцы к проксимальному концу мышцы, чтобы разделить мышцы.
- Верните прямые щипцы к дистальному концу. Перережьте дистальное сухожилие.
- Аккуратно захватите дистальное сухожилие мышцы изогнутыми щипцами. Поднимите мышцу вверх и над ее проксимальным прикреплением и осторожно разрежьте проксимальное сухожилие как можно ближе к точке прикрепления. Отрежьте другой конец и переложите ТА в чашку Петри.
- Используйте прямые щипцы со сверхтонкими наконечниками, чтобы пройти под дистальным сухожилием EDL.
- Сдвиньте щипцы к проксимальному концу мышцы, чтобы разделить мышцы.
- Верните прямые щипцы к дистальному концу. Перережьте дистальное сухожилие, не повреждая мышцу.
- Аккуратно захватите дистальное сухожилие EDL изогнутыми щипцами. Поднимите мышцу вверх и над ее проксимальным прикреплением и осторожно разрежьте проксимальное сухожилие как можно ближе к точке прикрепления. Отрежьте другой конец и переложите EDL в чашку Петри. Повторите то же самое для другой задней конечности, чтобы изолировать вторую мышцу TA и EDL.
- С помощью скальпеля разрежьте фасцию, сделав разрез 0,5 см вдоль боковой стороны большеберцовой кости (самая толстая нижняя кость задней конечности). Используйте изогнутые щипцы, чтобы захватить фасцию и потянуть, чтобы удалить ее.
- Изоляция ГА и камбаловидных мышц (нижняя задняя конечность, спинная сторона)
- Используйте прямые щипцы со сверхтонкими наконечниками, чтобы пройти между ахилловым сухожилием и нижними костями задних конечностей.
- Сдвиньте щипцы к проксимальному концу мышцы, чтобы отделить мышцу.
- Верните прямые щипцы к дистальному концу. Перережьте дистальное сухожилие.
ПРИМЕЧАНИЕ: Чтобы не повредить камбаловидную мышцу, которая находится под ГА, разрежьте как можно ближе к ее дистальному прикреплению ахиллова сухожилия, оставив кусок сухожилия прикрепленным к GA (рис. 2H). - Чтобы выявить и изолировать камбаловидную мышцу, потяните GA вверх и над малоберцовой костью (самая тонкая кость из двух костей в нижней задней конечности).
ПРИМЕЧАНИЕ: Камбаловидная мышца отличается характерным темно-красным цветом относительно ГА (рис. 2I). - Найдите сухожилие проксимального камбаловидного отдела. Прямыми щипцами пройдите между камбаловидной мышцей и ГА.
- Переместите щипцы к дистальному концу мышцы, чтобы отделить камбаловидную мышцу от ГА.
- Сначала изолируйте камбаловидную мышцу. Разрежьте проксимальное сухожилие, возьмитесь за сухожилие изогнутыми щипцами и осторожно поднимите камбаловидную мышцу, чтобы получить доступ к ее дистальному сухожилию. Разрежьте дистальное сухожилие, чтобы изолировать камбаловидную мышцу от ГА. Поместите камбаловидную мышцу в чашку Петри с моющим средством (рис. 2J)
- Нарежьте GA и поместите его в чашку Петри. Повторите это для другой ноги, чтобы изолировать вторую камбаловидную мышцу и мышцы GA.
- Изоляция трехглавых мышц (верхняя передняя конечность, спинная сторона)
- Используйте прямые щипцы со сверхтонкими наконечниками, чтобы пройти между трехглавой мышцей и плечевой костью (основная кость верхней части передней ноги) (рис. 2K-M).
- Сдвиньте щипцы к проксимальному концу мышцы, чтобы отделить мышцу. Разрежьте проксимальный конец мышцы.
- Возьмитесь за проксимальный конец трицепса изогнутыми щипцами и потяните его вверх и над локтем, чтобы получить доступ к дистальному сухожилию. Перережьте дистальное сухожилие трицепса, перенесите мышцу в чашку Петри и повторите процедуру для другой передней конечности.
- Изоляция жевательных мышц
- Удалите мех и кожу с челюсти. Сделайте ножницами горизонтальный надрез в 0,5 см. Обеими руками зажмите каждую сторону разреза большим и указательным пальцами. Снимите кожицу, потянув вверх и вниз.
- Найдите крупное сухожилие жевательной мышцы (хвостовое, ниже глаза). Вставьте плоское лезвие скальпеля между костью и мышцей (рис. 2N). Перережьте сухожилие.
- Захватите крупное жевательное сухожилие изогнутыми щипцами. Разрежьте его лезвием скальпеля или ножницами в ростральном направлении, чтобы отделить жевательную мышцу от челюстной кости (рис. 2O, P). Поместите изолированную жевательную мышцу в чашку Петри. Повторите процедуру для второй жевательной мышцы.
- Изоляция мышцы диафрагмы
ПРИМЕЧАНИЕ: При изоляции мышцы диафрагмы обязательно режьте осторожно, чтобы избежать порезов во внутренних органах и кишечнике, так как это является источником загрязнения.- С помощью ножниц сделайте торакотомию (разрез между ребрами) в середине грудины (длинная плоская кость, расположенная посередине грудной клетки, которая соединяет ребра) и прорежьте грудину (рис. 2Q).
- Обнажите диафрагму, разрезав грудную клетку на 360°.
- Отделите верхнюю часть тела от нижней части/живота. С помощью ножниц разрежьте трахею, пищевод, полую вену и брюшную аорту.
- Отделите диафрагму от нижней части корпуса. С помощью ножниц сделайте лапаротомию (хирургический разрез в брюшной полости) на 1 см ниже грудины и сделайте разрез на 360° (рис. 2R).
- Поместите закрытые ножницы между грудной клеткой и органами брюшной полости и надавите. Осторожно потяните за грудную клетку, чтобы отделить ее от органов брюшной полости (рис. 2S).
- Отделите диафрагму от грудной клетки. Неплотно зажмите диафрагму между двумя пальцами и разрежьте грудную клетку ножницами. Используйте ножницы, чтобы разрезать диафрагму как можно ближе к ребрам на 360°. Поместите изолированную диафрагму в чашку Петри.
ПРИМЕЧАНИЕ: Во время вывиха шейки матки диафрагма может разорваться и разрушиться о грудную клетку, что затруднит ее обнаружение. Мышца все еще может быть изолирована. Определите разрушенную мышцу, зажмите ее между двумя пальцами и разрежьте на 360 ° вслед за грудной клеткой.
4. Мышечное пищеварение до одноклеточной суспензии (~1 ч 35 мин)
ПРИМЕЧАНИЕ: Следующие шаги включают нестерильную (этапы 4.1-4.2) и стерильную рабочую среду (шаг 4.3).
- Механическое пищеварение
- Поместите изолированные мышцы в крышку 10-сантиметровой чашки Петри.
- Используя изогнутые щипцы, возьмитесь за изолированные мышцы одну за другой. Для камбаловидной мышцы и ГА удалите оставшиеся части ахиллова сухожилия.
- Используя ножницы, измельчите изолированные мышцы одну за другой, разрезав их примерно на 1 мм3 части.
- Ферментативное пищеварение
- Подготовьте буфер диссоциации мышц, добавив 40 мл среды для холодной стирки к взвешенному порошку коллагеназы II (коллагеназа II: 650 ЕД/мл в промывочной среде).
ПРИМЕЧАНИЕ: Используйте свежеприготовленный буфер для диссоциации мышц, чтобы обеспечить оптимальную ферментативную активность. - Перенесите измельченные мышцы в коническую трубку объемом 15 мл, содержащую 5 мл диссоциативного буфера.
- Инкубируйте пробирку в течение 35 минут на водяной бане при температуре 37 °C при 60 об/мин.
- После инкубации добавьте промывочную среду до общего объема 15 мл. Отжимайте пробирку при дозе 1 600 x g в течение 5 мин при 4 °C.
- Аспирируйте надосадочную жидкость до объема 4 мл с помощью вакуумного аспиратора. Чтобы не нарушить гранулы, медленно аспирируйте сверху и удалите всплывший жир.
- Размораживание запаса аликвот диспазы и коллагеназы II. Добавьте 500 мкл раствора коллагеназы II (1000 ЕД / мл, -20 ° C) к оставшимся 4 мл образца. Затем добавьте 500 мкл раствора диспазы (11 ЕД / мл, -20 ° C).
ПРИМЕЧАНИЕ: Диспаза может привести к образованию осадка. Если это произойдет, отжимайте исходный раствор диспаза в дозе 10 000 x g за 1 минуту до использования. Перенесите теперь прозрачную надосадочную жидкость в клеточную суспензию, не нарушая гранулу. - Ненадолго встряхните образцы, чтобы растворить гранулы.
- Инкубируйте образцы в течение 20 минут на водяной бане при температуре 37 °C при 60 об/мин.
ПРИМЕЧАНИЕ: Переваривание большого количества мышечных образцов отнимает много времени. Для этапов 4.3.1-4.3.6 оцените затраты 2-5 минут на образец. Этот шаг выполняется быстрее, если он выполняется параллельно двумя или более исследователями.
- Подготовьте буфер диссоциации мышц, добавив 40 мл среды для холодной стирки к взвешенному порошку коллагеназы II (коллагеназа II: 650 ЕД/мл в промывочной среде).
- Гомогенизация образцов
- Гомогенизируйте клеточную суспензию. Перенесите суспензию из пробирки объемом 15 мл в пробирку объемом 50 мл. Используйте шприц объемом 10 мл с иглой 20 г, чтобы ресуспендировать образец, протягивая образец вверх и вниз через иглу в 5 раз.
ПРИМЕЧАНИЕ: Если кусочки непереваренной мышцы забивают иглу, вытрите их бумажной салфеткой. - Поместите сетчатый фильтр для клеток 40 мкм на новую коническую трубку объемом 50 мл.
- Возьмите полную клеточную суспензию в шприц и процедите образец в новую коническую пробирку объемом 50 мл с клеточным сетчатым фильтром сверху. Процедите образец, распределив весь объем непосредственно на фильтр.
- Чтобы извлечь все одноядерные клетки, добавьте 20 мл промывочной среды в пустую коническую пробирку и вылейте ее через клеточный фильтр в коническую пробирку объемом 50 мл, содержащую процеженный образец. Извлеките оставшийся объем под клеточный фильтр с помощью пипетки p1000.
- Выбросьте клеточный фильтр и открутите образец при 1,600 x g в течение 5 мин при 4 ° C.
- Пипеткой пипеткой p1000 аспирируйте надосадочную жидкость, не нарушая гранулы.
- Пипеткой пипеткой p1000 ресуспендируют гранулу диафрагмы в 500 мкл промывочной среды и ресуспендируют другие образцы мышц в 300 мкл промывочной среды каждый.
ПРИМЕЧАНИЕ: Диафрагма является самой большой из мышц с самым высоким содержанием стволовых клеток и поэтому может использоваться для контрольного окрашивания.
- Гомогенизируйте клеточную суспензию. Перенесите суспензию из пробирки объемом 15 мл в пробирку объемом 50 мл. Используйте шприц объемом 10 мл с иглой 20 г, чтобы ресуспендировать образец, протягивая образец вверх и вниз через иглу в 5 раз.
5. Окрашивание и сортировка (~ 40 мин + 30 мин сортировка / образец)
ПРИМЕЧАНИЕ: Работайте в стерильной среде на льду в течение следующих шагов.
- Перенесите аликвоту 50 мкл суспензии диафрагменных ячеек в четыре новые микроцентрифужные пробирки по 2 мл для контрольных красителей (по 50 мкл каждая). Добавьте 250 мкл промывочной среды в каждую контрольную трубку до конечного объема 300 мкл.
- Добавьте 3 мкл (1:100) флуоресцентных антител минус один (FMO-контроль) в три контрольные окрашивающие пробирки и оставьте одну пробирку без антител (неокрашенный контроль) (см. Таблицу 2).
- Добавьте 3 мкл (1:100) антител (VCAM1-PECy7, CD45-FITC, CD31-FITC и SCA1-PacificBlue) к оставшимся суспензиям одноклеточных мышц, включая оставшийся образец диафрагмы.
- Инкубируйте клеточные суспензии в течение 15 мин при 4 °C в шейкере с головой.
ПРИМЕЧАНИЕ: Контрольные окрашивания необходимы для определения фоновых уровней флуоресценции и установки ворот для проточной цитометрии. Можно использовать разные антитела, но каждое из них будет иметь определенную рабочую концентрацию и время инкубации, которые необходимо проверить. Если используются антитела от разных поставщиков, концентрация и, следовательно, разведение могут варьироваться. Краситель жизнеспособности клеток может быть добавлен в окрашивающую смесь, чтобы удалить любые мертвые или умирающие клетки во время сортировки. - Отжим образцов при 1 600 x g в течение 5 мин при 4 °C. Выбросьте надосадочную жидкость, не нарушая гранулы пипеткой.
- Пипеткой пипеткой p1000 ресуспендируют каждый образец в 800 мкл промывочной среды.
- Отфильтруйте образцы с помощью пробирки FACS с крышкой сетчатого фильтра (40 мкм), чтобы удалить оставшиеся клеточные комки (или агрегаты).
- Промойте сетчатый фильтр, добавив дополнительно 800 мкл промывочной среды.
- Держите образцы покрытыми алюминиевой фольгой на льду до анализа.
ПРИМЕЧАНИЕ: Если в этот момент клеточная суспензия кажется мутной/плотной из-за высокой концентрации клеток, добавьте дополнительно 800 мкл промывочной среды, чтобы уменьшить плотность клеток. - Запустите FACS с помощью сопла 70 мкм.
- Используйте неокрашенные элементы управления и FMO, чтобы установить стратегию стробирования: MuSC отрицательны для CD45-FITC, CD31-FITC и SCA1-PacBlue и положительны для VCAM1-PECy7; FAP отрицательны для CD45-FITC, CD31-FITC, VCAM1-PECy7 и положительны для SCA1-PacBlue.
- Отсортируйте окрашенные одноклеточные суспензии с помощью двусторонней сортировки и соберите MuSC и FAP в отдельные пробирки для сбора, содержащие 500 мкл промывочной среды.
ПРИМЕЧАНИЕ: При использовании FACS с четырьмя лазерами (конфигурация: сопло 70 мкм, 405 нм, 488 нм, 561 нм, 633 нм) выбранная комбинация флуорофоров не требует компенсации флуоресцентного сигнала. Однако при использовании другого проточного цитометра или другой комбинации флуорофоров рекомендуются дополнительные одноокрашенные контрольные образцы для компенсации. Из меньших мышц (EDL, камбаловидная мышца, TA) следует ожидать выхода 3,000 MuSC и 5,000 FAP. Для других более крупных мышц следует ожидать выхода 20 000 MuSC и FAP. Количество событий, указанное программным обеспечением СУИМ, может отличаться от фактического количества жизнеспособных клеток в пробирке для сбора. Количество клеток может быть подтверждено подсчетом клеток с помощью гемоцитометра. - Отсортированные ячейки разложить при 1 600 x g в течение 5 мин при 4 °C. С помощью пипетки аспирируйте надосадочную жидкость, не нарушая клеточную гранулу.
- Добавьте 100 мкл промывочной среды к каждому образцу и осторожно ресуспендируйте клетки, не создавая пузырьков воздуха. Перенесите 100 мкл ресуспендированного образца в 96-луночную пластину, покрытую коллагеном. Пластина 1 000-3 000 ячеек на лунку.
ПРИМЕЧАНИЕ: Если клетки не ресуспендированы должным образом, клетки могут слипаться в сгустки, сбивая с толку более поздние микроскопические анализы. - Осмотрите клетки под микроскопом и обратите внимание на их распределение, форму и размер.
- Инкубировать пластину при 37 °C, 5%CO2. Клетки прилипнут в течение 2 часов.
ПРИМЕЧАНИЕ: Рекомендуется подтвердить чистоту собранных клеточных популяций либо с помощью проточного цитометрического анализа (путем загрузки аликвоты отсортированного образца в сортировщик и регистрации небольшого количества событий), либо путем окрашивания антителами покрытых клеток с последующей микроскопией (Pax7 является определяющим маркером для MuSC мыши, PDGFRa является определяющим маркером для FAP мыши). Начиная с раздела 7 ниже, приведен протокол окрашивания клеток на уровни белка Pax7 и PDGFRa.
6. Анализ регистрации EdU
ПРИМЕЧАНИЕ: Работайте в стерильных условиях и используйте химический вытяжной шкаф при работе с параформальдегидом (PFA) для следующих шагов. EdU представляет собой аналог нуклеотида, включенный в ДНК, когда клетки проходят через S-фазу клеточного цикла. Он мутагенен в высоких концентрациях. Всегда надевайте перчатки при работе с EdU. Ознакомьтесь с местными рекомендациями по обращению с отходами EdU.
- Пульс EdU (1-й день)
- Приготовьте рабочий раствор 2x EdU в свежем моющем средстве.
- Достаньте из инкубатора 96-луночную тарелку с ячейками. Осмотрите клетки под микроскопом, чтобы контролировать слияние. Переместитесь в вытяжку с ламинарным потоком.
- Удалите 50 мкл среды из пластины пипеткой. Добавьте 50 мкл рабочего раствора 2x EdU, чтобы конечный объем в лунке составил 100 мкл.
- Культивируют клетки в присутствии EdU в течение предполагаемого периода времени при 37 °C, 5% CO2.
ПРИМЕЧАНИЕ: Время и продолжительность импульса EdU могут варьироваться. В среднем, покоящимся MuSC требуется 2 дня, чтобы полностью активировать и завершить свое первое делениеклеток 19. EdU может быть добавлен в отсортированные ячейки сразу после нанесения покрытия.
- Фиксация (день 2)
ПРИМЕЧАНИЕ: PFA является канцерогеном. Всегда обращайтесь с PFA с осторожностью. Ознакомьтесь с местными правилами обращения с PFA и утилизации отходов.- Достаньте из инкубатора 96-луночную тарелку с ячейками. Осмотрите клетки под микроскопом и переместите пластину в вытяжной шкаф.
- С помощью пипетки удалите среду и зафиксируйте клетки, добавив 50 мкл 4% PFA в каждую лунку. Инкубируйте пластину в течение 10 минут при комнатной температуре (RT) в химическом вытяжном шкафу.
- Удалите PFA с помощью пипетки и выбросьте его в соответствующий контейнер для отходов.
- Промойте ячейки, добавив 100 мкл PBS во все лунки. С помощью пипетки аспирируйте PBS и повторите стирку. Храните клетки в 100 мкл PBS.
ПРИМЕЧАНИЕ: Чтобы избежать промывания ячеек, распределите PBS сбоку от колодца, медленно пипетируя.
- Маркировка EdU
- Проникните клетки до обнаружения EdU, удалив PBS и добавив 100 мкл 0,5% Triton X-100 в PBS. Выдерживайте пластину в течение 5 минут при температуре 4 °C.
ПРИМЕЧАНИЕ: Triton X-100 является поверхностно-активным веществом и может вызывать раздражение кожи. Обращайтесь с осторожностью и всегда используйте перчатки. - Через 5 минут аспирируйте Triton X-100 и добавьте 100 мкл PBS.
- Приготовьте реакционную смесь EdU в соответствии с протоколом производителя.
- Аспирируйте PBS и добавьте 33 мкл реакционной смеси EdU. Инкубируйте пластину в течение 30 минут при RT.
- Аспирируйте реакционную смесь EdU и промойте клетки 100 мкл PBS.
- Аспирируйте PBS, добавьте 100 мкл PBS с Hoechst (1:2,000) и инкубируйте в защищенном от света месте в течение 10 минут при RT.
- Аспирируйте Hoechst и промойте дважды, добавив 100 мкл PBS. Храните ячейки в 100 мкл PBS при 4 ° C в темноте.
- Изобразите клетки на перевернутом микроскопе. Клетки можно хранить в темноте месяцами, пока лунки не пересохнут.
ПРИМЕЧАНИЕ: Возможно совместное окрашивание клеток антителами. В этом случае приступают к этапу блокировки с последующей инкубацией с первичным антителом. Выберите вторичное антитело с конъюгированным флуорофором, спектр излучения которого не пересекается со спектром флуорофора, используемого для обнаружения EdU. Убедитесь, что не используются вторичные антитела с флуорофорами, перекрывающимися со спектральным диапазоном Хёхста.
- Проникните клетки до обнаружения EdU, удалив PBS и добавив 100 мкл 0,5% Triton X-100 в PBS. Выдерживайте пластину в течение 5 минут при температуре 4 °C.
7. Иммунофлуоресцентное окрашивание
ПРИМЕЧАНИЕ: Эта часть протокола может быть выполнена независимо от раздела 6. При пропуске раздела 6 выполните шаги 6.3.1 и 6.3.2, чтобы включить пермеабилизацию клеток, прежде чем переходить к шагу 7.2 ниже.
- Выньте табличку с ячейками, меченными EdU.
- Приготовьте 20 мл блокирующего буфера, добавив 2 мл ослиной сыворотки к 18 мл PBS.
- Чтобы предотвратить связывание неспецифических антител, удалите 100 мкл PBS из каждой лунки и добавьте 50 мкл блокирующего буфера с помощью пипетки p200. Инкубируйте пластину в течение 30 минут при RT, защищенную от света и покрытую алюминиевой фольгой, чтобы предотвратить фотообесцвечивание EdU, меченного фторфором.
ПРИМЕЧАНИЕ: Ячейки крепятся ко дну колодца, но могут отсоединиться, если при пипетировании приложено слишком большое усилие. - Блокируя образцы, приготовьте первичную смесь антител. Добавьте 8,0 мкл (1:100) мышиного анти-Pax7 и кроличьего анти-PDGFRa к 800 мкл блокирующего буфера, чтобы окрасить 16 лунок (восемь тканей, два типа клеток).
- После блокировки удалите ослиную сыворотку и добавьте 50 мкл смеси первичных антител в каждую лунку. Инкубируйте пластину в течение ночи при температуре 4 °C, покрытую алюминиевой фольгой.
- После инкубации удалите первичное антитело и добавьте по 50 мкл Тритона (0,5% в PBS) в каждую из лунок. Инкубируют планшет в течение 5 мин при ЛТ в защищенном от света месте, чтобы смыть несвязанное антитело. Повторите стирку три раза.
- Приготовьте основную смесь вторичных антител, добавив 1,0 мкл (1:1,000) ослиного анти-мыши-Alexa647 и ослиного анти-кролика-Alexa555 в микроцентрифужную пробирку, содержащую 1,000 мкл блокирующего буфера.
- Добавьте 33 мкл смеси вторичных антител в каждую из лунок. Выдерживают пластину в течение 60 мин при РТ в защищенном от света месте.
- Удалите избыток вторичных антител с помощью пипетки, добавьте 50 мкл тритона (0,1% в PBS) и инкубируйте в течение 5 минут при ЛТ, защищенном от света. Повторите стирку три раза.
- Наконец, добавьте 100 мкл PBS. Решите, следует ли немедленно визуализировать пластину с помощью инвертированного флуоресцентного микроскопа с охлаждаемой ПЗС-камерой или хранить пластину при температуре 4 °C до последующего анализа, запечатав края пластины парапленкой и обернув запечатанную пластину алюминиевой фольгой.
Результаты
В соответствии с протоколом индивидуальной изоляции скелетных мышц (рис. 2) грацилис, ТА, ЭДЛ, ГА, камбаловидная мышца, трицепс, массажер и мышцы диафрагмы были выделены из трех швейцарских самцов беспородных мышей, которые были прекращены из местной программы разведения (рис. 2). После диссоциации тканей и окрашивания антителами MuSC и FAP из отдельных мышц очищали с помощью FACS (рис. 3). Первоначальное стробирование было получено с неокрашенным образцом для идентификации клеток и отделения синглетов от дублетов (рис. 3А). Последующие ворота были установлены с использованием элементов управления FMO для определения порогов окрашивания (рис. 3B). Затем окрашенный образец был закрыт для CD31 / CD45-FITC и Sca1-PacBlue. Популяция SCA1+/CD31-/CD45- (FAP) была отсортирована в отдельную пробирку для сбора, в то время как двойная отрицательная популяция была закрыта и нанесена на график для VCAM1-PECy7 и прямого рассеяния (FSC). Популяция VCAM1+ (MuSC) была отсортирована в отдельную пробирку для сбора. MuSC и FAP были количественно определены как процент синглетов (таблица 3) и отсортированы по отдельным пробиркам для сбора, содержащим 500 мкл промывочной среды. Одноклеточные суспензии мышц диафрагмы и трицепса имеют более высокое относительное содержание MuSC, чем FAP, тогда как другие одноклеточные суспензии имеют более высокое относительное содержание FAP, чем MuSC (таблица 3).
Из отсортированных клеток 1000-3000 клеток высевали и инкубировали в течение 24 часов. После 24 ч инкубации среду удаляли и заменяли свежей средой, содержащей EdU. Клетки фиксировали через 48 ч, окрашивали на EdU, а затем антителами против белка Pax7 или белка PDGFRa и визуализировали с помощью инвертированного эпифлуоресцентного микроскопа. Изображения были количественно оценены с помощью плагина Fiji в ImageJ. Наблюдалось надежное окрашивание EdU, хотя фракция EdU-положительных клеток была разной для двух типов стволовых клеток и разных мышц (рис. 4A-C). MuSC, выделенные из EDL или GA, показали значительно более низкое включение EdU по сравнению с MuSC, выделенными из TA, диафрагмы, грацилиса или трицепса, тогда как MuSC, выделенные из жевательной и камбаловидной мышц, находятся между ними и существенно не отличаются ни от одной из групп (рис. 4A, B). Это согласуется с нашими предыдущими результатами22. Более того, ткани, из которых MuSC демонстрируют высокие уровни включения EdU, являются теми же тканями, из которых ранее было показано, что MuSC экспрессируют высокие уровни белка Pax322. FAP, выделенные из EDL, показали значительно более низкое включение EdU по сравнению с FAP, выделенными из GA и камбаловидной мышцы, в то время как FAP, выделенные из TA, показали значительно более низкое включение EdU по сравнению с FAP, выделенными из камбаловидной мышцы (рис. 4A, C). Это подчеркивает важность анализа стволовых клеток из отдельных тканей, а не объединения мышц из разных тканей для выделения. Для всех тканей средняя доля EdU-положительных MuSC была выше по сравнению со средней долей EdU-положительных FAP, что позволяет предположить, что MuSC активируются быстрее в данных условиях.
Наконец, чистота клеток была подтверждена иммунофлуоресцентным окрашиванием (рис. 4D). В среднем, 97,71% (± 1,38%) MuSC были окрашены положительно на белок Pax7, а 88,16% (±6,35%) FAP были окрашены положительно на белок PDGFRa, что подтверждает специфичность нашей процедуры выделения стволовых клеток (рис. 4D).

Рисунок 1: Схематический реферат протокола. Схема, показывающая два основных сегмента протокола: выделение MuSC (верхняя панель), анализ покоя (нижняя панель) и ключевые этапы методологии, используемой в каждом из них. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
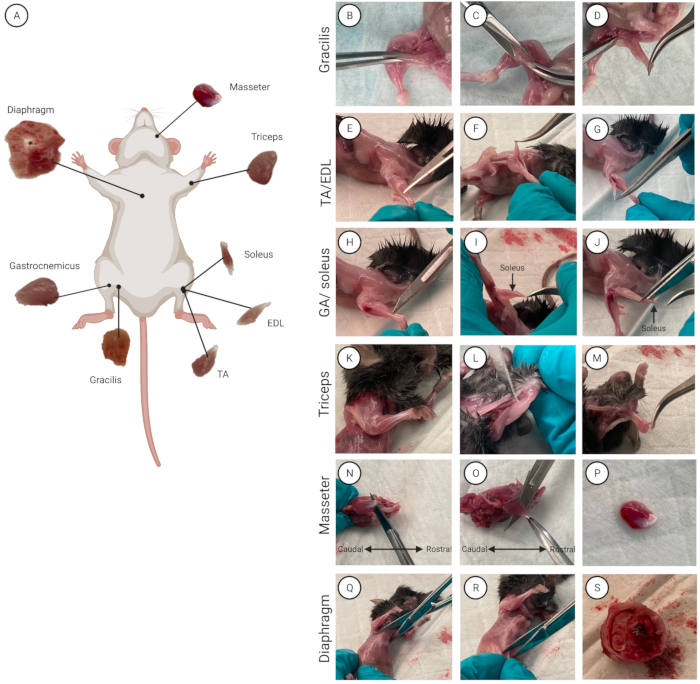
Рисунок 2: Расположение и изоляция мышц. (А) Схема, показывающая расположение каждой мышцы. (Б-С) Демонстрация мышечной изоляции для (B-D) GRACILIS, (E-G) TA/EDL, (H-J) трицепса, (K-M) GA/камбаловидной мышцы, (N-P) массажиста и (Q-S) мышц диафрагмы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
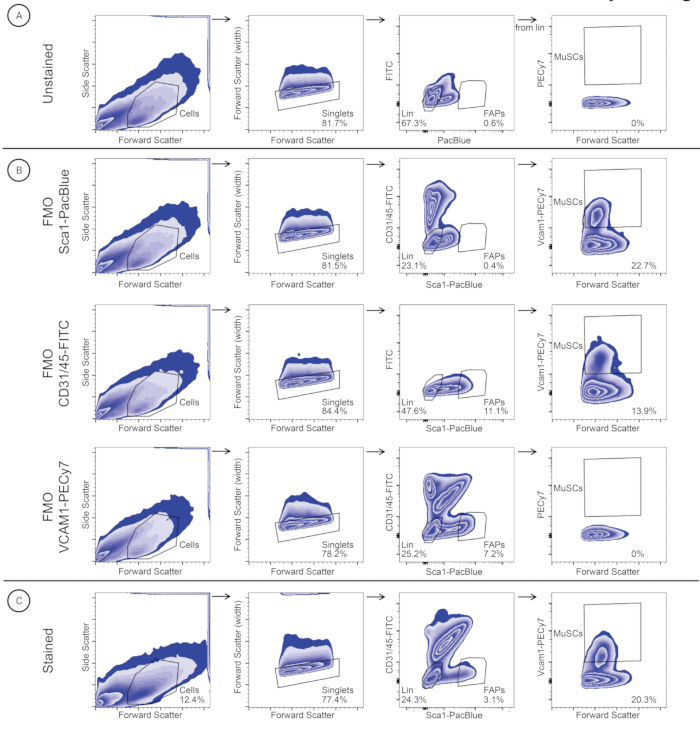
Рисунок 3: Стратегия стробирования, используемая для идентификации и сортировки MuSC и FAP в образце мышц диафрагмы. Ячейки идентифицируются на основе размера ячейки (прямое рассеяние (FSC)) и детализации (боковое рассеяние (SSC)). Синглеты подбираются на основе FSC-A и FSC-W. Клетки Lineage закрыты для последующей идентификации MuSC (Lineage-/VCAM1+), а клетки FAP (Lineage-/SCA1+) закрыты для идентификации FAP. Та же стратегия стробирования была применена к (A) неокрашенному контролю, (B) элементам управления FMO (FMO-SCA1PacBlue, FMO-CD31/45-FITC и FMO-VCAM1-PECy7) и (C) окрашенному образцу. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Количественная оценка активации клеток с помощью окрашивания EdU. (A) Репрезентативные изображения окрашивания EdU MuSC (верхние панели) и FAP (нижние панели) из образца диафрагмы. Показаны объединенные изображения EdU и Hoechst (левая панель), а также отдельные каналы зеленого (EdU, средние панели) и синего (Hoechst, правые панели). (В,В) Гистограмма, показывающая процент EdU-положительных (B) MuSC или (C) FAP для указанных мышц. Построено среднее значение ± SEM. Каждая точка представляет собой мышь. Статистический анализ проводился в GraphPad с использованием двусторонних t-критериев Стьюдента со значимостью *p < 0,05 и **p < 0,01. (D) Иммунофлуоресцентное окрашивание MuSC (верхние панели) и FAP (нижние панели) антителами против маркера MuSC Pax7 (левая сторона) и FAP-маркера PDGFRa (правая сторона). Показаны объединенные изображения Pax7 с Hoechst, за которыми следуют отдельные каналы, и объединенные изображения PDGFRa с Hoechst, за которыми следуют отдельные каналы. N = 3. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Решения | Реагентов | Количество |
| Моющее средство | F-10 Питательная смесь (ветчина) (1x), +L-глютамин | 445 мл |
| Сыворотка для лошадей | 50 мл | |
| Ручка/стрептококк | 5 мл | |
| Диссоциативный буфер (1-е сбраживание) | Коллагеназа II типа | 650 ЕД/мл |
| Моющее средство | 100 мл | |
| Диспаз бульон (2-е переваривание) | Dispase в PBS | 11 ЕД/мл |
| Коллагеназный запас (2-е пищеварение) | Коллагеназа II типа в PBS | 1000 ЕД/мл |
| ПБС 1x | Порошковый концентрат PBS 10x | 9,89 г/л |
| Автоклавная/стерильная вода | 1 л | |
| Кислая вода | Ледяная уксусная кислота (100%) Безводная для анализа | 5,15 мл |
| Автоклавная/стерильная вода | 895 мл | |
| Раствор коллагена (0,002%) | Коллаген из телячьей кожи | 20 мл |
| Кислая вода | 800 мл | |
| Тритон Х-100 | Тритон Х-100 | 0,5% (об./об.) |
| ПБС 1x | 99.5% | |
| Блокировка буфера | ПБС 1x | 18 мл |
| Ослиная сыворотка | 2 мл |
Таблица 1: Таблица рецептов.
| Образец No. | Имя |
| 1 | Безупречный |
| 2 | Флуоресценция минус VCAM1-PeCy7 |
| 3 | Флуоресценция минус SCA1-PacificBlue |
| 4 | Флуоресценция минус CD31/45-FITC |
| 5 | Экспериментальное окрашивание (все четыре антитела) |
Таблица 2: Обзор окрашивания, контроля и образцов, подготовленных для каждой ткани перед сортировкой.
| Ткань | Смесь антител | Клетки | Майки | Лин Нег | ФАПы | МуСК |
| Диафрагма | безупречный | 100% | 82% | 55% | 0.5% | 0.0% |
| FMO Sca1-PacBlue | 100% | 83% | 19% | 0.3% | 4.3% | |
| ФМО CD31/45-488 | 100% | 84% | 40% | 9.4% | 5.6% | |
| FMO Vcam1-PeCy7 | 100% | 78% | 20% | 5.6% | 0.0% | |
| запятнанный | 100% | 77% | 19% | 2.4% | 3.8% | |
| Грацилис | запятнанный | 100% | 96% | 11% | 2.6% | 1.4% |
| СПАСИБО | запятнанный | 100% | 88% | 16% | 2.8% | 2.2% |
| ЖНВЛП | запятнанный | 100% | 86% | 26% | 19.2% | 0.8% |
| Солеус | запятнанный | 100% | 91% | 41% | 13.3% | 1.1% |
| ГА | запятнанный | 100% | 94% | 51% | 6.1% | 1.5% |
| Трицепс | запятнанный | 100% | 92% | 30% | 2.6% | 4.5% |
| Жевательный аппарат | запятнанный | 100% | 85% | 27% | 19.3% | 2.6% |
Таблица 3: Обзор относительного содержания типов ячеек в данных СУИМ.
Обсуждение
Несколько шагов являются ключевыми в выполнении этого протокола для достижения хороших урожаев. Отдельные мышцы имеют небольшой объем по сравнению с количеством мышц, используемых в протоколах объемной изоляции. Это приводит к риску высыхания мышц во время рассечения, что снижает урожайность. Чтобы этого не допустить, важно добавлять медиум в мышцы сразу после рассечения. Кроме того, если рассечение занимает больше времени, кожу можно снимать с одной конечности за раз, чтобы сократить время воздействия на мышцы воздуха. Меньший объем также приводит к повышенному риску переваривания. Чтобы противостоять этому, настоящий способ требует меньшего количества фермента коллагеназы II и сокращения времени переваривания по сравнению с протоколами объемных мышц 9,16. Ферментативное пищеварение также зависит от чистоты ферментов, а более низкая чистота может негативно повлиять на урожайность. Кроме того, решающее значение имеет механическое пищеварение. В случае недостаточной резки уменьшенная площадь поверхности будет препятствовать ферментативному пищеварению и снижать выход стволовых клеток. В случае слишком большой резки увеличенная площадь поверхности вызовет чрезмерное переваривание и снизит выход стволовых клеток. Встряхивающая водяная баня предотвращает осаждение переваренной мышцы, улучшает распределение фермента и помогает создать однородную температуру, что в целом позволяет сократить время инкубации. Таким образом, настоящий способ позволяет значительно сократить время инкубации по сравнению с другими способами.
Этот протокол зависит от диссоциации и очистки клеток. Эти процедуры имитируют повреждение тканей, которое активирует стволовые клетки. Соответственно, недавние исследования показали, что MuSC изменяют свои программы экспрессии генов во время процедуры выделения27,28,29,30. В результате очищенные стволовые клетки отличаются от клеток in vivo с точки зрения паттернов экспрессии генов. Вторым ограничивающим фактором в протоколе является его зависимость от СУИМ, которая требует доступа к дорогостоящему оборудованию. FACS является золотым стандартом для одновременной изоляции нескольких клеточных популяций с высокой чистотой20. Последние достижения с использованием магнитных шариков и микропузырьков предлагают снижение стоимости31,32, но необходимо определить, обеспечивают ли они сопоставимую производительность для работы с отдельными мышцами. Наконец, выход протокола ограничен из-за небольшого размера мышц, что накладывает ограничения на потенциальные последующие анализы.
Предыдущие исследования основывались на объединении различных мышц при выделении MuSC и / или FAP для максимизации выхода клеток. Тем не менее, это усредняет любые тканеспецифические различия в поведении и функционировании стволовых клеток между различными мышцами. Текущий протокол позволяет изолировать MuSC и FAP от отдельных мышц для последующего анализа функции стволовых клеток. В качестве примера последующего анализа активация стволовых клеток была проанализирована путем включения EdU, показав, что стволовые клетки из разных тканей демонстрируют разную кинетику активации. В предыдущих работах была показана целесообразность использования других последующих анализов; эти анализы требуют меньшего количества клеток, таких как секвенирование одноклеточной РНК SmartSeq2, трансплантация клеток, микрофлюидная ПЦР и анализы клональной экспансии 22,33,34,35.
В заключение, этот протокол описывает метод рассечения отдельных мышц для выделения и изучения MuSC и FAP. Эта стратегия позволит экспериментам лучше понять функцию стволовых клеток в различных мышцах здоровья и болезней.
Раскрытие информации
У авторов нет конкурирующих финансовых интересов и конфликтов интересов.
Благодарности
Сортировка клеток проводилась на базовом объекте FACS, Орхусский университет, Дания. Фигуры были созданы с помощью Biorender.com. Мы благодарим доктора J. Farup за то, что он поделился антителом кролика против PDGFRa. Эта работа была поддержана стартовым грантом AUFF для E.P. и грантами Start Package от NovoNordiskFonden для E.P. (0071113) и A.D.M. (0071116).
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube( PCR performance tested, PP, 30,000 xg, DNA/DNase-/RNase-free, Low DNA binding, Sterile ) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 72.706.700 | 1.5 mL tube |
| 15 mL tube (PP/HD-PE, 20,000 xg, IVD/CE, IATA, DNA/DNase-/RNase-free, Non-cytotoxic, pyrogen free, Sterile) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 62.554.502 | 15 mL tube |
| 5 mL polystyrene round-bottom tube | Falcon, Fisher Scientific | 352054 | FACS tube without strainer cap |
| 5 mL polystyrene Round-bottom tube with cell-strainer cap | Falcon, Fisher Scientific | 352235 | FACS tube with strainer cap |
| 5 mL tube (PP, non sterile autoclavable) | VWR collection | 525.0946 | 5 mL tube |
| 50 mL tube( PP/HD-PE, 20,000 xg, IVD/CE, ADR, DNA/DNase-/RNase-free, non-cytotoxic, pyrogen free, Sterile) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 62.547.254 | 50 mL tube |
| Alexa Fluor 555 Donkey anti-rabbit IgG (H+L) | Invitrogen, Thermo Fisher | Lot: 2387458 (Cat # A31572) | |
| Alexa Fluor 647 donkey-anti mouse IgG (H+L) | Invitrogen, Thermo Fisher | Lot: 2420713 (Cat#A31571) | |
| ARIA 3 | BD | FACS, Core facility Aarhus University | |
| Centrifuge 5810 | eppendorf | EP022628188 | Centrifuge |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 488 dye | Invitrogen, Thermo Fisher | Lot: 2387287 (Cat# C10337) | Cell Proliferation Kit |
| Collagen from calf-skin | Bioreagent, Sigma Aldrich | Source: SLCK6209 (Cat# C8919) | |
| Collagenase type II | Worthington, Fisher Scientific | Lot: 40H20248 (cat# L5004177 ) | Collagenase |
| Dispase | Gibco, Fisher Scientific | Lot: 2309415 (cat# 17105-041 ) | Dispase |
| Donkey serum (non-sterile) | Sigma Aldrich, Merck | Lot: 2826455 (Cat# S30-100mL) | |
| Dumont nr. 5, 110 mm | Dumont, Hounisen Laboratorieudstyr A/S | 1606.327 | Straight forceps with fine tips |
| Dumont nr. 7, 115 mm | Dumont, Hounisen Laboratorieudstyr A/S | 1606.335 | Curved forceps |
| F-10 Nutrient mixture (Ham) (1x), +L-glutamine | Gibco, Fisher Scientific | Lot. 2453614 (cat# 31550-023) | |
| FITC anti-mouse CD31 | BioLegend, NordicBioSite | MEC13.3 (Cat # 102506) | |
| FITC Anti-mouse CD45 | BioLegend, NordicBioSite | 30-F11 (Cat# 103108) | |
| Glacial acetic acid (100%) | EMSURE, Merck | K44104563 9Cat # 1000631000) | |
| Head over head mini-tube rotator | Fisher Scientific | 15534080 (Model no. 88861052) | Head over head mini-tube rotator |
| Horse serum | Gibco, Fisher Scientific | Lot. 2482639 (cat# 10368902 ) | |
| Isotemp SWB 15 | FisherBrand, Fisher Scientific | 15325887 | Shaking water bath |
| MS2 mini-shaker | IKA | Vortex unit | |
| Needle 20 G (0.9 mm x 25 mm) | BD microlance, Fisher Scientific | 304827 | 20G needle |
| Neutral formalin buffer 10% | CellPath, Hounisen Laboratorieudstyr A/S | Lot: 03822014 (Cat # HOU/1000.1002) | |
| Non-pyrogenic cell strainer (40 µM) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 83.3945.040 | Cell strainer |
| Pacific Blue anti-mouse Ly-6A/E (Sca-1) | BioLegend, NordicBioSite | D7 (Cat# 108120) | |
| Pax7 primary antibody | DSHB | Lot: 2/3/22-282ug/mL (Cat# AB 528428) | |
| PBS 10x powder concentrate | Fisher BioReagents, Fisher Scientific | BP665-1 | |
| PE/Cy7 anti-mouse CD106 (VCAM1) | BioLegend, NordicBioSite | 429 (MVCAM.A) (Cat # 105720) | |
| Pen/strep | Gibco, Fisher Scientific | Lot. 163589 (cat# 11548876 ) | |
| Pipette tips p10 | Art tips, self sealing barrier, Thermo Scientific | 2140-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p1000 | Art tips, self sealing barrier, Thermo Scientific | 2279-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p20 | Art tips, self sealing barrier, Thermo Scientific | 2149P-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p200 | Art tips, self sealing barrier, Thermo Scientific | 2069-05 | Low retention, pre-sterilized, filter tips |
| Protective underpad | Abena | ACTC-7712 | 60 x 40cm, 8 layers |
| Rainin, pipet-lite XLS | Mettler Toledo, Thermo Scientific | 2140-05, 2149P-05, 2279-05, 2069-05 | Pipettes (P10, P20, P200, P1000) |
| Recombinant anti-PDGFR-alpha | RabMAb, abcam | AB134123 | |
| Scalpel (shaft no. 3) | Hounisen, Hounisen Laboratorieudstyr A/S | 1902.502 | Scalpel |
| Scalpel blade no. 11 | Heinz Herenz, Hounisen Laboratorieudstyr A/S | 1902.0911 | Scalpel |
| Scanlaf mars | Labogene | class 2 cabinet: Mars | Flow bench |
| ScanR | Olympus | Microscope, Core facility Aarhus University | |
| Scissors | FST | 14568-09 | |
| Series 8000 DH | Thermo Scientific | 3540-MAR | Incubator |
| Serological pipette 10 mL | VWR | 612-3700 | Sterile, non-pyrogenic |
| Serological pipette 5 mL | VWR, Avantor delivered by VWR | 612-3702 | Sterile, non-pyrogenic |
| Syringe 5 mL, Luer tip (6%), sterile | BD Emerald, Fisher Scientific | 307731 | Syringe |
| TC Dish 100, standard | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 83.3902 | Petri dish |
| Tissue Culture (TC)-treated surface, black polystyrene, flat bottom, sterile, lid, pack of 20 | Corning, Sigma Aldrich | 3764 | 96-well Half bottom plate |
| Triton X-100 | Sigma Aldrich, Merck | Source: SLCJ6163 (Cat # T8787) |
Ссылки
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9 (2), 493-495 (1961).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692 (2021).
- Cheung, T. H., Rando, T. A. Molecular regulation of stem cell quiescence. Nature Reviews. Molecular Cell Biology. 14 (6), 329-340 (2013).
- Kann, A. P., Hung, M., Krauss, R. S. Cell-cell contact and signaling in the muscle stem cell niche. Current Opinion in Cell Biology. 73, 78-83 (2021).
- Tedesco, F. S., Dellavalle, A., Diaz-Manera, J., Messina, G., Cossu, G. Repairing skeletal muscle: regenerative potential of skeletal muscle stem cells. Journal of Clinical Investigation. 120 (1), 11-19 (2010).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Lepper, C., Partridge, T. A., Fan, C. -. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Joe, A. W. B., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Uezumi, A., Fukada, S. -. I., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Seale, P., Sabourin, L. A., Girgis-Gabardo, A., Mansouri, A., Gruss, P., Rudnicki, M. A. Pax7 Is Required for the Specification of Myogenic Satellite Cells. Cell. 102 (6), 777-786 (2000).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- Fukada, S. -. I., et al. Molecular signature of quiescent satellite cells in adult skeletal muscle. Stem Cells. 25 (10), 2448-2459 (2007).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Joe, A., Wang, J., Rossi, F. Prospective isolation of adipogenic progenitors from skeletal muscle. Journal of Investigative Medicine. 55 (1), 124 (2007).
- Yi, L., Rossi, F. Purification of progenitors from skeletal muscle. Journal of Visualized Experiments. (49), e2476 (2011).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119 (4), 543-554 (2004).
- Montarras, D., et al. Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Conboy, M. J., Cerletti, M., Wagers, A. J., Conboy, I. M. Immuno-analysis and FACS sorting of adult muscle fiber-associated stem/precursor cells. Methods In Molecular Biology. 621, 165-173 (2010).
- de Morree, A., et al. Alternative polyadenylation of Pax3 controls muscle stem cell fate and muscle function. Science. 366 (6466), 734-738 (2019).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental Biology. 397 (1), 31-44 (2015).
- Mookhtiar, K., Randall Steinbrink, D., Van Wart, H. E. Mode of hydrolysis of collagen-like peptides by class I and class II Clostridium histolyticum collagenases: evidence for both endopeptidase and tripeptidylcarboxypeptidase activities. Biochemistry. 24 (23), 6527-6533 (1985).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. The Journal of Investigative Dermatology. 93 (2), 287-290 (1989).
- Baghdadi, M. B., et al. Reciprocal signalling by Notch-Collagen V-CALCR retains muscle stem cells in their niche. Nature. 557 (7707), 714-718 (2018).
- van Velthoven, C. T. J., de Morree, A., Egner, I. M., Brett, J. O., Rando, T. A. Transcriptional profiling of quiescent muscle stem cells in vivo. Cell Reports. 21 (7), 1994-2004 (2017).
- Machado, L., et al. In situ fixation redefines quiescence and early activation of skeletal muscle stem cells. Cell Reports. 21 (7), 1982-1993 (2017).
- Machado, L., et al. Tissue damage induces a conserved stress response that initiates quiescent muscle stem cell activation. Cell Stem Cell. 28 (6), 1125-1135 (2021).
- vanden Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Moore, D. K., Motaung, B., du Plessis, N., Shabangu, A. N., Loxton, A. G. SU-IRG consortium isolation of B-cells using Miltenyi MACS bead isolation kits. PloS One. 14 (3), 0213832 (2019).
- Liou, Y. -. R., Wang, Y. -. H., Lee, C. -. Y., Li, P. -. C. Buoyancy-activated cell sorting using targeted biotinylated albumin microbubbles. PloS One. 10 (5), 0125036 (2015).
- Brett, J. O., et al. Exercise rejuvenates quiescent skeletal muscle stem cells in old mice through restoration of Cyclin D1. Nature Metabolism. 2 (4), 307-317 (2020).
- Tabula Muris Consortium. A single-cell transcriptomic atlas characterizes ageing tissues in the mouse. Nature. 583 (7817), 590-595 (2020).
- de Morrée, A., et al. Staufen1 inhibits MyoD translation to actively maintain muscle stem cell quiescence. Proceedings of the National Academy of Sciences. 114 (43), 8996-9005 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены