Method Article
عزل مجموعات الخلايا الجذعية الهادئة عن العضلات الهيكلية الفردية
* These authors contributed equally
In This Article
Summary
يصف هذا البروتوكول عزل الخلايا الجذعية العضلية والأسلاف الليفية المسببة للدهون من عضلات الهيكل العظمي الفردية في الفئران. يتضمن البروتوكول تشريح عضلة واحدة ، وعزل الخلايا الجذعية عن طريق فرز الخلايا المنشطة بالفلورة ، وتقييم النقاء عن طريق تلطيخ التألق المناعي ، والقياس الكمي لدخول المرحلة S بواسطة مقايسة دمج 5-ethynyl-2'-deoxyuridine .
Abstract
تحتوي العضلات الهيكلية على مجموعات متميزة من الخلايا الجذعية البالغة التي تساهم في الاتزان الداخلي وإصلاح الأنسجة. تتمتع الخلايا الجذعية العضلية الهيكلية (MuSCs) بالقدرة على تكوين عضلات جديدة ، في حين تساهم الخلايا الجذعية الليفية (FAPs) في الأنسجة الداعمة للوحمة ولديها القدرة على صنع الخلايا الليفية والخلايا الشحمية. يتواجد كل من MuSCs و FAPs في حالة خروج دورة الخلية القابلة للانعكاس لفترات طويلة ، تسمى السكون. الحالة الهادئة هي مفتاح وظيفتها. عادة ما يتم تنقية الخلايا الجذعية الهادئة من أنسجة عضلية متعددة مجمعة معا في عينة واحدة. ومع ذلك ، فقد كشفت الدراسات الحديثة عن اختلافات واضحة في الملامح الجزيئية وعمق الهدوء من MuSCs المعزولة من العضلات المختلفة. يصف هذا البروتوكول عزل ودراسة MuSCs و FAPs من عضلات الهيكل العظمي الفردية ويقدم استراتيجيات لإجراء التحليل الجزيئي لتنشيط الخلايا الجذعية. يوضح بالتفصيل كيفية عزل وهضم العضلات ذات الأصول والسماكات والوظائف التنموية المختلفة ، مثل الحجاب الحاجز ، ثلاثية الرؤوس ، جراسيليس ، الظنبوب الأمامي (TA) ، الساق (GA) ، النعل ، الباسطة الرقمية الطويلة (EDL) ، وعضلات العضلة. يتم تنقية MuSCs و FAPs عن طريق فرز الخلايا المنشطة بالفلورة (FACS) وتحليلها عن طريق تلطيخ التألق المناعي ومقايسة دمج 5-ethynyl-2'-deoxyuridine (EdU).
Introduction
تتمتع العضلات الهيكلية بقدرة عالية على التجدد بسبب وجود الخلايا الجذعية العضلية (MuSCs). تقع MuSCs على الألياف العضلية ، أسفل الصفيحة القاعدية ، وتقيم في حالة هادئة من خروج دورة الخلية المطولة والقابلة للانعكاس1،2،3،4. عند الإصابة ، تنشط MuSCs وتدخل دورة الخلية لتؤدي إلى تضخيم السلف التي يمكن أن تتمايز وتندمج لتشكيل ألياف عضلية جديدة 2,5. أظهر العمل السابق أن MuSCs ضرورية للغاية لتجديد العضلات6،7،8. علاوة على ذلك ، يمكن ل MuSC واحد أن ينقش ويولد خلايا جذعية جديدة وألياف عضلية جديدة9. تحتوي العضلات الهيكلية أيضا على مجموعة من الخلايا اللحمية المتوسطة تسمى الأسلاف الليفية الأمينية (FAPs) ، والتي تلعب دورا مهما في دعم وظيفة MuSC أثناء تجديد العضلات6،10،11،12.
نظرا لقدرتها على تنسيق تجديد العضلات ، كان هناك اهتمام كبير بفهم كيفية عمل MuSCs و FAPs. يتم تمييز MuSCs الهادئة بالتعبير عن عوامل النسخ Pax7 و Sprouty1 ، ومستقبلات كالسيتونين بروتين سطح الخلية ، بينما يتم تمييز FAPs الهادئة بواسطة مستقبلات عامل النمو ألفا المشتقة من الصفائح الدموية لبروتين سطح الخلية (PDGFRa)10،12،13،14،15. أظهرت الدراسات السابقة أنه يمكن تنقية MuSCs و FAPs من العضلات الهيكلية باستخدام علامات سطح الخلية وفرز الخلايا المنشط بالفلورة (FACS) 9،15،16،17،18،19،20،21. في حين أن هذه البروتوكولات قد طورت بشكل كبير القدرة على دراسة MuSCs و FAPs ، فإن أحد العيوب هو أن معظم هذه البروتوكولات تتطلب عزل MuSCs من مجموعة من الأنسجة العضلية المختلفة. كشفت الأعمال الأخيرة منا ومن آخرين عن اختلافات في النمط الظاهري للخلية ومستويات التعبير الجيني بين MuSCs المعزولة من أنسجة مختلفة22,23. تظهر MuSCs من الحجاب الحاجز وثلاثية الرؤوس والجراسيليس تنشيطا أسرع من MuSCs من عضلات الأطراف الخلفية السفلية22 ، بينما تظهر MuSCs من العضلات خارج العين تمايزا أسرع من MuSCs من الحجاب الحاجز وعضلات الأطراف الخلفيةالسفلية 23.
يصف هذا البروتوكول عزل MuSCs و FAPs من العضلات الهيكلية الفردية (الشكل 1). وهذا يشمل تشريح الحجاب الحاجز ، ثلاثية الرؤوس ، جراسيليس ، الظنبوب الأمامي (TA) ، النعل ، الباسطة الرقمية الطويلة (EDL) ، الساق (GA) ، وعضلات العضلة. يتم فصل العضلات المقطعة لاحقا عن طريق الهضم الأنزيمي باستخدام كولاجيناز II (بروتياز يستهدف على وجه التحديد تسلسل Pro-X-Gly-Pro الأميني في الكولاجين ، مما يتيح تدهور النسيج الضام وتفكك الأنسجة24) و dispase (بروتياز يشق الفبرونيكتين والكولاجين الرابع ، مما يتيح المزيد من تفكك الخلايا25). يتم عزل MuSCs و FAPs من معلقات الخلية الواحدة بواسطة FACS. كأمثلة على المقايسات النهائية لتحليل الخلايا ، يتم تحديد تنشيط الخلايا الجذعية عن طريق فحص دمج 5-ethynyl-2'-deoxyuridine (EdU) ، بينما يتم تحديد نقاء الخلية عن طريق تلطيخ التألق المناعي للعلامات المحددة لنوع الخلية Pax7 و PDGFRa.
Protocol
تم تنفيذ البروتوكول الحالي وفقا للمبادئ التوجيهية لرعاية الحيوان في جامعة آرهوس ولوائح الأخلاقيات المحلية.
ملاحظة: تأكد من الامتثال للوائح اللجنة الأخلاقية المحلية للتجارب على الحيوانات والتعامل مع عينات القوارض بعد الوفاة. الفئران هي مصدر محتمل لمسببات الحساسية. إذا كان ذلك متاحا ، فقم بتشغيل تهوية العادم وضعها فوق مساحة العمل لتجنب التعرض المفرط لمسببات الحساسية. بدلا من ذلك ، ارتد قناعا للوجه إذا تم إجراء التجربة بانتظام. يتضمن هذا البروتوكول العمل مع الأدوات الحادة ، وينصح الباحثون بالتعرف على الإجراءات والخدمات اللوجستية لتطبيق الإسعافات الأولية في حالة القطع.
1. التحضير (1-2 ساعة ؛ في اليوم السابق للتشريح)
ملاحظة: يتم تحضير المحاليل والألواح والوسائط في ظروف معقمة وتصفيتها (0.45 ميكرومتر) قبل الاستخدام ما لم يذكر خلاف ذلك. تحضير محاليل مخزون ديسباز (11 وحدة / مل في PBS) وكولاجيناز II (1.000 وحدة / مل في PBS) وتخزينها في -20 درجة مئوية (الجدول 1). يتم إذابة المخزون واستخدامه للهضم الثانوي في الخطوة 4.2.6.
- طلاء الكولاجين من صفيحة نصف مساحة 96 بئرا
- تحضير المياه الحمضية. أضف 5.15 مل من حمض الأسيتيك الجليدي إلى 895 مل من الماء المعقم في كأس زجاجية سعة 2 لتر.
- قم بتصفية المحلول باستخدام وحدة تصفية 0.45 ميكرومتر ، 500 مل. انقل 800 مل من الماء الحمضي المصفى إلى زجاجة سعة 1 لتر.
- أضف 40 مل من محلول مرق الكولاجين المعقم إلى الزجاجة. امزج المحلول برفق عن طريق التدوير وخزنه على حرارة 4 درجات مئوية ، محميا من الضوء ، حتى الاستخدام.
- قم بتغطية واحد أو أكثر من الأطباق نصف المساحة المكونة من 96 بئرا بالكولاجين. أضف 50 ميكرولتر من محلول طلاء الكولاجين إلى كل بئر وقم بتغطية اللوحة طوال الليل (ON) عند 4 درجات مئوية.
- قم بنضح محلول الكولاجين في اليوم التالي باستخدام شفاط قائم على الفراغ واغسل اللوحة 2x بإضافة 100 ميكرولتر من الماء المعقم والشفط.
- قم بإمالة غطاء اللوحة واترك اللوحة تجف في الغطاء لمدة 20-30 دقيقة.
- عندما يجف الطبق تماما ، لفه بورق الألمنيوم ، واحفظه على حرارة 4 درجات مئوية حتى الاستخدام. يمكن تخزين الألواح المطلية لمدة تصل إلى 4 أسابيع.
ملاحظة: طلاء الكولاجين يتيح التصاق الخلايا. من المهم غسل الكولاجين الحر لأنه قد يتداخل مع وظيفة الخلية والإشارات (على سبيل المثال ، ارتباط الكولاجين V بمستقبلات الكالسيتونين في MuSCs)26.
2. التحضير (0.5 ساعة ؛ يوم التشريح):
- إعداد حلول إضافية ومساحة عمل
- قم بإعداد وسط غسيل معقم بإضافة 50 مل من مصل الحصان و 5 مل من القلم / البكتيريا إلى 445 مل من وسط F10 من HAM. العمل في غطاء التدفق الصفحي لمنع التلوث.
- احسب ووزن الكمية المناسبة من كولاجيناز II اللازمة لإعداد المخزن المؤقت للتفكك. (لكل فأر ، يتم استخدام 26000 وحدة من كولاجيناز II لصنع 40 مل من المخزن المؤقت للتفكك عند 650 وحدة / مل كولاجيناز II). أضف المسحوق المثقل إلى أنبوب مخروطي سعة 50 مل وقم بتخزينه على الثلج.
- تحضير طبقين 10 سم لعزل العضلات. صب 3 مل من وسط الغسيل (الجدول 1) في كل طبق بتري. أحضر الأطباق مقاس 10 سم خارج شفاط التدفق الصفحي لاستخدامها لاحقا.
- تحضير المواد لهضم العضلات. بناء على عدد العينات ، قم بتسمية العدد المناسب من الأنابيب المخروطية سعة 50 مل (ثمانية لكل فأر ، واحد لكل عضلة) واتركها على المقعد. رش الإبر ومحاقن 10 مل ومصافي الخلايا 40 ميكرومتر بإيثانول 70٪ (ثمانية من كل فأر ، واحد لكل عضلة) وأحضرها داخل غطاء التدفق الصفحي. نعلق الإبر على المحاقن.
- تحضير المواد للفرز. قم بتسمية أنابيب القاع المستديرة سعة 5 مل مع أغطية مصفاة الخلايا بناء على عدد العينات. قم بتغطية الأنابيب بورق الألمنيوم واتركها في غطاء التدفق الرقائقي.
- وفقا لعدد العينات والمجموعات التي يتم فرزها ، قم بإعداد أنابيب طرد مركزي دقيقة سعة 1.5 مل مع 500 ميكرولتر من وسط الغسيل لجمع الخلايا (16 لكل فأر ، أنبوب واحد لكل خلية لكل نسيج عضلي). تخزين هذه الأنابيب على الجليد.
3. تشريح العضلات (20-30 دقيقة)
ملاحظة: يتم تنفيذ هذا القسم من البروتوكول في بيئة غير معقمة. يمكن تنفيذ الإجراء باستخدام واحد أو عدة فئران. ومع ذلك، يكفي ماوس واحد لإعداد كل من العينات للفرز والضوابط لإعداد بوابات التعويض ونظام مراقبة الأصول الميدانية.
- بدء عزل العضلات
- تحضير مساحة العمل غير المعقمة للتشريح وعزل العضلات. تطهير محطة العمل مع 70 ٪ من الإيثانول. ضع وسادة سفلية واقية معقمة يمكن التخلص منها على محطة العمل.
- باستخدام علامة دائمة ، ارسم مربعا لكل عضلة أعلى غطاء طبق بتري لوضع العضلات المعزولة لاحقا.
- رش الأدوات الجراحية بنسبة 70٪ من الإيثانول.
- القتل الرحيم للفأر عن طريق استنشاق CO2 و / أو خلع عنق الرحم.
- عزل العضلات الفردية (من فأر واحد في كل مرة في حالة استخدام عدة فئران). رش الماوس مع الإيثانول 70 ٪ لتبليل الفراء وتطهير الجلد. ضع الماوس على الوسادة السفلية مع توجيه البطن لأعلى. يوضح الشكل 2 أ نظرة عامة على جميع العضلات الثماني وموقعها التشريحي.
- عزل عضلات جراسيليس
- استخدم مقصا لعمل شق أفقي 0.5 سم في جلد البطن.
- إزالة الجلد: باستخدام كلتا يديك ، استخدم الإبهام والسبابة للإمساك بالجزء العلوي والسفلي من الشق. اسحب كل جانب من الشق لتمزيق وفصل جلد الجذع والأطراف السفلية. اسحب جلد الطرف السفلي لأسفل لكشف كلا الطرفين الخلفيين (لأسفل من الورك إلى أصابع القدم). وبالمثل ، اسحب لأعلى لفضح الجذع.
- حدد موقع عضلة جراسيليس (الفخذ الداخلي). باستخدام ملقط منحني ، أمسك بالجراسيليس وارفع العضلات قليلا (الشكل 2 ب). باستخدام المقص ، قم بعمل شق 0.5 سم (الشكل 2 ج) ، حيث يتم قطع جراسيليس وعزله بالكامل (الشكل 2 د). كرر هذا للساق الأخرى لعزل عضلة جراسيليس الثانية.
- عزل عضلات TA و EDL (الطرف الخلفي السفلي ، الجانب البطني)
- باستخدام مشرط ، قم بقطع اللفافة عن طريق إجراء شق 0.5 سم على طول الجانب الجانبي من الظنبوب (أثخن عظم خلفي سفلي). استخدم ملقط منحني للإمساك باللفافة وسحبها لإزالتها.
ملاحظة: عندما تتم إزالة اللفافة بالكامل ، تكون الأوتار الموجودة في الطرف البعيد من الساق الخلفية مرئية ويمكن فصلها. - استخدم ملقط مستقيم مع أطراف فائقة الدقة للدخول بين الوتر البعيد ل TA (الجانب الجانبي من الساق) و EDL (أسفل TA) (الشكل 2E-G).
ملاحظة: مع الخبرة ، يمكن استخدام الطرف الحاد لشفرة المشرط بدلا من الملقط المستقيم. - حرك الملقط نحو الطرف القريب من العضلة لفصل العضلات.
- أعد الملقط المستقيم إلى النهاية البعيدة. قطع الوتر البعيد.
- أمسك بلطف الوتر البعيد للعضلة بالملقط المنحني. ارفع العضلة لأعلى وفوق ملحقها القريب واقطع الوتر القريب بعناية بالقرب من نقطة التعلق قدر الإمكان. قطع الطرف الآخر ونقل TA إلى طبق بتري.
- استخدم ملقط مستقيم مع أطراف فائقة الدقة للذهاب تحت الوتر البعيد ل EDL.
- حرك الملقط نحو الطرف القريب من العضلة لفصل العضلات.
- أعد الملقط المستقيم إلى النهاية البعيدة. قطع الوتر البعيد دون الإضرار بالعضلات.
- أمسك بلطف الوتر البعيد ل EDL بالملقط المنحني. ارفع العضلة لأعلى وفوق ملحقها القريب واقطع الوتر القريب بعناية بالقرب من نقطة التعلق قدر الإمكان. قطع الطرف الآخر ونقل EDL إلى طبق بتري. كرر ذلك مع الطرف الخلفي الآخر لعزل عضلات TA و EDL الثانية.
- باستخدام مشرط ، قم بقطع اللفافة عن طريق إجراء شق 0.5 سم على طول الجانب الجانبي من الظنبوب (أثخن عظم خلفي سفلي). استخدم ملقط منحني للإمساك باللفافة وسحبها لإزالتها.
- عزل GA والعضلات الوحيدة (الطرف الخلفي السفلي ، الجانب الظهري)
- استخدم ملقط مستقيم مع أطراف فائقة الدقة للدخول بين وتر العرقوب وعظام الطرف الخلفي السفلي.
- حرك الملقط نحو الطرف القريب من العضلة لفصل العضلات.
- أعد الملقط المستقيم إلى النهاية البعيدة. قطع الوتر البعيد.
ملاحظة: من أجل تجنب إتلاف العضلة النعلية ، التي تقع أسفل GA ، قم بقطع أقرب ما يمكن من ارتباط وتر العرقوب البعيد ، تاركا جزءا من الوتر متصلا ب GA (الشكل 2H). - للكشف عن العضلة النعلية وعزلها ، اسحب GA لأعلى وفوق الشظية (أنحف عظمة من العظمتين في الطرف الخلفي السفلي).
ملاحظة: تتميز العضلة الوحيدة بلونها الأحمر الداكن المميز بالنسبة إلى GA (الشكل 2I). - حدد موقع الوتر النعل القريب. باستخدام ملقط مستقيم ، انتقل بين النعل و GA.
- حرك الملقط نحو الطرف البعيد للعضلة لفصل النعل عن GA.
- عزل النعل أولا. قطع الوتر القريب ، والاستيلاء على الوتر بالملقط المنحني ، ورفع النعل بعناية للوصول إلى الوتر البعيد. قطع الوتر البعيد لعزل النعل عن GA. ضع النعل في طبق بتري مع وسط غسيل (الشكل 2J)
- قطع GA ووضعه في طبق بتري. كرر هذا للساق الأخرى لعزل العضلات الثانية وعضلات GA.
- عزل عضلات ثلاثية الرؤوس (الطرف الأمامي العلوي ، الجانب الظهري)
- استخدم ملقط مستقيم مع أطراف فائقة الدقة للدخول بين عضلة ثلاثية الرؤوس وعظم العضد (العظم الرئيسي للساق الأمامية العلوية) (الشكل 2K-M).
- حرك الملقط نحو الطرف القريب من العضلة لفصل العضلات. قطع الطرف القريب من العضلات.
- أمسك الطرف القريب من ثلاثية الرؤوس بالملقط المنحني واسحبه لأعلى وفوق الكوع للوصول إلى الوتر البعيد. قطع الوتر البعيد من ثلاثية الرؤوس ، ونقل العضلات إلى طبق بتري ، وكرر الإجراء للطرف الأمامي الآخر.
- عزل عضلات العضل
- إزالة الفراء والجلد من الفك. قم بعمل شق أفقي 0.5 سم بالمقص. باستخدام كلتا يديك ، اضغط على كل جانب من الشق باستخدام إصبعي الإبهام والسبابة. إزالة الجلد عن طريق سحب صعودا وهبوطا.
- حدد موقع الوتر الرئيسي للعضل (الذيلي، أسفل العين). أدخل شفرة المشرط المسطح بين العظم والعضلات (الشكل 2 ن). قطع الوتر.
- أمسك وتر العضلة الرئيسية بالملقط المنحني. اقطعها بشفرة مشرط أو مقص في اتجاه المنضدة لفصل عضلة العضلة الماضغة عن عظم الفك (الشكل 2O ، P). ضع عضلة الماضغة المعزولة في طبق بتري. كرر الإجراء لعضلة العضل الثانية.
- عزل عضلة الحجاب الحاجز
ملاحظة: عند عزل عضلة الحجاب الحاجز ، تأكد من قطعها بعناية لتجنب قطع الأعضاء الداخلية والأمعاء ، لأن هذا مصدر للتلوث.- باستخدام المقص ، قم بعمل بضع الصدر (قطع بين الأضلاع) في منتصف القص (عظم مسطح طويل ، يقع في منتصف الصدر ، يربط الأضلاع) ويقطع القص (الشكل 2Q).
- كشف الحجاب الحاجز عن طريق قطع 360 درجة من خلال القفص الصدري.
- افصل الجزء العلوي من الجسم عن الجزء السفلي / البطن. باستخدام مقص ، قم بقطع القصبة الهوائية والمريء والوريد الأجوف والشريان الأورطي البطني.
- افصل الحجاب الحاجز عن الجزء السفلي من الجسم. باستخدام المقص ، قم بعمل بضع البطن (شق جراحي في تجويف البطن) 1 سم تحت القص وقم بعمل قطع 360 درجة (الشكل 2R).
- ضع المقص المغلق بين القفص الصدري وأعضاء البطن واضغط لأسفل. اسحب القفص الصدري برفق لفصله عن أعضاء البطن (الشكل 2S).
- افصل الحجاب الحاجز عن القفص الصدري. امسك الحجاب الحاجز بشكل فضفاض بين إصبعين وقطع القفص الصدري بالمقص. استخدم المقص لقطع الحجاب الحاجز بالقرب من الضلوع قدر الإمكان في قطع 360 درجة. ضع الحجاب الحاجز المعزول في طبق بتري.
ملاحظة: أثناء خلع عنق الرحم ، قد يتمزق الحجاب الحاجز وينهار ضد القفص الصدري ، مما يجعل من الصعب تحديد موقعه. لا يزال من الممكن عزل العضلات. حدد العضلة المنهارة ، وأمسكها بين إصبعين ، واقطع 360 درجة بعد القفص الصدري.
4. هضم العضلات إلى تعليق خلية واحدة (~ 1 ساعة 35 دقيقة)
ملاحظة: تتضمن الخطوات التالية بيئات العمل غير المعقمة (الخطوات 4.1-4.2) وبيئات العمل المعقمة (الخطوة 4.3).
- الهضم الميكانيكي
- ضع العضلات المعزولة في غطاء طبق بتري 10 سم.
- باستخدام ملقط منحني ، أمسك بالعضلات المعزولة واحدة تلو الأخرى. بالنسبة للنعل و GA ، قم بإزالة الأجزاء المتبقية من وتر العرقوب.
- باستخدام المقص ، قم بفرم العضلات المعزولة واحدة تلو الأخرى عن طريق تقطيعها إلى حوالي 1 مم3 قطع.
- الهضم الأنزيمي
- قم بإعداد المخزن المؤقت لتفكك العضلات عن طريق إضافة 40 مل من وسط الغسيل البارد إلى مسحوق كولاجيناز II الموزن (كولاجيناز II: 650 وحدة / مل في وسائط الغسيل).
ملاحظة: استخدم عازل تفكك العضلات المحضر حديثا لضمان النشاط الأنزيمي الأمثل. - انقل العضلات المفرومة إلى أنبوب مخروطي سعة 15 مل يحتوي على 5 مل من محلول التفكك.
- احتضان الأنبوب لمدة 35 دقيقة في حمام مائي يهتز 37 درجة مئوية عند 60 دورة في الدقيقة.
- بعد الحضانة ، أضف وسط الغسيل إلى حجم إجمالي قدره 15 مل. أدر الأنبوب عند 1600 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- قم بشفط المادة الطافية إلى حجم 4 مل باستخدام شفاط قائم على التفريغ. لتجنب إزعاج الحبيبات ، قم بنضح ببطء من الأعلى وإزالة أي دهون عائمة.
- ذوبان الجليد حصص الأسهم من dispase وكولاجيناز II. أضف 500 ميكرولتر من محلول كولاجيناز II (مخزون 1000 وحدة / مل ، -20 درجة مئوية) إلى العينة المتبقية 4 مل. بعد ذلك ، أضف 500 ميكرولتر من محلول dispase (مخزون 11 وحدة / مل ، -20 درجة مئوية).
ملاحظة: يمكن أن يولد Dispase راسبا. في حالة حدوث ذلك ، قم بتدوير محلول مخزون dispase عند 10000 × جم ، قبل 1 دقيقة من الاستخدام. انقل المادة الطافية الواضحة الآن إلى تعليق الخلية دون إزعاج الحبيبات. - دوامة العينات لفترة وجيزة لإذابة بيليه.
- احتضان العينات لمدة 20 دقيقة في حمام مائي يهتز 37 درجة مئوية عند 60 دورة في الدقيقة.
ملاحظة: هضم عدد كبير من عينات العضلات يستغرق وقتا طويلا. بالنسبة للخطوات 4.3.1-4.3.6 ، تقدير أخذ 2-5 دقائق لكل عينة. تسير هذه الخطوة بشكل أسرع عندما يتم تنفيذها بالتوازي من قبل باحثين أو أكثر.
- قم بإعداد المخزن المؤقت لتفكك العضلات عن طريق إضافة 40 مل من وسط الغسيل البارد إلى مسحوق كولاجيناز II الموزن (كولاجيناز II: 650 وحدة / مل في وسائط الغسيل).
- تجانس العينات
- تجانس تعليق الخلية. انقل المعلق من أنبوب سعة 15 mL إلى أنبوب سعة 50 mL. استخدم حقنة سعة 10 مل مع إبرة 20 جيجا لإعادة تعليق العينة عن طريق سحب العينة لأعلى ولأسفل عبر الإبرة 5x.
ملاحظة: إذا كانت قطع العضلات غير المهضومة تسد الإبرة ، فامسحها على منديل ورقي. - ضع مصفاة خلية 40 ميكرومتر على أنبوب مخروطي جديد سعة 50 مل.
- خذ معلق الخلية الكامل في المحقنة وقم بتصفية العينة في أنبوب مخروطي جديد سعة 50 مل مع مصفاة خلوية في الأعلى. صفي العينة عن طريق توزيع الحجم الكلي مباشرة على الفلتر.
- لاسترداد جميع الخلايا أحادية النواة ، أضف 20 مل من وسط الغسيل إلى الأنبوب المخروطي الفارغ واسكبه من خلال مصفاة الخلية في الأنبوب المخروطي سعة 50 مل الذي يحتوي على العينة المتوترة. استرجع وحدة التخزين المتبقية تحت مصفاة الخلية باستخدام ماصة p1000.
- تخلص من مصفاة الخلية وقم بتدوير العينة عند 1600 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- عن طريق السحب باستخدام ماصة p1000 ، قم بنضح المادة الطافية دون إزعاج الحبيبات.
- عن طريق السحب باستخدام ماصة p1000 ، أعد تعليق حبيبات الحجاب الحاجز في 500 ميكرولتر من وسط الغسيل وأعد تعليق عينات العضلات الأخرى في 300 ميكرولتر من وسط الغسيل لكل منها.
ملاحظة: الحجاب الحاجز هو أكبر العضلات التي تحتوي على أعلى محتوى من الخلايا الجذعية وبالتالي يمكن استخدامه للتحكم في البقع.
- تجانس تعليق الخلية. انقل المعلق من أنبوب سعة 15 mL إلى أنبوب سعة 50 mL. استخدم حقنة سعة 10 مل مع إبرة 20 جيجا لإعادة تعليق العينة عن طريق سحب العينة لأعلى ولأسفل عبر الإبرة 5x.
5. تلطيخ والفرز (~ 40 دقيقة + 30 دقيقة فرز / عينة)
ملاحظة: العمل في بيئة معقمة على الجليد للخطوات التالية.
- نقل حصة 50 ميكرولتر من معلق خلية الحجاب الحاجز إلى أربعة أنابيب طرد مركزي دقيقة جديدة سعة 2 مل لبقع التحكم (50 ميكرولتر لكل منها). أضف 250 ميكرولتر من وسط الغسيل إلى كل أنبوب تحكم إلى حجم نهائي يبلغ 300 ميكرولتر.
- أضف 3 ميكرولتر (1: 100) من الأجسام المضادة الفلورية ناقص واحد (FMO-control) إلى أنابيب تلطيخ التحكم الثلاثة واترك أنبوبا واحدا بدون أجسام مضادة (تحكم غير ملوث) (انظر الجدول 2).
- أضف 3 ميكرولتر (1: 100) من الأجسام المضادة (VCAM1-PECy7 و CD45-FITC و CD31-FITC و SCA1-PacificBlue) إلى معلقات الخلية الواحدة المتبقية في العضلات ، بما في ذلك عينة الحجاب الحاجز المتبقية.
- احتضان معلقات الخلية لمدة 15 دقيقة عند 4 درجات مئوية في شاكر الرأس فوق الرأس.
ملاحظة: تعد تلطيخ التحكم ضرورية لتحديد مستويات مضان الخلفية وتعيين بوابات قياس التدفق الخلوي. يمكن استخدام أجسام مضادة مختلفة ، ولكن سيكون لكل منها تركيز عمل محدد ووقت حضانة يحتاج إلى اختبار. إذا تم استخدام الأجسام المضادة من بائعين مختلفين ، فقد يختلف التركيز ، وبالتالي التخفيف. يمكن إضافة صبغة صلاحية الخلية إلى خليط التلوين للتخلص من أي خلايا ميتة أو ميتة أثناء الفرز. - أدر العينات عند 1600 × جم لمدة 5 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية دون إزعاج الحبيبات عن طريق الماصة.
- عن طريق السحب باستخدام ماصة p1000 ، أعد تعليق كل عينة في 800 ميكرولتر من وسط الغسيل.
- قم بتصفية العينات باستخدام أنبوب FACS مع غطاء مصفاة خلية (40 ميكرومتر) لإزالة أي كتل خلوية متبقية (أو مجاميع).
- اغسل مصفاة الخلية بإضافة 800 ميكرولتر إضافية من وسط الغسيل.
- احتفظ بالعينات مغطاة بورق الألمنيوم على الثلج حتى التحليل.
ملاحظة: إذا ظهر تعليق الخلية في هذه المرحلة غائما / كثيفا بسبب التركيز العالي للخلايا ، أضف 800 ميكرولتر إضافية من وسط الغسيل لتقليل كثافة الخلية. - ابدأ تشغيل FACS بفوهة 70 ميكرومتر.
- استخدم عناصر التحكم غير الملوثة و FMO لتعيين استراتيجية البوابة: MuSCs سلبية ل CD45-FITC و CD31-FITC و SCA1-PacBlue ، وهي إيجابية ل VCAM1-PECy7 ؛ FAPs سلبية ل CD45-FITC و CD31-FITC و VCAM1-PECy7 وإيجابية ل SCA1-PacBlue.
- قم بفرز المعلقات أحادية الخلية الملطخة باستخدام فرز ثنائي الاتجاه واجمع MuSCs و FAPs في أنابيب تجميع منفصلة تحتوي على 500 ميكرولتر من وسط الغسيل.
ملاحظة: باستخدام FACS مع أربعة ليزر (التكوين: فوهة 70 ميكرومتر ، 405 نانومتر ، 488 نانومتر ، 561 نانومتر ، 633 نانومتر) ، لا تتطلب المجموعة المختارة من الفلوروفورات تعويض إشارة التألق. ومع ذلك ، في حالة استخدام مقياس تدفق خلوي مختلف أو مجموعة مختلفة من الفلوروفورات ، يوصى باستخدام عينات تحكم إضافية أحادية اللون للتعويض. من العضلات الأصغر (EDL ، النعل ، TA) ، من المتوقع أن تكون غلة 3000 MuSCs و 5000 FAPs. بالنسبة للعضلات الأكبر الأخرى ، من المتوقع أن تكون غلة 20000 MuSCs و FAPs. وقد تنحرف أعداد الأحداث المدرجة بواسطة برنامج FACS عن العدد الفعلي للخلايا القابلة للحياة في أنبوب التجميع. يمكن تأكيد أرقام الخلايا عن طريق عد الخلايا باستخدام مقياس الدم. - قم بتدوير الخلايا التي تم فرزها عند 1600 × جم لمدة 5 دقائق عند 4 درجات مئوية. عن طريق السحب ، نضح الطاف دون إزعاج حبيبات الخلية.
- أضف 100 ميكرولتر من وسط الغسيل إلى كل عينة وأعد تعليق الخلايا بعناية دون إنشاء فقاعات هواء. انقل 100 ميكرولتر من العينة المعاد تعليقها إلى صفيحة نصف منطقة 96 بئر مغلفة بالكولاجين. لوحة 1000-3000 خلية لكل بئر.
ملاحظة: إذا لم يتم إعادة تأهيل الخلايا بشكل صحيح ، فقد تلتصق الخلايا ببعضها البعض في كتل ، مما يربك التحليلات المجهرية اللاحقة. - افحص الخلايا تحت المجهر ولاحظ توزيعها وشكلها وحجمها.
- احتضان اللوحة عند 37 درجة مئوية ، 5٪ CO2. سوف تلتصق الخلايا في غضون 2 ساعة.
ملاحظة: يوصى بتأكيد نقاء مجموعات الخلايا التي تم جمعها ، إما عن طريق تحليل قياس التدفق الخلوي (عن طريق تحميل حصة من العينة التي تم فرزها على جهاز الفرز وتسجيل عدد صغير من الأحداث) أو عن طريق تلطيخ الأجسام المضادة للخلايا المطلية متبوعا بالفحص المجهري (Pax7 هو علامة تعريف ل MuSCs للفأر ، PDGFRa هو علامة تعريف ل FAPs للفأر). بدءا من القسم 7 أدناه هو بروتوكول لتلطيخ الخلايا لمستويات البروتين Pax7 و PDGFRa.
6. مقايسة تأسيس EdU
ملاحظة: اعمل في ظروف معقمة واستخدم غطاء الدخان الكيميائي عند التعامل مع بارافورمالدهايد (PFA) للخطوات التالية. EdU هو نظير نيوكليوتيد مدمج في الحمض النووي حيث تمر الخلايا بالمرحلة S من دورة الخلية. هو مطفر بتركيزات عالية. احرص دائما على ارتداء القفازات عند التعامل مع EdU. تحقق من الإرشادات المحلية للتعامل مع نفايات EdU.
- نبض EdU (اليوم 1)
- قم بإعداد حل عملي من 2x EdU في وسط غسيل جديد.
- خذ لوحة 96 بئرا مع الخلايا خارج الحاضنة. افحص الخلايا تحت المجهر لمراقبة التقاء. انتقل إلى غطاء التدفق الصفحي.
- قم بإزالة 50 ميكرولتر من الوسط من اللوحة عن طريق الماصة. أضف 50 ميكرولتر من محلول عمل 2x EdU بحيث يكون الحجم النهائي في البئر 100 ميكرولتر.
- استزراع الخلايا في وجود EdU للفترة الزمنية المقصودة عند 37 درجة مئوية ، 5٪ CO2.
ملاحظة: يمكن أن يختلف توقيت ومدة نبض EdU. في المتوسط ، تستغرق MuSCs الهادئة يومين لتنشيط وإكمال انقسام الخلايا الأول19 بالكامل. يمكن إضافة EdU إلى الخلايا التي تم فرزها مباشرة بعد الطلاء.
- التثبيت (اليوم 2)
ملاحظة: PFA مادة مسرطنة. تعامل دائما مع PFA بعناية. التعرف على اللوائح المحلية للتعامل مع PFA والتخلص من النفايات.- خذ لوحة 96 بئرا مع الخلايا خارج الحاضنة. افحص الخلايا الموجودة تحت المجهر وانقل اللوحة إلى غطاء الدخان.
- عن طريق السحب ، قم بإزالة الوسط وإصلاح الخلايا عن طريق إضافة 50 ميكرولتر من 4٪ PFA إلى كل بئر. احتضن اللوحة لمدة 10 دقائق في درجة حرارة الغرفة (RT) في غطاء دخان كيميائي.
- قم بإزالة PFA باستخدام ماصة وتخلص منها في حاوية نفايات مناسبة.
- اغسل الخلايا بإضافة 100 ميكرولتر من برنامج تلفزيوني إلى جميع الآبار. عن طريق السحب ، استنشق PBS وكرر الغسيل. الحفاظ على الخلايا في 100 ميكرولتر من PBS.
ملاحظة: لتجنب غسل أي خلايا ، قم بتوزيع PBS على جانب البئر عن طريق السحب ببطء.
- وضع العلامات EdU
- قم بتخلل الخلايا قبل اكتشاف EdU عن طريق إزالة PBS وإضافة 100 ميكرولتر من 0.5٪ Triton X-100 في PBS. احتضن الطبق لمدة 5 دقائق عند 4 درجات مئوية.
ملاحظة: Triton X-100 هو خافض للتوتر السطحي ويمكن أن يسبب تهيج الجلد. تعامل بحذر واستخدم القفازات دائما. - بعد 5 دقائق ، نضح Triton X-100 وأضف 100 ميكرولتر من PBS.
- قم بإعداد مزيج تفاعل كيمياء النقر EdU وفقا لبروتوكول الشركة المصنعة.
- نضح PBS وأضف 33 ميكرولتر من مزيج تفاعل كيمياء النقر EdU. احتضان الطبق لمدة 30 دقيقة في RT.
- نضح مزيج تفاعل EdU فوق الكيمياء واغسل الخلايا ب 100 ميكرولتر من PBS.
- نضح PBS ، أضف 100 ميكرولتر من PBS مع Hoechst (1: 2,000) ، واحتضان محمية من الضوء لمدة 10 دقائق في RT.
- نضح Hoechst واغسله مرتين بإضافة 100 ميكرولتر من برنامج تلفزيوني. قم بتخزين الخلايا في 100 ميكرولتر من PBS عند 4 درجات مئوية في الظلام.
- صور الخلايا على مجهر مقلوب. يمكن تخزين الخلايا في الظلام لعدة أشهر طالما أن الآبار لا تجف.
ملاحظة: من الممكن أن تشارك في تلطيخ الخلايا بالأجسام المضادة. في هذه الحالة ، تابع خطوة الحجب متبوعة بالحضانة بالجسم المضاد الأساسي. اختر جسما مضادا ثانويا يحتوي على فلوروفور مترافق لا يتداخل طيف انبعاثه مع طيف الفلوروفور المستخدم للكشف عن EdU. تأكد من عدم استخدام الأجسام المضادة الثانوية مع الفلوروفورات المتداخلة مع النطاق الطيفي ل Hoechst.
- قم بتخلل الخلايا قبل اكتشاف EdU عن طريق إزالة PBS وإضافة 100 ميكرولتر من 0.5٪ Triton X-100 في PBS. احتضن الطبق لمدة 5 دقائق عند 4 درجات مئوية.
7. تلطيخ المناعي
ملاحظة: يمكن تنفيذ هذا الجزء من البروتوكول بشكل مستقل عن القسم 6. عند تخطي القسم 6 ، يرجى تنفيذ الخطوتين 6.3.1 و 6.3.2 لتمكين نفاذية الخلية قبل المتابعة مع الخطوة 7.2 أدناه.
- أخرج اللوحة التي تحتوي على الخلايا التي تحمل علامة EdU.
- قم بإعداد 20 مل من المخزن المؤقت للحظر بإضافة 2 مل من مصل الحمير إلى 18 مل من PBS.
- لمنع ارتباط الأجسام المضادة غير المحددة ، قم بإزالة 100 ميكرولتر من PBS من كل بئر وأضف 50 ميكرولتر من المخزن المؤقت للحظر باستخدام ماصة p200. احتضن اللوحة لمدة 30 دقيقة في RT ، محمية من الضوء ومغطاة بورق الألمنيوم لمنع التبييض الضوئي ل EdU المسمى بالفلوروفور.
ملاحظة: يتم تثبيت الخلايا في قاع البئر ولكن يمكن فصلها إذا تم تطبيق الكثير من القوة عند سحب الماصة. - أثناء حظر العينات ، قم بإعداد مزيج الأجسام المضادة الأساسي. أضف 8.0 ميكرولتر (1: 100) من الفئران المضادة ل Pax7 والأرانب المضادة ل PDGFRa إلى 800 ميكرولتر من المخزن المؤقت المانع لتلطيخ 16 بئرا (ثمانية أنسجة ، نوعان من الخلايا).
- بعد الحجب ، قم بإزالة مصل الحمار وإضافة 50 ميكرولتر من مزيج الأجسام المضادة الأساسي إلى كل بئر. احتضان اللوحة طوال الليل عند 4 درجات مئوية ، مغطاة بورق الألمنيوم.
- بعد الحضانة ، قم بإزالة الجسم المضاد الأساسي وإضافة 50 ميكرولتر من Triton (0.5٪ في PBS) إلى كل بئر. احتضن اللوحة لمدة 5 دقائق في RT محمية من الضوء ، لغسل الجسم المضاد غير المقيد. كرر الغسيل ثلاث مرات.
- قم بإعداد المزيج الرئيسي للأجسام المضادة الثانوية عن طريق إضافة 1.0 ميكرولتر (1: 1000) من مضاد للحمار للفأر Alexa647 ومضاد للحمار - أرنب Alexa555 إلى أنبوب طرد مركزي دقيق يحتوي على 1000 ميكرولتر من المخزن المؤقت للحجب.
- أضف 33 ميكرولتر من المزيج الرئيسي للأجسام المضادة الثانوية إلى كل بئر. احتضان اللوحة لمدة 60 دقيقة في RT محمية من الضوء.
- قم بإزالة الجسم المضاد الثانوي الزائد عن طريق السحب ، وأضف 50 ميكرولتر من Triton (0.1٪ في PBS) ، واحتضانها لمدة 5 دقائق في RT محمية من الضوء. كرر الغسيل ثلاث مرات.
- أخيرا ، أضف 100 ميكرولتر من برنامج تلفزيوني. قرر ما إذا كنت تريد تصوير اللوحة على الفور باستخدام مجهر مضان مقلوب مع كاميرا CCD مبردة ، أو قم بتخزين اللوحة عند 4 درجات مئوية حتى يتم تحليلها لاحقا عن طريق إغلاق حواف اللوحة ببارافيلم ولف اللوحة المختومة بورق الألمنيوم.
النتائج
باتباع بروتوكول عزل العضلات الهيكلية الفردية (الشكل 2) ، تم عزل عضلات جراسيليس ، تا ، إي دي إل ، جا ، نعل ، ثلاثية الرؤوس ، مدلك ، والحجاب الحاجز من ثلاثة ذكور فئران سويسرية مهجنة تم إيقافها من برنامج تربية محلي (الشكل 2). بعد تفكك الأنسجة وتلطيخ الأجسام المضادة ، تم تنقية MuSCs و FAPs من العضلات الفردية بواسطة FACS (الشكل 3). تم الحصول على البوابة الأولية بعينة غير ملوثة لتحديد الخلايا وفصل المفردات عن الثنائيات (الشكل 3 أ). تم تعيين البوابات اللاحقة باستخدام ضوابط FMO لتحديد عتبات التلوين (الشكل 3B). ثم تم إغلاق العينة الملطخة ل CD31 / CD45-FITC و Sca1-PacBlue. تم فرز SCA1 + / CD31- / CD45- السكان (FAPs) في أنبوب تجميع منفصل ، بينما تم تصنيف السكان السالبين المزدوج ورسمهم ل VCAM1-PECy7 والتشتت الأمامي (FSC). تم فرز مجموعة VCAM1 + (MuSCs) في أنبوب تجميع منفصل. تم تحديد كمية MuSCs و FAPs كنسبة مئوية من المفردات (الجدول 3) وفرزها في أنابيب تجميع منفصلة تحتوي على 500 ميكرولتر من وسط الغسيل. تحتوي معلقات الحجاب الحاجز وعضلة ثلاثية الرؤوس أحادية الخلية على وفرة نسبية أعلى من MuSCs من FAPs ، في حين أن المعلقات أحادية الخلية الأخرى لها وفرة نسبية أعلى من FAPs من MuSCs (الجدول 3).
من بين الخلايا التي تم فرزها ، تم زرع 1000-3000 خلية وحضنها لمدة 24 ساعة. بعد 24 ساعة من الحضانة ، تمت إزالة الوسط واستبداله بوسط جديد يحتوي على EdU. تم تثبيت الخلايا في 48 ساعة ، ملطخة ل EdU ، وبعد ذلك بأجسام مضادة ضد بروتين Pax7 أو بروتين PDGFRa ، وتم تصويرها باستخدام مجهر التألق المقلوب. تم قياس الصور باستخدام المكون الإضافي Fiji في ImageJ. لوحظ تلطيخ قوي ل EdU ، على الرغم من أن جزء الخلايا الإيجابية EdU كان مختلفا لنوعي الخلايا الجذعية والعضلات المختلفة (الشكل 4A-C). أظهرت MuSCs المعزولة من EDL أو GA اندماجا أقل بكثير في EdU مقارنة ب MuSCs المعزولة إما من TA أو الحجاب الحاجز أو gracilis أو ثلاثية الرؤوس ، في حين أن MuSCs المعزولة من الماضغ والنعل تقع بينهما ولا تختلف اختلافا كبيرا عن أي من المجموعتين (الشكل 4 أ ، ب). وهذا يتفق مع نتائجنا السابقة22. علاوة على ذلك ، فإن الأنسجة التي تظهر منها MuSCs مستويات عالية من دمج EdU هي نفس الأنسجة التي تبين سابقا أن MuSCs تعبر عن مستويات عالية من بروتين Pax322. أظهرت FAPs المعزولة من EDL اندماجا أقل بكثير في EdU مقارنة ب FAPs المعزولة من GA و soleus ، بينما أظهرت FAPs المعزولة من TA اندماجا أقل بكثير في EdU مقارنة ب FAPs المعزولة من النعل (الشكل 4A ، C). هذا يؤكد أهمية تحليل الخلايا الجذعية من الأنسجة الفردية بدلا من تجميع العضلات من الأنسجة المختلفة للعزل. بالنسبة لجميع الأنسجة ، كان متوسط جزء MuSCs الإيجابي ل EdU أعلى مقارنة بالجزء المتوسط من FAPs الإيجابية ل EdU ، مما يشير إلى أن MuSCs تنشط بشكل أسرع في ظل الظروف المحددة.
أخيرا ، تم تأكيد نقاء الخلية من خلال تلطيخ التألق المناعي (الشكل 4D). في المتوسط ، 97.71٪ (± 1.38٪) من MuSCs ملطخة إيجابية لبروتين Pax7 ، و 88.16٪ (±6.35٪) من FAPs ملطخة إيجابية لبروتين PDGFRa ، مما يؤكد خصوصية إجراء عزل الخلايا الجذعية لدينا (الشكل 4D).

الشكل 1: ملخص تخطيطي للبروتوكول. رسم تخطيطي يوضح الجزأين الرئيسيين للبروتوكول ، عزل MuSC (اللوحة العلوية) ، مقايسة الهدوء (اللوحة السفلية) ، والخطوات الرئيسية للمنهجية المستخدمة في كل منهما. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
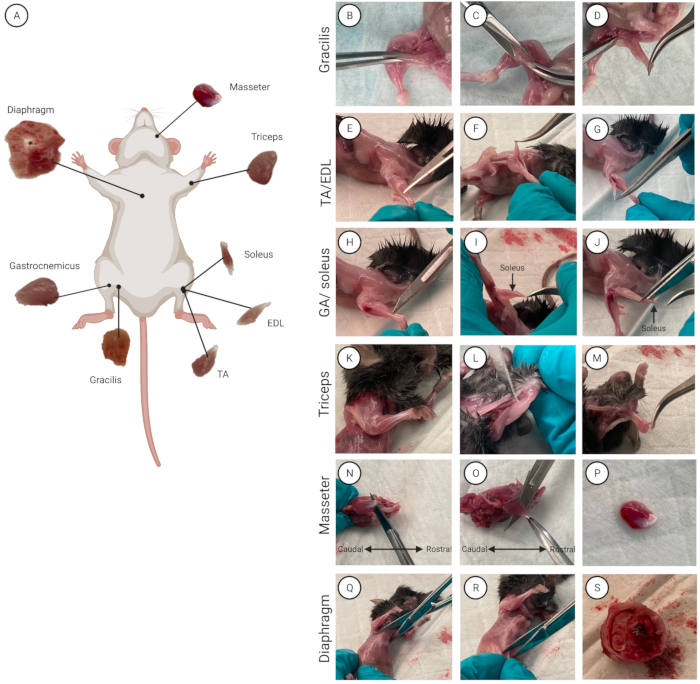
الشكل 2: موقع العضلات وعزلها. أ: مخطط يوضح موقع كل عضلة. (ب-س) عرض عزل العضلات لعضلات الحجاب الحاجز (B-D) و (E-G) TA / EDL و (H-J) ثلاثية الرؤوس و (K-M) GA / soleus و (N-P) مدلك و (Q-S). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
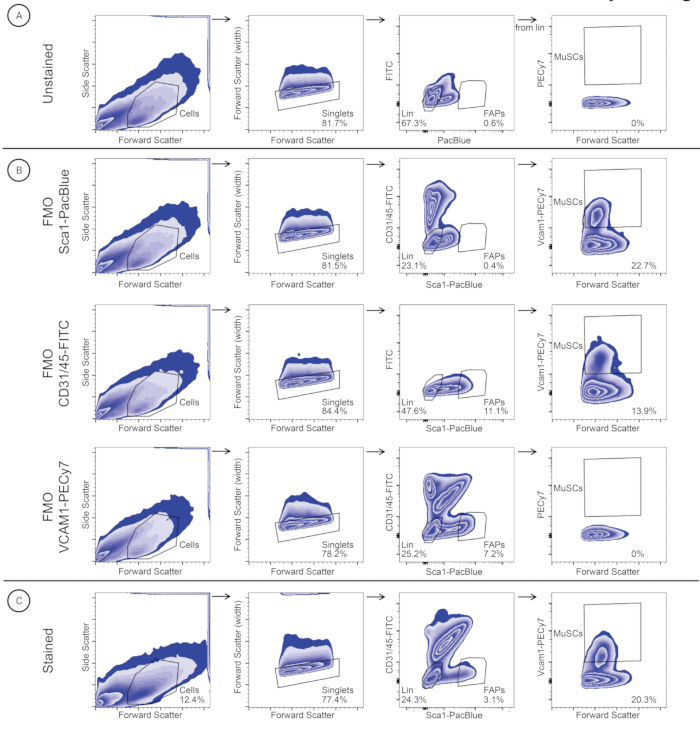
الشكل 3: استراتيجية البوابات المستخدمة لتحديد وفرز MuSCs و FAPs في عينة عضلة الحجاب الحاجز. يتم تحديد الخلايا بناء على حجم الخلية (التشتت الأمامي (FSC)) والدقة (التشتت الجانبي (SSC)). يتم تحديد المفردات بناء على FSC-A و FSC-W. يتم بوابات خلايا النسب لتحديد MuSCs (Lineage- / VCAM1 +) ، ويتم بوابات خلايا FAP (Lineage / SCA1 +) لتحديد FAPs. تم تطبيق نفس استراتيجية البوابة على (أ) عنصر تحكم غير ملوث ، (ب) ضوابط FMO (FMO-SCA1PacBlue ، FMO-CD31 / 45-FITC ، و FMO-VCAM1-PECy7) ، و (ج) عينة ملطخة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: القياس الكمي لتنشيط الخلية عن طريق تلطيخ EdU. (أ) صور تمثيلية لتلطيخ EdU ل MuSCs (الألواح العلوية) و FAPs (الألواح السفلية) من عينة الحجاب الحاجز. تظهر صور مدمجة ل EdU و Hoechst (اللوحات اليسرى) ، والقنوات الفردية باللون الأخضر (EdU ، اللوحات الوسطى) والأزرق (Hoechst ، اللوحات اليمنى). (ب، ج) رسم بياني شريطي يوضح النسبة المئوية ل EdU الإيجابي (B) MuSCs أو (C) FAPs للعضلات المشار إليها. المرسومة هي متوسط ± SEM. كل نقطة تمثل الماوس. تم إجراء التحليل الإحصائي في GraphPad باستخدام اختبارات t ثنائية الطرف للطالب ، مع تعيين الدلالة على * p < 0.05 و ** p < 0.01. (د) تلطيخ التألق المناعي ل MuSCs (الألواح العلوية) و FAPs (الألواح السفلية) مع الأجسام المضادة ضد علامة MuSC Pax7 (الجانب الأيسر) وعلامة FAP PDGFRa (الجانب الأيمن). تظهر صور مدمجة ل Pax7 مع Hoechst ، متبوعة بالقنوات الفردية ، وصور مدمجة ل PDGFRa مع Hoechst ، متبوعة بالقنوات الفردية. ن = 3. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| محاليل | الكواشف | مبلغ |
| غسل المتوسطة | F-10 خليط المغذيات (لحم الخنزير) (1x) ، + L- الجلوتامين | 445 مل |
| مصل الحصان | 50 مل | |
| قلم/بكتيريا | 5 مل | |
| العازلة التفكك (1st الهضم) | كولاجيناز النوع الثاني | 650 وحدة / مل |
| غسل المتوسطة | 100 مل | |
| مخزون Dispase (2nd الهضم) | Dispase في برنامج تلفزيوني | 11 وحدة / مل |
| مخزون كولاجيناز (2nd الهضم) | كولاجيناز النوع الثاني في برنامج تلفزيوني | 1000 وحدة / مل |
| برنامج تلفزيوني 1x | مركز مسحوق PBS 10x | 9.89 جم/لتر |
| ماء معقم / معقم | 1 لتر | |
| المياه الحمضية | حمض الخليك الجليدي (100٪) اللامائي للتحليل | 5.15 مل |
| ماء معقم / معقم | 895 مل | |
| محلول الكولاجين (0.002٪) | الكولاجين من جلد العجل | 20 مل |
| المياه الحمضية | 800 مل | |
| تريتون X-100 | تريتون X-100 | 0.5٪ (فولت / حجم) |
| برنامج تلفزيوني 1x | 99.5% | |
| حظر المخزن المؤقت | برنامج تلفزيوني 1x | 18 مل |
| مصل الحمير | 2 مل |
الجدول 1: جدول الوصفات.
| نموذج لا. | اسم |
| 1 | غير ملوثة |
| 2 | مضان ناقص VCAM1-PeCy7 |
| 3 | مضان ناقص SCA1-باسيفيكبلو |
| 4 | مضان ناقص CD31 / 45-FITC |
| 5 | صبغة تجريبية (جميع الأجسام المضادة الأربعة) |
الجدول 2: نظرة عامة على التلوين والضوابط والعينات المعدة لكل نسيج قبل الفرز.
| نسيج | مزيج الأجسام المضادة | خلايا | المفردات | لين | فابس | MuSCs |
| الحجاب الحاجز | غير ملوثة | 100% | 82% | 55% | 0.5% | 0.0% |
| FMO Sca1-PacBlue | 100% | 83% | 19% | 0.3% | 4.3% | |
| FMO CD31 / 45-488 | 100% | 84% | 40% | 9.4% | 5.6% | |
| FMO Vcam1-PeCy7 | 100% | 78% | 20% | 5.6% | 0.0% | |
| الملون | 100% | 77% | 19% | 2.4% | 3.8% | |
| جراسيليس | الملون | 100% | 96% | 11% | 2.6% | 1.4% |
| تا | الملون | 100% | 88% | 16% | 2.8% | 2.2% |
| مؤسسة كهرباء لبنان | الملون | 100% | 86% | 26% | 19.2% | 0.8% |
| سوليوس | الملون | 100% | 91% | 41% | 13.3% | 1.1% |
| جي إيه | الملون | 100% | 94% | 51% | 6.1% | 1.5% |
| ثلاثيه الرؤوس | الملون | 100% | 92% | 30% | 2.6% | 4.5% |
| ماستر | الملون | 100% | 85% | 27% | 19.3% | 2.6% |
الجدول 3: نظرة عامة على الوفرة النسبية لنوع الخلية في بيانات نظام مراقبة الأصول الميدانية.
Discussion
هناك عدة خطوات أساسية في تنفيذ هذا البروتوكول لتحقيق عوائد جيدة. العضلات الفردية لها حجم صغير مقارنة بكمية العضلات المستخدمة في بروتوكولات العزل السائبة. ينتج عن هذا خطر جفاف العضلات أثناء التشريح ، مما يقلل من الغلة. لمنع ذلك ، من المهم إضافة وسيط إلى العضلات مباشرة بعد التشريح. بالإضافة إلى ذلك ، إذا استغرق التشريح وقتا أطول ، فيمكن إزالة الجلد من طرف واحد في كل مرة لتقليل وقت تعرض العضلات للهواء. يؤدي الحجم الأصغر أيضا إلى زيادة خطر الإفراط في الهضم. لمواجهة ذلك ، تتطلب الطريقة الحالية كميات أقل من إنزيم كولاجيناز II وتقليل أوقات الهضم مقارنة ببروتوكولات العضلات السائبة 9,16. يعتمد الهضم الأنزيمي أيضا على نقاء الإنزيمات ، ويمكن أن يؤثر انخفاض النقاء سلبا على المحصول. بالإضافة إلى ذلك ، الهضم الميكانيكي أمر بالغ الأهمية. في حالة عدم كفاية القطع ، فإن انخفاض مساحة السطح سيعيق الهضم الأنزيمي ويقلل من إنتاج الخلايا الجذعية. في حالة القطع أكثر من اللازم ، فإن زيادة مساحة السطح ستؤدي إلى الإفراط في الهضم وتقليل إنتاج الخلايا الجذعية. يمنع حمام الماء المهتز ترسيب العضلات المهضومة ، ويحسن توزيع الإنزيم ، ويساعد في خلق درجة حرارة متجانسة ، مما يتيح تماما أوقات حضانة أقصر. لذلك ، تسمح الطريقة الحالية بتخفيض كبير في وقت الحضانة مقارنة بالطرق الأخرى.
يعتمد هذا البروتوكول على تفكك الخلايا وتنقيتها. تحاكي هذه الإجراءات إصابة الأنسجة التي تنشط الخلايا الجذعية. باستمرار ، كشفت الدراسات الحديثة أن MuSCs تغير برامج التعبير الجيني الخاصة بها أثناء إجراء العزل27،28،29،30. نتيجة لذلك ، تختلف الخلايا الجذعية المنقاة عن الخلايا الموجودة في الجسم الحي من حيث أنماط التعبير الجيني. العامل الثاني المقيد في البروتوكول هو اعتماده على FACS ، الأمر الذي يتطلب الوصول إلى معدات باهظة الثمن. FACS هو المعيار الذهبي لعزل مجموعات خلايا متعددة في وقت واحد بنقاوةعالية 20. تقدم التطورات الحديثة باستخدام الخرز المغناطيسي والفقاعات الدقيقة تخفيضات في التكلفة31,32 ، ولكن يجب تحديد ما إذا كانت توفر عوائد مماثلة للعمل على عضلات واحدة. أخيرا ، يكون عائد البروتوكول محدودا بسبب صغر حجم العضلات ، مما يفرض قيودا على المقايسات المحتملة في اتجاه مجرى النهر.
اعتمدت الدراسات السابقة على تجميع العضلات المختلفة عند عزل MuSCs و / أو FAPs لزيادة إنتاجية الخلايا. ومع ذلك ، فإن هذا متوسط أي اختلافات خاصة بالأنسجة في سلوك الخلايا الجذعية ووظيفتها بين العضلات المختلفة. يتيح البروتوكول الحالي عزل MuSCs و FAPs من العضلات الفردية لإجراء التحليلات النهائية لوظيفة الخلايا الجذعية. كمثال على مقايسة المصب ، تم فحص تنشيط الخلايا الجذعية من خلال دمج EdU ، مما يكشف أن الخلايا الجذعية من الأنسجة المختلفة تعرض حركية تنشيط مختلفة. في الأعمال السابقة ، تم عرض جدوى استخدام مقايسات المصب الأخرى. تتطلب هذه المقايسات أرقام خلايا أصغر ، مثل تسلسل الحمض النووي الريبي أحادي الخلية SmartSeq2 ، وزرع الخلايا ، وتفاعل البوليميراز المتسلسل الموائع الدقيقة ، ومقايسات التوسع النسيلي22،33،34،35.
في الختام ، يصف هذا البروتوكول طريقة لتشريح العضلات الفردية لعزل ودراسة MuSCs و FAPs. ستمكن هذه الاستراتيجية التجارب من اكتساب فهم أفضل لوظيفة الخلايا الجذعية عبر العضلات المختلفة في الصحة والمرض.
Disclosures
ليس للمؤلفين مصالح مالية متنافسة ولا تضارب في المصالح.
Acknowledgements
وأجري فرز الخلايا في المرفق الأساسي لنظام مراقبة الأصول الميدانية في جامعة آرهوس، الدانمرك. تم إنشاء الأرقام باستخدام Biorender.com. نشكر الدكتور ج. فاروب على مشاركة الجسم المضاد للأرانب المضاد PDGFRa. تم دعم هذا العمل من خلال منحة بدء AUFF إلى E.P. ومنح حزمة البدء من NovoNordiskFonden إلى E.P. (0071113) وإلى A.D.M. (0071116).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube( PCR performance tested, PP, 30,000 xg, DNA/DNase-/RNase-free, Low DNA binding, Sterile ) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 72.706.700 | 1.5 mL tube |
| 15 mL tube (PP/HD-PE, 20,000 xg, IVD/CE, IATA, DNA/DNase-/RNase-free, Non-cytotoxic, pyrogen free, Sterile) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 62.554.502 | 15 mL tube |
| 5 mL polystyrene round-bottom tube | Falcon, Fisher Scientific | 352054 | FACS tube without strainer cap |
| 5 mL polystyrene Round-bottom tube with cell-strainer cap | Falcon, Fisher Scientific | 352235 | FACS tube with strainer cap |
| 5 mL tube (PP, non sterile autoclavable) | VWR collection | 525.0946 | 5 mL tube |
| 50 mL tube( PP/HD-PE, 20,000 xg, IVD/CE, ADR, DNA/DNase-/RNase-free, non-cytotoxic, pyrogen free, Sterile) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 62.547.254 | 50 mL tube |
| Alexa Fluor 555 Donkey anti-rabbit IgG (H+L) | Invitrogen, Thermo Fisher | Lot: 2387458 (Cat # A31572) | |
| Alexa Fluor 647 donkey-anti mouse IgG (H+L) | Invitrogen, Thermo Fisher | Lot: 2420713 (Cat#A31571) | |
| ARIA 3 | BD | FACS, Core facility Aarhus University | |
| Centrifuge 5810 | eppendorf | EP022628188 | Centrifuge |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 488 dye | Invitrogen, Thermo Fisher | Lot: 2387287 (Cat# C10337) | Cell Proliferation Kit |
| Collagen from calf-skin | Bioreagent, Sigma Aldrich | Source: SLCK6209 (Cat# C8919) | |
| Collagenase type II | Worthington, Fisher Scientific | Lot: 40H20248 (cat# L5004177 ) | Collagenase |
| Dispase | Gibco, Fisher Scientific | Lot: 2309415 (cat# 17105-041 ) | Dispase |
| Donkey serum (non-sterile) | Sigma Aldrich, Merck | Lot: 2826455 (Cat# S30-100mL) | |
| Dumont nr. 5, 110 mm | Dumont, Hounisen Laboratorieudstyr A/S | 1606.327 | Straight forceps with fine tips |
| Dumont nr. 7, 115 mm | Dumont, Hounisen Laboratorieudstyr A/S | 1606.335 | Curved forceps |
| F-10 Nutrient mixture (Ham) (1x), +L-glutamine | Gibco, Fisher Scientific | Lot. 2453614 (cat# 31550-023) | |
| FITC anti-mouse CD31 | BioLegend, NordicBioSite | MEC13.3 (Cat # 102506) | |
| FITC Anti-mouse CD45 | BioLegend, NordicBioSite | 30-F11 (Cat# 103108) | |
| Glacial acetic acid (100%) | EMSURE, Merck | K44104563 9Cat # 1000631000) | |
| Head over head mini-tube rotator | Fisher Scientific | 15534080 (Model no. 88861052) | Head over head mini-tube rotator |
| Horse serum | Gibco, Fisher Scientific | Lot. 2482639 (cat# 10368902 ) | |
| Isotemp SWB 15 | FisherBrand, Fisher Scientific | 15325887 | Shaking water bath |
| MS2 mini-shaker | IKA | Vortex unit | |
| Needle 20 G (0.9 mm x 25 mm) | BD microlance, Fisher Scientific | 304827 | 20G needle |
| Neutral formalin buffer 10% | CellPath, Hounisen Laboratorieudstyr A/S | Lot: 03822014 (Cat # HOU/1000.1002) | |
| Non-pyrogenic cell strainer (40 µM) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 83.3945.040 | Cell strainer |
| Pacific Blue anti-mouse Ly-6A/E (Sca-1) | BioLegend, NordicBioSite | D7 (Cat# 108120) | |
| Pax7 primary antibody | DSHB | Lot: 2/3/22-282ug/mL (Cat# AB 528428) | |
| PBS 10x powder concentrate | Fisher BioReagents, Fisher Scientific | BP665-1 | |
| PE/Cy7 anti-mouse CD106 (VCAM1) | BioLegend, NordicBioSite | 429 (MVCAM.A) (Cat # 105720) | |
| Pen/strep | Gibco, Fisher Scientific | Lot. 163589 (cat# 11548876 ) | |
| Pipette tips p10 | Art tips, self sealing barrier, Thermo Scientific | 2140-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p1000 | Art tips, self sealing barrier, Thermo Scientific | 2279-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p20 | Art tips, self sealing barrier, Thermo Scientific | 2149P-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p200 | Art tips, self sealing barrier, Thermo Scientific | 2069-05 | Low retention, pre-sterilized, filter tips |
| Protective underpad | Abena | ACTC-7712 | 60 x 40cm, 8 layers |
| Rainin, pipet-lite XLS | Mettler Toledo, Thermo Scientific | 2140-05, 2149P-05, 2279-05, 2069-05 | Pipettes (P10, P20, P200, P1000) |
| Recombinant anti-PDGFR-alpha | RabMAb, abcam | AB134123 | |
| Scalpel (shaft no. 3) | Hounisen, Hounisen Laboratorieudstyr A/S | 1902.502 | Scalpel |
| Scalpel blade no. 11 | Heinz Herenz, Hounisen Laboratorieudstyr A/S | 1902.0911 | Scalpel |
| Scanlaf mars | Labogene | class 2 cabinet: Mars | Flow bench |
| ScanR | Olympus | Microscope, Core facility Aarhus University | |
| Scissors | FST | 14568-09 | |
| Series 8000 DH | Thermo Scientific | 3540-MAR | Incubator |
| Serological pipette 10 mL | VWR | 612-3700 | Sterile, non-pyrogenic |
| Serological pipette 5 mL | VWR, Avantor delivered by VWR | 612-3702 | Sterile, non-pyrogenic |
| Syringe 5 mL, Luer tip (6%), sterile | BD Emerald, Fisher Scientific | 307731 | Syringe |
| TC Dish 100, standard | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 83.3902 | Petri dish |
| Tissue Culture (TC)-treated surface, black polystyrene, flat bottom, sterile, lid, pack of 20 | Corning, Sigma Aldrich | 3764 | 96-well Half bottom plate |
| Triton X-100 | Sigma Aldrich, Merck | Source: SLCJ6163 (Cat # T8787) |
References
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9 (2), 493-495 (1961).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692(2021).
- Cheung, T. H., Rando, T. A. Molecular regulation of stem cell quiescence. Nature Reviews. Molecular Cell Biology. 14 (6), 329-340 (2013).
- Kann, A. P., Hung, M., Krauss, R. S. Cell-cell contact and signaling in the muscle stem cell niche. Current Opinion in Cell Biology. 73, 78-83 (2021).
- Tedesco, F. S., Dellavalle, A., Diaz-Manera, J., Messina, G., Cossu, G. Repairing skeletal muscle: regenerative potential of skeletal muscle stem cells. Journal of Clinical Investigation. 120 (1), 11-19 (2010).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Lepper, C., Partridge, T. A., Fan, C. -M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Joe, A. W. B., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Uezumi, A., Fukada, S. -I., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Seale, P., Sabourin, L. A., Girgis-Gabardo, A., Mansouri, A., Gruss, P., Rudnicki, M. A. Pax7 Is Required for the Specification of Myogenic Satellite Cells. Cell. 102 (6), 777-786 (2000).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- Fukada, S. -I., et al. Molecular signature of quiescent satellite cells in adult skeletal muscle. Stem Cells. 25 (10), 2448-2459 (2007).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Joe, A., Wang, J., Rossi, F. Prospective isolation of adipogenic progenitors from skeletal muscle. Journal of Investigative Medicine. 55 (1), 124(2007).
- Yi, L., Rossi, F. Purification of progenitors from skeletal muscle. Journal of Visualized Experiments. (49), e2476(2011).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119 (4), 543-554 (2004).
- Montarras, D., et al. Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Conboy, M. J., Cerletti, M., Wagers, A. J., Conboy, I. M. Immuno-analysis and FACS sorting of adult muscle fiber-associated stem/precursor cells. Methods In Molecular Biology. 621, 165-173 (2010).
- de Morree, A., et al. Alternative polyadenylation of Pax3 controls muscle stem cell fate and muscle function. Science. 366 (6466), 734-738 (2019).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental Biology. 397 (1), 31-44 (2015).
- Mookhtiar, K., Randall Steinbrink, D., Van Wart, H. E. Mode of hydrolysis of collagen-like peptides by class I and class II Clostridium histolyticum collagenases: evidence for both endopeptidase and tripeptidylcarboxypeptidase activities. Biochemistry. 24 (23), 6527-6533 (1985).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. The Journal of Investigative Dermatology. 93 (2), 287-290 (1989).
- Baghdadi, M. B., et al. Reciprocal signalling by Notch-Collagen V-CALCR retains muscle stem cells in their niche. Nature. 557 (7707), 714-718 (2018).
- van Velthoven, C. T. J., de Morree, A., Egner, I. M., Brett, J. O., Rando, T. A. Transcriptional profiling of quiescent muscle stem cells in vivo. Cell Reports. 21 (7), 1994-2004 (2017).
- Machado, L., et al. In situ fixation redefines quiescence and early activation of skeletal muscle stem cells. Cell Reports. 21 (7), 1982-1993 (2017).
- Machado, L., et al. Tissue damage induces a conserved stress response that initiates quiescent muscle stem cell activation. Cell Stem Cell. 28 (6), 1125-1135 (2021).
- vanden Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Moore, D. K., Motaung, B., du Plessis, N., Shabangu, A. N., Loxton, A. G. SU-IRG consortium isolation of B-cells using Miltenyi MACS bead isolation kits. PloS One. 14 (3), 0213832(2019).
- Liou, Y. -R., Wang, Y. -H., Lee, C. -Y., Li, P. -C. Buoyancy-activated cell sorting using targeted biotinylated albumin microbubbles. PloS One. 10 (5), 0125036(2015).
- Brett, J. O., et al. Exercise rejuvenates quiescent skeletal muscle stem cells in old mice through restoration of Cyclin D1. Nature Metabolism. 2 (4), 307-317 (2020).
- Tabula Muris Consortium. A single-cell transcriptomic atlas characterizes ageing tissues in the mouse. Nature. 583 (7817), 590-595 (2020).
- de Morrée, A., et al. Staufen1 inhibits MyoD translation to actively maintain muscle stem cell quiescence. Proceedings of the National Academy of Sciences. 114 (43), 8996-9005 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved