Method Article
בידוד אוכלוסיות תאי גזע שקטים משרירי שלד בודדים
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר בידוד של תאי גזע שריריים ואבות פיברו-אדיפוגניים משרירי שלד בודדים בעכברים. הפרוטוקול כולל דיסקציה של שריר יחיד, בידוד תאי גזע על ידי מיון תאים מופעל פלואורסצנטי, הערכת טוהר על ידי צביעה אימונופלואורסצנטית, ומדידה כמותית של כניסה לשלב S על ידי בדיקת שילוב 5-ethynyl-2'-deoxyuridine.
Abstract
שרירי השלד מכילים אוכלוסיות שונות של תאי גזע בוגרים התורמים להומאוסטזיס ולתיקון הרקמה. לתאי גזע של שרירי השלד (MuSCs) יש את היכולת לייצר שריר חדש, בעוד שאבות פיברו-אדיפוגניים (FAPs) תורמים לרקמות תומכות סטרומה ויש להם את היכולת לייצר פיברובלסטים ואדיפוציטים. גם MuSCs וגם FAPs חיים במצב של יציאה הפיכה ממושכת של מחזור התא, הנקרא שקט. המצב השקט הוא המפתח לתפקודם. תאי גזע שקטים מטוהרים בדרך כלל מרקמות שריר מרובות המאוגדות יחד בדגימה אחת. עם זאת, מחקרים אחרונים גילו הבדלים ברורים בפרופילים המולקולריים ובעומק השקט של MuSCs שבודדו משרירים שונים. הפרוטוקול הנוכחי מתאר את הבידוד והמחקר של MuSCs ו- FAPs משרירי שלד בודדים ומציג אסטרטגיות לביצוע ניתוח מולקולרי של הפעלת תאי גזע. הוא מפרט כיצד לבודד ולעכל שרירים ממוצא התפתחותי שונה, עוביים ותפקודים, כגון הסרעפת, תלת ראשי, gracilis, tibialis anterior (TA), gastrocnemius (GA), soleus, extensor digitorum longus (EDL), ואת שרירי Masseter. MuSCs ו- FAPs מטוהרים על ידי מיון תאים המופעלים על ידי פלואורסצנטיות (FACS) ומנותחים על ידי צביעת immunofluorescence ובדיקת שילוב 5-ethynyl-2'-deoxyuridine (EdU).
Introduction
שרירי השלד הם בעלי יכולת התחדשות גבוהה בשל נוכחות תאי גזע שריריים (MuSCs). MuSCs ממוקמים על myofibers, מתחת למינה הבסיסית, ומתגוררים במצב שקט של מחזור תאים ממושך והפיך יציאה 1,2,3,4. עם פציעה, MuSCs מופעלים ונכנסים למחזור התא כדי ליצור אבות מגבירים שיכולים להתמיין ולהתמזג ליצירתמיופייבר 2,5 חדשים. עבודות קודמות הראו כי MuSCs חיוניים לחלוטין להתחדשות שרירים 6,7,8. יתר על כן, MuSC יחיד יכול להשתיל וליצור גם תאי גזע חדשים וגם מיוסיבים חדשים9. שרירי השלד מכילים גם אוכלוסייה של תאי סטרומה מזנכימליים הנקראים אבות פיברו-אדיפוגניים (FAPs), אשר ממלאים תפקיד מכריע בתמיכה בתפקוד MuSC במהלך התחדשות שרירים 6,10,11,12.
בשל הפוטנציאל שלהם לתאם התחדשות שרירים, היה עניין עצום בהבנת האופן שבו MuSCs ו- FAPs עובדים. MuSCs שקטים מסומנים על ידי ביטוי של גורמי השעתוק Pax7 ו- Sprouty1, וקולטן הקלציטונין של חלבון פני השטח של התא, בעוד ש- FAPs שקטים מסומנים על ידי קולטן גורם גדילה הנגזר מטסיות הדם של פני התא אלפא (PDGFRa)10,12,13,14,15 . מחקרים קודמים הראו כי MuSCs ו- FAPs יכולים להיות מטוהרים משרירי השלד באמצעות סמנים של פני השטח של התא ומיון תאים המופעלים על ידי פלואורסצנטיות (FACS) 9,15,16,17,18,19,20,21. בעוד פרוטוקולים אלה קידמו מאוד את היכולת לחקור MuSCs ו- FAPs, חסרון אחד הוא שרוב הפרוטוקולים הללו דורשים בידוד של MuSCs ממאגר של רקמות שריר שונות. עבודות אחרונות שלנו ושל אחרים חשפו הבדלים בפנוטיפ התא וברמות ביטוי הגנים בין MuSCs שבודדו מרקמות שונות22,23. MuSCs מהסרעפת, התלת ראשי והגרציליס מראים הפעלה מהירה יותר מאשר MuSCs משרירי הגפיים האחוריות התחתונות22, בעוד MuSCs משריר חוץ-עיני מראים התמיינות מהירה יותר מאשר MuSCs מהסרעפת ומשרירי הגפיים האחוריות התחתונות23.
פרוטוקול זה מתאר את הבידוד של MuSCs ו-FAPs משרירי שלד בודדים (איור 1). זה כולל את הדיסקציה של הסרעפת, triceps, gracilis, tibialis anterior (TA), soleus, extensor digitorum longus (EDL), gastrocnemius (GA), ואת שרירי masseter. שרירים מנותחים מנותקים לאחר מכן על ידי עיכול אנזימטי באמצעות collagenase II (פרוטאז המכוון באופן ספציפי לרצף האמינו Pro-X-Gly-Pro בקולגן, המאפשר פירוק של דיסוציאציה של רקמת חיבור ורקמות24) ו dispase (פרוטאז המבקע פיברונקטין וקולגן IV, המאפשר דיסוציאציה נוספת של תאים25). MuSCs ו- FAPs מבודדים מתרחיפים של תא יחיד על ידי FACS. כדוגמאות לבדיקות במורד הזרם לניתוח תאים, הפעלת תאי גזע נקבעת על ידי שילוב 5-ethynyl-2'-deoxyuridine (EdU), בעוד טוהר התא נקבע על ידי צביעת immunofluorescence עבור סמנים ספציפיים מסוג התא Pax7 ו- PDGFRa.
Protocol
הפרוטוקול הנוכחי בוצע בהתאם להנחיות הטיפול בבעלי חיים באוניברסיטת ארהוס ולתקנות האתיקה המקומיות.
הערה: יש להקפיד לעמוד בתקנות הוועדה האתית המקומית לניסויים בבעלי חיים ולטיפול בדגימות מכרסמים לאחר המוות. עכברים הם מקור פוטנציאלי לאלרגנים; אם זמין, הפעל את אוורור הפליטה והנח אותו מעל סביבת העבודה כדי למנוע חשיפה מוגזמת לאלרגנים. לחלופין, חבשו מסכת פנים אם הניסוי מתבצע באופן קבוע. פרוטוקול זה כרוך בעבודה עם חדים, ומומלץ לחוקרים להכיר את הנהלים והלוגיסטיקה להגשת עזרה ראשונה במקרה של חתך.
1. הכנה (1-2 שעות; יום לפני נתיחה)
הערה: התמיסות, הלוחות והמדיה מוכנים בתנאים סטריליים ומסוננים (0.45 מיקרומטר) לפני השימוש אלא אם כן נאמר אחרת. הכינו תמיסות מלאי של dispase (11 U/mL ב-PBS) ו-collagenase II (1,000 U/mL ב-PBS) ואחסנו אותן בטמפרטורה של -20°C (טבלה 1). המלאים מופשרים ומשמשים לעיכול משני בשלב 4.2.6.
- ציפוי קולגן של צלחת 96 באר חצי שטח
- הכינו מים חומציים. הוסף 5.15 מ"ל של חומצה אצטית קרחונית ל 895 מ"ל של מים autoclaved בכד 2 L.
- סנן את התמיסה באמצעות יחידת סינון של 0.45 מיקרומטר, 500 מ"ל. מעבירים 800 מ"ל מהמים החומציים המסוננים לבקבוק 1 ליטר.
- הוסיפו לבקבוק 40 מ"ל של תמיסת קולגן סטרילית. ערבבו בעדינות את התמיסה על ידי ערבול ואחסנו בטמפרטורה של 4°C, מוגנת מפני אור, עד לשימוש.
- מצפים בקולגן צלחת אחת או יותר של 96 באר בחצי שטח. הוסיפו 50 מיקרוליטר של תמיסת ציפוי קולגן לכל באר וציפו את הצלחת למשך הלילה (ON) ב-4°C.
- שאפו את תמיסת הקולגן למחרת באמצעות שואב על בסיס ואקום ושטפו את הצלחת 2x על ידי הוספת 100 μL של מים אוטוקלאביים ושאיפה.
- הטו את מכסה הצלחת ותנו לצלחת להתייבש במכסה המנוע למשך 20-30 דקות.
- כאשר הצלחת יבשה לחלוטין, עטפו אותה ברדיד אלומיניום ואחסנו בטמפרטורה של 4°C עד לשימוש. ניתן לאחסן צלחות מצופות עד 4 שבועות.
הערה: ציפוי קולגן מאפשר היצמדות תאים. חשוב לשטוף קולגן חופשי, שכן הוא עלול להפריע לתפקוד התאים ולאיתות (למשל, קשירת קולגן V לקולטני הקלציטונין ב-MuSCs)26.
2. הכנה (0.5 שעות, יום הנתיחה):
- הכנת פתרונות נוספים וסביבת עבודה
- הכינו מדיום כביסה סטרילי על ידי הוספת 50 מ"ל של סרום סוסים ו-5 מ"ל עט/סטרפטוקוקוס ל-445 מ"ל של מדיום F10 של HAM. עבודה במכסה מנוע זרימה למינרית למניעת זיהום.
- חשב ושקול את הכמות המתאימה של collagenase II הדרוש להכנת מאגר הדיסוציאציה. (עבור כל עכבר, 26,000 יחידות של collagenase II משמש לייצור 40 מ"ל של חיץ דיסוציאציה ב 650 U/mL collagenase II). מוסיפים את האבקה הנשקלת לצינור חרוטי של 50 מ"ל ומאחסנים אותה על קרח.
- הכינו שתי מנות בקוטר 10 ס"מ לבידוד שרירים. יוצקים 3 מ"ל של מדיום כביסה (טבלה 1) לכל צלחת פטרי. הביאו את הכלים בקוטר 10 ס"מ מחוץ למכסה המנוע הלמינרי לשימוש מאוחר יותר.
- הכינו את החומרים לעיכול שרירים. בהתבסס על מספר הדגימות, תייגו את המספר המתאים של צינורות חרוטיים של 50 מ"ל (שמונה לכל עכבר, אחד לכל שריר) והשאירו אותם על הספסל. רססו את המחטים, מזרקי 10 מ"ל ומסננות תאים 40 מיקרומטר עם 70% אתנול (שמונה מכל עכבר, אחד לכל שריר) והכניסו אותם לתוך מכסה המנוע של הזרימה הלמינרית. הצמידו מחטים למזרקים.
- הכינו את החומרים למיון. תווית 5 מ"ל צינורות תחתונים עגולים עם מכסי מסננת תאים בהתבסס על מספר הדגימות. מכסים את הצינורות ברדיד אלומיניום ומשאירים אותם במכסה המנוע של הזרימה הלמינרית.
- בהתאם למספר הדגימות והאוכלוסיות הממוינות, הכינו צינורות מיקרוצנטריפוגות בנפח 1.5 מ"ל עם 500 מיקרוליטר מדיום שטיפה לאיסוף תאים (16 לעכבר, צינור אחד לכל אוכלוסיית תא לכל רקמת שריר). אחסנו את הצינורות האלה על קרח.
3. דיסקציה של שרירים (20-30 דקות)
הערה: חלק זה של הפרוטוקול מתבצע בסביבה לא סטרילית. ההליך יכול להתבצע באמצעות עכבר אחד או יותר. עם זאת, עכבר אחד מספיק כדי להכין הן דוגמאות למיון והן בקרות להגדרת פיצוי ושערי FACS.
- התחלת בידוד שרירים
- הכינו את סביבת העבודה הלא סטרילית לדיסקציה ולבידוד שרירים. יש לחטא את תחנת העבודה באתנול 70%. הניחו משטח הגנה חד פעמי סטרילי על עמדת העבודה.
- בעזרת טוש קבוע, ציירו קופסה לכל שריר על מכסה צלחת פטרי כדי למקם מאוחר יותר את השריר המבודד.
- רססו את כלי הניתוח באתנול 70%.
- יש להרדים את העכבר על ידי שאיפתCO2 ו/או נקע צוואר הרחם.
- בודד את השרירים הבודדים (מעכבר אחד בכל פעם אם אתה משתמש במספר עכברים). רססו את העכבר באתנול 70% כדי להרטיב את הפרווה ולחטא את העור. הניחו את העכבר על הכרית התחתונה כשהבטן פונה כלפי מעלה. סקירה כללית של כל שמונת השרירים והמיקום האנטומי שלהם בהתאמה מוצגת באיור 2A.
- בידוד שרירי הגרציליס
- השתמש בזוג מספריים כדי לבצע חתך אופקי של 0.5 ס"מ לתוך עור הבטן.
- הסרת העור: בעזרת שתי הידיים, השתמש באגודל ובאצבע המורה כדי לתפוס את החלק העליון והתחתון של החתך. משוך בכל צד של החתך כדי לקרוע ולחלק את העור של פלג הגוף העליון והגפיים התחתונות. משוך מטה את עור הגפיים התחתונות כדי לחשוף את שתי הגפיים האחוריות (כלפי מטה מהירך ועד אצבעות הרגליים). כמו כן, משוך כלפי מעלה כדי לחשוף את פלג הגוף העליון.
- אתר את שריר gracilis (הירך הפנימית). בעזרת מלקחיים מעוקלים, אחזו בגרציליס והרימו מעט את השריר (איור 2B). בעזרת מספריים, בצעו חתך בקוטר 0.5 ס"מ (איור 2C), שממנו חותכים את הגרציליס ומבודדים אותו לחלוטין (איור 2D). חזור על פעולה זו עבור הרגל השנייה כדי לבודד את שריר gracilis השני.
- בידוד שרירי TA ו-EDL (גפה אחורית תחתונה, צד גחוני)
- בעזרת אזמל, חותכים את הפאשיה על ידי ביצוע חתך של 0.5 ס"מ לאורך הצד הלטרלי של השוקה (עצם הגפה האחורית התחתונה העבה ביותר). השתמש במלקחיים מעוקלים כדי לתפוס את הפאשיה ולמשוך כדי להסיר אותה.
הערה: כאשר הפאשיה הוסרה במלואה, הגידים בקצה הדיסטלי של הרגל האחורית נראים לעין וניתן להפרידם. - השתמשו במלקחיים ישרים עם קצוות עדינים במיוחד כדי להיכנס בין הגיד הדיסטלי של TA (הצד הלטרלי של השוקה) לבין ה-EDL (מתחת ל-TA) (איור 2E-G).
הערה: עם ניסיון, ניתן להשתמש בקצה הקהה של להב אזמל במקום במלקחיים ישרים. - החליקו את המלקחיים לכיוון הקצה הפרוקסימלי של השריר כדי להפריד בין השרירים.
- מחזירים את המלקחיים הישרים לקצה הדיסטלי. חותכים את הגיד הדיסטלי.
- תפסו בעדינות את הגיד הדיסטלי של השריר בעזרת מלקחיים מעוקלים. הרימו את השריר למעלה ומעל החיבור הפרוקסימלי שלו וחתכו בזהירות את הגיד הפרוקסימלי קרוב ככל האפשר לנקודת החיבור שלו. חותכים את הקצה השני ומעבירים את הת"א לצלחת פטרי.
- השתמש במלקחיים ישרים עם קצוות עדינים במיוחד כדי להיכנס מתחת לגיד הדיסטלי של EDL.
- החליקו את המלקחיים לכיוון הקצה הפרוקסימלי של השריר כדי להפריד בין השרירים.
- מחזירים את המלקחיים הישרים לקצה הדיסטלי. חותכים את הגיד הדיסטלי מבלי לפגוע בשריר.
- תפסו בעדינות את הגיד הדיסטלי של ה-EDL בעזרת מלקחיים מעוקלים. הרימו את השריר למעלה ומעל החיבור הפרוקסימלי שלו וחתכו בזהירות את הגיד הפרוקסימלי קרוב ככל האפשר לנקודת החיבור שלו. חותכים את הקצה השני ומעבירים את ה-EDL לצלחת פטרי. חזור על הפעולה עבור הגפה האחורית השנייה כדי לבודד את שרירי TA ו- EDL השניים.
- בעזרת אזמל, חותכים את הפאשיה על ידי ביצוע חתך של 0.5 ס"מ לאורך הצד הלטרלי של השוקה (עצם הגפה האחורית התחתונה העבה ביותר). השתמש במלקחיים מעוקלים כדי לתפוס את הפאשיה ולמשוך כדי להסיר אותה.
- בידוד שרירי GA וסוליאוס (גפה אחורית תחתונה, צד גבי)
- השתמש במלקחיים ישרים עם קצוות עדינים במיוחד כדי לעבור בין גיד אכילס לבין עצמות הגפיים האחוריות התחתונות.
- החליקו את המלקחיים לכיוון הקצה הפרוקסימלי של השריר כדי להפריד את השריר.
- מחזירים את המלקחיים הישרים לקצה הדיסטלי. חותכים את הגיד הדיסטלי.
הערה: כדי להימנע מפגיעה בשריר הסולאוס שנמצא מתחת ל-GA, חתכו קרוב ככל האפשר לחיבור גיד אכילס הדיסטלי שלו, והותירו חלק מהגיד מחובר ל-GA (איור 2H). - כדי לחשוף ולבודד את שריר הסולאוס יש למשוך את ה-GA מעלה ומעל הפיבולה (העצם הדקה ביותר מבין שתי העצמות בגפה האחורית התחתונה).
הערה: שריר הסולאוס נבדל על-ידי צבעו האדום כהה האופייני ביחס ל-GA (איור 2I). - אתר את גיד הסולאוס הפרוקסימלי. עם מלקחיים ישרים, נכנסים בין הסולאוס ל-GA.
- הזיזו את המלקחיים לכיוון הקצה הדיסטלי של השריר כדי להפריד את הסולאוס מה-GA.
- בודדו תחילה את הסולאוס (soleus). חתכו את הגיד הפרוקסימלי שלו, תפסו את הגיד במלקחיים מעוקלים, והרימו בזהירות את הסולאוס כדי לגשת לגיד הדיסטלי שלו. חתכו את הגיד הדיסטלי כדי לבודד את הסולאוס מה-GA. הניחו את הסולאוס בצלוחית פטרי עם מדיום שטיפה (איור 2J)
- חותכים את GA ומניחים אותו בצלחת פטרי. חזור על פעולה זו עבור הרגל השנייה כדי לבודד את שרירי הסולאוס וה- GA השני.
- בידוד שרירי התלת ראשי (גפה קדמית עליונה, צד גבי)
- השתמשו במלקחיים ישרות עם קצוות עדינים במיוחד כדי להיכנס בין שריר התלת ראשי לבין עצם ההומרוס (העצם הראשית של הרגל הקדמית העליונה) (איור 2K-M).
- החליקו את המלקחיים לכיוון הקצה הפרוקסימלי של השריר כדי להפריד את השריר. חותכים את הקצה הפרוקסימלי של השריר.
- תפוס את הקצה הפרוקסימלי של התלת ראשי עם מלקחיים מעוקלים ומשוך אותו למעלה ומעל המרפק כדי לגשת לגיד הדיסטלי. חותכים את הגיד הדיסטלי של התלת ראשי, מעבירים את השריר לצלחת פטרי, וחוזרים על ההליך עבור הגפה הקדמית השנייה.
- בידוד שרירי המסה
- הסר את הפרווה והעור מהלסת. בצע חתך אופקי של 0.5 ס"מ עם מספריים. בעזרת שתי הידיים, צבטו בכל צד של החתך באמצעות האגודל והאצבע המורה. הסר את העור על ידי משיכה כלפי מעלה ומטה.
- אתר את הגיד העיקרי של המעסה (קאודלי, מתחת לעין). הכניסו את להב האזמל השטוח בין העצם לשריר (איור 2N). חותכים את הגיד.
- תפוס את גיד המסה העיקרי עם מלקחיים מעוקלים. חתכו אותו בעזרת להב אזמל או מספריים בכיוון הרוסטרלי כדי להפריד את שריר המסה מעצם הלסת (איור 2O, P). מניחים את שריר המסה המבודד בצלחת הפטרי. חזור על ההליך עבור שריר המסה השני.
- בידוד שריר הסרעפת
הערה: בעת בידוד שריר הסרעפת, הקפד לחתוך בזהירות כדי למנוע חיתוך לתוך האיברים הפנימיים והמעי, שכן זהו מקור לזיהום.- בעזרת מספריים, בצעו כריתת בית החזה (חתך בין הצלעות) במרכז עצם החזה (עצם שטוחה וארוכה, הממוקמת במרכז החזה, המחברת בין הצלעות) וחתכו דרך עצם החזה (איור 2Q).
- חשוף את הסרעפת על ידי חיתוך 360° דרך כלוב הצלעות.
- יש להפריד בין פלג הגוף העליון לחלק התחתון/הבטן. בעזרת זוג מספריים חותכים את קנה הנשימה, הוושט, הווריד הנבוב ואבי העורקים הבטני.
- הפרידו את הסרעפת מפלג הגוף התחתון. בעזרת מספריים, בצעו לפרוטומיה (חתך כירורגי בחלל הבטן) 1 ס"מ מתחת לעצם החזה ובצעו חתך של 360° (איור 2R).
- מניחים את המספריים הסגורים בין כלוב הצלעות לאיברי הבטן ולוחצים כלפי מטה. משכו בעדינות את כלוב הצלעות כדי להפריד אותו מאיברי הבטן (איור 2S).
- מפרידים את הסרעפת מכלוב הצלעות. להחזיק באופן רופף את הסרעפת בין שתי אצבעות לחתוך דרך כלוב הצלעות עם מספריים. השתמש במספריים כדי לחתוך את הסרעפת קרוב ככל האפשר לצלעות בחיתוך 360 מעלות. מניחים את הסרעפת המבודדת בצלחת פטרי.
הערה: במהלך פריקת צוואר הרחם, הסרעפת עלולה להיקרע ולקרוס כנגד כלוב הצלעות, מה שמקשה על איתורה. עדיין ניתן לבודד את השריר. זהו את השריר שהתמוטט, החזיקו אותו בין שתי אצבעות וחתכו 360° בעקבות כלוב הצלעות.
4. עיכול שרירים לתרחיף חד תאי (~ 1 שעות 35 דקות)
הערה: השלבים הבאים כוללים סביבות עבודה לא סטריליות (שלבים 4.1-4.2) וסטריליות (שלב 4.3).
- עיכול מכני
- מניחים את השרירים המבודדים במכסה של צלחת פטרי בקוטר 10 ס"מ.
- בעזרת מלקחיים מעוקלים, אחזו בשרירים המבודדים בזה אחר זה. עבור הסולאוס וה-GA, יש להסיר את החלקים הנותרים של גיד אכילס.
- בעזרת מספריים, לטחון את השרירים המבודדים אחד אחד על ידי חיתוך אותם בערך 1 מ"מ3 חתיכות.
- עיכול אנזימטי
- הכינו את חיץ הדיסוציאציה של השרירים על ידי הוספת 40 מ"ל של מדיום לשטיפה קרה לאבקת collagenase II השוקלת (collagenase II: 650 U/mL באמצעי שטיפה).
הערה: השתמש במאגר דיסוציאציה שרירי טרי שהוכן כדי להבטיח פעילות אנזימטית אופטימלית. - מעבירים את השרירים הטחונים לצינור חרוטי של 15 מ"ל המכיל 5 מ"ל של חיץ דיסוציאציה.
- יש לדגור על הצינור למשך 35 דקות באמבט מים מטלטל בטמפרטורה של 37 מעלות צלזיוס ב-60 סל"ד.
- לאחר הדגירה, להוסיף מדיום כביסה לנפח כולל של 15 מ"ל. סובב את הצינור ב- 1,600 x גרם למשך 5 דקות ב- 4 ° C.
- שאפו את הסופרנאטנט עד לנפח של 4 מ"ל באמצעות שואב מבוסס ואקום. כדי למנוע הפרעה לכדורית, שאפו לאט מלמעלה, והסירו כל שומן צף.
- הפשיר מלאי aliquots של dispase ו collagenase II. הוסף 500 μL של תמיסת collagenase II (1,000 U/mL מלאי, -20 ° C) לדגימה הנותרת של 4 מ"ל. לאחר מכן, הוסף 500 μL של תמיסת dispase (11 U / mL מלאי, -20 ° C).
הערה: דיספז יכול ליצור משקע. במקרה כזה, יש לסובב את תמיסת מלאי הפירוק במהירות של 10,000 x גרם, דקה אחת לפני השימוש. העבירו את הסופרנאטנט השקוף כעת למתלה התא מבלי להפריע לכדור. - מערבבים את הדגימות לזמן קצר כדי להמיס את הכדורית.
- דגרו על הדגימות במשך 20 דקות באמבט מים מטלטל בטמפרטורה של 37 מעלות צלזיוס ב-60 סל"ד.
הערה: עיכול מספר רב של דגימות שריר גוזל זמן. עבור שלבים 4.3.1-4.3.6, העריכו שלוקח 2-5 דקות לדגימה. שלב זה הולך מהר יותר כאשר מבוצע במקביל על ידי שני חוקרים או יותר.
- הכינו את חיץ הדיסוציאציה של השרירים על ידי הוספת 40 מ"ל של מדיום לשטיפה קרה לאבקת collagenase II השוקלת (collagenase II: 650 U/mL באמצעי שטיפה).
- הומוגניזציה של דגימות
- הומוגניזציה של השעיית התא. העבר את המתלה מצינור 15 מ"ל לצינור 50 מ"ל. השתמש מזרק 10 מ"ל עם מחט 20G כדי להשעות מחדש את הדגימה על ידי משיכת הדגימה למעלה ולמטה דרך המחט 5x.
הערה: אם חתיכות של שריר לא מעוכל סותמות את המחט, נגבו אותן על ממחטת נייר. - מניחים מסננת תאים של 40 מיקרומטר על צינור חרוטי חדש של 50 מ"ל.
- קח את מתלה התאים המלא במזרק ומתח את הדגימה לתוך צינור חרוטי חדש 50 מ"ל עם מסננת תאים על גבי. מסננים את הדגימה על ידי חלוקת הנפח הכולל ישירות על המסנן.
- כדי לאחזר את כל התאים החד-גרעיניים, הוסף 20 מ"ל ממדיום השטיפה לצינור החרוטי הריק ושפך זאת דרך מסננת התא לתוך הצינור החרוטי של 50 מ"ל המכיל את הדגימה המתוחה. אחזר את הנפח הנותר מתחת למסננת התא עם פיפטה p1000.
- השליכו את מסננת התאים וסובבו את הדגימה במהירות של 1,600 x גרם למשך 5 דקות ב-4°C.
- על ידי פיפטה עם פיפטה p1000, לשאוף את supernatant מבלי להפריע את הכדור.
- על ידי פיפטה עם פיפטה p1000, להשהות מחדש את גלולת הסרעפת ב 500 μL של מדיום הכביסה ולהשהות מחדש את דגימות השרירים האחרות ב 300 μL של מדיום הכביסה כל אחד.
הערה: הסרעפת היא הגדולה מבין השרירים עם תכולת תאי הגזע הגבוהה ביותר ולכן ניתן להשתמש בה לכתמי הבקרה.
- הומוגניזציה של השעיית התא. העבר את המתלה מצינור 15 מ"ל לצינור 50 מ"ל. השתמש מזרק 10 מ"ל עם מחט 20G כדי להשעות מחדש את הדגימה על ידי משיכת הדגימה למעלה ולמטה דרך המחט 5x.
5. צביעה ומיון (~ 40 דקות + 30 דקות מיון / דגימה)
הערה: עבוד בסביבה סטרילית על קרח עבור השלבים הבאים.
- העבר אליקוט 50 μL של תרחיף תא הסרעפת לארבעה צינורות מיקרוצנטריפוגות חדשים של 2 מ"ל עבור כתמי הבקרה (50 μL כל אחד). הוסף 250 μL של מדיום הכביסה לכל צינור בקרה לנפח סופי של 300 μL.
- הוסף 3 μL (1:100) של נוגדנים פלואורסצנטיים מינוס אחד (FMO-control) לשלושת צינורות צביעת הבקרה והשאר צינור אחד ללא נוגדנים (בקרה לא מוכתמת) (ראה טבלה 2).
- הוסף 3 μL (1:100) של הנוגדנים (VCAM1-PECy7, CD45-FITC, CD31-FITC ו- SCA1-PacificBlue) לתרחיפים הנותרים של תא בודד בשריר, כולל דגימת הסרעפת הנותרת.
- יש לדגור על מתלי התאים למשך 15 דקות בטמפרטורה של 4°C בשייקר ראש מעל הראש.
הערה: כתמי הבקרה נחוצים כדי לקבוע את רמות הפלואורסצנטיות ברקע ולקבוע את השערים לציטומטריית זרימה. ניתן להשתמש בנוגדנים שונים, אך לכל אחד מהם יהיה ריכוז עבודה ספציפי וזמן דגירה שצריך לבדוק. אם משתמשים בנוגדנים מספקים שונים, הריכוז, ולכן הדילול, עשויים להשתנות. ניתן להוסיף צבע כדאיות תא לתערובת הצביעה כדי לחסל תאים מתים או גוססים במהלך המיון. - סובב את הדגימות ב 1,600 x גרם במשך 5 דקות ב 4 ° C. השליכו את הסופרנאטנט מבלי להפריע לגלולה על ידי פיפט.
- על ידי פיפט עם פיפטה p1000, להשהות מחדש כל דגימה ב 800 μL של מדיום הכביסה.
- סנן את הדגימות באמצעות צינור FACS עם מכסה מסננת תאים (40 מיקרומטר) כדי להסיר גושי תאים (או אגרגטים) שנותרו.
- שטפו את מסננת התאים על ידי הוספת 800 μL נוספים של מדיום הכביסה.
- שמור את הדגימות מכוסות ברדיד אלומיניום על קרח עד לניתוח.
הערה: אם בשלב זה תרחיף התא נראה מעונן/צפוף עקב ריכוז גבוה של תאים, הוסף 800 μL נוספים של מדיום השטיפה כדי להקטין את צפיפות התא. - הפעל את FACS עם פייה של 70 מיקרומטר.
- השתמש בפקדי ה- FMO והלא מוכתמים כדי להגדיר את אסטרטגיית ה- gating: MuSCs שליליים עבור CD45-FITC, CD31-FITC ו- SCA1-PacBlue, והם חיוביים עבור VCAM1-PECy7; FAPs שליליים עבור CD45-FITC, CD31-FITC, VCAM1-PECy7, וחיוביים עבור SCA1-PacBlue.
- מיין את המתלים המוכתמים של תא בודד באמצעות מיון דו-כיווני ואסוף את MuSCs ו- FAPs לצינורות איסוף נפרדים המכילים 500 μL של מדיום הכביסה.
הערה: באמצעות FACS עם ארבעה לייזרים (תצורה: זרבובית 70 מיקרומטר, 405 ננומטר, 488 ננומטר, 561 ננומטר, 633 ננומטר), השילוב הנבחר של פלואורופורים אינו דורש פיצוי של אות פלואורסצנטי. עם זאת, אם משתמשים בציטומטר זרימה שונה או בשילוב שונה של פלואורופורים, מומלץ לבצע דגימות בקרה מוכתמות בודדות נוספות לפיצוי. מהשרירים הקטנים יותר (EDL, soleus, TA) יש לצפות לתפוקות של 3,000 MuSCs ו-5,000 FAPs. עבור השרירים הגדולים האחרים, יש לצפות לתשואות של 20,000 MuSCs ו- FAPs. ספירת אירועים המפורטים על-ידי תוכנת FACS עשויה לחרוג מהמספר בפועל של תאים ברי קיימא בצינור האיסוף. ניתן לאשר מספרי תאים על ידי ספירת תאים באמצעות המוציטומטר. - סובב את התאים הממוינים במהירות של 1,600 x גרם למשך 5 דקות ב- 4 ° C. על ידי pipetting, לשאוף את supernatant מבלי להפריע גלולת התא.
- הוסף 100 μL של מדיום הכביסה לכל דגימה והשהה בזהירות את התאים מבלי ליצור בועות אוויר. מעבירים את 100 μL של הדגימה המרחפת לצלחת מצופה קולגן בחצי שטח 96 בארות. צלחת 1,000-3,000 תאים לכל באר.
הערה: אם התאים אינם מושהים מחדש כראוי, התאים עלולים להידבק זה לזה בגושים, מה שמבלבל ניתוחים מיקרוסקופיים מאוחרים יותר. - בדקו את התאים מתחת למיקרוסקופ ושימו לב לפיזורם, צורתם וגודלם.
- לדגור על הצלחת ב 37 ° C, 5% CO2. התאים ייצמדו תוך שעתיים.
הערה: מומלץ לאשר את טוהר אוכלוסיות התאים שנאספו, בין אם על ידי ניתוח ציטומטריה של זרימה (על ידי טעינת aliquot של הדגימה הממוינת על הממיין ורישום מספר קטן של אירועים) או על ידי צביעת נוגדנים של התאים המצופים ואחריו מיקרוסקופיה (Pax7 הוא סמן מגדיר עבור MuSCs עכבר, PDGFRa הוא סמן מגדיר עבור FAPs עכבר). החל מסעיף 7 להלן פרוטוקול לצביעת תאים עבור רמות חלבון Pax7 ו-PDGFRa.
6. בדיקת התאגדות EdU
הערה: עבוד בתנאים סטריליים והשתמש במכסה האדים הכימי בעת טיפול בפרפורמאלדהיד (PFA) עבור השלבים הבאים. EdU הוא נוקלאוטיד אנלוגי המשולב בדנ"א כאשר התאים עוברים את שלב S של מחזור התא. הוא מוטגני בריכוזים גבוהים. יש ללבוש תמיד כפפות בעת הטיפול ב-EdU. בדוק את ההנחיות המקומיות לטיפול בפסולת EdU.
- דופק EdU (יום 1)
- הכינו פתרון עבודה של 2x EdU במדיום כביסה טרי.
- מוציאים את הצלחת בת 96 הבארות עם התאים מהאינקובטור. בדוק את התאים מתחת למיקרוסקופ כדי לפקח על מפגש. עברו למכסה המנוע של הזרימה הלמינרית.
- מוציאים 50 מיקרוליטר של מדיום מהצלחת על ידי פיפט. הוסף 50 μL של פתרון עבודה 2x EdU כך שהנפח הסופי בבאר הוא 100 μL.
- תרבית את התאים בנוכחות EdU לתקופה המיועדת של זמן ב 37 ° C, 5% CO2.
הערה: העיתוי ומשך פעימת ה-EdU עשויים להשתנות. בממוצע, MuSCs שקטים לוקחים יומיים כדי להפעיל באופן מלא ולהשלים את חלוקת התא הראשון שלהם19. ניתן להוסיף EdU לתאים הממוינים מיד לאחר הציפוי.
- קיבוע (יום 2)
הערה: PFA הוא חומר מסרטן. טפל תמיד ב- PFA בזהירות. להכיר את התקנות המקומיות לטיפול ב- PFA וסילוק פסולת.- מוציאים את הצלחת בת 96 הבארות עם התאים מהאינקובטור. בדקו את התאים מתחת למיקרוסקופ והזיזו את הצלחת לתוך מכסה האדים.
- על ידי pipetting, להסיר את המדיום לתקן את התאים על ידי הוספת 50 μL של 4% PFA לכל באר. דוגרים על הצלחת במשך 10 דקות בטמפרטורת החדר (RT) במכסה אדים כימי.
- הסר את ה- PFA עם פיפטה והשלך אותו למיכל פסולת מתאים.
- לשטוף את התאים על ידי הוספת 100 μL של PBS לכל הבארות. על ידי pipetting, שואפים PBS ולחזור על הכביסה. שמור את התאים ב 100 μL של PBS.
הערה: כדי להימנע משטיפת תאים, יש לפזר את PBS לצד הבאר על ידי צנרת איטית.
- תיוג EdU
- חדרו את התאים לפני זיהוי EdU על ידי הסרת PBS והוספת 100 μL של 0.5% Triton X-100 ב-PBS. לדגור על הצלחת במשך 5 דקות ב 4 ° C.
הערה: Triton X-100 הוא חומר פעיל שטח ועלול לגרום לגירוי בעור. טפל בזהירות והשתמש תמיד בכפפות. - לאחר 5 דקות, שאפו את Triton X-100 והוסיפו 100 μL של PBS.
- הכינו תערובת תגובת כימיית קליק EdU בהתאם לפרוטוקול היצרן.
- שאפו את PBS והוסיפו 33 μL של תערובת התגובה לכימיית הקליק של EdU. לדגור על הצלחת במשך 30 דקות ב RT.
- שאפו את תערובת תגובת הקליק-כימיה של EdU ושטפו את התאים עם 100 מיקרוליטר של PBS.
- שאפו את PBS, הוסיפו 100 μL של PBS עם Hoechst (1:2,000), ודגרו מוגנים מפני אור למשך 10 דקות ב-RT.
- שאפו את Hoechst ושטפו פעמיים על ידי הוספת 100 μL של PBS. אחסן את התאים ב 100 μL של PBS ב 4 ° C בחושך.
- דמיינו את התאים במיקרוסקופ הפוך. התאים יכולים להיות מאוחסנים בחושך במשך חודשים כל עוד הבארות לא מתייבשות.
הערה: ניתן להכתים את התאים בנוגדנים. במקרה זה, המשך עם צעד חסימה ואחריו דגירה עם הנוגדן העיקרי. בחר נוגדן משני עם פלואורופור מצומד שספקטרום הפליטה שלו אינו חופף לזה של הפלואורופור המשמש לזיהוי EdU. הקפד לא להשתמש בנוגדנים משניים עם פלואורופורים החופפים לטווח הספקטרלי של Hoechst.
- חדרו את התאים לפני זיהוי EdU על ידי הסרת PBS והוספת 100 μL של 0.5% Triton X-100 ב-PBS. לדגור על הצלחת במשך 5 דקות ב 4 ° C.
7. צביעה immunofluorescence
הערה: ניתן לבצע חלק זה של הפרוטוקול בנפרד מסעיף 6. בעת דילוג על סעיף 6, בצע את שלבים 6.3.1 ו- 6.3.2 כדי לאפשר חלחול תאים לפני שתמשיך לשלב 7.2 להלן.
- הוציאו את הצלחת המכילה את התאים המסומנים ב-EdU.
- הכן 20 מ"ל של חיץ חוסם על ידי הוספת 2 מ"ל של נסיוב חמור ל 18 מ"ל של PBS.
- כדי למנוע קשירת נוגדנים לא ספציפיים, הסר 100 μL של PBS מכל באר והוסף 50 μL של המאגר החוסם עם פיפטה p200. יש לדגור על הצלחת למשך 30 דקות ב-RT, כשהיא מוגנת מפני אור ומכוסה ברדיד אלומיניום כדי למנוע הלבנה של ה-EdU עם תווית הפלואורופור.
הערה: התאים מקובעים לתחתית הבאר אך יכולים להתנתק אם מופעל כוח רב מדי בעת פיפט. - בעת חסימת הדגימות, להכין את תערובת הנוגדנים העיקרית. הוסף 8.0 μL (1:100) של עכבר anti-Pax7 וארנב anti-PDGFRa ל 800 μL של חיץ חוסם כדי להכתים 16 בארות (שמונה רקמות, שני סוגי תאים).
- לאחר החסימה, להסיר את סרום חמור ולהוסיף 50 μL של תערובת נוגדנים ראשונית לכל באר. לדגור על הצלחת למשך הלילה ב 4 ° C, מכוסה ברדיד אלומיניום.
- לאחר הדגירה, להסיר את הנוגדן הראשוני ולהוסיף 50 μL של טריטון (0.5% PBS) לכל בארות. דגרו על הצלחת במשך 5 דקות ב-RT מוגן מאור, כדי לשטוף את הנוגדן הלא קשור. חזרו על הכביסה שלוש פעמים.
- הכינו את תערובת הנוגדנים המשנית על ידי הוספת 1.0 μL (1:1,000) של חמור נגד עכבר-Alexa647 וחמור נגד ארנב-Alexa555 לצינור מיקרוצנטריפוגה המכיל 1,000 μL של המאגר החוסם.
- הוסף 33 μL של תערובת האב נוגדנים משנית לכל אחת מהבארות. דגרו על הצלחת במשך 60 דקות ב-RT מוגן מאור.
- הסר את עודף הנוגדן המשני על ידי פיפטציה, הוסף 50 μL של טריטון (0.1% ב- PBS), ודגר במשך 5 דקות ב- RT מוגן מפני אור. חזרו על הכביסה שלוש פעמים.
- לבסוף, להוסיף 100 μL של PBS. החליטו אם לצלם את הצלחת באופן מיידי באמצעות מיקרוסקופ פלואורסצנטי הפוך עם מצלמת CCD מקוררת, או לאחסן את הצלחת בטמפרטורה של 4°C עד לניתוח מאוחר יותר על ידי איטום קצוות הצלחת בפרפילם ועטיפת הצלחת האטומה ברדיד אלומיניום.
תוצאות
בעקבות הפרוטוקול לבידוד שרירי שלד בודדים (איור 2), שרירי gracilis, TA, EDL, GA, soleus, triceps, Masseter ו-Diaphragm בודדו משלושה עכברים זכרים שוויצרים שהופסקו מתוכנית רבייה מקומית (איור 2). בעקבות דיסוציאציה של רקמות והכתמת נוגדנים, MuSCs ו-FAPs מהשרירים הבודדים טוהרו על-ידי FACS (איור 3). החיתוך הראשוני התקבל עם דגימה לא מוכתמת כדי לזהות את התאים ולהפריד את הסינגלטים מכפילים (איור 3A). השערים הבאים נקבעו באמצעות פקדי FMO לזיהוי ספי צביעה (איור 3B). הדגימה המוכתמת הייתה מגודרת עבור CD31/CD45-FITC ו-Sca1-PacBlue. אוכלוסיית SCA1+/CD31-/CD45- (FAPs) מויינה לשפופרת איסוף נפרדת, בעוד שאוכלוסיית הנגטיב הכפול הייתה מגודרת ושורטטה עבור VCAM1-PECy7 ופיזור קדימה (FSC). אוכלוסיית VCAM1+ (MuSCs) מויינה לשפופרת איסוף נפרדת. MuSCs ו-FAPs כומתו כאחוז הסינגלטים (טבלה 3) ומוינו לצינורות איסוף נפרדים המכילים 500 μL של מדיום השטיפה. למתלים החד-תאיים של שרירי הסרעפת והתלת ראשי יש שפע יחסי גבוה יותר של MuSCs מאשר ל-FAPs, בעוד שלמתלים החד-תאיים האחרים יש שפע יחסי גבוה יותר של FAPs מאשר ל-MuSCs (טבלה 3).
מתוך התאים שמוינו, 1,000-3,000 תאים נזרעו והודגרו במשך 24 שעות. לאחר 24 שעות של דגירה, המדיום הוסר והוחלף בתווך טרי המכיל EdU. התאים תוקנו ב-48 שעות, הוכתמו עבור EdU, ולאחר מכן עם נוגדנים נגד חלבון Pax7 או חלבון PDGFRa, וצולמו באמצעות מיקרוסקופ אפיפלואורסצנטי הפוך. התמונות כומתו באמצעות תוסף פיג'י ב-ImageJ. נצפתה צביעת EdU חזקה, אף על פי שחלק התאים החיוביים ל-EdU היה שונה עבור שני סוגי תאי הגזע והשרירים השונים (איור 4A-C). MuSCs שבודדו מה-EDL או מה-GA הראו שילוב EdU נמוך משמעותית בהשוואה ל-MuSCs שבודדו מה-TA, הסרעפת, הגרציליס או התלת ראשי, בעוד ש-MuSCs שבודדו מה-Masseter וה-Soleus נופלים ביניהם ואינם שונים באופן משמעותי מאף אחת מהקבוצות (איור 4A,B). זה עולה בקנה אחד עם התוצאות הקודמות שלנו22. יתר על כן, הרקמות שמהן ה- MuSCs מראים רמות שילוב EdU גבוהות הן אותן רקמות שמהן הודגם בעבר כי MuSCs מבטאים רמות גבוהות של חלבון Pax322. FAPs שבודדו מה-EDL הראו שילוב EdU נמוך משמעותית בהשוואה ל-FAPs שבודדו מה-GA וה-soleus, בעוד ש-FAPs שבודדו מה-TA הראו שילוב EdU נמוך משמעותית בהשוואה ל-FAPs שבודדו מה-soleus (איור 4A,C). זה מדגיש את החשיבות של ניתוח תאי גזע מרקמות בודדות במקום איגום שרירים מרקמות שונות לבידוד. עבור כל הרקמות, החלק הממוצע של MuSCs חיוביים ל- EdU היה גבוה יותר בהשוואה לחלק הממוצע של FAPs חיוביים ל- EdU, דבר המצביע על כך ש- MuSCs מופעלים מהר יותר בתנאים הנתונים.
לבסוף, טוהר התאים אושר באמצעות צביעה אימונופלואורסצנטית (איור 4D). בממוצע, 97.71% (± 1.38%) מה-MuSCs הוכתמו כחיוביים לחלבון Pax7, ו-88.16% (±6.35%) מה-FAPs הוכתמו כחיוביים לחלבון PDGFRa, מה שמאשר את הספציפיות של הליך בידוד תאי הגזע שלנו (איור 4D).

איור 1: תקציר סכמטי של הפרוטוקול. סכמטי המציג את שני המקטעים העיקריים של הפרוטוקול, בידוד MuSC (לוח עליון), בדיקת שקט (לוח תחתון), ואת שלבי המפתח של המתודולוגיה המשמשת בכל אחד מהם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
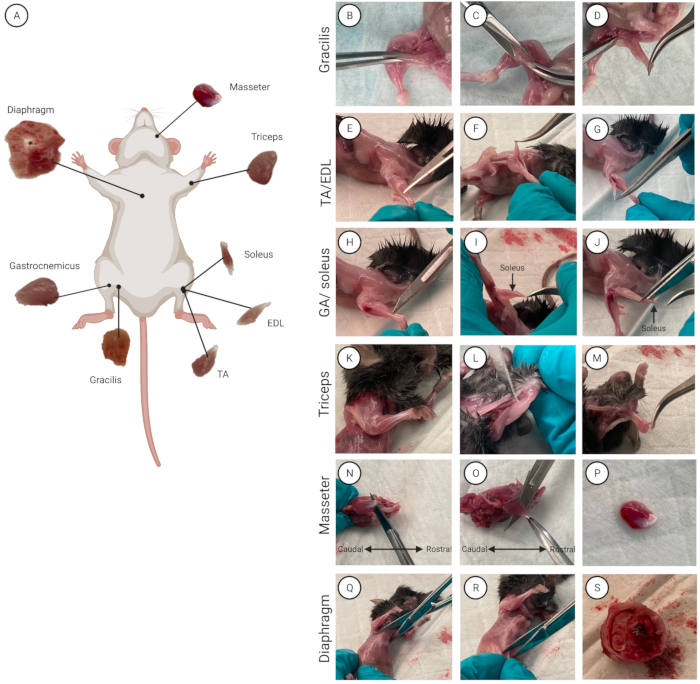
איור 2: מיקום שרירים ובידוד. (A) סכימה שמראה את המיקום של כל שריר. (ב-ס) הדגמה של בידוד שרירים עבור (B-D) gracilis, (E-G) TA/EDL, (H-J) triceps, (K-M) GA/soleus, (N-P) masseter, ו (Q-S) שרירי הסרעפת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
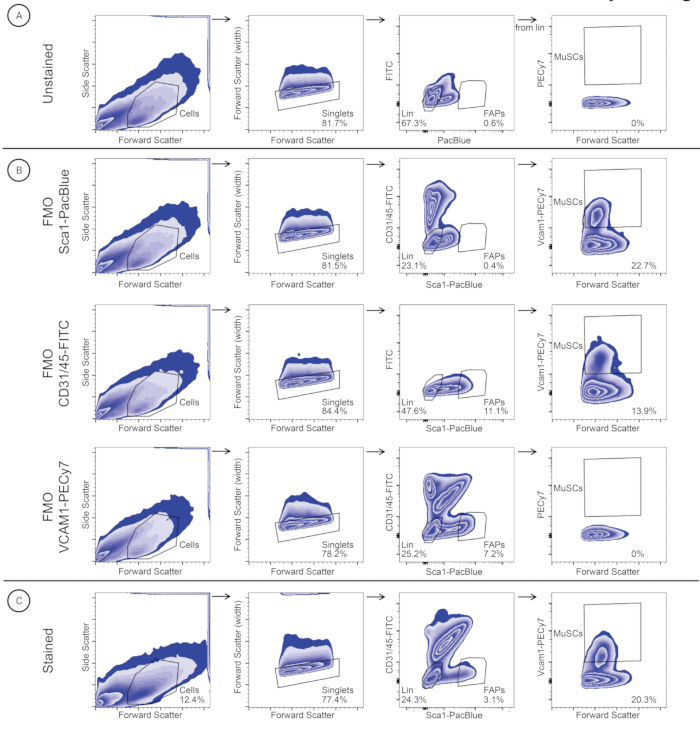
איור 3: אסטרטגיית Gating המשמשת לזיהוי ומיון MuSCs ו-FAPs בדגימת שריר הסרעפת. תאים מזוהים בהתבסס על גודל התא (פיזור קדימה (FSC)) וגרעיניות (פיזור צד (SSC)). סינגלים נבחרים על בסיס FSC-A ו- FSC-W. תאי שושלת מגודרים לזיהוי עוקב של MuSCs (Lineage-/VCAM1+), ותאי FAP (Lineage-/SCA1+) מגודרים לזיהוי FAPs. אותה אסטרטגיית gating יושמה על (A) פקד לא מוכתם, (B) פקדי FMO (FMO-SCA1PacBlue, FMO-CD31/45-FITC ו-FMO-VCAM1-PECy7), ו-(C) דגימה מוכתמת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: כימות הפעלת תאים על-ידי צביעת EdU. (A) תמונות מייצגות של צביעת EdU של MuSCs (לוחות עליונים) ו-FAPs (לוחות תחתונים) מדגימת דיאפרגמה. מוצגות תמונות ממוזגות של EdU ו- Hoechst (חלוניות שמאליות), והערוצים הבודדים בירוק (EdU, לוחות אמצעיים) וכחול (Hoechst, לוחות ימניים). (ב,ג) גרף עמודות המציג את אחוז ה- MuSCs (B) חיובי ל- EdU (B) או (C) FAPs עבור השרירים שצוינו. Plotted הוא הממוצע ± SEM. כל נקודה מייצגת עכבר. ניתוח סטטיסטי בוצע ב-GraphPad באמצעות מבחני t דו-זנביים של סטודנטים, כאשר מובהקותם נקבעה ל-*p <-0.05 ו-**p <-0.01. (D) צביעה אימונופלואורסצנטית של MuSCs (פאנלים עליונים) ו-FAPs (פאנלים תחתונים) עם נוגדנים כנגד סמן MuSC Pax7 (צד שמאל) וסמן FAP PDGFRa (צד ימין). מוצגות תמונות ממוזגות של Pax7 עם Hoechst, ואחריו הערוצים הבודדים, ותמונות ממוזגות של PDGFRa עם Hoechst, ואחריו הערוצים הבודדים. N = 3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| פתרונות | ריאגנטים | כמות |
| כביסה בינונית | F-10 תערובת חומרים מזינים (בשר חזיר) (1x), +L-גלוטמין | 445 מ"ל |
| נסיוב סוסים | 50 מ"ל | |
| עט/סטרפטוקוקוס | 5 מ"ל | |
| חיץ דיסוציאציה (עיכול ראשון) | קולגנאז סוג II | 650 U/מ"ל |
| כביסה בינונית | 100 מ"ל | |
| ציר דיספז (עיכול שני) | Dispase ב PBS | 11 U/מ"ל |
| ציר Collagenase (עיכול שני) | Collagenase סוג II ב PBS | 1000 U/מ"ל |
| PBS 1x | PBS 10x תרכיז אבקה | 9.89 גרם/ליטר |
| מים אוטוקלאביים/סטריליים | 1 ליטר | |
| מים חומציים | חומצה אצטית קרחונית (100%) נטולת מים לניתוח | 5.15 מ"ל |
| מים אוטוקלאביים/סטריליים | 895 מ"ל | |
| תמיסת קולגן (0.002%) | קולגן מעור עגל | 20 מ"ל |
| מים חומציים | 800 מ"ל | |
| טריטון X-100 | טריטון X-100 | 0.5% (V/V) |
| PBS 1x | 99.5% | |
| מאגר חוסם | PBS 1x | 18 מ"ל |
| נסיוב חמורים | 2 מ"ל |
טבלה 1: טבלת מתכונים.
| מס' מדגם. | שם |
| 1 | לא מוכתם |
| 2 | פלואורסצנטיות מינוס VCAM1-PeCy7 |
| 3 | פלואורסצנטיות מינוס SCA1-PacificBlue |
| 4 | פלואורסצנטיות פחות CD31/45-FITC |
| 5 | כתם ניסיוני (כל ארבעת הנוגדנים) |
טבלה 2: סקירה כללית של צביעה, בקרות ודגימות שהוכנו לכל רקמה לפני המיון.
| טישו | תערובת נוגדנים | תאים | סינגלטים | לין נג | FAPs | MuSCs |
| דיאפרגמה | לא מוכתם | 100% | 82% | 55% | 0.5% | 0.0% |
| FMO Sca1-PacBlue | 100% | 83% | 19% | 0.3% | 4.3% | |
| FMO CD31/45-488 | 100% | 84% | 40% | 9.4% | 5.6% | |
| FMO Vcam1-PeCy7 | 100% | 78% | 20% | 5.6% | 0.0% | |
| מוכתם | 100% | 77% | 19% | 2.4% | 3.8% | |
| גראציליס | מוכתם | 100% | 96% | 11% | 2.6% | 1.4% |
| תודה | מוכתם | 100% | 88% | 16% | 2.8% | 2.2% |
| EDL | מוכתם | 100% | 86% | 26% | 19.2% | 0.8% |
| סולאוס | מוכתם | 100% | 91% | 41% | 13.3% | 1.1% |
| GA | מוכתם | 100% | 94% | 51% | 6.1% | 1.5% |
| תלת ראשי | מוכתם | 100% | 92% | 30% | 2.6% | 4.5% |
| מסאטר | מוכתם | 100% | 85% | 27% | 19.3% | 2.6% |
טבלה 3: סקירה כללית של השפע היחסי של סוגי תאים בנתוני FACS.
Discussion
מספר שלבים הם המפתח בביצוע פרוטוקול זה כדי להשיג תשואות טובות. לשרירים הבודדים יש נפח קטן בהשוואה לכמות השריר המשמשת בפרוטוקולי בידוד בתפזורת. התוצאה היא סיכון שהשריר יתייבש במהלך הדיסקציה, מה שמקטין את התפוקה. כדי למנוע זאת, חשוב להוסיף מדיום לשרירים מיד לאחר הדיסקציה. בנוסף, אם הדיסקציה נמשכת זמן רב יותר, ניתן להסיר את העור מגפה אחת בכל פעם כדי להפחית את זמן החשיפה של השרירים לאוויר. הנפח הקטן יותר גורם גם לסיכון מוגבר לעיכול יתר. כדי להתמודד עם זה, השיטה הנוכחית דורשת כמויות נמוכות יותר של אנזים collagenase II וזמני עיכול מופחתים בהשוואה לפרוטוקולי שרירים בתפזורת 9,16. עיכול אנזימטי תלוי גם בטוהר האנזימים, וטוהר נמוך יותר יכול להשפיע לרעה על התפוקה. בנוסף, עיכול מכני הוא קריטי. במקרה של חיתוך לא מספיק, שטח הפנים המופחת יפגע בעיכול אנזימטי ויוריד את תפוקת תאי הגזע. במקרה של חיתוך רב מדי, שטח הפנים המוגדל יגרום לעיכול יתר ויוריד את תפוקת תאי הגזע. אמבט המים המרעיד מונע משקעים של השריר המעוכל, משפר את פיזור האנזים ומסייע ביצירת טמפרטורה הומוגנית, המאפשרת לחלוטין זמני דגירה קצרים יותר. לכן, השיטה הנוכחית מאפשרת קיצור משמעותי של זמן הדגירה בהשוואה לשיטות אחרות.
פרוטוקול זה תלוי בדיסוציאציה וטיהור תאים. הליכים אלה מחקים פגיעה ברקמות, המפעילה את תאי הגזע. באופן עקבי, מחקרים אחרונים גילו כי MuSCs משנים את תוכניות ביטוי הגנים שלהם במהלך הליך הבידוד27,28,29,30. כתוצאה מכך, תאי הגזע המטוהרים שונים מתאי in vivo מבחינת דפוסי ביטוי גנים. גורם מגביל שני בפרוטוקול הוא התלות שלו ב- FACS, הדורשת גישה לציוד יקר. FACS הוא תקן הזהב לבידוד אוכלוסיות תאים מרובות בו זמנית עם טוהר גבוה20. ההתקדמות האחרונה באמצעות חרוזים מגנטיים ומיקרו-בועות מציעה הפחתה של31,32 בעלות, אך יש לקבוע אם הם מציעים תשואות דומות לעבודה על שרירים בודדים. לבסוף, התשואה של הפרוטוקול מוגבלת בשל גודלם הקטן של השרירים, ובכך מציבה מגבלות על בדיקות פוטנציאליות במורד הזרם.
מחקרים קודמים הסתמכו על איגום שרירים שונים בעת בידוד MuSCs ו / או FAPs כדי למקסם את תפוקת התאים. עם זאת, זה ממוצע של כל הבדלים ספציפיים לרקמות בהתנהגות תאי גזע ובתפקוד בין שרירים שונים. הפרוטוקול הנוכחי מאפשר בידוד של MuSCs ו- FAPs משרירים בודדים לצורך ניתוח במורד הזרם של תפקוד תאי גזע. כדוגמה לניסוי במורד הזרם, הפעלת תאי גזע נבדקה על ידי שילוב EdU, וגילתה כי תאי גזע מרקמות שונות מציגים קינטיקה של הפעלה שונה. בעבודות קודמות הוכחה ההיתכנות של שימוש במבדקים אחרים במורד הזרם; בדיקות אלה דורשות מספרי תאים קטנים יותר, כגון ריצוף RNA חד-תאי SmartSeq2, השתלת תאים, PCR מיקרופלואידי ומבחני הרחבת שבטים 22,33,34,35.
לסיכום, פרוטוקול זה מתאר שיטה לדיסקציה של שרירים בודדים כדי לבודד ולחקור MuSCs ו- FAPs. אסטרטגיה זו תאפשר לניסויים להשיג הבנה טובה יותר של תפקוד תאי גזע על פני שרירים שונים בבריאות ובחולי.
Disclosures
למחברים אין אינטרסים כלכליים מתחרים ואין ניגודי עניינים.
Acknowledgements
מיון התאים בוצע במתקן הליבה FACS, אוניברסיטת ארהוס, דנמרק. הדמויות נוצרו באמצעות Biorender.com. אנו מודים לד"ר ג'יי פארופ על שיתוף נוגדן הארנב נגד PDGFRa. עבודה זו נתמכה על ידי מענק התחלתי של AUFF ל- E.P. ו- Start Package מ- NovoNordiskFonden ל- E.P. (0071113) ול- A.D.M. (0071116).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube( PCR performance tested, PP, 30,000 xg, DNA/DNase-/RNase-free, Low DNA binding, Sterile ) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 72.706.700 | 1.5 mL tube |
| 15 mL tube (PP/HD-PE, 20,000 xg, IVD/CE, IATA, DNA/DNase-/RNase-free, Non-cytotoxic, pyrogen free, Sterile) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 62.554.502 | 15 mL tube |
| 5 mL polystyrene round-bottom tube | Falcon, Fisher Scientific | 352054 | FACS tube without strainer cap |
| 5 mL polystyrene Round-bottom tube with cell-strainer cap | Falcon, Fisher Scientific | 352235 | FACS tube with strainer cap |
| 5 mL tube (PP, non sterile autoclavable) | VWR collection | 525.0946 | 5 mL tube |
| 50 mL tube( PP/HD-PE, 20,000 xg, IVD/CE, ADR, DNA/DNase-/RNase-free, non-cytotoxic, pyrogen free, Sterile) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 62.547.254 | 50 mL tube |
| Alexa Fluor 555 Donkey anti-rabbit IgG (H+L) | Invitrogen, Thermo Fisher | Lot: 2387458 (Cat # A31572) | |
| Alexa Fluor 647 donkey-anti mouse IgG (H+L) | Invitrogen, Thermo Fisher | Lot: 2420713 (Cat#A31571) | |
| ARIA 3 | BD | FACS, Core facility Aarhus University | |
| Centrifuge 5810 | eppendorf | EP022628188 | Centrifuge |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 488 dye | Invitrogen, Thermo Fisher | Lot: 2387287 (Cat# C10337) | Cell Proliferation Kit |
| Collagen from calf-skin | Bioreagent, Sigma Aldrich | Source: SLCK6209 (Cat# C8919) | |
| Collagenase type II | Worthington, Fisher Scientific | Lot: 40H20248 (cat# L5004177 ) | Collagenase |
| Dispase | Gibco, Fisher Scientific | Lot: 2309415 (cat# 17105-041 ) | Dispase |
| Donkey serum (non-sterile) | Sigma Aldrich, Merck | Lot: 2826455 (Cat# S30-100mL) | |
| Dumont nr. 5, 110 mm | Dumont, Hounisen Laboratorieudstyr A/S | 1606.327 | Straight forceps with fine tips |
| Dumont nr. 7, 115 mm | Dumont, Hounisen Laboratorieudstyr A/S | 1606.335 | Curved forceps |
| F-10 Nutrient mixture (Ham) (1x), +L-glutamine | Gibco, Fisher Scientific | Lot. 2453614 (cat# 31550-023) | |
| FITC anti-mouse CD31 | BioLegend, NordicBioSite | MEC13.3 (Cat # 102506) | |
| FITC Anti-mouse CD45 | BioLegend, NordicBioSite | 30-F11 (Cat# 103108) | |
| Glacial acetic acid (100%) | EMSURE, Merck | K44104563 9Cat # 1000631000) | |
| Head over head mini-tube rotator | Fisher Scientific | 15534080 (Model no. 88861052) | Head over head mini-tube rotator |
| Horse serum | Gibco, Fisher Scientific | Lot. 2482639 (cat# 10368902 ) | |
| Isotemp SWB 15 | FisherBrand, Fisher Scientific | 15325887 | Shaking water bath |
| MS2 mini-shaker | IKA | Vortex unit | |
| Needle 20 G (0.9 mm x 25 mm) | BD microlance, Fisher Scientific | 304827 | 20G needle |
| Neutral formalin buffer 10% | CellPath, Hounisen Laboratorieudstyr A/S | Lot: 03822014 (Cat # HOU/1000.1002) | |
| Non-pyrogenic cell strainer (40 µM) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 83.3945.040 | Cell strainer |
| Pacific Blue anti-mouse Ly-6A/E (Sca-1) | BioLegend, NordicBioSite | D7 (Cat# 108120) | |
| Pax7 primary antibody | DSHB | Lot: 2/3/22-282ug/mL (Cat# AB 528428) | |
| PBS 10x powder concentrate | Fisher BioReagents, Fisher Scientific | BP665-1 | |
| PE/Cy7 anti-mouse CD106 (VCAM1) | BioLegend, NordicBioSite | 429 (MVCAM.A) (Cat # 105720) | |
| Pen/strep | Gibco, Fisher Scientific | Lot. 163589 (cat# 11548876 ) | |
| Pipette tips p10 | Art tips, self sealing barrier, Thermo Scientific | 2140-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p1000 | Art tips, self sealing barrier, Thermo Scientific | 2279-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p20 | Art tips, self sealing barrier, Thermo Scientific | 2149P-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p200 | Art tips, self sealing barrier, Thermo Scientific | 2069-05 | Low retention, pre-sterilized, filter tips |
| Protective underpad | Abena | ACTC-7712 | 60 x 40cm, 8 layers |
| Rainin, pipet-lite XLS | Mettler Toledo, Thermo Scientific | 2140-05, 2149P-05, 2279-05, 2069-05 | Pipettes (P10, P20, P200, P1000) |
| Recombinant anti-PDGFR-alpha | RabMAb, abcam | AB134123 | |
| Scalpel (shaft no. 3) | Hounisen, Hounisen Laboratorieudstyr A/S | 1902.502 | Scalpel |
| Scalpel blade no. 11 | Heinz Herenz, Hounisen Laboratorieudstyr A/S | 1902.0911 | Scalpel |
| Scanlaf mars | Labogene | class 2 cabinet: Mars | Flow bench |
| ScanR | Olympus | Microscope, Core facility Aarhus University | |
| Scissors | FST | 14568-09 | |
| Series 8000 DH | Thermo Scientific | 3540-MAR | Incubator |
| Serological pipette 10 mL | VWR | 612-3700 | Sterile, non-pyrogenic |
| Serological pipette 5 mL | VWR, Avantor delivered by VWR | 612-3702 | Sterile, non-pyrogenic |
| Syringe 5 mL, Luer tip (6%), sterile | BD Emerald, Fisher Scientific | 307731 | Syringe |
| TC Dish 100, standard | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 83.3902 | Petri dish |
| Tissue Culture (TC)-treated surface, black polystyrene, flat bottom, sterile, lid, pack of 20 | Corning, Sigma Aldrich | 3764 | 96-well Half bottom plate |
| Triton X-100 | Sigma Aldrich, Merck | Source: SLCJ6163 (Cat # T8787) |
References
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9 (2), 493-495 (1961).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692(2021).
- Cheung, T. H., Rando, T. A. Molecular regulation of stem cell quiescence. Nature Reviews. Molecular Cell Biology. 14 (6), 329-340 (2013).
- Kann, A. P., Hung, M., Krauss, R. S. Cell-cell contact and signaling in the muscle stem cell niche. Current Opinion in Cell Biology. 73, 78-83 (2021).
- Tedesco, F. S., Dellavalle, A., Diaz-Manera, J., Messina, G., Cossu, G. Repairing skeletal muscle: regenerative potential of skeletal muscle stem cells. Journal of Clinical Investigation. 120 (1), 11-19 (2010).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Lepper, C., Partridge, T. A., Fan, C. -M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Joe, A. W. B., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Uezumi, A., Fukada, S. -I., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Seale, P., Sabourin, L. A., Girgis-Gabardo, A., Mansouri, A., Gruss, P., Rudnicki, M. A. Pax7 Is Required for the Specification of Myogenic Satellite Cells. Cell. 102 (6), 777-786 (2000).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- Fukada, S. -I., et al. Molecular signature of quiescent satellite cells in adult skeletal muscle. Stem Cells. 25 (10), 2448-2459 (2007).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Joe, A., Wang, J., Rossi, F. Prospective isolation of adipogenic progenitors from skeletal muscle. Journal of Investigative Medicine. 55 (1), 124(2007).
- Yi, L., Rossi, F. Purification of progenitors from skeletal muscle. Journal of Visualized Experiments. (49), e2476(2011).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119 (4), 543-554 (2004).
- Montarras, D., et al. Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Conboy, M. J., Cerletti, M., Wagers, A. J., Conboy, I. M. Immuno-analysis and FACS sorting of adult muscle fiber-associated stem/precursor cells. Methods In Molecular Biology. 621, 165-173 (2010).
- de Morree, A., et al. Alternative polyadenylation of Pax3 controls muscle stem cell fate and muscle function. Science. 366 (6466), 734-738 (2019).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental Biology. 397 (1), 31-44 (2015).
- Mookhtiar, K., Randall Steinbrink, D., Van Wart, H. E. Mode of hydrolysis of collagen-like peptides by class I and class II Clostridium histolyticum collagenases: evidence for both endopeptidase and tripeptidylcarboxypeptidase activities. Biochemistry. 24 (23), 6527-6533 (1985).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. The Journal of Investigative Dermatology. 93 (2), 287-290 (1989).
- Baghdadi, M. B., et al. Reciprocal signalling by Notch-Collagen V-CALCR retains muscle stem cells in their niche. Nature. 557 (7707), 714-718 (2018).
- van Velthoven, C. T. J., de Morree, A., Egner, I. M., Brett, J. O., Rando, T. A. Transcriptional profiling of quiescent muscle stem cells in vivo. Cell Reports. 21 (7), 1994-2004 (2017).
- Machado, L., et al. In situ fixation redefines quiescence and early activation of skeletal muscle stem cells. Cell Reports. 21 (7), 1982-1993 (2017).
- Machado, L., et al. Tissue damage induces a conserved stress response that initiates quiescent muscle stem cell activation. Cell Stem Cell. 28 (6), 1125-1135 (2021).
- vanden Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Moore, D. K., Motaung, B., du Plessis, N., Shabangu, A. N., Loxton, A. G. SU-IRG consortium isolation of B-cells using Miltenyi MACS bead isolation kits. PloS One. 14 (3), 0213832(2019).
- Liou, Y. -R., Wang, Y. -H., Lee, C. -Y., Li, P. -C. Buoyancy-activated cell sorting using targeted biotinylated albumin microbubbles. PloS One. 10 (5), 0125036(2015).
- Brett, J. O., et al. Exercise rejuvenates quiescent skeletal muscle stem cells in old mice through restoration of Cyclin D1. Nature Metabolism. 2 (4), 307-317 (2020).
- Tabula Muris Consortium. A single-cell transcriptomic atlas characterizes ageing tissues in the mouse. Nature. 583 (7817), 590-595 (2020).
- de Morrée, A., et al. Staufen1 inhibits MyoD translation to actively maintain muscle stem cell quiescence. Proceedings of the National Academy of Sciences. 114 (43), 8996-9005 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved