Method Article
個々の骨格筋からの静止幹細胞集団の分離
要約
このプロトコルは、マウスの個々の骨格筋からの筋幹細胞および線維脂肪原性前駆細胞の単離について説明しています。このプロトコルには、単一筋解剖、蛍光活性化細胞選別による幹細胞の単離、免疫蛍光染色による純度評価、および5-エチニル-2'-デオキシウリジン取り込みアッセイによるS期侵入の定量的測定が含まれます。
要約
骨格筋には、組織の恒常性と修復に寄与する成体幹細胞の明確な集団があります。骨格筋幹細胞(MuSC)は新しい筋肉を作る能力を持っていますが、線維脂肪原性前駆細胞(FAP)は間質支持組織に寄与し、線維芽細胞や脂肪細胞を作る能力を持っています。MuSCとFAPはどちらも、静止と呼ばれる長期の可逆的な細胞周期の出口の状態で存在します。静止状態は、それらの機能の鍵です。静止幹細胞は、通常、単一のサンプルに一緒にプールされた複数の筋肉組織から精製されます。しかし、最近の研究では、異なる筋肉から単離されたMuSCの分子プロファイルと静止深度に明確な違いがあることが明らかになりました。本プロトコルは、個々の骨格筋からのMuSCおよびFAPの単離および研究について説明し、幹細胞活性化の分子分析を実行するための戦略を提示します。横隔膜、上腕三頭筋、グラシリス、前脛骨筋(TA)、腓腹筋(GA)、ヒラメ筋、長指伸筋(EDL)、咬筋など、さまざまな発達起源、厚さ、機能の筋肉を分離して消化する方法について詳しく説明します。MuSCおよびFAPは、蛍光活性化セルソーティング(FACS)によって精製され、免疫蛍光染色および5-エチニル-2'-デオキシウリジン(EdU)取り込みアッセイによって分析されます。
概要
骨格筋は、筋幹細胞(MuSC)の存在により、再生能力が高い。MuSCは筋線維上、基底膜の下に位置し、長期にわたる可逆的な細胞周期出口1,2,3,4の静止状態で存在します。損傷を受けると、MuSCは活性化して細胞周期に入り、分化して融合して新しい筋線維を形成することができる増幅前駆細胞を生じさせます2,5。以前の研究では、MuSCが筋肉の再生に絶対に不可欠であることが示されています6,7,8。さらに、単一のMuSCは、新しい幹細胞と新しい筋線維の両方を生着させて生成することができます9。骨格筋はまた、線維脂肪原性前駆細胞(FAP)と呼ばれる間葉系間質細胞の集団を有しており、筋肉再生中のMuSC機能をサポートする上で重要な役割を果たします6,10,11,12。
筋肉の再生を調整する可能性があるため、MuSCとFAPがどのように機能するかを理解することに大きな関心が寄せられています。静止性MuSCは転写因子Pax7およびSprouty1の発現、ならびに細胞表面タンパク質カルシトニン受容体によって示され、静止性FAPは細胞表面タンパク質血小板由来成長因子受容体α(PDGFRa)によって示されます10,12,13,14,15。.以前の研究では、細胞表面マーカーと蛍光活性化セルソーティング(FACS)を使用して骨格筋からMuSCとFAPを精製できることが示されています9、15、16、17、18、19、20、21。これらのプロトコルはMuSCとFAPを研究する能力を大幅に向上させましたが、1つの欠点は、これらのプロトコルのほとんどがさまざまな筋肉組織のプールからMuSCを分離する必要があることです。私たちや他の人々からの最近の研究は、異なる組織から単離されたMuSC間の細胞表現型と遺伝子発現レベルの違いを明らかにしました22,23。横隔膜、上腕三頭筋、およびグラシリスからのMuSCは、下肢筋からのMuSCよりも速い活性化を示します22、一方、外眼筋からのMuSCは、横隔膜および下肢筋肉からのMuSCよりも速い分化を示します23。
このプロトコルでは、個々の骨格筋からのMuSCとFAPの分離について説明します(図1)。これには、横隔膜、上腕三頭筋、グラシリス、前脛骨筋(TA)、ヒラメ筋、長指伸筋(EDL)、腓腹筋(GA)、および咬筋の解剖が含まれます。解剖された筋肉は、続いてコラゲナーゼII(コラーゲンのPro-X-Gly-Proアミノ酸配列を特異的に標的とし、結合組織の分解と組織の解離を可能にするプロテアーゼ24)およびディスパーゼ(フィブロネクチンとコラーゲンIVを切断し、さらなる細胞解離を可能にするプロテアーゼ)を使用した酵素消化によって解離されます25).MuSCおよびFAPは、FACSによってシングルセル懸濁液から単離されます。細胞分析のためのダウンストリームアッセイの例として、幹細胞の活性化は5-エチニル-2'-デオキシウリジン(EdU)取り込みをアッセイすることによって決定され、細胞純度は細胞タイプ特異的マーカーPax7およびPDGFRaの免疫蛍光染色によって決定される。
プロトコル
本プロトコルは、オーフス大学の動物飼育ガイドラインおよび地域の倫理規則に従って実施されました。
注:動物実験および死後のげっ歯類サンプルの取り扱いに関する地元の倫理委員会の規則を必ず遵守してください。マウスはアレルゲンの潜在的な供給源です。可能な場合は、排気換気をオンにして、アレルゲンへの過度の暴露を避けるためにワークスペースの上に置きます。または、実験が定期的に行われる場合は、フェイスマスクを着用してください。このプロトコルは鋭利なものを扱うことを含み、研究者はカットの場合に応急処置を適用するための手順と物流に慣れることをお勧めします。
1.準備(1〜2時間、解剖前日)
注:溶液、プレート、および培地は、特に明記されていない限り、無菌条件下で調製され、使用前にろ過(0.45 μm)されます。ディスパーゼ(PBS溶液11 U/mL)およびコラゲナーゼII(PBS溶液1.000 U/mL)のストック溶液を調製し、-20°Cで保存します(表1)。ストックは解凍され、ステップ4.2.6で二次消化に使用されます。
- 96ウェルハーフエリアプレートのコラーゲンコーティング
- 酸性水を準備します。2 Lビーカーのオートクレーブ処理水895 mLに5.15 mLの氷酢酸を加えます。
- 0.45 μm、500 mLのフィルターユニットを使用して溶液をろ過します。ろ過した酸性水800 mLを1 Lボトルに移します。
- 40 mLの滅菌コラーゲンストック溶液をボトルに加えます。溶液を旋回させて穏やかに混合し、使用するまで光から保護された4°Cで保管します。
- 1つまたは複数の96ウェルハーフエリアプレートをコラーゲンでコーティングします。50 μLのコラーゲンコーティング溶液を各ウェルに加え、プレートを4°Cで一晩(ON)コーティングします。
- 翌日、真空ベースのアスピレーターを使用してコラーゲン溶液を吸引し、100 μLのオートクレーブ水を加えてプレートを2倍洗浄し、吸引します。
- プレートの蓋を傾け、プレートをフード内で20〜30分間乾燥させます。
- プレートが完全に乾いたら、アルミホイルで包み、使用するまで4°Cで保管してください。コーティングされたプレートは最大4週間保存できます。
注:コラーゲンコーティングは細胞接着を可能にします。遊離コラーゲンは細胞の機能とシグナル伝達(例えば、コラーゲンVのMuSC上のカルシトニン受容体への結合)を妨げる可能性があるため、洗い流すことが重要です26。
2.準備(0.5時間;解剖日):
- 追加のソリューションとワークスペースの準備
- 445 mLのHAMのF10培地に50 mLの馬血清と5 mLのペン/連鎖球菌を加えて、滅菌洗浄培地を調製します。汚染を防ぐために層流フードで作業してください。
- 解離バッファーの調製に必要なコラゲナーゼIIの適切な量を計算して計量します。(各マウスについて、26,000単位のコラゲナーゼIIを使用して、650 U/mLのコラゲナーゼIIで40 mLの解離バッファーを作製します)。計量した粉末を50 mLのコニカルチューブに加え、氷上に保管します。
- 筋肉を隔離するために2つの10 cm皿を準備します。3 mLの洗浄媒体(表1)を各ペトリ皿に注ぎます。後で使用するために、10cmの皿を層流フードの外に持ってきます。
- 筋肉消化のための材料を準備します。サンプル数に基づいて、適切な数の50 mLコニカルチューブ(マウスあたり8本、筋肉ごとに1本)にラベルを付け、ベンチに置いておきます。針、10 mLシリンジ、および40 μmセルストレーナーに70%エタノール(マウスごとに8つ、筋肉ごとに1つ)をスプレーし、層流フード内に持ち込みます。注射器に針を取り付けます。
- 仕分け用の材料を準備します。サンプル数に基づいて、セルストレーナーキャップで5 mL丸底チューブにラベルを付けます。チューブをアルミホイルで覆い、層流フードに入れたままにします。
- 選別するサンプルと集団の数に対応して、細胞収集用の洗浄培地500 μL(マウスあたり16本、筋肉組織あたり細胞集団ごとに1本)を入れた1.5 mLマイクロ遠心チューブを準備します。これらのチューブを氷上に保管してください。
3.筋肉解剖(20〜30分)
注意: プロトコルのこのセクションは、非滅菌環境で実行されます。この手順は、1匹または数匹のマウスを用いて実施することができる。ただし、ソーティング用のサンプルと、補正およびFACSゲートを設定するためのコントロールの両方を準備するには、1匹のマウスで十分です。
- 筋肉の隔離を開始する
- 解剖と筋肉の分離のために非滅菌ワークスペースを準備します。ワークステーションを70%エタノールで消毒します。滅菌保護用の使い捨てアンダーパッドをワークステーションに置きます。
- パーマネントマーカーを使用して、ペトリ皿の蓋の上に各筋肉のボックスを描き、後で孤立した筋肉を配置します。
- 手術器具に70%エタノールをスプレーします。
- CO2 吸入および/または頸部脱臼によってマウスを安楽死させる。
- 個々の筋肉を分離します(複数のマウスを使用する場合は、一度に1匹のマウスから)。マウスに70%エタノールをスプレーして毛皮を濡らし、皮膚を消毒します。腹部を上に向けてアンダーパッドにマウスを置きます。8つの筋肉すべてとそれぞれの解剖学的位置の概要を 図2Aに示します。
- グラシリスの筋肉を隔離する
- はさみを使用して、腹部の皮膚を0.5 cm水平に切開します。
- 皮膚を取り除く:両手を使用して、親指と人差し指を使用して、切開の上部と下部をつかみます。切開の両側を引っ張って、胴体と下肢の皮膚を引き裂いて分けます。下肢の皮膚を引き下げて、両方の後肢(腰からつま先まで下向き)を露出させます。同様に、上に引き上げて胴体を露出させます。
- グラシリスの筋肉(太ももの内側)を見つけます。湾曲した鉗子を使用して、グラシリスをつかみ、筋肉をわずかに持ち上げます(図2B)。はさみで0.5 cmの切開を行い(図2C)、そこからグラシリスを切り取り、完全に隔離します(図2D)。もう一方の脚についてもこれを繰り返して、2番目のグラシリス筋肉を分離します。
- TAとEDLの筋肉を分離する(下後肢、腹側)
- メスを使用して、脛骨の外側(最も厚い下肢骨)に沿って0.5 cmの切開を行うことにより、筋膜を切断します。湾曲した鉗子を使用して筋膜をつかみ、引っ張って取り除きます。
注意: 筋膜が完全に除去されると、後脚の遠位端の腱が見え、分離することができます。 - TAの遠位腱(脛骨の外側)とEDL(TAの下)の間に入るために、超微細な先端を持つまっすぐな鉗子を使用します(図2E-G)。
注意: 経験上、まっすぐな鉗子の代わりにメスの刃の鈍い端を使用できます。 - 鉗子を筋肉の近位端に向かってスライドさせて、筋肉を分離します。
- まっすぐな鉗子を遠位端に戻します。遠位腱を切断します。
- 湾曲した鉗子で筋肉の遠位腱をそっとつかみます。筋肉を近位の付着部の上に持ち上げ、近位腱をできるだけ付着点に近づけて慎重に切断します。もう一方の端を切り取り、TAをペトリ皿に移します。
- 超微細な先端を備えたまっすぐな鉗子を使用して、EDLの遠位腱の下に行きます。
- 鉗子を筋肉の近位端に向かってスライドさせて、筋肉を分離します。
- まっすぐな鉗子を遠位端に戻します。筋肉を傷つけずに遠位腱を切る。
- 湾曲した鉗子でEDLの遠位腱をそっとつかみます。筋肉を近位の付着部の上に持ち上げ、近位腱をできるだけ付着点に近づけて慎重に切断します。もう一方の端を切り取り、EDLをペトリ皿に移します。もう一方の後肢についても繰り返して、2番目のTAとEDLの筋肉を分離します。
- メスを使用して、脛骨の外側(最も厚い下肢骨)に沿って0.5 cmの切開を行うことにより、筋膜を切断します。湾曲した鉗子を使用して筋膜をつかみ、引っ張って取り除きます。
- GAとヒラメ筋(下後肢、背側)を分離する
- 先端が極細のまっすぐな鉗子を使用して、アキレス腱と下後肢の骨の間に入ります。
- 鉗子を筋肉の近位端に向かってスライドさせて、筋肉を分離します。
- まっすぐな鉗子を遠位端に戻します。遠位腱を切断します。
注:GAの下にあるヒラメ筋の損傷を避けるために、遠位アキレス腱の付着部にできるだけ近づけて切断し、腱の塊をGAに付着させたままにします(図2H)。 - ヒラメ筋を明らかにして分離するには、GAを腓骨(下後肢の2つの骨の中で最も薄い骨)の上に引き上げます。
注:ヒラメ筋は、GAに対する特徴的な濃い赤色によって区別されます(図2I)。 - 近位ヒラメ筋腱を見つけます。まっすぐな鉗子で、ヒラメ筋とGAの間に入ります。
- 鉗子を筋肉の遠位端に向かって動かして、ヒラメ筋をGAから分離します。
- 最初にヒラメ筋を隔離します。近位腱を切断し、湾曲した鉗子で腱をつかみ、ヒラメ筋を慎重に持ち上げて遠位腱にアクセスします。遠位腱を切断して、ヒラメ筋をGAから分離します。 ヒラメ筋を洗浄媒体でペトリ皿に入れます(図2J)。
- GAを切り取り、ペトリ皿に入れます。もう一方の脚についてもこれを繰り返して、2番目のヒラメ筋とGA筋肉を分離します。
- 上腕三頭筋(上前肢、背側)を隔離する
- 上腕三頭筋と上腕骨(上腕前脚の主骨)の間に入るために、超微細な先端を備えたまっすぐな鉗子を使用します(図2K-M)。
- 鉗子を筋肉の近位端に向かってスライドさせて、筋肉を分離します。筋肉の近位端を切断します。
- 湾曲した鉗子で上腕三頭筋の近位端をつかみ、それを肘の上に引き上げて遠位腱にアクセスします。上腕三頭筋の遠位腱を切断し、筋肉をペトリ皿に移し、もう一方の前肢に対して手順を繰り返します。
- 咬筋を分離する
- 顎から毛皮と皮膚を取り除きます。ハサミで0.5 cmの水平切開を行います。両手を使用して、親指と人差し指を使用して切開の両側をつまみます。上下に引っ張って皮膚を取り除きます。
- 咬筋の主要な腱(尾、目の下)を見つけます。平らなメスの刃を骨と筋肉の間に挿入します(図2N)。腱を切ります。
- 湾曲した鉗子で主要な咬筋腱をつかみます。メスの刃またははさみで吻側に切り、咬筋を顎の骨から分離します(図2O、P)。分離した咬筋をペトリ皿に入れます。2番目の咬筋に対して手順を繰り返します。
- 横隔膜筋を隔離する
注意: 横隔膜の筋肉を隔離するときは、汚染源であるため、内臓や腸に切り込まないように慎重に切断してください。- ハサミを使用して、胸骨の中央(肋骨をつなぐ胸の中央に位置する長い平らな骨)に開胸術(肋骨の間の切り込み)を行い、胸骨を切り裂きます(図2Q)。
- 胸郭を通して360°切断して横隔膜を露出させます。
- 上半身を下半身/腹部から分離します。はさみを使用して、気管、食道、大静脈、腹部大動脈を切ります。
- 横隔膜を下半身から分離します。ハサミを使用して、胸骨の1 cm下に開腹術(腹腔内を外科的に切開)を行い、360°カットします(図2R)。
- 閉じたはさみを胸郭と腹部臓器の間に置き、押し下げます。胸郭をそっと引っ張って腹部臓器から分離します(図2S)。
- ダイヤフラムを胸郭から分離します。横隔膜を2本の指でゆるく持ち、ハサミで胸郭を切ります。はさみを使用して、360°カットでダイヤフラムをリブのできるだけ近くでカットします。分離されたダイヤフラムをペトリ皿に入れます。
注意: 頸部脱臼中に、横隔膜が破裂して胸郭に押しつぶされ、位置を特定するのが困難になる場合があります。筋肉はまだ分離することができます。崩壊した筋肉を特定し、2本の指で挟み、胸郭に沿って360°切断します。
4. 単一細胞懸濁液への筋肉消化(~1時間35分)
注意: 次の手順には、非滅菌(ステップ4.1〜4.2)および滅菌作業環境(ステップ4.3)が含まれます。
- 機械的消化
- 隔離した筋肉を10 cmのペトリ皿の蓋に入れます。
- 湾曲した鉗子を使用して、孤立した筋肉を1つずつつかみます。ヒラメ筋とGAの場合は、アキレス腱の残りの部分を取り外します。
- はさみを使用して、孤立した筋肉を約1 mm3 個に切って1つずつ細かく刻みます。
- 酵素消化
- 秤量したコラゲナーゼII粉末に40 mLの冷洗浄培地を加えて、筋肉解離バッファーを調製します(コラゲナーゼII:洗浄培地中の650 U/mL)。
注:最適な酵素活性を確保するために、新たに調製した筋肉解離バッファーを使用してください。 - ミンチ筋肉を、5 mLの解離バッファーを含む15 mLのコニカルチューブに移します。
- チューブを60rpmの37°Cの振とう水浴中で35分間インキュベートします。
- インキュベーション後、洗浄媒体を総容量15 mLまで加えます。チューブを1,600 x g で4°Cで5分間回転させます。
- 真空ベースの吸引器を使用して上清を4mLの容量まで吸引します。ペレットを乱さないように、上からゆっくりと吸引し、浮遊脂肪を取り除きます。
- ディスパーゼとコラゲナーゼIIのストックアリコートを解凍します。残りの4 mLサンプルに500 μLのコラゲナーゼII溶液(1,000 U/mLストック、-20°C)を加えます。次に、ディスパーゼ溶液500 μL(11 U/mLストック、-20°C)を加えます。
注意: ディスパーゼは沈殿物を生成する可能性があります。このような場合は、使用の1分前にディスパーゼ原液を10,000 x gで回転させてください。透明になった上清をペレットを乱すことなく細胞懸濁液に移す。 - サンプルを短時間ボルテックスしてペレットを溶解します。
- サンプルを60rpmの37°Cの振とう水浴中で20分間インキュベートします。
注:大量の筋肉サンプルを消化するには時間がかかります。ステップ4.3.1〜4.3.6では、サンプルあたり2〜5分かかると推定します。このステップは、2人以上の研究者が並行して実行すると速くなります。
- 秤量したコラゲナーゼII粉末に40 mLの冷洗浄培地を加えて、筋肉解離バッファーを調製します(コラゲナーゼII:洗浄培地中の650 U/mL)。
- サンプルの均質化
- 細胞懸濁液を均質化する。懸濁液を15 mLチューブから50 mLチューブに移します。20G針付きの10 mLシリンジを使用して、サンプルを針を通して上下に5回引き上げてサンプルを再懸濁します。
注意: 未消化の筋肉片が針を詰まらせた場合は、ティッシュペーパーで拭き取ってください。 - 40 μmのセルストレーナーを新しい50 mLコニカルチューブに置きます。
- シリンジに全細胞懸濁液を取り込み、セルストレーナーを上にした新しい50 mLコニカルチューブにサンプルを濾します。フィルターに直接全量を分注して、サンプルを濾します。
- すべての単核細胞を回収するには、20 mLの洗浄培地を空のコニカルチューブに加え、これをセルストレーナーを通して、ひずみサンプルを含む50 mLのコニカルチューブに注ぎます。セルストレーナーの下の残りの容量をp1000ピペットで取り出します。
- セルストレーナーを廃棄し、サンプルを1,600 x g で4°Cで5分間回転させます。
- p1000ピペットでピペッティングすることにより、ペレットを乱すことなく上清を吸引する。
- p1000ピペットでピペッティングすることにより、ダイアフラムペレットを500 μLの洗浄培地に再懸濁し、他の筋肉サンプルをそれぞれ300 μLの洗浄培地に再懸濁します。
注:横隔膜は、幹細胞含有量が最も高い筋肉の中で最大のものであるため、コントロール染色に使用できます。
- 細胞懸濁液を均質化する。懸濁液を15 mLチューブから50 mLチューブに移します。20G針付きの10 mLシリンジを使用して、サンプルを針を通して上下に5回引き上げてサンプルを再懸濁します。
5. 染色とソーティング(~40分 + 30分のソーティング/サンプル)
注意: 次の手順では、氷上で無菌環境で作業してください。
- 50 μLのダイアフラム細胞懸濁液を、対照染色用の4つの新しい2 mLマイクロ遠心チューブ(各50 μL)に移します。250 μLの洗浄媒体を各コントロールチューブに添加し、最終容量300 μLにします。
- 3 μL(1:100)の蛍光マイナス1抗体(FMOコントロール)を3本の対照染色チューブに加え、抗体を含まない1本のチューブ(無染色対照)を残します( 表2を参照)。
- 残りの横隔膜サンプルを含む残りの筋肉単一細胞懸濁液に3 μL(1:100)の抗体(VCAM1-PECy7、CD45-FITC、CD31-FITC、およびSCA1-PacificBlue)を追加します。
- 細胞懸濁液をヘッドオーバーヘッドシェーカーで4°Cで15分間インキュベートします。
注:コントロール染色は、バックグラウンド蛍光レベルを決定し、フローサイトメトリーのゲートを設定するために必要です。異なる抗体を使用できますが、それぞれに特定の作業濃度とインキュベーション時間があり、テストする必要があります。異なるベンダーの抗体を使用する場合、濃度、したがって希釈率は異なる場合があります。細胞生存率色素を染色混合物に添加して、選別中に死細胞または死にかけている細胞を除去することができます。 - サンプルを1,600 x g で4°Cで5分間スピンします。 ピペッティングによりペレットを乱すことなく上清を廃棄する。
- p1000ピペットでピペッティングすることにより、各サンプルを800 μLの洗浄媒体に再懸濁します。
- セルストレーナーキャップ(40 μm)付きのFACSチューブを使用してサンプルをろ過し、残っている細胞凝集塊(または凝集体)を取り除きます。
- セルストレーナーに800 μLの洗浄培地を追加して洗浄します。
- 分析するまで、サンプルを氷上でアルミホイルで覆ってください。
注:この時点で、細胞の濃度が高いために細胞懸濁液が濁っている/濃いように見える場合は、細胞密度を下げるためにさらに800 μLの洗浄培地を追加します。 - 70 μmのノズルでFACSを起動します。
- 染色されていないコントロールと FMO コントロールを使用して、ゲーティング戦略を設定します: MuSC は CD45-FITC、CD31-FITC、および SCA1-PacBlue に対して陰性であり、VCAM1-PECy7 に対して陽性です。FAPは、CD45-FITC、CD31-FITC、VCAM1-PECy7に対して陰性であり、SCA1-PacBlueに対して陽性である。
- 染色されたシングルセル懸濁液を双方向ソーティングで選別し、MuSCとFAPを500 μLの洗浄培地を含む別々の回収チューブに回収します。
注:4つのレーザー(構成:70 μmノズル、405 nm、488 nm、561 nm、633 nm)を備えたFACSを使用すると、蛍光色素の組み合わせを選択しても蛍光シグナルの補正は必要ありません。ただし、異なるフローサイトメーターまたは異なる組み合わせの蛍光色素を使用する場合は、補正のために追加の単一染色コントロールサンプルを使用することをお勧めします。より小さな筋肉(EDL、ヒラメ筋、TA)から、3,000のMuSCと5,000のFAPの収量が期待されます。他のより大きな筋肉については、20,000のMuSCとFAPの収量が期待されます。FACSソフトウェアによってリストされたイベントカウントは、収集チューブ内の実際の生細胞数から逸脱する可能性があります。細胞数は、血球計算盤を用いた細胞計数により確認することができる。 - 選別したセルを1,600 x g で4°Cで5分間スピンダウンします。 ピペッティングにより、細胞ペレットを乱すことなく上清を吸引する。
- 各サンプルに100 μLの洗浄培地を加え、気泡を発生させずに細胞を注意深く再懸濁します。再懸濁したサンプル100 μLをコラーゲンコーティングされたハーフエリア96ウェルプレートに移します。ウェルあたり1,000〜3,000セルをプレートします。
注:細胞が適切に再懸濁されていない場合、細胞が凝集塊でくっつき、後の顕微鏡分析を混乱させる可能性があります。 - 顕微鏡下で細胞を検査し、それらの分布、形状、およびサイズをメモします。
- プレートを37°C、5%CO2でインキュベートする。細胞は2時間以内に接着します。
注:フローサイトメトリー分析(選別されたサンプルのアリコートをソーターにロードし、少数のイベントを記録する)または播種細胞の抗体染色とそれに続く顕微鏡検査(Pax7はマウスMuSCの定義マーカー、PDGFRaはマウスFAPの定義マーカー)のいずれかによって、収集された細胞集団の純度を確認することをお勧めします。以下のセクション7から始まるのは、Pax7およびPDGFRaタンパク質レベルの細胞を染色するためのプロトコルです。
6.EdU組み込みアッセイ
注意: 無菌条件下で作業し、パラホルムアルデヒド(PFA)を取り扱うときは化学ヒュームフードを使用してください。EdUは、細胞が細胞周期のS期を通過するときにDNAに組み込まれるヌクレオチド類似体です。高濃度で変異原性です。EdUを取り扱うときは、常に手袋を着用してください。EdU廃棄物の取り扱いに関する地域のガイドラインを確認してください。
- EdUパルス(1日目)
- 新鮮な洗浄媒体で2x EdUの作業溶液を調製します。
- 細胞の入った96ウェルプレートをインキュベーターから取り出します。顕微鏡下で細胞を検査して、コンフルエントを監視します。層流フードに移動します。
- ピペッティングによりプレートから50 μLの培地を除去します。ウェル内の最終容量が100 μLになるように、50 μLの2x EdU作業溶液を追加します。
- 細胞をEdUの存在下で、37°C、5%CO2で意図した期間培養する。
注意: EdUパルスのタイミングと持続時間は異なる場合があります。静止したMuSCは、最初の細胞分裂を完全に活性化して完了するまでに平均2日かかります19。EdUは、めっき直後に選別されたセルに添加することができる。
- 固定(2日目)
注:PFAは発がん性物質です。PFAの取り扱いには必ず注意してください。PFAの取り扱いと廃棄物の処分に関する地域の規制に精通してください。- 細胞の入った96ウェルプレートをインキュベーターから取り出します。顕微鏡下で細胞を検査し、プレートをドラフトに移動します。
- ピペッティングにより培地を取り出し、各ウェルに50 μLの4%PFAを加えて細胞を固定します。プレートを化学ヒュームフード内で室温(RT)で10分間インキュベートします。
- ピペットでPFAを取り出し、適切な廃棄物容器に廃棄します。
- すべてのウェルに100 μLのPBSを加えて細胞を洗浄します。ピペッティングにより、PBSを吸引し、洗浄を繰り返します。細胞を100 μLのPBSに保持します。
注意: 細胞が洗い流されないように、ゆっくりとピペッティングしてPBSをウェルの横に分注します。
- EdU ラベリング
- EdU検出前にPBSを除去し、PBS中の0.5%Triton X-100を100 μL添加して細胞を透過処理します。プレートを4°Cで5分間インキュベートします。
注意: Triton X-100は界面活性剤であり、皮膚の炎症を引き起こす可能性があります。取り扱いには注意し、常に手袋を使用してください。 - 5分後、トリトンX-100を吸引し、100μLのPBSを加えます。
- メーカーのプロトコルに従って、EdUクリックケミストリー反応ミックスを準備します。
- PBSを吸引し、33 μLのEdUクリックケミストリー反応混合物を加えます。プレートをRTで30分間インキュベートします。
- EdUクリックケミストリー反応混合物を吸引し、100 μLのPBSで細胞を洗浄します。
- PBSを吸引し、100 μLのPBSをヘキスト(1:2,000)で加え、光から保護された状態でRTで10分間インキュベートします。
- ヘキストを吸引し、100 μLのPBSを加えて2回洗浄します。細胞を100 μLのPBSに4°C、暗所で保存します。
- 倒立顕微鏡で細胞を画像化します。細胞は、ウェルが乾燥しない限り、数ヶ月間暗所に保管することができます。
注:細胞を抗体と共染色することが可能です。この場合、ブロッキングステップに進み、続いて一次抗体とのインキュベーションを行います。EdUの検出に使用した蛍光色素の発光スペクトルと発光スペクトルが重複しない標識蛍光色素を有する二次抗体を選択します。ヘキストのスペクトル範囲と重複する蛍光色素を持つ二次抗体は使用しないでください。
- EdU検出前にPBSを除去し、PBS中の0.5%Triton X-100を100 μL添加して細胞を透過処理します。プレートを4°Cで5分間インキュベートします。
7. 免疫蛍光染色
注: プロトコルのこの部分は、セクション 6 とは独立して実行できます。セクション6をスキップする場合は、以下の手順7.2に進む前に、手順6.3.1および6.3.2を実行して細胞透過処理を有効にしてください。
- EdU標識細胞を含むプレートを取り出す。
- 18 mLのPBSに2 mLのロバ血清を加えて、20 mLのブロッキングバッファーを調製します。
- 非特異的抗体の結合を防ぐために、各ウェルから100 μLのPBSを除去し、p200ピペットで50 μLのブロッキングバッファーを追加します。プレートをRTで30分間インキュベートし、光から保護し、蛍光色素標識EdUの光退色を防ぐためにアルミホイルで覆います。
注意: セルはウェルの底に固定されていますが、ピペッティング時に力がかかりすぎると剥離する可能性があります。 - サンプルをブロッキングしながら、一次抗体ミックスを調製します。8.0 μL(1:100)のマウス抗Pax7およびウサギ抗PDGFRaを800 μLのブロッキングバッファーに加え、16ウェル(8つの組織、2つの細胞タイプ)を染色します。
- ブロッキング後、ロバ血清を除去し、50 μLの一次抗体ミックスを各ウェルに加えます。プレートを4°Cで一晩インキュベートし、アルミホイルで覆います。
- インキュベーション後、一次抗体を除去し、50 μLのトリトン(PBS溶液0.5%)を各ウェルに加えます。光から保護されたRTでプレートを5分間インキュベートし、結合していない抗体を洗い流します。洗浄を3回繰り返します。
- 1,000 μLのブロッキングバッファーが入ったマイクロ遠心チューブに1.0 μL(1:1,000)のロバ抗マウス-Alexa647とロバ抗ウサギ-Alexa555を加えて、二次抗体マスターミックスを調製します。
- 33 μLの二次抗体マスターミックスを各ウェルに加えます。光から保護されたRTでプレートを60分間インキュベートします。
- ピペッティングで余分な二次抗体を除去し、50 μLのトリトン(PBS溶液0.1%)を加え、光から保護されたRTで5分間インキュベートします。洗浄を3回繰り返します。
- 最後に、PBSを100 μL加えます。冷却CCDカメラを備えた倒立蛍光顕微鏡を使用してプレートをすぐにイメージングするか、プレートの端をパラフィルムで密封し、密封されたプレートをアルミホイルで包んで、後で分析するまでプレートを4°Cで保存するかを決定します。
結果
個々の骨格筋の分離に関するプロトコル(図2)に従って、地元の繁殖プログラムから中止された3匹のスイスのオスの近交系マウスから、グラシリス、TA、EDL、GA、ヒラメ筋、上腕三頭筋、マッサージ師、および横隔膜筋を分離しました(図2)。組織解離および抗体染色に続いて、個々の筋肉由来のMuSCおよびFAPをFACSによって精製した(図3)。最初のゲーティングは、細胞を同定し、一重項をダブレットから分離するために、染色されていないサンプルで得られました(図3A)。その後のゲートは、染色閾値を特定するためにFMOコントロールを使用して設定されました(図3B)。次いで、染色したサンプルをCD31/CD45-FITCおよびSca1-PacBlueについてゲーティングした。SCA1+/CD31-/CD45-集団(FAPs)は別の収集チューブに分類され、二重陰性集団はVCAM1-PECy7および前方散乱(FSC)についてゲートおよびプロットされた。VCAM1+集団(MuSC)は、別の収集チューブに分類されました。MuSCおよびFAPは、シングレットの割合として定量され(表3)、500 μLの洗浄媒体を含む別々の収集チューブに分類されました。横隔膜および上腕三頭筋の単一細胞懸濁液は、FAPよりもMuSCの相対存在量が高く、他の単一細胞懸濁液は、MuSCよりもFAPの相対存在量が高い(表3)。
選別された細胞のうち、1,000〜3,000個の細胞を播種し、24時間インキュベートした。24時間のインキュベーション後、培地を除去し、EdUを含む新しい培地と交換した。細胞を48時間で固定し、EdUについて染色し、続いてPax7タンパク質またはPDGFRaタンパク質に対する抗体で染色し、倒立落射蛍光顕微鏡を用いて画像化した。画像は、ImageJのフィジープラグインを使用して定量化されました。堅牢なEdU染色が観察されましたが、EdU陽性細胞の割合は2つの幹細胞タイプと異なる筋肉で異なっていました(図4A-C)。EDLまたはGAのいずれかから単離されたMuSCは、TA、横隔膜、グラシリス、または上腕三頭筋のいずれかから分離されたMuSCと比較して、EdUの取り込みが有意に低いことを示しましたが、咬筋とヒラメ筋から分離されたMuSCは、どちらのグループとも有意差はありません(図4A、B)。これは、以前の結果と一致しています22。さらに、MuSCが高いEdU取り込みレベルを示す組織は、MuSCが以前に高レベルのPax3タンパク質22を発現することが示された組織と同じである。EDLから分離されたFAPは、GAおよびヒラメ筋から分離されたFAPと比較して有意に低いEdU取り込みを示したが、TAから分離されたFAPは、ヒラメ筋から分離されたFAPと比較して有意に低いEdU取り込みを示した(図4A、C)。これは、分離のために異なる組織の筋肉をプールするのではなく、個々の組織からの幹細胞を分析することの重要性を強調しています。すべての組織について、EdU陽性MuSCの平均割合はEdU陽性FAPの平均割合と比較して高く、MuSCは与えられた条件下でより速く活性化することを示唆しています。
最後に、細胞純度を免疫蛍光染色で確認した(図4D)。平均して、MuSCの97.71%(±1.38%)がPax7タンパク質に陽性に染色され、FAPの88.16%(±6.35%)がPDGFRaタンパク質に陽性に染色され、幹細胞分離手順の特異性が確認されました(図4D)。

図1:プロトコルの概略図。 プロトコルの2つの主要なセグメント、MuSC分離(上のパネル)、静止アッセイ(下のパネル)、およびそれらのそれぞれで使用される方法論の主要なステップを示す概略図。 この図の拡大版を表示するには、ここをクリックしてください。
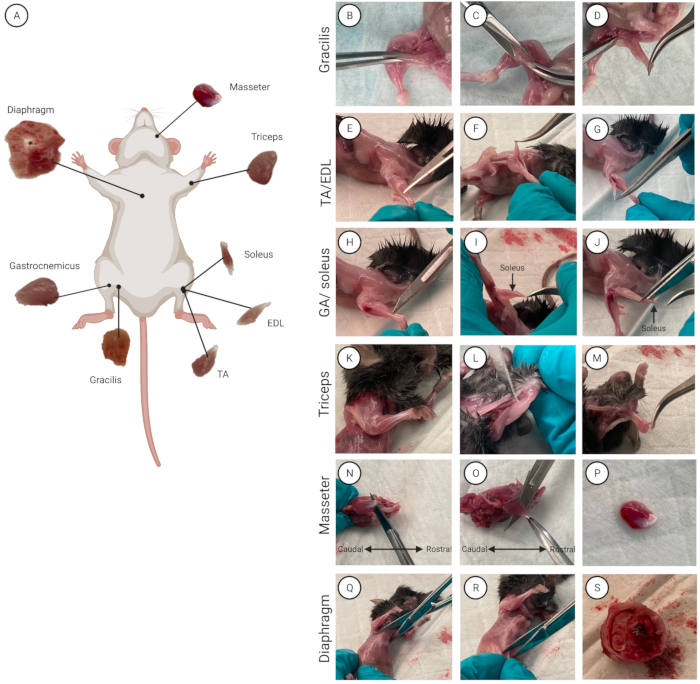
図2:筋肉の位置と分離。 (A)各筋肉の位置を示すスキーム。(ビーエス)(B-D)グラシリス、(E-G)TA / EDL、(H-J)上腕三頭筋、(K-M)GA /ヒラメ筋、(N-P)マッサージ師、および(Q-S)横隔膜筋の筋肉分離のデモンストレーション。この図の拡大版を表示するには、ここをクリックしてください。
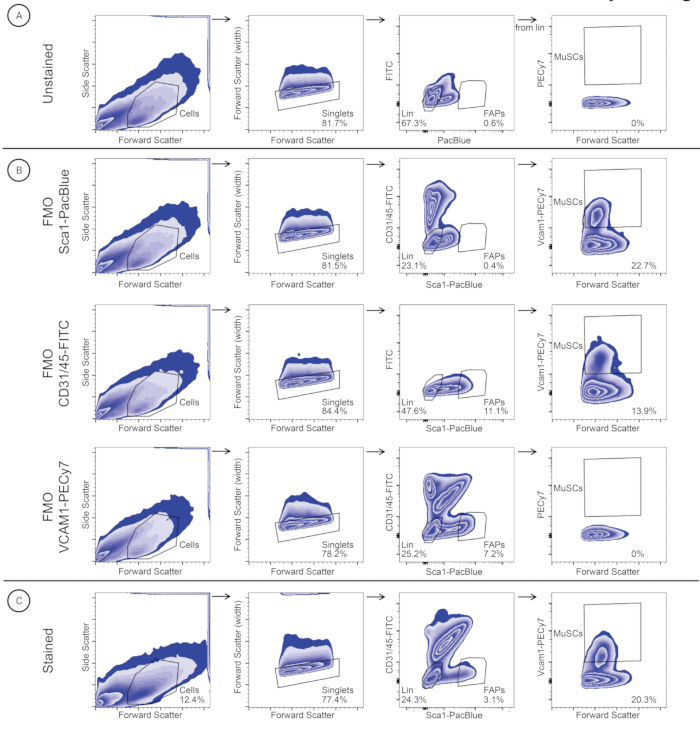
図3:横隔膜筋サンプル中のMuSCとFAPを識別して分類するために使用されるゲーティング戦略。セルは、セル サイズ (前方散乱 (FSC)) と粒度 (側方散乱 (SSC)) に基づいて識別されます。シングレットは、FSC-AおよびFSC-Wに基づいて選択されます。系統細胞はMuSC(系統-/VCAM1+)のその後の同定のためにゲーティングされ、FAP(系統-/SCA1+)細胞はFAPを同定するためにゲーティングされます。同じゲーティング戦略を、(A)非染色コントロール、(B)FMOコントロール(FMO-SCA1PacBlue、FMO-CD31/45-FITC、およびFMO-VCAM1-PECy7)、および(C)染色サンプルに適用しました。この図の拡大版を表示するには、ここをクリックしてください。

図4:EdU染色による細胞活性化の定量。 (A)ダイアフラムサンプルからのMuSC(トップパネル)およびFAP(ボトムパネル)のEdU染色の代表的な画像。EdUとHoechstのマージされた画像(左パネル)と、緑(EdU、中央パネル)と青(Hoechst、右パネル)の単一チャネルが示されています。(B,C)示された筋肉に対するEdU陽性の(B)MuSCまたは(C)FAPの割合を示す棒グラフ。プロットはSEM±平均値です。各ドットはマウスを表します。統計分析は、両側スチューデントのt検定を使用してGraphPadで実行され、有意性は*p < 0.05、**p < 0.01に設定されました。(D)MuSCマーカーPax7(左側)およびFAPマーカーPDGFRa(右側)に対する抗体によるMuSC(上パネル)およびFAP(下パネル)の免疫蛍光染色。Pax7とヘキストのマージされた画像、それに続く単一チャネル、PDGFRaとヘキストのマージ画像、および単一チャネルが示されています。N = 3。この図の拡大版を表示するには、ここをクリックしてください。
| ソリューション | 試薬 | 量 |
| 洗浄媒体 | F-10 栄養混合物(ハム) (1x), +L-グルタミン | 445ミリリットル |
| 馬血清 | 50ミリリットル | |
| ペン/連鎖球菌 | 5ミリリットル | |
| 解離バッファー(1回目の消化) | コラゲナーゼII型 | 650 U/mL |
| 洗浄媒体 | 100ミリリットル | |
| ディスパーゼストック(2回目の消化) | PBSでのディスパーゼ | 11 U/mL |
| コラゲナーゼストック(2回目の消化) | PBS中のコラゲナーゼII型 | 1000 U/mL |
| PBS 1x | PBS 10x 粉末濃縮物 | 9.89 グラム/リットル |
| オートクレーブ/滅菌水 | 1リットル | |
| 酸性水 | 分析用無水氷酢酸(100%) | 5.15ミリリットル |
| オートクレーブ/滅菌水 | 895ミリリットル | |
| コラーゲン溶液 (0.002%) | 子牛の皮からのコラーゲン | 20ミリリットル |
| 酸性水 | 800ミリリットル | |
| トリトンX-100 | トリトンX-100 | 0.5% (v/v) |
| PBS 1x | 99.5% | |
| ブロッキングバッファ | PBS 1x | 18ミリリットル |
| ロバ血清 | 2ミリリットル |
表1:レシピの表。
| サンプル番号 | 名前 |
| 1 | 染色なし |
| 2 | 蛍光マイナスVCAM1-PeCy7 |
| 3 | 蛍光マイナスSCA1-パシフィックブルー |
| 4 | 蛍光マイナスCD31/45-FITCの |
| 5 | 実験用染色剤(4抗体すべて) |
表2:染色、対照、および選別前に各組織について調製したサンプルの概要。
| 組織 | 抗体ミックス | 細胞 | シングレット | リン・ネグ | ファップ | ムスク |
| 隔膜 | 染色されていない | 100% | 82% | 55% | 0.5% | 0.0% |
| FMO スカ1-パックブルー | 100% | 83% | 19% | 0.3% | 4.3% | |
| FMO CD31/45-488 | 100% | 84% | 40% | 9.4% | 5.6% | |
| FMO Vcam1-PeCy7 | 100% | 78% | 20% | 5.6% | 0.0% | |
| ステンド | 100% | 77% | 19% | 2.4% | 3.8% | |
| グラシリス | ステンド | 100% | 96% | 11% | 2.6% | 1.4% |
| ティッカー | ステンド | 100% | 88% | 16% | 2.8% | 2.2% |
| ティッカー | ステンド | 100% | 86% | 26% | 19.2% | 0.8% |
| ヒラメ | ステンド | 100% | 91% | 41% | 13.3% | 1.1% |
| ジョージア 州 | ステンド | 100% | 94% | 51% | 6.1% | 1.5% |
| 三頭筋 | ステンド | 100% | 92% | 30% | 2.6% | 4.5% |
| 咬筋 | ステンド | 100% | 85% | 27% | 19.3% | 2.6% |
表3:FACSデータにおける相対的な細胞型の存在量の概要。
ディスカッション
良好な歩留まりを達成するために、このプロトコルの実行にはいくつかのステップが重要です。個々の筋肉は、バルク分離プロトコルで使用される筋肉の量と比較して小さな体積を有する。これにより、解剖中に筋肉が乾燥するリスクがあり、収量が低下します。これを防ぐためには、解剖直後に筋肉に培地を加えることが重要です。さらに、解剖に時間がかかる場合は、筋肉が空気にさらされる時間を短縮するために、一度に片方の手足から皮膚を取り除くことができます。容量が小さいと、過剰消化のリスクも高まります。これに対抗するために、本方法は、バルク筋肉プロトコルと比較して、より少ない量のコラゲナーゼII酵素および短縮された消化時間を必要とする9,16。酵素消化は酵素の純度にも依存し、純度が低いと収量に悪影響を与える可能性があります。さらに、機械的消化が重要です。切断が不十分な場合、表面積の減少は酵素消化を妨げ、幹細胞の収量を低下させます。切断しすぎると、表面積が増えると過剰消化が発生し、幹細胞の収量が低下します。振とう水浴は、消化された筋肉の沈殿を防ぎ、酵素の分布を改善し、均一な温度を作り出すのを助け、全体としてインキュベーション時間を短縮します。したがって、本方法は、他の方法と比較してインキュベーション時間の大幅な短縮を可能にする。
このプロトコルは、細胞の解離と精製に依存します。これらの手順は、幹細胞を活性化する組織損傷を模倣しています。一貫して、最近の研究では、MuSCが単離手順中に遺伝子発現プログラムを変更することが明らかになっています27、28、29、30。その結果、精製された幹細胞は、遺伝子発現パターンの点で生体内の細胞とは異なる。プロトコルの2番目の制限要因は、高価な機器へのアクセスを必要とするFACSへの依存です。FACSは、複数の細胞集団を高純度20で同時に単離するためのゴールドスタンダードです。磁気ビーズとマイクロバブルを使用した最近の進歩は、コスト31,32の削減を提供しますが、それらが単一の筋肉で作業するのに匹敵する収量を提供するかどうかを判断する必要があります。最後に、筋肉のサイズが小さいため、プロトコルの収量が制限され、潜在的なダウンストリームアッセイに制限が生じます。
以前の研究では、細胞収量を最大化するためにMuSCおよび/またはFAPを単離する際に異なる筋肉をプールすることに依存していました。ただし、これは、異なる筋肉間の幹細胞の挙動と機能の組織固有の違いを平均化します。現在のプロトコルでは、幹細胞機能の下流分析のために、個々の筋肉からMuSCおよびFAPを分離することができます。下流アッセイの例として、幹細胞活性化をEdU取り込みによってアッセイし、異なる組織からの幹細胞が異なる活性化動態を示すことを明らかにした。以前の研究では、他のダウンストリームアッセイを使用することの実現可能性が示されています。これらのアッセイでは、SmartSeq2シングルセルRNAシーケンシング、細胞移植、マイクロ流体PCR、クローン増殖アッセイなど、より少ない細胞数が必要です22、33、34、35。
結論として、このプロトコルは、MuSCおよびFAPを分離および研究するための個々の筋肉の解剖方法について説明しています。この戦略により、実験は健康と病気のさまざまな筋肉にわたる幹細胞機能をよりよく理解することができます。
開示事項
著者には、競合する金銭的利益や利益相反はありません。
謝辞
細胞選別は、デンマークのオーフス大学のFACSコア施設で実施されました。図は Biorender.com を使用して作成されました。ウサギ抗PDGFRa抗体を共有してくれたJ.ファラップ博士に感謝します。この作業は、E.P.へのAUFF開始助成金と、ノボノルディスクフォンデンからEP(0071113)およびA.D.M.(0071116)への開始パッケージ助成金によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube( PCR performance tested, PP, 30,000 xg, DNA/DNase-/RNase-free, Low DNA binding, Sterile ) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 72.706.700 | 1.5 mL tube |
| 15 mL tube (PP/HD-PE, 20,000 xg, IVD/CE, IATA, DNA/DNase-/RNase-free, Non-cytotoxic, pyrogen free, Sterile) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 62.554.502 | 15 mL tube |
| 5 mL polystyrene round-bottom tube | Falcon, Fisher Scientific | 352054 | FACS tube without strainer cap |
| 5 mL polystyrene Round-bottom tube with cell-strainer cap | Falcon, Fisher Scientific | 352235 | FACS tube with strainer cap |
| 5 mL tube (PP, non sterile autoclavable) | VWR collection | 525.0946 | 5 mL tube |
| 50 mL tube( PP/HD-PE, 20,000 xg, IVD/CE, ADR, DNA/DNase-/RNase-free, non-cytotoxic, pyrogen free, Sterile) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 62.547.254 | 50 mL tube |
| Alexa Fluor 555 Donkey anti-rabbit IgG (H+L) | Invitrogen, Thermo Fisher | Lot: 2387458 (Cat # A31572) | |
| Alexa Fluor 647 donkey-anti mouse IgG (H+L) | Invitrogen, Thermo Fisher | Lot: 2420713 (Cat#A31571) | |
| ARIA 3 | BD | FACS, Core facility Aarhus University | |
| Centrifuge 5810 | eppendorf | EP022628188 | Centrifuge |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 488 dye | Invitrogen, Thermo Fisher | Lot: 2387287 (Cat# C10337) | Cell Proliferation Kit |
| Collagen from calf-skin | Bioreagent, Sigma Aldrich | Source: SLCK6209 (Cat# C8919) | |
| Collagenase type II | Worthington, Fisher Scientific | Lot: 40H20248 (cat# L5004177 ) | Collagenase |
| Dispase | Gibco, Fisher Scientific | Lot: 2309415 (cat# 17105-041 ) | Dispase |
| Donkey serum (non-sterile) | Sigma Aldrich, Merck | Lot: 2826455 (Cat# S30-100mL) | |
| Dumont nr. 5, 110 mm | Dumont, Hounisen Laboratorieudstyr A/S | 1606.327 | Straight forceps with fine tips |
| Dumont nr. 7, 115 mm | Dumont, Hounisen Laboratorieudstyr A/S | 1606.335 | Curved forceps |
| F-10 Nutrient mixture (Ham) (1x), +L-glutamine | Gibco, Fisher Scientific | Lot. 2453614 (cat# 31550-023) | |
| FITC anti-mouse CD31 | BioLegend, NordicBioSite | MEC13.3 (Cat # 102506) | |
| FITC Anti-mouse CD45 | BioLegend, NordicBioSite | 30-F11 (Cat# 103108) | |
| Glacial acetic acid (100%) | EMSURE, Merck | K44104563 9Cat # 1000631000) | |
| Head over head mini-tube rotator | Fisher Scientific | 15534080 (Model no. 88861052) | Head over head mini-tube rotator |
| Horse serum | Gibco, Fisher Scientific | Lot. 2482639 (cat# 10368902 ) | |
| Isotemp SWB 15 | FisherBrand, Fisher Scientific | 15325887 | Shaking water bath |
| MS2 mini-shaker | IKA | Vortex unit | |
| Needle 20 G (0.9 mm x 25 mm) | BD microlance, Fisher Scientific | 304827 | 20G needle |
| Neutral formalin buffer 10% | CellPath, Hounisen Laboratorieudstyr A/S | Lot: 03822014 (Cat # HOU/1000.1002) | |
| Non-pyrogenic cell strainer (40 µM) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 83.3945.040 | Cell strainer |
| Pacific Blue anti-mouse Ly-6A/E (Sca-1) | BioLegend, NordicBioSite | D7 (Cat# 108120) | |
| Pax7 primary antibody | DSHB | Lot: 2/3/22-282ug/mL (Cat# AB 528428) | |
| PBS 10x powder concentrate | Fisher BioReagents, Fisher Scientific | BP665-1 | |
| PE/Cy7 anti-mouse CD106 (VCAM1) | BioLegend, NordicBioSite | 429 (MVCAM.A) (Cat # 105720) | |
| Pen/strep | Gibco, Fisher Scientific | Lot. 163589 (cat# 11548876 ) | |
| Pipette tips p10 | Art tips, self sealing barrier, Thermo Scientific | 2140-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p1000 | Art tips, self sealing barrier, Thermo Scientific | 2279-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p20 | Art tips, self sealing barrier, Thermo Scientific | 2149P-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p200 | Art tips, self sealing barrier, Thermo Scientific | 2069-05 | Low retention, pre-sterilized, filter tips |
| Protective underpad | Abena | ACTC-7712 | 60 x 40cm, 8 layers |
| Rainin, pipet-lite XLS | Mettler Toledo, Thermo Scientific | 2140-05, 2149P-05, 2279-05, 2069-05 | Pipettes (P10, P20, P200, P1000) |
| Recombinant anti-PDGFR-alpha | RabMAb, abcam | AB134123 | |
| Scalpel (shaft no. 3) | Hounisen, Hounisen Laboratorieudstyr A/S | 1902.502 | Scalpel |
| Scalpel blade no. 11 | Heinz Herenz, Hounisen Laboratorieudstyr A/S | 1902.0911 | Scalpel |
| Scanlaf mars | Labogene | class 2 cabinet: Mars | Flow bench |
| ScanR | Olympus | Microscope, Core facility Aarhus University | |
| Scissors | FST | 14568-09 | |
| Series 8000 DH | Thermo Scientific | 3540-MAR | Incubator |
| Serological pipette 10 mL | VWR | 612-3700 | Sterile, non-pyrogenic |
| Serological pipette 5 mL | VWR, Avantor delivered by VWR | 612-3702 | Sterile, non-pyrogenic |
| Syringe 5 mL, Luer tip (6%), sterile | BD Emerald, Fisher Scientific | 307731 | Syringe |
| TC Dish 100, standard | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 83.3902 | Petri dish |
| Tissue Culture (TC)-treated surface, black polystyrene, flat bottom, sterile, lid, pack of 20 | Corning, Sigma Aldrich | 3764 | 96-well Half bottom plate |
| Triton X-100 | Sigma Aldrich, Merck | Source: SLCJ6163 (Cat # T8787) |
参考文献
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9 (2), 493-495 (1961).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692 (2021).
- Cheung, T. H., Rando, T. A. Molecular regulation of stem cell quiescence. Nature Reviews. Molecular Cell Biology. 14 (6), 329-340 (2013).
- Kann, A. P., Hung, M., Krauss, R. S. Cell-cell contact and signaling in the muscle stem cell niche. Current Opinion in Cell Biology. 73, 78-83 (2021).
- Tedesco, F. S., Dellavalle, A., Diaz-Manera, J., Messina, G., Cossu, G. Repairing skeletal muscle: regenerative potential of skeletal muscle stem cells. Journal of Clinical Investigation. 120 (1), 11-19 (2010).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Lepper, C., Partridge, T. A., Fan, C. -. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Joe, A. W. B., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Uezumi, A., Fukada, S. -. I., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Seale, P., Sabourin, L. A., Girgis-Gabardo, A., Mansouri, A., Gruss, P., Rudnicki, M. A. Pax7 Is Required for the Specification of Myogenic Satellite Cells. Cell. 102 (6), 777-786 (2000).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- Fukada, S. -. I., et al. Molecular signature of quiescent satellite cells in adult skeletal muscle. Stem Cells. 25 (10), 2448-2459 (2007).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Joe, A., Wang, J., Rossi, F. Prospective isolation of adipogenic progenitors from skeletal muscle. Journal of Investigative Medicine. 55 (1), 124 (2007).
- Yi, L., Rossi, F. Purification of progenitors from skeletal muscle. Journal of Visualized Experiments. (49), e2476 (2011).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119 (4), 543-554 (2004).
- Montarras, D., et al. Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Conboy, M. J., Cerletti, M., Wagers, A. J., Conboy, I. M. Immuno-analysis and FACS sorting of adult muscle fiber-associated stem/precursor cells. Methods In Molecular Biology. 621, 165-173 (2010).
- de Morree, A., et al. Alternative polyadenylation of Pax3 controls muscle stem cell fate and muscle function. Science. 366 (6466), 734-738 (2019).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental Biology. 397 (1), 31-44 (2015).
- Mookhtiar, K., Randall Steinbrink, D., Van Wart, H. E. Mode of hydrolysis of collagen-like peptides by class I and class II Clostridium histolyticum collagenases: evidence for both endopeptidase and tripeptidylcarboxypeptidase activities. Biochemistry. 24 (23), 6527-6533 (1985).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. The Journal of Investigative Dermatology. 93 (2), 287-290 (1989).
- Baghdadi, M. B., et al. Reciprocal signalling by Notch-Collagen V-CALCR retains muscle stem cells in their niche. Nature. 557 (7707), 714-718 (2018).
- van Velthoven, C. T. J., de Morree, A., Egner, I. M., Brett, J. O., Rando, T. A. Transcriptional profiling of quiescent muscle stem cells in vivo. Cell Reports. 21 (7), 1994-2004 (2017).
- Machado, L., et al. In situ fixation redefines quiescence and early activation of skeletal muscle stem cells. Cell Reports. 21 (7), 1982-1993 (2017).
- Machado, L., et al. Tissue damage induces a conserved stress response that initiates quiescent muscle stem cell activation. Cell Stem Cell. 28 (6), 1125-1135 (2021).
- vanden Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Moore, D. K., Motaung, B., du Plessis, N., Shabangu, A. N., Loxton, A. G. SU-IRG consortium isolation of B-cells using Miltenyi MACS bead isolation kits. PloS One. 14 (3), 0213832 (2019).
- Liou, Y. -. R., Wang, Y. -. H., Lee, C. -. Y., Li, P. -. C. Buoyancy-activated cell sorting using targeted biotinylated albumin microbubbles. PloS One. 10 (5), 0125036 (2015).
- Brett, J. O., et al. Exercise rejuvenates quiescent skeletal muscle stem cells in old mice through restoration of Cyclin D1. Nature Metabolism. 2 (4), 307-317 (2020).
- Tabula Muris Consortium. A single-cell transcriptomic atlas characterizes ageing tissues in the mouse. Nature. 583 (7817), 590-595 (2020).
- de Morrée, A., et al. Staufen1 inhibits MyoD translation to actively maintain muscle stem cell quiescence. Proceedings of the National Academy of Sciences. 114 (43), 8996-9005 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved