Method Article
Isolamento de Populações de Células-Tronco Quiescentes de Músculos Esqueléticos Individuais
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve o isolamento de células-tronco musculares e progenitores fibroadipogênicos de músculos esqueléticos individuais em camundongos. O protocolo envolve dissecção muscular única, isolamento de células-tronco por classificação de células ativadas por fluorescência, avaliação da pureza por coloração de imunofluorescência e medição quantitativa da entrada da fase S pelo ensaio de incorporação de 5-etinil-2'-desoxiuridina.
Resumo
O músculo esquelético abriga populações distintas de células-tronco adultas que contribuem para a homeostase e reparo do tecido. As células-tronco musculares esqueléticas (MuSCs) têm a capacidade de produzir novos músculos, enquanto os progenitores fibroadipogênicos (FAPs) contribuem para os tecidos de suporte estromais e têm a capacidade de produzir fibroblastos e adipócitos. Tanto MuSCs quanto FAPs residem em um estado de saída prolongada e reversível do ciclo celular, chamado quiescência. O estado quiescente é fundamental para sua função. As células-tronco quiescentes são comumente purificadas a partir de múltiplos tecidos musculares agrupados em uma única amostra. No entanto, estudos recentes têm revelado diferenças distintas nos perfis moleculares e na profundidade de quiescência de MuSCs isolados de diferentes músculos. O presente protocolo descreve o isolamento e estudo de MuSCs e FAPs de músculos esqueléticos individuais e apresenta estratégias para realizar análise molecular da ativação de células-tronco. Ele detalha como isolar e digerir músculos de diferentes origens de desenvolvimento, espessuras e funções, como diafragma, tríceps, grácil, tibial anterior (TA), gastrocnêmio (GA), sóleo, extensor longo dos dedos (EDL) e músculos masseteres. MuSCs e FAPs são purificados por classificação celular ativada por fluorescência (FACS) e analisados por coloração de imunofluorescência e ensaio de incorporação de 5-etinil-2'-desoxiuridina (EdU).
Introdução
O músculo esquelético tem uma alta capacidade de regeneração devido à presença de células-tronco musculares (MuSCs). As MuSCs localizam-se nas miofibras, abaixo da lâmina basal, e residem em estado quiescente de saída prolongada e reversível do ciclo celular 1,2,3,4. Após a lesão, as MuSCs ativam-se e entram no ciclo celular para dar origem a progenitores amplificadores que podem se diferenciar e fundir-se para formar novas miofibras 2,5. Trabalhos anteriores mostraram que as CTms são absolutamente essenciais para a regeneração muscular 6,7,8. Além disso, uma única MuSC pode enxertar e gerar tanto novas células-tronco quanto novas miofibras9. O músculo esquelético também abriga uma população de células estromais mesenquimais denominadas progenitores fibroadipogênicos (PAFs), que desempenham papel crucial no suporte da função de MuSC durante a regeneração muscular 6,10,11,12.
Devido ao seu potencial para coordenar a regeneração muscular, tem havido um enorme interesse em entender como MuSCs e FAPs funcionam. MuSCs quiescentes são marcadas pela expressão dos fatores de transcrição Pax7 e Sprouty1 e do receptor de calcitonina da proteína de superfície celular, enquanto as FAPs quiescentes são marcadas pelo receptor alfa do fator de crescimento derivado de plaquetas da proteína de superfície celular (PDGFRa)10,12,13,14,15 . Estudos prévios mostraram que MuSCs e FAPs poderiam ser purificados de músculos esqueléticos usando marcadores de superfície celular e classificação celular ativada por fluorescência (FACS)9,15,16,17,18,19,20,21. Embora esses protocolos tenham avançado muito a capacidade de estudar MuSCs e FAPs, uma desvantagem é que a maioria desses protocolos requer o isolamento de MuSCs de um pool de diferentes tecidos musculares. Trabalhos recentes nossos e de outros têm revelado diferenças no fenótipo celular e nos níveis de expressão gênica entre MuSCs isolados de diferentestecidos22,23. As CPm do diafragma, tríceps e grácil apresentam ativação mais rápida do que as CPm dos músculos dos membros posterioresinferiores 22, enquanto as CP das MuSC do músculo extraocular apresentam diferenciação mais rápida do que as CP do diafragma e dos músculos dos membros posterioresinferiores 23.
Este protocolo descreve o isolamento de MuSCs e FAPs de músculos esqueléticos individuais (Figura 1). Isso inclui a dissecção dos músculos diafragma, tríceps, grácil, tibial anterior (TA), sóleo, extensor longo dos dedos (EDL), gastrocnêmio (GA) e masseter. Os músculos dissecados são posteriormente dissociados por digestão enzimática utilizando colagenase II (protease que tem como alvo específico a sequência amino Pro-X-Gly-Pro no colágeno, possibilitando a degradação do tecido conjuntivo e dissociação tecidual24) e dispase (protease que cliva fibronectina e colágeno IV, possibilitando maior dissociação celular25). MuSCs e FAPs são isolados de suspensões de célula única por FACS. Como exemplos de ensaios a jusante para análise celular, a ativação de células-tronco é determinada pelo ensaio de incorporação de 5-etinil-2'-desoxiuridina (EdU), enquanto a pureza celular é determinada pela coloração por imunofluorescência para os marcadores específicos de tipo celular Pax7 e PDGFRa.
Protocolo
O presente protocolo foi realizado de acordo com as diretrizes de cuidados com animais da Universidade de Aarhus e regulamentos de ética locais.
NOTA: Certifique-se de cumprir os regulamentos do comitê de ética local para experimentação animal e manuseio de amostras post-mortem de roedores. Os ratos são uma fonte potencial de alérgenos; Se disponível, ligue a ventilação de exaustão e coloque-a sobre o espaço de trabalho para evitar a exposição excessiva a alérgenos. Alternativamente, use uma máscara facial se o experimento for realizado regularmente. Esse protocolo envolve o trabalho com materiais perfurocortantes, e recomenda-se que os pesquisadores se familiarizem com os procedimentos e a logística para a aplicação de primeiros socorros em caso de corte.
1. Preparação (1-2 h; um dia antes da dissecção)
NOTA: As soluções, placas e meios são preparados em condições estéreis e filtrados (0,45 μm) antes da utilização, salvo indicação em contrário. Preparar soluções-estoque de dispase (11 U/mL em PBS) e colagenase II (1.000 U/mL em PBS) e armazená-las a -20 °C (Tabela 1). As unidades populacionais são descongeladas e utilizadas para digestão secundária na etapa 4.2.6.
- Revestimento de colágeno de uma placa de meia área de 96 poços
- Prepare água ácida. Adicionar 5,15 mL de ácido acético glacial a 895 mL de água autoclavada em copo de 2 L.
- Filtrar a solução utilizando uma unidade filtrante de 0,45 μm e 500 ml. Transfira 800 mL da água ácida filtrada para um frasco de 1 L.
- Adicionar 40 mL de solução estoque de colágeno estéril ao frasco. Misture suavemente a solução por redemoinho e conservar a 4 °C, protegido da luz, até à utilização.
- Revestir uma ou mais placas de meia área de 96 poços com colágeno. Adicionar 50 μL de solução de revestimento de colagénio a cada poço e revestir a placa durante a noite (ON) a 4 °C.
- Aspirar a solução de colágeno no dia seguinte com aspirador a vácuo e lavar a placa 2x adicionando 100 μL de água autoclavada e aspirando.
- Incline a tampa da placa e deixe a placa secar no capô por 20-30 min.
- Quando a placa estiver totalmente seca, envolva-a em papel alumínio e guarde a 4 °C até usar. As placas revestidas podem ser armazenadas por até 4 semanas.
NOTA: O revestimento de colágeno permite a adesão celular. É importante lavar o colágeno livre, pois ele pode interferir na função e sinalização celular (por exemplo, ligação do colágeno V aos receptores de calcitonina nas MuSCs)26.
2. Preparo (0,5 h; dia da dissecção):
- Preparação de soluções adicionais e espaço de trabalho
- Preparar meio de lavagem estéril adicionando 50 mL de soro de cavalo e 5 mL de caneta/strep a 445 mL de meio F10 da HAM. Trabalhe em uma capela de fluxo laminar para evitar contaminação.
- Calcular e pesar a quantidade adequada de colagenase II necessária para preparar o tampão de dissociação. (Para cada camundongo, 26.000 unidades de colagenase II são usadas para fazer 40 mL de tampão de dissociação a 650 U/mL de colagenase II). Adicionar o pó pesado a um tubo cônico de 50 mL e armazená-lo no gelo.
- Prepare dois pratos de 10 cm para isolamento muscular. Despejar 3 mL de meio de lavagem (Tabela 1) em cada placa de Petri. Traga as placas de 10 cm para fora da coifa de fluxo laminar para uso posterior.
- Prepare os materiais para a digestão muscular. Com base no número de amostras, rotular o número apropriado de tubos cônicos de 50 mL (oito por camundongo, um para cada músculo) e deixá-los no banco. Borrifar as agulhas, seringas de 10 mL e filtros celulares de 40 μm com etanol 70% (oito de cada camundongo, um para cada músculo) e trazê-los para dentro da capela de fluxo laminar. Coloque agulhas nas seringas.
- Prepare os materiais para triagem. Rotular tubos de fundo redondo de 5 mL com tampas de filtro de células com base no número de amostras. Cubra os tubos com papel alumínio e deixe-os na capela de fluxo laminar.
- Correspondente ao número de amostras e populações a serem triadas, preparar tubos de microcentrífuga de 1,5 mL com 500 μL de meio de lavagem para coleta celular (16 por camundongo, um tubo para cada população celular por tecido muscular). Guarde esses tubos no gelo.
3. Dissecção muscular (20-30 min)
NOTA: Esta seção do protocolo é realizada em um ambiente não estéril. O procedimento pode ser realizado usando um ou vários camundongos. No entanto, um mouse é suficiente para preparar amostras para triagem e controles para configurar compensações e portas FACS.
- Iniciando o isolamento muscular
- Preparar o espaço de trabalho não estéril para dissecção e isolamento muscular. Desinfetar a estação de trabalho com etanol 70%. Coloque uma almofada protetora descartável estéril na estação de trabalho.
- Usando um marcador permanente, desenhe uma caixa para cada músculo em cima de uma tampa de placa de Petri para depois colocar o músculo isolado.
- Borrifar os instrumentos cirúrgicos com etanol 70%.
- Eutanásia do camundongo por inalação de CO2 e/ou luxação cervical.
- Isole os músculos individuais (de um rato de cada vez se utilizar vários ratinhos). Borrife o rato com etanol a 70% para molhar o pelo e desinfetar a pele. Coloque o mouse na parte inferior com o abdômen voltado para cima. Uma visão geral de todos os oito músculos e sua respectiva localização anatômica é mostrada na Figura 2A.
- Isolando os músculos grácis
- Use uma tesoura para fazer uma incisão horizontal de 0,5 cm na pele abdominal.
- Retire a pele: Usando as duas mãos, use o polegar e o indicador para agarrar a parte superior e inferior da incisão. Puxe em cada lado da incisão para rasgar e separar a pele do tronco e membros inferiores. Puxe para baixo a pele do membro inferior para expor ambos os membros posteriores (para baixo do quadril aos dedos dos pés). Da mesma forma, puxe para cima para expor o tronco.
- Localize o músculo grácil (parte interna da coxa). Com pinça curva, agarre o grácil e levante levemente o músculo (Figura 2B). Com tesoura, fazer uma incisão de 0,5 cm (Figura 2C), a partir da qual o grácil é recortado e totalmente isolado (Figura 2D). Repita isso para a outra perna para isolar o segundo músculo grácil.
- Isolando os músculos TA e EDL (membro posterior inferior, lado ventral)
- Com bisturi, corte a fáscia fazendo uma incisão de 0,5 cm ao longo da face lateral da tíbia (o osso mais espesso dos membros posteriores). Use pinças curvas para agarrar a fáscia e puxe para removê-la.
NOTA: Quando a fáscia foi totalmente removida, os tendões na extremidade distal da pata traseira são visíveis e podem ser separados. - Utilizar pinça reta com pontas superfinas para transitar entre o tendão distal do TA (face lateral da tíbia) e o EDL (abaixo do TA) (Figura 2E-G).
NOTA: Com a experiência, a extremidade romba de uma lâmina de bisturi pode ser usada em vez da pinça reta. - Deslize a pinça em direção à extremidade proximal do músculo para separar os músculos.
- Leve a pinça reta de volta para a extremidade distal. Corte o tendão distal.
- Segure suavemente o tendão distal do músculo com pinça curva. Levantar o músculo para cima e sobre sua fixação proximal e cortar cuidadosamente o tendão proximal o mais próximo possível de seu ponto de fixação. Corte a outra extremidade e transfira o TA para uma placa de Petri.
- Use pinças retas com pontas superfinas para passar por baixo do tendão distal do EDL.
- Deslize a pinça em direção à extremidade proximal do músculo para separar os músculos.
- Leve a pinça reta de volta para a extremidade distal. Cortar o tendão distal sem danificar o músculo.
- Segure suavemente o tendão distal do EDL com pinça curva. Levantar o músculo para cima e sobre sua fixação proximal e cortar cuidadosamente o tendão proximal o mais próximo possível de seu ponto de fixação. Corte a outra extremidade e transfira o EDL para uma placa de Petri. Repetir para o outro membro posterior para isolar o segundo TA e EDL.
- Com bisturi, corte a fáscia fazendo uma incisão de 0,5 cm ao longo da face lateral da tíbia (o osso mais espesso dos membros posteriores). Use pinças curvas para agarrar a fáscia e puxe para removê-la.
- Isolando os músculos GA e sóleo (membro posterior inferior, lado dorsal)
- Use pinças retas com pontas superfinas para entrar entre o tendão de Aquiles e os ossos dos membros posteriores inferiores.
- Deslize a pinça em direção à extremidade proximal do músculo para separá-lo.
- Leve a pinça reta de volta para a extremidade distal. Corte o tendão distal.
OBS: Para não lesar o músculo sóleo, que fica abaixo do GA, corte o mais próximo possível de sua fixação distal do tendão de Aquiles, deixando um pedaço do tendão aderido ao GA (Figura 2H). - Para revelar e isolar o músculo sóleo, puxe o GA para cima e sobre a fíbula (o osso mais fino dos dois ossos no membro posterior inferior).
NOTA: O músculo sóleo distingue-se pela sua característica cor vermelho escuro em relação ao GA (Figura 2I). - Localizar o tendão sóleo proximal. Com pinças retas, entre o sóleo e o GA.
- Mover a pinça em direção à extremidade distal do músculo para separar o sóleo do GA.
- Isole o sóleo primeiro. Corte seu tendão proximal, agarre o tendão com pinça curva e levante cuidadosamente o sóleo para acessar seu tendão distal. Cortar o tendão distal para isolar o sóleo do GA. Coloque o sóleo na placa de Petri com meio de lavagem (Figura 2J)
- Corte o GA e coloque-o na placa de Petri. Repita isso para a outra perna para isolar o segundo sóleo e os músculos GA.
- Isolando os músculos tríceps (membro anterior superior, lado dorsal)
- Use pinças retas com pontas superfinas para ficar entre o músculo tríceps e o úmero (principal osso da perna dianteira superior) (Figura 2K-M).
- Deslize a pinça em direção à extremidade proximal do músculo para separá-lo. Corte a extremidade proximal do músculo.
- Agarrar a extremidade proximal do tríceps com pinça curva e puxá-la para cima e sobre o cotovelo para acessar o tendão distal. Corte o tendão distal do tríceps, transfira o músculo para uma placa de Petri e repita o procedimento para o outro membro anterior.
- Isolando os músculos masseteres
- Remova o pelo e a pele da mandíbula. Faça uma incisão horizontal de 0,5 cm com tesoura. Usando as duas mãos, aperte em cada lado da incisão usando os dedos polegar e indicador. Remova a pele puxando para cima e para baixo.
- Localize o tendão maior do masseter (caudal, abaixo do olho). Inserir a lâmina plana de bisturi entre o osso e o músculo (Figura 2N). Corte o tendão.
- Agarre o tendão masseter maior com pinça curva. Corte-o com lâmina de bisturi ou tesoura no sentido rostral para separar o músculo masseter do osso maxilar (Figura 2O, P). Coloque o músculo masseter isolado na placa de Petri. Repita o procedimento para o segundo músculo masseter.
- Isolando o músculo diafragma
NOTA: Ao isolar o músculo diafragma, certifique-se de cortar com cuidado para evitar o corte nos órgãos internos e intestino, pois esta é uma fonte de contaminação.- Com tesoura, faça uma toracotomia (corte entre as costelas) no meio do esterno (osso longo e chato, situado no meio do tórax, que conecta as costelas) e corte o esterno (Figura 2Q).
- Expor o diafragma cortando 360° através da caixa torácica.
- Separe a parte superior do corpo da parte inferior/abdômen. Usando uma tesoura, corte a traqueia, esôfago, veia cava e aorta abdominal.
- Separe o diafragma da parte inferior do corpo. Com tesoura, fazer laparotomia (incisão cirúrgica na cavidade abdominal) 1 cm abaixo do esterno e fazer um corte de 360° (Figura 2R).
- Coloque a tesoura fechada entre a caixa torácica e os órgãos abdominais e pressione para baixo. Puxe suavemente a caixa torácica para separá-la dos órgãos abdominais (Figura 2S).
- Separe o diafragma da caixa torácica. Segure frouxamente o diafragma entre dois dedos e corte a caixa torácica com uma tesoura. Use uma tesoura para cortar o diafragma o mais próximo possível das costelas em um corte de 360°. Coloque o diafragma isolado em uma placa de Petri.
OBS: Durante a luxação cervical, o diafragma pode romper e colapsar contra a caixa torácica, dificultando sua localização. O músculo ainda pode ser isolado. Identifique o músculo colapsado, segure-o entre dois dedos e corte 360° após a caixa torácica.
4. Digestão muscular para uma suspensão de célula única (~1 h 35 min)
Observação : as etapas a seguir incluem ambientes de trabalho não estéreis (etapas 4.1-4.2) e estéreis (etapa 4.3).
- Digestão mecânica
- Coloque os músculos isolados na tampa de uma placa de Petri de 10 cm.
- Usando pinças curvas, agarre os músculos isolados um a um. Para o sóleo e GA, remova as partes restantes do tendão de Aquiles.
- Usando tesoura, pique os músculos isolados, um a um, cortando-os em cerca de 1 mm3 pedaços.
- Digestão enzimática
- Preparar o tampão de dissociação muscular adicionando 40 mL de meio de lavagem a frio ao pó pesado de colagenase II (colagenase II: 650 U/mL em meio de lavagem).
NOTA: Use tampão de dissociação muscular recém-preparado para garantir a atividade enzimática ideal. - Transferir os músculos picados para um tubo cônico de 15 mL contendo 5 mL de tampão de dissociação.
- Incubar o tubo durante 35 min num banho de água de agitação a 37 °C a 60 rpm.
- Após a incubação, adicionar o meio de lavagem a um volume total de 15 mL. Gire o tubo a 1.600 x g por 5 min a 4 °C.
- Aspirar o sobrenadante até um volume de 4 mL usando um aspirador a vácuo. Para evitar perturbar o pellet, aspirar lentamente a partir do topo, e remover qualquer gordura flutuante.
- Descongelar alíquotas de dispase e colagenase II. Adicionar 500 μL da solução de colagenase II (1.000 U/mL de estoque, -20 °C) aos 4 mL restantes da amostra. Em seguida, adicionar 500 μL da solução dispase (11 U/mL de estoque, -20 °C).
NOTA: Dispase pode gerar um precipitado. Se isso ocorrer, gire a solução-mãe dispase a 10.000 x g, 1 min antes do uso. Transfira o sobrenadante agora claro para a suspensão celular sem perturbar o pellet. - Vórtice as amostras brevemente para dissolver o pellet.
- Incubar as amostras durante 20 min num banho de água de agitação a 37 °C a 60 rpm.
NOTA: Digerir um grande número de amostras musculares é demorado. Para as etapas 4.3.1-4.3.6, estimar a tomada de 2-5 min por amostra. Essa etapa é mais rápida quando realizada em paralelo por dois ou mais pesquisadores.
- Preparar o tampão de dissociação muscular adicionando 40 mL de meio de lavagem a frio ao pó pesado de colagenase II (colagenase II: 650 U/mL em meio de lavagem).
- Homogeneização de amostras
- Homogeneizar a suspensão celular. Transfira a suspensão do tubo de 15 mL para um tubo de 50 mL. Use uma seringa de 10 mL com uma agulha 20G para ressuspender a amostra puxando a amostra para cima e para baixo através da agulha 5x.
NOTA: Se pedaços de músculo não digerido obstruírem a agulha, limpe-os em um lenço de papel. - Coloque um filtro celular de 40 μm em um novo tubo cônico de 50 mL.
- Pegue a suspensão de células completas na seringa e coe a amostra em um novo tubo cônico de 50 mL com um filtro de células por cima. Coar a amostra dispensando o volume total directamente no filtro.
- Para recuperar todas as células mononucleadas, adicione 20 mL do meio de lavagem ao tubo cônico vazio e despeje-o através do filtro celular no tubo cônico de 50 mL contendo a amostra coada. Recupere o volume restante sob o filtro de células com uma pipeta p1000.
- Eliminar o filtro celular e girar a amostra a 1.600 x g durante 5 minutos a 4 °C.
- Ao pipetar com uma pipeta p1000, aspirar o sobrenadante sem perturbar o pellet.
- Por pipetagem com pipeta p1000, ressuspenda o pellet de diafragma em 500 μL do meio de lavagem e ressuspenda as demais amostras musculares em 300 μL do meio de lavagem cada.
NOTA: O diafragma é o maior dos músculos com maior conteúdo de células-tronco e, portanto, pode ser usado para as colorações de controle.
- Homogeneizar a suspensão celular. Transfira a suspensão do tubo de 15 mL para um tubo de 50 mL. Use uma seringa de 10 mL com uma agulha 20G para ressuspender a amostra puxando a amostra para cima e para baixo através da agulha 5x.
5. Coloração e classificação (~40 min + 30 min sort/sample)
NOTA: Trabalhe em um ambiente estéril no gelo para as etapas a seguir.
- Transferir uma alíquota de 50 μL da suspensão da célula diafragmática para quatro novos tubos de microcentrífuga de 2 mL para as colorações controle (50 μL cada). Adicionar 250 μL do meio de lavagem a cada tubo de controlo até um volume final de 300 μL.
- Adicionar 3 μL (1:100) dos anticorpos de fluorescência menos um (FMO-controle) aos três tubos de coloração de controle e deixar um tubo sem anticorpos (controle não corado) (ver Tabela 2).
- Adicionar 3 μL (1:100) dos anticorpos (VCAM1-PECy7, CD45-FITC, CD31-FITC e SCA1-PacificBlue) às demais suspensões de célula única muscular, incluindo a amostra restante do diafragma.
- Incubar as suspensões celulares durante 15 minutos a 4 °C num agitador cabeça-sobre-cabeça.
NOTA: As colorações de controle são necessárias para determinar os níveis de fluorescência de fundo e definir as portas para citometria de fluxo. Anticorpos diferentes podem ser usados, mas cada um terá uma concentração de trabalho específica e um tempo de incubação que precisa ser testado. Se forem usados anticorpos de diferentes fornecedores, a concentração e, portanto, a diluição, podem variar. Um corante de viabilidade celular pode ser adicionado à mistura de coloração para eliminar quaisquer células mortas ou moribundas durante a triagem. - Girar as amostras a 1.600 x g por 5 min a 4 °C. Descarte o sobrenadante sem perturbar o pellet por pipetagem.
- Por pipetagem com uma pipeta p1000, ressuspenda cada amostra em 800 μL do meio de lavagem.
- Filtrar as amostras utilizando um tubo FACS com uma tampa de filtro de células (40 μm) para remover quaisquer aglomerados celulares (ou agregados) restantes.
- Lave o filtro celular adicionando mais 800 μL do meio de lavagem.
- Manter as amostras cobertas com papel alumínio sobre gelo até a análise.
NOTA: Se neste ponto a suspensão celular parecer turva/densa devido à alta concentração de células, adicione mais 800 μL do meio de lavagem para diminuir a densidade celular. - Inicie o FACS com um bocal de 70 μm.
- Use os controles sem manchas e FMO para definir a estratégia de limitação: MuSCs são negativos para CD45-FITC, CD31-FITC e SCA1-PacBlue, e são positivos para VCAM1-PECy7; As FAPs são negativas para CD45-FITC, CD31-FITC, VCAM1-PECy7 e positivas para SCA1-PacBlue.
- Classificar as suspensões unicelulares coradas usando classificação bidirecional e coletar os MuSCs e FAPs em tubos de coleta separados contendo 500 μL do meio de lavagem.
NOTA: Usando FACS com quatro lasers (configuração: bico de 70 μm, 405 nm, 488 nm, 561 nm, 633 nm), a combinação escolhida de fluoróforos não requer compensação do sinal de fluorescência. No entanto, se usar um citômetro de fluxo diferente ou uma combinação diferente de fluoróforos, recomenda-se amostras controle adicionais de coloração única para compensação. Dos músculos menores (EDL, sóleo, TA), são esperados rendimentos de 3.000 MuSCs e 5.000 FAPs. Para os outros músculos maiores, são esperados rendimentos de 20.000 MuSCs e FAPs. As contagens de eventos listadas pelo software FACS podem divergir do número real de células viáveis no tubo de coleta. O número de células pode ser confirmado pela contagem de células usando um hemocitômetro. - Gire as células classificadas a 1.600 x g por 5 min a 4 °C. Ao pipetar, aspirar o sobrenadante sem perturbar a pelota celular.
- Adicionar 100 μL do meio de lavagem a cada amostra e ressuspender cuidadosamente as células sem criar bolhas de ar. Transfira os 100 μL da amostra ressuspensa para uma placa de 96 poços revestida com colágeno. Placa 1.000-3.000 células por poço.
NOTA: Se as células não forem adequadamente ressuspensas, as células podem ficar juntas em aglomerados, confundindo análises de microscopia posteriores. - Inspecione as células sob o microscópio e observe sua distribuição, forma e tamanho.
- Incubar a placa a 37 °C, 5% CO2. As células irão aderir dentro de 2 h.
NOTA: Recomenda-se confirmar a pureza das populações celulares coletadas, seja por análise de citometria de fluxo (carregando uma alíquota da amostra classificada no classificador e registrando um pequeno número de eventos) ou pela coloração de anticorpos das células plaqueadas seguida de microscopia (Pax7 é um marcador definidor para MuSCs de camundongo, PDGFRa é um marcador definidor para FAPs de camundongo). A partir da seção 7 abaixo está um protocolo para a coloração de células para os níveis de proteína Pax7 e PDGFRa.
6. Ensaio de incorporação da EdU
NOTA: Trabalhe em condições estéreis e use o exaustor químico ao manusear paraformaldeído (PFA) para as etapas a seguir. EdU é um análogo de nucleotídeo incorporado ao DNA à medida que as células passam pela fase S do ciclo celular. É mutagénico em concentrações elevadas. Use sempre luvas ao manusear EdU. Verifique as diretrizes locais para o manuseio de resíduos de EdU.
- Pulso de EdU (dia 1)
- Prepare uma solução de trabalho de 2x EdU em um meio de lavagem fresco.
- Pegue a placa de 96 poços com as células para fora da incubadora. Inspecionar as células sob o microscópio para monitorar a confluência. Mova para o exaustor de fluxo laminar.
- Retire 50 μL de meio da placa por pipetagem. Adicionar 50 μL de solução de trabalho de 2x EdU para que o volume final no poço seja de 100 μL.
- Cultivar as células na presença de EdU durante o período de tempo pretendido a 37 °C, 5% CO2.
NOTA: O tempo e a duração do pulso de EdU podem variar. Em média, os MuSCs quiescentes levam 2 dias para ativar completamente e completar sua primeira divisão celular19. EdU pode ser adicionado às células classificadas imediatamente após o plaqueamento.
- Fixação (dia 2)
NOTA: PFA é um carcinógeno. Manuseie sempre o PFA com cuidado. Familiarize-se com as regulamentações locais para manuseio de PFA e descarte de resíduos.- Pegue a placa de 96 poços com as células para fora da incubadora. Inspecione as células sob o microscópio e mova a placa para o exaustor.
- Ao pipetar, remova o meio e fixe as células adicionando 50 μL de PFA a 4% em cada poço. Incubar a placa durante 10 minutos à temperatura ambiente (TR) num exaustor químico.
- Retire o PFA com uma pipeta e elimine-o num contentor de resíduos adequado.
- Lave as células adicionando 100 μL de PBS a todos os poços. Ao pipetar, aspirar o PBS e repetir a lavagem. Manter as células em 100 μL de PBS.
NOTA: Para evitar lavar quaisquer células, distribua o PBS para o lado do poço pipetando lentamente.
- Rotulagem EdU
- Permeabilizar as células antes da detecção de EdU removendo o PBS e adicionando 100 μL de Triton X-100 a 0,5% em PBS. Incubar a placa durante 5 min a 4 °C.
NOTA: Triton X-100 é um surfactante e pode causar irritação da pele. Manuseie com cuidado e use sempre luvas. - Após 5 min, aspirar o Triton X-100 e adicionar 100 μL de PBS.
- Prepare uma mistura de reação de química de clique EdU de acordo com o protocolo do fabricante.
- Aspirar o PBS e adicionar 33 μL da mistura de reacção químico-clique de EdU. Incubar a placa por 30 min no TR.
- Aspirar a mistura de reação químico-clique de EdU e lavar as células com 100 μL de PBS.
- Aspirar o PBS, adicionar 100 μL de PBS com Hoechst (1:2.000) e incubar protegido da luz por 10 min no TR.
- Aspirar o Hoechst e lavar duas vezes adicionando 100 μL de PBS. Armazenar as células em 100 μL de PBS a 4 °C no escuro.
- Imagem das células em um microscópio invertido. As células podem ser armazenadas no escuro por meses, desde que os poços não sequem.
NOTA: É possível co-manchar as células com anticorpos. Neste caso, prossiga com uma etapa de bloqueio seguida de incubação com o anticorpo primário. Selecionar um anticorpo secundário com um fluoróforo conjugado cujo espectro de emissão não se sobreponha ao do fluoróforo usado para detectar a EdU. Certifique-se de não usar anticorpos secundários com fluoróforos sobrepostos à faixa espectral da Hoechst.
- Permeabilizar as células antes da detecção de EdU removendo o PBS e adicionando 100 μL de Triton X-100 a 0,5% em PBS. Incubar a placa durante 5 min a 4 °C.
7. Coloração por imunofluorescência
NOTA: Esta parte do protocolo pode ser executada independentemente da secção 6. Ao ignorar a seção 6, execute as etapas 6.3.1 e 6.3.2 para habilitar a permeabilização celular antes de continuar com a etapa 7.2 abaixo.
- Retire a placa que contém as células marcadas com EdU.
- Preparar 20 ml de tampão de bloqueio adicionando 2 ml de soro de burro a 18 ml de PBS.
- Para evitar a ligação de anticorpos inespecíficos, remova 100 μL do PBS de cada poço e adicione 50 μL do tampão de bloqueio com uma pipeta p200. Incubar a placa por 30 min em RT, protegida da luz e coberta com papel alumínio para evitar o fotobranqueamento da EdU marcada com fluoróforo.
NOTA: As células são fixadas no fundo do poço, mas podem se desprender se muita força for aplicada durante a pipetagem. - Ao bloquear as amostras, prepare a mistura primária de anticorpos. Adicionar 8,0 μL (1:100) de camundongo anti-Pax7 e coelho anti-PDGFRa a 800 μL de tampão de bloqueio para corar 16 poços (oito tecidos, dois tipos celulares).
- Após o bloqueio, remova o soro do burro e adicione 50 μL da mistura de anticorpos primários a cada poço. Incubar a placa durante a noite a 4 °C, coberta com papel alumínio.
- Após a incubação, remover o anticorpo primário e adicionar 50 μL de Triton (0,5% em PBS) a cada um dos poços. Incubar a placa por 5 min em RT protegida da luz, para lavar o anticorpo não ligado. Repita a lavagem três vezes.
- Prepare a mistura mestra de anticorpos secundários adicionando 1,0 μL (1:1.000) de burro anti-rato-Alexa647 e burro anti-coelho-Alexa555 a um tubo de microcentrífuga contendo 1.000 μL do tampão de bloqueio.
- Adicionar 33 μL da mistura mestra de anticorpos secundários a cada um dos poços. Incubar a placa por 60 min em TR protegida da luz.
- Remova o excesso de anticorpo secundário por pipetagem, adicione 50 μL de Triton (0,1% em PBS) e incube por 5 min em RT protegido da luz. Repita a lavagem três vezes.
- Finalmente, adicione 100 μL de PBS. Decida se deseja obter imagens da placa imediatamente usando um microscópio de fluorescência invertido com uma câmera CCD resfriada ou armazenar a placa a 4 °C até análise posterior, selando as bordas da placa com parafilme e envolvendo a placa selada em papel alumínio.
Resultados
Seguindo o protocolo de isolamento individual da musculatura esquelética (Figura 2), os músculos grácil, AT, EDL, GA, sóleo, tríceps, masseter e diafragma foram isolados de três camundongos machos suíços de raça outbre que haviam sido descontinuados de um programa de melhoramento local (Figura 2). Após dissociação tecidual e coloração de anticorpos, MuSCs e FAPs dos músculos individuais foram purificados por FACS (Figura 3). O gating inicial foi obtido com uma amostra não corada para identificar as células e separar os singlets dos duplos (Figura 3A). As comportas subsequentes foram ajustadas utilizando-se controles FMO para identificar os limiares de coloração (Figura 3B). A amostra corada foi então fechada para CD31/CD45-FITC e Sca1-PacBlue. A população SCA1+/CD31-/CD45- (FAPs) foi classificada em um tubo de coleta separado, enquanto a população dupla negativa foi fechada e plotada para VCAM1-PECy7 e forward scatter (FSC). A população VCAM1+ (MuSCs) foi classificada em um tubo de coleta separado. MuSCs e FAPs foram quantificados como a porcentagem de singlets (Tabela 3) e classificados em tubos de coleta separados contendo 500 μL do meio de lavagem. As suspensões unicelulares do diafragma e do músculo tríceps têm maior abundância relativa de MuSCs do que as FAPs, enquanto as outras suspensões unicelulares têm maior abundância relativa de FAPs do que MuSCs (Tabela 3).
Das células selecionadas, 1.000-3.000 células foram semeadas e incubadas por 24 h. Após 24 h de incubação, o meio foi removido e substituído por um meio fresco contendo EdU. As células foram fixadas em 48 h, coradas para EdU e, posteriormente, com anticorpos contra a proteína Pax7 ou proteína PDGFRa, e imageadas em microscópio de epifluorescência invertido. As imagens foram quantificadas usando o plugin Fiji no ImageJ. Observou-se coloração robusta de EdU, embora a fração de células EdU positivas tenha sido diferente para os dois tipos de células-tronco e os diferentes músculos (Figura 4A-C). MuSCs isolados do EDL ou GA mostraram incorporação de EdU significativamente menor em comparação com MuSCs isolados de AT, diafragma, grácil ou tríceps, enquanto MuSCs isolados do masseter e sóleo se encaixam entre si e não são significativamente diferentes de ambos os grupos (Figura 4A,B). Isso é consistente com nossos resultados anteriores22. Além disso, os tecidos dos quais os MuSCs apresentam altos níveis de incorporação de EdU são os mesmos tecidos dos quais os MuSCs expressaram previamente altos níveis de proteína Pax322. Os FAPs isolados do EDL apresentaram uma incorporação de EdU significativamente menor em comparação com os FAPs isolados do GA e sóleo, enquanto os FAPs isolados do TA apresentaram uma incorporação de EdU significativamente menor em comparação com os FAPs isolados do sóleo (Figura 4A,C). Isso ressalta a importância de analisar células-tronco de tecidos individuais em vez de agrupar músculos de diferentes tecidos para isolamento. Para todos os tecidos, a fração média de MuSCs EdU-positivas foi maior em comparação com a fração média de FAPs EdU-positivas, sugerindo que MuSCs se ativam mais rapidamente sob as condições dadas.
Finalmente, a pureza celular foi confirmada pela coloração de imunofluorescência (Figura 4D). Em média, 97,71% (± 1,38%) dos MuSCs foram positivos para proteína Pax7, e 88,16% (±6,35%) dos FAPs foram positivos para proteína PDGFRa, confirmando a especificidade do nosso procedimento de isolamento de células-tronco (Figura 4D).

Figura 1: Resumo esquemático do protocolo. Esquema mostrando os dois principais segmentos do protocolo, isolamento de MuSC (painel superior), ensaio de quiescência (painel inferior) e as principais etapas da metodologia utilizada em cada um deles. Clique aqui para ver uma versão maior desta figura.
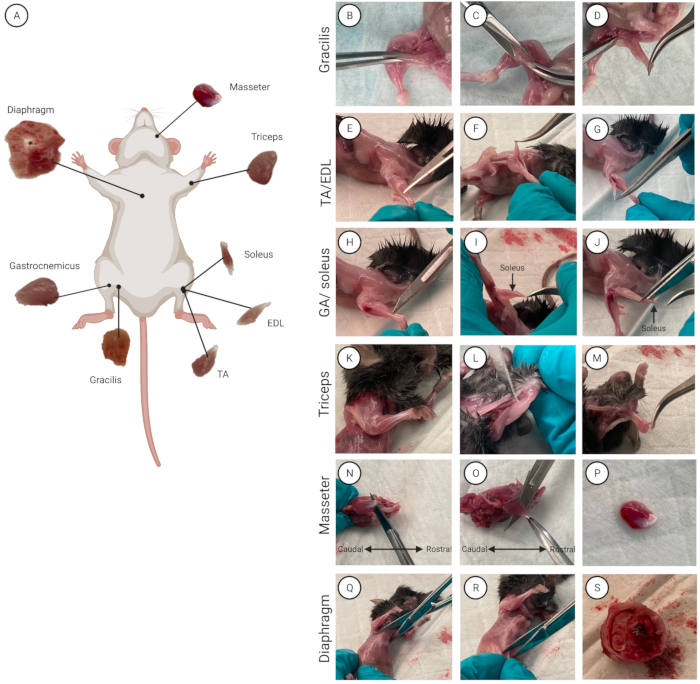
Figura 2: Localização e isolamento muscular. (A) Um esquema mostrando a localização de cada músculo. (B-S) Demonstração de isolamento muscular para os músculos (B-D) grácil, (E-G) TA/EDL, (H-J) tríceps, (K-M) GA/sóleo, (N-P) masseter e (Q-S) diafragma. Clique aqui para ver uma versão maior desta figura.
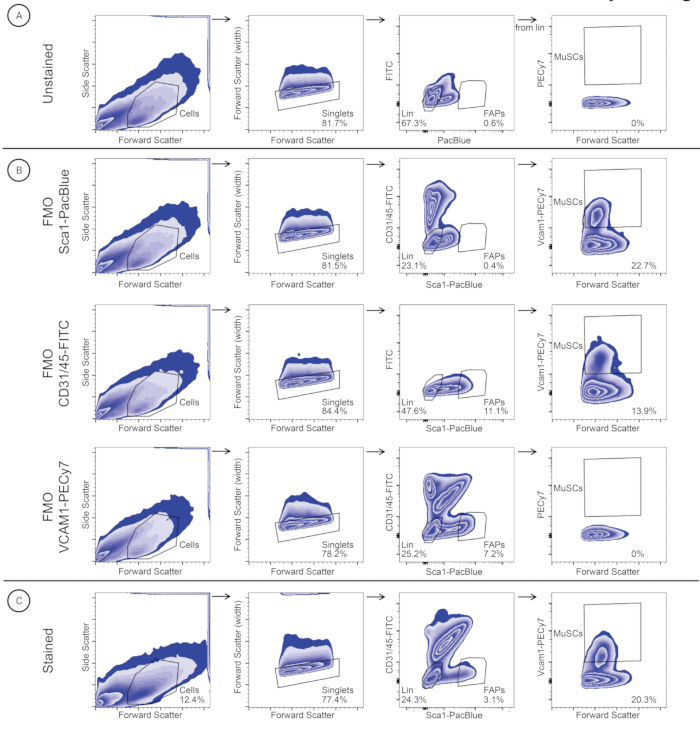
Figura 3: Estratégia de Gating utilizada para identificar e classificar MuSCs e FAPs em uma amostra de músculo diafragma. As células são identificadas com base no tamanho da célula (Forward Scatter (FSC)) e granularidade (Side Scatter (SSC)). Os singlets são selecionados com base no FSC-A e FSC-W. As células de linhagem são fechadas para posterior identificação de MuSCs (Lineage-/VCAM1+), e as células FAP (Lineage-/SCA1+) são fechadas para identificar FAPs. A mesma estratégia de gating foi aplicada a (A) um controle não corado, (B) controles FMO (FMO-SCA1PacBlue, FMO-CD31/45-FITC e FMO-VCAM1-PECy7) e (C) uma amostra corada. Clique aqui para ver uma versão maior desta figura.

Figura 4: Quantificação da ativação celular pela coloração de EdU. (A) Imagens representativas da coloração de EdU de MuSCs (painéis superiores) e FAPs (painéis inferiores) de uma amostra de diafragma. São mostradas imagens mescladas de EdU e Hoechst (painéis esquerdos), e os canais únicos em verde (EdU, painéis do meio) e azul (Hoechst, painéis da direita). (B,C) Gráfico de barras mostrando a porcentagem de MuSCs (B) ou FAPs (C) positivas para EdU para os músculos indicados. Plotado é a média ± MEV. Cada ponto representa um mouse. A análise estatística foi realizada no GraphPad por meio do teste t de Student bicaudal, com nível de significância de *p < 0,05 e **p < 0,01. (D) Coloração por imunofluorescência de MuSCs (painéis superiores) e FAPs (painéis inferiores) com anticorpos contra o marcador MuSC Pax7 (lado esquerdo) e o marcador FAP PDGFRa (lado direito). São mostradas imagens mescladas de Pax7 com Hoechst, seguidas pelos canais únicos, e imagens mescladas de PDGFRa com Hoechst, seguidas pelos canais únicos. N = 3. Clique aqui para ver uma versão maior desta figura.
| Soluções | Reagentes | Quantidade |
| Meio de lavagem | F-10 Mistura de nutrientes (Ham) (1x), +L-glutamina | 445 mL |
| Soro para cavalos | 50 mL | |
| Caneta/strep | 5 mL | |
| Tampão de dissociação (1ª digestão) | Colagenase tipo II | 650 U/mL |
| Meio de lavagem | 100 mL | |
| Dispase stock (2ª digestão) | Dispase em PBS | 11 U/mL |
| Estoque de colagenase (2ª digestão) | Colagenase tipo II em PBS | 1000 U/mL |
| PBS 1x | PBS 10x pó concentrado | 9,89 g/L |
| Água autoclavada/estéril | 1 L | |
| Água ácida | Ácido acético glacial (100%) Anidro para análise | 5,15 mL |
| Água autoclavada/estéril | 895 mL | |
| Solução de colágeno (0,002%) | Colágeno da pele do bezerro | 20 mL |
| Água ácida | 800 mL | |
| Tritão X-100 | Tritão X-100 | 0,5% (v/v) |
| PBS 1x | 99.5% | |
| Buffer de bloqueio | PBS 1x | 18 mL |
| Soro de burro | 2 mL |
Tabela 1: Tabela de receitas.
| Amostra nº. | Nome |
| 1 | Sem manchas |
| 2 | Fluorescência menos VCAM1-PeCy7 |
| 3 | Fluorescência menos SCA1-PacificBlue |
| 4 | Fluorescência menos CD31/45-FITC |
| 5 | Coloração experimental (todos os quatro anticorpos) |
Tabela 2: Visão geral da coloração, controles e amostras preparadas para cada tecido antes da triagem.
| Tecido | Mistura de anticorpos | Células | Singlets | Lin neg | FAPs | MuSCs |
| Diafragma | sem manchas | 100% | 82% | 55% | 0.5% | 0.0% |
| FMO Sca1-PacBlue | 100% | 83% | 19% | 0.3% | 4.3% | |
| FMO CD31/45-488 | 100% | 84% | 40% | 9.4% | 5.6% | |
| FMO Vcam1-PeCy7 | 100% | 78% | 20% | 5.6% | 0.0% | |
| Manchado | 100% | 77% | 19% | 2.4% | 3.8% | |
| Gracilis | Manchado | 100% | 96% | 11% | 2.6% | 1.4% |
| OBRIGADA | Manchado | 100% | 88% | 16% | 2.8% | 2.2% |
| EDL | Manchado | 100% | 86% | 26% | 19.2% | 0.8% |
| Sóleo | Manchado | 100% | 91% | 41% | 13.3% | 1.1% |
| GA | Manchado | 100% | 94% | 51% | 6.1% | 1.5% |
| Tríceps | Manchado | 100% | 92% | 30% | 2.6% | 4.5% |
| Masseter | Manchado | 100% | 85% | 27% | 19.3% | 2.6% |
Tabela 3: Visão geral da abundância relativa do tipo celular nos dados FACS.
Discussão
Várias etapas são fundamentais na execução deste protocolo para alcançar bons rendimentos. Os músculos individuais têm um volume pequeno em comparação com a quantidade de músculo utilizada em protocolos de isolamento em massa. Isso resulta em um risco de o músculo secar durante a dissecção, o que reduz o rendimento. Para evitar isso, é importante adicionar meio aos músculos imediatamente após a dissecção. Além disso, se a dissecção estiver demorando mais, a pele pode ser removida de um membro de cada vez para reduzir o tempo de exposição dos músculos ao ar. O volume menor também resulta em um risco aumentado de excesso de digestão. Para contrapor isso, o presente método requer menores quantidades da enzima colagenase II e tempos de digestão reduzidos em comparação com protocolos de massa muscular 9,16. A digestão enzimática também depende da pureza das enzimas, e uma pureza mais baixa pode afetar negativamente o rendimento. Além disso, a digestão mecânica é fundamental. Em caso de corte insuficiente, a diminuição da área superficial dificultará a digestão enzimática e diminuirá o rendimento de células-tronco. Em caso de corte excessivo, o aumento da área de superfície causará digestão excessiva e diminuirá o rendimento de células-tronco. O banho de água agitada evita a precipitação do músculo digerido, melhora a distribuição da enzima e ajuda a criar uma temperatura homogênea, permitindo tempos de incubação mais curtos. Portanto, o presente método permite uma redução significativa do tempo de incubação em comparação com outros métodos.
Este protocolo depende da dissociação e purificação celular. Esses procedimentos mimetizam a lesão tecidual, que ativa as células-tronco. Consistentemente, estudos recentes têm revelado que as MuSCs alteram seus programas de expressão gênica durante o procedimento de isolamento27,28,29,30. Como resultado, as células-tronco purificadas são diferentes das células in vivo em termos de padrões de expressão gênica. Um segundo fator limitante do protocolo é sua dependência da FACS, que requer acesso a equipamentos de alto custo. A FACS é o padrão-ouro para isolar populações de múltiplas células simultaneamente com altapureza20. Avanços recentes usando esferas magnéticas e microbolhas oferecem reduções no custo31,32, mas é necessário determinar se elas oferecem rendimentos comparáveis para trabalhar em músculos isolados. Finalmente, o rendimento do protocolo é limitado devido ao pequeno tamanho dos músculos, restringindo potenciais ensaios a jusante.
Estudos anteriores se basearam no agrupamento de diferentes músculos ao isolar MuSCs e/ou FAPs para maximizar o rendimento celular. No entanto, isso faz uma média de quaisquer diferenças tecido-específicas no comportamento e função das células-tronco entre diferentes músculos. O protocolo atual permite o isolamento de MuSCs e FAPs de músculos individuais para as análises a jusante da função das células-tronco. Como exemplo de um ensaio a jusante, a ativação de células-tronco foi ensaiada por incorporação de EdU, revelando que células-tronco de diferentes tecidos exibem diferentes cinéticas de ativação. Em trabalhos anteriores, a viabilidade do uso de outros ensaios a jusante foi demonstrada; esses ensaios requerem menor número de células, como sequenciamento de RNA de célula única SmartSeq2, transplante de células, PCR microfluídico e ensaios de expansão clonal22,33,34,35.
Em conclusão, este protocolo descreve um método de dissecção de músculos individuais para isolar e estudar MuSCs e FAPs. Essa estratégia permitirá que os experimentos obtenham uma melhor compreensão da função das células-tronco em diferentes músculos na saúde e na doença.
Divulgações
Os autores não têm interesses financeiros concorrentes nem conflitos de interesse.
Agradecimentos
A triagem celular foi realizada no FACS Core Facility, Universidade de Aarhus, Dinamarca. As figuras foram criadas usando Biorender.com. Agradecemos ao Dr. J. Farup por compartilhar o anticorpo anti-PDGFRa do coelho. Este trabalho foi apoiado por uma subvenção inicial da AUFF para E.P. e Start Package da NovoNordiskFonden para E.P. (0071113) e para A.D.M. (0071116).
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube( PCR performance tested, PP, 30,000 xg, DNA/DNase-/RNase-free, Low DNA binding, Sterile ) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 72.706.700 | 1.5 mL tube |
| 15 mL tube (PP/HD-PE, 20,000 xg, IVD/CE, IATA, DNA/DNase-/RNase-free, Non-cytotoxic, pyrogen free, Sterile) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 62.554.502 | 15 mL tube |
| 5 mL polystyrene round-bottom tube | Falcon, Fisher Scientific | 352054 | FACS tube without strainer cap |
| 5 mL polystyrene Round-bottom tube with cell-strainer cap | Falcon, Fisher Scientific | 352235 | FACS tube with strainer cap |
| 5 mL tube (PP, non sterile autoclavable) | VWR collection | 525.0946 | 5 mL tube |
| 50 mL tube( PP/HD-PE, 20,000 xg, IVD/CE, ADR, DNA/DNase-/RNase-free, non-cytotoxic, pyrogen free, Sterile) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 62.547.254 | 50 mL tube |
| Alexa Fluor 555 Donkey anti-rabbit IgG (H+L) | Invitrogen, Thermo Fisher | Lot: 2387458 (Cat # A31572) | |
| Alexa Fluor 647 donkey-anti mouse IgG (H+L) | Invitrogen, Thermo Fisher | Lot: 2420713 (Cat#A31571) | |
| ARIA 3 | BD | FACS, Core facility Aarhus University | |
| Centrifuge 5810 | eppendorf | EP022628188 | Centrifuge |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 488 dye | Invitrogen, Thermo Fisher | Lot: 2387287 (Cat# C10337) | Cell Proliferation Kit |
| Collagen from calf-skin | Bioreagent, Sigma Aldrich | Source: SLCK6209 (Cat# C8919) | |
| Collagenase type II | Worthington, Fisher Scientific | Lot: 40H20248 (cat# L5004177 ) | Collagenase |
| Dispase | Gibco, Fisher Scientific | Lot: 2309415 (cat# 17105-041 ) | Dispase |
| Donkey serum (non-sterile) | Sigma Aldrich, Merck | Lot: 2826455 (Cat# S30-100mL) | |
| Dumont nr. 5, 110 mm | Dumont, Hounisen Laboratorieudstyr A/S | 1606.327 | Straight forceps with fine tips |
| Dumont nr. 7, 115 mm | Dumont, Hounisen Laboratorieudstyr A/S | 1606.335 | Curved forceps |
| F-10 Nutrient mixture (Ham) (1x), +L-glutamine | Gibco, Fisher Scientific | Lot. 2453614 (cat# 31550-023) | |
| FITC anti-mouse CD31 | BioLegend, NordicBioSite | MEC13.3 (Cat # 102506) | |
| FITC Anti-mouse CD45 | BioLegend, NordicBioSite | 30-F11 (Cat# 103108) | |
| Glacial acetic acid (100%) | EMSURE, Merck | K44104563 9Cat # 1000631000) | |
| Head over head mini-tube rotator | Fisher Scientific | 15534080 (Model no. 88861052) | Head over head mini-tube rotator |
| Horse serum | Gibco, Fisher Scientific | Lot. 2482639 (cat# 10368902 ) | |
| Isotemp SWB 15 | FisherBrand, Fisher Scientific | 15325887 | Shaking water bath |
| MS2 mini-shaker | IKA | Vortex unit | |
| Needle 20 G (0.9 mm x 25 mm) | BD microlance, Fisher Scientific | 304827 | 20G needle |
| Neutral formalin buffer 10% | CellPath, Hounisen Laboratorieudstyr A/S | Lot: 03822014 (Cat # HOU/1000.1002) | |
| Non-pyrogenic cell strainer (40 µM) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 83.3945.040 | Cell strainer |
| Pacific Blue anti-mouse Ly-6A/E (Sca-1) | BioLegend, NordicBioSite | D7 (Cat# 108120) | |
| Pax7 primary antibody | DSHB | Lot: 2/3/22-282ug/mL (Cat# AB 528428) | |
| PBS 10x powder concentrate | Fisher BioReagents, Fisher Scientific | BP665-1 | |
| PE/Cy7 anti-mouse CD106 (VCAM1) | BioLegend, NordicBioSite | 429 (MVCAM.A) (Cat # 105720) | |
| Pen/strep | Gibco, Fisher Scientific | Lot. 163589 (cat# 11548876 ) | |
| Pipette tips p10 | Art tips, self sealing barrier, Thermo Scientific | 2140-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p1000 | Art tips, self sealing barrier, Thermo Scientific | 2279-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p20 | Art tips, self sealing barrier, Thermo Scientific | 2149P-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p200 | Art tips, self sealing barrier, Thermo Scientific | 2069-05 | Low retention, pre-sterilized, filter tips |
| Protective underpad | Abena | ACTC-7712 | 60 x 40cm, 8 layers |
| Rainin, pipet-lite XLS | Mettler Toledo, Thermo Scientific | 2140-05, 2149P-05, 2279-05, 2069-05 | Pipettes (P10, P20, P200, P1000) |
| Recombinant anti-PDGFR-alpha | RabMAb, abcam | AB134123 | |
| Scalpel (shaft no. 3) | Hounisen, Hounisen Laboratorieudstyr A/S | 1902.502 | Scalpel |
| Scalpel blade no. 11 | Heinz Herenz, Hounisen Laboratorieudstyr A/S | 1902.0911 | Scalpel |
| Scanlaf mars | Labogene | class 2 cabinet: Mars | Flow bench |
| ScanR | Olympus | Microscope, Core facility Aarhus University | |
| Scissors | FST | 14568-09 | |
| Series 8000 DH | Thermo Scientific | 3540-MAR | Incubator |
| Serological pipette 10 mL | VWR | 612-3700 | Sterile, non-pyrogenic |
| Serological pipette 5 mL | VWR, Avantor delivered by VWR | 612-3702 | Sterile, non-pyrogenic |
| Syringe 5 mL, Luer tip (6%), sterile | BD Emerald, Fisher Scientific | 307731 | Syringe |
| TC Dish 100, standard | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 83.3902 | Petri dish |
| Tissue Culture (TC)-treated surface, black polystyrene, flat bottom, sterile, lid, pack of 20 | Corning, Sigma Aldrich | 3764 | 96-well Half bottom plate |
| Triton X-100 | Sigma Aldrich, Merck | Source: SLCJ6163 (Cat # T8787) |
Referências
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9 (2), 493-495 (1961).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692 (2021).
- Cheung, T. H., Rando, T. A. Molecular regulation of stem cell quiescence. Nature Reviews. Molecular Cell Biology. 14 (6), 329-340 (2013).
- Kann, A. P., Hung, M., Krauss, R. S. Cell-cell contact and signaling in the muscle stem cell niche. Current Opinion in Cell Biology. 73, 78-83 (2021).
- Tedesco, F. S., Dellavalle, A., Diaz-Manera, J., Messina, G., Cossu, G. Repairing skeletal muscle: regenerative potential of skeletal muscle stem cells. Journal of Clinical Investigation. 120 (1), 11-19 (2010).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Lepper, C., Partridge, T. A., Fan, C. -. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Joe, A. W. B., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Uezumi, A., Fukada, S. -. I., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Seale, P., Sabourin, L. A., Girgis-Gabardo, A., Mansouri, A., Gruss, P., Rudnicki, M. A. Pax7 Is Required for the Specification of Myogenic Satellite Cells. Cell. 102 (6), 777-786 (2000).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- Fukada, S. -. I., et al. Molecular signature of quiescent satellite cells in adult skeletal muscle. Stem Cells. 25 (10), 2448-2459 (2007).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Joe, A., Wang, J., Rossi, F. Prospective isolation of adipogenic progenitors from skeletal muscle. Journal of Investigative Medicine. 55 (1), 124 (2007).
- Yi, L., Rossi, F. Purification of progenitors from skeletal muscle. Journal of Visualized Experiments. (49), e2476 (2011).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119 (4), 543-554 (2004).
- Montarras, D., et al. Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Conboy, M. J., Cerletti, M., Wagers, A. J., Conboy, I. M. Immuno-analysis and FACS sorting of adult muscle fiber-associated stem/precursor cells. Methods In Molecular Biology. 621, 165-173 (2010).
- de Morree, A., et al. Alternative polyadenylation of Pax3 controls muscle stem cell fate and muscle function. Science. 366 (6466), 734-738 (2019).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental Biology. 397 (1), 31-44 (2015).
- Mookhtiar, K., Randall Steinbrink, D., Van Wart, H. E. Mode of hydrolysis of collagen-like peptides by class I and class II Clostridium histolyticum collagenases: evidence for both endopeptidase and tripeptidylcarboxypeptidase activities. Biochemistry. 24 (23), 6527-6533 (1985).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. The Journal of Investigative Dermatology. 93 (2), 287-290 (1989).
- Baghdadi, M. B., et al. Reciprocal signalling by Notch-Collagen V-CALCR retains muscle stem cells in their niche. Nature. 557 (7707), 714-718 (2018).
- van Velthoven, C. T. J., de Morree, A., Egner, I. M., Brett, J. O., Rando, T. A. Transcriptional profiling of quiescent muscle stem cells in vivo. Cell Reports. 21 (7), 1994-2004 (2017).
- Machado, L., et al. In situ fixation redefines quiescence and early activation of skeletal muscle stem cells. Cell Reports. 21 (7), 1982-1993 (2017).
- Machado, L., et al. Tissue damage induces a conserved stress response that initiates quiescent muscle stem cell activation. Cell Stem Cell. 28 (6), 1125-1135 (2021).
- vanden Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Moore, D. K., Motaung, B., du Plessis, N., Shabangu, A. N., Loxton, A. G. SU-IRG consortium isolation of B-cells using Miltenyi MACS bead isolation kits. PloS One. 14 (3), 0213832 (2019).
- Liou, Y. -. R., Wang, Y. -. H., Lee, C. -. Y., Li, P. -. C. Buoyancy-activated cell sorting using targeted biotinylated albumin microbubbles. PloS One. 10 (5), 0125036 (2015).
- Brett, J. O., et al. Exercise rejuvenates quiescent skeletal muscle stem cells in old mice through restoration of Cyclin D1. Nature Metabolism. 2 (4), 307-317 (2020).
- Tabula Muris Consortium. A single-cell transcriptomic atlas characterizes ageing tissues in the mouse. Nature. 583 (7817), 590-595 (2020).
- de Morrée, A., et al. Staufen1 inhibits MyoD translation to actively maintain muscle stem cell quiescence. Proceedings of the National Academy of Sciences. 114 (43), 8996-9005 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados