Method Article
개별 골격근에서 정지 줄기 세포 집단의 분리
요약
이 프로토콜은 마우스의 개별 골격근에서 근육 줄기 세포와 섬유 지방 생성 전구체의 분리를 설명합니다. 이 프로토콜에는 단일 근육 해부, 형광 활성화 세포 분류에 의한 줄기 세포 분리, 면역형광 염색에 의한 순도 평가, 5-ethynyl-2'-deoxyuridine 혼입 분석에 의한 S상 진입의 정량적 측정이 포함됩니다.
초록
골격근은 조직의 항상성과 복구에 기여하는 뚜렷한 성체 줄기 세포 집단을 가지고 있습니다. 골격근 줄기 세포(MuSC)는 새로운 근육을 만드는 능력이 있는 반면, 섬유 지방 생성 전구세포(FAP)는 기질 지지 조직에 기여하고 섬유아세포와 지방 세포를 만드는 능력이 있습니다. MuSC와 FAP는 모두 정지라고 하는 장기간의 가역적 세포 주기 종료 상태에 있습니다. 정지 상태는 기능의 핵심입니다. 정지 줄기 세포는 일반적으로 단일 샘플에 함께 모인 여러 근육 조직에서 정제됩니다. 그러나 최근 연구에서는 다른 근육에서 분리된 MuSC의 분자 프로파일과 정지 깊이에서 뚜렷한 차이가 있음이 밝혀졌습니다. 현재 프로토콜은 개별 골격근에서 MuSC 및 FAP의 분리 및 연구를 설명하고 줄기 세포 활성화의 분자 분석을 수행하기 위한 전략을 제시합니다. 횡격막, 삼두근, 그라실리스, 전경골근(TA), 비복근(GA), 가자미근, 장신근(EDL) 및 교근과 같은 다양한 발달 기원, 두께 및 기능의 근육을 분리하고 소화하는 방법을 자세히 설명합니다. MuSC 및 FAP는 형광-활성화 세포 분류 (FACS)에 의해 정제되고, 면역형광 염색 및 5-에티닐-2'-데옥시우리딘 (EdU) 혼입 분석에 의해 분석된다.
서문
골격근은 근육 줄기 세포(MuSC)의 존재로 인해 재생 능력이 높습니다. MuSC는 기저층 아래의 근섬유에 위치하며 1,2,3,4번 출구로 나오는 장기간의 가역적 세포 주기의 정지 상태에 있습니다. 손상 시 MuSC는 활성화되고 세포 주기에 들어가 분화 및 융합하여 새로운 근섬유를 형성할 수 있는 증폭 전구체를 생성합니다 2,5. 이전 연구에서는 MuSC가 근육 재생에 절대적으로 필수적이라는 것을 보여주었습니다 6,7,8. 또한, 단일 MuSC는 새로운 줄기세포와 새로운 근섬유를 생착시켜 생성할 수 있다9. 골격근은 또한 섬유 지방 생성 전구 세포 (FAPs)라고 불리는 중간 엽 기질 세포 집단을 보유하고 있으며, 이는 근육 재생동안 MuSC 기능을 지원하는 데 중요한 역할을합니다 6,10,11,12.
근육 재생을 조정할 수 있는 잠재력으로 인해 MuSC와 FAP의 작동 방식을 이해하는 데 엄청난 관심이 있었습니다. 정지 MuSC는 전사 인자 Pax7 및 Sprouty1 및 세포 표면 단백질 칼시토닌 수용체의 발현으로 표시되는 반면, 정지 FAP는 세포 표면 단백질 혈소판 유래 성장 인자 수용체 알파(PDGFRa)10,12,13,14,15에 의해 표시됩니다. 이전 연구에서는 MuSC 및 FAP가 세포 표면 마커 및 형광 활성화 세포 분류(FACS)9,15,16,17,18,19,20,21을 사용하여 골격근에서 정제될 수 있음을 보여주었습니다. 이러한 프로토콜은 MuSC 및 FAP를 연구하는 능력을 크게 향상시켰지만 한 가지 단점은 이러한 프로토콜의 대부분이 서로 다른 근육 조직 풀에서 MuSC를 분리해야 한다는 것입니다. 우리와 다른 사람들의 최근 연구는 다른 조직에서 분리된 MuSC 간의 세포 표현형과 유전자 발현 수준의 차이를 밝혀냈습니다22,23. 횡격막, 삼두근 및 흉근의 MuSC는 하부 뒷다리 근육의 MuSC보다 빠른 활성화를 보이는 반면(22), 외안근의 MuSC는 횡격막과 하부 뒷다리 근육의 MuSC보다 더 빠른 분화를 보인다23.
이 프로토콜은 개별 골격근에서 MuSC 및 FAP의 분리를 설명합니다(그림 1). 여기에는 횡격막, 삼두근, 그라실리스, 전경골근(TA), 가자미근, 장신근(EDL), 비복근(GA) 및 교근의 박리가 포함됩니다. 해부된 근육은 콜라게나제 II(콜라겐의 Pro-X-Gly-Pro 아미노 서열을 특이적으로 표적으로 하여 결합 조직의 분해 및 조직 해리를 가능하게 하는 프로테아제)와 디스파아제(피브로넥틴과 콜라겐 IV를 절단하여 추가 세포 해리를 가능하게 하는 프로테아제)를 사용하는 효소 분해에 의해 해리됩니다25). MuSC 및 FAP는 FACS에 의해 단일 세포 현탁액으로부터 분리된다. 세포 분석을 위한 다운스트림 분석의 예로, 줄기 세포 활성화는 5-ethynyl-2'-deoxyuridine(EdU) 혼입을 분석하여 측정하고, 세포 순도는 세포 유형 특이적 마커인 Pax7 및 PDGFRa에 대한 면역형광 염색으로 측정합니다.
프로토콜
본 프로토콜은 오르후스 대학교의 동물 관리 지침 및 지역 윤리 규정에 따라 수행되었습니다.
알림: 동물 실험 및 사후 설치류 샘플 취급에 대한 지역 윤리 위원회의 규정을 준수해야 합니다. 마우스는 알레르겐의 잠재적 공급원입니다. 가능한 경우 배기 환기를 켜고 알레르겐에 과도하게 노출되지 않도록 작업 공간 위에 놓으십시오. 또는 실험이 정기적으로 수행되는 경우 안면 마스크를 착용하십시오. 이 프로토콜에는 날카로운 물건 작업이 포함되며 연구원은 절단 시 응급 처치를 적용하기 위한 절차와 물류를 숙지하는 것이 좋습니다.
1. 준비 (1-2 시간, 해부 전날)
알림: 용액, 플레이트 및 배지는 달리 명시되지 않는 한 사용 전에 멸균 조건에서 준비되고 여과(0.45μm)됩니다. dispaase(PBS에서 11U/mL) 및 collagenase II(PBS에서 1.000U/mL)의 저장 용액을 준비하고 -20°C에서 보관합니다(표 1). 스톡은 해동되어 4.2.6 단계에서 2 차 소화에 사용됩니다.
- 96웰 반면적 플레이트의 콜라겐 코팅
- 산성 물을 준비하십시오. 5.15L 비커에 있는 895mL의 오토클레이브된 물에 2mL의 빙초산을 추가합니다.
- 0.45 μm, 500 mL 필터 유닛을 사용하여 용액을 여과한다. 여과된 산성수 800mL를 1L 병에 옮깁니다.
- 40mL의 멸균 콜라겐 원액을 병에 추가합니다. 용액을 소용돌이 치면서 부드럽게 혼합하고 사용할 때까지 빛으로부터 보호되는 4 °C에서 보관하십시오.
- 하나 이상의 96웰 반면적 플레이트에 콜라겐을 코팅합니다. 50 μL의 콜라겐 코팅 용액을 각 웰에 첨가하고 플레이트를 4°C에서 밤새 코팅합니다(ON).
- 다음 날 진공 기반 흡인물을 사용하여 콜라겐 용액을 흡인하고 100μL의 오토클레이브된 물을 첨가하고 흡인하여 플레이트를 2배 세척합니다.
- 플레이트의 뚜껑을 기울이고 플레이트를 후드에서 20-30분 동안 건조시킵니다.
- 플레이트가 완전히 건조되면 알루미늄 호일로 싸서 사용할 때까지 4 °C에서 보관하십시오. 코팅된 플레이트는 최대 4주 동안 보관할 수 있습니다.
참고: 콜라겐 코팅은 세포 접착을 가능하게 합니다. 유리 콜라겐은 세포 기능과 신호 전달(예: MuSC의 칼시토닌 수용체에 콜라겐 V의 결합)을 방해할 수 있으므로 씻어내는 것이 중요합니다.26.
2. 준비 (0.5 시간, 해부 당일) :
- 추가 솔루션 및 작업 공간 준비
- 50mL의 HAM의 F545 배지에 말 혈청 5mL와 펜/연쇄상 구균 445mL를 추가하여 멸균 세척 배지를 준비합니다. 오염을 방지하기 위해 층류 후드에서 작업하십시오.
- 해리 완충액을 제조하는 데 필요한 콜라게나제 II의 적절한 양을 계산하고 무게를 잰다. (각 마우스에 대해 26,000 단위의 콜라게나제 II를 사용하여 650 U/mL 콜라게나제 II에서 40 mL의 해리 완충액을 만듭니다.) 칭량된 분말을 50mL 원뿔형 튜브에 넣고 얼음에 보관합니다.
- 근육 격리를 위해 10cm 접시 2 개를 준비하십시오. 세척 배지 3mL(표 1)를 각 페트리 접시에 붓습니다. 나중에 사용할 수 있도록 10cm 접시를 층류 후드 외부로 가져옵니다.
- 근육 소화를위한 재료를 준비하십시오. 샘플 수에 따라 적절한 수의 50mL 원뿔형 튜브(마우스당 8개, 각 근육당 하나씩)에 라벨을 붙이고 벤치에 둡니다. 바늘, 10mL 주사기 및 40μm 세포 여과기에 70% 에탄올(마우스당 8개, 근육당 1개)을 분사하고 층류 후드 내부로 가져옵니다. 주사기에 바늘을 부착하십시오.
- 정렬 할 재료를 준비하십시오. 샘플 수에 따라 셀 스트레이너 캡이 있는 5mL 둥근 바닥 튜브에 라벨을 붙입니다. 튜브를 알루미늄 호일로 덮고 층류 후드에 그대로 두십시오.
- 분류되는 샘플 및 집단의 수에 따라 세포 수집을 위한 500μL의 세척 배지가 있는 1.5mL 미세 원심분리기 튜브를 준비합니다(마우스당 16개, 근육 조직당 각 세포 집단당 튜브 1개). 이 튜브를 얼음에 보관하십시오.
3. 근육 해부 (20-30 분)
알림: 프로토콜의 이 섹션은 비멸균 환경에서 수행됩니다. 절차는 하나 또는 여러 개의 마우스를 사용하여 수행 할 수 있습니다. 그러나 하나의 마우스는 정렬을 위한 샘플과 보정 및 FACS 게이트 설정을 위한 제어를 모두 준비하기에 충분합니다.
- 근육 격리 시작
- 해부 및 근육 격리를 위해 비멸균 작업 공간을 준비합니다. 70% 에탄올로 워크스테이션을 소독합니다. 워크스테이션에 멸균 보호용 일회용 언더패드를 놓습니다.
- 영구 마커를 사용하여 페트리 접시 뚜껑 위에 각 근육에 대한 상자를 그려 나중에 분리 된 근육을 배치합니다.
- 수술 기구에 70% 에탄올을 뿌립니다.
- CO2 흡입 및/또는 자궁경부 탈구로 마우스를 안락사시킵니다.
- 개별 근육을 분리하십시오 (여러 마우스를 사용하는 경우 한 번에 한 마우스에서). 마우스에 70 % 에탄올을 뿌려 모피를 적시고 피부를 소독하십시오. 복부가 위를 향하도록 마우스를 언더패드에 놓습니다. 8개의 근육과 각각의 해부학적 위치에 대한 개요가 그림 2A에 나와 있습니다.
- gracilis 근육 분리
- 가위를 사용하여 복부 피부에 0.5cm 수평으로 절개하십시오.
- 피부 제거: 양손으로 엄지와 검지를 사용하여 절개 부위의 위쪽과 아래쪽 부분을 잡습니다. 절개 부위의 양쪽을 당겨 몸통과 하지의 피부를 찢고 나눕니다. 하지의 피부를 아래로 당겨 양쪽 뒷다리(엉덩이에서 발가락까지 아래로)를 노출시킵니다. 마찬가지로 몸통을 노출시키기 위해 위로 당깁니다.
- gracilis 근육 (허벅지 안쪽)을 찾습니다. 구부러진 집게를 사용하여 그라실리스를 잡고 근육을 약간 들어 올립니다(그림 2B). 가위로 0.5cm 절개 (그림 2C)를하여 그레이 실리스를 잘라내어 완전히 분리합니다 (그림 2D). 다른 쪽 다리에 대해 이 작업을 반복하여 두 번째 그라실리스 근육을 분리합니다.
- TA 및 EDL 근육 분리(하부 뒷다리, 복부 쪽)
- 메스를 사용하여 경골 (가장 두꺼운 하부 뒷다리 뼈)의 측면을 따라 0.5cm 절개하여 근막을 자릅니다. 구부러진 집게를 사용하여 근막을 잡고 당겨서 제거합니다.
알림: 근막이 완전히 제거되면 뒷다리 말단부의 힘줄이 보이고 분리될 수 있습니다. - 극세 팁이 있는 직선 집게를 사용하여 TA의 원위 힘줄(경골의 측면)과 EDL(TA 아래) 사이로 들어갑니다(그림 2E-G).
알림: 경험이 있으면 직선 집게 대신 메스 날의 뭉툭한 끝을 사용할 수 있습니다. - 집게를 근육의 근위 끝으로 밀어 근육을 분리합니다.
- 직선 집게를 말단부로 다시 가져옵니다. 말단 힘줄을 자릅니다.
- 구부러진 집게로 근육의 말단 힘줄을 부드럽게 잡습니다. 근위 부착 부위 위로 근육을 들어 올리고 근위 힘줄을 부착 지점에 최대한 가깝게 조심스럽게 자릅니다. 다른 쪽 끝을 자르고 TA를 페트리 접시에 옮깁니다.
- EDL의 말단 힘줄 아래로 가기 위해 극세 팁이 있는 직선 집게를 사용하십시오.
- 집게를 근육의 근위 끝으로 밀어 근육을 분리합니다.
- 직선 집게를 말단부로 다시 가져옵니다. 근육을 손상시키지 않고 원위 힘줄을 자릅니다.
- 구부러진 집게로 EDL의 말단 힘줄을 부드럽게 잡습니다. 근위 부착 부위 위로 근육을 들어 올리고 근위 힘줄을 부착 지점에 최대한 가깝게 조심스럽게 자릅니다. 다른 쪽 끝을 자르고 EDL을 페트리 접시에 옮깁니다. 다른 뒷다리에 대해 반복하여 두 번째 TA 및 EDL 근육을 분리합니다.
- 메스를 사용하여 경골 (가장 두꺼운 하부 뒷다리 뼈)의 측면을 따라 0.5cm 절개하여 근막을 자릅니다. 구부러진 집게를 사용하여 근막을 잡고 당겨서 제거합니다.
- GA와 가자미근 분리 (하부 뒷다리, 등쪽)
- 아킬레스건과 하부 뒷다리 뼈 사이로 들어가기 위해 극세 팁이 있는 직선 집게를 사용합니다.
- 집게를 근육의 근위 끝으로 밀어 근육을 분리합니다.
- 직선 집게를 말단부로 다시 가져옵니다. 말단 힘줄을 자릅니다.
알림: GA 아래에 있는 가자미근의 손상을 방지하기 위해 원위 아킬레스건 부착물에 최대한 가깝게 절단하여 GA에 부착된 힘줄 덩어리를 남깁니다(그림 2H). - 가자미근을 드러내고 분리하려면 GA를 비골(하부 뒷다리에 있는 두 뼈 중 가장 얇은 뼈) 위로 당깁니다.
참고: 가자미근은 GA에 비해 특징적인 짙은 빨간색으로 구별됩니다(그림 2I). - 근위 가자미근 힘줄을 찾습니다. 스트레이트 포셉으로 가자미근과 GA 사이로 들어갑니다.
- 집게를 근육의 말단부로 움직여 가자미근과 GA를 분리합니다.
- 먼저 가자미근을 분리하십시오. 근위 힘줄을 자르고 구부러진 집게로 힘줄을 잡고 가자미근을 조심스럽게 들어 올려 말단 힘줄에 접근합니다. GA에서 가자미근을 분리하기 위해 원위 힘줄을 자릅니다. 세척 매체가 있는 페트리 접시에 가자미근을 넣습니다(그림 2J)
- GA를 잘라 페트리 접시에 담습니다. 다른 쪽 다리에 대해 이 작업을 반복하여 두 번째 가자미근과 GA 근육을 분리합니다.
- 삼두근 근육 분리 (앞다리 윗부분, 등쪽)
- 삼두근과 상완골(상완골의 주골) 사이로 들어가기 위해 극세 팁이 있는 직선 집게를 사용합니다(그림 2K-M).
- 집게를 근육의 근위 끝으로 밀어 근육을 분리합니다. 근육의 근위 끝을 자릅니다.
- 구부러진 집게로 삼두근의 근위 끝을 잡고 팔꿈치 위로 당겨 원위 힘줄에 접근합니다. 삼두근의 원위 힘줄을 자르고 근육을 페트리 접시에 옮기고 다른 앞다리에 대한 절차를 반복하십시오.
- 교근 분리
- 턱에서 모피와 피부를 제거하십시오. 가위로 0.5cm의 수평 절개를하십시오. 양손을 사용하여 엄지와 검지로 절개 부위의 양쪽을 꼬집습니다. 위아래로 당겨 피부를 제거합니다.
- 교근의 주요 힘줄(꼬리, 눈 아래)을 찾습니다. 납작한 메스 칼날을 뼈와 근육 사이에 삽입합니다(그림 2N). 힘줄을 자릅니다.
- 구부러진 집게로 주요 교근 힘줄을 잡습니다. 메스 날이나 가위로 방향으로 잘라 교근을 턱뼈에서 분리합니다(그림 2O, P). 분리된 교근을 페트리 접시에 넣습니다. 두 번째 교근에 대해 절차를 반복하십시오.
- 횡격막 근육 분리
알림: 횡격막 근육을 분리할 때 내부 장기와 내장이 오염원이 되지 않도록 조심스럽게 절단해야 합니다.- 가위를 사용하여 흉골 중앙(갈비뼈를 연결하는 가슴 중앙에 위치한 길고 납작한 뼈)에 개흉술(갈비뼈 사이 절개)을 하고 흉골을 자릅니다(그림 2Q).
- 흉곽을 통해 360° 절단하여 다이어프램을 노출시킵니다.
- 상체와 하체/복부를 분리합니다. 가위를 사용하여 기관, 식도, 대정맥 및 복부 대동맥을 자릅니다.
- 다이어프램을 하체에서 분리하십시오. 가위를 사용하여 흉골 아래 1cm에 개복술(복강 내 외과적 절개)을 하고 360° 절단합니다(그림 2R).
- 흉곽과 복부 장기 사이에 닫힌 가위를 놓고 아래로 누릅니다. 흉곽을 부드럽게 당겨 복부 장기에서 분리합니다(그림 2S).
- 흉곽에서 다이어프램을 분리합니다. 두 손가락 사이에 다이어프램을 느슨하게 잡고 가위로 흉곽을 자릅니다. 가위를 사용하여 다이어프램을 360° 절단으로 갈비뼈에 최대한 가깝게 자릅니다. 분리된 다이어프램을 페트리 접시에 넣습니다.
알림: 경추 탈구 중에 횡격막이 파열되어 흉곽에 부딪혀 위치를 찾기 어려울 수 있습니다. 근육은 여전히 고립 될 수 있습니다. 무너진 근육을 확인하고 두 손가락 사이에 잡고 흉곽을 따라 360° 자릅니다.
4. 단세포 현탁액으로의 근육 소화 (~ 1 시간 35 분)
알림: 다음 단계에는 비멸균(4.1-4.2단계) 및 멸균 작업 환경(4.3단계)이 포함됩니다.
- 기계적 소화
- 분리 된 근육을 10cm 페트리 접시의 뚜껑에 놓습니다.
- 구부러진 집게를 사용하여 고립 된 근육을 하나씩 잡습니다. 가자미근과 GA의 경우 아킬레스건의 나머지 부분을 제거합니다.
- 가위를 사용하여 분리된 근육을 약 1mm3 개로 잘라 하나씩 다집니다.
- 효소 소화
- 칭량된 콜라게나제 II 분말(콜라게나제 II: 세척 매체 중 650U/mL)에 40mL의 냉간 세척 배지를 추가하여 근육 해리 완충액을 준비합니다.
알림: 최적의 효소 활성을 보장하기 위해 새로 준비된 근육 해리 완충액을 사용하십시오. - 다진 근육을 5mL의 해리 완충액이 들어 있는 15mL 원뿔형 튜브로 옮깁니다.
- 튜브를 60 rpm의 37°C 진탕 수조에서 35분 동안 인큐베이션한다.
- 배양 후, 세척 배지를 총 부피 15mL에 첨가한다. 튜브를 1,600 x g 에서 4°C에서 5분 동안 회전시킵니다.
- 진공 기반 흡인기(Aspirator)를 사용하여 상층액을 4mL 용량으로 흡인합니다. 펠릿을 방해하지 않으려면 위에서 천천히 흡인하고 떠 다니는 지방을 제거하십시오.
- dispase 및 collagenase II의 스톡 분취량을 해동합니다. 콜라게나제 II 용액 500μL(1,000U/mL 스톡, -20°C)를 나머지 4mL 샘플에 추가합니다. 다음으로, 500 μL의 디스파제 용액(11 U/mL 스톡, -20 °C)을 추가합니다.
참고: Dispase는 침전물을 생성할 수 있습니다. 이 경우 사용 1분 전에 디스파제 원액을 10,000 x g로 회전시키십시오. 펠릿을 방해하지 않고 이제 맑은 상청액을 세포 현탁액으로 옮깁니다. - 펠릿을 용해시키기 위해 샘플을 잠깐 소용돌이.
- 샘플을 60 rpm의 37°C 진탕 수조에서 20분 동안 인큐베이션한다.
참고: 많은 수의 근육 샘플을 소화하는 것은 시간이 많이 걸립니다. 4.3.1-4.3.6 단계의 경우 샘플당 2-5분이 소요될 것으로 추정합니다. 이 단계는 두 명 이상의 연구원이 병렬로 수행할 때 더 빨라집니다.
- 칭량된 콜라게나제 II 분말(콜라게나제 II: 세척 매체 중 650U/mL)에 40mL의 냉간 세척 배지를 추가하여 근육 해리 완충액을 준비합니다.
- 시료의 균질화
- 세포 현탁액을 균질화합니다. 현탁액을 15mL 튜브에서 50mL 튜브로 옮깁니다. 20G 바늘이 있는 10mL 주사기를 사용하여 바늘을 통해 샘플을 위아래로 5배 당겨 샘플을 재현탁합니다.
알림: 소화되지 않은 근육 조각이 바늘을 막히면 종이 티슈로 닦아냅니다. - 40μm 셀 스트레이너를 새 50mL 원뿔형 튜브에 놓습니다.
- 주사기에서 전체 세포 현탁액을 꺼내고 상단에 세포 여과기가 있는 새로운 50mL 원뿔형 튜브에 샘플을 변형시킵니다. 전체 부피를 필터에 직접 분배하여 샘플을 변형시킵니다.
- 모든 단핵구를 회수하려면 세척 배지 20mL를 빈 원뿔형 튜브에 넣고 세포 여과기를 통해 변형된 샘플이 들어 있는 50mL 원뿔형 튜브에 붓습니다. p1000 피펫으로 셀 스트레이너 아래에 남아 있는 부피를 회수합니다.
- 셀 스트레이너를 버리고 샘플을 1,600 x g 에서 4°C에서 5분 동안 회전시킵니다.
- p1000 피펫으로 피펫팅하여 펠릿을 방해하지 않고 상층액을 흡인합니다.
- p1000 피펫으로 피펫팅하여 다이어프램 펠릿을 세척 배지 500μL에 재현탁하고 다른 근육 샘플을 각각 세척 배지 300μL에 재현탁합니다.
참고: 횡격막은 줄기 세포 함량이 가장 높은 근육 중 가장 크므로 대조군 염색에 사용할 수 있습니다.
- 세포 현탁액을 균질화합니다. 현탁액을 15mL 튜브에서 50mL 튜브로 옮깁니다. 20G 바늘이 있는 10mL 주사기를 사용하여 바늘을 통해 샘플을 위아래로 5배 당겨 샘플을 재현탁합니다.
5. 염색 및 선별 (~40분 + 30분 분류/시료)
알림: 다음 단계를 위해 얼음 위의 무균 환경에서 작업하십시오.
- 다이어프램 세포 현탁액의 분취액 50μL를 대조군 염색을 위해 4개의 새로운 2mL 미세원심분리기 튜브에 옮깁니다(각각 50μL). 세척 배지 250 μL를 각 대조군 튜브에 최종 부피 300 μL까지 첨가한다.
- 3개의 대조군 염색 튜브에 3μL(1:100)의 형광 마이너스 항체(FMO-대조군)를 추가하고 항체 없이 하나의 튜브(염색되지 않은 대조군)를 남겨둡니다( 표 2 참조).
- 항체(VCAM1-PECy7, CD45-FITC, CD31-FITC 및 SCA1-PacificBlue)의 3μL(1:100)를 나머지 다이어프램 샘플을 포함한 나머지 근육 단일 세포 현탁액에 추가합니다.
- 세포 현탁액을 헤드-오버-헤드 쉐이커에서 4°C에서 15분 동안 인큐베이션한다.
참고: 대조 염색은 배경 형광 수준을 결정하고 유세포 분석을 위한 게이트를 설정하는 데 필요합니다. 서로 다른 항체를 사용할 수 있지만 각각은 테스트해야 하는 특정 작업 농도와 배양 시간을 갖습니다. 다른 공급업체의 항체를 사용하는 경우 농도와 희석이 다를 수 있습니다. 세포 생존율 염료를 염색 혼합물에 첨가하여 분류 중에 죽은 세포 또는 죽어가는 세포를 제거할 수 있습니다. - 샘플을 4°C에서 5분 동안 1,600 x g 로 회전시킵니다. 피펫팅으로 펠릿을 방해하지 않고 상청액을 버립니다.
- p1000 피펫으로 피펫팅하여 각 샘플을 세척 배지 800μL에 재현탁합니다.
- 세포 스트레이너 캡(40μm)이 있는 FACS 튜브를 사용하여 샘플을 여과하여 남아 있는 세포 덩어리(또는 응집체)를 제거합니다.
- 세척 배지 800 μL를 추가로 첨가하여 세포 여과기를 세척한다.
- 분석 될 때까지 샘플을 얼음 위에 알루미늄 호일로 덮으십시오.
참고: 이 시점에서 세포 농도가 높기 때문에 세포 현탁액이 흐리거나 조밀하게 나타나면 세척 배지 800μL를 추가하여 세포 밀도를 줄입니다. - 70μm 노즐로 FACS를 시작합니다.
- 염색되지 않은 대조군 및 FMO 대조군을 사용하여 게이팅 전략을 설정합니다: MuSC는 CD45-FITC, CD31-FITC 및 SCA1-PacBlue에 대해 음성이고 VCAM1-PECy7에 대해 양성입니다. FAP는 CD45-FITC, CD31-FITC, VCAM1-PECy7에 대해 음성이고 SCA1-PacBlue에 대해 양성입니다.
- 양방향 정렬을 사용하여 염색된 단일 세포 현탁액을 분류하고 MuSC 및 FAP를 500μL의 세척 배지가 들어 있는 별도의 수집 튜브에 수집합니다.
참고: 4개의 레이저(구성: 70μm 노즐, 405nm, 488nm, 561nm, 633nm)와 함께 FACS를 사용하면 선택한 형광단 조합에 형광 신호를 보정할 필요가 없습니다. 그러나 다른 유세포 분석기 또는 다른 형광단 조합을 사용하는 경우 보상을 위해 추가 단일 염색 대조 샘플을 사용하는 것이 좋습니다. 더 작은 근육(EDL, 가자미근, TA)에서 3,000 MuSC 및 5,000 FAP의 수율이 예상됩니다. 다른 더 큰 근육의 경우 20,000 MuSC 및 FAP의 수율이 예상됩니다. FACS 소프트웨어에 의해 나열된 이벤트 수는 수집 튜브의 실제 생존 세포 수와 다를 수 있습니다. 세포 번호는 혈구계를 사용하여 세포 계수를 통해 확인할 수 있습니다. - 분류된 셀을 1,600 x g 에서 4°C에서 5분 동안 스핀다운합니다. 피펫팅을 통해 세포 펠릿을 방해하지 않고 상층액을 흡인합니다.
- 세척 배지 100μL을 각 샘플에 추가하고 기포를 생성하지 않고 세포를 조심스럽게 재현탁합니다. 재현탁된 샘플 100μL를 콜라겐 코팅된 하프 영역 96웰 플레이트로 옮깁니다. 웰 당 1,000-3,000 세포를 플레이트합니다.
참고: 세포가 제대로 재현탁되지 않으면 세포가 덩어리로 서로 달라붙어 나중에 현미경 분석에 혼란을 줄 수 있습니다. - 현미경으로 세포를 검사하고 분포, 모양 및 크기를 확인합니다.
- 플레이트를 37°C, 5%CO2에서 인큐베이션한다. 세포는 2시간 이내에 부착됩니다.
참고: 유세포 분석(분류된 샘플의 분취량을 분류기에 로드하고 소수의 이벤트를 기록) 또는 도금된 세포의 항체 염색 후 현미경(Pax7은 마우스 MuSC에 대한 정의 마커, PDGFRa는 마우스 FAP에 대한 정의 마커)을 통해 수집된 세포 집단의 순도를 확인하는 것이 좋습니다. 아래 섹션 7에서 시작하는 것은 Pax7 및 PDGFRa 단백질 수준에 대한 세포 염색을 위한 프로토콜입니다.
6. EdU 혼입 분석
알림: 무균 상태에서 작업하고 다음 단계를 위해 파라포름알데히드(PFA)를 취급할 때 화학 흄 후드를 사용하십시오. EdU는 세포가 세포 주기의 S단계를 거치면서 DNA에 통합된 뉴클레오티드 유사체입니다. 고농도에서 돌연변이 유발 성입니다. EdU를 다룰 때는 항상 장갑을 착용하십시오. EdU 폐기물 처리에 대한 현지 지침을 확인하십시오.
- EdU 펄스(1일차)
- 신선한 세척 매체에 2x EdU의 작업 용액을 준비합니다.
- 세포가 있는 96웰 플레이트를 인큐베이터에서 꺼냅니다. 합류를 모니터링하기 위해 현미경으로 세포를 검사합니다. 층류 후드로 이동합니다.
- 피펫팅을 통해 플레이트에서 배지 50 μL를 제거합니다. 웰의 최종 부피가 100μL가 되도록 50μL의 2x EdU 작업 용액을 추가합니다.
- 세포를 37°C, 5%CO2에서 의도된 기간 동안 EdU의 존재 하에 배양한다.
알림: EdU 펄스의 타이밍과 지속 시간은 다를 수 있습니다. 평균적으로, 정지 MuSC는 첫 번째 세포 분열을 완전히 활성화하고 완료하는 데 2일이 걸린다19. EdU는 도금 직후 분류된 셀에 첨가할 수 있습니다.
- 고정(2일차)
참고: PFA는 발암 물질입니다. PFA는 항상 주의해서 다루십시오. PFA 취급 및 폐기물 처리에 대한 현지 규정을 숙지하십시오.- 세포가 있는 96웰 플레이트를 인큐베이터에서 꺼냅니다. 현미경으로 세포를 검사하고 플레이트를 흄 후드로 옮깁니다.
- 피펫팅을 통해 배지를 제거하고 각 웰에 4% PFA 50μL를 추가하여 세포를 고정합니다. 화학 흄 후드에서 실온(RT)에서 10분 동안 플레이트를 배양합니다.
- 피펫으로 PFA를 제거하고 적절한 폐기물 용기에 버리십시오.
- 모든 웰에 100 μL의 PBS를 첨가하여 세포를 세척한다. 피펫팅을 통해 PBS를 흡인하고 세척을 반복합니다. 세포를 100 μL의 PBS에 보관한다.
알림: 세포가 씻겨 나가는 것을 방지하려면 PBS를 천천히 피펫팅하여 웰 측면에 분배하십시오.
- EdU 라벨링
- PBS를 제거하고 PBS 중 0.5% Triton X-100 100 μL를 첨가하여 EdU 검출 전에 세포를 투과화합니다. 플레이트를 4°C에서 5분 동안 인큐베이션한다.
알림: Triton X-100은 계면활성제이며 피부 자극을 유발할 수 있습니다. 조심해서 다루고 항상 장갑을 사용하십시오. - 5분 후 Triton X-100을 흡인하고 PBS 100μL를 추가합니다.
- 제조업체의 프로토콜에 따라 EdU 클릭-화학 반응 혼합물을 준비합니다.
- PBS를 흡인하고 EdU 클릭-화학 반응 혼합물 33μL를 추가합니다. RT에서 30분 동안 플레이트를 배양합니다.
- EdU 클릭-화학 반응 혼합물을 흡인하고 100 μL의 PBS로 세포를 세척합니다.
- PBS를 흡인하고, Hoechst(1:2,000)로 PBS 100μL를 첨가하고, RT에서 10분 동안 빛으로부터 보호하여 배양합니다.
- Hoechst를 흡인하고 PBS 100μL를 추가하여 두 번 세척합니다. 세포를 어둠 속에서 4°C에서 100 μL의 PBS에 보관한다.
- 도립 현미경으로 세포를 이미지화합니다. 세포는 우물이 마르지 않는 한 몇 달 동안 어둠 속에 보관할 수 있습니다.
참고: 항체와 세포를 공동 염색할 수 있습니다. 이 경우 차단 단계를 진행한 후 1차 항체와 함께 배양합니다. 방출 스펙트럼이 EdU 검출에 사용되는 형광단의 방출 스펙트럼과 겹치지 않는 접합 형광단을 가진 2차 항체를 선택합니다. Hoechst의 스펙트럼 범위와 겹치는 형광단을 가진 2차 항체를 사용하지 마십시오.
- PBS를 제거하고 PBS 중 0.5% Triton X-100 100 μL를 첨가하여 EdU 검출 전에 세포를 투과화합니다. 플레이트를 4°C에서 5분 동안 인큐베이션한다.
7. 면역형광염색
참고: 프로토콜의 이 부분은 섹션 6과 독립적으로 수행할 수 있습니다. 섹션 6을 건너뛸 때 아래 6.3.1단계를 계속하기 전에 6.3.2단계 및 7.2단계를 수행하여 세포 투과화를 활성화하십시오.
- EdU 표지된 세포가 들어 있는 플레이트를 꺼냅니다.
- 18mL의 PBS에 2mL의 당나귀 혈청을 첨가하여 20mL의 블로킹 완충액을 준비합니다.
- 비특이적 항체 결합을 방지하기 위해 각 웰에서 PBS 100μL를 제거하고 p200 피펫으로 블로킹 완충액 50μL를 추가합니다. 플레이트를 RT에서 30분 동안 인큐베이션하고, 빛으로부터 보호하고, 형광단으로 표지된 EdU의 광표백을 방지하기 위해 알루미늄 호일로 덮습니다.
알림: 셀은 웰 바닥에 고정되어 있지만 피펫팅 시 너무 많은 힘을 가하면 분리될 수 있습니다. - 샘플을 차단하면서 1차 항체 혼합물을 준비합니다. 8.0μL(1:100)의 마우스 항-Pax7 및 토끼 항-PDGFRa를 800μL의 차단 완충액에 추가하여 16개의 웰(8개 조직, 2개의 세포 유형)을 염색합니다.
- 차단 후, 당나귀 혈청을 제거하고 50 μL의 1차 항체 혼합물을 각 웰에 첨가한다. 플레이트를 알루미늄 호일로 덮고 4°C에서 밤새 인큐베이션합니다.
- 인큐베이션 후, 1차 항체를 제거하고 50 μL의 트리톤(PBS 중 0.5%)을 각각의 웰에 첨가한다. 플레이트를 빛으로부터 보호된 RT에서 5분 동안 인큐베이션하여, 결합되지 않은 항체를 씻어낸다. 세탁을 세 번 반복하십시오.
- 1,000μL의 차단 완충액이 들어 있는 미세 원심분리기 튜브에 당나귀 항쥐-Alexa647 및 당나귀 항-토끼-Alexa555 1.0μL(1:1,000)를 추가하여 2차 항체 마스터 믹스를 준비합니다.
- 33 μL의 2차 항체 마스터 믹스를 각 웰에 추가합니다. 플레이트를 빛으로부터 보호되는 RT에서 60분 동안 인큐베이션한다.
- 피펫팅으로 과량의 2차 항체를 제거하고 50μL의 트리톤(PBS 중 0.1%)을 첨가하고 빛으로부터 보호된 RT에서 5분 동안 배양합니다. 세탁을 세 번 반복하십시오.
- 마지막으로 PBS 100μL를 추가합니다. 냉각된 CCD 카메라와 함께 도립 형광 현미경을 사용하여 플레이트를 즉시 이미지화할지 아니면 플레이트 가장자리를 파라필름으로 밀봉하고 밀봉된 플레이트를 알루미늄 호일로 싸서 나중에 분석할 때까지 플레이트를 4°C에서 보관할지 결정합니다.
결과
개별 골격근 분리를 위한 프로토콜(그림 2)에 따라 그라실리스, TA, EDL, GA, 가자미근, 삼두근, 교근 및 횡격막 근육을 지역 육종 프로그램에서 중단된 3마리의 스위스 수컷 이종 교배 마우스에서 분리했습니다(그림 2). 조직 해리 및 항체 염색에 이어 개별 근육의 MuSC 및 FAP를 FACS로 정제했습니다(그림 3). 염색되지 않은 샘플로 초기 게이팅을 얻어 세포를 식별하고 이중선에서 싱글렛을 분리했습니다(그림 3A). 염색 역치를 식별하기 위해 FMO 대조군을 사용하여 후속 게이트를 설정했습니다(그림 3B). 그런 다음 염색된 샘플을 CD31/CD45-FITC 및 Sca1-PacBlue에 대해 게이팅했습니다. SCA1+/CD31-/CD45- 모집단(FAP)은 별도의 수집 튜브로 분류되었고, 이중 음성 모집단은 VCAM1-PECy7 및 순방향 산란(FSC)에 대해 게이트 및 플로팅되었습니다. VCAM1+ 모집단(MuSC)을 별도의 수집 튜브로 분류했습니다. MuSC 및 FAP를 싱글렛의 백분율로 정량화하고(표 3) 500μL의 세척 배지를 포함하는 별도의 수집 튜브로 분류했습니다. 횡격막 및 삼두근 근육 단세포 현탁액은 FAP보다 MuSC의 상대적 풍부도가 더 높은 반면, 다른 단일-세포 현탁액은 MuSC보다 FAP의 상대적 풍부도가 더 높습니다(표 3).
분류된 세포 중 1,000-3,000개의 세포를 시딩하고 24시간 동안 배양했습니다. 24시간 배양 후, 배지를 제거하고, EdU를 함유하는 새로운 배지로 교체하였다. 세포를 48시간에 고정하고, EdU에 대해 염색하고, 이어서 Pax7 단백질 또는 PDGFRa 단백질에 대한 항체로 염색하고, 도립 에피형광 현미경을 사용하여 이미지화했습니다. 이미지는 ImageJ의 Fiji 플러그인을 사용하여 정량화되었습니다. EdU 양성 세포의 분획은 두 줄기 세포 유형과 다른 근육에 대해 달랐지만 강력한 EdU 염색이 관찰되었습니다(그림 4A-C). EDL 또는 GA에서 분리된 MuSC는 TA, 횡격막, 그라실리스 또는 삼두근에서 분리된 MuSC에 비해 EdU 통합이 현저히 낮은 반면, 교근과 가자미근에서 분리된 MuSC는 그 사이에 속하며 두 그룹 모두에서 크게 다르지 않습니다(그림 4A, B). 이는 이전 결과22와 일치합니다. 또한, MuSC가 높은 EdU 혼입 수준을 나타내는 조직은 MuSC가 이전에 높은 수준의 Pax3 단백질22를 발현하는 것으로 나타난 조직과 동일합니다. EDL로부터 분리된 FAP는 GA 및 가자미근으로부터 분리된 FAP에 비해 유의하게 낮은 EdU 혼입을 보인 반면, TA로부터 분리된 FAP는 가자미근으로부터 분리된 FAP에 비해 현저히 낮은 EdU 혼입을 보였다(도 4A,C). 이것은 분리를 위해 다른 조직의 근육을 모으는 것보다 개별 조직의 줄기 세포를 분석하는 것의 중요성을 강조합니다. 모든 조직에서 EdU 양성 MuSC의 평균 분율은 EdU 양성 FAP의 평균 분율에 비해 더 높았으며, 이는 MuSC가 주어진 조건에서 더 빨리 활성화됨을 시사합니다.
마지막으로, 면역형광염색법으로 세포 순도를 확인하였다(도 4D). 평균적으로 MuSC의 97.71%(± 1.38%)가 Pax7 단백질에 대해 양성으로 염색되었고, FAP의 88.16%(±6.35%)가 PDGFRa 단백질에 대해 양성으로 염색되어 줄기 세포 분리 절차의 특이성을 확인했습니다(그림 4D).

그림 1: 프로토콜의 개략도. 프로토콜의 두 가지 주요 부분인 MuSC 분리(상단 패널), 정지 분석(하단 패널) 및 각각에 사용된 방법론의 주요 단계를 보여주는 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
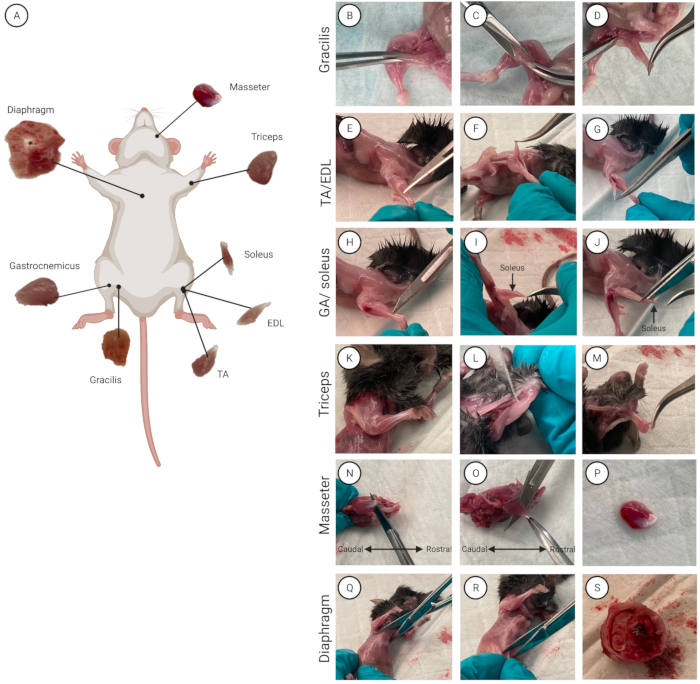
그림 2: 근육 위치 및 격리. (A) 각 근육의 위치를 나타내는 도식. (BS) (BD) gracilis, (EG) TA/EDL, (HJ) 삼두근, (KM) GA/가자미근, (N-P) 교근 및 (QS) 횡격막 근육에 대한 근육 격리 시연. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
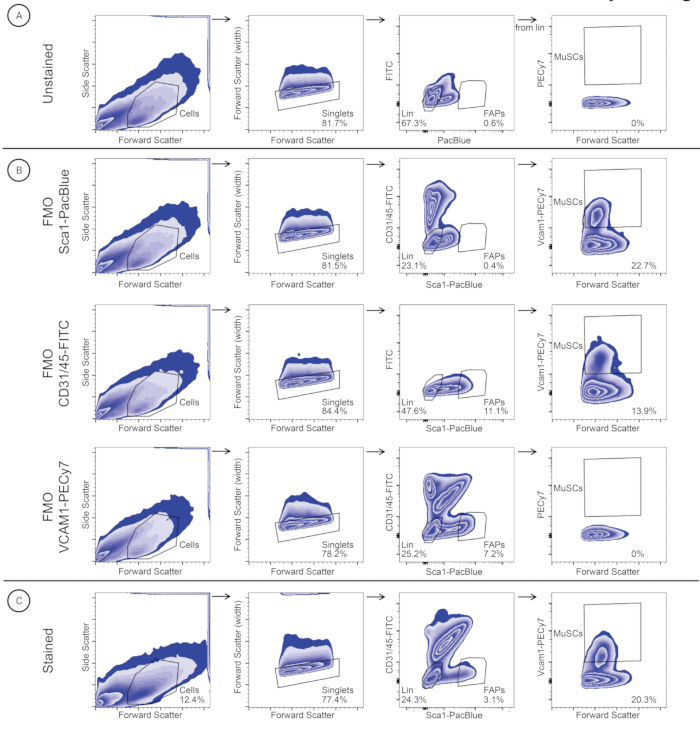
그림 3: 횡격막 근육 샘플에서 MuSC 및 FAP를 식별하고 분류하는 데 사용되는 게이팅 전략. 셀은 셀 크기(FSC(Forward Scatter))와 세분성(SSC(Side Scatter))을 기반으로 식별됩니다. 단일항은 FSC-A 및 FSC-W를 기준으로 선택됩니다. 계보 세포는 MuSC(계보-/VCAM1+)의 후속 식별을 위해 게이트되고 FAP(리니지-/SCA1+) 세포는 FAP를 식별하기 위해 게이트됩니다. (A) 염색되지 않은 대조군, (B) FMO 대조군(FMO-SCA1PacBlue, FMO-CD31/45-FITC 및 FMO-VCAM1-PECy7) 및 (C) 염색된 샘플에 동일한 게이팅 전략을 적용했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: EdU 염색에 의한 세포 활성화 정량화. (A) 다이어프램 샘플에서 MuSC(상단 패널) 및 FAP(하단 패널)의 EdU 염색의 대표 이미지. EdU 및 Hoechst(왼쪽 패널)의 병합된 이미지와 녹색(EdU, 중간 패널) 및 파란색(Hoechst, 오른쪽 패널)의 단일 채널이 표시됩니다. (나,씨) 표시된 근육에 대한 EdU 양성 (B) MuSC 또는 (C) FAP의 백분율을 보여주는 막대 그래프. 플롯은 SEM± 평균입니다. 각 점은 마우스를 나타냅니다. 통계 분석은 GraphPad에서 양측 스튜던트 t-검정을 사용하여 수행되었으며 유의성은 *p < 0.05 및 **p < 0.01로 설정되었습니다. (D) MuSC 마커 Pax7(왼쪽) 및 FAP 마커 PDGFRa(오른쪽)에 대한 항체를 사용한 MuSC(상단 패널) 및 FAP(하단 패널)의 면역형광 염색. Pax7과 Hoechst의 병합된 이미지, 단일 채널, PDGFRa와 Hoechst의 병합된 이미지, 단일 채널이 차례로 표시됩니다. N = 3입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 솔루션 | 시약 | 분량 |
| 세척 매체 | F-10 영양소 혼합물 (햄) (1x), +L-글루타민 | 445 mL의 |
| 말 혈청 | 50 밀리리터 | |
| 펜/연쇄상 구균 | 5 mL | |
| 해리 완충액(1차 분해) | 콜라게나제 유형 II | 650 U/mL |
| 세척 매체 | 100 밀리리터 | |
| 디스파제 스톡(2차 소화) | PBS의 Dispase | 11 U/mL |
| 콜라게나제 스톡(2차 소화) | PBS의 콜라게나제 유형 II | 1000 U/mL |
| PBS 1배 | PBS 10x 분말 농축액 | 9.89g/리터 |
| 오토클레이브/멸균수 | 1리터 | |
| 산성 물 | 빙초산 (100 %) 분석용 무수 | 5.15 밀리리터 |
| 오토클레이브/멸균수 | 895 mL의 | |
| 콜라겐 용액 (0.002 %) | 송아지 피부에서 추출한 콜라겐 | 20 밀리리터 |
| 산성 물 | 800 밀리리터 | |
| 트리톤 X-100 | 트리톤 X-100 | 0.5% (v/v) |
| PBS 1배 | 99.5% | |
| 블로킹 버퍼 | PBS 1배 | 18 mL |
| 당나귀 세럼 | 2 밀리리터 |
표 1 : 조리법 표.
| 샘플 번호. | 이름 |
| 1 | 염색되지 않은 |
| 2 | 형광에서 VCAM1-PeCy7을 뺀 값 |
| 3 | 형광 - SCA1-PacificBlue |
| 4 | 형광 마이너스 CD31/45-FITC |
| 5 | 실험 염색 (4 개의 항체 모두) |
표 2: 염색, 대조군 및 분류하기 전에 각 조직에 대해 준비된 샘플의 개요.
| 조직 | 항체 혼합물 | 셀 | 싱글렛 | 린 네그 | FAPs (영어) | 뮤스크 |
| 진동판 | 염색되지 않은 | 100% | 82% | 55% | 0.5% | 0.0% |
| FMO SCA1-PAC블루 | 100% | 83% | 19% | 0.3% | 4.3% | |
| FMO CD31/45-488 | 100% | 84% | 40% | 9.4% | 5.6% | |
| FMO Vcam1-PeCy7 | 100% | 78% | 20% | 5.6% | 0.0% | |
| 스테인드 | 100% | 77% | 19% | 2.4% | 3.8% | |
| 그라실리스 | 스테인드 | 100% | 96% | 11% | 2.6% | 1.4% |
| 고맙습니다 | 스테인드 | 100% | 88% | 16% | 2.8% | 2.2% |
| 증권 시세 표시기 | 스테인드 | 100% | 86% | 26% | 19.2% | 0.8% |
| 가자미레우스 | 스테인드 | 100% | 91% | 41% | 13.3% | 1.1% |
| 조지아 | 스테인드 | 100% | 94% | 51% | 6.1% | 1.5% |
| 삼두근 | 스테인드 | 100% | 92% | 30% | 2.6% | 4.5% |
| 교근 | 스테인드 | 100% | 85% | 27% | 19.3% | 2.6% |
표 3: FACS 데이터에서 상대적인 세포 유형 풍부도의 개요.
토론
좋은 수율을 달성하기 위해 이 프로토콜을 실행하는 데 몇 가지 단계가 중요합니다. 개별 근육은 대량 격리 프로토콜에 사용되는 근육의 양에 비해 부피가 작습니다. 이로 인해 해부 중에 근육이 건조되어 수율이 감소할 위험이 있습니다. 이를 방지하려면 해부 직후 근육에 배지를 추가하는 것이 중요합니다. 또한 해부가 더 오래 걸리면 한 번에 한쪽 팔다리에서 피부를 제거하여 근육이 공기에 노출되는 시간을 줄일 수 있습니다. 부피가 작을수록 과소화 위험이 증가합니다. 이에 대응하기 위해, 본 방법은 벌크 근육 프로토콜에 비해 더 적은 양의 콜라게나제 II 효소와 감소된 소화 시간을 필요로 한다 9,16. 효소 분해는 또한 효소의 순도에 따라 달라지며 순도가 낮으면 수율에 부정적인 영향을 미칠 수 있습니다. 또한 기계적 소화가 중요합니다. 절단이 불충분 한 경우, 감소 된 표면적은 효소 소화를 방해하고 줄기 세포 수율을 낮 춥니 다. 너무 많이 자르면 표면적이 증가하면 소화가 과도하게 이루어지고 줄기 세포 수율이 낮아집니다. 흔들리는 수조는 소화된 근육의 침전을 방지하고 효소의 분포를 개선하며 균일한 온도를 생성하는 데 도움을 주어 배양 시간을 단축할 수 있습니다. 따라서, 본 방법은 다른 방법에 비해 배양 시간의 현저한 감소를 허용한다.
이 프로토콜은 세포 해리 및 정제에 따라 다릅니다. 이러한 절차는 줄기 세포를 활성화시키는 조직 손상을 모방합니다. 일관되게, 최근 연구에 따르면 MuSC는 분리 절차27,28,29,30 동안 유전자 발현 프로그램을 변경합니다. 그 결과, 정제된 줄기세포는 생체 내 세포와 유전자 발현 패턴 면에서 상이하다. 프로토콜의 두 번째 제한 요소는 고가의 장비에 액세스해야 하는 FACS에 대한 의존성입니다. FACS는 고순도20으로 여러 세포 집단을 동시에 분리하기 위한 황금 표준(gold standard)입니다. 마그네틱 비드와 마이크로 버블을 사용한 최근의 발전은 비용31,32의 절감을 제공하지만 단일 근육에 대한 작업에 필적하는 수율을 제공하는지 여부를 결정해야합니다. 마지막으로, 근육의 크기가 작기 때문에 프로토콜의 수율이 제한되어 잠재적인 다운스트림 분석에 제한이 있습니다.
이전 연구에서는 세포 수율을 최대화하기 위해 MuSC 및/또는 FAP를 분리할 때 서로 다른 근육을 모으는 데 의존했습니다. 그러나 이것은 서로 다른 근육 사이의 줄기 세포 행동과 기능의 조직 특이적 차이를 평균화합니다. 현재 프로토콜은 줄기 세포 기능의 다운스트림 분석을 위해 개별 근육에서 MuSC 및 FAP를 분리할 수 있습니다. 다운스트림 분석의 예로, EdU 통합에 의해 줄기 세포 활성화를 분석하여 다른 조직의 줄기 세포가 다른 활성화 동역학을 나타낸다는 것을 밝혔습니다. 이전 연구에서 다른 다운스트림 분석을 사용할 수 있는 타당성이 나타났습니다. 이러한 분석에는 SmartSeq2 단일 세포 RNA 시퀀싱, 세포 이식, 미세유체 PCR 및 클론 확장 분석과 같은 더 작은 세포 수가 필요합니다 22,33,34,35.
결론적으로, 이 프로토콜은 MuSC 및 FAP를 분리하고 연구하기 위해 개별 근육을 해부하는 방법을 설명합니다. 이 전략을 통해 실험은 건강과 질병의 다양한 근육에 걸친 줄기 세포 기능에 대한 더 나은 이해를 얻을 수 있습니다.
공개
저자는 경쟁하는 재정적 이해 관계와 이해 상충이 없습니다.
감사의 말
세포 분류는 덴마크 오르후스 대학교의 FACS Core Facility에서 수행되었습니다. 그림은 Biorender.com 사용하여 만들어졌습니다. 토끼 항-PDGFRa 항체를 공유해 주신 J. Farup 박사에게 감사드립니다. 이 작업은 E.P.에 대한 AUFF 시작 보조금 및 NovoNordiskFonden에서 E.P. (0071113) 및 A.D.M. (0071116)에 대한 시작 패키지 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube( PCR performance tested, PP, 30,000 xg, DNA/DNase-/RNase-free, Low DNA binding, Sterile ) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 72.706.700 | 1.5 mL tube |
| 15 mL tube (PP/HD-PE, 20,000 xg, IVD/CE, IATA, DNA/DNase-/RNase-free, Non-cytotoxic, pyrogen free, Sterile) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 62.554.502 | 15 mL tube |
| 5 mL polystyrene round-bottom tube | Falcon, Fisher Scientific | 352054 | FACS tube without strainer cap |
| 5 mL polystyrene Round-bottom tube with cell-strainer cap | Falcon, Fisher Scientific | 352235 | FACS tube with strainer cap |
| 5 mL tube (PP, non sterile autoclavable) | VWR collection | 525.0946 | 5 mL tube |
| 50 mL tube( PP/HD-PE, 20,000 xg, IVD/CE, ADR, DNA/DNase-/RNase-free, non-cytotoxic, pyrogen free, Sterile) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 62.547.254 | 50 mL tube |
| Alexa Fluor 555 Donkey anti-rabbit IgG (H+L) | Invitrogen, Thermo Fisher | Lot: 2387458 (Cat # A31572) | |
| Alexa Fluor 647 donkey-anti mouse IgG (H+L) | Invitrogen, Thermo Fisher | Lot: 2420713 (Cat#A31571) | |
| ARIA 3 | BD | FACS, Core facility Aarhus University | |
| Centrifuge 5810 | eppendorf | EP022628188 | Centrifuge |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 488 dye | Invitrogen, Thermo Fisher | Lot: 2387287 (Cat# C10337) | Cell Proliferation Kit |
| Collagen from calf-skin | Bioreagent, Sigma Aldrich | Source: SLCK6209 (Cat# C8919) | |
| Collagenase type II | Worthington, Fisher Scientific | Lot: 40H20248 (cat# L5004177 ) | Collagenase |
| Dispase | Gibco, Fisher Scientific | Lot: 2309415 (cat# 17105-041 ) | Dispase |
| Donkey serum (non-sterile) | Sigma Aldrich, Merck | Lot: 2826455 (Cat# S30-100mL) | |
| Dumont nr. 5, 110 mm | Dumont, Hounisen Laboratorieudstyr A/S | 1606.327 | Straight forceps with fine tips |
| Dumont nr. 7, 115 mm | Dumont, Hounisen Laboratorieudstyr A/S | 1606.335 | Curved forceps |
| F-10 Nutrient mixture (Ham) (1x), +L-glutamine | Gibco, Fisher Scientific | Lot. 2453614 (cat# 31550-023) | |
| FITC anti-mouse CD31 | BioLegend, NordicBioSite | MEC13.3 (Cat # 102506) | |
| FITC Anti-mouse CD45 | BioLegend, NordicBioSite | 30-F11 (Cat# 103108) | |
| Glacial acetic acid (100%) | EMSURE, Merck | K44104563 9Cat # 1000631000) | |
| Head over head mini-tube rotator | Fisher Scientific | 15534080 (Model no. 88861052) | Head over head mini-tube rotator |
| Horse serum | Gibco, Fisher Scientific | Lot. 2482639 (cat# 10368902 ) | |
| Isotemp SWB 15 | FisherBrand, Fisher Scientific | 15325887 | Shaking water bath |
| MS2 mini-shaker | IKA | Vortex unit | |
| Needle 20 G (0.9 mm x 25 mm) | BD microlance, Fisher Scientific | 304827 | 20G needle |
| Neutral formalin buffer 10% | CellPath, Hounisen Laboratorieudstyr A/S | Lot: 03822014 (Cat # HOU/1000.1002) | |
| Non-pyrogenic cell strainer (40 µM) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 83.3945.040 | Cell strainer |
| Pacific Blue anti-mouse Ly-6A/E (Sca-1) | BioLegend, NordicBioSite | D7 (Cat# 108120) | |
| Pax7 primary antibody | DSHB | Lot: 2/3/22-282ug/mL (Cat# AB 528428) | |
| PBS 10x powder concentrate | Fisher BioReagents, Fisher Scientific | BP665-1 | |
| PE/Cy7 anti-mouse CD106 (VCAM1) | BioLegend, NordicBioSite | 429 (MVCAM.A) (Cat # 105720) | |
| Pen/strep | Gibco, Fisher Scientific | Lot. 163589 (cat# 11548876 ) | |
| Pipette tips p10 | Art tips, self sealing barrier, Thermo Scientific | 2140-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p1000 | Art tips, self sealing barrier, Thermo Scientific | 2279-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p20 | Art tips, self sealing barrier, Thermo Scientific | 2149P-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p200 | Art tips, self sealing barrier, Thermo Scientific | 2069-05 | Low retention, pre-sterilized, filter tips |
| Protective underpad | Abena | ACTC-7712 | 60 x 40cm, 8 layers |
| Rainin, pipet-lite XLS | Mettler Toledo, Thermo Scientific | 2140-05, 2149P-05, 2279-05, 2069-05 | Pipettes (P10, P20, P200, P1000) |
| Recombinant anti-PDGFR-alpha | RabMAb, abcam | AB134123 | |
| Scalpel (shaft no. 3) | Hounisen, Hounisen Laboratorieudstyr A/S | 1902.502 | Scalpel |
| Scalpel blade no. 11 | Heinz Herenz, Hounisen Laboratorieudstyr A/S | 1902.0911 | Scalpel |
| Scanlaf mars | Labogene | class 2 cabinet: Mars | Flow bench |
| ScanR | Olympus | Microscope, Core facility Aarhus University | |
| Scissors | FST | 14568-09 | |
| Series 8000 DH | Thermo Scientific | 3540-MAR | Incubator |
| Serological pipette 10 mL | VWR | 612-3700 | Sterile, non-pyrogenic |
| Serological pipette 5 mL | VWR, Avantor delivered by VWR | 612-3702 | Sterile, non-pyrogenic |
| Syringe 5 mL, Luer tip (6%), sterile | BD Emerald, Fisher Scientific | 307731 | Syringe |
| TC Dish 100, standard | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 83.3902 | Petri dish |
| Tissue Culture (TC)-treated surface, black polystyrene, flat bottom, sterile, lid, pack of 20 | Corning, Sigma Aldrich | 3764 | 96-well Half bottom plate |
| Triton X-100 | Sigma Aldrich, Merck | Source: SLCJ6163 (Cat # T8787) |
참고문헌
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9 (2), 493-495 (1961).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692(2021).
- Cheung, T. H., Rando, T. A. Molecular regulation of stem cell quiescence. Nature Reviews. Molecular Cell Biology. 14 (6), 329-340 (2013).
- Kann, A. P., Hung, M., Krauss, R. S. Cell-cell contact and signaling in the muscle stem cell niche. Current Opinion in Cell Biology. 73, 78-83 (2021).
- Tedesco, F. S., Dellavalle, A., Diaz-Manera, J., Messina, G., Cossu, G. Repairing skeletal muscle: regenerative potential of skeletal muscle stem cells. Journal of Clinical Investigation. 120 (1), 11-19 (2010).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Lepper, C., Partridge, T. A., Fan, C. -M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Joe, A. W. B., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Uezumi, A., Fukada, S. -I., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Seale, P., Sabourin, L. A., Girgis-Gabardo, A., Mansouri, A., Gruss, P., Rudnicki, M. A. Pax7 Is Required for the Specification of Myogenic Satellite Cells. Cell. 102 (6), 777-786 (2000).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- Fukada, S. -I., et al. Molecular signature of quiescent satellite cells in adult skeletal muscle. Stem Cells. 25 (10), 2448-2459 (2007).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Joe, A., Wang, J., Rossi, F. Prospective isolation of adipogenic progenitors from skeletal muscle. Journal of Investigative Medicine. 55 (1), 124(2007).
- Yi, L., Rossi, F. Purification of progenitors from skeletal muscle. Journal of Visualized Experiments. (49), e2476(2011).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119 (4), 543-554 (2004).
- Montarras, D., et al. Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Conboy, M. J., Cerletti, M., Wagers, A. J., Conboy, I. M. Immuno-analysis and FACS sorting of adult muscle fiber-associated stem/precursor cells. Methods In Molecular Biology. 621, 165-173 (2010).
- de Morree, A., et al. Alternative polyadenylation of Pax3 controls muscle stem cell fate and muscle function. Science. 366 (6466), 734-738 (2019).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental Biology. 397 (1), 31-44 (2015).
- Mookhtiar, K., Randall Steinbrink, D., Van Wart, H. E. Mode of hydrolysis of collagen-like peptides by class I and class II Clostridium histolyticum collagenases: evidence for both endopeptidase and tripeptidylcarboxypeptidase activities. Biochemistry. 24 (23), 6527-6533 (1985).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. The Journal of Investigative Dermatology. 93 (2), 287-290 (1989).
- Baghdadi, M. B., et al. Reciprocal signalling by Notch-Collagen V-CALCR retains muscle stem cells in their niche. Nature. 557 (7707), 714-718 (2018).
- van Velthoven, C. T. J., de Morree, A., Egner, I. M., Brett, J. O., Rando, T. A. Transcriptional profiling of quiescent muscle stem cells in vivo. Cell Reports. 21 (7), 1994-2004 (2017).
- Machado, L., et al. In situ fixation redefines quiescence and early activation of skeletal muscle stem cells. Cell Reports. 21 (7), 1982-1993 (2017).
- Machado, L., et al. Tissue damage induces a conserved stress response that initiates quiescent muscle stem cell activation. Cell Stem Cell. 28 (6), 1125-1135 (2021).
- vanden Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Moore, D. K., Motaung, B., du Plessis, N., Shabangu, A. N., Loxton, A. G. SU-IRG consortium isolation of B-cells using Miltenyi MACS bead isolation kits. PloS One. 14 (3), 0213832(2019).
- Liou, Y. -R., Wang, Y. -H., Lee, C. -Y., Li, P. -C. Buoyancy-activated cell sorting using targeted biotinylated albumin microbubbles. PloS One. 10 (5), 0125036(2015).
- Brett, J. O., et al. Exercise rejuvenates quiescent skeletal muscle stem cells in old mice through restoration of Cyclin D1. Nature Metabolism. 2 (4), 307-317 (2020).
- Tabula Muris Consortium. A single-cell transcriptomic atlas characterizes ageing tissues in the mouse. Nature. 583 (7817), 590-595 (2020).
- de Morrée, A., et al. Staufen1 inhibits MyoD translation to actively maintain muscle stem cell quiescence. Proceedings of the National Academy of Sciences. 114 (43), 8996-9005 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유