Method Article
Isolement de populations de cellules souches quiescentes à partir de muscles squelettiques individuels
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit l’isolement des cellules souches musculaires et des progéniteurs fibro-adipogènes des muscles squelettiques individuels chez la souris. Le protocole implique la dissection musculaire unique, l’isolement des cellules souches par tri cellulaire activé par fluorescence, l’évaluation de la pureté par coloration par immunofluorescence et la mesure quantitative de l’entrée en phase S par test d’incorporation de la 5-éthynyl-2'-désoxyuridine.
Résumé
Le muscle squelettique abrite des populations distinctes de cellules souches adultes qui contribuent à l’homéostasie et à la réparation des tissus. Les cellules souches du muscle squelettique (MuSC) ont la capacité de fabriquer de nouveaux muscles, tandis que les progéniteurs fibro-adipogènes (FAP) contribuent aux tissus de soutien stromaux et ont la capacité de fabriquer des fibroblastes et des adipocytes. Les MuSC et les FAP résident dans un état de sortie prolongée du cycle cellulaire réversible, appelé quiescence. L’état de repos est la clé de leur fonction. Les cellules souches quiescentes sont généralement purifiées à partir de plusieurs tissus musculaires regroupés dans un seul échantillon. Cependant, des études récentes ont révélé des différences distinctes dans les profils moléculaires et la profondeur de quiescence des MuSC isolés de différents muscles. Le présent protocole décrit l’isolement et l’étude des MuSC et des FAP à partir de muscles squelettiques individuels et présente des stratégies pour effectuer une analyse moléculaire de l’activation des cellules souches. Il détaille comment isoler et digérer les muscles de différentes origines développementales, épaisseurs et fonctions, tels que le diaphragme, triceps, gracilis, tibial antérieur (TA), gastrocnémien (GA), soléaire, extenseur digitorum longus (EDL) et les muscles masséters. Les MuSC et les FAP sont purifiés par tri cellulaire activé par fluorescence (FACS) et analysés par coloration par immunofluorescence et test d’incorporation de 5-éthynyl-2'-désoxyuridine (EdU).
Introduction
Le muscle squelettique a une grande capacité de régénération en raison de la présence de cellules souches musculaires (MuSC). Les MuSC sont situés sur les myofibres, sous la lame basale, et résident dans un état de repos de sortieprolongée et réversible du cycle cellulaire 1,2,3,4. En cas de blessure, les MuSCs s’activent et entrent dans le cycle cellulaire pour donner naissance à des progéniteurs amplificateurs qui peuvent se différencier et fusionner pour former de nouvelles myofibres 2,5. Des travaux antérieurs ont montré que les MuSCs sont absolument essentiels à la régénération musculaire 6,7,8. De plus, un seul MuSC peut se greffer et générer à la fois de nouvelles cellules souches et de nouvelles myofibres9. Le muscle squelettique abrite également une population de cellules stromales mésenchymateuses appelées progéniteurs fibro-adipogènes (FAP), qui jouent un rôle crucial dans le soutien de la fonction MuSC pendant la régénération musculaire 6,10,11,12.
En raison de leur potentiel à coordonner la régénération musculaire, il y a eu un énorme intérêt pour comprendre comment fonctionnent les MuSC et les FAP. Les MuSC quiescents sont marqués par l’expression des facteurs de transcription Pax7 et Sprouty1, et du récepteur de la calcitonine, une protéine de surface cellulaire, tandis que les FAP quiescents sont marqués par le récepteur alpha du facteur de croissance dérivé des plaquettes de surface cellulaire (PDGFRa)10,12,13,14,15 . Des études antérieures ont montré que les MuSC et les FAP pouvaient être purifiés des muscles squelettiques à l’aide de marqueurs de surface cellulaire et de tri cellulaire activé par fluorescence (FACS)9,15,16,17,18,19,20,21. Bien que ces protocoles aient considérablement amélioré la capacité d’étudier les MuSC et les FAP, un inconvénient est que la plupart de ces protocoles nécessitent l’isolement des MuSC à partir d’un pool de tissus musculaires différents. Des travaux récents de notre part et d’autres ont révélé des différences dans le phénotype cellulaire et les niveaux d’expression génique entre les MuSC isolés de différents tissus22,23. Les MuSC du diaphragme, des triceps et des graciles montrent une activation plus rapide que les MuSC des muscles inférieurs des membres postérieurs22, tandis que les MuSC du muscle extraoculaire montrent une différenciation plus rapide que les MuSC du diaphragme et des muscles inférieurs des membres postérieurs23.
Ce protocole décrit l’isolement des MuSC et des FAP des muscles squelettiques individuels (Figure 1). Cela comprend la dissection du diaphragme, triceps, gracilis, tibial antérieur (TA), soléaire, extenseur digitorum longus (EDL), gastrocnémien (GA) et masséters. Les muscles disséqués sont ensuite dissociés par digestion enzymatique à l’aide de collagénase II (une protéase qui cible spécifiquement la séquence aminée Pro-X-Gly-Pro dans le collagène, permettant la dégradation du tissu conjonctif et de la dissociation tissulaire24) et de la dispase (une protéase qui clive la fibronectine et le collagène IV, permettant une dissociation cellulaire supplémentaire25). Les MuSC et les FAP sont isolés des suspensions unicellulaires par FACS. À titre d’exemples de tests en aval pour l’analyse cellulaire, l’activation des cellules souches est déterminée par dosage de l’incorporation de la 5-éthynyl-2'-désoxyuridine (EdU), tandis que la pureté cellulaire est déterminée par coloration par immunofluorescence pour les marqueurs spécifiques du type cellulaire Pax7 et PDGFRa.
Protocole
Le présent protocole a été exécuté conformément aux directives de soins aux animaux de l’Université d’Aarhus et aux réglementations locales en matière d’éthique.
NOTE: Assurez-vous de respecter les règlements du comité d’éthique local pour l’expérimentation animale et la manipulation d’échantillons post-mortem de rongeurs. Les souris sont une source potentielle d’allergènes; Si disponible, activez la ventilation par aspiration et placez-la sur l’espace de travail pour éviter une exposition excessive aux allergènes. Vous pouvez également porter un masque facial si l’expérience est effectuée régulièrement. Ce protocole implique de travailler avec des objets tranchants, et il est recommandé aux chercheurs de se familiariser avec les procédures et la logistique pour appliquer les premiers soins dans le cas d’une coupure.
1. Préparation (1-2 h; la veille de la dissection)
NOTE: Les solutions, les plaques et les milieux sont préparés dans des conditions stériles et filtrés (0,45 μm) avant utilisation, sauf indication contraire. Préparer des solutions mères de dispase (11 U/mL dans le PBS) et de collagénase II (1 000 U/mL dans le PBS) et les conserver à -20 °C (tableau 1). Les souches sont décongelées et utilisées pour la digestion secondaire à l’étape 4.2.6.
- Revêtement de collagène d’une plaque demi-surface de 96 puits
- Préparez de l’eau acide. Ajouter 5,15 mL d’acide acétique glacial à 895 mL d’eau autoclavée dans un bécher de 2 L.
- Filtrer la solution à l’aide d’une unité filtrante de 0,45 μm et 500 mL. Transvaser 800 mL de l’eau acide filtrée dans une bouteille de 1 L.
- Ajouter 40 ml de solution mère de collagène stérile dans le flacon. Mélanger délicatement la solution en remuant et conserver à 4 °C, à l’abri de la lumière, jusqu’à utilisation.
- Enduisez de collagène une ou plusieurs plaques de 96 puits en demi-surface. Ajouter 50 μL de solution d’enrobage de collagène à chaque puits et enduire la plaque pendant une nuit (ON) à 4 °C.
- Aspirez la solution de collagène le lendemain à l’aide d’un aspirateur à vide et lavez la plaque 2x en ajoutant 100 μL d’eau autoclavée et en aspirant.
- Inclinez le couvercle de la plaque et laissez la plaque sécher dans le capot pendant 20-30 min.
- Lorsque la plaque est complètement sèche, enveloppez-la dans du papier d’aluminium et conservez à 4 °C jusqu’à utilisation. Les plaques revêtues peuvent être conservées jusqu’à 4 semaines.
REMARQUE: Le revêtement de collagène permet l’adhésion cellulaire. Il est important d’éliminer le collagène libre, car il pourrait interférer avec la fonction cellulaire et la signalisation (par exemple, la liaison du collagène V aux récepteurs de la calcitonine sur les MuSC)26.
2. Préparation (0,5 h; le jour de la dissection):
- Préparation de solutions supplémentaires et espace de travail
- Préparer un produit de lavage stérile en ajoutant 50 mL de sérum de cheval et 5 mL de stylo/streptocoque à 445 mL du milieu F10 de HAM. Travailler dans une hotte à flux laminaire pour éviter la contamination.
- Calculer et peser la quantité appropriée de collagénase II nécessaire pour préparer le tampon de dissociation. (Pour chaque souris, 26 000 unités de collagénase II sont utilisées pour fabriquer 40 mL de tampon de dissociation à 650 U/mL de collagénase II). Ajouter la poudre pesée dans un tube conique de 50 ml et la conserver sur de la glace.
- Préparez deux plats de 10 cm pour l’isolation musculaire. Verser 3 mL de produit de lavage (tableau 1) dans chaque boîte de Pétri. Apportez les plats de 10 cm à l’extérieur de la hotte à flux laminaire pour une utilisation ultérieure.
- Préparer les matériaux pour la digestion musculaire. En fonction du nombre d’échantillons, étiqueter le nombre approprié de tubes coniques de 50 ml (huit par souris, un pour chaque muscle) et les laisser sur le banc. Vaporisez les aiguilles, les seringues de 10 ml et les crépines cellulaires de 40 μm avec de l’éthanol à 70 % (huit de chaque souris, une pour chaque muscle) et amenez-les à l’intérieur de la hotte à flux laminaire. Fixez des aiguilles aux seringues.
- Préparer les matériaux pour le tri. Étiqueter les tubes à fond rond de 5 ml avec des bouchons de crépine en fonction du nombre d’échantillons. Couvrez les tubes avec du papier d’aluminium et laissez-les dans la hotte à flux laminaire.
- En fonction du nombre d’échantillons et de populations à trier, préparer des tubes microcentrifugeuses de 1,5 mL avec 500 μL de produit de lavage pour le prélèvement cellulaire (16 par souris, un tube pour chaque population cellulaire par tissu musculaire). Conservez ces tubes sur de la glace.
3. Dissection musculaire (20-30 min)
REMARQUE: Cette section du protocole est effectuée dans un environnement non stérile. La procédure peut être effectuée à l’aide d’une ou plusieurs souris. Cependant, une souris suffit pour préparer à la fois les échantillons pour le tri et les contrôles pour la mise en place de portes de compensation et FACS.
- Initier l’isolement musculaire
- Préparez l’espace de travail non stérile pour la dissection et l’isolement musculaire. Désinfectez le poste de travail avec de l’éthanol à 70%. Placez un sous-tampon de protection stérile jetable sur le poste de travail.
- À l’aide d’un marqueur permanent, dessinez une boîte pour chaque muscle sur le dessus d’un couvercle de boîte de Pétri pour placer plus tard le muscle isolé.
- Pulvériser les instruments chirurgicaux avec de l’éthanol à 70%.
- Euthanasier la souris par inhalation de CO2 et/ou luxation cervicale.
- Isolez les muscles individuels (d’une souris à la fois si vous utilisez plusieurs souris). Vaporisez la souris avec de l’éthanol à 70% pour mouiller la fourrure et désinfecter la peau. Placez la souris sur le coussin inférieur avec l’abdomen tourné vers le haut. Un aperçu des huit muscles et de leur emplacement anatomique respectif est présenté à la figure 2A.
- Isoler les muscles graciliens
- Utilisez une paire de ciseaux pour faire une incision horizontale de 0,5 cm dans la peau abdominale.
- Retirez la peau : À l’aide des deux mains, utilisez le pouce et l’index pour saisir la partie supérieure et inférieure de l’incision. Tirez de chaque côté de l’incision pour déchirer et séparer la peau du torse et des membres inférieurs. Tirez vers le bas la peau du membre inférieur pour exposer les deux membres postérieurs (vers le bas de la hanche aux orteils). De même, tirez vers le haut pour exposer le torse.
- Localisez le muscle gracilis (intérieur de la cuisse). À l’aide d’une pince incurvée, saisissez le gracilis et soulevez légèrement le muscle (figure 2B). Avec des ciseaux, faire une incision de 0,5 cm (Figure 2C), à partir de laquelle le gracilis est découpé et complètement isolé (Figure 2D). Répétez cette opération pour l’autre jambe afin d’isoler le deuxième muscle gracilis.
- Isoler les muscles TA et EDL (membre postérieur inférieur, face ventrale)
- À l’aide d’un scalpel, coupez le fascia en faisant une incision de 0,5 cm le long du côté latéral du tibia (l’os le plus épais du membre postérieur inférieur). Utilisez des pinces incurvées pour saisir le fascia et tirez pour l’enlever.
REMARQUE: Lorsque le fascia a été complètement enlevé, les tendons à l’extrémité distale de la patte postérieure sont visibles et peuvent être séparés. - Utilisez une pince droite avec des extrémités superfines pour passer entre le tendon distal du TA (côté latéral du tibia) et l’EDL (sous le TA) (Figure 2E-G).
REMARQUE: Avec l’expérience, l’extrémité émoussée d’une lame de scalpel peut être utilisée à la place de la pince droite. - Faites glisser la pince vers l’extrémité proximale du muscle pour séparer les muscles.
- Ramenez la pince droite à l’extrémité distale. Couper le tendon distal.
- Saisissez doucement le tendon distal du muscle avec une pince incurvée. Soulevez le muscle vers le haut et au-dessus de son attachement proximal et coupez soigneusement le tendon proximal aussi près que possible de son point d’attache. Coupez l’autre extrémité et transférez le TA dans une boîte de Pétri.
- Utilisez des pinces droites avec des pointes super fines pour aller sous le tendon distal de l’EDL.
- Faites glisser la pince vers l’extrémité proximale du muscle pour séparer les muscles.
- Ramenez la pince droite à l’extrémité distale. Coupez le tendon distal sans endommager le muscle.
- Saisissez doucement le tendon distal de l’EDL avec une pince incurvée. Soulevez le muscle vers le haut et au-dessus de son attachement proximal et coupez soigneusement le tendon proximal aussi près que possible de son point d’attache. Coupez l’autre extrémité et transférez l’EDL dans une boîte de Pétri. Répétez l’opération pour l’autre membre postérieur afin d’isoler les deuxièmes muscles TA et EDL.
- À l’aide d’un scalpel, coupez le fascia en faisant une incision de 0,5 cm le long du côté latéral du tibia (l’os le plus épais du membre postérieur inférieur). Utilisez des pinces incurvées pour saisir le fascia et tirez pour l’enlever.
- Isoler les muscles GA et soléaire (membre postérieur inférieur, face dorsale)
- Utilisez des pinces droites avec des pointes ultrafines pour aller entre le tendon d’Achille et les os des membres postérieurs inférieurs.
- Faites glisser la pince vers l’extrémité proximale du muscle pour séparer le muscle.
- Ramenez la pince droite à l’extrémité distale. Couper le tendon distal.
REMARQUE: Afin d’éviter d’endommager le muscle soléaire, qui se trouve sous le GA, coupez aussi près que possible de son tendon d’Achille distal, laissant un morceau du tendon attaché à l’AG (Figure 2H). - Pour révéler et isoler le muscle soléaire, tirez le GA vers le haut et au-dessus du péroné (l’os le plus mince des deux os du membre postérieur inférieur).
REMARQUE: Le muscle soléaire se distingue par sa couleur rouge foncé caractéristique par rapport à l’AG (Figure 2I). - Localisez le tendon soléaire proximal. Avec une pince droite, passez entre le soléaire et GA.
- Déplacez la pince vers l’extrémité distale du muscle pour séparer le soléaire de l’AG.
- Isolez d’abord le soléaire. Coupez son tendon proximal, saisissez le tendon avec une pince incurvée et soulevez délicatement le soléaire pour accéder à son tendon distal. Couper le tendon distal pour isoler le soléaire de l’AG. Placer le soléaire dans la boîte de Petri avec le produit de lavage (figure 2J)
- Coupez le GA et placez-le dans la boîte de Pétri. Répétez cette opération pour l’autre jambe afin d’isoler le deuxième soléaire et les muscles GA.
- Isoler les muscles triceps (membre antérieur supérieur, côté dorsal)
- Utilisez une pince droite avec des extrémités super fines pour passer entre le muscle triceps et l’os de l’humérus (l’os principal de la partie supérieure de la jambe antérieure) (Figure 2K-M).
- Faites glisser la pince vers l’extrémité proximale du muscle pour séparer le muscle. Coupez l’extrémité proximale du muscle.
- Saisissez l’extrémité proximale du triceps avec une pince incurvée et tirez-la vers le haut et par-dessus le coude pour accéder au tendon distal. Coupez le tendon distal des triceps, transférez le muscle dans une boîte de Petri et répétez la procédure pour l’autre membre antérieur.
- Isoler les muscles masséters
- Retirez la fourrure et la peau de la mâchoire. Faites une incision horizontale de 0,5 cm avec des ciseaux. À l’aide des deux mains, pincez de chaque côté de l’incision à l’aide du pouce et de l’index. Enlevez la peau en tirant vers le haut et vers le bas.
- Localisez le tendon principal du masséter (caudale, sous l’œil). Insérez la lame plate du scalpel entre l’os et le muscle (Figure 2N). Couper le tendon.
- Saisissez le tendon masséter majeur avec une pince incurvée. Coupez-le avec une lame de scalpel ou des ciseaux dans le sens rostral pour séparer le muscle masséter de l’os de la mâchoire (Figure 2O, P). Placez le muscle masséter isolé dans la boîte de Pétri. Répétez la procédure pour le deuxième muscle masséter.
- Isoler le muscle du diaphragme
REMARQUE: Lorsque vous isolez le muscle du diaphragme, assurez-vous de couper soigneusement pour éviter de couper dans les organes internes et l’intestin, car il s’agit d’une source de contamination.- À l’aide de ciseaux, faites une thoracotomie (une coupure entre les côtes) au milieu du sternum (un long os plat, situé au milieu de la poitrine, qui relie les côtes) et coupez à travers le sternum (Figure 2Q).
- Exposez le diaphragme en coupant à 360° à travers la cage thoracique.
- Séparez le haut du corps de la partie inférieure / abdomen. À l’aide d’une paire de ciseaux, couper la trachée, l’œsophage, la veine cave et l’aorte abdominale.
- Séparez le diaphragme du bas du corps. À l’aide de ciseaux, faites une laparotomie (incision chirurgicale dans la cavité abdominale) à 1 cm sous le sternum et faites une coupe à 360° (figure 2R).
- Placez les ciseaux fermés entre la cage thoracique et les organes abdominaux et appuyez vers le bas. Tirez doucement sur la cage thoracique pour la séparer des organes abdominaux (Figure 2S).
- Séparez le diaphragme de la cage thoracique. Tenez lâchement le diaphragme entre deux doigts et coupez la cage thoracique avec des ciseaux. Utilisez des ciseaux pour couper le diaphragme le plus près possible des côtes dans une coupe à 360°. Placez le diaphragme isolé dans une boîte de Pétri.
REMARQUE: Pendant la luxation cervicale, le diaphragme peut se rompre et s’effondrer contre la cage thoracique, ce qui le rend difficile à localiser. Le muscle peut encore être isolé. Identifiez le muscle affaissé, tenez-le entre deux doigts et coupez à 360° en suivant la cage thoracique.
4. Digestion musculaire en suspension unicellulaire (~1 h 35 min)
REMARQUE : Les étapes suivantes comprennent les environnements de travail non stériles (étapes 4.1 à 4.2) et stériles (étape 4.3).
- Digestion mécanique
- Placez les muscles isolés dans le couvercle d’une boîte de Petri de 10 cm.
- À l’aide de pinces incurvées, saisissez les muscles isolés un par un. Pour le soléaire et l’AG, retirez les parties restantes du tendon d’Achille.
- À l’aide de ciseaux, hachez les muscles isolés un par un en les coupant en morceaux d’environ 1 mm3 .
- Digestion enzymatique
- Préparer le tampon de dissociation musculaire en ajoutant 40 mL de produit de lavage à froid à la poudre de collagénase II pesée (collagénase II : 650 U/mL dans le produit de lavage).
REMARQUE: Utilisez un tampon de dissociation musculaire fraîchement préparé pour assurer une activité enzymatique optimale. - Transférer les muscles émincés dans un tube conique de 15 mL contenant 5 mL de tampon de dissociation.
- Incuber le tube pendant 35 min dans un bain-marie à agitation à 37 °C à 60 tr/min.
- Après l’incubation, ajouter le produit de lavage jusqu’à un volume total de 15 mL. Faire tourner le tube à 1 600 x g pendant 5 min à 4 °C.
- Aspirer le surnageant jusqu’à un volume de 4 mL à l’aide d’un aspirateur à vide. Pour éviter de déranger la pastille, aspirez lentement par le haut et enlevez toute graisse flottante.
- Décongeler les aliquotes de dispase et de collagénase II. Ajouter 500 μL de la solution de collagénase II (1 000 U/mL de stock, -20 °C) à l’échantillon restant de 4 mL. Ensuite, ajouter 500 μL de la solution de dispase (11 U/mL de stock, -20 °C).
REMARQUE: La dispase peut générer un précipité. Si cela se produit, faire tourner la solution mère de dispase à 10 000 x g, 1 min avant utilisation. Transférer le surnageant maintenant clair sur la suspension cellulaire sans perturber la pastille. - Vortex brièvement les échantillons pour dissoudre la pastille.
- Incuber les échantillons pendant 20 min dans un bain-marie à agitation à 37 °C à 60 tr/min.
REMARQUE: La digestion d’un grand nombre d’échantillons musculaires prend beaucoup de temps. Pour les étapes 4.3.1 à 4.3.6, estimer le prélèvement de 2 à 5 minutes par échantillon. Cette étape va plus vite lorsqu’elle est effectuée en parallèle par deux chercheurs ou plus.
- Préparer le tampon de dissociation musculaire en ajoutant 40 mL de produit de lavage à froid à la poudre de collagénase II pesée (collagénase II : 650 U/mL dans le produit de lavage).
- Homogénéisation des échantillons
- Homogénéiser la suspension cellulaire. Transférer la suspension du tube de 15 mL dans un tube de 50 mL. Utilisez une seringue de 10 ml avec une aiguille de 20 G pour remettre l’échantillon en suspension en tirant l’échantillon de haut en bas à travers l’aiguille 5x.
REMARQUE: Si des morceaux de muscle non digérés obstruent l’aiguille, essuyez-les sur un mouchoir en papier. - Placez une crépine cellulaire de 40 μm sur un nouveau tube conique de 50 mL.
- Prendre la suspension cellulaire complète dans la seringue et filtrer l’échantillon dans un nouveau tube conique de 50 ml avec une crépine cellulaire sur le dessus. Filtrer l’échantillon en distribuant le volume total directement sur le filtre.
- Pour récupérer toutes les cellules mononucléées, ajoutez 20 mL du produit de lavage dans le tube conique vide et versez-le à travers la passoire cellulaire dans le tube conique de 50 ml contenant l’échantillon filtré. Récupérez le volume restant sous la crépine à l’aide d’une pipette p1000.
- Jeter la passoire cellulaire et faire tourner l’échantillon à 1 600 x g pendant 5 min à 4 °C.
- En pipetant avec une pipette p1000, aspirer le surnageant sans déranger la pastille.
- Par pipetage avec une pipette p1000, remettre en suspension la pastille de diaphragme dans 500 μL du produit de lavage et remettre en suspension les autres échantillons musculaires dans 300 μL du produit de lavage chacun.
REMARQUE: Le diaphragme est le plus gros des muscles avec la teneur en cellules souches la plus élevée et peut donc être utilisé pour les colorations de contrôle.
- Homogénéiser la suspension cellulaire. Transférer la suspension du tube de 15 mL dans un tube de 50 mL. Utilisez une seringue de 10 ml avec une aiguille de 20 G pour remettre l’échantillon en suspension en tirant l’échantillon de haut en bas à travers l’aiguille 5x.
5. Coloration et tri (~40 min + 30 min de tri/échantillon)
REMARQUE : Travaillez dans un environnement stérile sur de la glace pour les étapes suivantes.
- Transférer une partie aliquote de 50 μL de la suspension de cellules à membrane dans quatre nouveaux tubes microcentrifugeuses de 2 mL pour les taches de contrôle (50 μL chacun). Ajouter 250 μL du produit de lavage à chaque tube de contrôle jusqu’à un volume final de 300 μL.
- Ajouter 3 μL (1:100) d’anticorps de fluorescence moins un (contrôle FMO) aux trois tubes de coloration témoins et laisser un tube sans anticorps (témoin non coloré) (voir le tableau 2).
- Ajouter 3 μL (1:100) d’anticorps (VCAM1-PECy7, CD45-FITC, CD31-FITC et SCA1-PacificBlue) aux suspensions monocellulaires musculaires restantes, y compris l’échantillon de diaphragme restant.
- Incuber les suspensions cellulaires pendant 15 min à 4 °C dans un agitateur tête au-dessus de la tête.
REMARQUE: Les colorations de contrôle sont nécessaires pour déterminer les niveaux de fluorescence de fond et régler les portes de la cytométrie en flux. Différents anticorps peuvent être utilisés, mais chacun aura une concentration de travail spécifique et un temps d’incubation qui doit être testé. Si des anticorps provenant de différents fournisseurs sont utilisés, la concentration, et donc la dilution, peuvent varier. Un colorant de viabilité cellulaire peut être ajouté au mélange de coloration pour éliminer toutes les cellules mortes ou mourantes pendant le tri. - Faire tourner les échantillons à 1 600 x g pendant 5 min à 4 °C. Jeter le surnageant sans déranger la pastille par pipetage.
- En pipetant avec une pipette p1000, remettre chaque échantillon en suspension dans 800 μL du produit de lavage.
- Filtrer les échantillons à l’aide d’un tube FACS muni d’un capuchon de crépine cellulaire (40 μm) pour éliminer les amas cellulaires restants (ou agrégats).
- Lavez la crépine cellulaire en ajoutant 800 μL supplémentaires de produit de lavage.
- Gardez les échantillons recouverts de papier d’aluminium sur la glace jusqu’à l’analyse.
REMARQUE: Si, à ce stade, la suspension cellulaire semble trouble / dense en raison de la forte concentration de cellules, ajoutez 800 μL supplémentaires du produit de lavage pour diminuer la densité cellulaire. - Démarrez le FACS avec une buse de 70 μm.
- Utilisez les contrôles non tachés et FMO pour définir la stratégie de contrôle : les MuSC sont négatifs pour CD45-FITC, CD31-FITC et SCA1-PacBlue, et sont positifs pour VCAM1-PECy7; Les FAP sont négatifs pour CD45-FITC, CD31-FITC, VCAM1-PECy7 et positifs pour SCA1-PacBlue.
- Trier les suspensions monocellulaires colorées en utilisant un tri bidirectionnel et recueillir les MuSC et les FAP dans des tubes de collecte séparés contenant 500 μL de produit de lavage.
REMARQUE: En utilisant FACS avec quatre lasers (configuration: buse de 70 μm, 405 nm, 488 nm, 561 nm, 633 nm), la combinaison de fluorophores choisie ne nécessite pas de compensation du signal de fluorescence. Toutefois, si vous utilisez un cytomètre en flux différent ou une combinaison différente de fluorophores, des échantillons témoins à coloration unique supplémentaires pour la compensation sont recommandés. Parmi les muscles plus petits (EDL, soléaire, TA), des rendements de 3 000 MuSC et 5 000 FAP sont à prévoir. Pour les autres muscles plus gros, des rendements de 20 000 MuSC et FAP sont à prévoir. Le nombre d’événements répertoriés par le logiciel FACS peut s’écarter du nombre réel de cellules viables dans le tube de collecte. Le nombre de cellules peut être confirmé par comptage cellulaire à l’aide d’un hémocytomètre. - Faites tourner les cellules triées à 1 600 x g pendant 5 min à 4 °C. Par pipetage, aspirer le surnageant sans perturber la pastille cellulaire.
- Ajouter 100 μL du produit de lavage à chaque échantillon et remettre délicatement les cellules en suspension sans créer de bulles d’air. Transférer les 100 μL de l’échantillon remis en suspension dans une plaque de 96 puits en demi-zone recouverte de collagène. Plaque 1 000-3 000 cellules par puits.
REMARQUE: Si les cellules ne sont pas correctement remises en suspension, les cellules peuvent coller ensemble en touffes, confondant les analyses de microscopie ultérieures. - Inspectez les cellules au microscope et notez leur distribution, leur forme et leur taille.
- Incuber la plaque à 37 °C, 5% CO2. Les cellules adhéreront dans les 2 heures.
NOTE: Il est recommandé de confirmer la pureté des populations cellulaires collectées, soit par analyse par cytométrie en flux (en chargeant une partie aliquote de l’échantillon trié sur le trieur et en enregistrant un petit nombre d’événements), soit par coloration des anticorps des cellules plaquées suivie d’une microscopie (Pax7 est un marqueur définissant les MuSC de souris, PDGFRa est un marqueur définissant les FAP de souris). À partir de la section 7 ci-dessous, un protocole pour la coloration des cellules pour les niveaux de protéines Pax7 et PDGFRa est à partir de la section 7.
6. Essai d’incorporation d’EdU
NOTE: Travailler dans des conditions stériles et utiliser la hotte chimique lors de la manipulation du paraformaldéhyde (PFA) pour les étapes suivantes. EdU est un analogue nucléotidique incorporé dans l’ADN lorsque les cellules passent par la phase S du cycle cellulaire. Il est mutagène à des concentrations élevées. Portez toujours des gants lorsque vous manipulez EdU. Consultez les directives locales pour la manipulation des déchets EdU.
- Pouls EdU (jour 1)
- Préparez une solution de travail de 2x EdU dans un produit de lavage frais.
- Sortez la plaque de 96 puits avec les cellules de l’incubateur. Inspectez les cellules au microscope pour surveiller la confluence. Déplacez-vous dans la hotte à flux laminaire.
- Retirer 50 μL de milieu de la plaque par pipetage. Ajouter 50 μL de solution de travail 2x EdU de sorte que le volume final dans le puits soit de 100 μL.
- Culture des cellules en présence d’EdU pendant la période prévue à 37 °C, 5% CO2.
REMARQUE: Le moment et la durée de l’impulsion EdU peuvent varier. En moyenne, les MuSC quiescents prennent 2 jours pour activer complètement et compléter leur première division cellulaire19. EdU peut être ajouté aux cellules triées immédiatement après le placage.
- Fixation (jour 2)
REMARQUE : Le PFA est cancérigène. Manipulez toujours le PFA avec soin. Familiarisez-vous avec les réglementations locales en matière de manipulation des PFA et d’élimination des déchets.- Sortez la plaque de 96 puits avec les cellules de l’incubateur. Inspectez les cellules au microscope et déplacez la plaque dans la hotte.
- Par pipetage, retirer le milieu et fixer les cellules en ajoutant 50 μL de PFA à 4 % à chaque puits. Incuber la plaque pendant 10 min à température ambiante (RT) dans une hotte chimique.
- Retirez le PFA à l’aide d’une pipette et jetez-le dans un conteneur à déchets approprié.
- Lavez les cellules en ajoutant 100 μL de PBS à tous les puits. En pipetant, aspirez le PBS et répétez le lavage. Conservez les cellules dans 100 μL de PBS.
REMARQUE: Pour éviter de laver les cellules, distribuez le PBS sur le côté du puits en pipetant lentement.
- Étiquetage EdU
- Perméabiliser les cellules avant la détection de l’EdU en retirant le PBS et en ajoutant 100 μL de Triton X-100 à 0,5% dans le PBS. Incuber la plaque pendant 5 min à 4 °C.
REMARQUE: Triton X-100 est un tensioactif et peut causer une irritation de la peau. Manipulez avec soin et utilisez toujours des gants. - Après 5 min, aspirez le Triton X-100 et ajoutez 100 μL de PBS.
- Préparez un mélange réactionnel EdU click-chimie selon le protocole du fabricant.
- Aspirer le PBS et ajouter 33 μL du mélange réactionnel EdU-chimie cliquet. Incuber la plaque pendant 30 min à TA.
- Aspirer le mélange réactionnel EdU click-chimie et laver les cellules avec 100 μL de PBS.
- Aspirer le PBS, ajouter 100 μL de PBS avec Hoechst (1:2 000) et incuber à l’abri de la lumière pendant 10 min à TA.
- Aspirer le Hoechst et laver deux fois en ajoutant 100 μL de PBS. Conservez les cellules dans 100 μL de PBS à 4 °C dans l’obscurité.
- Imagez les cellules sur un microscope inversé. Les cellules peuvent être stockées dans l’obscurité pendant des mois tant que les puits ne se dessèchent pas.
REMARQUE: Il est possible de co-colorer les cellules avec des anticorps. Dans ce cas, procédez à une étape de blocage suivie d’une incubation avec l’anticorps primaire. Choisir un anticorps secondaire avec un fluorophore conjugué dont le spectre d’émission ne chevauche pas celui du fluorophore utilisé pour détecter l’EdU. Assurez-vous de ne pas utiliser d’anticorps secondaires avec des fluorophores chevauchant la gamme spectrale de Hoechst.
- Perméabiliser les cellules avant la détection de l’EdU en retirant le PBS et en ajoutant 100 μL de Triton X-100 à 0,5% dans le PBS. Incuber la plaque pendant 5 min à 4 °C.
7. Coloration par immunofluorescence
REMARQUE : Cette partie du protocole peut être effectuée indépendamment de la section 6. Lorsque vous sautez la section 6, veuillez effectuer les étapes 6.3.1 et 6.3.2 pour activer la perméabilisation cellulaire avant de passer à l’étape 7.2 ci-dessous.
- Sortez la plaque contenant les cellules marquées EdU.
- Préparer 20 mL de tampon bloquant en ajoutant 2 mL de sérum d’ânesse à 18 mL de PBS.
- Pour empêcher la liaison d’anticorps non spécifiques, retirez 100 μL du PBS de chaque puits et ajoutez 50 μL du tampon de blocage avec une pipette p200. Incuber la plaque pendant 30 min à TA, à l’abri de la lumière et recouverte d’une feuille d’aluminium pour éviter le photoblanchiment de l’EdU marqué au fluorophore.
REMARQUE: Les cellules sont fixées au fond du puits, mais peuvent se détacher si trop de force est appliquée lors du pipetage. - Tout en bloquant les échantillons, préparez le mélange d’anticorps primaires. Ajouter 8,0 μL (1:100) d’anti-Pax7 de souris et d’anti-PDGFRa de lapin à 800 μL de tampon bloquant pour colorer 16 puits (huit tissus, deux types de cellules).
- Après le blocage, retirez le sérum d’ânesse et ajoutez 50 μL du mélange d’anticorps primaires à chaque puits. Incuber la plaque pendant une nuit à 4 °C, recouverte de papier d’aluminium.
- Après l’incubation, retirer l’anticorps primaire et ajouter 50 μL de Triton (0,5% dans PBS) à chacun des puits. Incuber la plaque pendant 5 min à TA à l’abri de la lumière, pour laver l’anticorps non lié. Répétez le lavage trois fois.
- Préparer le mélange principal d’anticorps secondaires en ajoutant 1,0 μL (1:1 000) d’âne anti-souris-Alexa647 et d’âne anti-lapin-Alexa555 dans un tube microcentrifuge contenant 1 000 μL de tampon de blocage.
- Ajouter 33 μL du mélange principal d’anticorps secondaires à chacun des puits. Incuber la plaque pendant 60 min à la TA à l’abri de la lumière.
- Retirer l’anticorps secondaire en excès par pipetage, ajouter 50 μL de Triton (0,1% dans PBS) et incuber pendant 5 minutes à TA à l’abri de la lumière. Répétez le lavage trois fois.
- Enfin, ajoutez 100 μL de PBS. Décidez s’il faut imager la plaque immédiatement à l’aide d’un microscope à fluorescence inversée avec une caméra CCD refroidie, ou stocker la plaque à 4 °C jusqu’à une analyse ultérieure en scellant les bords de la plaque avec un parafilm et en enveloppant la plaque scellée dans du papier d’aluminium.
Résultats
Conformément au protocole d’isolement individuel des muscles squelettiques (Figure 2), les muscles gracilis, TA, EDL, GA, soléus, triceps, masséter et diaphragme ont été isolés chez trois souris mâles suisses consanguines qui avaient été interrompues d’un programme de sélection local (Figure 2). Après dissociation tissulaire et coloration des anticorps, les MuSCs et les FAP des muscles individuels ont été purifiés par FACS (Figure 3). Le contrôle initial a été obtenu avec un échantillon non coloré pour identifier les cellules et séparer les singulets des doublets (figure 3A). Les vannes subséquentes ont été installées à l’aide de contrôles FMO pour déterminer les seuils de coloration (figure 3B). L’échantillon coloré a ensuite été fermé pour CD31/CD45-FITC et Sca1-PacBlue. La population SCA1+/CD31-/CD45- (FAP) a été triée dans un tube de collecte séparé, tandis que la population doublement négative a été fermée et tracée pour VCAM1-PECy7 et la diffusion vers l’avant (FSC). La population VCAM1+ (MuSC) a été triée dans un tube de collecte séparé. Les MuSC et les FAP ont été quantifiés en pourcentage de singlets (tableau 3) et triés dans des tubes de collecte séparés contenant 500 μL de produit de lavage. Les suspensions unicellulaires du muscle diaphragme et triceps ont une abondance relative plus élevée de MuSC que de FAP, tandis que les autres suspensions unicellulaires ont une abondance relative plus élevée de FAP que les MuSC (tableau 3).
Parmi les cellules triées, 1 000 à 3 000 cellules ont été ensemencées et incubées pendant 24 heures. Après 24 h d’incubation, le milieu a été retiré et remplacé par un milieu frais contenant de l’EdU. Les cellules ont été fixées à 48 h, colorées pour EdU, puis avec des anticorps contre la protéine Pax7 ou la protéine PDGFRa, et imagées à l’aide d’un microscope à épifluorescence inversée. Les images ont été quantifiées à l’aide du plugin Fiji dans ImageJ. Une coloration robuste de l’EdU a été observée, bien que la fraction de cellules EdU-positives était différente pour les deux types de cellules souches et les différents muscles (Figure 4A-C). Les MuSC isolés de l’EDL ou de l’AG ont montré une incorporation d’EdU significativement plus faible par rapport aux MuSC isolés de l’AT, du diaphragme, du gracilis ou du triceps, tandis que les MuSC isolés du masséter et du soléaire se situent entre les deux et ne sont pas significativement différents de l’un ou l’autre groupe (Figure 4A, B). Cela est cohérent avec nos résultats précédents22. De plus, les tissus à partir desquels les MuSC présentent des niveaux élevés d’incorporation d’EdU sont les mêmes tissus à partir desquels il a été démontré précédemment que les MuSC expriment des niveaux élevés de protéine Pax322. Les FAP isolés de la PC Plus ont montré une incorporation d’EdU significativement plus faible que les FAP isolés de l’AG et du soléaire, tandis que les FAP isolés de l’AT ont montré une incorporation d’EdU significativement plus faible que les FAP isolés du soléaire (figure 4A, C). Cela souligne l’importance d’analyser les cellules souches de tissus individuels plutôt que de mettre en commun les muscles de différents tissus pour les isoler. Pour tous les tissus, la fraction moyenne des MuSC EdU-positifs était plus élevée que la fraction moyenne des PAF EdU-positifs, ce qui suggère que les MuSCs s’activent plus rapidement dans les conditions données.
Enfin, la pureté cellulaire a été confirmée par coloration par immunofluorescence (Figure 4D). En moyenne, 97,71 % (± 1,38 %) des MuSC étaient colorés positifs pour la protéine Pax7, et 88,16 % (±6,35 %) des PAF étaient colorés positifs pour la protéine PDGFRa, confirmant la spécificité de notre procédure d’isolement des cellules souches (Figure 4D).

Figure 1 : Résumé schématique du protocole. Schéma montrant les deux principaux segments du protocole, l’isolement MuSC (panneau supérieur), le test de quiescence (panneau inférieur) et les étapes clés de la méthodologie utilisée dans chacun d’eux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
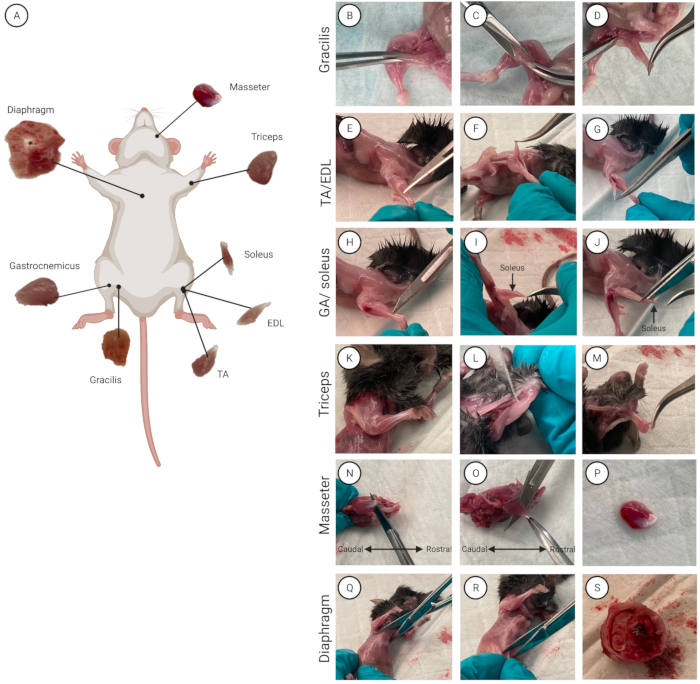
Figure 2: Localisation et isolement musculaires. (A) Un schéma montrant l’emplacement de chaque muscle. (B-S) Démonstration de l’isolement musculaire pour (B-D) gracilis, (E-G) TA/EDL, (H-J) triceps, (K-M) GA/soléaire, (N-P) masséter et (Q-S) muscles du diaphragme. Veuillez cliquer ici pour voir une version agrandie de cette figure.
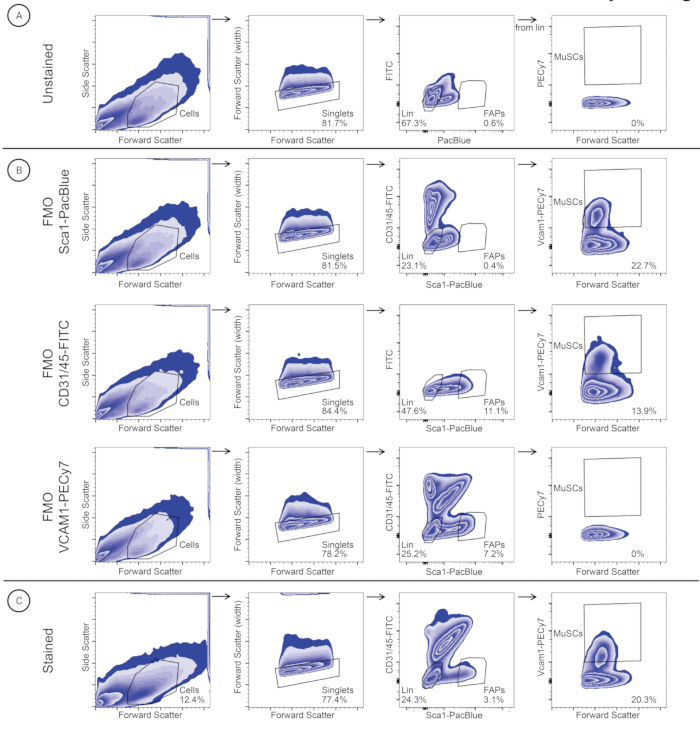
Figure 3 : Stratégie de contrôle utilisée pour identifier et trier les MuSC et les FAP dans un échantillon de muscle du diaphragme. Les cellules sont identifiées en fonction de la taille des cellules (Forward Scatter (FSC)) et de la granularité (Side Scatter (SSC)). Les singlets sont sélectionnés en fonction de FSC-A et FSC-W. Les cellules de lignée sont fermées pour l’identification ultérieure des MuSC (Lineage-/VCAM1+), et les cellules FAP (Lineage-/SCA1+) sont fermées pour identifier les FAP. La même stratégie de contrôle a été appliquée à (A) un témoin non coloré, (B) des contrôles FMO (FMO-SCA1PacBlue, FMO-CD31/45-FITC et FMO-VCAM1-PECy7) et (C) un échantillon coloré. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Quantification de l’activation cellulaire par coloration EdU. (A) Images représentatives de la coloration EdU des MuSC (panneaux supérieurs) et des FAP (panneaux inférieurs) à partir d’un échantillon de diaphragme. Les images fusionnées d’EdU et de Hoechst (panneaux de gauche) et les canaux simples en vert (EdU, panneaux du milieu) et en bleu (Hoechst, panneaux de droite) sont montrés. (B,C) Diagramme à barres montrant le pourcentage de MuSCs (B) ou (C) FAPs positifs pour les muscles indiqués. Tracé est la moyenne ± SEM. Chaque point représente une souris. L’analyse statistique a été effectuée dans GraphPad à l’aide de tests t de Student bilatéraux, avec une signification définie sur *p < 0,05 et **p < 0,01. (D) Coloration par immunofluorescence des MuSCs (panneaux supérieurs) et des FAP (panneaux inférieurs) avec des anticorps dirigés contre le marqueur MuSC Pax7 (côté gauche) et le marqueur FAP PDGFRa (côté droit). Les images fusionnées de Pax7 avec Hoechst, suivies des canaux simples, et les images fusionnées de PDGFRa avec Hoechst, suivies des canaux simples. N = 3. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Solutions | Réactifs | Quantité |
| Fluide de lavage | F-10 Mélange nutritif (jambon) (1x), +L-glutamine | 445 mL |
| Sérum de cheval | 50 mL | |
| Stylo/streptocoque | 5 mL | |
| Tampon de dissociation (1ère digestion) | Collagénase de type II | 650 U/mL |
| Fluide de lavage | 100 mL | |
| Stock de dispase (2ème digestion) | Dispase dans PBS | 11 U/ml |
| Stock de collagénase (2e digestion) | Collagénase de type II dans PBS | 1000 U/mL |
| PBS 1x | PBS 10x concentré en poudre | 9,89 g/L |
| Eau autoclavée/stérile | 1 L | |
| Eau acide | Acide acétique glacial (100%) Anhydre pour analyse | 5,15 mL |
| Eau autoclavée/stérile | 895 mL | |
| Solution de collagène (0,002%) | Collagène de peau de veau | 20 mL |
| Eau acide | 800 mL | |
| Triton X-100 | Triton X-100 | 0,5 % (v/v) |
| PBS 1x | 99.5% | |
| Blocage du tampon | PBS 1x | 18 mL |
| Sérum d’ânesse | 2 mL |
Tableau 1 : Tableau des recettes.
| N° d’échantillon | Nom |
| 1 | Non taché |
| 2 | Fluorescence moins VCAM1-PeCy7 |
| 3 | Fluorescence moins SCA1-PacificBlue |
| 4 | Fluorescence moins CD31/45-FITC |
| 5 | Coloration expérimentale (les quatre anticorps) |
Tableau 2 : Aperçu de la coloration, des témoins et des échantillons préparés pour chaque tissu avant le tri.
| Tissu | Mélange d’anticorps | Cellules | Maillots | Lin neg | PAF | Les CSMU |
| Diaphragme | non taché | 100% | 82% | 55% | 0.5% | 0.0% |
| FMO Sca1-PacBlue | 100% | 83% | 19% | 0.3% | 4.3% | |
| FMO CD31/45-488 | 100% | 84% | 40% | 9.4% | 5.6% | |
| FMO Vcam1-PeCy7 | 100% | 78% | 20% | 5.6% | 0.0% | |
| Tachée | 100% | 77% | 19% | 2.4% | 3.8% | |
| Gracilis | Tachée | 100% | 96% | 11% | 2.6% | 1.4% |
| MERCI | Tachée | 100% | 88% | 16% | 2.8% | 2.2% |
| EDL | Tachée | 100% | 86% | 26% | 19.2% | 0.8% |
| Soléaire | Tachée | 100% | 91% | 41% | 13.3% | 1.1% |
| GA | Tachée | 100% | 94% | 51% | 6.1% | 1.5% |
| Triceps | Tachée | 100% | 92% | 30% | 2.6% | 4.5% |
| Masséter | Tachée | 100% | 85% | 27% | 19.3% | 2.6% |
Tableau 3 : Aperçu de l’abondance relative des types de cellules dans les données FACS.
Discussion
Plusieurs étapes sont essentielles dans l’exécution de ce protocole pour obtenir de bons rendements. Les muscles individuels ont un petit volume par rapport à la quantité de muscle utilisée dans les protocoles d’isolement en vrac. Il en résulte un risque de dessèchement musculaire pendant la dissection, ce qui réduit le rendement. Pour éviter cela, il est important d’ajouter du milieu aux muscles immédiatement après la dissection. De plus, si la dissection prend plus de temps, la peau peut être retirée d’un membre à la fois pour réduire le temps d’exposition des muscles à l’air. Le volume plus petit entraîne également un risque accru de surdigestion. Pour contrer cela, la méthode actuelle nécessite des quantités plus faibles d’enzyme collagénase II et des temps de digestion réduits par rapport aux protocoles musculaires en vrac 9,16. La digestion enzymatique dépend également de la pureté des enzymes, et une pureté plus faible peut avoir un impact négatif sur le rendement. De plus, la digestion mécanique est essentielle. En cas de coupe insuffisante, la diminution de la surface entravera la digestion enzymatique et réduira le rendement en cellules souches. En cas de coupe excessive, l’augmentation de la surface entraînera une surdigestion et réduira le rendement en cellules souches. Le bain-marie à secousses empêche la précipitation du muscle digéré, améliore la distribution de l’enzyme et aide à créer une température homogène, permettant des temps d’incubation plus courts. Par conséquent, la méthode actuelle permet une réduction significative du temps d’incubation par rapport aux autres méthodes.
Ce protocole dépend de la dissociation et de la purification cellulaires. Ces procédures imitent les lésions tissulaires, ce qui active les cellules souches. De manière cohérente, des études récentes ont révélé que les MuSC modifient leurs programmes d’expression génique au cours de la procédure d’isolement27,28,29,30. En conséquence, les cellules souches purifiées sont différentes des cellules in vivo en termes de profils d’expression génique. Un deuxième facteur limitant le protocole est sa dépendance à l’égard de la FACS, qui nécessite l’accès à un équipement coûteux. FACS est l’étalon-or pour isoler plusieurs populations cellulaires simultanément avec une puretéélevée 20. Les progrès récents utilisant des billes magnétiques et des microbulles offrent des réductions de coûtde 31,32, mais il reste à déterminer s’ils offrent des rendements comparables pour travailler sur des muscles individuels. Enfin, le rendement du protocole est limité en raison de la petite taille des muscles, ce qui pose des restrictions sur les tests potentiels en aval.
Des études antérieures se sont appuyées sur la mise en commun de différents muscles lors de l’isolement des MuSC et / ou des FAP pour maximiser le rendement cellulaire. Cependant, cela fait la moyenne des différences spécifiques aux tissus dans le comportement et la fonction des cellules souches entre les différents muscles. Le protocole actuel permet d’isoler les MuSC et les FAP des muscles individuels pour les analyses en aval de la fonction des cellules souches. À titre d’exemple d’essai en aval, l’activation des cellules souches a été dosée par incorporation d’EdU, révélant que les cellules souches de différents tissus présentent une cinétique d’activation différente. Dans des travaux antérieurs, la faisabilité de l’utilisation d’autres essais en aval a été démontrée; ces tests nécessitent un plus petit nombre de cellules, tels que le séquençage de l’ARN unicellulaire SmartSeq2, la transplantation cellulaire, la PCR microfluidique et les tests d’expansion clonale 22,33,34,35.
En conclusion, ce protocole décrit une méthode de dissection de muscles individuels pour isoler et étudier les MuSC et les FAP. Cette stratégie permettra aux expériences de mieux comprendre la fonction des cellules souches dans différents muscles de la santé et de la maladie.
Déclarations de divulgation
Les auteurs n’ont pas d’intérêts financiers concurrents et pas de conflits d’intérêts.
Remerciements
Le tri cellulaire a été effectué au centre FACS de l’Université d’Aarhus (Danemark). Les figures ont été créées à l’aide de Biorender.com. Nous remercions le Dr J. Farup d’avoir partagé l’anticorps anti-PDGFRa du lapin. Ce travail a été soutenu par une subvention de démarrage AUFF à E.P. et des subventions Start Package de NovoNordiskFonden à E.P. (0071113) et à A.D.M. (0071116).
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube( PCR performance tested, PP, 30,000 xg, DNA/DNase-/RNase-free, Low DNA binding, Sterile ) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 72.706.700 | 1.5 mL tube |
| 15 mL tube (PP/HD-PE, 20,000 xg, IVD/CE, IATA, DNA/DNase-/RNase-free, Non-cytotoxic, pyrogen free, Sterile) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 62.554.502 | 15 mL tube |
| 5 mL polystyrene round-bottom tube | Falcon, Fisher Scientific | 352054 | FACS tube without strainer cap |
| 5 mL polystyrene Round-bottom tube with cell-strainer cap | Falcon, Fisher Scientific | 352235 | FACS tube with strainer cap |
| 5 mL tube (PP, non sterile autoclavable) | VWR collection | 525.0946 | 5 mL tube |
| 50 mL tube( PP/HD-PE, 20,000 xg, IVD/CE, ADR, DNA/DNase-/RNase-free, non-cytotoxic, pyrogen free, Sterile) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 62.547.254 | 50 mL tube |
| Alexa Fluor 555 Donkey anti-rabbit IgG (H+L) | Invitrogen, Thermo Fisher | Lot: 2387458 (Cat # A31572) | |
| Alexa Fluor 647 donkey-anti mouse IgG (H+L) | Invitrogen, Thermo Fisher | Lot: 2420713 (Cat#A31571) | |
| ARIA 3 | BD | FACS, Core facility Aarhus University | |
| Centrifuge 5810 | eppendorf | EP022628188 | Centrifuge |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 488 dye | Invitrogen, Thermo Fisher | Lot: 2387287 (Cat# C10337) | Cell Proliferation Kit |
| Collagen from calf-skin | Bioreagent, Sigma Aldrich | Source: SLCK6209 (Cat# C8919) | |
| Collagenase type II | Worthington, Fisher Scientific | Lot: 40H20248 (cat# L5004177 ) | Collagenase |
| Dispase | Gibco, Fisher Scientific | Lot: 2309415 (cat# 17105-041 ) | Dispase |
| Donkey serum (non-sterile) | Sigma Aldrich, Merck | Lot: 2826455 (Cat# S30-100mL) | |
| Dumont nr. 5, 110 mm | Dumont, Hounisen Laboratorieudstyr A/S | 1606.327 | Straight forceps with fine tips |
| Dumont nr. 7, 115 mm | Dumont, Hounisen Laboratorieudstyr A/S | 1606.335 | Curved forceps |
| F-10 Nutrient mixture (Ham) (1x), +L-glutamine | Gibco, Fisher Scientific | Lot. 2453614 (cat# 31550-023) | |
| FITC anti-mouse CD31 | BioLegend, NordicBioSite | MEC13.3 (Cat # 102506) | |
| FITC Anti-mouse CD45 | BioLegend, NordicBioSite | 30-F11 (Cat# 103108) | |
| Glacial acetic acid (100%) | EMSURE, Merck | K44104563 9Cat # 1000631000) | |
| Head over head mini-tube rotator | Fisher Scientific | 15534080 (Model no. 88861052) | Head over head mini-tube rotator |
| Horse serum | Gibco, Fisher Scientific | Lot. 2482639 (cat# 10368902 ) | |
| Isotemp SWB 15 | FisherBrand, Fisher Scientific | 15325887 | Shaking water bath |
| MS2 mini-shaker | IKA | Vortex unit | |
| Needle 20 G (0.9 mm x 25 mm) | BD microlance, Fisher Scientific | 304827 | 20G needle |
| Neutral formalin buffer 10% | CellPath, Hounisen Laboratorieudstyr A/S | Lot: 03822014 (Cat # HOU/1000.1002) | |
| Non-pyrogenic cell strainer (40 µM) | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 83.3945.040 | Cell strainer |
| Pacific Blue anti-mouse Ly-6A/E (Sca-1) | BioLegend, NordicBioSite | D7 (Cat# 108120) | |
| Pax7 primary antibody | DSHB | Lot: 2/3/22-282ug/mL (Cat# AB 528428) | |
| PBS 10x powder concentrate | Fisher BioReagents, Fisher Scientific | BP665-1 | |
| PE/Cy7 anti-mouse CD106 (VCAM1) | BioLegend, NordicBioSite | 429 (MVCAM.A) (Cat # 105720) | |
| Pen/strep | Gibco, Fisher Scientific | Lot. 163589 (cat# 11548876 ) | |
| Pipette tips p10 | Art tips, self sealing barrier, Thermo Scientific | 2140-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p1000 | Art tips, self sealing barrier, Thermo Scientific | 2279-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p20 | Art tips, self sealing barrier, Thermo Scientific | 2149P-05 | Low retention, pre-sterilized, filter tips |
| Pipette tips p200 | Art tips, self sealing barrier, Thermo Scientific | 2069-05 | Low retention, pre-sterilized, filter tips |
| Protective underpad | Abena | ACTC-7712 | 60 x 40cm, 8 layers |
| Rainin, pipet-lite XLS | Mettler Toledo, Thermo Scientific | 2140-05, 2149P-05, 2279-05, 2069-05 | Pipettes (P10, P20, P200, P1000) |
| Recombinant anti-PDGFR-alpha | RabMAb, abcam | AB134123 | |
| Scalpel (shaft no. 3) | Hounisen, Hounisen Laboratorieudstyr A/S | 1902.502 | Scalpel |
| Scalpel blade no. 11 | Heinz Herenz, Hounisen Laboratorieudstyr A/S | 1902.0911 | Scalpel |
| Scanlaf mars | Labogene | class 2 cabinet: Mars | Flow bench |
| ScanR | Olympus | Microscope, Core facility Aarhus University | |
| Scissors | FST | 14568-09 | |
| Series 8000 DH | Thermo Scientific | 3540-MAR | Incubator |
| Serological pipette 10 mL | VWR | 612-3700 | Sterile, non-pyrogenic |
| Serological pipette 5 mL | VWR, Avantor delivered by VWR | 612-3702 | Sterile, non-pyrogenic |
| Syringe 5 mL, Luer tip (6%), sterile | BD Emerald, Fisher Scientific | 307731 | Syringe |
| TC Dish 100, standard | Sarstedt AG & Co. KG, Hounisen Laboratorieudstyr A/S | 83.3902 | Petri dish |
| Tissue Culture (TC)-treated surface, black polystyrene, flat bottom, sterile, lid, pack of 20 | Corning, Sigma Aldrich | 3764 | 96-well Half bottom plate |
| Triton X-100 | Sigma Aldrich, Merck | Source: SLCJ6163 (Cat # T8787) |
Références
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9 (2), 493-495 (1961).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692(2021).
- Cheung, T. H., Rando, T. A. Molecular regulation of stem cell quiescence. Nature Reviews. Molecular Cell Biology. 14 (6), 329-340 (2013).
- Kann, A. P., Hung, M., Krauss, R. S. Cell-cell contact and signaling in the muscle stem cell niche. Current Opinion in Cell Biology. 73, 78-83 (2021).
- Tedesco, F. S., Dellavalle, A., Diaz-Manera, J., Messina, G., Cossu, G. Repairing skeletal muscle: regenerative potential of skeletal muscle stem cells. Journal of Clinical Investigation. 120 (1), 11-19 (2010).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Lepper, C., Partridge, T. A., Fan, C. -M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Joe, A. W. B., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Uezumi, A., Fukada, S. -I., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Seale, P., Sabourin, L. A., Girgis-Gabardo, A., Mansouri, A., Gruss, P., Rudnicki, M. A. Pax7 Is Required for the Specification of Myogenic Satellite Cells. Cell. 102 (6), 777-786 (2000).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- Fukada, S. -I., et al. Molecular signature of quiescent satellite cells in adult skeletal muscle. Stem Cells. 25 (10), 2448-2459 (2007).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Joe, A., Wang, J., Rossi, F. Prospective isolation of adipogenic progenitors from skeletal muscle. Journal of Investigative Medicine. 55 (1), 124(2007).
- Yi, L., Rossi, F. Purification of progenitors from skeletal muscle. Journal of Visualized Experiments. (49), e2476(2011).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119 (4), 543-554 (2004).
- Montarras, D., et al. Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Conboy, M. J., Cerletti, M., Wagers, A. J., Conboy, I. M. Immuno-analysis and FACS sorting of adult muscle fiber-associated stem/precursor cells. Methods In Molecular Biology. 621, 165-173 (2010).
- de Morree, A., et al. Alternative polyadenylation of Pax3 controls muscle stem cell fate and muscle function. Science. 366 (6466), 734-738 (2019).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental Biology. 397 (1), 31-44 (2015).
- Mookhtiar, K., Randall Steinbrink, D., Van Wart, H. E. Mode of hydrolysis of collagen-like peptides by class I and class II Clostridium histolyticum collagenases: evidence for both endopeptidase and tripeptidylcarboxypeptidase activities. Biochemistry. 24 (23), 6527-6533 (1985).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. The Journal of Investigative Dermatology. 93 (2), 287-290 (1989).
- Baghdadi, M. B., et al. Reciprocal signalling by Notch-Collagen V-CALCR retains muscle stem cells in their niche. Nature. 557 (7707), 714-718 (2018).
- van Velthoven, C. T. J., de Morree, A., Egner, I. M., Brett, J. O., Rando, T. A. Transcriptional profiling of quiescent muscle stem cells in vivo. Cell Reports. 21 (7), 1994-2004 (2017).
- Machado, L., et al. In situ fixation redefines quiescence and early activation of skeletal muscle stem cells. Cell Reports. 21 (7), 1982-1993 (2017).
- Machado, L., et al. Tissue damage induces a conserved stress response that initiates quiescent muscle stem cell activation. Cell Stem Cell. 28 (6), 1125-1135 (2021).
- vanden Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Moore, D. K., Motaung, B., du Plessis, N., Shabangu, A. N., Loxton, A. G. SU-IRG consortium isolation of B-cells using Miltenyi MACS bead isolation kits. PloS One. 14 (3), 0213832(2019).
- Liou, Y. -R., Wang, Y. -H., Lee, C. -Y., Li, P. -C. Buoyancy-activated cell sorting using targeted biotinylated albumin microbubbles. PloS One. 10 (5), 0125036(2015).
- Brett, J. O., et al. Exercise rejuvenates quiescent skeletal muscle stem cells in old mice through restoration of Cyclin D1. Nature Metabolism. 2 (4), 307-317 (2020).
- Tabula Muris Consortium. A single-cell transcriptomic atlas characterizes ageing tissues in the mouse. Nature. 583 (7817), 590-595 (2020).
- de Morrée, A., et al. Staufen1 inhibits MyoD translation to actively maintain muscle stem cell quiescence. Proceedings of the National Academy of Sciences. 114 (43), 8996-9005 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon