Method Article
Трехмерная культура склепков толстой кишки мышей для изучения функции стволовых клеток кишечника Ex vivo
В этой статье
Резюме
Настоящий протокол описывает создание органоидной системы толстой кишки для изучения активности и функционирования стволовых клеток толстой кишки в нокаут-модели клодина-7.
Аннотация
Кишечный эпителий регенерирует каждые 5-7 дней и контролируется популяцией кишечных эпителиальных стволовых клеток (IESC), расположенной в нижней части области крипты. К КЭСК относятся активные стволовые клетки, которые самообновляются и дифференцируются в различные типы эпителиальных клеток, и покоящиеся стволовые клетки, которые служат резервными стволовыми клетками в случае травмы. Регенерация кишечного эпителия контролируется самообновляющимися и дифференцирующими возможностями этих активных ИЭСК. Кроме того, баланс популяции стволовых клеток крипты и поддержание ниши стволовых клеток имеют важное значение для регенерации кишечника. Органоидная культура является важным и привлекательным подходом к изучению белков, сигнальных молекул и сигналов окружающей среды, которые регулируют выживание и функции стволовых клеток. Эта модель дешевле, менее трудоемка и более манипулируема, чем модели животных. Органоиды также имитируют микроокружение тканей, обеспечивая актуальность in vivo . Настоящий протокол описывает изоляцию крипт толстой кишки, встраивание этих изолированных клеток крипты в трехмерную систему гелевой матрицы и культивирование клеток крипты с образованием органоидов толстой кишки, способных к самоорганизации, пролиферации, самообновлению и дифференцировке. Эта модель позволяет манипулировать окружающей средой, выбивая специфические белки, такие как клодин-7, активируя / деактивируя сигнальные пути и т. Д., Чтобы изучить, как эти эффекты влияют на функционирование стволовых клеток толстой кишки. В частности, была изучена роль белка плотного соединения claudin-7 в функции стволовых клеток толстой кишки. Клаудин-7 жизненно важен для поддержания кишечного гомеостаза и барьерной функции и целостности. Нокаут клавдина-7 у мышей вызывает воспалительный фенотип, подобный заболеванию кишечника, демонстрирующий воспаление кишечника, гиперплазию эпителия, потерю веса, изъязвления слизистой оболочки, шелушение эпителиальных клеток и аденомы. Ранее сообщалось, что клаудин-7 необходим для функций эпителиальных стволовых клеток кишечника в тонком кишечнике. В этом протоколе устанавливается система культуры толстой кишки для изучения роли клаудина-7 в толстой кишке.
Введение
Кишечная органоидная культура представляет собой трехмерную (3D) систему ex vivo, в которой стволовые клетки выделяют из кишечных крипт первичной ткани и покрывают в гелевую матрицу 1,2. Эти стволовые клетки способны к самообновлению, самоорганизации и функциональности органа2. Органоиды имитируют микроокружение тканей и больше похожи на модели in vivo, чем на двумерные (2D) модели культур клеток in vitro, хотя и менее манипулируемы, чем клетки 3,4. Эта модель устраняет препятствия, встречающиеся в 2D-моделях, такие как отсутствие надлежащих клеточно-клеточных спаек, клеточно-матричных взаимодействий и однородных популяций, а также уменьшает ограничения животных моделей, включая высокие затраты и длительные периоды времени5. Кишечные органоиды, также называемые колоноидами для тех, которые выращены из стволовых клеток, полученных из крипты толстой кишки, по существу являются мини-органами, которые содержат эпителий, включая все типы клеток, которые будут присутствовать in vivo, а также просвет. Эта модель позволяет манипулировать системой для изучения многих аспектов кишечника, таких как ниша стволовых клеток, физиология кишечника, патофизиология и морфогенез кишечника 3,5,6. Он также предоставляет отличную модель для открытия лекарств, изучения кишечных расстройств человека, таких как воспалительные заболевания кишечника (ВЗК) и колоректальный рак, разработки персонализированного лечения для конкретного пациента и изучения регенерации тканей 4,7,8,9. Кроме того, органоидная система также может быть использована для изучения клеточной связи, метаболизма лекарств, жизнеспособности, пролиферации и ответа на стимулы 7,8. Хотя животные модели могут быть использованы для тестирования потенциальных терапевтических средств для кишечных патологических состояний, они довольно ограничены, поскольку изучение нескольких лекарств одновременно представляет собой проблему. Существует больше смешанных переменных in vivo, и связанные с ними затраты и время являются высокими и длинными, соответственно. С другой стороны, система органоидных культур позволяет проводить скрининг многих терапевтических средств одновременно за более короткий период времени, а также позволяет персонализировать лечение путем использования органоидной культуры, полученной от пациента 4,8. Способность органоидов толстой кишки имитировать организацию тканей, микроокружение и функциональность также делает их отличной моделью для изучения регенерации и восстановления тканей9. Наша лаборатория создала систему органоидных культур тонкой кишки для изучения влияния клаудина-7 на функции стволовых клеток тонкой кишки10. В этом исследовании установлена система культур органоидов толстого кишечника для изучения способности или отсутствия способности стволовых клеток к самообновлению, дифференцировке и пролиферации в условной модели нокаута claudin-7 (cKO).
Клодин-7 является очень важным белком плотного соединения (TJ), который высоко экспрессируется в кишечнике и необходим для поддержания функции и целостности TJ11. Мыши cKO страдают от фенотипа, подобного IBD, проявляя сильное воспаление, изъязвления, шелушение эпителиальных клеток, аденомы и повышенные уровни цитокинов11,12. Хотя широко признано, что клаудины жизненно важны для функции эпителиального барьера, появляются новые роли для клаудинов; они участвуют в пролиферации, миграции, прогрессировании рака и функции стволовых клеток 10,12,13,14,15,16,17. В настоящее время неизвестно, как клодин-7 влияет на нишу стволовых клеток и функцию стволовых клеток толстой кишки. Поскольку кишечник быстро самообновляется примерно каждые 5-7 дней, поддержание ниши стволовых клеток и правильное функционирование активных стволовых клеток имеет жизненно важное значение18. Здесь создана система для изучения потенциальных регуляторных эффектов клаудина-7 на нишу стволовых клеток толстой кишки.
протокол
Все эксперименты и процедуры на животных были одобрены Комитетом по уходу и использованию животных Университета Восточной Каролины (ECU) и проведены в соответствии с руководящими принципами Национальных институтов здравоохранения и ECU по уходу за лабораторными животными и их использованию. Индуцируемые, специфические для кишечника нокаутирующие мыши claudin-7 были получены путем скрещивания трансгенных мышей C57BL6 claudin-7-flox с мышами Villin-CreERT219. В этом исследовании использовались самцы и самки мышей в возрасте 3 месяцев.
1. Подготовка реагентов/оборудования
- Охладите следующие реагенты/оборудование перед началом связанных с ними экспериментов: фосфатно-буферный физиологический раствор (PBS) для промывки ткани толстой кишки во время изоляции крипты; качелька/ротатор (поместите в холодильник при температуре 4 °C) для инкубации с эпителиальными диссоциационными средами.
- Снимите гелевую матрицу (см. Таблицу материалов) с -20 °C и разморозьте на льду перед нанесением покрытия.
- Предварительно охладите центрифугу до 4 °C перед раскруткой крипт для нанесения покрытия.
- Охладите 0,1% буфера цитрата натрия (см. Таблицу материалов) и держите на льду до обнаружения гибели клеток in situ .
- Прогрейте следующие реагенты перед началом связанных с ними экспериментов: 96-луночную культуральную пластину в течение 24 ч перед нанесением покрытия; Носитель L-WRN (см. Таблицу материалов) перед добавлением в позолоченные крипты и перед каждым изменением носителя.
- Нагрейте водяную баню до 94 °C перед окрашиванием.
2. Изоляция крипты мышей толстой кишки
- Подготовьте необходимый носитель, выполнив следующие действия.
ПРИМЕЧАНИЕ: Объемы среды рассчитываются здесь для ткани толстой кишки двух мышей.- Готовят эпителиальные диссоциационные среды: 30 мл 1x PBS + 400 мкл 0,5 M EDTA + 50 мкл 10 мМ Y-27632 дигидрохлорида (см. Таблицу материалов). Держите на льду до использования.
- Подготовьте среду диссоциации крипты: 10 мл 1x PBS + 10 мкл 10 мМ Y-27632 дигидрохлорида. Держите на льду до использования.
- Добавка L-WRN среда: 50 мл среды L-WRN + 47,5 мл DMEM высокой глюкозы с L-глютамином + 500 мкл L-глутамина + 500 мкл пенницилина/ стрептомицина + 1000 мкл добавки B-27 (50x) + 500 мкл добавки N2 (100x) + 50 мкл буферного раствора HEPES (1 M) (см. Таблицу материалов).
- Фильтруйте полный (дополненный) носитель L-WRN и аликвоту для хранения при -20 °C в течение 3 месяцев.
ПРИМЕЧАНИЕ: Размороженная среда стабильна при 4 °C в течение 2 недель.
- Выполните изоляцию крипты.
- Для общей анестезии добавьте 1 мл изофлурана в хлопок и поместите его в пластиковую кассету в анестезиологической камере объемом 0,09 кубических футов (см. Таблицу материалов). Поместите мышь в анестезиологическую камеру до остановки дыхания (примерно через 3-5 мин), а затем выполните вывих шейки матки20.
- Сделайте примерно 2 разреза вниз по средней линии мыши, закрепив кожу спины, чтобы обнажить брюшко. Изолируют толстую кишку, разрезая чуть ниже слепой кишки с проксимальной стороны и выше прямой кишки с дистальной стороны21.
- С помощью щипцов удаляют жировую ткань, прикрепленную к толстой кишке. Осторожно выталкивайте фекалии, используя плоский конец щипцов, и разрезайте ткань, открытую продольно.
- Промыть ткань 10-15 раз холодным 1x PBS, используя щипцы, чтобы «закрутить» ткань вокруг PBS между стирками.
- С помощью чистых, острых ножниц разрежьте ткань на мелкие кусочки, размером примерно 3-5 мм.
- Повторите процесс для второй мыши и объедините кусочки ткани в пробирке объемом 50 мл, содержащей холодные эпителиальные диссоциационные среды (этап 2.1.1).
- Инкубируют кусочки ткани толстой кишки в эпителиальных диссоциационных средах в течение 90 мин при 4 °C с мягким раскачиванием.
- Дайте фрагментам ткани опуститься на дно трубки, затем осторожно отбросьте эпителиальные диссоциационные среды, не нарушая ткань. Повторите этот процесс при промывке салфетки 10-15 раз холодным 1x PBS. Выбросьте как можно больше PBS во время окончательной стирки.
- Добавьте криптодиссоциационную среду (стадия 2.1.2) в трубку объемом 50 мл, содержащую кусочки ткани толстой кишки, и непрерывно встряхивайте в течение 5-10 мин вручную.
ПРИМЕЧАНИЕ: Носители должны стать мутными от разрозненных склепов. - Под капюшоном клеточной культуры отфильтруйте ткань и среду с помощью ситечка нейлоновых клеток размером 70 мкм (см. Таблицу материалов) в свежую трубку объемом 50 мл.
- Центрифугу при 200 х г в течение 10 мин при комнатной температуре и выбросьте супернатант, не потревожив криптоносную гранулу.
ПРИМЕЧАНИЕ: В зависимости от оборудования можно перенести деформированную среду в трубку объемом 15 мл для центрифугирования. - Повторно суспендировать гранулу в ~3-4 мл холодного 1x PBS.
- Пипетка 10 мкл изолированных склепов в линию на предметном стекле микроскопа. Под микроскопом подсчитайте количество полных, длинных крипт, чтобы оценить концентрацию крипты на 10 мкл.
- Рассчитайте соответствующий объем склепов для вращения, чтобы покрыть 10 крипт / мкл в 96-луночной пластине.
3. Покрытие крипты
- Центрифугировать соответствующий объем изолированных крипт в микроцентрифужной трубке объемом 1,5 мл при 200 х г в течение 5 мин при 4 °С.
- Осторожно удалите супернатант с помощью пипетки объемом 1000 мкл, не нарушая гранулированные крипты.
- Добавьте 100 мкл гелевой матрицы (достаточно для девяти лунок) в гранулированные крипты и пипетку осторожно, чтобы избежать введения пузырьков воздуха.
ПРИМЕЧАНИЕ: Смотрите раздел Обсуждение для подробного описания того, как смешивать гелевую матрицу и крипты. Как правило, 100 мкл достаточно для девяти скважин. - Дайте гелевой матрице частично затвердеть (~1-2 мин).
- Пластина 10 мкл гелевой матрицы смешивается с криптами в каждой лунке предварительно нагретой 96-луночной культуральной пластины с образованием куполообразной формы.
ПРИМЕЧАНИЕ: Поместите купол в центр колодца. Будьте осторожны, чтобы не дать гелевой матрице распространиться по бокам лунки. Подробное описание затвердевания и нанесения покрытий см. в разделе «Обсуждение». - Дайте полностью установить гелевую матрицу в течение 10-20 мин в инкубаторе при 37 °C с 5% CO2.
- Подготовьте окончательное рабочее решение среды L-WRN.
- Добавьте 100 мкл пенницилина/стрептомицина к 10 мл аликвоты среды L-WRN (см. шаг 2.1.3) (стабильно в течение 2 недель при 4 °C).
- Добавьте добавки к 900 мкл среды L-WRN с пенницилином/стрептомицином: 0,9 мкл 1 мг/мл EGF + 0,9 мкл 10 мМ Y-27632 дигидрохлорида.
ПРИМЕЧАНИЕ: Объемы основаны на девяти скважинах. Дигидрохлорид Y-27632 добавляется только на 0 день (во время покрытия).
- Добавьте 100 мкл среды в каждую лунку. Будьте осторожны, чтобы не нарушить купол.
- Инкубировать при 37 °C с 5% CO2 в течение 24 ч.
4. Создание нокаута клаудина-7 в культуре
- Дайте криптам нормально расти в культуре в течение 24 часов после нанесения покрытия.
- В микроцентрифужной трубке объемом 1,5 мл добавляют 2,7 мкл 1 ммоль/л 4-гидрокситамоксифена (4OH-тамоксифен) до 900 мкл среды L-WRN (конечная концентрация 3 мкмоль/л) + 0,9 мкл 1 мг/мл EGF.
ПРИМЕЧАНИЕ: Исходный раствор 4OH-Тамоксифена получают путем смешивания порошкообразного 4OH-тамоксифена (см. Таблицу материалов) с 1x PBS до концентрации 1 ммоль/л. - Удалите старые среды из скважин с помощью вакуумного всасывания.
- Добавьте 100 мкл 4OH-тамоксифенсодержащих сред в каждую лунку и пометьте их как claudin-7 cKO/4OH-TAM.
ПРИМЕЧАНИЕ: ДМСО необходимо добавить в контрольные скважины. Свежие 4OH-тамоксифен-содержащие носители необходимо добавлять каждые 2 дня. - Инкубировать при 37 °C до следующей смены среды (~2-3 дня).
5. Поддержание органоидов толстой кишки
ПРИМЕЧАНИЕ: Медиафайлы должны меняться каждые 2-3 дня. Культура до 12 дней.
- Готовят свежий конечный рабочий раствор среды L-WRN: 900 мкл L-WRN среды + 0,9 мкл 1 мг/мл EGF.
- Удалите старые среды из скважин с помощью вакуумного всасывания. Добавьте свежие медиа в колодцы.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не нарушить купол. - Инкубировать при 37 °C до следующей смены среды.
ПРИМЕЧАНИЕ: Культуры могут поддерживаться и передаваться в течение времени, необходимого для эксперимента. Культуры для настоящего исследования обычно сохранялись в течение 9-12 дней, но можно пожелать продолжить дальше, в течение 15 или 20 дней.
6. Извлечение и встраивание органоидов толстой кишки
- Удалите старые среды из скважин с помощью вакуумного всасывания.
- Зафиксируйте органоиды 4% параформальдегидом (PFA) в течение 1 ч при комнатной температуре.
ПРИМЕЧАНИЕ: PFA является токсичным материалом. Примите меры предосторожности при использовании этого реагента. - Удалите 4% PFA из скважин с помощью вакуумного всасывания и добавьте 30% сахарозы в течение 24 ч при 4 °C.
- Нанесите этикетку на пластиковую форму и заполните ее до 90% компаундом оптимальной температуры резки (OCT) (см. Таблицу материалов).
- Удалите 30% сахарозы из скважин с помощью вакуумного всасывания. Добавьте 10 мкл 1x PBS к каждой скважине.
- Наконечником пипетки аккуратно поцарапайте дно колодца, чтобы диссоциировать купол, содержащий органоиды.
- С помощью пипетки удалите PBS, содержащую диссоциированные органоиды, и загрузите жидкость в форму, содержащую OCT.
ПРИМЕЧАНИЕ: Избегайте введения пузырьков в соединение OCT. - Продолжайте этот процесс до тех пор, пока все органоиды не будут удалены из всех колодцев.
- В колбу Дьюара из нержавеющей стали добавьте гранулы сухого льда и 2-метилбутан (достаточно, чтобы покрыть гранулы сухого льда) (см. Таблицу материалов).
- Устойчиво удерживать органоид-содержащий блок ОКТ выше 2-метилбутана для мгновенного замораживания.
- Храните органоид-содержащий блок ОКТ при -80 °C до готовности к разделению (может храниться до 1 года).
7. Иммунофлуоресценция
- Сечение органоидсодержащего ОКТ блока толщиной 5 мкм с помощью криостата (см. Таблицу материалов) при -20 °C.
- Для каждого участка проверьте под микроскопом, чтобы убедиться, что органоид был захвачен. После завершения секционирования храните слайды при -80 °C до готовности к окрашиванию (можно хранить до 6 месяцев).
- Нагревайте слайды в буфере цитрата натрия 10 мМ в течение 10 мин при 94 °C.
ПРИМЕЧАНИЕ: Буфер производится путем растворения цитрата натрия в деионизированной воде. Отрегулируйте pH до 6 с соляной кислотой. - Дайте горкам остыть на столешнице в течение 20 минут. Смойте дистиллированной водой в течение 5 мин.
- Смонтируйте слайды в окрашивающую стойку (см. Таблицу материалов) с 0,2% Triton X-100 и инкубируйте с глицином 100 мМ в течение 15 мин.
- Смойте три раза 1x PBS в течение 5 минут каждый. Блокировать с 5% бычьим сывороточным альбумином (BSA) в течение 45 мин при комнатной температуре.
- Инкубировать с клаудином-7 против мышиного кролика первичным антителом22 (разведенным в 1% BSA) в течение ночи при 4 °C. Смойте три раза 1x PBS в течение 10 минут каждый.
- Инкубировать с Cy3 анти-кроликом вторичным антителом23 (разведенным в 1% BSA) в течение 1 ч при комнатной температуре. Смойте три раза 1x PBS в течение 10 минут каждый.
- Смонтируйте слайды с помощью соответствующего монтажного носителя (см. Таблицу материалов) с помощью DAPI и добавьте крышку.
8. Обнаружение гибели клеток
- Зафиксируйте органоиды внутри скважин 4% параформальдегидом в течение 1 ч при комнатной температуре. Смойте 1x PBS в течение 5 мин.
- Инкубируют культуральную пластину на льду с 0,1% Тритоном Х-100 в холодном 0,1% цитратном буфере натрия в течение 2 мин. Смойте дважды по 1 pBS в течение 5 минут каждый.
- Приготовьте реакцию TUNEL24,25 с использованием TMR Red, набора для обнаружения гибели клеток in situ(см. Таблицу материалов). Добавьте 50 мкл реакционных реагентов TUNEL в каждую лунку.
- Инкубировать в увлажненной атмосфере в течение 1 ч при 37 °C в темноте.
ПРИМЕЧАНИЕ: Все остальные шаги должны быть выполнены в темноте. - Смойте три раза 1x PBS в течение 5 минут каждый. Инкубировать с 1:2,500 Hoechst (разбавленным в 1x PBS, см. Таблицу материалов) в течение 3 мин.
- Смойте три раза 1x PBS в течение 5 минут каждый. Используйте фильтр TRITC для визуализации изображений на флуоресцентном микроскопе (см. Таблицу материалов).
Результаты
Чтобы изучить регуляторные эффекты клаудина-7 на стволовые клетки толстой кишки, крипты толстой кишки были выделены из ткани толстой кишки мышей, как описано выше и показано на рисунке 1A. Как только крипты были выделены из первичной ткани, они были покрыты 3D-матрицей в 96-луночной пластине для роста в течение 11 дней (рисунок 1). Нормальные здоровые крипты закрывают просвет и становятся сфероидами ко 2-му дню и в конечном итоге начинают почковаться и формировать различные типы эпителиальных клеток примерно на 5-й день (рисунок 1B). Колониоидам было разрешено расти до 11-го дня, где их затем собирали для дальнейших экспериментов (рисунок 1B). Чтобы выбить клодина-7 в культуре, криптам дали нормально расти в течение 24 ч. Через 24 ч крипты обрабатывали 3 мкмоль/л 4OH-тамоксифеном (TAM) и культивировали в течение 10 дополнительных дней. Питательную среду, содержащую свежий 4OH-TAM, меняли каждые 2 дня. DMSO использовался в качестве транспортного средства в контрольных скважинах. Крипты с дефицитом Claudin-7 (claudin-7 KO) не смогли сформировать надлежащие сфероиды и начали быстро умирать после 1 дня лечения 4OH-TAM (рисунок 1B).
Рисунок 2А показывает успешный рост колоноидов из нормальных крипт, содержащих клаудин-7 (контроль), по мере их прогрессирования в течение 9 дней культуры. Эти склепы начали образовывать сфероиды ко 2-му дню, начали почковаться на 5-й день и продолжали расти и почковаться, пока они не были собраны на 9-й день (рисунок 2А). Напротив, склепы, лишенные клодина-7 (claudin-7 KO), очень быстро портились (рисунок 2B). Примерно через 2-3 дня после лечения 4OH-TAM крипты клодина-7 КО не образовывали здоровых сфероидов и появлялись только в виде круговых скоплений клеток (рисунок 2В). Крипты, выделенные от мышей дикого типа, обрабатывали 4OH-TAM, чтобы подтвердить отсутствие токсического эффекта из-за обработки тамоксифеном; эти склепы смогли выжить и нормально расти. Для изучения делеции клодина-7 и состояния выживаемости колоноидов claudin-7 KO использовали метод иммуноокрашения и набор для обнаружения гибели клеток in situ (рисунок 3). Иммунофлуоресцентное окрашивание для клаудина-7 в собранных контрольных и cKO органоидах подтвердило успешное выбивание клаудина-7 в культуре (рисунок 3A). Контрольные колоноиды 9-го дня демонстрировали очень мало апоптотического сигнала (рисунок 3B); однако у колоноидов claudin-7 KO наблюдался высокий апоптоз (рисунок 3B). Без клодина-7 стволовые клетки не могли бы выжить, самообновляться или дифференцироваться с образованием колоноидов.

Рисунок 1: Схематическое изображение, показывающее изоляцию крипты и рост колоноидов. (A) Графическое изображение процесса изоляции крипты, покрытия в 3D-матрице и роста до сбора урожая. (B) Хронология экспериментов и роста колоноидов в контрольных и клодин-7 KO-производных криптах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
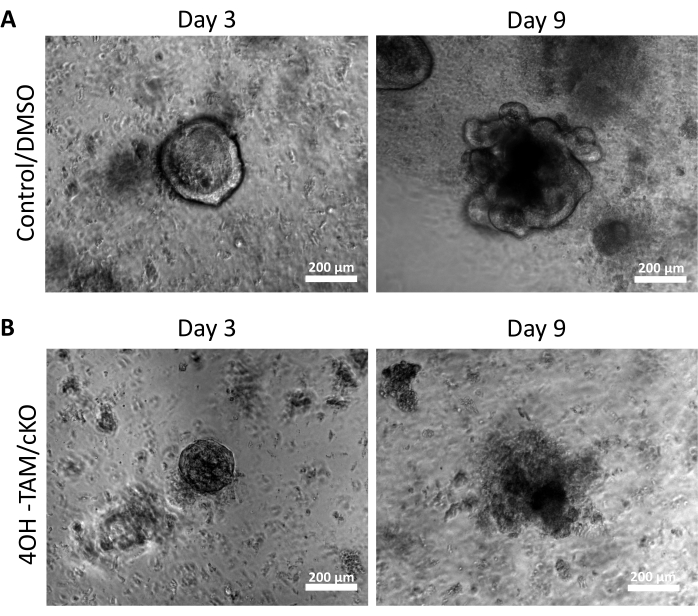
Рисунок 2: Колоноиды с дефицитом Клодина-7 не способны выживать и расти. (А) Репрезентативные изображения контрольных органоидов /ДМСО на 3-й и 9-й день. (B) Репрезентативные изображения органоидов 4OH-TAM/cKO на 3-й и 9-й день, n = 10. Шкала = 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
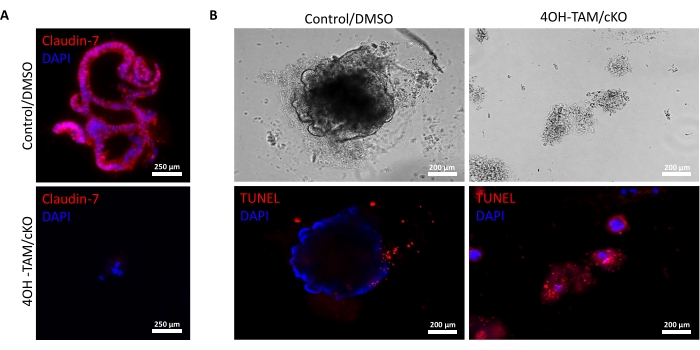
Рисунок 3: Колоноиды с дефицитом Claudin-7 быстро подвергаются апоптозу. (A) Окрашивание Claudin-7 в 9-й день контрольной /DMSO и claudin-7 cKO/4OH-TAM органоидов, n = 3. Шкала стержней = 250 мкм. (B) Апоптотическое окрашивание в контрольный день 9 и колоноиды cKO/4OH-TAM, n = 3. Шкала = 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Органоидная культура является отличной моделью для изучения функции стволовых клеток, физиологии кишечника, открытия лекарств, кишечных заболеваний человека, атакже регенерации и восстановления тканей 7,8,9,10,11,26. Хотя он имеет много преимуществ, его может быть сложно установить. Осторожность должна быть предпринята на всех этапах протокола, но самое главное на этапе покрытия. При смешивании изолированных крипт с гелевой матрицей убедитесь, что пипетка тщательно поднимается и опускается, чтобы разбить гранулу крипты, образованную после центрифугирования, и равномерно распределите крипты по всей матрице. Одновременно избегайте введения пузырьков воздуха в матрицу во время пипетки. Для этого пипетку необходимо производить медленно, кончиком пипетки к нижней части трубки объемом 1,5 мл.
Кроме того, гелевая матрица не должна быть полностью затвердевшей на протяжении всего этого процесса. Чтобы предотвратить преждевременное затвердевание, перемешайте путем тщательного пипетирования, затем поместите трубку на лед и повторите этот процесс. Как только изолированные крипты и гелевая матрица будут достаточно перемешаны, дайте гелевой матрице частично затвердеть. Этот процесс может занять 1-5 минут, в зависимости от типа / марки используемой гелевой матрицы. Он должен напоминать гель, который будет слегка двигаться, если трубка опрокинута, но не должен быть слишком жидким, чтобы он выплеснулся при переворачивании. В этот момент можно начать покрывать 10 мкл в центр каждой скважины. Гелевая матрица должна образовывать 3D-купол и не должна касаться боковых сторон колодца. Если гелевая матрица растекается и ударяется о стенку лунки, она недостаточно затвердевает; подождите, пока он достаточно затвердеет, чтобы сформировать купол, так как склепы не выживут и не вырастут, если купол не будет сформирован. Как только покрытие будет завершено должным образом, и крипты будут достаточно дополнены, как описано выше, органоиды, как ожидается, будут расти без проблем.
Этот протокол устанавливает органоидную систему толстой кишки с клодином-7 или без него, чтобы наблюдать его влияние на выживание стволовых клеток толстой кишки. Хотя органоидная культура толстой кишки является инновационной и выгодной системой, модель все еще имеет ограничения. В зависимости от типа исследования недостаток иммунных клеток и микробиоты в кишечных органоидах может быть преимуществом или недостатком26. Для настоящего исследования целесообразно исследовать регуляторную роль клодина-7 на функции стволовых клеток без иммунного компонента. Был сделан вывод о том, что определенный эффект обусловлен именно клодином-7, а не другими потенциальными переменными, такими как иммунный ответ, который будет присутствовать в моделях животных in vivo. И наоборот, этот фактор может быть ограничением для других типов исследований. Создание культуры органоидов толстой кишки также может быть более дорогостоящим и трудоемким, чем традиционные 2D-клеточные линии. Тем не менее, они могут имитировать клеточное микроокружение тканей, обеспечивая актуальность in vivo, гораздо более репрезентативны для ткани, чем 2D-клеточная культура, и все еще менее дорогостоящи, чем животные модели 4,7. Учитывая обширное применение кишечной органоидной культуры и огромный потенциал, эта система, вероятно, станет идеальной моделью в лабораторных исследованиях во всем мире.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Это исследование финансировалось NIH DK103166.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.09 cubic feet space-saver vacuum desiccator | United States Plastic Corp | 78564 | anesthesia chamber |
| 0.5 M EDTA pH 8.0 | Invitrogen | AM9261 | |
| 1.5 mL microcentrifuge tubes | ThermoFisher | 69715 | |
| 15 mL conical centrifuge tubes | Fisher Scientific | 14-959-53A | |
| 1x Dulbecco’s Phosphate buffered saline | Gibco | 14190-144 | |
| 2-methylbutane | Sigma | 277258 | |
| 4% paraformaldehyde | ThermoFisher | J61899.AK | |
| 4-hydroxytamoxifen (4OH-TAM) | Sigma | 579002 | |
| 50 mL conical centrifuge tubes | Fisher Scientific | 14-432-22 | |
| 70 µm nylon cell strainer | Corning | 352350 | |
| 96 well culture plate | Greiner Bio-One | 655180 | |
| B-27 Supplement (50x) | Gibco | 12587-010 | |
| Bovine serum albumin | Fisher Scientific | BP1605-100 | |
| Claudin-7 anti-murine rabbit antibody | Immuno-Biological Laboratories | 18875 | |
| Cover glass (24 x 50-1.5) | Fisher Scientific | 12544E | |
| Cryomolds | vwr | 25608-916 | |
| Cultrex RCF BME, Type 2 | R&D Systems | 3533-005-02 | gel matrix |
| Cy3 anti-rabbit antibody | Jackson Immunoresearch | 111-165-003 | |
| Dewar Flask | Thomas Scientific | 1173F61 | |
| DMEM High Glucose with L-Glutamine | ATCC | 30-2002 | |
| EVOS FLoid Imaging System | ThermoFisher | 4477136 | |
| Fluoro-Gel II with DAPI | Electron Microscopy Sciences | 17985-50 | |
| GlutaMAX (100x) | Gibco | 35050-061 | |
| Glycine | JT Baker | 4059-02 | |
| HEPES (1 M) Buffer Solution | Gibco | 15630-080 | |
| Hoechst | ThermoFisher | 62249 | |
| In situ cell death detection kit, TMR Red | Roche | 12156792910 | |
| Isoflurane | Pivetal | 07-893-8440 | |
| L-WRN Media | Harvard Medical School Gastrointestinal Organoid Derivation and Culture Core | N/A | |
| Mouse surgical kit | Kent Scientific Corporation | INSMOUSEKIT | |
| Murine EGF | PeproTech | 315-09-500UG | |
| N2 Supplement (100x) | Gibco | 17502-048 | |
| Optimum cutting temperature (OCT) compound | Agar Scientific | AGR1180 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Sequenza Rack | vwr | 10129-584 | |
| Sodium Citrate | Fisher Scientific | S-279 | |
| Sucrose | Sigma | S9378 | |
| Triton X-100 | Sigma | X100 | |
| Vacuum filter (0.22 µm; cellulose acetate) | Corning | 430769 | |
| Y-27632 dihydrochloride | Tocris Bioscience | 1254 |
Ссылки
- Hughes, C. S., Postovit, L. M., Lajoie, G. A. Matrigel: a complex protein mixture required for optimal growth of cell culture. Proteomics. 10 (9), 1886-1890 (2010).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Wallach, T. E., Bayrer, J. R. Intestinal organoids: new frontiers in the study of intestinal disease and physiology. Journal of Pediatric Gastroenterology and Nutrition. 64 (2), 180-185 (2017).
- Shankaran, A., Prasad, K., Chaudhari, S., Brand, A., Satyamoorthy, K. Advances in development and application of human organoids. 3 Biotech. 11 (6), 257 (2021).
- Angus, H., Butt, A., Schultz, M., Kemp, R. Intestinal organoids as a tool for inflammatory bowel disease research. Frontiers in Medicine. 6, 334 (2020).
- Fan, Y., Davidson, L. A., Chapkin, R. S. Murine colonic organoid culture system and down stream assay applications. Methods in Molecular Biology. 1576, 171-181 (2019).
- Gupta, N., et al. Microfluidics-based 3D cell culture models: Utility in novel drug discovery and delivery research. Bioengineering and Translational Medicine. 1 (1), 63-81 (2016).
- Yoo, J., Donowitz, M. Intesitnal enteroids/organoids: A novel platform for drug discovery in inflammatory bowel diseases. World Journal of Gastroenterology. 25 (30), 4125-4147 (2019).
- Qu, M., et al. Establishment of intestinal organoid cultures modeling injury-associated epithelial regeneration. Cell Research. 31 (3), 259-271 (2021).
- Xing, T., et al. Tight junction protein claudin-7 is essential for intestinal epithelial stem cell self-renewal and differentiation. Cellular and Molecular Gastroenterology and Hepatology. 9 (4), 641-659 (2020).
- Ding, L., et al. Inflammation and disruption of the mucosal architecture in claudin-7-deficient mice. Gastroenterology. 142 (2), 305-315 (2012).
- Lu, Z., Ding, L., Lu, Q., Chen, Y. H. Claudins in intestines: distribution and functional significance in health and diseases. Tissue Barriers. 1 (3), 24978 (2013).
- Ding, L., Lu, Z., Lu, Q., Chen, Y. H. The claudin family of proteins in human malignancy: a clinical perspective. Cancer Management and Research. 5, 367-375 (2013).
- Bhat, A. A., et al. Claudin-7 expression induces mesenchymal to epithelial transformation (MET) to inhibit colon tumorigenesis. Oncogene. 34 (35), 4570-4580 (2015).
- Lu, Z., et al. A non-tight junction function of claudin-7-interaction with integrin signaling in suppressing lung cancer cell proliferation and detachement. Molecular Cancer. 14, 120 (2015).
- Wang, K., Xu, C., Li, W., Ding, L. Emerging clinical significance of claudin-7 in colorectal cancer: a review. Cancer Management and Research. 10, 3741-3752 (2018).
- Wang, K., et al. Claudin-7 downregulation induces metastasis and invasion in colorectal cancer via the promotion of epithelial-mesenchymal transition. Biochemical and Biophysical Research Communications. 508 (3), 797-804 (2019).
- Wang, F., et al. Isolation and characterization of intestinal stem cells based on surface marker combinations and colony-formation assay. Gastroenterology. 145 (2), 383 (2013).
- Li, W., et al. Severe intestinal inflammation in the small intestine of mice induced by controllable deletion of claudin-7. Digestive Diseases and Sciences. 63 (5), 1200-1209 (2018).
- Donovan, J., Brown, P. Euthanasia. Current Protocols in Immunology. 73 (1), (2006).
- Khalil, H., Nie, W., Edwards, R. A., Yoo, J. Isolation of primary myofibroblasts from mouse and human colon tissue. Journal of Visual Experiments. (80), e50611 (2013).
- Sugimoto, K., et al. Cell adhesion signals regulate the nuclear receptor activity. Proceedings of the National Academy of Sciences. 116 (49), 24600-24609 (2019).
- Mansour, H., et al. Connexin 30 expression and frewuency of connexin heterogeneity in astrocyte gap junction plaques increase with age in the rat retina. PLoS One. 8 (3), 57038 (2013).
- Miranda, M., et al. Antioxidants rescue photoreceptors in rd1 mice: relationship with thiol metabolism. Free Radical Biology and Medicine. 48 (2), 216-222 (2010).
- Wang, L., et al. Mesenchymal stromal cells ameliorate oxidative stress-induced islet endothelium apoptosis and functional impairment via Wnt4-β-catenin signaling. Stem Cell Research and Therapy. 8 (1), 188 (2017).
- Almeqdadi, M., Mana, M., Roper, J., Yilmaz, O. Gut organoids: mini-tissues in culture to study intestinal physiology and disease. American Journal of Physiology-Cell Physiology. 317 (3), 405-419 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены