Method Article
Culture tridimensionnelle de cryptes coliques murines pour étudier la fonction des cellules souches intestinales ex vivo
Dans cet article
Résumé
Le présent protocole décrit l’établissement d’un système organoïde du côlon murin pour étudier l’activité et le fonctionnement des cellules souches du côlon dans un modèle knockout claudin-7.
Résumé
L’épithélium intestinal se régénère tous les 5 à 7 jours et est contrôlé par la population de cellules souches épithéliales intestinales (IESC) située au fond de la région de la crypte. Les CSEI comprennent les cellules souches actives, qui s’auto-renouvellent et se différencient en divers types de cellules épithéliales, et les cellules souches quiescentes, qui servent de cellules souches de réserve en cas de blessure. La régénération de l’épithélium intestinal est contrôlée par les capacités d’auto-renouvellement et de différenciation de ces IESC actifs. De plus, l’équilibre de la population de cellules souches cryptiques et le maintien de la niche des cellules souches sont essentiels à la régénération intestinale. La culture organoïde est une approche importante et attrayante pour étudier les protéines, les molécules de signalisation et les signaux environnementaux qui régulent la survie et les fonctions des cellules souches. Ce modèle est moins cher, moins long et plus manipulable que les modèles animaux. Les organoïdes imitent également le microenvironnement tissulaire, fournissant une pertinence in vivo . Le présent protocole décrit l’isolement des cryptes du côlon, l’intégration de ces cellules cryptiques isolées dans un système de matrice de gel tridimensionnel et la culture de cellules cryptiques pour former des organoïdes du côlon capables d’auto-organisation, de prolifération, d’auto-renouvellement et de différenciation. Ce modèle permet de manipuler l’environnement - éliminer des protéines spécifiques telles que la claudine 7, activer / désactiver les voies de signalisation, etc. - pour étudier comment ces effets influencent le fonctionnement des cellules souches du côlon. Plus précisément, le rôle de la protéine de jonction serrée claudin-7 dans la fonction des cellules souches du côlon a été examiné. Claudin-7 est vital pour maintenir l’homéostasie intestinale et la fonction et l’intégrité de la barrière. L’élimination de la claudine-7 chez la souris induit un phénotype semblable à une maladie inflammatoire de l’intestin présentant une inflammation intestinale, une hyperplasie épithéliale, une perte de poids, des ulcérations des muqueuses, une desquamation des cellules épithéliales et des adénomes. Auparavant, il a été rapporté que la claudine-7 est nécessaire pour les fonctions des cellules souches épithéliales intestinales dans l’intestin grêle. Dans ce protocole, un système de culture organoïde du côlon est établi pour étudier le rôle de la claudine-7 dans le gros intestin.
Introduction
La culture organoïde intestinale est un système ex vivo tridimensionnel (3D) dans lequel les cellules souches sont isolées des cryptes intestinales du tissu primaire et plaquées dans une matrice de gel 1,2. Ces cellules souches sont capables d’auto-renouvellement, d’auto-organisation et de fonctionnalité des organes2. Les organoïdes imitent le microenvironnement tissulaire et sont plus semblables aux modèles in vivo qu’aux modèles de culture cellulaire in vitro bidimensionnels (2D), bien que moins manipulables que les cellules 3,4. Ce modèle élimine les obstacles rencontrés dans les modèles 2D, tels que le manque d’adhérences cellule-cellule appropriées, les interactions cellule-matrice et les populations homogènes, et réduit également les limites des modèles animaux, y compris les coûts élevés et les longues périodes de temps5. Les organoïdes intestinaux - également appelés colonoïdes pour ceux cultivés à partir de cellules souches dérivées de cryptes du côlon - sont essentiellement des mini-organes qui contiennent un épithélium comprenant tous les types de cellules qui seraient présentes in vivo, ainsi qu’une lumière. Ce modèle permet de manipuler le système pour étudier de nombreux aspects de l’intestin, tels que la niche des cellules souches, la physiologie intestinale, la physiopathologie et la morphogenèse intestinale 3,5,6. Il fournit également un excellent modèle pour la découverte de médicaments, l’étude des troubles intestinaux humains tels que les maladies inflammatoires de l’intestin (MII) et le cancer colorectal, le développement de traitements personnalisés spécifiques au patient et l’étude de la régénération tissulaire 4,7,8,9. En outre, le système organoïde peut également être utilisé pour étudier la communication cellulaire, le métabolisme des médicaments, la viabilité, la prolifération et la réponse aux stimuli 7,8. Bien que des modèles animaux puissent être utilisés pour tester des traitements potentiels pour les affections pathologiques intestinales, ils sont assez limités, car l’étude de plusieurs médicaments à la fois pose un défi. Il y a plus de variables confondantes in vivo, et le coût et le temps associés sont respectivement élevés et longs. D’autre part, le système de culture organoïde permet le criblage de nombreux produits thérapeutiques à la fois dans un laps de temps plus court et permet également un traitement personnalisé grâce à l’utilisation de cultures organoïdes dérivées du patient 4,8. La capacité des organoïdes du côlon à imiter l’organisation, le microenvironnement et la fonctionnalité des tissus en fait également un excellent modèle pour étudier la régénération et la réparation des tissus9. Notre laboratoire a mis en place un système de culture organoïde de l’intestin grêle pour étudier l’effet de la claudine-7 sur les fonctions des cellules souches de l’intestin grêle10. Dans cette étude, un système de culture organoïde intestinal de grande taille est établi pour étudier la capacité, ou l’absence de capacité, des cellules souches à s’auto-renouveler, à se différencier et à proliférer dans un modèle conditionnel de claudin-7 knockout (cKO).
La claudine-7 est une protéine de jonction serrée (TJ) très importante qui est fortement exprimée dans l’intestin et est essentielle au maintien de la fonction et de l’intégrité de TJ11. Les souris cKO souffrent d’un phénotype de type MII, présentant une inflammation sévère, des ulcérations, une desquamation des cellules épithéliales, des adénomes et une augmentation des taux de cytokines11,12. Bien qu’il soit largement admis que les claudines sont vitales pour la fonction de barrière épithéliale, de nouveaux rôles pour les claudines émergent; Ils sont impliqués dans la prolifération, la migration, la progression du cancer et la fonction des cellules souches 10,12,13,14,15,16,17. On ignore actuellement comment la claudine-7 affecte la niche des cellules souches et la fonction des cellules souches du côlon. Comme l’intestin s’auto-renouvelle rapidement environ tous les 5 à 7 jours, le maintien de la niche des cellules souches et le bon fonctionnement des cellules souches actives sont essentiels18. Ici, un système est établi pour examiner les effets régulateurs potentiels de la claudine-7 sur la niche des cellules souches du côlon.
Protocole
Toutes les expériences et procédures sur les animaux ont été approuvées par le Comité de soin et d’utilisation des animaux (IACUC) de l’Université de Caroline de l’Est (ECU) et menées conformément aux directives des National Institutes of Health et de l’ECU sur le soin et l’utilisation des animaux de laboratoire. Des souris knockout claudin-7 inductibles et intestinales spécifiques ont été générées en croisant des souris transgéniques claudin-7-flox C57BL6 avec des souris Villin-CreERT219. Des souris mâles et femelles âgées de 3 mois ont été utilisées dans cette étude.
1. Préparation du réactif/équipement
- Refroidir les réactifs/équipements suivants avant de commencer leurs expériences associées : solution saline tamponnée au phosphate (PBS) pour laver les tissus du côlon pendant l’isolement de la crypte; une bascule/rotateur (placer dans un réfrigérateur à 4 °C) pour l’incubation avec un milieu de dissociation épithéliale.
- Retirer la matrice de gel (voir le tableau des matières) à -20 °C et décongeler sur la glace avant le placage.
- Prérefroidissez la centrifugeuse à 4 °C avant de faire tourner les cryptes pour le placage.
- Refroidir le tampon de citrate de sodium à 0,1 % (voir le tableau des matières) et le conserver sur la glace avant la détection in situ de la mort cellulaire.
- Réchauffer les réactifs suivants avant de commencer leurs expériences associées : une plaque de culture de 96 puits pendant 24 h avant le placage ; Supports L-WRN (voir Tableau des matériaux) avant d’ajouter aux cryptes plaquées et avant chaque changement de support.
- Chauffer le bain-marie à 94 °C avant de le colorer.
2. Isolement de la crypte colique murine
- Préparez le support nécessaire en suivant les étapes ci-dessous.
REMARQUE: Les volumes de milieux sont calculés ici pour le tissu colique de deux souris.- Préparer les milieux de dissociation épithéliale : 30 mL de 1x PBS + 400 μL de 0,5 M EDTA + 50 μL de 10 mM de chlorhydrate Y-27632 (voir le tableau des matières). Conserver sur la glace jusqu’à utilisation.
- Préparer les milieux de dissociation cryptique : 10 mL de 1x PBS + 10 μL de 10 mM de chlorhydrate Y-27632. Conserver sur la glace jusqu’à utilisation.
- Supplément L-WRN : 50 mL de milieu L-WRN + 47,5 mL de DMEM à haute teneur en glucose avec de la L-glutamine + 500 μL de L-glutamine + 500 μL de penniciline/streptomycine + 1 000 μL de supplément de B-27 (50x) + 500 μL de supplément de N2 (100x) + 50 μL de solution tampon HEPES (1 M) (voir Tableau des matières).
- Filtrer le milieu L-WRN complet (supplémenté) et l’aliquote pour le stockage à -20 °C pendant 3 mois maximum.
REMARQUE: Les milieux décongelés sont stables à 4 ° C jusqu’à 2 semaines.
- Effectuez l’isolation de crypte.
- Pour l’anesthésie générale, ajouter 1 mL d’isoflurane au coton et le placer dans une cassette en plastique dans une chambre d’anesthésie de 0,09 pied cube (voir Tableau des matériaux). Placez la souris dans la chambre d’anesthésie jusqu’à ce que la respiration s’arrête (environ 3-5 minutes), puis effectuez une luxation cervicale20.
- Faites une incision d’environ 2 pouces le long de la ligne médiane de la souris, en épinglant la peau du dos pour exposer l’abdomen. Isoler le côlon en coupant juste en dessous du caecum du côté proximal et au-dessus du rectum du côté distal21.
- À l’aide d’une pince, retirez le tissu adipeux attaché au côlon. Poussez doucement les matières fécales à l’aide de l’extrémité plate de la pince et coupez le tissu ouvert longitudinalement.
- Lavez le mouchoir 10-15 fois avec 1x PBS froid en utilisant des forceps pour « tourbillonner » le tissu dans PBS entre les lavages.
- À l’aide de ciseaux propres et tranchants, coupez le tissu en petits morceaux d’environ 3 à 5 mm.
- Répéter le processus pour la deuxième souris et combiner les morceaux de tissu dans un tube de 50 mL contenant un milieu de dissociation épithéliale froid (étape 2.1.1).
- Incuber les morceaux de tissu du côlon dans un milieu de dissociation épithéliale pendant 90 min à 4 °C en berçant doucement.
- Laissez les fragments de tissu couler au fond du tube, puis jetez soigneusement le milieu de dissociation épithéliale sans perturber le tissu. Répétez ce processus lors du lavage du mouchoir 10-15 fois avec froid 1x PBS. Jetez autant de PBS que possible pendant le lavage final.
- Ajouter le milieu de dissociation cryptique (étape 2.1.2) au tube de 50 mL contenant des morceaux de tissu du côlon et agiter continuellement pendant 5 à 10 minutes à la main.
REMARQUE: Les médias doivent devenir nuageux à partir des cryptes dissociées. - Sous la hotte de culture cellulaire, filtrer les tissus et le milieu à l’aide d’une crépine à cellules en nylon de 70 μm (voir le tableau des matériaux) dans un nouveau tube de 50 ml.
- Centrifuger à 200 x g pendant 10 min à température ambiante et jeter le surnageant sans perturber la pastille contenant la crypte.
REMARQUE: Selon l’équipement, on peut transférer le fluide filtré dans un tube de 15 mL pour centrifugation. - Remettez la pastille en suspension dans ~3-4 mL de 1x PBS froid.
- Pipette 10 μL des cryptes isolées dans une ligne sur une lame de microscope. Au microscope, comptez le nombre de cryptes longues et pleines pour estimer la concentration de cryptes par 10 μL.
- Calculez le volume approprié de cryptes à faire tourner afin de plaquer 10 cryptes/μL dans une plaque de 96 puits.
3. Cryptage
- Centrifuger un volume approprié de cryptes isolées dans un tube microcentrifuge de 1,5 mL à 200 x g pendant 5 min à 4 °C.
- Retirez délicatement le surnageant à l’aide d’une pipette de 1 000 μL sans perturber les cryptes granulées.
- Ajouter 100 μL de matrice de gel (assez pour neuf puits) aux cryptes granulées et pipette soigneusement pour éviter d’introduire des bulles d’air.
REMARQUE: Voir la section Discussion pour une description détaillée de la façon de mélanger la matrice de gel et les cryptes. En règle générale, 100 μL est suffisant pour neuf puits. - Laisser la matrice de gel se solidifier partiellement (~1-2 min).
- Plaque 10 μL de la matrice de gel mélangée aux cryptes dans chaque puits d’une plaque de culture préchauffée de 96 puits pour former une forme de dôme.
REMARQUE: Placez le dôme au centre du puits. Veillez à ne pas laisser la matrice de gel se propager sur les côtés du puits. Voir la section Discussion pour une description détaillée de la solidification et du placage. - Laisser la matrice de gel être complètement réglée pendant 10-20 min dans un incubateur à 37 °C avec 5% de CO2.
- Préparer la solution de travail finale du média L-WRN.
- Ajouter 100 μL de penniciline/streptomycine à une partie aliquote de 10 mL de milieu L-WRN (voir étape 2.1.3) (stable pendant 2 semaines à 4 °C).
- Ajouter des suppléments à 900 μL de milieu L-WRN avec de la péniciline/streptomycine : 0,9 μL de 1 mg/mL d’EGF + 0,9 μL de 10 mM de dichlorhydrate Y-27632.
NOTE: Les volumes sont basés sur neuf puits. Le dichlorhydrate Y-27632 n’est ajouté que le jour 0 (au moment du placage).
- Ajouter 100 μL de média à chaque puits. Veillez à ne pas perturber le dôme.
- Incuber à 37 °C avec 5% de CO2 pendant 24 h.
4. Créer Claudin-7 knockout dans la culture
- Laissez les cryptes pousser normalement en culture pendant 24 h après le placage.
- Dans un tube microcentrifuge de 1,5 mL, ajouter 2,7 μL de 1 mmol/L de 4-hydroxytamoxifène (4OH-tamoxifène) à 900 μL de milieu L-WRN (concentration finale de 3 μmol/L) + 0,9 μL de 1 mg/mL d’EGF.
NOTE: La solution mère de 4OH-Tamoxifène est préparée en mélangeant du 4OH-Tamoxifène en poudre (voir le tableau des matières) avec 1x PBS à une concentration de 1 mmol/L. - Retirez les vieux supports des puits par aspiration sous vide.
- Ajouter 100 μL de milieu contenant du 4OH-tamoxifène à chaque puits et étiqueter comme claudin-7 cKO/4OH-TAM.
REMARQUE: DMSO doit être ajouté aux puits de contrôle. Des milieux frais contenant du 4OH-tamoxifène doivent être ajoutés tous les 2 jours. - Incuber à 37 °C jusqu’au prochain changement de média (~2-3 jours).
5. Entretien organoïde du côlon
REMARQUE: Le support doit être changé tous les 2-3 jours. Culture jusqu’à 12 jours.
- Préparer une nouvelle solution de travail finale de milieu L-WRN : 900 μL de milieu L-WRN + 0,9 μL de 1 mg/mL d’EGF.
- Retirez les vieux supports des puits par aspiration sous vide. Ajouter des produits frais aux puits.
REMARQUE: Veillez à ne pas perturber le dôme. - Incuber à 37 °C jusqu’au prochain changement de média.
NOTE: Les cultures peuvent être maintenues et passées pendant la durée souhaitée pour l’expérience. Les cultures pour la présente étude ont généralement été maintenues entre 9 et 12 jours, mais on peut souhaiter continuer plus loin, pendant 15 ou 20 jours.
6. Récolte et intégration des organoïdes du côlon
- Retirez les vieux supports des puits par aspiration sous vide.
- Fixer les organoïdes avec 4% de paraformaldéhyde (PFA) pendant 1 h à température ambiante.
REMARQUE : Le PFA est une matière toxique. Prenez des précautions lors de l’utilisation de ce réactif. - Retirer 4 % de PFA des puits par aspiration sous vide et ajouter 30 % de saccharose pendant 24 h à 4 °C.
- Étiquetez un moule en plastique et remplissez-le à 90 % avec un composé à température de coupe optimale (OCT) (voir le tableau des matériaux).
- Retirer 30% de saccharose des puits par aspiration sous vide. Ajouter 10 μL de 1x PBS à chaque puits.
- À l’aide d’une pointe de pipette, gratter délicatement le fond du puits pour dissocier le dôme contenant les organoïdes.
- À l’aide d’une pipette, retirez le PBS contenant les organoïdes dissociés et chargez le liquide dans le moule contenant de l’OCT.
REMARQUE: Évitez d’introduire des bulles dans le composé OCT. - Continuez ce processus jusqu’à ce que tous les organoïdes aient été retirés de tous les puits.
- Dans une fiole Dewar en acier inoxydable, ajouter des pastilles de glace carbonique et du 2-méthylbutane (assez pour couvrir les pastilles de glace carbonique) (voir le tableau des matières).
- Maintenez régulièrement le bloc OCT contenant des organoïdes au-dessus du 2-méthylbutane pour qu’il soit congelé.
- Conserver le bloc OCT contenant des organoïdes à -80 °C jusqu’à ce qu’il soit prêt à être sectionné (peut être conservé jusqu’à 1 an).
7. Immunofluorescence
- Couper le bloc OCT contenant des organoïdes à une épaisseur de 5 μm à l’aide d’un cryostat (voir tableau des matières) à -20 °C.
- Pour chaque section, vérifier au microscope pour s’assurer qu’un organoïde a été capturé. Lorsque la section est terminée, conserver les lames à -80 °C jusqu’à ce qu’elles soient prêtes à être tachées (peuvent être conservées jusqu’à 6 mois).
- Chauffer les lames dans un tampon de citrate de sodium de 10 mM pendant 10 min à 94 °C.
NOTE: Le tampon est fabriqué en dissolvant le citrate de sodium dans de l’eau désionisée. Ajuster le pH à 6 avec de l’acide chlorhydrique. - Laissez les toboggans refroidir sur la paillasse pendant 20 min. Rincer à l’eau distillée pendant 5 min.
- Assembler les lames dans une grille de coloration (voir tableau des matériaux) avec 0,2% de Triton X-100 et incuber avec 100 mM de glycine pendant 15 min.
- Rincer trois fois avec 1x PBS pendant 5 min chacun. Bloquer avec 5% d’albumine sérique bovine (BSA) pendant 45 min à température ambiante.
- Incuber avec l’anticorps primaire 22 antimurin22 de lapin claudin-7 (dilué dans 1% BSA) pendant une nuit à 4 °C. Rincer trois fois avec 1x PBS pendant 10 min chacun.
- Incuber avec l’anticorps secondaire anti-lapinCy3 23 (dilué dans 1% BSA) pendant 1 h à température ambiante. Rincer trois fois avec 1x PBS pendant 10 min chacun.
- Montez les glissières avec un support de montage approprié (voir Tableau des matériaux) avec DAPI et ajoutez une lamelle de couverture.
8. Détection de la mort cellulaire
- Fixer les organoïdes à l’intérieur des puits avec 4% de paraformaldéhyde pendant 1 h à température ambiante. Rincer avec 1x PBS pendant 5 min.
- Incuber la plaque de culture sur glace avec du Triton X-100 à 0,1 % dans un tampon froid de citrate de sodium à 0,1 % pendant 2 min. Rincer deux fois avec 1x PBS pendant 5 min chacun.
- Préparer la réaction TUNEL24,25 à l’aide de TMR Red, un kit de détection de la mort cellulaire in situ(voir le tableau des matériaux). Ajouter 50 μL de réactifs réactionnels TUNEL à chaque puits.
- Incuber dans une atmosphère humidifiée pendant 1 h à 37 °C dans l’obscurité.
REMARQUE: Toutes les étapes restantes doivent être effectuées dans l’obscurité. - Rincer trois fois avec 1x PBS pendant 5 min chacun. Incuber avec 1:2 500 Hoechst (dilué dans 1x PBS, voir le tableau des matériaux) pendant 3 min.
- Rincer trois fois avec 1x PBS pendant 5 min chacun. Utilisez le filtre TRITC pour visualiser des images sur un microscope fluorescent (voir Tableau des matériaux).
Résultats
Afin d’examiner les effets régulateurs de la claudine-7 sur les cellules souches du côlon, des cryptes du côlon ont été isolées à partir de tissu murin du côlon, comme décrit ci-dessus et illustré à la figure 1A. Une fois les cryptes isolées du tissu primaire, elles ont été plaquées dans une matrice 3D dans une plaque de 96 puits pour croître pendant 11 jours (Figure 1). Les cryptes saines normales fermeront la lumière et deviendront des sphéroïdes au jour 2 et commenceront éventuellement à bourgeonner et à former les différents types de cellules épithéliales vers le jour 5 (Figure 1B). Les colonoïdes ont été autorisés à croître jusqu’au jour 11, où ils ont ensuite été récoltés pour d’autres expériences (Figure 1B). Pour éliminer claudin-7 en culture, les cryptes ont été autorisées à pousser normalement pendant 24 h. Après 24 h, les cryptes ont été traitées avec 3 μmol/L de 4OH-tamoxifène (TAM) et cultivées pendant 10 jours supplémentaires. Le milieu de culture contenant du 4OH-TAM frais a été changé tous les 2 jours. Le DMSO a été utilisé comme véhicule dans les puits de contrôle. Les cryptes déficientes en claudin-7 (claudin-7 KO) n’ont pas réussi à former des sphéroïdes appropriés et ont commencé à mourir rapidement après 1 jour de traitement 4OH-TAM (Figure 1B).
La figure 2A met en évidence la croissance réussie des colonoïdes à partir de cryptes normales contenant de la claudine 7 (témoin) au fur et à mesure qu’ils progressent tout au long des 9 jours de culture. Ces cryptes ont commencé à former des sphéroïdes au jour 2, ont commencé à bourgeonner le jour 5 et ont continué à croître et à bourgeonner jusqu’à ce qu’elles soient récoltées le jour 9 (Figure 2A). En revanche, les cryptes dépourvues de claudin-7 (claudin-7 KO) se sont détériorées très rapidement (Figure 2B). Environ 2 à 3 jours après le traitement par 4OH-TAM, les cryptes KO de claudine-7 n’avaient pas formé de sphéroïdes d’apparence saine et n’apparaissaient que sous forme d’amas circulaires de cellules (Figure 2B). Des cryptes isolées de souris de type sauvage ont été traitées avec du 4OH-TAM pour confirmer qu’il n’y a pas d’effet toxique dû au traitement au tamoxifène; Ces cryptes ont pu survivre et croître normalement. Pour examiner la délétion de la claudine 7 et les conditions de survie des colonoïdes KO de la claudine-7, une méthode d’immunomarquage et un kit de détection de la mort cellulaire in situ ont été utilisés (Figure 3). La coloration immunofluorescente de la claudine-7 dans les organoïdes témoins récoltés et cKO a confirmé l’élimination réussie de la claudine-7 en culture (figure 3A). Les colonoïdes témoins du jour 9 présentaient très peu de signal apoptotique (figure 3B); cependant, les colonoïdes KO claudin-7 présentaient une apoptose élevée (Figure 3B). Sans claudine-7, les cellules souches ne pourraient pas survivre, s’auto-renouveler ou se différencier pour former des colonoïdes.

Figure 1 : Représentation schématique montrant l’isolement de la crypte et la croissance des colonoïdes. (A) Représentation graphique du processus d’isolation de la crypte, du placage dans la matrice 3D et de la croissance jusqu’à la récolte. (B) Chronologie des expériences et de la croissance des colonoïdes dans les cryptes témoins et dérivées de la claudine-7 KO. Veuillez cliquer ici pour voir une version agrandie de cette figure.
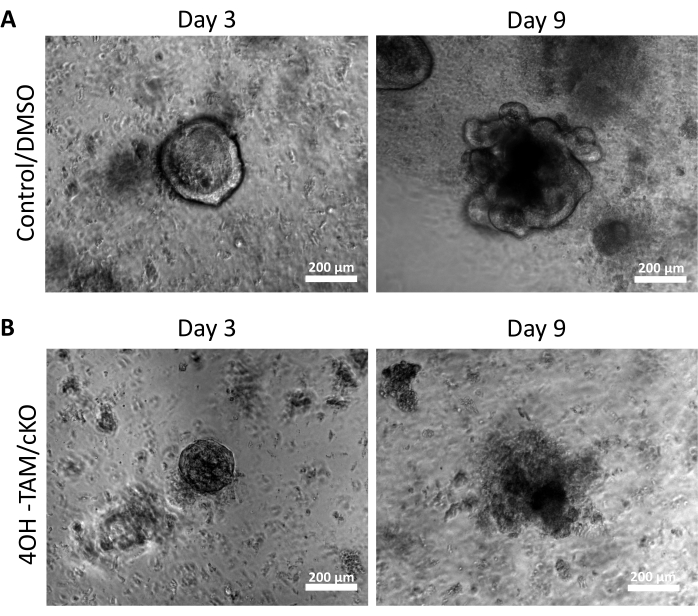
Figure 2 : Les colonoïdes déficients en Claudin-7 sont incapables de survivre et de croître. (A) Images représentatives des organoïdes témoins/DMSO au jour 3 et au jour 9. (B) Images représentatives des organoïdes 4OH-TAM/cKO au jour 3 et au jour 9, n = 10. Barres d’échelle = 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
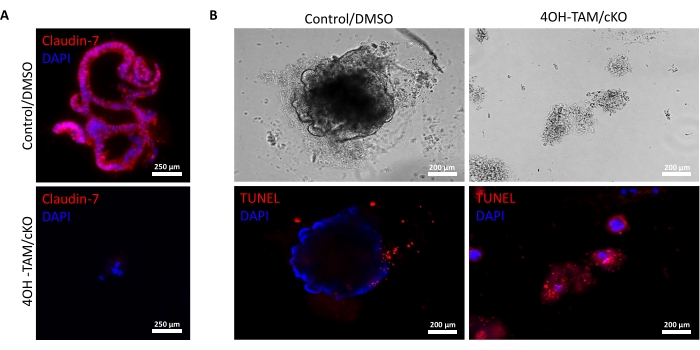
Figure 3 : Les coloïdes déficients en Claudin-7 subissent rapidement une apoptose. (A) Coloration Claudin-7 dans les organoïdes témoins du jour 9/DMSO et claudin-7 cKO/4OH-TAM, n = 3. Barres d’échelle = 250 μm. (B) Coloration apoptotique chez les colonoïdes témoins du jour 9 et claudin-7 cKO/4OH-TAM, n = 3. Barres d’échelle = 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La culture organoïde est un excellent modèle pour étudier la fonction des cellules souches, la physiologie intestinale, la découverte de médicaments, les maladies intestinales humaines et la régénération et la réparation des tissus 7,8,9,10,11,26. Bien qu’il présente de nombreux avantages, il peut être difficile à établir. Des précautions doivent être prises dans toutes les étapes du protocole, mais surtout pendant la phase de placage. Lorsque vous mélangez les cryptes isolées avec une matrice de gel, assurez-vous de bien pipeter de haut en bas pour briser la pastille de crypte formée après la centrifugation et répartir les cryptes uniformément dans toute la matrice. Parallèlement, évitez d’introduire des bulles d’air dans la matrice pendant le pipetage. Pour ce faire, le pipetage doit être effectué lentement, avec l’embout de la pipette vers le bas du tube de 1,5 mL.
De plus, la matrice de gel ne doit pas être complètement solidifiée tout au long de ce processus. Pour éviter une solidification prématurée, mélangez par pipetage soigneux, puis placez le tube sur de la glace et répétez ce processus. Une fois que les cryptes isolées et la matrice de gel sont suffisamment mélangées, laissez la matrice de gel se solidifier partiellement. Ce processus peut prendre de 1 à 5 minutes, selon le type / la marque de matrice de gel utilisée. Il doit ressembler à un gel qui bougera légèrement si le tube est basculé, mais ne doit pas être trop liquide pour qu’il déborde s’il était inversé. À ce stade, on peut commencer à plaquer 10 μL au centre de chaque puits. La matrice de gel doit former un dôme 3D et ne doit pas toucher les côtés du puits. Si la matrice de gel se propage et frappe la paroi du puits, elle n’est pas suffisamment solidifiée; Attendez qu’il soit suffisamment solidifié pour former un dôme, car les cryptes ne survivront pas et ne grandiront pas si le dôme n’est pas formé. Une fois que le placage est terminé correctement et que les cryptes sont suffisamment complétées, comme expliqué ci-dessus, les organoïdes devraient se développer sans problème.
Ce protocole établit un système organoïde du côlon avec ou sans claudine-7 pour observer ses effets sur la survie des cellules souches du côlon. Bien que la culture organoïde du côlon soit un système innovant et avantageux, le modèle a encore des limites. Selon le type d’étude, l’absence de cellules immunitaires et de microbiote dans les organoïdes intestinaux peut être un avantage ou un inconvénient26. Pour la présente étude, il est avantageux d’étudier le rôle régulateur de la claudine-7 sur les fonctions des cellules souches sans la composante immunitaire. Il a été conclu qu’un certain effet est spécifiquement dû à la claudine 7, plutôt qu’à d’autres variables potentielles telles que la réponse immunitaire qui serait présente dans des modèles animaux in vivo. Inversement, ce facteur peut constituer une limite pour d’autres types d’études. L’établissement d’une culture organoïde du côlon peut également être plus coûteux et plus long que les lignées cellulaires 2D traditionnelles. Cependant, ils peuvent imiter le microenvironnement cellulaire des tissus fournissant une pertinence in vivo, sont beaucoup plus représentatifs des tissus que la culture cellulaire 2D et sont encore moins coûteux que les modèles animaux 4,7. Compte tenu de la vaste application et de l’énorme potentiel de la culture d’organoïdes intestinaux, ce système est susceptible de devenir le modèle idéal dans la recherche en laboratoire dans le monde entier.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Cette étude a été financée par NIH DK103166.
matériels
| Name | Company | Catalog Number | Comments |
| 0.09 cubic feet space-saver vacuum desiccator | United States Plastic Corp | 78564 | anesthesia chamber |
| 0.5 M EDTA pH 8.0 | Invitrogen | AM9261 | |
| 1.5 mL microcentrifuge tubes | ThermoFisher | 69715 | |
| 15 mL conical centrifuge tubes | Fisher Scientific | 14-959-53A | |
| 1x Dulbecco’s Phosphate buffered saline | Gibco | 14190-144 | |
| 2-methylbutane | Sigma | 277258 | |
| 4% paraformaldehyde | ThermoFisher | J61899.AK | |
| 4-hydroxytamoxifen (4OH-TAM) | Sigma | 579002 | |
| 50 mL conical centrifuge tubes | Fisher Scientific | 14-432-22 | |
| 70 µm nylon cell strainer | Corning | 352350 | |
| 96 well culture plate | Greiner Bio-One | 655180 | |
| B-27 Supplement (50x) | Gibco | 12587-010 | |
| Bovine serum albumin | Fisher Scientific | BP1605-100 | |
| Claudin-7 anti-murine rabbit antibody | Immuno-Biological Laboratories | 18875 | |
| Cover glass (24 x 50-1.5) | Fisher Scientific | 12544E | |
| Cryomolds | vwr | 25608-916 | |
| Cultrex RCF BME, Type 2 | R&D Systems | 3533-005-02 | gel matrix |
| Cy3 anti-rabbit antibody | Jackson Immunoresearch | 111-165-003 | |
| Dewar Flask | Thomas Scientific | 1173F61 | |
| DMEM High Glucose with L-Glutamine | ATCC | 30-2002 | |
| EVOS FLoid Imaging System | ThermoFisher | 4477136 | |
| Fluoro-Gel II with DAPI | Electron Microscopy Sciences | 17985-50 | |
| GlutaMAX (100x) | Gibco | 35050-061 | |
| Glycine | JT Baker | 4059-02 | |
| HEPES (1 M) Buffer Solution | Gibco | 15630-080 | |
| Hoechst | ThermoFisher | 62249 | |
| In situ cell death detection kit, TMR Red | Roche | 12156792910 | |
| Isoflurane | Pivetal | 07-893-8440 | |
| L-WRN Media | Harvard Medical School Gastrointestinal Organoid Derivation and Culture Core | N/A | |
| Mouse surgical kit | Kent Scientific Corporation | INSMOUSEKIT | |
| Murine EGF | PeproTech | 315-09-500UG | |
| N2 Supplement (100x) | Gibco | 17502-048 | |
| Optimum cutting temperature (OCT) compound | Agar Scientific | AGR1180 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Sequenza Rack | vwr | 10129-584 | |
| Sodium Citrate | Fisher Scientific | S-279 | |
| Sucrose | Sigma | S9378 | |
| Triton X-100 | Sigma | X100 | |
| Vacuum filter (0.22 µm; cellulose acetate) | Corning | 430769 | |
| Y-27632 dihydrochloride | Tocris Bioscience | 1254 |
Références
- Hughes, C. S., Postovit, L. M., Lajoie, G. A. Matrigel: a complex protein mixture required for optimal growth of cell culture. Proteomics. 10 (9), 1886-1890 (2010).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Wallach, T. E., Bayrer, J. R. Intestinal organoids: new frontiers in the study of intestinal disease and physiology. Journal of Pediatric Gastroenterology and Nutrition. 64 (2), 180-185 (2017).
- Shankaran, A., Prasad, K., Chaudhari, S., Brand, A., Satyamoorthy, K. Advances in development and application of human organoids. 3 Biotech. 11 (6), 257 (2021).
- Angus, H., Butt, A., Schultz, M., Kemp, R. Intestinal organoids as a tool for inflammatory bowel disease research. Frontiers in Medicine. 6, 334 (2020).
- Fan, Y., Davidson, L. A., Chapkin, R. S. Murine colonic organoid culture system and down stream assay applications. Methods in Molecular Biology. 1576, 171-181 (2019).
- Gupta, N., et al. Microfluidics-based 3D cell culture models: Utility in novel drug discovery and delivery research. Bioengineering and Translational Medicine. 1 (1), 63-81 (2016).
- Yoo, J., Donowitz, M. Intesitnal enteroids/organoids: A novel platform for drug discovery in inflammatory bowel diseases. World Journal of Gastroenterology. 25 (30), 4125-4147 (2019).
- Qu, M., et al. Establishment of intestinal organoid cultures modeling injury-associated epithelial regeneration. Cell Research. 31 (3), 259-271 (2021).
- Xing, T., et al. Tight junction protein claudin-7 is essential for intestinal epithelial stem cell self-renewal and differentiation. Cellular and Molecular Gastroenterology and Hepatology. 9 (4), 641-659 (2020).
- Ding, L., et al. Inflammation and disruption of the mucosal architecture in claudin-7-deficient mice. Gastroenterology. 142 (2), 305-315 (2012).
- Lu, Z., Ding, L., Lu, Q., Chen, Y. H. Claudins in intestines: distribution and functional significance in health and diseases. Tissue Barriers. 1 (3), 24978 (2013).
- Ding, L., Lu, Z., Lu, Q., Chen, Y. H. The claudin family of proteins in human malignancy: a clinical perspective. Cancer Management and Research. 5, 367-375 (2013).
- Bhat, A. A., et al. Claudin-7 expression induces mesenchymal to epithelial transformation (MET) to inhibit colon tumorigenesis. Oncogene. 34 (35), 4570-4580 (2015).
- Lu, Z., et al. A non-tight junction function of claudin-7-interaction with integrin signaling in suppressing lung cancer cell proliferation and detachement. Molecular Cancer. 14, 120 (2015).
- Wang, K., Xu, C., Li, W., Ding, L. Emerging clinical significance of claudin-7 in colorectal cancer: a review. Cancer Management and Research. 10, 3741-3752 (2018).
- Wang, K., et al. Claudin-7 downregulation induces metastasis and invasion in colorectal cancer via the promotion of epithelial-mesenchymal transition. Biochemical and Biophysical Research Communications. 508 (3), 797-804 (2019).
- Wang, F., et al. Isolation and characterization of intestinal stem cells based on surface marker combinations and colony-formation assay. Gastroenterology. 145 (2), 383 (2013).
- Li, W., et al. Severe intestinal inflammation in the small intestine of mice induced by controllable deletion of claudin-7. Digestive Diseases and Sciences. 63 (5), 1200-1209 (2018).
- Donovan, J., Brown, P. Euthanasia. Current Protocols in Immunology. 73 (1), (2006).
- Khalil, H., Nie, W., Edwards, R. A., Yoo, J. Isolation of primary myofibroblasts from mouse and human colon tissue. Journal of Visual Experiments. (80), e50611 (2013).
- Sugimoto, K., et al. Cell adhesion signals regulate the nuclear receptor activity. Proceedings of the National Academy of Sciences. 116 (49), 24600-24609 (2019).
- Mansour, H., et al. Connexin 30 expression and frewuency of connexin heterogeneity in astrocyte gap junction plaques increase with age in the rat retina. PLoS One. 8 (3), 57038 (2013).
- Miranda, M., et al. Antioxidants rescue photoreceptors in rd1 mice: relationship with thiol metabolism. Free Radical Biology and Medicine. 48 (2), 216-222 (2010).
- Wang, L., et al. Mesenchymal stromal cells ameliorate oxidative stress-induced islet endothelium apoptosis and functional impairment via Wnt4-β-catenin signaling. Stem Cell Research and Therapy. 8 (1), 188 (2017).
- Almeqdadi, M., Mana, M., Roper, J., Yilmaz, O. Gut organoids: mini-tissues in culture to study intestinal physiology and disease. American Journal of Physiology-Cell Physiology. 317 (3), 405-419 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon