Method Article
Cultivo tridimensional de criptas colónicas murinas para estudiar la función de las células madre intestinales ex vivo
En este artículo
Resumen
El presente protocolo describe el establecimiento de un sistema organoide colónico murino para estudiar la actividad y el funcionamiento de las células madre colónicas en un modelo knockout de claudina-7.
Resumen
El epitelio intestinal se regenera cada 5-7 días, y es controlado por la población de células madre epiteliales intestinales (IESC) ubicada en la parte inferior de la región de la cripta. Las IESC incluyen células madre activas, que se autorrenuevan y se diferencian en varios tipos de células epiteliales, y células madre quiescentes, que sirven como células madre de reserva en caso de lesión. La regeneración del epitelio intestinal está controlada por las capacidades autorrenovadoras y diferenciadoras de estos IESC activos. Además, el equilibrio de la población de células madre de la cripta y el mantenimiento del nicho de células madre son esenciales para la regeneración intestinal. El cultivo de organoides es un enfoque importante y atractivo para estudiar proteínas, moléculas de señalización y señales ambientales que regulan la supervivencia y las funciones de las células madre. Este modelo es menos costoso, consume menos tiempo y es más manipulable que los modelos animales. Los organoides también imitan el microambiente tisular, proporcionando relevancia in vivo . El presente protocolo describe el aislamiento de criptas colónicas, incrustando estas células de cripta aisladas en un sistema de matriz de gel tridimensional y cultivando células de cripta para formar organoides colónicos capaces de autoorganización, proliferación, autorrenovación y diferenciación. Este modelo permite manipular el entorno, eliminando proteínas específicas como la claudina-7, activando / desactivando las vías de señalización, etc., para estudiar cómo estos efectos influyen en el funcionamiento de las células madre del colon. Específicamente, se examinó el papel de la proteína de unión estrecha claudina-7 en la función de las células madre del colon. Claudina-7 es vital para mantener la homeostasis intestinal y la función e integridad de barrera. La eliminación de claudina-7 en ratones induce un fenotipo similar a la enfermedad inflamatoria intestinal que exhibe inflamación intestinal, hiperplasia epitelial, pérdida de peso, ulceraciones de la mucosa, desprendimiento de células epiteliales y adenomas. Anteriormente, se informó que la claudina-7 es necesaria para las funciones de las células madre epiteliales intestinales en el intestino delgado. En este protocolo, se establece un sistema de cultivo de organoides colónicos para estudiar el papel de la claudina-7 en el intestino grueso.
Introducción
El cultivo de organoides intestinales es un sistema tridimensional (3D) ex vivo en el que las células madre se aíslan de las criptas intestinales del tejido primario y se colocan en una matriz de gel 1,2. Estas células madre son capaces de autorrenovación, autoorganización y funcionalidad de órganos2. Los organoides imitan el microambiente tisular y son más similares a los modelos in vivo que a los modelos de cultivo celular in vitro bidimensionales (2D), aunque menos manipulables que las células 3,4. Este modelo elimina los obstáculos encontrados en los modelos 2D, como la falta de adherencias adecuadas célula-célula, interacciones célula-matriz y poblaciones homogéneas, y también reduce las limitaciones de los modelos animales, incluidos los altos costos y los largos períodos de tiempo5. Los organoides intestinales, también conocidos como colonoides para aquellos cultivados a partir de células madre derivadas de criptas colónicas, son esencialmente miniórganos que contienen un epitelio que incluye todos los tipos de células que estarían presentes in vivo, así como un lumen. Este modelo permite la manipulación del sistema para estudiar muchos aspectos del intestino, como el nicho de células madre, la fisiología intestinal, la fisiopatología y la morfogénesis intestinal 3,5,6. También proporciona un gran modelo para el descubrimiento de fármacos, estudiando trastornos intestinales humanos como la enfermedad inflamatoria intestinal (EII) y el cáncer colorrectal, el desarrollo de tratamientos personalizados específicos para el paciente y el estudio de la regeneración de tejidos 4,7,8,9. Además, el sistema organoide también puede ser utilizado para estudiar la comunicación celular, el metabolismo de los fármacos, la viabilidad, la proliferación y la respuesta a estímulos 7,8. Si bien los modelos animales pueden usarse para probar terapias potenciales para afecciones patológicas intestinales, son bastante limitados, ya que estudiar múltiples medicamentos a la vez plantea un desafío. Hay más variables de confusión in vivo, y el costo y el tiempo asociados son altos y largos, respectivamente. Por otro lado, el sistema de cultivo de organoides permite el cribado de muchas terapias a la vez en un período de tiempo más corto y también permite el tratamiento personalizado mediante el uso del cultivo de organoides derivado del paciente 4,8. La capacidad de los organoides colónicos para imitar la organización tisular, el microambiente y la funcionalidad también los convierte en un excelente modelo para estudiar la regeneración y la reparación de tejidos9. Nuestro laboratorio ha establecido un sistema de cultivo de organoides del intestino delgado para estudiar el efecto de la claudina-7 en las funciones de las células madre del intestino delgado10. En este estudio, se establece un sistema de cultivo de organoides del intestino grande para estudiar la capacidad o falta de capacidad de las células madre para autorrenovarse, diferenciarse y proliferar en un modelo de knockout condicional de claudina-7 (cKO).
La claudina-7 es una proteína de unión estrecha (TJ) muy importante que se expresa altamente en el intestino y es esencial para mantener la función e integridad de TJ11. Los ratones cKO sufren de un fenotipo similar a la EII, exhibiendo inflamación severa, ulceraciones, desprendimiento de células epiteliales, adenomas y aumento de los niveles de citoquinas11,12. Si bien es ampliamente aceptado que las claudinas son vitales para la función de barrera epitelial, están surgiendo nuevos roles para las claudinas; Están involucrados en la proliferación, migración, progresión del cáncer y función de las células madre 10,12,13,14,15,16,17. Actualmente se desconoce cómo la claudina-7 afecta el nicho de células madre y la función de las células madre del colon. Como el intestino se renueva rápidamente aproximadamente cada 5-7 días, el mantenimiento del nicho de células madre y el funcionamiento adecuado de las células madre activas es vital18. Aquí, se establece un sistema para examinar los posibles efectos reguladores de la claudina-7 en el nicho de células madre del colon.
Protocolo
Todos los experimentos y procedimientos con animales fueron aprobados por el Comité de Cuidado y Uso de Animales (IACUC) de la Universidad de Carolina del Este (ECU) y se llevaron a cabo de conformidad con las pautas de los Institutos Nacionales de Salud y ECU sobre el cuidado y uso de animales de laboratorio. Se generaron ratones knockout de claudina-7 específicos intestinales inducibles cruzando ratones transgénicos C57BL6 claudina-7-flox con ratones Villin-CreERT219. En este estudio se utilizaron ratones machos y hembras de 3 meses de edad.
1. Preparación del reactivo/equipo
- Enfríe los siguientes reactivos/equipos antes de comenzar sus experimentos asociados: solución salina tamponada con fosfato (PBS) para lavar el tejido del colon durante el aislamiento de la cripta; un balancín/rotador (colocar en nevera a 4 °C) para incubación con medios de disociación epitelial.
- Retire la matriz de gel (ver Tabla de materiales) a -20 °C y descongele en hielo antes de chapar.
- Enfríe previamente la centrífuga a 4 °C antes de girar las criptas para el chapado.
- Enfríe el tampón de citrato de sodio al 0,1% (consulte la Tabla de materiales) y manténgalo en hielo antes de la detección de muerte celular in situ .
- Calentar los siguientes reactivos antes de comenzar sus experimentos asociados: una placa de cultivo de 96 pocillos durante 24 h antes del recubrimiento; Medios L-WRN (consulte la Tabla de materiales) antes de agregarlos a las criptas plateadas y antes de cada cambio de medios.
- Calentar el baño maría a 94 °C antes de teñir.
2. Aislamiento de la cripta colónica murina
- Prepare los medios necesarios siguiendo los pasos a continuación.
NOTA: Los volúmenes de medios se calculan aquí para el tejido colónico de dos ratones.- Preparar medios de disociación epitelial: 30 mL de 1x PBS + 400 μL de 0,5 M EDTA + 50 μL de 10 mM Y-27632 diclorhidrato (ver Tabla de Materiales). Mantener en hielo hasta su uso.
- Preparar medios de disociación de criptas: 10 mL de 1x PBS + 10 μL de 10 mM Y-27632 diclorhidrato. Mantener en hielo hasta su uso.
- Suplemento de medios L-WRN: 50 ml de medios L-WRN + 47,5 ml de DMEM glucosa alta con L-glutamina + 500 μL de L-glutamina + 500 μL de pennicilina/estreptomicina + 1.000 μL de suplemento B-27 (50x) + 500 μL de suplemento N2 (100x) + 50 μL de solución tampón HEPES (1 M) (ver Tabla de materiales).
- Filtrar el medio L-WRN completo (suplementado) y la alícuota para su almacenamiento a -20 °C durante un máximo de 3 meses.
NOTA: El medio descongelado es estable a 4 °C durante un máximo de 2 semanas.
- Realice el aislamiento de la cripta.
- Para la anestesia general, agregue 1 ml de isoflurano al algodón y colóquelo dentro de un casete de plástico dentro de una cámara de anestesia de 0.09 pies cúbicos (consulte la Tabla de materiales). Coloque el ratón en la cámara de anestesia hasta que la respiración se detenga (aproximadamente 3-5 min) y luego realice la luxación cervical20.
- Haga una incisión de aproximadamente 2 pulgadas por la línea media del ratón, fijando la piel de la espalda para exponer el abdomen. Aislar el colon cortando justo debajo del ciego desde el lado proximal y por encima del recto desde el lado distal21.
- Con fórceps, retire el tejido adiposo adherido al colon. Empuje suavemente las heces hacia afuera utilizando el extremo plano de los fórceps y corte el tejido abierto longitudinalmente.
- Lave el pañuelo de papel 10-15 veces con PBS frío 1x usando fórceps para "girar" el tejido alrededor de PBS entre lavados.
- Con tijeras limpias y afiladas, corte el tejido en trozos pequeños, de aproximadamente 3-5 mm de tamaño.
- Repita el proceso para el segundo ratón y combine las piezas de tejido en un tubo de 50 ml que contenga medios de disociación epitelial fría (paso 2.1.1).
- Incubar las piezas de tejido del colon en medios de disociación epitelial durante 90 min a 4 °C con un balanceo suave.
- Permita que los fragmentos de tejido se hundan hasta el fondo del tubo, luego deseche cuidadosamente los medios de disociación epitelial sin interrumpir el tejido. Repita este proceso al lavar el pañuelo 10-15 veces con PBS frío 1x. Deseche la mayor cantidad posible de PBS durante el lavado final.
- Añadir los medios de disociación de cripta (paso 2.1.2) al tubo de 50 ml que contiene trozos de tejido del colon y agitar continuamente durante 5-10 minutos con la mano.
NOTA: Los medios deben volverse turbios de las criptas disociadas. - Bajo la campana de cultivo celular, filtre el tejido y el medio con un filtro de células de nylon de 70 μm (consulte la Tabla de materiales) en un tubo fresco de 50 ml.
- Centrifugar a 200 x g durante 10 min a temperatura ambiente y desechar el sobrenadante sin alterar el pellet que contiene la cripta.
NOTA: Dependiendo del equipo, se pueden transferir los medios deformados a un tubo de 15 ml para centrifugar. - Resuspender el pellet en ~3-4 mL de PBS frío 1x.
- Pipetear 10 μL de las criptas aisladas en una línea en un portaobjetos de microscopio. Bajo el microscopio, cuente el número de criptas largas y completas para estimar la concentración de criptas por 10 μL.
- Calcule el volumen apropiado de criptas para girar hacia abajo con el fin de colocar 10 criptas / μL en una placa de 96 pocillos.
3. Chapado de cripta
- Centrifugar un volumen apropiado de criptas aisladas en un tubo de microcentrífuga de 1,5 ml a 200 x g durante 5 min a 4 °C.
- Retire con cuidado el sobrenadante con una pipeta de 1.000 μL sin interrumpir las criptas granuladas.
- Agregue 100 μL de matriz de gel (suficiente para nueve pocillos) a las criptas peletizadas y pipete cuidadosamente para evitar la introducción de burbujas de aire.
NOTA: Consulte la sección Discusión para obtener una descripción detallada de cómo mezclar la matriz de gel y las criptas. Por lo general, 100 μL es suficiente para nueve pozos. - Permita que la matriz de gel se solidifique parcialmente (~1-2 min).
- Placa de 10 μL de la matriz de gel mezclada con las criptas en cada pocillo de una placa de cultivo de 96 pocillos precalentada para formar una forma de cúpula.
NOTA: Coloque la cúpula en el centro del pozo. Tenga cuidado de no permitir que la matriz de gel se extienda a los lados del pozo. Consulte la sección Discusión para obtener una descripción detallada sobre la solidificación y el recubrimiento. - Deje que la matriz de gel se fije completamente durante 10-20 minutos en una incubadora a 37 °C con 5% deCO2.
- Preparar la solución de trabajo final de los medios L-WRN.
- Añadir 100 μL de pennicilina/estreptomicina a una alícuota de 10 ml de medios L-WRN (ver paso 2.1.3) (estable durante 2 semanas a 4 °C).
- Añadir suplementos a 900 μL de medios L-WRN con pennicilina/estreptomicina: 0,9 μL de 1 mg/ml de EGF + 0,9 μL de 10 mM Y-27632 diclorhidrato.
NOTA: Los volúmenes se basan en nueve pozos. El diclorhidrato Y-27632 solo se agrega el día 0 (en el momento del recubrimiento).
- Agregue 100 μL de medio a cada pocillo. Tenga cuidado de no interrumpir la cúpula.
- Incubar a 37 °C con 5% deCO2 durante 24 h.
4. Creando el knockout de claudina-7 en la cultura
- Deje que las criptas crezcan normalmente en cultivo durante 24 h después del enchapado.
- En un tubo de microcentrífuga de 1,5 ml, añadir 2,7 μL de 1 mmol/L de 4-hidroxitamoxifeno (4OH-tamoxifeno) a 900 μL de medios L-WRN (concentración final de 3 μmol/L) + 0,9 μL de 1 mg/ml de EGF.
NOTA: La solución madre de 4OH-tamoxifeno se prepara mezclando 4OH-tamoxifeno en polvo (ver Tabla de materiales) con 1x PBS a una concentración de 1 mmol / L. - Retire los medios viejos de los pozos mediante succión al vacío.
- Agregue 100 μL de medios que contengan 4OH-tamoxifeno a cada pocillo y etiquételos como claudina-7 cKO/4OH-TAM.
NOTA: DMSO debe agregarse a los pozos de control. Se deben agregar medios frescos que contienen 4OH-tamoxifeno cada 2 días. - Incubar a 37 °C hasta el siguiente cambio de soporte (~2-3 días).
5. Mantenimiento organoide colónico
NOTA: Los medios deben cambiarse cada 2-3 días. Cultivo hasta 12 días.
- Preparar una nueva solución de trabajo final de medios L-WRN: 900 μL de medios L-WRN + 0,9 μL de 1 mg/ml de EGF.
- Retire los medios viejos de los pozos mediante succión al vacío. Agregue medios frescos a los pozos.
NOTA: Tenga cuidado de no interrumpir la cúpula. - Incubar a 37 °C hasta el siguiente cambio de soporte.
NOTA: Los cultivos se pueden mantener y pasar durante el tiempo deseado para el experimento. Los cultivos para el presente estudio se mantuvieron típicamente entre 9 y 12 días, pero uno puede desear continuar más, durante 15 o 20 días.
6. Recolección e incorporación de organoides colónicos
- Retire los medios viejos de los pozos mediante succión al vacío.
- Fijar los organoides con paraformaldehído al 4% (PFA) durante 1 h a temperatura ambiente.
NOTA: El PFA es un material tóxico. Tome precauciones al usar este reactivo. - Eliminar el PFA al 4% de los pocillos mediante aspiración al vacío y añadir sacarosa al 30% durante 24 h a 4 °C.
- Etiquete un molde de plástico y llénelo al 90% con un compuesto de temperatura óptima de corte (OCT) (consulte la Tabla de materiales).
- Retire el 30% de sacarosa de los pocillos mediante succión al vacío. Agregue 10 μL de 1x PBS a cada pocillo.
- Con una punta de pipeta, raye suavemente el fondo del pozo para disociar la cúpula que contiene organoides.
- Con una pipeta, retire el PBS que contiene los organoides disociados y cargue el líquido en el molde que contiene OCT.
NOTA: Evite introducir burbujas en el compuesto OCT. - Continúe este proceso hasta que todos los organoides hayan sido retirados de todos los pozos.
- En un matraz Dewar de acero inoxidable, añadir gránulos de hielo seco y 2-metilbutano (suficiente para cubrir los gránulos de hielo seco) (ver Tabla de materiales).
- Mantenga firmemente el bloque OCT que contiene organoides por encima del 2-metilbutano para congelarse rápidamente.
- Almacene el bloque OCT que contiene organoides a -80 °C hasta que esté listo para seccionar (se puede almacenar hasta por 1 año).
7. Inmunofluorescencia
- Seccionar el bloque OCT que contiene organoides a un espesor de 5 μm utilizando un criostato (véase la Tabla de materiales) a -20 °C.
- Para cada sección, verifique bajo el microscopio para asegurarse de que se haya capturado un organoide. Cuando finalice la sección, guarde los portaobjetos a -80 °C hasta que estén listos para teñirse (se pueden almacenar hasta 6 meses).
- Calentar los portaobjetos en tampón de citrato de sodio de 10 mM durante 10 min a 94 °C.
NOTA: El tampón se produce disolviendo citrato de sodio en agua desionizada. Ajustar el pH a 6 con ácido clorhídrico. - Deje que las diapositivas se enfríen en la mesa de trabajo durante 20 minutos. Enjuagar con agua destilada durante 5 min.
- Ensamble los portaobjetos en una rejilla de tinción (consulte la Tabla de materiales) con Triton X-100 al 0,2% e incube con glicina a 100 mM durante 15 min.
- Enjuague tres veces con 1x PBS durante 5 minutos cada una. Bloquear con albúmina sérica bovina (BSA) al 5% durante 45 min a temperatura ambiente.
- Incubar con el anticuerpo primario22 antimurino de conejo claudina-7 (diluido en BSA al 1%) durante la noche a 4 °C. Enjuague tres veces con 1x PBS durante 10 minutos cada una.
- Incubar con Cy3 anticuerpo secundario anti-conejo23 (diluido en BSA al 1%) durante 1 h a temperatura ambiente. Enjuague tres veces con 1x PBS durante 10 minutos cada una.
- Monte las guías con un medio de montaje apropiado (consulte la Tabla de materiales) con DAPI y agregue un cubreobjetos.
8. Detección de muerte celular
- Fijar los organoides dentro de los pocillos con paraformaldehído al 4% durante 1 h a temperatura ambiente. Enjuague con 1x PBS durante 5 min.
- Incubar la placa de cultivo en hielo con Triton X-100 al 0,1% en tampón de citrato de sodio al 0,1% frío durante 2 min. Enjuague dos veces con 1x PBS durante 5 minutos cada una.
- Preparar la reacción TUNEL24,25 utilizando TMR Red, un kit de detección de muerte celular in situ(ver Tabla de materiales). Añadir 50 μL de reactivos de reacción TUNEL a cada pocillo.
- Incubar en atmósfera humidificada durante 1 h a 37 °C en la oscuridad.
NOTA: Todos los pasos restantes deben completarse en la oscuridad. - Enjuague tres veces con 1x PBS durante 5 minutos cada una. Incubar con 1:2.500 Hoechst (diluido en 1x PBS, ver Tabla de materiales) durante 3 min.
- Enjuague tres veces con 1x PBS durante 5 minutos cada una. Utilice el filtro TRITC para visualizar imágenes en un microscopio fluorescente (consulte la Tabla de materiales).
Resultados
Con el fin de examinar los efectos reguladores de la claudina-7 en las células madre del colon, se aislaron criptas colónicas del tejido murino del colon como se describió anteriormente y se muestra en la Figura 1A. Una vez que las criptas se aislaron del tejido primario, se colocaron en una matriz 3D en una placa de 96 pocillos para crecer durante 11 días (Figura 1). Las criptas sanas normales cerrarán la luz y se convertirán en esferoides para el día 2 y eventualmente comenzarán a gemir y formar los diversos tipos de células epiteliales aproximadamente en el día 5 (Figura 1B). Se permitió que los colonoides crecieran hasta el día 11, donde luego se cosecharon para experimentos adicionales (Figura 1B). Para eliminar la claudina-7 en cultivo, se permitió que las criptas crecieran normalmente durante 24 h. Después de 24 h, las criptas fueron tratadas con 3 μmol/L 4OH-Tamoxifeno (TAM) y cultivadas durante 10 días adicionales. El medio de cultivo que contenía 4OH-TAM fresco se cambió cada 2 días. DMSO se utilizó como vehículo en pozos de control. Las criptas deficientes de claudina-7 (claudin-7 KO) no lograron formar esferoides adecuados y comenzaron a morir rápidamente después de 1 día de tratamiento con 4OH-TAM (Figura 1B).
La Figura 2A destaca el crecimiento exitoso de colonoides de criptas normales que contienen claudina-7 (control) a medida que progresan a lo largo de los 9 días de cultivo. Estas criptas comenzaron a formar esferoides en el día 2, comenzaron a brotar el día 5 y continuaron creciendo y brotando hasta que se cosecharon el día 9 (Figura 2A). En contraste, las criptas que carecen de claudina-7 (claudin-7 KO) se deterioraron muy rápidamente (Figura 2B). Aproximadamente 2-3 días después del tratamiento con 4OH-TAM, las criptas de claudina-7 KO no habían formado esferoides de aspecto saludable y aparecieron solo como grupos circulares de células (Figura 2B). Las criptas aisladas de ratones de tipo salvaje fueron tratadas con 4OH-TAM para confirmar que no hay efecto tóxico debido al tratamiento con tamoxifeno; Estas criptas fueron capaces de sobrevivir y crecer normalmente. Para examinar la deleción de claudina-7 y la condición de supervivencia de los colonoides KO de claudina-7, se utilizó un método de inmunotinción y un kit de detección de muerte celular in situ (Figura 3). La tinción inmunofluorescente para claudina-7 en organoides control cosechados y cKO confirmó el knockout exitoso de claudina-7 en cultivo (Figura 3A). Los colonoides control del día 9 presentaron muy poca señal apoptótica (Figura 3B); sin embargo, los colonoides de claudina-7 KO mostraron alta apoptosis (Figura 3B). Sin claudina-7, las células madre no podrían sobrevivir, autorrenovarse o diferenciarse para formar colonoides.

Figura 1: Representación esquemática que muestra el aislamiento de criptas y el crecimiento de colonoides. (A) Representación gráfica del proceso de aislamiento de criptas, chapado en la matriz 3D y crecimiento hasta la cosecha. (B) Cronología de experimentos y crecimiento de colonoides en criptas derivadas de control y claudina-7 KO. Haga clic aquí para ver una versión más grande de esta figura.
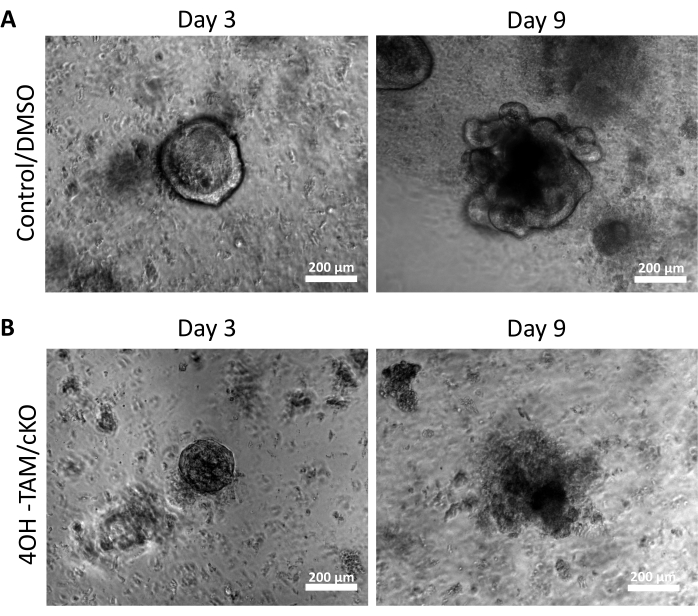
Figura 2: Los colonoides deficientes en claudina-7 no pueden sobrevivir y crecer . (A) Imágenes representativas de organoides control/DMSO en el día 3 y el día 9. (B) Imágenes representativas de organoides 4OH-TAM/cKO en el día 3 y el día 9, n = 10. Barras de escala = 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
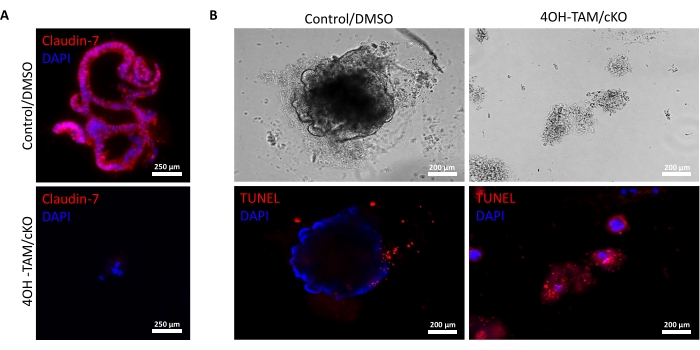
Figura 3: Los colonoides deficientes en claudina-7 sufren rápidamente apoptosis. (A) Tinción de claudina-7 en el día 9 control/DMSO y claudina-7 cKO/4OH-TAM organoides, n = 3. Barras de escala = 250 μm. (B) Tinción apoptótica en control del día 9 y colonoides claudina-7 cKO/4OH-TAM, n = 3. Barras de escala = 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El cultivo de organoides es un excelente modelo para estudiar la función de las células madre, la fisiología intestinal, el descubrimiento de fármacos, las enfermedades intestinales humanas y la regeneración y reparación de tejidos 7,8,9,10,11,26. Si bien tiene muchas ventajas, puede ser difícil de establecer. Se debe tener cuidado en todos los pasos a lo largo del protocolo, pero lo más importante durante la etapa de enchapado. Al mezclar las criptas aisladas con una matriz de gel, asegúrese de pipetear bien hacia arriba y hacia abajo para romper la bolita de cripta formada después de la centrifugación y distribuya las criptas uniformemente por toda la matriz. Al mismo tiempo, evite introducir burbujas de aire en la matriz durante el pipeteo. Para ello, el pipeteo debe realizarse lentamente, con la punta de la pipeta hacia el fondo del tubo de 1,5 ml.
Además, la matriz de gel no debe solidificarse completamente durante este proceso. Para evitar la solidificación prematura, mezcle con un pipeteo cuidadoso, luego coloque el tubo en hielo y repita este proceso. Una vez que las criptas aisladas y la matriz de gel estén suficientemente mezcladas, permita que la matriz de gel se solidifique parcialmente. Este proceso puede tomar de 1 a 5 minutos, dependiendo del tipo / marca de matriz de gel utilizada. Debe parecerse a un gel que se moverá ligeramente si se inclina el tubo, pero no debe ser demasiado líquido para que se derrame si se invierte. En este punto, uno puede comenzar a colocar 10 μL en el centro de cada pozo. La matriz de gel debe formar una cúpula 3D y no debe tocar los lados del pozo. Si la matriz de gel se extiende y golpea la pared del pozo, no se solidifica lo suficiente; Espere hasta que esté lo suficientemente solidificado para formar una cúpula, ya que las criptas no sobrevivirán y crecerán si la cúpula no se forma. Una vez que el recubrimiento se complete correctamente y las criptas estén suficientemente complementadas, como se explicó anteriormente, se espera que los organoides crezcan sin problemas.
Este protocolo establece un sistema organoide de colon con o sin claudina-7 para observar sus efectos sobre la supervivencia de las células madre colónicas. Si bien el cultivo de organoides de colon es un sistema innovador y ventajoso, el modelo todavía tiene limitaciones. Dependiendo del tipo de estudio, la falta de células inmunes y de microbiota en los organoides intestinales puede ser una ventaja o desventaja26. Para el presente estudio, es ventajoso investigar el papel regulador de la claudina-7 en las funciones de las células madre sin el componente inmune. Se concluyó que un cierto efecto se debe específicamente a la claudina-7, en lugar de otras variables potenciales como la respuesta inmune que estaría presente en modelos animales in vivo. Por el contrario, este factor puede ser una limitación para otros tipos de estudios. El establecimiento del cultivo de organoides de colon también puede ser más costoso y requerir más tiempo que las líneas celulares 2D tradicionales. Sin embargo, pueden imitar el microambiente celular de los tejidos proporcionando relevancia in vivo, son mucho más representativos del tejido que el cultivo celular 2D y aún son menos costosos que los modelos animales 4,7. Dada la vasta aplicación y el enorme potencial del cultivo de organoides intestinales, es probable que este sistema se convierta en el modelo ideal en la investigación de laboratorio en todo el mundo.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Este estudio fue financiado por NIH DK103166.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.09 cubic feet space-saver vacuum desiccator | United States Plastic Corp | 78564 | anesthesia chamber |
| 0.5 M EDTA pH 8.0 | Invitrogen | AM9261 | |
| 1.5 mL microcentrifuge tubes | ThermoFisher | 69715 | |
| 15 mL conical centrifuge tubes | Fisher Scientific | 14-959-53A | |
| 1x Dulbecco’s Phosphate buffered saline | Gibco | 14190-144 | |
| 2-methylbutane | Sigma | 277258 | |
| 4% paraformaldehyde | ThermoFisher | J61899.AK | |
| 4-hydroxytamoxifen (4OH-TAM) | Sigma | 579002 | |
| 50 mL conical centrifuge tubes | Fisher Scientific | 14-432-22 | |
| 70 µm nylon cell strainer | Corning | 352350 | |
| 96 well culture plate | Greiner Bio-One | 655180 | |
| B-27 Supplement (50x) | Gibco | 12587-010 | |
| Bovine serum albumin | Fisher Scientific | BP1605-100 | |
| Claudin-7 anti-murine rabbit antibody | Immuno-Biological Laboratories | 18875 | |
| Cover glass (24 x 50-1.5) | Fisher Scientific | 12544E | |
| Cryomolds | vwr | 25608-916 | |
| Cultrex RCF BME, Type 2 | R&D Systems | 3533-005-02 | gel matrix |
| Cy3 anti-rabbit antibody | Jackson Immunoresearch | 111-165-003 | |
| Dewar Flask | Thomas Scientific | 1173F61 | |
| DMEM High Glucose with L-Glutamine | ATCC | 30-2002 | |
| EVOS FLoid Imaging System | ThermoFisher | 4477136 | |
| Fluoro-Gel II with DAPI | Electron Microscopy Sciences | 17985-50 | |
| GlutaMAX (100x) | Gibco | 35050-061 | |
| Glycine | JT Baker | 4059-02 | |
| HEPES (1 M) Buffer Solution | Gibco | 15630-080 | |
| Hoechst | ThermoFisher | 62249 | |
| In situ cell death detection kit, TMR Red | Roche | 12156792910 | |
| Isoflurane | Pivetal | 07-893-8440 | |
| L-WRN Media | Harvard Medical School Gastrointestinal Organoid Derivation and Culture Core | N/A | |
| Mouse surgical kit | Kent Scientific Corporation | INSMOUSEKIT | |
| Murine EGF | PeproTech | 315-09-500UG | |
| N2 Supplement (100x) | Gibco | 17502-048 | |
| Optimum cutting temperature (OCT) compound | Agar Scientific | AGR1180 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Sequenza Rack | vwr | 10129-584 | |
| Sodium Citrate | Fisher Scientific | S-279 | |
| Sucrose | Sigma | S9378 | |
| Triton X-100 | Sigma | X100 | |
| Vacuum filter (0.22 µm; cellulose acetate) | Corning | 430769 | |
| Y-27632 dihydrochloride | Tocris Bioscience | 1254 |
Referencias
- Hughes, C. S., Postovit, L. M., Lajoie, G. A. Matrigel: a complex protein mixture required for optimal growth of cell culture. Proteomics. 10 (9), 1886-1890 (2010).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Wallach, T. E., Bayrer, J. R. Intestinal organoids: new frontiers in the study of intestinal disease and physiology. Journal of Pediatric Gastroenterology and Nutrition. 64 (2), 180-185 (2017).
- Shankaran, A., Prasad, K., Chaudhari, S., Brand, A., Satyamoorthy, K. Advances in development and application of human organoids. 3 Biotech. 11 (6), 257 (2021).
- Angus, H., Butt, A., Schultz, M., Kemp, R. Intestinal organoids as a tool for inflammatory bowel disease research. Frontiers in Medicine. 6, 334 (2020).
- Fan, Y., Davidson, L. A., Chapkin, R. S. Murine colonic organoid culture system and down stream assay applications. Methods in Molecular Biology. 1576, 171-181 (2019).
- Gupta, N., et al. Microfluidics-based 3D cell culture models: Utility in novel drug discovery and delivery research. Bioengineering and Translational Medicine. 1 (1), 63-81 (2016).
- Yoo, J., Donowitz, M. Intesitnal enteroids/organoids: A novel platform for drug discovery in inflammatory bowel diseases. World Journal of Gastroenterology. 25 (30), 4125-4147 (2019).
- Qu, M., et al. Establishment of intestinal organoid cultures modeling injury-associated epithelial regeneration. Cell Research. 31 (3), 259-271 (2021).
- Xing, T., et al. Tight junction protein claudin-7 is essential for intestinal epithelial stem cell self-renewal and differentiation. Cellular and Molecular Gastroenterology and Hepatology. 9 (4), 641-659 (2020).
- Ding, L., et al. Inflammation and disruption of the mucosal architecture in claudin-7-deficient mice. Gastroenterology. 142 (2), 305-315 (2012).
- Lu, Z., Ding, L., Lu, Q., Chen, Y. H. Claudins in intestines: distribution and functional significance in health and diseases. Tissue Barriers. 1 (3), 24978 (2013).
- Ding, L., Lu, Z., Lu, Q., Chen, Y. H. The claudin family of proteins in human malignancy: a clinical perspective. Cancer Management and Research. 5, 367-375 (2013).
- Bhat, A. A., et al. Claudin-7 expression induces mesenchymal to epithelial transformation (MET) to inhibit colon tumorigenesis. Oncogene. 34 (35), 4570-4580 (2015).
- Lu, Z., et al. A non-tight junction function of claudin-7-interaction with integrin signaling in suppressing lung cancer cell proliferation and detachement. Molecular Cancer. 14, 120 (2015).
- Wang, K., Xu, C., Li, W., Ding, L. Emerging clinical significance of claudin-7 in colorectal cancer: a review. Cancer Management and Research. 10, 3741-3752 (2018).
- Wang, K., et al. Claudin-7 downregulation induces metastasis and invasion in colorectal cancer via the promotion of epithelial-mesenchymal transition. Biochemical and Biophysical Research Communications. 508 (3), 797-804 (2019).
- Wang, F., et al. Isolation and characterization of intestinal stem cells based on surface marker combinations and colony-formation assay. Gastroenterology. 145 (2), 383 (2013).
- Li, W., et al. Severe intestinal inflammation in the small intestine of mice induced by controllable deletion of claudin-7. Digestive Diseases and Sciences. 63 (5), 1200-1209 (2018).
- Donovan, J., Brown, P. Euthanasia. Current Protocols in Immunology. 73 (1), (2006).
- Khalil, H., Nie, W., Edwards, R. A., Yoo, J. Isolation of primary myofibroblasts from mouse and human colon tissue. Journal of Visual Experiments. (80), e50611 (2013).
- Sugimoto, K., et al. Cell adhesion signals regulate the nuclear receptor activity. Proceedings of the National Academy of Sciences. 116 (49), 24600-24609 (2019).
- Mansour, H., et al. Connexin 30 expression and frewuency of connexin heterogeneity in astrocyte gap junction plaques increase with age in the rat retina. PLoS One. 8 (3), 57038 (2013).
- Miranda, M., et al. Antioxidants rescue photoreceptors in rd1 mice: relationship with thiol metabolism. Free Radical Biology and Medicine. 48 (2), 216-222 (2010).
- Wang, L., et al. Mesenchymal stromal cells ameliorate oxidative stress-induced islet endothelium apoptosis and functional impairment via Wnt4-β-catenin signaling. Stem Cell Research and Therapy. 8 (1), 188 (2017).
- Almeqdadi, M., Mana, M., Roper, J., Yilmaz, O. Gut organoids: mini-tissues in culture to study intestinal physiology and disease. American Journal of Physiology-Cell Physiology. 317 (3), 405-419 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados