Method Article
Dreidimensionale Kultur von murinen Kolonkrypten zur Untersuchung der Funktion von intestinalen Stammzellen ex vivo
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt die Etablierung eines murinen Kolonorganoidsystems zur Untersuchung der Aktivität und Funktion von Kolonstammzellen in einem Claudin-7-Knockout-Modell.
Zusammenfassung
Das Darmepithel regeneriert sich alle 5-7 Tage und wird von der intestinalen Epithelstammzellpopulation (IESC) am Boden der Kryptenregion gesteuert. IESCs umfassen aktive Stammzellen, die sich selbst erneuern und in verschiedene Epithelzelltypen differenzieren, und ruhende Stammzellen, die im Falle einer Verletzung als Reservestammzellen dienen. Die Regeneration des Darmepithels wird durch die sich selbst erneuernden und differenzierenden Fähigkeiten dieser aktiven IESCs gesteuert. Darüber hinaus sind das Gleichgewicht der kryptalen Stammzellpopulation und der Erhalt der Stammzellnische essentiell für die Darmregeneration. Die Organoidkultur ist ein wichtiger und attraktiver Ansatz zur Untersuchung von Proteinen, Signalmolekülen und Umwelthinweisen, die das Überleben und die Funktionen von Stammzellen regulieren. Dieses Modell ist kostengünstiger, weniger zeitaufwendig und manipulierbarer als Tiermodelle. Organoide ahmen auch die Mikroumgebung des Gewebes nach und sorgen für In-vivo-Relevanz . Das vorliegende Protokoll beschreibt die Isolierung von Kolonkrypten, die Einbettung dieser isolierten Kryptzellen in ein dreidimensionales Gelmatrixsystem und die Kultivierung von Kryptenzellen zur Bildung von Kolonorganoiden, die zur Selbstorganisation, Proliferation, Selbsterneuerung und Differenzierung fähig sind. Dieses Modell ermöglicht es, die Umwelt zu manipulieren - bestimmte Proteine wie Claudin-7 auszuschalten, Signalwege zu aktivieren / deaktivieren usw. - um zu untersuchen, wie diese Effekte die Funktion von Kolonstammzellen beeinflussen. Insbesondere wurde die Rolle des Tight-Junction-Proteins Claudin-7 bei der Funktion von Kolonstammzellen untersucht. Claudin-7 ist wichtig für die Aufrechterhaltung der intestinalen Homöostase und Barrierefunktion und -integrität. Knockout von Claudin-7 bei Mäusen induziert einen entzündlichen Darmerkrankungs-ähnlichen Phänotyp, der Darmentzündungen, Epithelhyperplasie, Gewichtsverlust, Schleimhautgeschwüre, Epithelzellablösung und Adenome aufweist. Zuvor wurde berichtet, dass Claudin-7 für intestinale epitheliale Stammzellfunktionen im Dünndarm benötigt wird. In diesem Protokoll wird ein Kolon-Organoid-Kultursystem etabliert, um die Rolle von Claudin-7 im Dickdarm zu untersuchen.
Einleitung
Die intestinale Organoidkultur ist ein dreidimensionales (3D) ex vivo System, in dem Stammzellen aus den Darmkrypten des Primärgewebes isoliert und zu einer Gelmatrix 1,2 plattiert werden. Diese Stammzellen sind zur Selbsterneuerung, Selbstorganisation und Organfunktionalität fähig2. Organoide ahmen die Mikroumgebung des Gewebes nach und sind In-vivo-Modellen ähnlicher als zweidimensionale (2D) In-vitro-Zellkulturmodelle, obwohl sie weniger manipulierbar sind als Zellen 3,4. Dieses Modell beseitigt Hindernisse, die in 2D-Modellen auftreten, wie z. B. das Fehlen geeigneter Zell-Zell-Adhäsionen, Zell-Matrix-Interaktionen und homogener Populationen, und reduziert auch die Einschränkungen von Tiermodellen, einschließlich hoher Kosten und langer Zeiträume5. Darmorganoide - auch als Kolonoide für diejenigen bezeichnet, die aus Stammzellen der Kolonkrypta gezüchtet werden - sind im Wesentlichen Miniorgane, die ein Epithel enthalten, das alle Zelltypen enthält, die in vivo vorhanden wären, sowie ein Lumen. Dieses Modell ermöglicht die Manipulation des Systems, um viele Aspekte des Darms zu untersuchen, wie die Stammzellnische, Darmphysiologie, Pathophysiologie und Darmmorphogenese 3,5,6. Es bietet auch ein großartiges Modell für die Arzneimittelforschung, die Untersuchung menschlicher Darmerkrankungen wie entzündliche Darmerkrankungen (IBD) und Darmkrebs, patientenspezifische personalisierte Behandlungsentwicklung und die Untersuchung der Geweberegeneration 4,7,8,9. Darüber hinaus kann das Organoidsystem auch verwendet werden, um zelluläre Kommunikation, Arzneimittelmetabolismus, Lebensfähigkeit, Proliferation und Reaktion auf Reizezu untersuchen 7,8. Während Tiermodelle verwendet werden können, um potenzielle Therapeutika für intestinale pathologische Erkrankungen zu testen, sind sie ziemlich begrenzt, da die Untersuchung mehrerer Medikamente gleichzeitig eine Herausforderung darstellt. Es gibt mehr Störvariablen in vivo, und die damit verbundenen Kosten und Zeit sind hoch bzw. lang. Auf der anderen Seite ermöglicht das Organoidkultursystem das Screening vieler Therapeutika auf einmal in kürzerer Zeit und ermöglicht auch eine personalisierte Behandlung durch die Verwendung von patientenabgeleitetenOrganoidkulturen 4,8. Die Fähigkeit von Kolonorganoiden, Gewebeorganisation, Mikroumgebung und Funktionalität nachzuahmen, macht sie auch zu einem hervorragenden Modell für die Untersuchung von Regeneration und Gewebereparatur9. Unser Labor hat ein Dünndarm-Organoid-Kultursystem etabliert, um die Wirkung von Claudin-7 auf die Funktionen von Dünndarmstammzellen zu untersuchen10. In dieser Studie wird ein Dickdarm-Organoid-Kultursystem etabliert, um die Fähigkeit oder mangelnde Fähigkeit von Stammzellen zu untersuchen, sich selbst zu erneuern, zu differenzieren und sich in einem bedingten Claudin-7-Knockout-Modell (cKO) zu vermehren.
Claudin-7 ist ein sehr wichtiges Tight Junction (TJ)-Protein, das im Darm stark exprimiert wird und für die Aufrechterhaltung der TJ-Funktion und -Integrität unerlässlich ist11. cKO-Mäuse leiden an einem IBD-ähnlichen Phänotyp, der schwere Entzündungen, Ulzerationen, Epithelzellablagerungen, Adenome und erhöhte Zytokinspiegel aufweist11,12. Während allgemein anerkannt ist, dass Claudine für die epitheliale Barrierefunktion von entscheidender Bedeutung sind, entstehen neue Rollen für Clavine. Sie sind an Proliferation, Migration, Krebsprogression und Stammzellfunktion beteiligt 10,12,13,14,15,16,17. Derzeit ist nicht bekannt, wie sich Claudin-7 auf die Stammzellnische und die Funktion von Kolonstammzellen auswirkt. Da sich der Darm etwa alle 5-7 Tage schnell selbst erneuert, ist die Aufrechterhaltung der Stammzellnische und das ordnungsgemäße Funktionieren der aktiven Stammzellen von entscheidender Bedeutung18. Hier wird ein System etabliert, um die möglichen regulatorischen Effekte von Claudin-7 auf die Dickdarmstammzellnische zu untersuchen.
Protokoll
Alle Tierversuche und -verfahren wurden vom Animal Care and Use Committee (IACUC) der East Carolina University (ECU) genehmigt und in Übereinstimmung mit den Richtlinien der National Institutes of Health und der ECU zur Pflege und Verwendung von Labortieren durchgeführt. Induzierbare, Darm-spezifische Claudin-7-Knockout-Mäuse wurden durch Kreuzung von C57BL6-Claudin-7-flox-transgenen Mäusen mit Villin-CreERT2-Mäusenerzeugt 19. Männliche und weibliche Mäuse im Alter von 3 Monaten wurden in dieser Studie verwendet.
1. Vorbereitung des Reagenzes/der Ausrüstung
- Kühlen Sie die folgenden Reagenzien/Geräte ab, bevor Sie mit den zugehörigen Experimenten beginnen: phosphatgepufferte Kochsalzlösung (PBS) zum Waschen von Darmgewebe während der Kryptenisolierung; eine Wippe/Rotatorin (in einem 4 °C Kühlschrank) zur Inkubation mit epithelialen Dissoziationsmedien.
- Die Gelmatrix (siehe Materialtabelle) von -20 °C entfernen und vor dem Plattieren auf Eis auftauen.
- Kühlen Sie die Zentrifuge auf 4 °C vor, bevor Sie die Krypten zur Beschichtung abdrehen.
- Kühlen Sie 0,1% Natriumcitratpuffer (siehe Tabelle der Materialien) und halten Sie es auf Eis, bevor der Zelltod in situ nachgewiesen wird.
- Erwärmen Sie die folgenden Reagenzien, bevor Sie mit den zugehörigen Experimenten beginnen: eine 96-Well-Kulturplatte für 24 Stunden vor dem Plattieren; L-WRN-Medien (siehe Materialtabelle) vor dem Hinzufügen zu plattierten Krypten und vor jedem Medienwechsel.
- Das Wasserbad vor dem Färben auf 94 °C erhitzen.
2. Isolierung der Kolonkrypta von Murine
- Bereiten Sie die erforderlichen Medien vor, indem Sie die folgenden Schritte ausführen.
HINWEIS: Die Medienvolumina werden hier für das Dickdarmgewebe zweier Mäuse berechnet.- epitheliale Dissoziationsmedien vorbereiten: 30 mL 1x PBS + 400 μL 0,5 M EDTA + 50 μL 10 mM Y-27632-Dihydrochlorid (siehe Materialtabelle). Bis zum Gebrauch auf Eis halten.
- Krypta-Dissoziationsmedien vorbereiten: 10 mL 1x PBS + 10 μL 10 mM Y-27632-Dihydrochlorid. Bis zum Gebrauch auf Eis halten.
- Ergänzung L-WRN-Medien: 50 ml L-WRN-Medien + 47,5 ml DMEM-Hochglukose mit L-Glutamin + 500 μL L-Glutamin + 500 μL Pennicilin/Streptomycin + 1.000 μL B-27-Ergänzung (50x) + 500 μL N2-Ergänzung (100x) + 50 μL HEPES-Pufferlösung (1 M) (siehe Materialtabelle).
- Filtern Sie das komplette (ergänzte) L-WRN-Medium und Aliquot für die Lagerung bei -20 °C für bis zu 3 Monate.
HINWEIS: Aufgetaute Medien sind bis zu 2 Wochen bei 4 °C stabil.
- Führen Sie die Crypt-Isolierung durch.
- Für die Vollnarkose fügen Sie 1 ml Isofluran zu Baumwolle hinzu und legen Sie es in eine Plastikkassette in einer 0,09 Kubikfuß Anästhesiekammer (siehe Materialtabelle). Legen Sie die Maus in die Anästhesiekammer, bis die Atmung anhält (ca. 3-5 min) und führen Sie dann eine zervikale Dislokationdurch 20.
- Machen Sie einen etwa 2-Zoll-Schnitt entlang der Mittellinie der Maus und stecken Sie die Rückenhaut fest, um den Bauch freizulegen. Isolieren Sie den Dickdarm, indem Sie von der proximalen Seite direkt unter dem Blinddarm und von der distalen Seite über dem Rektum schneiden21.
- Entfernen Sie mit einer Pinzette das am Dickdarm befestigte Fettgewebe. Drücken Sie den Kot vorsichtig mit dem flachen Ende der Pinzette heraus und schneiden Sie das Gewebe längs auf.
- Waschen Sie das Gewebe 10-15 Mal mit kaltem 1x PBS mit einer Pinzette, um das Gewebe zwischen den Wäschen in PBS herumzuwirbeln.
- Schneiden Sie das Gewebe mit einer sauberen, scharfen Schere in kleine Stücke, die etwa 3-5 mm groß sind.
- Wiederholen Sie den Vorgang für die zweite Maus und kombinieren Sie die Gewebestücke in einem 50-ml-Röhrchen mit kalten epithelialen Dissoziationsmedien (Schritt 2.1.1).
- Die Dickdarmgewebestücke in epithelialen Dissoziationsmedien 90 min bei 4 °C unter leichtem Schaukeln inkubieren.
- Lassen Sie die Gewebefragmente auf den Boden des Röhrchens sinken und entsorgen Sie dann vorsichtig das epitheliale Dissoziationsmedium, ohne das Gewebe zu stören. Wiederholen Sie diesen Vorgang, wenn Sie das Gewebe 10-15 Mal mit kaltem 1x PBS waschen. Entsorgen Sie so viel PBS wie möglich während der letzten Wäsche.
- Fügen Sie das Krypta-Dissoziationsmedium (Schritt 2.1.2) in das 50-ml-Röhrchen mit den Dickdarmgewebestücken hinzu und schütteln Sie es kontinuierlich für 5-10 Minuten von Hand.
HINWEIS: Die Medien müssen von den dissoziierten Krypten trüb werden. - Unter der Zellkulturhaube filtrieren Sie das Gewebe und die Medien mit einem 70-μm-Nylonzellsieb (siehe Materialtabelle) in ein frisches 50-ml-Röhrchen.
- Bei 200 x g 10 min bei Raumtemperatur zentrifugieren und den Überstand entsorgen, ohne das kryptahaltige Pellet zu stören.
HINWEIS: Je nach Gerät kann man das gespannte Medium zum Zentrifugieren in ein 15-ml-Rohr überführen. - Resuspendieren Sie das Pellet in ~3-4 mL kaltem 1x PBS.
- Pipette 10 μL der isolierten Krypten in einer Linie auf einem Objektträger. Zählen Sie unter dem Mikroskop die Anzahl der vollen, langen Krypten, um die Kryptenkonzentration pro 10 μL zu schätzen.
- Berechnen Sie das geeignete Volumen der zu drehenden Krypten, um 10 Krypten / μL in eine 96-Well-Platte zu legen.
3. Verschlüsselung
- Zentrifugieren Sie ein geeignetes Volumen isolierter Krypten in einem 1,5-ml-Mikrozentrifugenröhrchen bei 200 x g für 5 min bei 4 °C.
- Entfernen Sie den Überstand vorsichtig mit einer 1.000 μL Pipette, ohne die pelletierten Krypten zu stören.
- Fügen Sie 100 μL Gelmatrix (genug für neun Vertiefungen) zu den pelletierten Krypten hinzu und pipetten Sie vorsichtig, um das Einbringen von Luftblasen zu vermeiden.
HINWEIS: Im Abschnitt Diskussion finden Sie eine detaillierte Beschreibung, wie die Gelmatrix und die Krypten gemischt werden. Typischerweise sind 100 μL für neun Vertiefungen ausreichend. - Lassen Sie die Gelmatrix teilweise erstarren (~1-2 min).
- Platte 10 μL der Gelmatrix gemischt mit den Krypten in jeder Vertiefung einer vorgewärmten 96-Well-Kulturplatte, um eine Kuppelform zu bilden.
HINWEIS: Platzieren Sie die Kuppel in der Mitte des Brunnens. Achten Sie darauf, dass sich die Gelmatrix nicht an den Seiten des Brunnens ausbreitet. Eine detaillierte Beschreibung der Erstarrung und Beschichtung finden Sie im Abschnitt Diskussion. - Lassen Sie die Gelmatrix für 10-20 min in einem Inkubator bei 37 °C mit 5%CO2 vollständig aushärten.
- Bereiten Sie die endgültige Arbeitslösung von L-WRN-Medien vor.
- 100 μL Pennicilin/Streptomycin zu einem 10 ml Aliquot von L-WRN-Medien (siehe Schritt 2.1.3) (stabil für 2 Wochen bei 4 °C).
- Fügen Sie Ergänzungen zu 900 μL L-WRN-Medien mit Pennicilin / Streptomycin hinzu: 0,9 μL 1 mg / ml EGF + 0,9 μL 10 mM Y-27632-Dihydrochlorid.
HINWEIS: Die Volumina basieren auf neun Bohrungen. Y-27632-Dihydrochlorid wird erst am Tag 0 (zum Zeitpunkt der Beschichtung) hinzugefügt.
- Fügen Sie 100 μL Medien in jede Vertiefung hinzu. Achten Sie darauf, die Kuppel nicht zu stören.
- Bei 37 °C mit 5%CO2 für 24 h inkubieren.
4. Claudin-7-Knockout in der Kultur schaffen
- Lassen Sie die Krypten nach dem Plattieren 24 h lang normal in Kultur wachsen.
- In einem 1,5-ml-Mikrozentrifugenröhrchen werden 2,7 μL 1 mmol/L 4-Hydroxytamoxifen (4OH-Tamoxifen) zu 900 μL L-WRN-Medien (Endkonzentration von 3 μmol/L) + 0,9 μL 1 mg/ml EGF gegeben.
HINWEIS: Die Stammlösung von 4OH-Tamoxifen wird hergestellt, indem pulverisiertes 4OH-Tamoxifen (siehe Materialtabelle) mit 1x PBS auf eine Konzentration von 1 mmol/L gemischt wird. - Entfernen Sie alte Medien aus den Vertiefungen durch Vakuumabsaugung.
- Fügen Sie 100 μL 4OH-Tamoxifen-haltige Medien in jede Vertiefung und kennzeichnen Sie sie als Claudin-7 cKO / 4OH-TAM.
HINWEIS: DMSO muss den Kontrollmulden hinzugefügt werden. Frische 4OH-Tamoxifen-haltige Medien müssen alle 2 Tage hinzugefügt werden. - Bei 37 °C bis zum nächsten Medienwechsel (~2-3 Tage) inkubieren.
5. Dickdarm-Organoid-Erhaltung
HINWEIS: Medien müssen alle 2-3 Tage gewechselt werden. Kultur bis zu 12 Tage.
- Bereiten Sie eine frische endgültige Arbeitslösung von L-WRN-Medien vor: 900 μL L-L-WRN-Medien + 0,9 μL 1 mg/ml EGF.
- Entfernen Sie alte Medien aus den Vertiefungen durch Vakuumabsaugung. Fügen Sie den Brunnen frische Medien hinzu.
HINWEIS: Achten Sie darauf, die Kuppel nicht zu stören. - Bei 37 °C bis zum nächsten Medienwechsel inkubieren.
HINWEIS: Kulturen können für die für das Experiment gewünschte Dauer gepflegt und durchlaufen werden. Die Kulturen für die vorliegende Studie wurden typischerweise zwischen 9-12 Tagen aufbewahrt, aber man möchte vielleicht 15 oder 20 Tage weitermachen.
6. Ernte und Einbettung von Kolonorganoiden
- Entfernen Sie alte Medien aus den Vertiefungen durch Vakuumabsaugung.
- Fixieren Sie die Organoide mit 4% Paraformaldehyd (PFA) für 1 h bei Raumtemperatur.
HINWEIS: PFA ist ein giftiges Material. Treffen Sie Vorsichtsmaßnahmen, wenn Sie dieses Reagenz verwenden. - Entfernen Sie 4% PFA aus den Vertiefungen durch Vakuumabsaugung und fügen Sie 30% Saccharose für 24 h bei 4 °C hinzu.
- Beschriften Sie eine Kunststoffform und füllen Sie sie zu 90% mit optimaler Schnitttemperatur (OCT) (siehe Materialtabelle).
- Entfernen Sie 30% Saccharose aus den Vertiefungen durch Vakuumabsaugung. Fügen Sie 10 μL 1x PBS in jede Vertiefung hinzu.
- Kratzen Sie mit einer Pipettenspitze vorsichtig am Boden des Brunnens, um die Kuppel mit Organoiden zu dissoziieren.
- Entfernen Sie mit einer Pipette das PBS, das die dissoziierten Organoide enthält, und laden Sie die Flüssigkeit in die Form, die OCT enthält.
HINWEIS: Vermeiden Sie das Einbringen von Blasen in die OCT-Verbindung. - Setzen Sie diesen Vorgang fort, bis alle Organoide aus allen Vertiefungen entfernt wurden.
- In einem Dewarkolben aus Edelstahl Trockeneispellets und 2-Methylbutan (genug, um die Trockeneispellets zu bedecken) hinzufügen (siehe Materialtabelle).
- Halten Sie den organoidhaltigen OCT-Block stetig über 2-Methylbutan, um ihn einzufrieren.
- Lagern Sie den organoidhaltigen OCT-Block bei -80 °C, bis er zerlegefertig ist (bis zu 1 Jahr lagerfähig).
7. Immunfluoreszenz
- Schneiden Sie den organoidhaltigen OCT-Block in einer Dicke von 5 μm mit einem Kryostaten (siehe Materialtabelle) bei -20 °C.
- Überprüfen Sie für jeden Abschnitt unter dem Mikroskop, ob ein Organoid erfasst wurde. Wenn das Schneiden abgeschlossen ist, lagern Sie die Dias bei -80 °C, bis sie fleckenbereit sind (kann bis zu 6 Monate gelagert werden).
- Die Objektträger in 10 mM Natriumcitratpuffer 10 min bei 94 °C erhitzen.
HINWEIS: Der Puffer wird durch Auflösen von Natriumcitrat in entionisiertem Wasser hergestellt. Stellen Sie den pH-Wert mit Salzsäure auf 6 ein. - Lassen Sie die Dias 20 min auf dem Tischgerät abkühlen. Mit destilliertem Wasser 5 min abspülen.
- Die Objektträger in einem Färbegestell (siehe Materialtabelle) mit 0,2% Triton X-100 zusammensetzen und mit 100 mM Glycin 15 min inkubieren.
- Dreimal mit 1x PBS für jeweils 5 min abspülen. Block mit 5% Rinderserumalbumin (BSA) für 45 min bei Raumtemperatur.
- Mit Claudin-7 Anti-murinem Kaninchen-Primärantikörper22 (verdünnt in 1% BSA) über Nacht bei 4 °C inkubieren. Spülen Sie dreimal mit 1x PBS für jeweils 10 min.
- Inkubieren Sie mit Cy3 Anti-Kaninchen-Sekundärantikörper23 (verdünnt in 1% BSA) für 1 h bei Raumtemperatur. Spülen Sie dreimal mit 1x PBS für jeweils 10 min.
- Montieren Sie die Dias mit einem geeigneten Montagemedium (siehe Materialtabelle) mit DAPI und fügen Sie ein Deckglas hinzu.
8. Zelltod-Erkennung
- Fixieren Sie die Organoide in den Vertiefungen mit 4% Paraformaldehyd für 1 h bei Raumtemperatur. Mit 1x PBS 5 min abspülen.
- Die Kulturplatte auf Eis mit 0,1% Triton X-100 in kaltem 0,1% Natriumcitratpuffer für 2 min inkubieren. Zweimal mit 1x PBS für jeweils 5 min spülen.
- Vorbereitung der TUNEL-Reaktion24,25 unter Verwendung von TMR Red, einem In-situ-Kitzum Nachweis des Zelltods (siehe Materialtabelle). Geben Sie 50 μL TUNEL-Reaktionsreagenzien in jede Vertiefung.
- In befeuchteter Atmosphäre 1 h bei 37 °C im Dunkeln inkubieren.
HINWEIS: Alle verbleibenden Schritte müssen im Dunkeln ausgeführt werden. - Dreimal mit 1x PBS für jeweils 5 min abspülen. Inkubieren mit 1:2.500 Hoechst (verdünnt in 1x PBS, siehe Materialtabelle) für 3 min.
- Dreimal mit 1x PBS für jeweils 5 min abspülen. Verwenden Sie den TRITC-Filter, um Bilder auf einem Fluoreszenzmikroskop zu visualisieren (siehe Materialtabelle).
Ergebnisse
Um die regulatorischen Wirkungen von Claudin-7 auf Dickdarmstammzellen zu untersuchen, wurden Kolonkrypten aus murinem Dickdarmgewebe isoliert, wie oben beschrieben und in Abbildung 1A gezeigt. Sobald die Krypten aus dem primären Gewebe isoliert waren, wurden sie in einer 3D-Matrix in einer 96-Well-Platte plattiert, um 11 Tage lang zu wachsen (Abbildung 1). Normale gesunde Krypten schließen das Lumen und werden am 2. Tag zu Sphäroiden und beginnen schließlich etwa am Tag 5 zu knospen und die verschiedenen Epithelzelltypen zu bilden (Abbildung 1B). Die Kolonoide durften bis zum 11. Tag wachsen, wo sie dann für weitere Experimente geerntet wurden (Abbildung 1B). Um Claudin-7 in Kultur auszuschalten, durften die Krypten 24 Stunden lang normal wachsen. Nach 24 h wurden die Krypten mit 3 μmol/L 4OH-Tamoxifen (TAM) behandelt und für weitere 10 Tage kultiviert. Das Kulturmedium mit frischem 4OH-TAM wurde alle 2 Tage gewechselt. DMSO wurde als Fahrzeug in Kontrollbrunnen eingesetzt. Claudin-7-defiziente Krypten (Claudin-7 KO) konnten keine richtigen Sphäroide bilden und begannen nach 1 Tag 4OH-TAM-Behandlung schnell zu sterben (Abbildung 1B).
Abbildung 2A zeigt das erfolgreiche Wachstum von Kolonoiden aus normalen Krypten, die Claudin-7 (Kontrolle) enthalten, während sie während der 9 Tage der Kultur fortschreiten. Diese Krypten begannen am 2. Tag Sphäroide zu bilden, begannen am 5. Tag zu knospen und wuchsen und knospten weiter, bis sie am 9. Tag geerntet wurden (Abbildung 2A). Im Gegensatz dazu verschlechterten sich Krypten ohne Claudin-7 (Claudin-7 KO) sehr schnell (Abbildung 2B). Etwa 2-3 Tage nach der Behandlung mit 4OH-TAM hatten Claudin-7-KO-Krypten keine gesund aussehenden Sphäroide gebildet und erschienen nur als kreisförmige Zellklumpen (Abbildung 2B). Krypten, die von Wildtyp-Mäusen isoliert wurden, wurden mit 4OH-TAM behandelt, um zu bestätigen, dass es keine toxische Wirkung aufgrund der Tamoxifen-Behandlung gibt; Diese Krypten konnten überleben und normal wachsen. Um die Claudin-7-Deletion und den Überlebenszustand von Claudin-7-KO-Kolonoiden zu untersuchen, wurden eine Immunfärbungsmethode und ein In-situ-Zelltod-Detektionskit verwendet (Abbildung 3). Immunfluoreszierende Färbung für Claudin-7 in der entnommenen Kontrolle und cKO-Organoide bestätigten einen erfolgreichen Knockout von Claudin-7 in Kultur (Abbildung 3A). Tag 9 Kontrollkolonoide zeigten sehr wenig apoptotische Signale (Abbildung 3B); Claudin-7-KO-Kolonoide zeigten jedoch eine hohe Apoptose (Abbildung 3B). Ohne Claudin-7 könnten die Stammzellen nicht überleben, sich selbst erneuern oder differenzieren, um Kolonoide zu bilden.

Abbildung 1: Schematische Darstellung der Kryptoisolation und des Kolonoidwachstums . (A) Grafische Darstellung des Krypto-Isolationsprozesses, der Beschichtung in der 3D-Matrix und des Wachstums bis zur Ernte. (B) Zeitleiste der Experimente und des Kolonoidwachstums in Kontroll- und Claudin-7-KO-abgeleiteten Krypten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
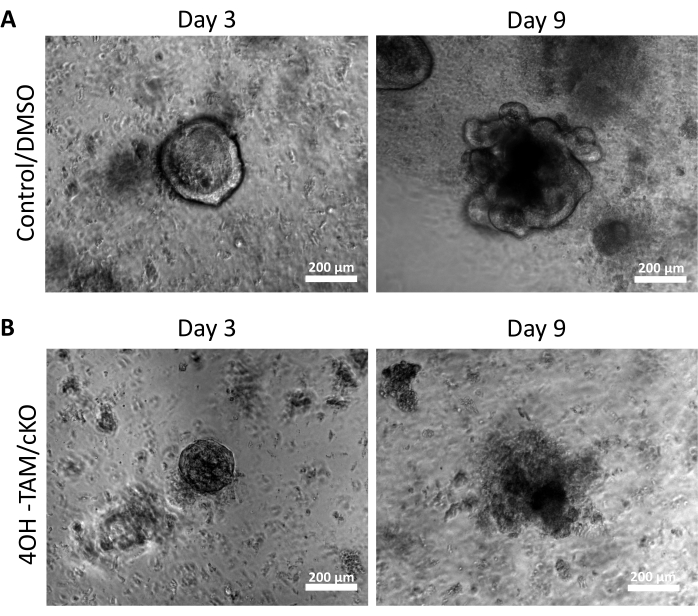
Abbildung 2: Claudin-7-defiziente Kolonoide können nicht überleben und wachsen . (A) Repräsentative Bilder von Kontroll-/DMSO-Organoiden an Tag 3 und Tag 9. (B) Repräsentative Bilder von 4OH-TAM/cKO-Organoiden an Tag 3 und Tag 9, n = 10. Maßstäbe = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
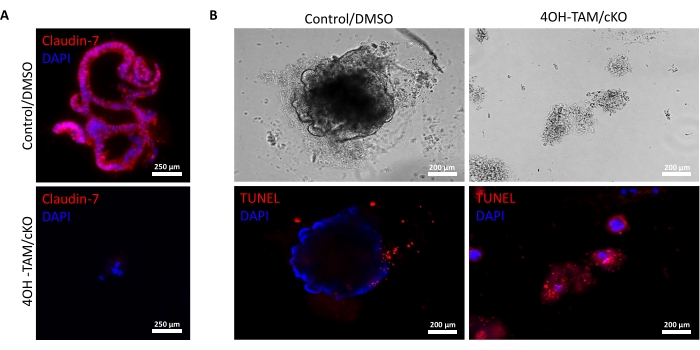
Abbildung 3: Claudin-7-defiziente Kolonoide durchlaufen schnell Apoptose. (A) Claudin-7-Färbung in Tag 9 Kontroll-/DMSO- und Claudin-7-cKO/4OH-TAM-Organoiden, n = 3. Maßstabsbalken = 250 μm. (B) Apoptotische Färbung bei Tag 9 Kontrolle und Claudin-7 cKO/4OH-TAM-Kolonoiden, n = 3. Maßstäbe = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Organoidkultur ist ein hervorragendes Modell für die Untersuchung der Stammzellfunktion, der Darmphysiologie, der Arzneimittelforschung, der menschlichen Darmerkrankungen sowie der Regeneration und Reparatur von Geweben 7,8,9,10,11,26. Obwohl es viele Vorteile hat, kann es schwierig sein, es zu etablieren. Vorsicht ist bei allen Schritten während des gesamten Protokolls geboten, vor allem aber während der Beschichtungsphase. Wenn Sie die isolierten Krypten mit einer Gelmatrix mischen, stellen Sie sicher, dass Sie gründlich nach oben und unten pipettieren, um das nach dem Zentrifugieren gebildete Kryptenpellet aufzubrechen und die Krypten gleichmäßig in der gesamten Matrix zu verteilen. Vermeiden Sie gleichzeitig, während des Pipettierens Luftblasen in die Matrix einzuführen. Um dies zu tun, muss das Pipettieren langsam erfolgen, wobei die Pipettenspitze zum Boden des 1,5-ml-Röhrchens hin gerichtet ist.
Außerdem darf die Gelmatrix während dieses Prozesses nicht vollständig verfestigt werden. Um eine vorzeitige Erstarrung zu vermeiden, mischen Sie durch vorsichtiges Pipettieren, legen Sie das Röhrchen auf Eis und wiederholen Sie diesen Vorgang. Sobald die isolierten Krypten und die Gelmatrix ausreichend gemischt sind, lassen Sie die Gelmatrix teilweise erstarren. Dieser Vorgang kann 1-5 Minuten dauern, abhängig von der Art / Marke der verwendeten Gelmatrix. Es muss einem Gel ähneln, das sich leicht bewegt, wenn das Röhrchen gekippt ist, sollte aber nicht zu flüssig sein, dass es bei Invertierung auslaufen würde. An diesem Punkt kann man beginnen, 10 μL in die Mitte jeder Vertiefung zu plattieren. Die Gelmatrix muss eine 3D-Kuppel bilden und sollte die Seiten des Brunnens nicht berühren. Wenn sich die Gelmatrix ausbreitet und auf die Wand des Brunnens trifft, ist sie nicht verfestigt genug; Warten Sie, bis es ausreichend verfestigt ist, um eine Kuppel zu bilden, da die Krypten nicht überleben und wachsen, wenn die Kuppel nicht gebildet wird. Sobald die Beschichtung ordnungsgemäß abgeschlossen ist und die Krypten ausreichend ergänzt sind, wie oben erläutert, wird erwartet, dass die Organoide ohne Probleme wachsen.
Dieses Protokoll etabliert ein Dickdarm-Organoidsystem mit oder ohne Claudin-7, um seine Auswirkungen auf das Überleben von Kolonstammzellen zu beobachten. Während die Dickdarmorganoidkultur ein innovatives und vorteilhaftes System ist, hat das Modell immer noch Grenzen. Je nach Art der Studie kann das Fehlen von Immunzellen und der Mikrobiota in Darmorganoiden ein Vor- oder Nachteil sein26. Für die vorliegende Studie ist es vorteilhaft, die regulatorische Rolle von Claudin-7 auf Stammzellfunktionen ohne die Immunkomponente zu untersuchen. Es wurde der Schluss gezogen, dass eine bestimmte Wirkung spezifisch auf Claudin-7 zurückzuführen ist und nicht auf andere potenzielle Variablen wie die Immunantwort, die in In-vivo-Tiermodellen vorhanden wäre. Umgekehrt kann dieser Faktor eine Einschränkung für andere Arten von Studien sein. Die Etablierung einer Dickdarm-Organoid-Kultur kann auch teurer und zeitintensiver sein als herkömmliche 2D-Zelllinien. Sie können jedoch die zelluläre Mikroumgebung von Geweben nachahmen, die In-vivo-Relevanz bieten, sind viel repräsentativer für Gewebe als 2D-Zellkulturen und sind immer noch kostengünstiger als Tiermodelle 4,7. Angesichts der großen Anwendung und des enormen Potenzials der intestinalen Organoidkultur dürfte dieses System das ideale Modell in der Laborforschung weltweit werden.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Diese Studie wurde vom NIH DK103166 finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.09 cubic feet space-saver vacuum desiccator | United States Plastic Corp | 78564 | anesthesia chamber |
| 0.5 M EDTA pH 8.0 | Invitrogen | AM9261 | |
| 1.5 mL microcentrifuge tubes | ThermoFisher | 69715 | |
| 15 mL conical centrifuge tubes | Fisher Scientific | 14-959-53A | |
| 1x Dulbecco’s Phosphate buffered saline | Gibco | 14190-144 | |
| 2-methylbutane | Sigma | 277258 | |
| 4% paraformaldehyde | ThermoFisher | J61899.AK | |
| 4-hydroxytamoxifen (4OH-TAM) | Sigma | 579002 | |
| 50 mL conical centrifuge tubes | Fisher Scientific | 14-432-22 | |
| 70 µm nylon cell strainer | Corning | 352350 | |
| 96 well culture plate | Greiner Bio-One | 655180 | |
| B-27 Supplement (50x) | Gibco | 12587-010 | |
| Bovine serum albumin | Fisher Scientific | BP1605-100 | |
| Claudin-7 anti-murine rabbit antibody | Immuno-Biological Laboratories | 18875 | |
| Cover glass (24 x 50-1.5) | Fisher Scientific | 12544E | |
| Cryomolds | vwr | 25608-916 | |
| Cultrex RCF BME, Type 2 | R&D Systems | 3533-005-02 | gel matrix |
| Cy3 anti-rabbit antibody | Jackson Immunoresearch | 111-165-003 | |
| Dewar Flask | Thomas Scientific | 1173F61 | |
| DMEM High Glucose with L-Glutamine | ATCC | 30-2002 | |
| EVOS FLoid Imaging System | ThermoFisher | 4477136 | |
| Fluoro-Gel II with DAPI | Electron Microscopy Sciences | 17985-50 | |
| GlutaMAX (100x) | Gibco | 35050-061 | |
| Glycine | JT Baker | 4059-02 | |
| HEPES (1 M) Buffer Solution | Gibco | 15630-080 | |
| Hoechst | ThermoFisher | 62249 | |
| In situ cell death detection kit, TMR Red | Roche | 12156792910 | |
| Isoflurane | Pivetal | 07-893-8440 | |
| L-WRN Media | Harvard Medical School Gastrointestinal Organoid Derivation and Culture Core | N/A | |
| Mouse surgical kit | Kent Scientific Corporation | INSMOUSEKIT | |
| Murine EGF | PeproTech | 315-09-500UG | |
| N2 Supplement (100x) | Gibco | 17502-048 | |
| Optimum cutting temperature (OCT) compound | Agar Scientific | AGR1180 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Sequenza Rack | vwr | 10129-584 | |
| Sodium Citrate | Fisher Scientific | S-279 | |
| Sucrose | Sigma | S9378 | |
| Triton X-100 | Sigma | X100 | |
| Vacuum filter (0.22 µm; cellulose acetate) | Corning | 430769 | |
| Y-27632 dihydrochloride | Tocris Bioscience | 1254 |
Referenzen
- Hughes, C. S., Postovit, L. M., Lajoie, G. A. Matrigel: a complex protein mixture required for optimal growth of cell culture. Proteomics. 10 (9), 1886-1890 (2010).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Wallach, T. E., Bayrer, J. R. Intestinal organoids: new frontiers in the study of intestinal disease and physiology. Journal of Pediatric Gastroenterology and Nutrition. 64 (2), 180-185 (2017).
- Shankaran, A., Prasad, K., Chaudhari, S., Brand, A., Satyamoorthy, K. Advances in development and application of human organoids. 3 Biotech. 11 (6), 257 (2021).
- Angus, H., Butt, A., Schultz, M., Kemp, R. Intestinal organoids as a tool for inflammatory bowel disease research. Frontiers in Medicine. 6, 334 (2020).
- Fan, Y., Davidson, L. A., Chapkin, R. S. Murine colonic organoid culture system and down stream assay applications. Methods in Molecular Biology. 1576, 171-181 (2019).
- Gupta, N., et al. Microfluidics-based 3D cell culture models: Utility in novel drug discovery and delivery research. Bioengineering and Translational Medicine. 1 (1), 63-81 (2016).
- Yoo, J., Donowitz, M. Intesitnal enteroids/organoids: A novel platform for drug discovery in inflammatory bowel diseases. World Journal of Gastroenterology. 25 (30), 4125-4147 (2019).
- Qu, M., et al. Establishment of intestinal organoid cultures modeling injury-associated epithelial regeneration. Cell Research. 31 (3), 259-271 (2021).
- Xing, T., et al. Tight junction protein claudin-7 is essential for intestinal epithelial stem cell self-renewal and differentiation. Cellular and Molecular Gastroenterology and Hepatology. 9 (4), 641-659 (2020).
- Ding, L., et al. Inflammation and disruption of the mucosal architecture in claudin-7-deficient mice. Gastroenterology. 142 (2), 305-315 (2012).
- Lu, Z., Ding, L., Lu, Q., Chen, Y. H. Claudins in intestines: distribution and functional significance in health and diseases. Tissue Barriers. 1 (3), 24978 (2013).
- Ding, L., Lu, Z., Lu, Q., Chen, Y. H. The claudin family of proteins in human malignancy: a clinical perspective. Cancer Management and Research. 5, 367-375 (2013).
- Bhat, A. A., et al. Claudin-7 expression induces mesenchymal to epithelial transformation (MET) to inhibit colon tumorigenesis. Oncogene. 34 (35), 4570-4580 (2015).
- Lu, Z., et al. A non-tight junction function of claudin-7-interaction with integrin signaling in suppressing lung cancer cell proliferation and detachement. Molecular Cancer. 14, 120 (2015).
- Wang, K., Xu, C., Li, W., Ding, L. Emerging clinical significance of claudin-7 in colorectal cancer: a review. Cancer Management and Research. 10, 3741-3752 (2018).
- Wang, K., et al. Claudin-7 downregulation induces metastasis and invasion in colorectal cancer via the promotion of epithelial-mesenchymal transition. Biochemical and Biophysical Research Communications. 508 (3), 797-804 (2019).
- Wang, F., et al. Isolation and characterization of intestinal stem cells based on surface marker combinations and colony-formation assay. Gastroenterology. 145 (2), 383 (2013).
- Li, W., et al. Severe intestinal inflammation in the small intestine of mice induced by controllable deletion of claudin-7. Digestive Diseases and Sciences. 63 (5), 1200-1209 (2018).
- Donovan, J., Brown, P. Euthanasia. Current Protocols in Immunology. 73 (1), (2006).
- Khalil, H., Nie, W., Edwards, R. A., Yoo, J. Isolation of primary myofibroblasts from mouse and human colon tissue. Journal of Visual Experiments. (80), e50611 (2013).
- Sugimoto, K., et al. Cell adhesion signals regulate the nuclear receptor activity. Proceedings of the National Academy of Sciences. 116 (49), 24600-24609 (2019).
- Mansour, H., et al. Connexin 30 expression and frewuency of connexin heterogeneity in astrocyte gap junction plaques increase with age in the rat retina. PLoS One. 8 (3), 57038 (2013).
- Miranda, M., et al. Antioxidants rescue photoreceptors in rd1 mice: relationship with thiol metabolism. Free Radical Biology and Medicine. 48 (2), 216-222 (2010).
- Wang, L., et al. Mesenchymal stromal cells ameliorate oxidative stress-induced islet endothelium apoptosis and functional impairment via Wnt4-β-catenin signaling. Stem Cell Research and Therapy. 8 (1), 188 (2017).
- Almeqdadi, M., Mana, M., Roper, J., Yilmaz, O. Gut organoids: mini-tissues in culture to study intestinal physiology and disease. American Journal of Physiology-Cell Physiology. 317 (3), 405-419 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten