Method Article
생체 외 장내 줄기세포 기능을 연구하기 위한 쥐 결장 음와의 3차원 배양
요약
본 프로토콜은 claudin-7 녹아웃 모델에서 결장 줄기 세포의 활성 및 기능을 연구하기 위해 쥐 결장 오가노이드 시스템을 확립하는 것을 설명합니다.
초록
장 상피는 5-7 일마다 재생되며 음낭 부위의 바닥에 위치한 장 상피 줄기 세포 (IESC) 집단에 의해 제어됩니다. IESC에는 자체 재생되어 다양한 상피 세포 유형으로 분화하는 활성 줄기 세포와 손상시 예비 줄기 세포 역할을하는 정지 줄기 세포가 포함됩니다. 장 상피의 재생은 이러한 활성 IESC의 자체 재생 및 분화 능력에 의해 제어됩니다. 또한, 지하실 줄기 세포 집단의 균형과 줄기 세포 틈새의 유지는 장 재생에 필수적입니다. 오가노이드 배양은 줄기 세포의 생존과 기능을 조절하는 단백질, 신호 분자 및 환경 신호를 연구하는 데 중요하고 매력적인 접근 방식입니다. 이 모델은 동물 모델보다 저렴하고 시간이 덜 걸리며 조작이 가능합니다. 오가노이드는 또한 조직 미세 환경을 모방하여 생체 내 관련성을 제공합니다. 본 프로토콜은 결장 종루의 분리, 이러한 분리된 종와를 3차원 겔 매트릭스 시스템에 매립하고 자가조직화, 증식, 자가 재생 및 분화가 가능한 결장 오가노이드를 형성하기 위해 종와세포를 배양하는 방법을 설명합니다. 이 모델을 통해 claudin-7과 같은 특정 단백질을 녹아웃하고 신호 경로를 활성화 / 비활성화하는 등 환경을 조작하여 이러한 효과가 결장 줄기 세포의 기능에 어떻게 영향을 미치는지 연구 할 수 있습니다. 구체적으로, 결장 줄기세포 기능에서 밀착접합 단백질 claudin-7의 역할을 조사하였다. Claudin-7은 장 항상성과 장벽 기능 및 무결성을 유지하는 데 필수적입니다. 마우스에서 claudin-7의 녹아웃은 장 염증, 상피 증식, 체중 감소, 점막 궤양, 상피 세포 슬라우킹 및 선종을 나타내는 염증성 장 질환 유사 표현형을 유도합니다. 이전에는 claudin-7이 소장에서 장 상피 줄기 세포 기능에 필요한 것으로보고되었습니다. 이 프로토콜에서는 대장에서 claudin-7의 역할을 연구하기 위해 결장 오가노이드 배양 시스템이 구축됩니다.
서문
장 오가노이드 배양은 줄기 세포를 일차 조직의 장 음와에서 분리하고 겔 매트릭스 1,2로 도금하는 3차원(3D) 생체 외 시스템입니다. 이 줄기 세포는자가 재생,자가 조직 및 장기 기능이 가능합니다2. 오가노이드는 조직 미세 환경을 모방하고 세포 3,4보다 조작이 적지 만 2 차원 (2D) 시험관 내 세포 배양 모델보다 생체 내 모델과 더 유사합니다. 이 모델은 적절한 세포-세포 유착, 세포-매트릭스 상호 작용 및 균질 개체군의 부족과 같은 2D 모델에서 발생하는 장애물을 제거하고 높은 비용과긴 기간을 포함하여 동물 모델의 한계를 줄입니다5. 장내 오가노이드(결장 토굴 유래 줄기 세포에서 성장한 경우 콜로노이드라고도 함)는 본질적으로 생체 내에 존재하는 모든 세포 유형과 내강을 포함하는 상피를 포함하는 미니 기관입니다. 이 모델을 사용하면 시스템을 조작하여 줄기 세포 틈새, 장 생리학, 병태 생리학 및 장 형태 형성 3,5,6과 같은 장의 여러 측면을 연구 할 수 있습니다. 또한 약물 발견, 염증성 장 질환 (IBD) 및 대장 암과 같은 인간 장 질환 연구, 환자 별 개인화 된 치료 개발 및 조직 재생 4,7,8,9 연구를위한 훌륭한 모델을 제공합니다. 또한 오가노이드 시스템은 세포 통신, 약물 대사, 생존력, 증식 및 자극에 대한 반응을 연구하는 데에도 사용할수 있습니다7,8. 동물 모델은 장 병리학적 상태에 대한 잠재적인 치료제를 테스트하는 데 사용될 수 있지만 한 번에 여러 약물을 연구하는 것이 어려울 수 있으므로 매우 제한적입니다. 생체 내에는 더 많은 교란 변수가 있으며 관련 비용과 시간은 각각 높고 길다. 반면에, 오가노이드 배양 시스템은 더 짧은 기간에 한 번에 많은 치료제의 스크리닝을 허용하고, 또한 환자 유래 오가노이드 배양 4,8의 사용을 통해 개인화된 치료를 가능하게 한다. 결장 오가노이드가 조직 조직, 미세 환경 및 기능을 모방하는 능력은 또한 재생 및조직 복구를 연구하기 위한 훌륭한 모델입니다9. 우리 연구실은 소장 줄기 세포 기능에 대한 claudin-7의 효과를 연구하기 위해 소장 오가노이드 배양 시스템을 구축했습니다10. 이 연구에서는 조건부 claudin-7 녹아웃(cKO) 모델에서 줄기세포의 자가 갱신, 분화 및 증식 능력 또는 능력 부족을 연구하기 위해 대장 오가노이드 배양 시스템을 구축했습니다.
Claudin-7은 장에서 고도로 발현되고 TJ 기능 및 무결성11을 유지하는 데 필수적인 매우 중요한 단단한 접합 (TJ) 단백질입니다. cKO 마우스는 IBD 유사 표현형을 앓고 있으며 심각한 염증, 궤양, 상피 세포 슬라우링, 선종 및 증가된 사이토카인 수치11,12를 나타냅니다. 클로딘이 상피 장벽 기능에 필수적이라는 것은 널리 받아 들여지고 있지만, 클로딘의 새로운 역할이 등장하고 있습니다. 그들은 증식, 이동, 암 진행 및 줄기 세포 기능 10,12,13,14,15,16,17에 관여합니다. claudin-7이 줄기 세포 틈새와 결장 줄기 세포의 기능에 어떤 영향을 미치는지는 현재 알려져 있지 않습니다. 장이 약 5-7 일마다 빠르게 자체 재생되기 때문에 줄기 세포 틈새의 유지와 활성 줄기 세포의 적절한 기능이 중요합니다18. 여기에서는 결장 줄기 세포 틈새에 대한 claudin-7의 잠재적 인 조절 효과를 조사하기위한 시스템이 구축됩니다.
프로토콜
모든 동물 실험 및 절차는 이스트 캐롤라이나 대학교 (ECU) 동물 관리 및 사용위원회 (IACUC)의 승인을 받았으며 실험실 동물 관리 및 사용에 관한 국립 보건원 및 ECU의 지침에 따라 수행되었습니다. 유도성, 장 특이적 클로딘-7 녹아웃 마우스를 C57BL6 클로딘-7-플록스 형질전환 마우스와 Villin-CreERT2 마우스19를 교배시킴으로써 생성하였다. 3개월령의 수컷 및 암컷 마우스를 본 연구에 사용하였다.
1. 시약/장비 준비
- 관련 실험을 시작하기 전에 다음 시약/장비를 냉각하십시오: 지하실 분리 동안 결장 조직을 세척하기 위한 인산염 완충 식염수(PBS); 상피 해리 매체와의 배양을 위한 로커/로테이터(4°C 냉장고에 배치).
- -20°C에서 겔 매트릭스( 재료 표 참조)를 제거하고 도금하기 전에 얼음에서 해동합니다.
- 도금을 위해 크립트를 회전시키기 전에 원심분리기를 4°C로 사전 냉각합니다.
- 0.1% 구연산나트륨 완충액( 재료 표 참조)을 식히고 현장 세포 사멸 감지 전에 얼음 위에 보관하십시오.
- 관련 실험을 시작하기 전에 다음 시약을 따뜻하게 합니다: 도금하기 전에 24시간 동안 96-웰 배양 플레이트; L-WRN 미디어( 재료 표 참조) 도금된 크립트에 추가하기 전과 각 미디어를 변경하기 전에.
- 염색하기 전에 수조를 94°C로 가열합니다.
2. 쥐 결장 지하실 분리
- 아래 단계에 따라 필요한 미디어를 준비합니다.
참고: 배지 부피는 여기에서 두 마우스의 결장 조직에 대해 계산됩니다.- 상피 해리 배지를 준비합니다: 30mL의 1x PBS + 400μL의 0.5M EDTA + 50μL의 10mM Y-27632 디하이드로클로라이드( 재료 표 참조). 사용할 때까지 얼음 위에 보관하십시오.
- 음와해리 배지를 준비합니다: 10mL의 1x PBS + 10μL의 10mM Y-27632 디하이드로클로라이드. 사용할 때까지 얼음 위에 보관하십시오.
- L-WRN 배지 보충: L-WRN 배지 50mL + L-글루타민이 함유된 DMEM 고혈당 47.5mL + L-글루타민 500μL + 페니실린/스트렙토마이신 500μL + B-27 보충제 1,000μL + N2 보충제(100x) + 50μL HEPES(1M) 완충액(재료 표 참조).
- 전체(보충된) L-WRN 배지와 분취량을 여과하여 -20°C에서 최대 3개월 동안 보관합니다.
참고: 해동된 매체는 4°C에서 최대 2주 동안 안정적입니다.
- 암호 격리를 수행합니다.
- 전신 마취의 경우 면에 이소플루란 1mL를 넣고 0.09입방피트 마취실 내의 플라스틱 카세트 안에 넣습니다( 재료 표 참조). 호흡이 멈출 때까지 (약 3-5 분) 마우스를 마취실에 넣은 다음 자궁 경부 탈구20을 수행하십시오.
- 마우스의 정중선을 따라 약 2인치를 절개하고 등 피부를 고정하여 복부를 노출시킵니다. 맹장 바로 아래를 근위부에서 절단하고 직장 위를 원위부21에서 절단하여 결장을 분리합니다.
- 집게를 사용하여 결장에 부착 된 지방 조직을 제거하십시오. 집게의 평평한 끝을 사용하여 대변을 부드럽게 밀어내고 조직을 세로로 자릅니다.
- 세척 사이에 PBS에서 조직을 "소용돌이치기"위해 집게를 사용하여 차가운 1x PBS로 조직을 10-15회 세척합니다.
- 깨끗하고 날카로운 가위를 사용하여 조직을 약 3-5mm 크기의 작은 조각으로 자릅니다.
- 두 번째 마우스에 대해 이 과정을 반복하고 차가운 상피 해리 배지가 포함된 50mL 튜브에 조직 조각을 합친다(단계 2.1.1).
- 결장 조직 조각을 상피 해리 배지에서 4°C에서 90분 동안 부드러운 흔들림으로 배양합니다.
- 조직 조각이 튜브의 바닥으로 가라앉도록 한 다음 조직을 방해하지 않고 상피 해리 배지를 조심스럽게 버립니다. 차가운 1x PBS로 조직을 10-15 회 씻을 때이 과정을 반복하십시오. 최종 세척 중에 가능한 한 많은 PBS를 폐기하십시오.
- 결장 조직 조각이 들어 있는 50mL 튜브에 암호 해리 배지(단계 2.1.2)를 넣고 손으로 5-10분 동안 계속 흔듭니다.
참고: 미디어는 해리된 지하실에서 흐려져야 합니다. - 세포 배양 후드 아래에서 70μm 나일론 세포 여과기( 재료 표 참조)로 조직과 배지를 여과하여 새로운 50mL 튜브에 넣습니다.
- 실온에서 10분 동안 200 x g 로 원심분리하고 지하실 함유 펠릿을 방해하지 않고 상청액을 버립니다.
알림: 장비에 따라 변형된 매체를 15mL 튜브로 옮겨 원심분리할 수 있습니다. - 펠릿을 ~3-4mL의 차가운 1x PBS에 재현탁합니다.
- 현미경 슬라이드의 라인에 분리된 음와를 10μL의 피펫팅합니다. 현미경으로 10μL당 음핵 농도를 추정하기 위해 완전하고 긴 음와의 수를 세십시오.
- 96웰 플레이트에 10 crypts/μL를 도금하기 위해 스핀다운할 크립트의 적절한 부피를 계산합니다.
3. 크립트 도금
- 1.5mL 마이크로 원심분리 튜브에 200 x g 의 적절한 부피의 분리된 음와를 4°C에서 5분 동안 원심분리합니다.
- 펠릿화된 음와를 방해하지 않고 1,000μL 피펫을 사용하여 상층액을 조심스럽게 제거합니다.
- 100μL의 겔 매트릭스(9웰에 충분)를 펠릿화된 크립트와 피펫에 조심스럽게 추가하여 기포가 유입되지 않도록 합니다.
참고: 젤 매트릭스와 크립트를 혼합하는 방법에 대한 자세한 설명은 토론 섹션을 참조하십시오. 일반적으로 9개의 웰에 대해 100μL이면 충분합니다. - 겔 매트릭스가 부분적으로 응고되도록하십시오 (~ 1-2 분).
- 예열된 96-웰 배양 플레이트의 각 웰에 있는 토와 혼합된 겔 매트릭스 10 μL를 플레이트하여 돔 모양을 형성하였다.
알림: 돔을 우물 중앙에 놓습니다. 젤 매트릭스가 우물의 측면으로 퍼지지 않도록주의하십시오. 응고 및 도금에 대한 자세한 설명은 토론 섹션을 참조하십시오. - 겔 매트릭스가 5%CO2로 37°C의 인큐베이터에서 10-20분 동안 완전히 설정되도록 합니다.
- L-WRN 미디어의 최종 작업 솔루션을 준비합니다.
- L-WRN 배지 10mL 분취량에 100μL 페니실린/스트렙토마이신을 추가합니다(단계 2.1.3 참조)(4°C에서 2주 동안 안정).
- 페니실린/스트렙토마이신이 함유된 900μL의 L-WRN 배지에 보충제를 추가합니다: 0.9μL의 1mg/mL EGF + 0.9μL의 10mM Y-27632 디하이드로클로라이드.
참고: 볼륨은 9개의 웰을 기준으로 합니다. Y-27632 디 하이드로 클로라이드는 0 일 (도금시)에만 첨가됩니다.
- 각 웰에 100μL의 배지를 추가합니다. 돔을 방해하지 않도록주의하십시오.
- 37°C에서 5%CO2 로 24시간 동안 배양한다.
4. 문화에서 클로딘 -7 녹아웃 만들기
- 도�이 도금 후 24시간 동안 배양에서 정상적으로 자라도록 합니다.
- 1.5mL 미세 원심분리 튜브에 2.7μL의 1mmol/L 4-하이드록시타목시펜(4OH-타목시펜)을 900μL의 L-WRN 배지(최종 농도 3μmol/L) + 0.9μL의 1mg/mL EGF에 추가합니다.
참고 : 4OH- 타목시펜의 저장 용액은 분말 4OH- 타목시펜 ( 재료 표 참조)을 1x PBS와 혼합하여 1mmol / L 농도로 혼합하여 준비됩니다. - 진공 흡입을 통해 우물에서 오래된 매체를 제거하십시오.
- 각 웰에 100μL의 4OH-타목시펜 함유 배지를 추가하고 클로딘-7 cKO/4OH-TAM으로 표시합니다.
알림: DMSO를 제어 웰에 추가해야 합니다. 신선한 4OH- 타목시펜 함유 배지는 2 일마다 추가해야합니다. - 다음 배지가 바뀔 때까지 37°C에서 배양합니다(~2-3일).
5. 결장 오가노이드 유지
참고: 미디어는 2-3일마다 교체해야 합니다. 최대 12 일 문화.
- L-WRN 배지의 새로운 최종 작업 용액을 준비합니다: L-WRN 배지 900μL + 1mg/mL EGF 0.9μL.
- 진공 흡입을 통해 우물에서 오래된 매체를 제거하십시오. 우물에 신선한 미디어를 추가하십시오.
알림: 돔을 방해하지 않도록주의하십시오. - 다음 배지가 바뀔 때까지 37°C에서 배양합니다.
참고: 배양물은 실험에 원하는 기간 동안 유지되고 계대배양될 수 있습니다. 본 연구를 위한 배양물은 전형적으로 9-12일 동안 유지되었지만, 15 또는 20일 동안 더 계속하기를 원할 수 있다.
6. 결장 오가노이드 수확 및 매립
- 진공 흡입을 통해 우물에서 오래된 매체를 제거하십시오.
- 오가노이드를 4% 파라포름알데히드(PFA)로 실온에서 1시간 동안 고정합니다.
알림: PFA는 독성 물질입니다. 이 시약을 사용할 때 예방 조치를 취하십시오. - 진공 흡입을 통해 웰에서 4% PFA를 제거하고 4°C에서 24시간 동안 30% 슈크로스를 추가합니다.
- 플라스틱 몰드에 라벨을 붙이고 최적 절단 온도(OCT) 컴파운드로 90%까지 채웁니다( 재료 표 참조).
- 진공 흡입을 통해 웰에서 30% 자당을 제거합니다. 각 웰에 10μL의 1x PBS를 추가합니다.
- 피펫 팁으로 우물 바닥을 부드럽게 긁어 오가노이드가 들어있는 돔을 해리시킵니다.
- 피펫으로 해리된 오가노이드가 포함된 PBS를 제거하고 OCT가 포함된 몰드에 액체를 넣습니다.
참고: OCT 화합물에 기포가 들어가지 않도록 하십시오. - 모든 웰에서 모든 유기체가 제거 될 때까지이 과정을 계속하십시오.
- 스테인리스 스틸 Dewar 플라스크에 드라이 아이스 펠릿과 2- 메틸 부탄 (드라이 아이스 펠릿을 덮을만큼 충분)을 첨가하십시오 ( 재료 표 참조).
- 오가노이드 함유 OCT 블록을 2-메틸부탄 이상으로 꾸준히 유지하여 급속 동결시킨다.
- 오가노이드 함유 OCT 블록을 절편할 준비가 될 때까지 -80°C에서 보관하십시오(최대 1년 동안 보관 가능).
7. 면역형광법
- 절편화된 오가노이드-함유 OCT 블록을 -20°C에서 동결유지장치( 재료 표 참조)를 사용하여 5 μm 두께로 절단하였다.
- 각 섹션에 대해 현미경으로 확인하여 오가노이드가 캡처되었는지 확인합니다. 절단이 완료되면 얼룩이 질 준비가 될 때까지 슬라이드를 -80°C에서 보관하십시오(최대 6개월 동안 보관 가능).
- 슬라이드를 10 mM 시트르산나트륨 완충액에서 94°C에서 10분 동안 가열한다.
알림: 완충액은 구연산나트륨을 탈이온수에 용해시켜 만듭니다. 염산으로 pH를 6으로 조정하십시오. - 슬라이드를 벤치 탑에서 20 분 동안 식히십시오. 증류수로 5 분 동안 헹굽니다.
- 슬라이드를 0.2% Triton X-100이 있는 염색 랙( 재료 표 참조)에 조립하고 100mM 글리신과 함께 15분 동안 배양합니다.
- 1x PBS로 각각 5분 동안 3회 헹굽니다. 실온에서 45분 동안 5% 소 혈청 알부민(BSA)으로 차단합니다.
- 클로딘-7 항뮤린 토끼 1차 항체22 (1% BSA로 희석)와 함께 4°C에서 밤새 인큐베이션한다. 1x PBS로 각각 10분 동안 3회 헹굽니다.
- Cy3 항-토끼 2차 항체23 (1% BSA로 희석)과 함께 실온에서 1시간 동안 인큐베이션합니다. 1x PBS로 각각 10분 동안 3회 헹굽니다.
- DAPI를 사용하여 적절한 장착 매체( 재료 표 참조)로 슬라이드를 장착하고 커버슬립을 추가합니다.
8. 세포 사멸 검출
- 실온에서 1 시간 동안 4 % 파라 포름 알데히드로 웰 내부의 유기체를 고정하십시오. 1x PBS로 5분 동안 헹굽니다.
- 배양 플레이트를 차가운 0.1% 시트르산나트륨 완충액에 0.1% Triton X-100과 함께 얼음 위에서 2분 동안 배양합니다. 1x PBS로 각각 5분 동안 두 번 헹굽니다.
- 현장세포 사멸 검출 키트인 TMR Red를 사용하여 TUNEL 반응24,25를 준비합니다(재료 표 참조). 각 웰에 50μL의 TUNEL 반응 시약을 추가합니다.
- 어두운 곳에서 37 ° C에서 1 시간 동안 가습 된 분위기에서 배양하십시오.
알림: 나머지 모든 단계는 어둠 속에서 완료해야 합니다. - 1x PBS로 각각 5분 동안 3회 헹굽니다. 1:2,500 Hoechst(1x PBS로 희석, 재료 표 참조)와 함께 3분 동안 배양합니다.
- 1x PBS로 각각 5분 동안 3회 헹굽니다. TRITC 필터를 사용하여 형광 현미경에서 이미지를 시각화합니다( 재료 표 참조).
결과
결장 줄기 세포에 대한 claudin-7의 조절 효과를 조사하기 위해, 결장 음와를 상기 기재된 바와 같이 뮤린 결장 조직으로부터 분리하고 도 1A에 나타내었다. 지하실이 1차 조직에서 분리되면 96웰 플레이트의 3D 매트릭스에 도말하여 11일 동안 성장시켰습니다(그림 1). 정상적인 건강한 음와(Crypt)는 2일째에 내강을 닫고 스페로이드가 되며 결국 약 5일째에 다양한 상피 세포 유형을 형성하기 시작합니다(그림 1B). 콜로노이드는 11일까지 성장하도록 허용한 다음, 추가 실험을 위해 수확하였다(그림 1B). 배양에서 claudin-7을 녹아웃하기 위해 지하실은 24 시간 동안 정상적으로 성장할 수있었습니다. 24시간 후, 크립트를 3μmol/L 4OH-타목시펜(TAM)으로 처리하고 추가로 10일 동안 배양했습니다. 신선한 4OH-TAM을 함유하는 배양액을 2일마다 교체하였다. DMSO는 대조군 웰에서 비히클로 사용되었습니다. Claudin-7 결핍 음와(claudin-7 KO)는 적절한 스페로이드를 형성하지 못하고 4OH-TAM 처리 1일 후 빠르게 죽기 시작했습니다(그림 1B).
그림 2A 는 배양 9일 동안 진행됨에 따라 claudin-7(대조군)을 포함하는 정상 음와에서 콜로노이드의 성공적인 성장을 강조합니다. 이 지하실은 2일째에 스페로이드를 형성하기 시작했고, 5일째에 싹이 트기 시작했으며, 9일째에 수확될 때까지 계속 성장하고 싹이 트었습니다(그림 2A). 대조적으로, claudin-7 (claudin-7 KO)이없는 음와가 매우 빠르게 악화되었습니다 (그림 2B). 4OH-TAM으로 처리한 후 약 2-3일 후, claudin-7 KO 음와에는 건강해 보이는 스페로이드가 형성되지 않았으며 원형 세포 덩어리로만 나타났습니다(그림 2B). 야생형 마우스에서 분리 된 음와를 4OH-TAM으로 처리하여 타목시펜 처리로 인한 독성 효과가 없음을 확인했습니다. 이 지하실은 정상적으로 생존하고 자랄 수있었습니다. claudin-7 결실 및 claudin-7 KO 콜로노이드의 생존 조건을 조사하기 위해 면역 염색법과 현장 세포 사멸 검출 키트를 활용했습니다(그림 3). 수확된 대조군 및 cKO 오가노이드에서 claudin-7에 대한 면역형광 염색은 배양에서 claudin-7의 성공적인 녹아웃을 확인했습니다(그림 3A). 9일째 대조군 콜로노이드는 매우 적은 세포사멸 신호를 나타내었다(도 3B); 그러나, 클라우딘-7 KO 콜로노이드는 높은 세포자멸사를 나타냈다(도 3B). claudin-7이 없으면 줄기 세포는 생존, 자체 재생 또는 분화하여 콜로노이드를 형성 할 수 없습니다.

그림 1: 음핵 분리 및 콜로노이드 성장을 보여주는 개략적 표현. (A) 음핵 분리 과정, 3D 매트릭스에서의 도금 및 수확까지의 성장에 대한 그래픽 묘사. (B) 대조군 및 claudin-7 KO 유래 음와에서의 실험 및 콜로노이드 성장의 타임라인. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
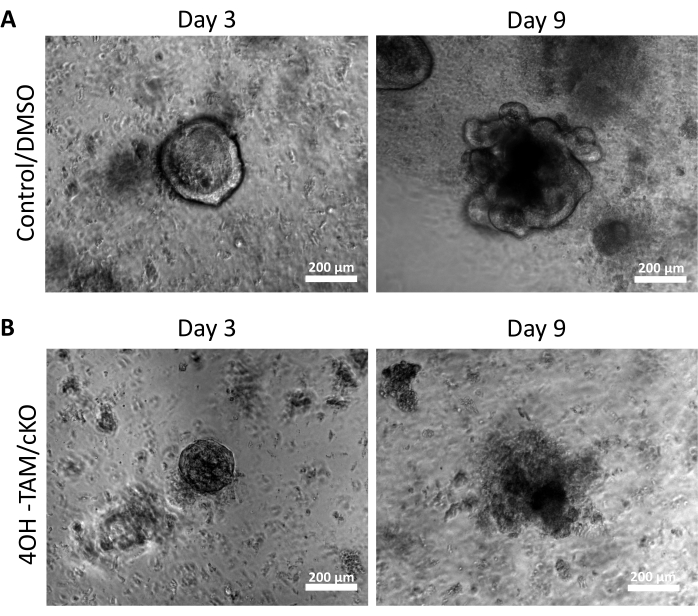
그림 2: Claudin-7 결핍 콜로노이드는 생존하고 성장할 수 없습니다 . (A) 3일째와 9일째의 대조군/DMSO 오가노이드의 대표 이미지. (B) 3일째와 9일째의 4OH-TAM/cKO 오가노이드의 대표 이미지, n = 10. 스케일 바 = 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
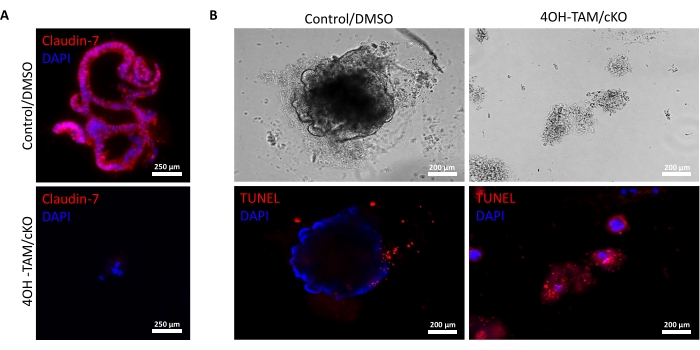
그림 3: Claudin-7 결핍 콜로노이드는 빠르게 세포자멸사를 겪습니다. (A) 9일차 대조군/DMSO 및 클라우딘-7 cKO/4OH-TAM 오가노이드에서의 클라우딘-7 염색, n = 3. 스케일 바 = 250 μm. (B) 9일째 대조군 및 클로딘-7 cKO/4OH-TAM 콜로노이드에서의 세포자멸 염색, n = 3. 스케일 바 = 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
오가노이드 배양은 줄기 세포 기능, 장 생리학, 약물 발견, 인간 장 질환, 조직 재생 및 복구 7,8,9,10,11,26을 연구하기 위한 훌륭한 모델입니다. 많은 장점이 있지만 설정하기가 어려울 수 있습니다. 프로토콜 전체의 모든 단계에서 주의를 기울여야 하지만 가장 중요한 것은 도금 단계에서 주의해야 합니다. 분리된 크립을 겔 매트릭스와 혼합할 때 원심분리 후 형성된 크립트 펠릿을 분해하고 매트릭스 전체에 크립트를 고르게 분배하기 위해 위아래로 완전히 피펫팅해야 합니다. 동시에 피펫팅하는 동안 매트릭스에 기포가 유입되지 않도록 하십시오. 이를 위해서는 피펫 팁이 1.5mL 튜브의 바닥을 향하도록 피펫팅을 천천히 수행해야 합니다.
또한 겔 매트릭스는 이 과정에서 완전히 응고되어서는 안 됩니다. 조기 응고를 방지하려면 조심스럽게 피펫팅하여 혼합한 다음 튜브를 얼음 위에 놓고 이 과정을 반복합니다. 분리된 음와와 겔 매트릭스가 충분히 혼합되면 겔 매트릭스가 부분적으로 응고되도록 합니다. 이 과정은 사용되는 젤 매트릭스의 유형/브랜드에 따라 1-5분이 소요될 수 있습니다. 튜브가 기울어지면 약간 움직이는 젤과 비슷해야하지만 뒤집히면 쏟아질 정도로 너무 묽어서는 안됩니다. 이 시점에서 각 웰의 중앙에 10μL의 도금을 시작할 수 있습니다. 겔 매트릭스는 3D 돔을 형성해야하며 우물의 측면에 닿지 않아야합니다. 겔 매트릭스가 퍼지고 우물 벽에 부딪히면 충분히 응고되지 않습니다. 돔이 형성되지 않으면 지하실이 생존하고 성장하지 않으므로 돔을 형성하기에 충분히 응고 될 때까지 기다리십시오. 도금이 제대로 완료되고 위에서 설명한 것처럼 지하실이 충분히 보완되면 오가노이드는 문제 없이 성장할 것으로 예상됩니다.
이 프로토콜은 결장 줄기 세포 생존에 미치는 영향을 관찰하기 위해 claudin-7의 유무에 관계없이 결장 오가노이드 시스템을 설정합니다. 결장 오가노이드 배양은 혁신적이고 유리한 시스템이지만 모델에는 여전히 한계가 있습니다. 연구 유형에 따라 면역 세포의 부족과 장내 오가노이드의 미생물총이 장점일 수도 있고 단점이 될 수도 있습니다26. 본 연구에서는 면역 성분없이 줄기 세포 기능에 대한 claudin-7의 조절 역할을 조사하는 것이 유리합니다. 특정 효과는 생체 내 동물 모델에 존재할 면역 반응과 같은 다른 잠재적 변수보다는 특히 claudin-7에 기인한다고 결론지었습니다. 반대로,이 요소는 다른 유형의 연구에 대한 한계가 될 수 있습니다. 결장 오가노이드 배양을 확립하는 것은 또한 기존의 2D 세포주보다 비용과 시간이 많이 소요될 수 있습니다. 그러나, 이들은 생체내 관련성을 제공하는 조직의 세포 미세환경을 모방할 수 있고, 2D 세포 배양보다 조직을 훨씬 더 대표하며,동물 모델보다 여전히 비용이 적게 든다4,7. 장내 오가노이드 배양의 방대한 응용과 엄청난 잠재력을 감안할 때 이 시스템은 전 세계 실험실 연구에서 이상적인 모델이 될 것입니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 NIH DK103166의 자금 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.09 cubic feet space-saver vacuum desiccator | United States Plastic Corp | 78564 | anesthesia chamber |
| 0.5 M EDTA pH 8.0 | Invitrogen | AM9261 | |
| 1.5 mL microcentrifuge tubes | ThermoFisher | 69715 | |
| 15 mL conical centrifuge tubes | Fisher Scientific | 14-959-53A | |
| 1x Dulbecco’s Phosphate buffered saline | Gibco | 14190-144 | |
| 2-methylbutane | Sigma | 277258 | |
| 4% paraformaldehyde | ThermoFisher | J61899.AK | |
| 4-hydroxytamoxifen (4OH-TAM) | Sigma | 579002 | |
| 50 mL conical centrifuge tubes | Fisher Scientific | 14-432-22 | |
| 70 µm nylon cell strainer | Corning | 352350 | |
| 96 well culture plate | Greiner Bio-One | 655180 | |
| B-27 Supplement (50x) | Gibco | 12587-010 | |
| Bovine serum albumin | Fisher Scientific | BP1605-100 | |
| Claudin-7 anti-murine rabbit antibody | Immuno-Biological Laboratories | 18875 | |
| Cover glass (24 x 50-1.5) | Fisher Scientific | 12544E | |
| Cryomolds | vwr | 25608-916 | |
| Cultrex RCF BME, Type 2 | R&D Systems | 3533-005-02 | gel matrix |
| Cy3 anti-rabbit antibody | Jackson Immunoresearch | 111-165-003 | |
| Dewar Flask | Thomas Scientific | 1173F61 | |
| DMEM High Glucose with L-Glutamine | ATCC | 30-2002 | |
| EVOS FLoid Imaging System | ThermoFisher | 4477136 | |
| Fluoro-Gel II with DAPI | Electron Microscopy Sciences | 17985-50 | |
| GlutaMAX (100x) | Gibco | 35050-061 | |
| Glycine | JT Baker | 4059-02 | |
| HEPES (1 M) Buffer Solution | Gibco | 15630-080 | |
| Hoechst | ThermoFisher | 62249 | |
| In situ cell death detection kit, TMR Red | Roche | 12156792910 | |
| Isoflurane | Pivetal | 07-893-8440 | |
| L-WRN Media | Harvard Medical School Gastrointestinal Organoid Derivation and Culture Core | N/A | |
| Mouse surgical kit | Kent Scientific Corporation | INSMOUSEKIT | |
| Murine EGF | PeproTech | 315-09-500UG | |
| N2 Supplement (100x) | Gibco | 17502-048 | |
| Optimum cutting temperature (OCT) compound | Agar Scientific | AGR1180 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Sequenza Rack | vwr | 10129-584 | |
| Sodium Citrate | Fisher Scientific | S-279 | |
| Sucrose | Sigma | S9378 | |
| Triton X-100 | Sigma | X100 | |
| Vacuum filter (0.22 µm; cellulose acetate) | Corning | 430769 | |
| Y-27632 dihydrochloride | Tocris Bioscience | 1254 |
참고문헌
- Hughes, C. S., Postovit, L. M., Lajoie, G. A. Matrigel: a complex protein mixture required for optimal growth of cell culture. Proteomics. 10 (9), 1886-1890 (2010).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Wallach, T. E., Bayrer, J. R. Intestinal organoids: new frontiers in the study of intestinal disease and physiology. Journal of Pediatric Gastroenterology and Nutrition. 64 (2), 180-185 (2017).
- Shankaran, A., Prasad, K., Chaudhari, S., Brand, A., Satyamoorthy, K. Advances in development and application of human organoids. 3 Biotech. 11 (6), 257 (2021).
- Angus, H., Butt, A., Schultz, M., Kemp, R. Intestinal organoids as a tool for inflammatory bowel disease research. Frontiers in Medicine. 6, 334 (2020).
- Fan, Y., Davidson, L. A., Chapkin, R. S. Murine colonic organoid culture system and down stream assay applications. Methods in Molecular Biology. 1576, 171-181 (2019).
- Gupta, N., et al. Microfluidics-based 3D cell culture models: Utility in novel drug discovery and delivery research. Bioengineering and Translational Medicine. 1 (1), 63-81 (2016).
- Yoo, J., Donowitz, M. Intesitnal enteroids/organoids: A novel platform for drug discovery in inflammatory bowel diseases. World Journal of Gastroenterology. 25 (30), 4125-4147 (2019).
- Qu, M., et al. Establishment of intestinal organoid cultures modeling injury-associated epithelial regeneration. Cell Research. 31 (3), 259-271 (2021).
- Xing, T., et al. Tight junction protein claudin-7 is essential for intestinal epithelial stem cell self-renewal and differentiation. Cellular and Molecular Gastroenterology and Hepatology. 9 (4), 641-659 (2020).
- Ding, L., et al. Inflammation and disruption of the mucosal architecture in claudin-7-deficient mice. Gastroenterology. 142 (2), 305-315 (2012).
- Lu, Z., Ding, L., Lu, Q., Chen, Y. H. Claudins in intestines: distribution and functional significance in health and diseases. Tissue Barriers. 1 (3), 24978 (2013).
- Ding, L., Lu, Z., Lu, Q., Chen, Y. H. The claudin family of proteins in human malignancy: a clinical perspective. Cancer Management and Research. 5, 367-375 (2013).
- Bhat, A. A., et al. Claudin-7 expression induces mesenchymal to epithelial transformation (MET) to inhibit colon tumorigenesis. Oncogene. 34 (35), 4570-4580 (2015).
- Lu, Z., et al. A non-tight junction function of claudin-7-interaction with integrin signaling in suppressing lung cancer cell proliferation and detachement. Molecular Cancer. 14, 120 (2015).
- Wang, K., Xu, C., Li, W., Ding, L. Emerging clinical significance of claudin-7 in colorectal cancer: a review. Cancer Management and Research. 10, 3741-3752 (2018).
- Wang, K., et al. Claudin-7 downregulation induces metastasis and invasion in colorectal cancer via the promotion of epithelial-mesenchymal transition. Biochemical and Biophysical Research Communications. 508 (3), 797-804 (2019).
- Wang, F., et al. Isolation and characterization of intestinal stem cells based on surface marker combinations and colony-formation assay. Gastroenterology. 145 (2), 383 (2013).
- Li, W., et al. Severe intestinal inflammation in the small intestine of mice induced by controllable deletion of claudin-7. Digestive Diseases and Sciences. 63 (5), 1200-1209 (2018).
- Donovan, J., Brown, P. Euthanasia. Current Protocols in Immunology. 73 (1), (2006).
- Khalil, H., Nie, W., Edwards, R. A., Yoo, J. Isolation of primary myofibroblasts from mouse and human colon tissue. Journal of Visual Experiments. (80), e50611 (2013).
- Sugimoto, K., et al. Cell adhesion signals regulate the nuclear receptor activity. Proceedings of the National Academy of Sciences. 116 (49), 24600-24609 (2019).
- Mansour, H., et al. Connexin 30 expression and frewuency of connexin heterogeneity in astrocyte gap junction plaques increase with age in the rat retina. PLoS One. 8 (3), 57038 (2013).
- Miranda, M., et al. Antioxidants rescue photoreceptors in rd1 mice: relationship with thiol metabolism. Free Radical Biology and Medicine. 48 (2), 216-222 (2010).
- Wang, L., et al. Mesenchymal stromal cells ameliorate oxidative stress-induced islet endothelium apoptosis and functional impairment via Wnt4-β-catenin signaling. Stem Cell Research and Therapy. 8 (1), 188 (2017).
- Almeqdadi, M., Mana, M., Roper, J., Yilmaz, O. Gut organoids: mini-tissues in culture to study intestinal physiology and disease. American Journal of Physiology-Cell Physiology. 317 (3), 405-419 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유