Method Article
ثقافة ثلاثية الأبعاد لخبايا القولون الفئران لدراسة وظيفة الخلايا الجذعية المعوية خارج الجسم الحي
In This Article
Summary
يصف البروتوكول الحالي إنشاء نظام عضوي قولوني للفئران لدراسة نشاط وعمل الخلايا الجذعية القولونية في نموذج خروج المغلوب claudin-7.
Abstract
تتجدد ظهارة الأمعاء كل 5-7 أيام ، ويتم التحكم فيها بواسطة مجموعة الخلايا الجذعية الظهارية المعوية (IESC) الموجودة في الجزء السفلي من منطقة القبو. تشمل IESCs الخلايا الجذعية النشطة ، التي تتجدد ذاتيا وتتمايز إلى أنواع مختلفة من الخلايا الظهارية ، والخلايا الجذعية الهادئة ، والتي تعمل كخلايا جذعية احتياطية في حالة الإصابة. يتم التحكم في تجديد ظهارة الأمعاء من خلال قدرات التجديد الذاتي والتمايز لهذه IESCs النشطة. بالإضافة إلى ذلك ، فإن توازن عدد الخلايا الجذعية القبو والحفاظ على مكانة الخلايا الجذعية ضروريان لتجديد الأمعاء. تعد الثقافة العضوية طريقة مهمة وجذابة لدراسة البروتينات وجزيئات الإشارات والإشارات البيئية التي تنظم بقاء الخلايا الجذعية ووظائفها. هذا النموذج أقل تكلفة وأقل استهلاكا للوقت وأكثر قابلية للتلاعب من النماذج الحيوانية. تحاكي الكائنات العضوية أيضا البيئة المكروية للأنسجة ، مما يوفر أهمية في الجسم الحي . يصف البروتوكول الحالي عزل خبايا القولون ، ودمج خلايا القبو المعزولة هذه في نظام مصفوفة هلام ثلاثي الأبعاد وزراعة خلايا القبو لتشكيل عضويات قولونية قادرة على التنظيم الذاتي والانتشار والتجديد الذاتي والتمايز. يسمح هذا النموذج للمرء بمعالجة البيئة - ضرب بروتينات معينة مثل claudin-7 ، وتنشيط / إلغاء تنشيط مسارات الإشارات ، وما إلى ذلك - لدراسة كيفية تأثير هذه التأثيرات على عمل الخلايا الجذعية القولونية. على وجه التحديد ، تم فحص دور بروتين الوصلة الضيقة claudin-7 في وظيفة الخلايا الجذعية القولونية. Claudin-7 أمر حيوي للحفاظ على التوازن المعوي ووظيفة الحاجز وسلامته. يؤدي خروج المغلوب من claudin-7 في الفئران إلى نمط ظاهري يشبه مرض التهاب الأمعاء يظهر التهابا معويا ، وتضخم ظهاري ، وفقدان الوزن ، وتقرحات الغشاء المخاطي ، وتقشير الخلايا الظهارية ، والأورام الغدية. في السابق ، أفيد أن claudin-7 مطلوب لوظائف الخلايا الجذعية الظهارية المعوية في الأمعاء الدقيقة. في هذا البروتوكول ، يتم إنشاء نظام زراعة عضوي القولون لدراسة دور claudin-7 في الأمعاء الغليظة.
Introduction
الثقافة العضوية المعوية هي نظام ثلاثي الأبعاد (3D) خارج الجسم الحي يتم فيه عزل الخلايا الجذعية من الخبايا المعوية للأنسجة الأولية ومطلية في مصفوفة هلام 1,2. هذه الخلايا الجذعية قادرة على التجديد الذاتي والتنظيم الذاتي ووظائف الأعضاء2. تحاكي الكائنات العضوية البيئة المكروية للأنسجة وهي أكثر تشابها مع النماذج في الجسم الحي من نماذج زراعة الخلايا ثنائية الأبعاد (2D) في المختبر ، على الرغم من أنها أقل قابلية للتلاعب من الخلايا 3,4. يزيل هذا النموذج العقبات التي تواجهها نماذج 2D ، مثل عدم وجود التصاقات مناسبة للخلايا الخلوية ، وتفاعلات مصفوفة الخلية ، والمجموعات المتجانسة ، ويقلل أيضا من قيود النماذج الحيوانية ، بما في ذلك التكاليف المرتفعة والفترات الزمنية الطويلة5. الكائنات العضوية المعوية - يشار إليها أيضا باسم القولون لتلك التي تزرع من الخلايا الجذعية المشتقة من سرداب القولون - هي في الأساس أعضاء صغيرة تحتوي على ظهارة بما في ذلك جميع أنواع الخلايا التي ستكون موجودة في الجسم الحي ، بالإضافة إلى التجويف. يسمح هذا النموذج بمعالجة النظام لدراسة العديد من جوانب الأمعاء ، مثل مكانة الخلايا الجذعية ، وعلم وظائف الأعضاء المعوية ، والفيزيولوجيا المرضية ، وتشكل الأمعاء3،5،6. كما يوفر نموذجا رائعا لاكتشاف الأدوية ، ودراسة الاضطرابات المعوية البشرية مثل مرض التهاب الأمعاء (IBD) وسرطان القولون والمستقيم ، وتطوير العلاج الشخصي الخاص بالمريض ، ودراسة تجديد الأنسجة4،7،8،9. بالإضافة إلى ذلك ، يمكن أيضا استخدام النظام العضوي لدراسة الاتصالات الخلوية ، واستقلاب الدواء ، والجدوى ، والانتشار ، والاستجابة للمنبهات 7,8. في حين يمكن استخدام النماذج الحيوانية لاختبار العلاجات المحتملة للحالات المرضية المعوية ، إلا أنها محدودة للغاية ، حيث تشكل دراسة أدوية متعددة في وقت واحد تحديا. هناك المزيد من المتغيرات المربكة في الجسم الحي ، والتكلفة والوقت المرتبطان مرتفعان وطويلان ، على التوالي. من ناحية أخرى ، يسمح نظام الزراعة العضوية بفحص العديد من العلاجات في وقت واحد في فترة زمنية أقصر ويسمح أيضا بالعلاج الشخصي من خلال استخدام الثقافة العضوية المشتقة من المريض 4,8. كما أن قدرة الكائنات العضوية القولونية على تقليد تنظيم الأنسجة والبيئة المكروية والوظائف تجعلها أيضا نموذجا ممتازا لدراسة التجديد وإصلاح الأنسجة9. أنشأ مختبرنا نظام زراعة عضوي للأمعاء الدقيقة لدراسة تأثير claudin-7 على وظائف الخلايا الجذعية للأمعاء الدقيقة10. في هذه الدراسة ، تم إنشاء نظام زراعة عضوي معوي كبير لدراسة قدرة الخلايا الجذعية ، أو عدم قدرتها ، على التجديد الذاتي والتمايز والتكاثر في نموذج خروج المغلوب claudin-7 الشرطي (cKO).
Claudin-7 هو بروتين مهم جدا للوصلة الضيقة (TJ) يتم التعبير عنه بشكل كبير في الأمعاء وهو ضروري للحفاظ على وظيفة TJ وسلامته11. تعاني فئران cKO من نمط ظاهري يشبه IBD ، حيث تظهر التهابا شديدا ، وتقرحات ، وتقشير الخلايا الظهارية ، والأورام الغدية ، وزيادة مستويات السيتوكين11,12. في حين أنه من المقبول على نطاق واسع أن claudins حيوية لوظيفة الحاجز الظهاري ، فإن أدوارا جديدة للكلاودين آخذة في الظهور. يشاركون في الانتشار والهجرة وتطور السرطان ووظيفة الخلايا الجذعية 10،12،13،14،15،16،17. من غير المعروف حاليا كيف يؤثر claudin-7 على مكانة الخلايا الجذعية ووظيفة الخلايا الجذعية القولونية. نظرا لأن الأمعاء تتجدد ذاتيا بسرعة كل 5-7 أيام تقريبا ، فإن الحفاظ على مكانة الخلايا الجذعية والأداء السليم للخلايا الجذعية النشطة أمر حيوي18. هنا ، يتم إنشاء نظام لدراسة الآثار التنظيمية المحتملة ل claudin-7 على مكانة الخلايا الجذعية القولونية.
Protocol
تمت الموافقة على جميع التجارب والإجراءات على الحيوانات من قبل لجنة رعاية واستخدام الحيوان بجامعة إيست كارولينا (ECU) وأجريت وفقا للمبادئ التوجيهية الصادرة عن المعاهد الوطنية للصحة ووحدة التحكم الإلكترونية بشأن رعاية المختبر واستخدامها. تم إنشاء فئران خروج المغلوب claudin-7 المحرضة والخاصة بالأمعاء عن طريق عبور الفئران المعدلة وراثيا C57BL6 claudin-7-flox مع الفئران Villin-CreERT219. تم استخدام الفئران الذكور والإناث الذين تتراوح أعمارهم بين 3 أشهر في هذه الدراسة.
1. إعداد الكاشف / المعدات
- تبريد الكواشف / المعدات التالية قبل البدء في التجارب المرتبطة بها: محلول ملحي مخزن بالفوسفات (PBS) لغسل أنسجة القولون أثناء عزل القبو. هزاز / دوار (يوضع في ثلاجة 4 درجات مئوية) للحضانة مع وسائط التفكك الظهاري.
- قم بإزالة مصفوفة الهلام (انظر جدول المواد) من -20 درجة مئوية وقم بإذابة الثلج على الثلج قبل الطلاء.
- قم بتبريد جهاز الطرد المركزي مسبقا إلى 4 درجات مئوية قبل تدوير الخبايا للطلاء.
- قم بتبريد محلول سترات الصوديوم بنسبة 0.1٪ (انظر جدول المواد) واحتفظ به على الثلج قبل اكتشاف موت الخلايا في الموقع .
- قم بتسخين الكواشف التالية قبل بدء التجارب المرتبطة بها: لوحة استزراع 96 بئرا لمدة 24 ساعة قبل الطلاء ؛ وسائط L-WRN (انظر جدول المواد) قبل الإضافة إلى الخبايا المطلية وقبل تغيير كل وسائط.
- سخني الحمام المائي إلى 94 درجة مئوية قبل تلطيخه.
2. عزل سرداب القولون الفئران
- قم بإعداد الوسائط اللازمة باتباع الخطوات أدناه.
ملاحظة: يتم حساب أحجام الوسائط هنا للنسيج القولوني لفئران.- تحضير وسائط التفكك الظهاري: 30 مل من 1x PBS + 400 ميكرولتر من 0.5 M EDTA + 50 ميكرولتر من 10 mM Y-27632 ثنائي هيدروكلوريد (انظر جدول المواد). يحفظ على الثلج حتى الاستخدام.
- تحضير وسائط تفكك القبو: 10 مل من 1x PBS + 10 ميكرولتر من 10 mM Y-27632 ثنائي هيدروكلوريد. يحفظ على الثلج حتى الاستخدام.
- ملحق وسائط L-WRN: 50 مل من وسائط L-WRN + 47.5 مل من الجلوكوز العالي DMEM مع L-Glutamine + 500 ميكرولتر من L-glutamine + 500 ميكرولتر من البنسيلين / الستربتومايسين + 1000 ميكرولتر من مكمل B-27 (50x) + 500 ميكرولتر من مكمل N2 (100x) + 50 ميكرولتر من محلول HEPES (1 M) (انظر جدول المواد).
- قم بتصفية وسائط L-WRN الكاملة (المكملة) والقسمة للتخزين عند -20 درجة مئوية لمدة تصل إلى 3 أشهر.
ملاحظة: الوسائط المذابة مستقرة عند 4 درجات مئوية لمدة تصل إلى 2 أسابيع.
- قم بإجراء عزل القبو.
- للتخدير العام ، أضف 1 مل من الأيزوفلوران إلى القطن وضعه داخل علبة بلاستيكية داخل غرفة تخدير 0.09 قدم مكعب (انظر جدول المواد). ضع الفأر في غرفة التخدير حتى يتوقف التنفس (حوالي 3-5 دقائق) ثم قم بإجراء خلع عنق الرحم20.
- قم بعمل شق 2 تقريبا أسفل خط الوسط للماوس ، مع تثبيت الجلد الخلفي لكشف البطن. عزل القولون عن طريق قطع أسفل الأعور مباشرة من الجانب القريب وفوق المستقيم من الجانب البعيد21.
- باستخدام ملقط ، قم بإزالة الأنسجة الدهنية المرتبطة بالقولون. ادفع البراز برفق للخارج باستخدام الطرف المسطح للملقط واقطع الأنسجة مفتوحة طوليا.
- اغسل المنديل 10-15 مرة باستخدام برنامج تلفزيوني بارد 1x باستخدام ملقط "لتحريك" الأنسجة في برنامج تلفزيوني بين الغسلات.
- باستخدام مقص نظيف وحاد ، قم بتقطيع الأنسجة إلى قطع صغيرة ، بحجم 3-5 مم تقريبا.
- كرر العملية للفأر الثاني وادمج قطع الأنسجة في أنبوب سعة 50 مل يحتوي على وسائط تفكك ظهاري باردة (الخطوة 2.1.1).
- احتضان قطع أنسجة القولون في وسط التفكك الظهاري لمدة 90 دقيقة عند 4 درجات مئوية مع هزاز لطيف.
- اسمح لشظايا الأنسجة بالغرق في قاع الأنبوب ، ثم تخلص بعناية من وسائط التفكك الظهاري دون تعطيل الأنسجة. كرر هذه العملية عند غسل الأنسجة 10-15 مرة مع بارد 1x PBS. تخلص من أكبر قدر ممكن من برنامج تلفزيوني أثناء الغسيل النهائي.
- أضف وسائط تفكك القبو (الخطوة 2.1.2) إلى أنبوب 50 مل الذي يحتوي على قطع أنسجة القولون ورجه باستمرار لمدة 5-10 دقائق باليد.
ملاحظة: يجب أن تصبح الوسائط غائمة من الخبايا المنفصلة. - تحت غطاء زراعة الخلايا ، قم بتصفية الأنسجة والوسائط باستخدام مصفاة خلية نايلون 70 ميكرومتر (انظر جدول المواد) في أنبوب جديد سعة 50 مل.
- جهاز طرد مركزي عند 200 × جم لمدة 10 دقائق في درجة حرارة الغرفة وتخلص من المادة الطافية دون إزعاج الحبيبات المحتوية على سرداب.
ملاحظة: اعتمادا على المعدات ، يمكن للمرء نقل الوسائط المتوترة إلى أنبوب 15 مل للطرد المركزي. - أعد تعليق الحبيبات في ~ 3-4 مل من برنامج تلفزيوني بارد 1x.
- ماصة 10 ميكرولتر من الخبايا المعزولة في خط على شريحة المجهر. تحت المجهر ، احسب عدد الخبايا الطويلة الكاملة لتقدير تركيز القبو لكل 10 ميكرولتر.
- احسب الحجم المناسب للخبايا لتدور من أجل لوحة 10 سراديب / ميكرولتر في لوحة 96 بئر.
3. سرداب الطلاء
- جهاز طرد مركزي حجم مناسب من الخبايا المعزولة في أنبوب طرد مركزي دقيق سعة 1.5 مل عند 200 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- قم بإزالة المادة الطافية بعناية باستخدام ماصة 1000 ميكرولتر دون تعطيل الخبايا المحببة.
- أضف 100 ميكرولتر من مصفوفة الهلام (تكفي لتسعة آبار) إلى الخبايا المحببة والماصة بعناية لتجنب إدخال فقاعات الهواء.
ملاحظة: راجع قسم المناقشة للحصول على وصف تفصيلي لكيفية مزج مصفوفة الهلام والخبايا. عادة ، 100 ميكرولتر كافية لتسعة آبار. - اسمح لمصفوفة الهلام بالتصلب جزئيا (~ 1-2 دقيقة).
- لوحة 10 ميكرولتر من مصفوفة الهلام مختلطة مع الخبايا في كل بئر من لوحة استزراع 96 بئر تم تسخينها مسبقا لتشكيل شكل قبة.
ملاحظة: ضع القبة في وسط البئر. احرص على عدم السماح لمصفوفة الهلام بالانتشار إلى جوانب البئر. راجع قسم المناقشة للحصول على وصف تفصيلي حول التصلب والطلاء. - اسمح لمصفوفة الهلام أن تكون مضبوطة بالكامل لمدة 10-20 دقيقة في حاضنة عند 37 درجة مئوية مع 5٪ CO2.
- قم بإعداد حل العمل النهائي لوسائط L-WRN.
- أضف 100 ميكرولتر من البنسيلين / الستربتومايسين إلى حصة 10 مل من وسائط L-WRN (انظر الخطوة 2.1.3) (مستقرة لمدة أسبوعين عند 4 درجات مئوية).
- أضف مكملات إلى 900 ميكرولتر من وسائط L-WRN مع البنسيلين / الستربتومايسين: 0.9 ميكرولتر من 1 مجم / مل EGF + 0.9 ميكرولتر من 10 مللي مول Y-27632 ثنائي هيدروكلوريد.
ملاحظة: تستند الأحجام إلى تسعة آبار. يضاف Y-27632 ثنائي هيدروكلوريد فقط في اليوم 0 (في وقت الطلاء).
- أضف 100 ميكرولتر من الوسائط إلى كل بئر. احرص على عدم تعطيل القبة.
- احتضان عند 37 درجة مئوية مع 5٪ CO2 لمدة 24 ساعة.
4. خلق كلاودين -7 بالضربة القاضية في الثقافة
- اسمح للخبايا بالنمو بشكل طبيعي في الثقافة لمدة 24 ساعة بعد الطلاء.
- في أنبوب طرد مركزي دقيق سعة 1.5 مل ، أضف 2.7 ميكرولتر من 1 مليمول / لتر 4-هيدروكسيتاموكسيفين (4OH-Tamoxifen) إلى 900 ميكرولتر من وسائط L-WRN (التركيز النهائي 3 ميكرومول / لتر) + 0.9 ميكرولتر من 1 مجم / مل EGF.
ملاحظة: يتم تحضير محلول مخزون 4OH-Tamoxifen عن طريق خلط مسحوق 4OH-Tamoxifen (انظر جدول المواد) مع 1x PBS بتركيز 1 مليمول / لتر. - قم بإزالة الوسائط القديمة من الآبار عن طريق الشفط الفراغي.
- أضف 100 ميكرولتر من الوسائط المحتوية على 4OH-Tamoxifen إلى كل بئر وقم بتسميتها على أنها claudin-7 cKO / 4OH-TAM.
ملاحظة: يجب إضافة DMSO إلى آبار التحكم. يجب إضافة وسائط جديدة تحتوي على 4OH-Tamoxifen كل 2 أيام. - احتضان عند 37 درجة مئوية حتى تتغير الوسائط التالية (~ 2-3 أيام).
5. صيانة القولون العضوية
ملاحظة: يجب تغيير الوسائط كل 2-3 أيام. ثقافة تصل إلى 12 يوما.
- قم بإعداد حل عمل نهائي جديد لوسائط L-WRN: 900 ميكرولتر من وسائط L-WRN + 0.9 ميكرولتر من 1 مجم / مل EGF.
- قم بإزالة الوسائط القديمة من الآبار عن طريق الشفط الفراغي. أضف وسائط جديدة إلى الآبار.
ملاحظة: احرص على عدم تعطيل القبة. - احتضن عند 37 درجة مئوية حتى تتغير الوسائط التالية.
ملاحظة: يمكن الحفاظ على الثقافات وتمريرها للمدة المطلوبة للتجربة. عادة ما يتم الحفاظ على ثقافات الدراسة الحالية لمدة تتراوح بين 9-12 يوما ، ولكن قد يرغب المرء في الاستمرار أكثر ، لمدة 15 أو 20 يوما.
6. حصاد وتضمين عضويات القولون
- قم بإزالة الوسائط القديمة من الآبار عن طريق الشفط الفراغي.
- إصلاح المواد العضوية مع 4 ٪ بارافورمالدهيد (PFA) لمدة 1 ساعة في درجة حرارة الغرفة.
ملاحظة: PFA مادة سامة. اتخذ الاحتياطات اللازمة عند استخدام هذا الكاشف. - قم بإزالة 4٪ PFA من الآبار عن طريق الشفط الفراغي وأضف 30٪ سكروز لمدة 24 ساعة عند 4 درجات مئوية.
- قم بتسمية قالب بلاستيكي واملأه بنسبة 90٪ بمركب درجة حرارة القطع المثلى (OCT) (انظر جدول المواد).
- قم بإزالة 30٪ سكروز من الآبار عن طريق الشفط الفراغي. أضف 10 ميكرولتر من 1x PBS إلى كل بئر.
- باستخدام طرف ماصة ، خدش قاع البئر برفق لفصل القبة التي تحتوي على المواد العضوية.
- باستخدام ماصة ، قم بإزالة PBS الذي يحتوي على الكائنات العضوية المنفصلة وقم بتحميل السائل في القالب الذي يحتوي على OCT.
ملاحظة: تجنب إدخال الفقاعات في مركب OCT. - استمر في هذه العملية حتى تتم إزالة جميع المواد العضوية من جميع الآبار.
- في قارورة ديوار المصنوعة من الفولاذ المقاوم للصدأ ، أضف كريات الثلج الجاف و 2-ميثيل بوتان (يكفي لتغطية كريات الثلج الجاف) (انظر جدول المواد).
- امسك بثبات كتلة OCT المحتوية على عضوي فوق 2-methylbutane لتجميد الفلاش.
- قم بتخزين كتلة OCT المحتوية على المواد العضوية عند -80 درجة مئوية حتى تصبح جاهزة للقسم (يمكن تخزينها لمدة تصل إلى 1 سنة).
7. التألق المناعي
- قسم كتلة OCT المحتوية على المواد العضوية بسمك 5 ميكرومتر باستخدام cryostat (انظر جدول المواد) عند -20 درجة مئوية.
- لكل قسم ، تحقق تحت المجهر للتأكد من التقاط كائن عضوي. عند اكتمال التقسيم ، قم بتخزين الشرائح في درجة حرارة -80 درجة مئوية حتى تصبح جاهزة للبقع (يمكن تخزينها لمدة تصل إلى 6 أشهر).
- سخني الشرائح في محلول سترات الصوديوم 10 مللي مول لمدة 10 دقائق عند 94 درجة مئوية.
ملاحظة: يتكون المخزن المؤقت عن طريق إذابة سترات الصوديوم في الماء منزوع الأيونات. اضبط الرقم الهيدروجيني على 6 باستخدام حمض الهيدروكلوريك. - اترك الشرائح لتبرد على الطاولة لمدة 20 دقيقة. شطف بالماء المقطر لمدة 5 دقائق.
- قم بتجميع الشرائح في رف تلطيخ (انظر جدول المواد) باستخدام 0.2٪ Triton X-100 واحتضانها ب 100 مللي مول من الجلايسين لمدة 15 دقيقة.
- شطف ثلاث مرات مع 1x PBS لمدة 5 دقائق لكل منهما. يحجب مع 5٪ ألبومين مصل البقر (BSA) لمدة 45 دقيقة في درجة حرارة الغرفة.
- احتضان مع claudin-7 الجسم المضاد الأولي للأرانب المضادةللفئران 22 (مخفف في 1٪ BSA) طوال الليل عند 4 درجات مئوية. شطف ثلاث مرات مع 1x PBS لمدة 10 دقائق لكل منهما.
- احتضان مع Cy3 المضادة الثانوية المضادة للأرانب23 (المخفف في 1 ٪ BSA) لمدة 1 ساعة في درجة حرارة الغرفة. شطف ثلاث مرات مع 1x PBS لمدة 10 دقائق لكل منهما.
- قم بتركيب الشرائح باستخدام وسيط تركيب مناسب (انظر جدول المواد) باستخدام DAPI وأضف قسيمة غطاء.
8. كشف موت الخلية
- إصلاح المواد العضوية داخل الآبار مع 4 ٪ بارافورمالدهيد لمدة 1 ساعة في درجة حرارة الغرفة. شطف مع 1x PBS لمدة 5 دقائق.
- احتضان طبق الاستزراع على الجليد مع 0.1٪ Triton X-100 في محلول سترات الصوديوم البارد 0.1٪ لمدة دقيقتين. شطف مرتين مع 1x PBS لمدة 5 دقائق لكل منهما.
- قم بإعداد تفاعل TUNEL24,25 باستخدام TMR Red ، وهي مجموعة أدوات للكشف عن موت الخلايا في الموقع(انظر جدول المواد). أضف 50 ميكرولتر من كواشف تفاعل TUNEL إلى كل بئر.
- احتضان في جو مرطب لمدة 1 ساعة عند 37 درجة مئوية في الظلام.
ملاحظة: يجب إكمال جميع الخطوات المتبقية في الظلام. - شطف ثلاث مرات مع 1x PBS لمدة 5 دقائق لكل منهما. احتضان مع 1: 2500 Hoechst (مخفف في 1x PBS ، انظر جدول المواد) لمدة 3 دقائق.
- شطف ثلاث مرات مع 1x PBS لمدة 5 دقائق لكل منهما. استخدم مرشح TRITC لتصور الصور على مجهر الفلورسنت (انظر جدول المواد).
النتائج
من أجل فحص الآثار التنظيمية للكلاودين -7 على الخلايا الجذعية للقولون ، تم عزل خبايا القولون من أنسجة القولون الفئران كما هو موضح أعلاه وموضح في الشكل 1 أ. بمجرد عزل الخبايا من الأنسجة الأولية ، تم طلاؤها في مصفوفة ثلاثية الأبعاد في لوحة 96 بئرا لتنمو لمدة 11 يوما (الشكل 1). ستغلق الخبايا الصحية الطبيعية التجويف وتصبح كروية بحلول اليوم 2 وتبدأ في النهاية في التبرعم وتشكيل أنواع الخلايا الظهارية المختلفة في اليوم 5 تقريبا (الشكل 1 ب). سمح للقولونات بالنمو حتى اليوم 11 ، حيث تم حصادها بعد ذلك لإجراء مزيد من التجارب (الشكل 1 ب). لضرب claudin-7 في الثقافة ، سمح للخبايا بالنمو بشكل طبيعي لمدة 24 ساعة. بعد 24 ساعة ، تمت معالجة الخبايا ب 3 ميكرومول / لتر 4OH-Tamoxifen (TAM) واستزراعها لمدة 10 أيام إضافية. تم تغيير وسط الاستزراع الذي يحتوي على 4OH-TAM الطازج كل 2 أيام. تم استخدام DMSO كوسيلة في آبار التحكم. فشلت خبايا Claudin-7 الناقصة (claudin-7 KO) في تكوين كرويات مناسبة وبدأت تموت بسرعة بعد يوم واحد من علاج 4OH-TAM (الشكل 1B).
يسلط الشكل 2 أ الضوء على النمو الناجح للقولونويدات من الخبايا العادية التي تحتوي على claudin-7 (التحكم) أثناء تقدمها طوال 9 أيام من الثقافة. بدأت هذه الخبايا في تكوين كرويات بحلول اليوم 2 ، وبدأت في مهدها في اليوم 5 ، واستمرت في النمو والتبرعم حتى تم حصادها في اليوم 9 (الشكل 2 أ). في المقابل ، تدهورت الخبايا التي تفتقر إلى claudin-7 (claudin-7 KO) بسرعة كبيرة (الشكل 2B). بعد حوالي 2-3 أيام من العلاج ب 4OH-TAM ، لم تشكل خبايا claudin-7 KO كرويات ذات مظهر صحي وظهرت فقط ككتل دائرية من الخلايا (الشكل 2 ب). تمت معالجة الخبايا المعزولة من الفئران البرية باستخدام 4OH-TAM للتأكد من عدم وجود تأثير سام بسبب علاج تاموكسيفين. كانت هذه الخبايا قادرة على البقاء والنمو بشكل طبيعي. لفحص حذف claudin-7 وحالة بقاء claudin-7 KO colonoids ، تم استخدام طريقة تلطيخ مناعي ومجموعة أدوات للكشف عن موت الخلايا في الموقع (الشكل 3). أكد تلطيخ الفلورسنت المناعي للكلاودين -7 في السيطرة المحصودة وعضويات cKO نجاح خروج المغلوب من claudin-7 في الثقافة (الشكل 3 أ). أظهرت قولونويدات التحكم في اليوم 9 إشارة موت الخلايا المبرمج قليلة جدا (الشكل 3 ب) ؛ ومع ذلك ، أظهرت claudin-7 KO colonoids موت الخلايا المبرمج العالي (الشكل 3B). بدون claudin-7 ، لا يمكن للخلايا الجذعية البقاء على قيد الحياة أو التجديد الذاتي أو التمايز لتشكيل القولون.

الشكل 1: تمثيل تخطيطي يوضح عزل القبو ونمو القولون . (أ) تصوير رسومي لعملية عزل القبو ، والطلاء في مصفوفة 3D ، والنمو حتى الحصاد. (ب) الجدول الزمني للتجارب ونمو القولون في التحكم والخبايا المشتقة من claudin-7 KO. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
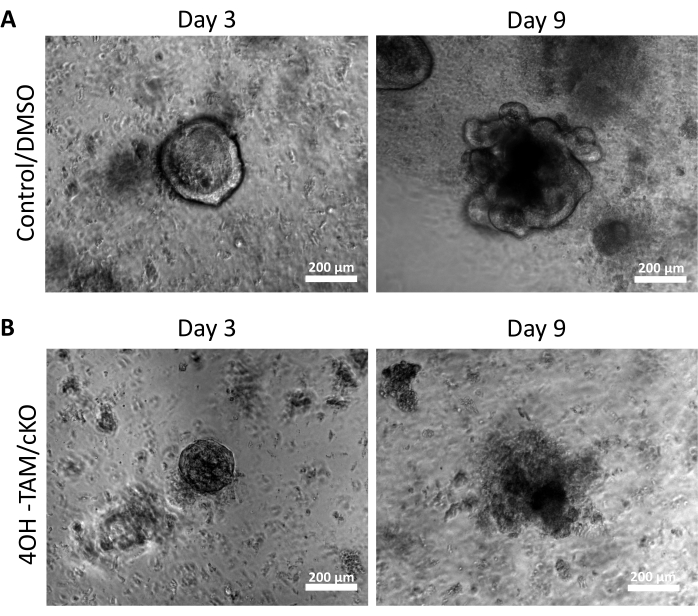
الشكل 2: القولون الناقص Claudin-7 غير قادر على البقاء والنمو . (أ) صور تمثيلية للعناصر العضوية الضابطة / DMSO في اليوم 3 واليوم 9. (ب) صور تمثيلية للعضويات 4OH-TAM / cKO في اليوم 3 واليوم 9 ، ن = 10. أشرطة المقياس = 200 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
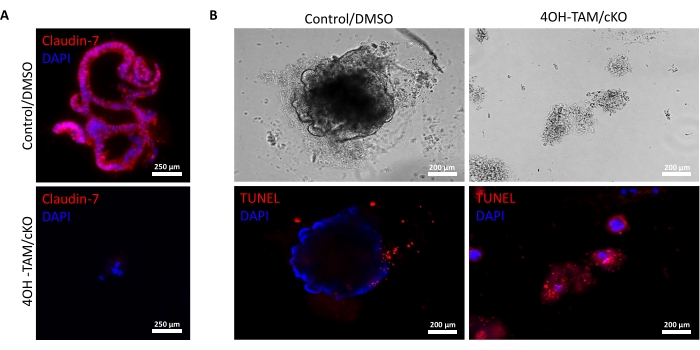
الشكل 3: القولون الناقص Claudin-7 يخضع بسرعة لموت الخلايا المبرمج. (أ) تلطيخ كلودين -7 في اليوم 9 التحكم / DMSO و claudin-7 cKO / 4OH-TAM organoids ، ن = 3. قضبان المقياس = 250 ميكرومتر. (ب) تلطيخ موت الخلايا المبرمج في اليوم 9 التحكم و claudin-7 cKO / 4OH-TAM colonoids ، n = 3. أشرطة المقياس = 200 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
تعد الزراعة العضوية نموذجا ممتازا لدراسة وظيفة الخلايا الجذعية ، وعلم وظائف الأعضاء المعوية ، واكتشاف الأدوية ، والأمراض المعوية البشرية ، وتجديد الأنسجةوإصلاحها 7،8،9،10،11،26. في حين أن لها العديد من المزايا ، إلا أنه قد يكون من الصعب تأسيسها. يجب توخي الحذر في جميع الخطوات في جميع أنحاء البروتوكول ، ولكن الأهم من ذلك خلال مرحلة الطلاء. عند خلط الخبايا المعزولة مع مصفوفة هلامية ، تأكد من ماصة تماما لأعلى ولأسفل لتفتيت حبيبات القبو التي تشكلت بعد الطرد المركزي وتوزيع الخبايا بالتساوي في جميع أنحاء المصفوفة. في الوقت نفسه ، تجنب إدخال فقاعات الهواء في المصفوفة أثناء سحب العينات. من أجل القيام بذلك ، يجب أن يتم السحب ببطء ، مع طرف الماصة باتجاه الجزء السفلي من الأنبوب سعة 1.5 مل.
بالإضافة إلى ذلك ، يجب عدم ترسيخ مصفوفة الهلام بالكامل طوال هذه العملية. لمنع التصلب المبكر ، اخلطه عن طريق السحب الدقيق ، ثم ضع الأنبوب على الثلج ، وكرر هذه العملية. بمجرد خلط الخبايا المعزولة ومصفوفة الهلام بشكل كاف ، اسمح لمصفوفة الهلام بالتصلب جزئيا. قد تستغرق هذه العملية 1-5 دقائق ، اعتمادا على نوع / ماركة مصفوفة الجل المستخدمة. يجب أن يشبه الجل الذي سيتحرك قليلا إذا كان الأنبوب مائلا ، ولكن يجب ألا يكون سائلا جدا بحيث ينسكب إذا كان مقلوبا. في هذه المرحلة ، يمكن للمرء أن يبدأ في طلاء 10 ميكرولتر في وسط كل بئر. يجب أن تشكل مصفوفة الهلام قبة 3D ويجب ألا تلمس جوانب البئر. إذا انتشرت مصفوفة الهلام وضربت جدار البئر ، فلن يتم ترسيخها بدرجة كافية ؛ انتظر حتى يتم ترسيخها بشكل كاف لتشكيل قبة ، لأن الخبايا لن تنجو وتنمو إذا لم يتم تشكيل القبة. بمجرد اكتمال الطلاء بشكل صحيح ، واستكمال الخبايا بشكل كاف ، كما هو موضح أعلاه ، من المتوقع أن تنمو الكائنات العضوية دون مشكلة.
ينشئ هذا البروتوكول نظاما عضويا للقولون مع أو بدون claudin-7 لمراقبة آثاره على بقاء الخلايا الجذعية القولونية. في حين أن ثقافة القولون العضوية هي نظام مبتكر ومفيد ، إلا أن النموذج لا يزال به قيود. اعتمادا على نوع الدراسة ، قد يكون نقص الخلايا المناعية والميكروبات في الكائنات العضوية المعوية ميزة أو عيبا26. بالنسبة للدراسة الحالية ، من المفيد التحقيق في الدور التنظيمي ل claudin-7 على وظائف الخلايا الجذعية بدون المكون المناعي. تم التوصل إلى أن تأثيرا معينا يرجع على وجه التحديد إلى claudin-7 ، بدلا من المتغيرات المحتملة الأخرى مثل الاستجابة المناعية التي ستكون موجودة في النماذج الحيوانية في الجسم الحي. على العكس من ذلك ، قد يكون هذا العامل قيدا على أنواع أخرى من الدراسات. قد يكون إنشاء ثقافة القولون العضوية أكثر تكلفة ووقتا طويلا من خطوط خلايا 2D التقليدية. ومع ذلك ، يمكنهم تقليد البيئة المكروية الخلوية للأنسجة التي توفر أهمية في الجسم الحي ، وهي أكثر تمثيلا للأنسجة من ثقافة الخلايا ثنائية الأبعاد ، ولا تزال أقل تكلفة من النماذج الحيوانية 4,7. نظرا للتطبيق الهائل للثقافة العضوية المعوية والإمكانات الهائلة ، من المرجح أن يصبح هذا النظام النموذج المثالي في الأبحاث المختبرية في جميع أنحاء العالم.
Disclosures
يعلن المؤلفون عدم وجود تضارب في المصالح.
Acknowledgements
تم تمويل هذه الدراسة من قبل NIH DK103166.
Materials
| Name | Company | Catalog Number | Comments |
| 0.09 cubic feet space-saver vacuum desiccator | United States Plastic Corp | 78564 | anesthesia chamber |
| 0.5 M EDTA pH 8.0 | Invitrogen | AM9261 | |
| 1.5 mL microcentrifuge tubes | ThermoFisher | 69715 | |
| 15 mL conical centrifuge tubes | Fisher Scientific | 14-959-53A | |
| 1x Dulbecco’s Phosphate buffered saline | Gibco | 14190-144 | |
| 2-methylbutane | Sigma | 277258 | |
| 4% paraformaldehyde | ThermoFisher | J61899.AK | |
| 4-hydroxytamoxifen (4OH-TAM) | Sigma | 579002 | |
| 50 mL conical centrifuge tubes | Fisher Scientific | 14-432-22 | |
| 70 µm nylon cell strainer | Corning | 352350 | |
| 96 well culture plate | Greiner Bio-One | 655180 | |
| B-27 Supplement (50x) | Gibco | 12587-010 | |
| Bovine serum albumin | Fisher Scientific | BP1605-100 | |
| Claudin-7 anti-murine rabbit antibody | Immuno-Biological Laboratories | 18875 | |
| Cover glass (24 x 50-1.5) | Fisher Scientific | 12544E | |
| Cryomolds | vwr | 25608-916 | |
| Cultrex RCF BME, Type 2 | R&D Systems | 3533-005-02 | gel matrix |
| Cy3 anti-rabbit antibody | Jackson Immunoresearch | 111-165-003 | |
| Dewar Flask | Thomas Scientific | 1173F61 | |
| DMEM High Glucose with L-Glutamine | ATCC | 30-2002 | |
| EVOS FLoid Imaging System | ThermoFisher | 4477136 | |
| Fluoro-Gel II with DAPI | Electron Microscopy Sciences | 17985-50 | |
| GlutaMAX (100x) | Gibco | 35050-061 | |
| Glycine | JT Baker | 4059-02 | |
| HEPES (1 M) Buffer Solution | Gibco | 15630-080 | |
| Hoechst | ThermoFisher | 62249 | |
| In situ cell death detection kit, TMR Red | Roche | 12156792910 | |
| Isoflurane | Pivetal | 07-893-8440 | |
| L-WRN Media | Harvard Medical School Gastrointestinal Organoid Derivation and Culture Core | N/A | |
| Mouse surgical kit | Kent Scientific Corporation | INSMOUSEKIT | |
| Murine EGF | PeproTech | 315-09-500UG | |
| N2 Supplement (100x) | Gibco | 17502-048 | |
| Optimum cutting temperature (OCT) compound | Agar Scientific | AGR1180 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Sequenza Rack | vwr | 10129-584 | |
| Sodium Citrate | Fisher Scientific | S-279 | |
| Sucrose | Sigma | S9378 | |
| Triton X-100 | Sigma | X100 | |
| Vacuum filter (0.22 µm; cellulose acetate) | Corning | 430769 | |
| Y-27632 dihydrochloride | Tocris Bioscience | 1254 |
References
- Hughes, C. S., Postovit, L. M., Lajoie, G. A. Matrigel: a complex protein mixture required for optimal growth of cell culture. Proteomics. 10 (9), 1886-1890 (2010).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Wallach, T. E., Bayrer, J. R. Intestinal organoids: new frontiers in the study of intestinal disease and physiology. Journal of Pediatric Gastroenterology and Nutrition. 64 (2), 180-185 (2017).
- Shankaran, A., Prasad, K., Chaudhari, S., Brand, A., Satyamoorthy, K. Advances in development and application of human organoids. 3 Biotech. 11 (6), 257 (2021).
- Angus, H., Butt, A., Schultz, M., Kemp, R. Intestinal organoids as a tool for inflammatory bowel disease research. Frontiers in Medicine. 6, 334 (2020).
- Fan, Y., Davidson, L. A., Chapkin, R. S. Murine colonic organoid culture system and down stream assay applications. Methods in Molecular Biology. 1576, 171-181 (2019).
- Gupta, N., et al. Microfluidics-based 3D cell culture models: Utility in novel drug discovery and delivery research. Bioengineering and Translational Medicine. 1 (1), 63-81 (2016).
- Yoo, J., Donowitz, M. Intesitnal enteroids/organoids: A novel platform for drug discovery in inflammatory bowel diseases. World Journal of Gastroenterology. 25 (30), 4125-4147 (2019).
- Qu, M., et al. Establishment of intestinal organoid cultures modeling injury-associated epithelial regeneration. Cell Research. 31 (3), 259-271 (2021).
- Xing, T., et al. Tight junction protein claudin-7 is essential for intestinal epithelial stem cell self-renewal and differentiation. Cellular and Molecular Gastroenterology and Hepatology. 9 (4), 641-659 (2020).
- Ding, L., et al. Inflammation and disruption of the mucosal architecture in claudin-7-deficient mice. Gastroenterology. 142 (2), 305-315 (2012).
- Lu, Z., Ding, L., Lu, Q., Chen, Y. H. Claudins in intestines: distribution and functional significance in health and diseases. Tissue Barriers. 1 (3), 24978 (2013).
- Ding, L., Lu, Z., Lu, Q., Chen, Y. H. The claudin family of proteins in human malignancy: a clinical perspective. Cancer Management and Research. 5, 367-375 (2013).
- Bhat, A. A., et al. Claudin-7 expression induces mesenchymal to epithelial transformation (MET) to inhibit colon tumorigenesis. Oncogene. 34 (35), 4570-4580 (2015).
- Lu, Z., et al. A non-tight junction function of claudin-7-interaction with integrin signaling in suppressing lung cancer cell proliferation and detachement. Molecular Cancer. 14, 120 (2015).
- Wang, K., Xu, C., Li, W., Ding, L. Emerging clinical significance of claudin-7 in colorectal cancer: a review. Cancer Management and Research. 10, 3741-3752 (2018).
- Wang, K., et al. Claudin-7 downregulation induces metastasis and invasion in colorectal cancer via the promotion of epithelial-mesenchymal transition. Biochemical and Biophysical Research Communications. 508 (3), 797-804 (2019).
- Wang, F., et al. Isolation and characterization of intestinal stem cells based on surface marker combinations and colony-formation assay. Gastroenterology. 145 (2), 383 (2013).
- Li, W., et al. Severe intestinal inflammation in the small intestine of mice induced by controllable deletion of claudin-7. Digestive Diseases and Sciences. 63 (5), 1200-1209 (2018).
- Donovan, J., Brown, P. Euthanasia. Current Protocols in Immunology. 73 (1), (2006).
- Khalil, H., Nie, W., Edwards, R. A., Yoo, J. Isolation of primary myofibroblasts from mouse and human colon tissue. Journal of Visual Experiments. (80), e50611 (2013).
- Sugimoto, K., et al. Cell adhesion signals regulate the nuclear receptor activity. Proceedings of the National Academy of Sciences. 116 (49), 24600-24609 (2019).
- Mansour, H., et al. Connexin 30 expression and frewuency of connexin heterogeneity in astrocyte gap junction plaques increase with age in the rat retina. PLoS One. 8 (3), 57038 (2013).
- Miranda, M., et al. Antioxidants rescue photoreceptors in rd1 mice: relationship with thiol metabolism. Free Radical Biology and Medicine. 48 (2), 216-222 (2010).
- Wang, L., et al. Mesenchymal stromal cells ameliorate oxidative stress-induced islet endothelium apoptosis and functional impairment via Wnt4-β-catenin signaling. Stem Cell Research and Therapy. 8 (1), 188 (2017).
- Almeqdadi, M., Mana, M., Roper, J., Yilmaz, O. Gut organoids: mini-tissues in culture to study intestinal physiology and disease. American Journal of Physiology-Cell Physiology. 317 (3), 405-419 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved