Method Article
Гетеропереход оксида металла для фотокаталитической активности
В этой статье
Резюме
Разработка гетероперехода повышает фотокаталитическую активность синтеза горения раствора, который является процессом, эффективным по времени и энергии. Для оценки характеристик материалов в этом протоколе были использованы передовые методы аналитической характеризации, а нанокомпозиты продемонстрировали улучшенную деградацию кислотного оранжевого красителя-8.
Аннотация
Во всем мире существует значительный спрос на усовершенствование методов синтеза и их оптимальных характеристик, особенно для применения в промышленных масштабах. Синтез горения на основе золь-гель раствора (SG-SCS) является простым методом получения упорядоченных пористых материалов. В этом отношении теория твердых и мягких кислот и оснований Пирсона помогает в выборе реакционной способности хозяин-легирующая примесь для формирования правильной гетеропереходности.
Образование гетероперехода также изменяет основные свойства материалов, улучшая фотокатализ за счет переноса заряда или синергетической активности. Температура прокаливания 500 °C идеально подходит для этого процесса, основываясь на результатах оценки стабильности с помощью дифференциального термогравиметрического анализа соотношения (DTG).
Наноразмерные размеры полученных наночастиц (НЧ) и нанокомпозитов (НК) были проверены с помощью рентгеновской дифракции и просвечивающей электронной микроскопии высокого разрешения (HRTEM). Кроме того, микрофотографии сканирующей электронной микроскопии и анализы BET подтвердили пористость материалов. HRTEM, рентгеновская фотоэлектронная спектроскопия и энергодисперсионные рентгеновские исследования установили состав материалов. Исследование показало, что NC ухудшают кислотно-оранжевый цвет 8 (AO8) более эффективно, чем чистый ZnO.
Введение
Охрана окружающей среды стала одной из основных проблем в связи с быстрым ростом числа компаний во всем мире. Следовательно, наноматериалы (ЯМ) на основе нанотехнологий и их синтез привлекли внимание исследователей в современном научном мире, а не объемные материалы1. Для обработки органических и неорганических загрязнителей было адаптировано несколько физико-химических подходов 2,3. В связи с этим, благодаря своей простоте и способности растворять токсины без создания вторичного загрязнения, гетерогенный фотокатализ рассматривается как адаптивный методремедиации4. В исследованиях был разработан гетеропереход или легирование между подходящими полупроводниками в запрещенной зоне, что помогает уменьшить электронно-дырочную рекомбинацию компонента, площадь поверхности и объем. Это состояние впоследствии увеличивало фотокаталитическую деградацию красителей 5,6,7. В недавних работах также сообщается о синергетической и зарядной роли в улучшении передачи за счет гетеропереходов/гибридов 8,9, а полупроводниковые оксиды металлов демонстрируют уникальные физические и химические свойства для многофункциональных применений10. В результатеTiO2 и НЧ оксида цинка (ZnO NPs) привлекли значительное внимание исследователей11,12.
По сравнению с отдельными материалами, образование гетероперехода стало одним из уникальных преимуществ для увеличения площади поверхности и объемного соотношения материалов, а также улучшения фотокаталитических и антибактериальных характеристик материала. Кроме того, синергетическое воздействие бинарных гетеропереходов улучшает разделение фотогенерируемых электрон/дырочных пар по сравнению с бинарными гетеропереходами13,14. Исследования показали, что гетеропереход между Mn2O3 и ZnO NPs15 улучшает стабильность и адсорбционную способность субстрата и снижает сопротивление переносу заряда в синтезированных НЧ. Кроме того, в нескольких исследованиях использовалась реакционная способность хозяин-легирующая примесь, основанная на теории твердых и мягких кислот и оснований Пирсона (HSAB) для проверки гетероперехода или образования легирующей примеси. Было обнаружено, что твердые кислоты Льюиса (такие как Mn(III)) не могут диффундировать в границу решетки хозяина Zn (II) в присутствии растворителя твердого основания, такого как вода16,17. Они адсорбируются на поверхности хозяина и окисляются с образованием гибрида при кальцинировании.
В связи с его потенциалом, в настоящее время глобальное внимание к промышленно масштабируемым приложениям синтеза материалов сосредоточено на совершенствовании подхода и его критических перспективах. Синтез горения в растворе (SCS) является простым, экономичным по времени и энергии методом создания регулярно упорядоченных пористых материалов18, которые играют значительную роль в явлении ионо-/массопереноса19. SCS включает в себя приличное распределение легирующей примеси или гетеропереход, основанное на теории твердых и мягких кислот и оснований Пирсона (HSAB). Легирование/гетеропереход может регулировать оптические, магнитные и электрические свойства материалов, что впоследствии повышает применимость материалов за счет эффективного переноса заряда и/или синергетических функций20. SCS с помощью агента-управляющего агента (ADA) также может производить упорядоченные коллоидные нанокристаллические каркасы (CNF), используемые для переноса массы/ионов в устройствах, преобразующих энергию21,22.
В рамках этого исследования были получены поверхностно-активное вещество и комплексообразователь на основе поливинилового спирта (ПВА) для синтеза НЧ ZnO и гетероперехода бинарных нанокомпозитов (НК) на основе ZnO с использованием экологически чистого подхода SG-SCS. Гетеропереход между оксидами, который играет важную роль в переносе заряда, был оценен на основе теории HSAB. Методы характеризации были использованы для понимания структурных, оптических и морфологических свойств материалов. Эффективность разложения материала была проверена как на стабильных, так и на токсичных красителях AO8.
протокол
1. Синтез наноматериалов
- Синтез нанокомпозитов ZnO-Mn2O3
- Синтез нанокомпозитов с использованием поливинилового спирта в качестве поверхностно-активного вещества и подхода SG-SCS с помощью комплексообразующего агента. Графическая иллюстрация подхода SG-SCS приведена на дополнительном рисунке S1.
- Растворить 1,5 г полимера ПВА в 100 мл дистиллированной воды при непрерывном перемешивании на магнитной мешалке в течение примерно 15 мин при 115 °С23.
- В растворенный раствор ПВА при непрерывном перемешивании в течение примерно 10 мин влейте растворы предшественников солей, гексагидрат нитрата цинка в концентрации 90% v/v и сульфат марганца в концентрации 10% v/v и снизьте температуру до 70 °C.
Примечание: Прекурсоры солей смешивали одновременно для балансировки реакционной способности нанокомпозитного предшественника в соответствии с подходом к зародышеобразованию-легированию16,24. Температура была снижена до 70 °C для контроля ускоренного роста и агрегации наночастиц в соответствии с модельюLa Mar 25,26. - Состарьте образующиеся золи (коллоидные частицы) гидроксида металлов, удерживая их в закрытом и темном месте в течение 2 дней. Затем обезвожьте раствор, нагревая до 110 °C (на воздухе) до образования геля.
ПРИМЕЧАНИЕ: Полимер ПВА действует как архитектура, направляя шаблоны и комплексообразующие агенты, которые способствуют однородному диспергированию катионов металлов, инициируя процесс горения и предотвращая свойства агрегации/агломерации. - Подвергните гель горению на воздухе, нагрев духовку до температуры воспламенения ~150-250 °C (приблизительная температура проверяется с помощью простого термометра). Температура воспламенения — это минимальная температура, необходимая для начала горения. Во время сгорания используйте вытяжки для сбора всех токсичных газовых побочных продуктов, влияющих на здоровье человека.
ПРИМЕЧАНИЕ: Процесс горения активировался путем образования комплексов между полимером ПВА и предшественниками нитратов, которые действуют как топливо для облегчения процесса горения. - Прокалить сгораемые материалы в течение 3 ч при 500 °C в муфельной печи, оптимизированной с помощью аналитического метода дифференциальной термогравиметрии (DTG). DTG разлагает несгоревшие примеси и улучшает кристалличность материалов27.
- Синтез чистых ZnO и Mn2O3 NPs
- Синтезируйте голые оксиды металлов с использованием золь-гель подхода. Синтезируйте чистый ZnO и Mn2O3 без ПВА, используя все описанные ранее шаги, шаги 1.1.1.-1.1.6., за исключением шага 1.1.2. Благодаря отсутствию комплексов нитрата металла и полимера ПВА на заключительной стадии сушки не происходит процесса самораспространения.
2. Определение характеристик NP
- Определите термогравиметрическое соотношение, в частности, термогравиметрическое/дифференциально-термическое (анализ DT/DTA), в атмосфере азота со скоростью потока 20,0 мл/мин и временем нарастания 50 °C/мин для изучения термической стабильности и деградации NP и NC.
- Проведите инфракрасную спектроскопию с преобразованием Фурье (FTIR) с использованием гранул KBr в диапазоне 400-4000 см-1 для изучения поведения поверхностных функциональных групп НЧ и НК.
- Выполнение рентгеновской дифракции (XRD) для изучения кристаллографической структуры ПВА, НЧ и НК.
- Используйте метод Брунауэра-Эммета-Теллера (BET; N2 изотерм адсорбции-десорбции) для расчета удельной площади поверхности образцов в диапазоне относительного давления (P/Po) 0,05-0,35. Определите распределение пор и размеров образцов с помощью метода Барретта-Джойнера-Галенды (BJH). Наконец, измерьте сорбцию N2 всех НЧ и НЧ при температуре −196,15 °C.
- Использование сканирующей электронной микроскопии с энергодисперсионной рентгеновской спектроскопией (SEM-EDX) и просвечивающей электронной микроскопией высокого разрешения (HRTEM) для изучения морфологии и проведения исследований состава NP и NCs.
- Выполнение анализа с помощью рентгеновской фотоэлектронной спектроскопии (XPS) на системе, интегрированной с запатентованной магнитной иммерсионной линзой Kratos, системой нейтрализации заряда и анализатором сферических зеркал. Калибровка пиковых энергий на основе энергии внешнего углерода.
ПРИМЕЧАНИЕ: Исследователь принял все стандартные процедуры и протоколы в процессе определения характеристик.
3. Исследования деградации партий
- Провести фотокаталитический эксперимент путем растворения 20 ppm красителя AO8 в 250 мл водного раствора (водного растворителя) с 0,06 г ZnO NPs и NCs фотокатализаторов.
- Используйте эксперимент по деградации в качестве проводника в реакторе из круглого стекла диаметром 176,6 см2 . Для этого эксперимента в качестве источника света используется ртутная лампа среднего давления (лампа ртутного столба) (λmax = 365 нм, 125 Вт)28. Перед освещением реакционную суспензию непрерывно перемешивать в темноте в течение 30 минут для создания равновесия адсорбции/десорбции AO8/CR на НЧ/НК.
- Облучайте образцы напрямую, фокусируя свет на реакционной смеси с расстояния 20 см. Используйте магнитную мешалку со скоростью 110 об/мин для непрерывного перемешивания раствора. Контролируйте общую температуру реактора во время эксперимента с помощью циркуляции воды.
- Каждые 15 минут отбирайте 5 мл раствора красителя для измерения их концентраций в момент t с помощью УФ-видимого спектрофотометра. Рассчитайте процент эффективности фотокаталитической деградации с помощью уравнения:
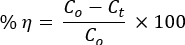
где Co и Ct – начальная и последующая концентрации t облучения, соответственно, раствора красителей AO8 и CR; и η эффективность обесцвечивания фотографий, - Используйте псевдокинетическое уравнение первого порядка для изучения динамики реакции:
Псевдо - кинетика первого порядка: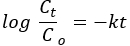
где Co и Ct — начальная и равновесная концентрации красителя AO8 (мг/л) соответственно, k — константа скорости, а t — время в минутах.
Результаты
На рисунке 1A показана термическая стабильность двоичных НК до того, как прибор DTG проанализирует кальцинацию в атмосфере N2. Последовательность испарения адсорбированных молекулН2О, внутримолекулярного распада, разложения гидроксидов металлов и/или боковой цепи ПВА, межмолекулярного разложения/разложения главной цепи ПВС и, наконец, кристаллической части с образованием углерода, углеводородов и золы29,30.
НК показали потерю стабильности при температуре выше 720 °C. Углы дифракции рентгеновской картины с соответствующими кристаллическими плоскостями соответствовали гексагональной структуре ZnO NP (ICSD: 00-036-1451; Рисунок 1B). НЧ ZnO демонстрировали острые пики по сравнению с композитами, что указывает на менее кристаллические свойства НЧ31. Кристаллические структуры ZnO (рис. 1C) и Mn2O3 (рис. 1C) были сформированы с помощью программного обеспечения VESTA 3D для визуализации.
Приблизительные средние размеры кристаллитов были рассчитаны с использованием формулы Дебая-Шеррера:
D = Kλ/(β cos θ)
где λ — длина волны рентгеновского излучения (для излучения Cu Kα λ = 0,15418 нм), K — константа, β — ширина линии на максимальной полувысоте, θ — дифракционный угол32. Приблизительные размеры ZnO NP и NC составляют 59 нм и 23 нм соответственно.
Отсутствие сдвигов пиков для НК относительно ZnO указывает на образование только локальных гетеропереходов между оксидами, что соответствует теории HSAB Пирсона 16,17,33. Дифрактометрические пики ПВА также не наблюдались в дифрактометрических паттернах ZnO и NC. Это показало полное разложение ПВС при 500 °C, что было подтверждено анализом DTG.
Среди базовых моделей формы пор графики BET ZnO NP и NC имели цилиндрическую форму (рис. 2B)34. Среди шести типов изотерм адсорбции и четырех типов петель гистерезиса классификации ИЮПАК НЧ и НК были сопоставлены с изотермой адсорбции типа IV и петлей гистерезисаH3 35. Резкое увеличение при относительном давлении 0,8 P/P0 показывает совместное распределение размеров мезопористых и макропористых пор36.
Графики распределения пор по размерам Барретта-Джойнера-Халенды (BJH) показывают доминирование распределения размеров мезопористых пор (врезка Рис. 2)34. Полосы поглощения спектров ИК-Фурье спектров как для НЧ ZnO, так и для НЧ на ~3650 см−1 и ~1650 см−1 могут быть отнесены к вибрациям гидроксильных групп и молекул воды соответственно (рис. 2B). Морфологические, композиционные и структурные особенности НЧ и НЧ могут влиять на количество и положение пиков. Считается, что морфологическая модификация сферической размерности к одно-, двух- или трехмерным частицам приводит к широте и расщеплению полос37,38. Для ZnO NP пики поглощения были разделены на две части, в то время как для NC только один пик наблюдался на 450 см-1. Сдвиг волнового числа зависит от прочности и слабости связи металл-кислород39. Сдвиг пика в сторону более низкого волнового числа/частоты для NC (3560 см−1) по сравнению с ZnO (3655 см−1) подтверждает ослабление связи металл-кислород из-за введения Mn2O3 фазы40. Появление других пиков может быть обусловлено переходными примесями, образующимися при синтезе 41.
На рисунках 3A, B показаны СЭМ-изображения материалов ZnO и NC. Снимки SEM показали более высокую пористость для NC, чем ZnO. Этот результат согласуется с интерпретацией BET. Чем более пористые материалы, тем больше поверхностных дефектов/активных центров, перенос заряда и эффективность поглощения видимого света. Кроме того, анализ состава с помощью метода EDX подтвердил реальность предсказуемых элементных составов Zn, Mn и O (рисунок 3C) с наблюдением соответствующих основных пиков при 1 кэВ, 0,5 кэВ и 0,45 кэВ. Элементы C и S были обнаружены как примеси.
Спектр XPS ZnO NP и NC (дополнительный рисунок S1) подтвердил существование химических состояний Zn 2p, Mn 2p, O 1s и C 1s. Орбитальная область Mn 2p с высоким разрешением на NC подтверждает, что химические состояния Mn 2 p3/2 и Mn 2 p1/2 присутствуют при энергиях связи 641,1 эВ и 653,2 эВ соответственно42. Приблизительная энергия расщепления 12,1 эВ между Mn 2p3/2 и Mn 2p1/2 представляет собой типичное значение для Mn3+43. Наконец, энергия связи Zn 2p в NCs (1022,7 эВ) демонстрирует положительный сдвиг по сравнению с чистой ZnO (1022,0 эВ). Этот сдвиг происходит из-за переноса электронов с ферми-уровня ZnO на ферми-уровень Fe2O3 и/или Mn2O3 44,45,46.
Изображения ПЭМ (рис. 3D) показывают, что размеры синтезированных НК находились в нанометровом диапазоне (~20 - 50 нм), что согласуется с анализом XRD. На изображениях ПЭМ также визуализируется присутствие двойных кристаллитов (двух кристаллитов разного размера), разделенных границей, известной как ориентированное прикрепление47. Это крепление позволяет частицам иметь общую кристаллографическую ориентацию47,48 и способствует возникновению способности к непрерывному переносу заряда49. Дифракционные пятна, присутствующие точно на кольце SAED, указывают на кристалличность ZnO NP. Пятна за пределами кольца указывают на присутствие Mn2O3 (рис. 3E)50.
Измеренные значения межпланарного расстояния из SAED для ЧПУ соответствуют гексагональной структуре вюрцита ZnO (врезка рис. 3E). Значение d-разноса 0,34 нм от изображения HRTEM соответствует 221 плоскости α-Mn2O3 (рис. 3F)51,52. Обнаруженные дефекты укладки на изображении IFFT HRTEM выявили пористые свойства НК (изображения IFFT со вставкой на рисунке 3E). С другой стороны, решетчатая бахрома для ZnO не наблюдалась для НК. Возможно, это связано со случайным выбором кристаллита во время разрешения.
На рисунках 4A, B показана активность фотодеградации ZnO, НЧ и НК по разложению AO8. Небольшой процент адсорбции происходил в темноте во время уравновешивания адсорбции/десорбции. Как ZnO, так и NC показали хорошую фотокаталитическую активность на красителе AO8.
Зависящие от времени данные (Ct/Co vs. t и log (Ct/Co) vs. t) приведены на рисунке 4C и врезке соответственно. Полученные значения константы скорости k для ZnO и ZnO-Mn2O3 NCs составили 0,0058 мин-1 и 0,0087 мин-1 соответственно. Хорошая фотокаталитическая активность ZnO NP связана с некоторыми дефектами (вакансиями), препятствующими рекомбинации e−/h+ . Окислительно-восстановительные потенциалы оксидов цинка и марганца до и после гетероперехода показаны на рисунке 4D (слева).
В исследовании было отмечено, что запрещенные зоны Mn2O3 (уровень Ферми вблизи VB) и ZnO (уровень Ферми вблизи CB) движутся вверх и вниз соответственно, достигая стабильности своего уровня Ферми и, наконец, достигая равновесия, как показано на рисунке 4C (справа). Фотокаталитическая активность бинарных НК на красителе AO8, вероятно, обусловлена формированием подходящего выравнивания полос разрывного зазора (типа III). Кроме того, гетеропереход с разорванной щелью переносит электроны от более отрицательного CB-потенциала ZnO к более отрицательному VB-потенциалу Mn2O353,54. Следовательно, разделение e- и h+ было увеличено для повышения эффективности деградации55.
Несмотря на то, что положение края зоны зависит от поверхностного заряда, оксиды полупроводниковых металлов обладают типичной энергией запрещенной зоны, которая поглощает светопределенной частоты 56. Для полупроводников решающее значение для деградации загрязняющих веществ имеет более высокий отрицательный потенциал CB, чем H+/H2, и более положительный потенциал VB, чем у O2/H2O57. Наличие хорошего свойства переноса заряда свидетельствует об образовании гетеропереходов/локального контакта между оксидами металлов, что оказывает заметное влияние на уменьшение рекомбинации e−/h+. Результаты исследования и обзоры позволяют предположить возможный предполагаемый механизм деградации НК после гетероперехода 33,46, как показано на рисунке 4D.
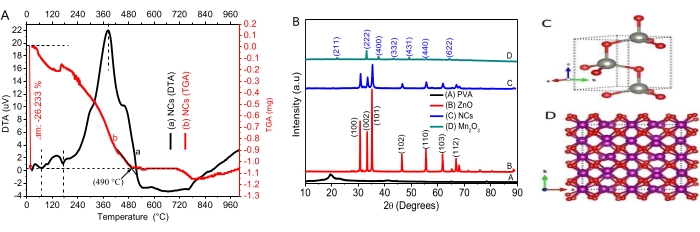
Рисунок 1. Анализ стабильности материалов. (A) Графики ТГА/ДТА PVA-ZnO/Mn2O3 до прокаливания. (B) рентгеноструктурные диаграммы PVA, ZnO, PVA-ZnO/Mn2O3 и Mn2O3; кристаллические структуры (C) ZnO и (D) Mn2O3 по принципу «шарик и палочка», созданные с помощью программного обеспечения VESTA 3D Imaging (красный цвет обозначает атом O), прокаленные при 500 °C. Эта цифра была изменена с28. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
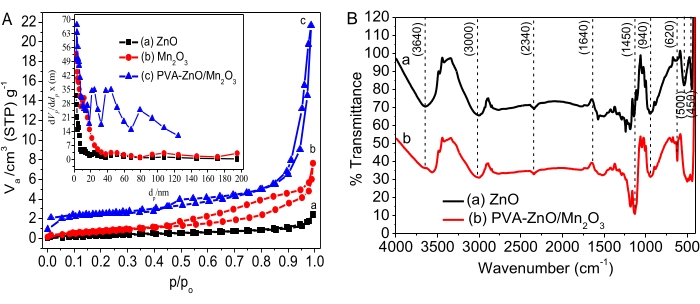
Рисунок 2. Анализ текстурных свойств и химических связей. (A) Графики BET ZnO, Mn2O3 и PVA-ZnO/Mn2O3 прокалены при 500 °C. На рисунке на врезке показаны графики BJH. (B) ИК-Фурье спектры ZnO NPs и образцов PVA-ZnO/Mn2O3 , прокаленных при 500 °C. Эта цифра была изменена с28. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
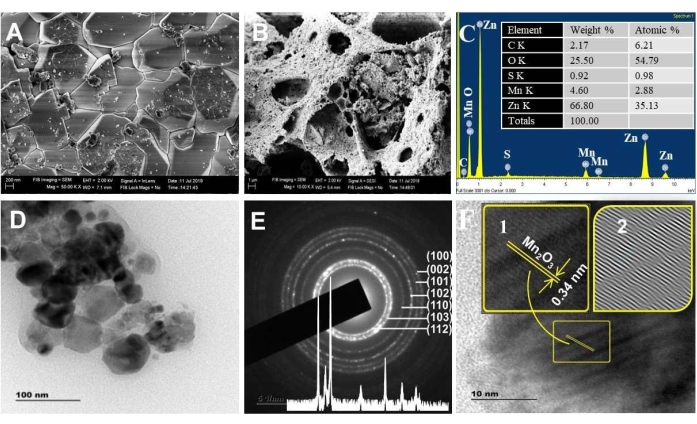
Рисунок 3. Морфологический анализ. СЭМ-изображение спектров (A) ZnO и (B) ZnO/Mn,2, O,3, (C) EDXS, прокаленных при 500 °C. Врезка в C — это % массы элемента и результат % атома. (D) изображения TEM, (E) SAED и (F) HRTEM, прокаленные при 500 °C. Вставка в E — это шаблон XRD; вставка в F — увеличенная решетчатая кайма (1) и узор IFFT (2). Эта цифра была изменена с28. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
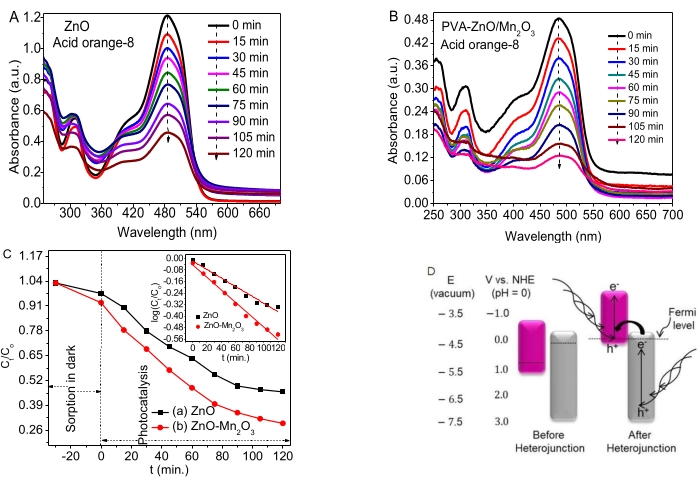
Рисунок 4. Фотокаталитическая активность ZnO NPs и ZnO-Mn2O3 NC (A, B) Зависимость поглощения от длины волны ZnO и ZnO/Mn2O3 соответственно. (C) График данных кинетики Ct/Co в зависимости от t и log (Ct/Co) в зависимости от t . (D) Тип разорванного зазора возможного предлагаемого механизма (левый, до гетероперехода, и правый, после гетероперехода). Эта цифра была изменена с28. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный рисунок S1. Принципиальная схема иллюстрирует синтез горения с помощью агента, который позволяет получить активный пористый наноразмерный материал с благородным переносом массы/ионов. (А) раствор прекурсора; (В) образовавшийся гель при обезвоживании при 110 °С; (В) взрыв газообразного побочного продукта при дальнейшем нагревании с целью воспламенения температуры; (D) стабильный пористый побочный продукт, получаемый при кальцинации при 500°С. Этот показатель был изменен с28. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Настоящий протокол описывает синтез нанокристаллов с использованием восходящей стратегии с точной формой, размером и структурой. В исследовании было отмечено, что зарождение и рост нанокристаллов были значительными до формирования нанокристаллов. Здесь оксиды ZnO и марганца были синтезированы на основе теории групп25 Ламера, которая постулирует процесс образования нанокристаллов после восстановления предшественников на атомы и ядра, что приводит к образованию затравок для получения нанокристаллов. В этом отношении общая форма и размер нанокристаллов зависят от роста семян, свойств семян и реактивации поверхностно-активных веществ/укупоривающего агента. Поливиниловый спирт может выступать в качестве восстановителя и укупорки/стабилизирующего агента58,59. Между тем, в отличие от традиционного подхода SG-SCS, при котором в качестве окислителя используется топливо, в качестве комплексообразователя и укупорочного агента использовался только полимер ПВС без использования какого-либо топлива. В этом случае в качестве растворителя использовалась вода, что не является распространенным, так как в других исследованиях использовались токсичные, вызывающие рак и мутагенные растворители.
Данное исследование модифицировало реакционную способность цинка и марганца на основе теории твердых и мягких кислот и оснований (HSAB)16,24. Менее реакционноспособная и растворимая легирующая примесь сульфата марганца была использована для образования локальной гетеропереходы с более реакционноспособным предшественником нитрата цинка. Он положил начало зарождению цинка, и атомы марганца были диффундированы и прикреплены к подходящим поверхностным участкам (ступеням и изломам)26.
Восстановители, нейтральные/на основе хлоридов или окислители солей, основанные на окислителях/нитратах, могут использоваться в качестве SG-SCS. Как известно, восстановители и прекурсоры на основе нейтрали/хлора нуждаются в дополнительных окислителях и выделяют HCl, что приводит к загрязнению конечных продуктов. В целом, предшественник нитратов является лучшим окислителем с такими важными свойствами, как достаточный окислительный потенциал и стабильная температура разложения, которые способствуют образованию чистого продукта60, и благородная растворимость61. Сульфатный прекурсор, используемый для контроля реакционной способности в этой работе, приводит к образованию примесей, требующих высокой температуры разложения (см. анализ EDX, рисунок 3C). Поскольку нитратная соль обладает подходящим окислительным и комплексообразующим потенциалом61, предполагается, что предшественник нитратов и другие условия используются для балансировки реакционной способности хозяин-легирующая примесь вместо поверхностной соли.
SG-SCS в данном исследовании проводила последовательность стадий, включая образование коллоидных/зольных веществ, дегидратацию (гелеобразование) и самоподдерживающуюся реакцию горения 1,62. Это привело к выделению газов, которые улучшают пористость/текстурные свойства продукта63 и, наконец, к гашению реакции за счет выделения газов (см. дополнительный рисунок 1). В процессе SG-SCS процессы горения могут образовывать губчатую/пенообразную структуру при горении во многих точках или длинную проволочную структуру за счет горения в точке/точке. Кроме того, кальцинация сгораемых материалов способствует разложению несгоревших примесей и улучшает кристалличность материалов27.
В этом исследовании был представлен подход синтеза с помощью сжигания раствора (SCS) как новая методология с эффективным использованием времени и энергии для производства высокостабильных и пористых наноматериалов, которые могут быть эффективно применены в промышленно масштабируемых условиях. В процедурах SG-SCS успешно синтезированы пористые бинарные НК на основе ZnO. В исследовании было отмечено, что золь-гель метод улучшает SAS для синтезированных НК. Пористость НЦ была проверена с помощью СЭМ-изображения, кольца SAED и анализа BET, в то время как оптимизированная температура деградации ПВС для НЦ была определена как 500 °C с помощью анализа DTG. Анализ изображений XRD и TEM подтвердил, что размеры кристаллитов NP и NC находятся на наноуровне. Для исследования состава и актуальности были применены анализы EDX, XPS и HRTEM. В конечном счете, бинарные НК показали хорошую деградацию красителя AO8, доказав свою эффективность. В целом, любой материал может быть разумно синтезирован путем устранения упомянутых недостатков, а SCS может обеспечить менее дорогостоящий, простой и экономичный по времени/энергии метод питания энергетических устройств в будущем.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы хотели бы выразить признательность Научно-техническому университету Адама за поддержку в этой работе. Финансирование было предоставлено Университетом Таифа под номером проекта поддержки исследователей (TURSP-2020/44), Университет Таиф, Таиф, Саудовская Аравия.
Материалы
| Name | Company | Catalog Number | Comments |
| Acid orange 8 | Sigma-Aldrich | 65%, | |
| Chlorine | Sigma-Aldrich | 7782-50-5 | |
| Dithienogermole | Sigma-Aldrich | 773881-43-9 | |
| HCl | Sigma-Aldrich | 7647-01-0 | |
| Manganese nitrate (10%) salt | Sigma-Aldrich | 15710-66-4 | 10% |
| Manganese sulfate monohydrate | Sigma-Aldrich | Density: 2.95 g/cm³; solubility in water: 70 g/100 mL (70 °C); 99.95%, MnSO4.H2O | |
| Poly (vinyl alcohol) | Sigma-Aldrich | 9002-89-5 | Density: 1.19–1.31 g/cm³ @20 °C, soluble in water only @ > 80 °C |
| Zinc nitrate hexahydrate (90%) | Sigma-Aldrich | 10196-18-6 | 98%; Density: 2.065 g/cm³ @20 °C; solubility in water: 184.3 g/100 mL @20 °C |
| Instruments used | |||
| Materials name | Model | Analysis | |
| BET (N2 adsorption-desorption isotherms) | Quanta chrome instrument. | Textural properties | |
| DT/DTA | Shimadzu DTG-60H | Measure thermal stability | |
| FTIR | Perkin Elmer FT-IR, Spectrum 65 | Chemical bonding information | |
| HRTEM | JEOL TEM 2100 HRTEM | Morphological, size, and composition analysis | |
| SEM-EDX | SEM-EDX-EVO 18 with low vacuum facility and ALTO 1000 cryo attachment | Morphological analysis | |
| XPS | AXIS ULTRA from AXIS 165 | ||
| XRD | Shimadzu, XRD-7000 | Crystallinity, structure, and approximate average crystallite size | |
| Common software used | |||
| Name | Company | Use | |
| Mendeley | Mendeley-Desktop-1.19.8-win32 | For citing references | |
| Origin | OriginPro 8 | XRD, BET, UV-vis-DRS data analysis |
Ссылки
- Khort, A., et al. Corrosion and transformation of solution combustion synthesized Co, Ni and CoNi nanoparticles in synthetic freshwater with and without natural organic matter. Scientific Reports. 11 (1), 7860 (2021).
- Pype, M., Lawrence, M. G., Keller, J., Gernjak, W. Reverse osmosis integrity monitoring in water reuse: The challenge to verify virus removal - A review. Water Research. 98, 384-395 (2016).
- Adeleye, A. S., et al. Engineered nanomaterials for water treatment and remediation: Costs, benefits, and applicability. Chemical Engineering Journal. 286, 640-662 (2016).
- Gómez-Pastora, J., et al. Review and perspectives on the use of magnetic nanophotocatalysts (MNPCs) in water treatment. Chemical Engineering Journal. 310 (2), 407-427 (2017).
- Nadeem, M. S., et al. Enhancement in the photocatalytic and antimicrobial properties of ZnO nanoparticles by structural variations and energy bandgap tuning through Fe and Co co-doping. Ceramics International. 47 (8), 11109-11121 (2021).
- Nadeem, M. S., et al. Energy-levels well-matched direct Z-scheme ZnNiNdO/CdS heterojunction for elimination of diverse pollutants from wastewater and microbial disinfection. Environmental Science and Pollution Research International. , (2022).
- Munawar, T., Iqbal, F., Yasmeen, S., Mahmood, K., Hussain, A. Multi metal oxide NiO-CdO-ZnO nanocomposite-Synthesis, structural, optical, electrical properties and enhanced sunlight driven photocatalytic activity. Ceramics International. 46 (2), 2421-2437 (2020).
- Srinivasa, N., et al. Facile synthesis of Ni/NiO nanocomposites: The effect of Ni content in NiO upon the oxygen evolution reaction within alkaline media. RSC Advances. 11 (24), 14654-14664 (2021).
- Chen, P., et al. Solution combustion synthesis of ternary Ni/WC/C composites with efficient electrocatalytic oxygen reduction performance. RSC Advances. 11 (61), 38718-38726 (2021).
- Nagvenkar, A. P., Perelshtein, I., Piunno, Y., Mantecca, P., Gedanken, A. Sonochemical one-step synthesis of polymer-capped metal oxide nanocolloids: Antibacterial activity and cytotoxicity. ACS Omega. 4 (9), 13631-13639 (2019).
- Janotti, A., Van de Walle, C. G. Fundamentals of zinc oxide as a semiconductor. Reports on Progress in Physics. 72 (12), 126501 (2009).
- Abebe, B., Murthy, H. C. A., Amare, E. Enhancing the photocatalytic efficiency of ZnO: Defects, heterojunction, and optimization. Environmental Nanotechnology, Monitoring. & Management. 14, 100336 (2020).
- Abebe, B., Murthy, H. C. A., Zereffa, E. A. Multifunctional application of PVA-aided Zn-Fe-Mn coupled oxide nanocomposite. Nanoscale Research Letters. 16, 1 (2021).
- Shekofteh-Gohari, M., Habibi-Yangjeh, A. Fe3O4/ZnO/CoWO4 nanocomposites: Novel magnetically separable visible-light-driven photocatalysts with enhanced activity in degradation of different dye pollutants. Ceramics International. 43 (3), 3063-3071 (2017).
- Saravanan, R., Gupta, V. K. K., Narayanan, V., Stephen, A. Visible light degradation of textile effluent using novel catalyst ZnO/γ-Mn2O3. Journal of the Taiwan Institute of Chemical Engineers. 45 (4), 1910-1917 (2014).
- Buonsanti, R., Milliron, D. J. Chemistry of doped colloidal nanocrystals. Chemistry of Materials. 25 (8), 1305-1317 (2013).
- Hu, H., He, H., Zhang, J., Hou, X., Wu, P. Optical sensing at the nanobiointerface of metal ion-optically-active nanocrystals. Nanoscale. 10 (11), 5035-5046 (2018).
- Deganello, F., Tyagi, A. K. Solution combustion synthesis, energy and environment: Best parameters for better materials. Progress in Crystal Growth and Characterization of Materials. 64 (2), 23-61 (2018).
- Buonsanti, R., et al. Assembly of ligand-stripped nanocrystals into precisely controlled mesoporous architectures. Nano Letters. 12 (7), 3872-3877 (2012).
- Li, F., Ran, J., Jaroniec, M., Qiao, S. Z. Solution combustion synthesis of metal oxide nanomaterials for energy storage and conversion. Nanoscale. 7 (42), 17590-17610 (2015).
- Williams, T. E., et al. Nearest-neighbour nanocrystal bonding dictates framework stability or collapse in colloidal nanocrystal frameworks. Chemical Communications. 53 (35), 4853-4856 (2017).
- Helms, B. A., Williams, T. E., Buonsanti, R., Milliron, D. J. Colloidal nanocrystal frameworks. Advanced Materials. 27 (38), 5820-5829 (2015).
- Liu, B., et al. Synthesis of ZnO nano-powders via a novel PVA-assisted freeze-drying process. RSC Advances. 6 (111), 110349-110355 (2016).
- Abebe, B., Murthy, H. C. A. Insights into ZnO-based doped porous nanocrystal frameworks. RSC Advances. 12 (10), 5816-5833 (2022).
- LaMer, V. K., Dinegar, R. H. Theory, production and mechanism of formation of monodispersed hydrosols. Journal of the American Chemical Society. 72 (11), 4847-4854 (1950).
- Jun, Y. -. S., et al. Classical and nonclassical nucleation and growth mechanisms for nanoparticle formation. Annual Review of Physical Chemistry. 73, 453-477 (2022).
- Gao, Y., Meng, F., Li, X., Wen, J. Z., Li, Z. Factors controlling nanosized Ni-Al 2 O 3 catalysts synthesized by solution combustion for slurry-phase CO methanation: the ratio of reducing valences to oxidizing valences in redox systems. Catalysis Science & Technology. 6 (21), 7800-7811 (2016).
- Abebe, B., Zereffa, E. A., Murthy, H. C. A. Synthesis of poly(vinyl alcohol)-aided ZnO/Mn 2 O 3 nanocomposites for acid orange-8 dye degradation: Mechanism and antibacterial activity. ACS Omega. 6 (1), 954-964 (2021).
- Kumar, S., Krishnakumar, B., Sobral, A. J. F. N., Koh, J. Bio-based ( chitosan / PVA / ZnO ) nanocomposites fi lm Thermally stable and photoluminescence material for removal of organic dye. Carbohydrate Polymers. 205, 559-564 (2019).
- Dai, Y., et al. Enhanced mechanical, thermal, and UV-shielding properties of poly(vinyl alcohol)/metal-organic framework nanocomposites. RSC Advances. 8 (67), 38681-38688 (2018).
- Munawar, T., et al. Novel tri-phase heterostructured ZnO-Yb2O3-Pr2O3 nanocomposite; structural, optical, photocatalytic and antibacterial studies. Ceramics International. 46 (8), 11101-11114 (2020).
- Mukhtar, F., et al. Enhancement in carrier separation of ZnO-Ho2O3-Sm2O3 hetrostuctured nanocomposite with rGO and PANI supported direct dual Z-scheme for antimicrobial inactivation and sunlight driven photocatalysis. Advanced Powder Technology. 32 (10), 3770-3787 (2021).
- Lachheb, H., et al. Electron transfer in ZnO-Fe 2 O 3 aqueous slurry systems and its effects on visible light photocatalytic activity. Catalysis Science & Technology. 7 (18), 4041-4047 (2017).
- Thommes, M., et al. Physisorption of gases, with special reference to the evaluation of surface area and pore size distribution (IUPAC Technical Report). Pure and Applied Chemistry. 87 (9-10), 1051-1069 (2015).
- Kumar, P., Kim, K. -. H., Kwon, E. E., Szulejko, J. E. Metal-organic frameworks for the control and management of air quality: advances and future direction. Journal of Materials Chemistry A. 4 (2), 345-361 (2016).
- Liu, J., et al. NiO-PTA supported on ZIF-8 as a highly effective catalyst for hydrocracking of Jatropha oil. Scientific Reports. 6, 23667 (2016).
- Fatehah, M. O., Aziz, H. A., Stoll, S. Stability of ZnO nanoparticles in solution. Influence of pH, dissolution, aggregation and disaggregation effects. Journal of Colloid Science and Biotechnology. 3 (1), 75-84 (2014).
- Sigoli, F. A., Davolos, M. R., Jafelicci, M. Morphological evolution of zinc oxide originating from zinc hydroxide carbonate. Journal of Alloys and Compounds. 262-263, 292-295 (1997).
- Wachs, I. E. Raman and IR studies of surface metal oxide species on oxide supports: Supported metal oxide catalysts. Catalysis Today. 27 (3-4), 437-455 (1996).
- Parler, C. M., Ritter, J. A., Amiridis, M. D. Infrared spectroscopic study of sol-gel derived mixed-metal oxides. Journal of Non-Crystalline Solids. 279 (2-3), 119-125 (2001).
- Anžlovar, A., Kogej, K., Crnjak Orel, Z., Žigon, M. Polyol mediated nano size zinc oxide and nanocomposites with poly(methyl methacrylate). Express Polymer Letters. 5 (7), 604-619 (2011).
- Saravanan, R., et al. ZnO/Ag/Mn 2 O 3 nanocomposite for visible light-induced industrial textile effluent degradation, uric acid and ascorbic acid sensing and antimicrobial activity. RSC Advances. 5 (44), 34645-34651 (2015).
- Yang, G., Yan, W., Wang, J., Yang, H. Fabrication and formation mechanism of Mn 2 O 3 hollow nanofibers by single-spinneret electrospinning. CrystEngComm. 16 (30), 6907-6913 (2014).
- Liu, Y., et al. A magnetically separable photocatalyst based on nest-like γ-Fe 2 O 3 /ZnO double-shelled hollow structures with enhanced photocatalytic activity. Nanoscale. 4 (1), 183-187 (2012).
- Hu, Y., et al. A microwave-assisted rapid route to synthesize ZnO/ZnS core-shell nanostructures via controllable surface sulfidation of ZnO nanorods. CrystEngComm. 13 (10), 3438-3443 (2011).
- Zhang, J., et al. Synthesis and gas sensing properties of α-Fe 2 O 3 @ ZnO core-shell nanospindles. Nanotechnology. 22 (18), 185501 (2011).
- Penn, R. L. Imperfect oriented attachment: Dislocation generation in defect-free nanocrystals. Science. 281 (5379), 969-971 (1998).
- Zhang, J., Huang, F., Lin, Z. Progress of nanocrystalline growth kinetics based on oriented attachment. Nanoscale. 2 (1), 18-34 (2009).
- Zeng, Z., et al. A fluorescence-electrochemical study of carbon nanodots (CNDs) in bio- and photoelectronic applications and energy gap investigation. Physical Chemistry Chemical Physics. 19 (30), 20101-20109 (2017).
- Zhai, T., et al. Controllable synthesis of hierarchical ZnO nanodisks for highly photocatalytic activity. CrystEngComm. 14 (5), 1850-1855 (2012).
- Li, N., et al. Efficient removal of chromium from water by Mn3O4 @ZnO/Mn3O4 composite under simulated sunlight irradiation: Synergy of photocatalytic reduction and adsorption. Applied Catalysis B: Environmental. 214, 126-136 (2017).
- Abebe, B. Polymer assisted colloidal nanocrystal framework synthesis: Sol-gel approach. Materials Research Express. 8 (12), 125005 (2021).
- Jiamprasertboon, A., et al. Heterojunction α-Fe2O3/ZnO films with enhanced photocatalytic properties grown by aerosol-assisted chemical vapour deposition. Chemistry - A European Journal. 25 (48), 11337-11345 (2019).
- Mukhtar, F., et al. Dual S-scheme heterojunction ZnO-V2O5-WO3 nanocomposite with enhanced photocatalytic and antimicrobial activity. Materials Chemistry and Physics. 263, 124372 (2021).
- Marschall, R. Semiconductor composites: Strategies for enhancing charge carrier separation to improve photocatalytic activity. Advanced Functional Materials. 24 (17), 2421-2440 (2013).
- Beranek, R. (Photo)electrochemical methods for the determination of the band edge positions of TiO 2-based nanomaterials. Advances in Physical Chemistry. 2011, 786759 (2011).
- Hoffmann, M. R., Martin, S. T., Choi, W., Bahnemann, D. W. Environmental applications of semiconductor photocatalysis. Chemical Reviews. 95 (1), 69-96 (1995).
- Wu, Y., Wang, D., Li, Y. Understanding of the major reactions in solution synthesis of functional nanomaterials. Science China Materials. 59, 938-996 (2016).
- Xia, Y., Xiong, Y., Lim, B., Skrabalak, S. E. Shape-controlled synthesis of metal nanocrystals: Simple chemistry meets complex physics. Angewandte Chemie. 48 (1), 60-103 (2008).
- Kim, S. J., Yoon, S., Kim, H. J. Review of solution-processed oxide thin-film transistors. Japanese Journal of Applied Physics. 53, (2014).
- Zhang, J., Guo, Q., Liu, Y., Cheng, Y. Preparation and characterization of Fe2O3/Al2O3 using the solution combustion approach for chemical looping combustion. Industrial & Engineering Chemistry Research. 51 (39), 12773-12781 (2012).
- Novitskaya, E., Kelly, J. P., Bhaduri, S., Graeve, O. A. A review of solution combustion synthesis: an analysis of parameters controlling powder characteristics. International Materials Reviews. 66 (3), 188-214 (2021).
- González-Cortés, S. L., Imbert, F. E. Fundamentals, properties and applications of solid catalysts prepared by solution combustion synthesis (SCS). Applied Catalysis A: General. 452, 117-131 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены