Method Article
أكسيد المعادن غير المتجانسة للأنشطة التحفيزية الضوئية
In This Article
Summary
يعزز تطوير الوصلة غير المتجانسة أنشطة التحفيز الضوئي لتخليق احتراق المحلول ، وهي عملية موفرة للوقت / الطاقة. تم استخدام تقنيات التوصيف التحليلي المتقدمة في هذا البروتوكول لتقييم خصائص المواد ، وأظهرت المركبات النانوية تحلل صبغة البرتقال الحمضي -8.
Abstract
هناك طلب عالمي كبير على التحسينات في تقنيات التوليف وخصائصها المثلى ، خاصة بالنسبة للتطبيقات على نطاق صناعي. يعد تخليق احتراق المحلول القائم على Sol-gel (SG-SCS) طريقة بسيطة لإنتاج مواد مسامية مرتبة. في هذا الصدد ، تساعد نظرية الأحماض والقواعد الصلبة والناعمة لبيرسون في اختيار تفاعل المضيف المنشط لتشكيل تقاطع غير متجانس مناسب.
يؤدي تكوين الوصلة غير المتجانسة أيضا إلى تغيير الخصائص الأساسية للمواد ، مما يحسن التحفز الضوئي عن طريق نقل الشحنة أو الأنشطة التآزرية. تعتبر درجة حرارة التكليس البالغة 500 درجة مئوية مثالية لهذه العملية بناء على نتائج تقييم الثبات عبر تحليل نسبة القياس الحراري التفاضلي (DTG).
تم التحقق من صحة الأبعاد النانوية للجسيمات النانوية (NPs) والمركبات النانوية (NCs) المتولدة باستخدام حيود الأشعة السينية والمجهر الإلكتروني عالي الدقة (HRTEM). علاوة على ذلك ، أكدت الصور المجهرية المجهرية الإلكترونية الماسحة وتحليلات BET طبيعة مسامية المواد. أنشأت HRTEM ، والتحليل الطيفي للإلكترون الضوئي بالأشعة السينية ، وتحقيقات الأشعة السينية المشتتة للطاقة تكوين المواد. وجدت الدراسة أن NCs تحلل اللون البرتقالي الحمضي 8 (AO8) بشكل أكثر كفاءة من ZnO العاري.
Introduction
أصبحت حماية البيئة مصدر قلق كبير مع الارتفاع السريع في الشركات في جميع أنحاء العالم. وبالتالي ، جذبت المواد النانوية القائمة على تقنية النانو (NMs) وتخليقها انتباه الباحثين على المواد السائبة في العالم العلميالحديث 1. تم تكييف العديد من الأساليب الفيزيائية والكيميائية لمعالجة الملوثات العضوية وغير العضوية2،3. في هذا الصدد ، نظرا لبساطته وقدرته على إذابة السموم دون إحداث تلوث ثانوي ، يعتبر التحفيز الضوئي غير المتجانس تقنية معالجة تكيفية4. صممت الدراسات مقطعا غير متجانس أو منشطات بين أشباه الموصلات المناسبة لفجوة النطاق ، مما يساعد على تقليل إعادة تركيب ثقب الإلكترون ، ومساحة السطح ، والحجم. زادت هذه الحالة لاحقا من التدهور المحفز الضوئي للأصباغ5،6،7. أبلغت الأعمال الحديثة أيضا عن دور تحسين التآزر ونقل الشاحن من خلال الوصلات غير المتجانسة / الهجينة 8,9 ، وتظهر أكاسيد معدن أشباه الموصلات خصائص فيزيائية وكيميائية فريدة للتطبيقات متعددة الوظائف10. نتيجة لذلك ، حظيت TiO2 و Nis أكسيد الزنك (ZnO NPs) باهتمام كبير11،12 بين الباحثين.
بالمقارنة مع المواد المفردة ، أصبح تكوين الوصلة غير المتجانسة أحد التفضيلات الفريدة لزيادة مساحة السطح ونسبة حجم المواد وتحسين أداء التحفيز الضوئي والمضاد للبكتيريا للمادة. علاوة على ذلك ، فإن التأثير التآزري للوصلات غير المتجانسة الثنائية يحسن فصل أزواج الإلكترون / الثقب المولدة ضوئيا مقارنة بالوصلات غير المتجانسةالثنائية 13،14. أظهرت الدراسات أن التقاطع غير المتجانس بين Mn2O3 و ZnO NPs15 يحسن الاستقرار وقدرة امتصاص الركيزة ويقلل من مقاومة نقل الشحنة في NPs المركبة. علاوة على ذلك ، استخدمت العديد من الدراسات تفاعل المضيف المنشط بناء على نظرية الأحماض والقواعد الصلبة والناعمة (HSAB) لبيرسون لاختبار تكوين الوصلة غير المتجانسة أو المنشطة. وجد أن أحماض لويس الصلبة (مثل المنزوني (III)) لا يمكن أن تنتشر في الخط الحدودي لشبكة مضيف Zn (II) في وجود مذيب قاعدة صلبة مثل الماء16،17. يتم امتصاصها على سطح المضيف وتأكسد لتشكيل هجين عند التكلس.
نظرا لإمكانياتها ، فإن التركيز العالمي الحالي للتطبيقات القابلة للتطوير صناعيا لتخليق المواد ينصب على تحسين النهج وآفاقه النقدية13. تخليق احتراق المحلول (SCS) هو طريقة بسيطة وموفرة للوقت / الطاقة لإنشاء مواد مسامية مرتبة بانتظام18 ، والتي تلعب دورا مهما في ظاهرة النقل الأيوني / الكتلي19. يشتمل SCS على توزيع مضيف مخدر لائق أو تقاطع غير متجانس بناء على نظرية بيرسون للأحماض والقواعد الصلبة والناعمة (HSAB). يمكن للمنشطات / الوصلة غير المتجانسة ضبط الخصائص البصرية والمغناطيسية والكهربائية للمواد ، وبالتالي تعزيز تطبيق المواد من خلال نقل الشحنة الفعال و / أو الأدوارالتآزرية 20. يمكن ل SCS بمساعدة عامل توجيه الهندسة المعمارية (ADA) أيضا إنتاج أطر بلورات نانوية غروية مرتبة (CNFs) تستخدم لنقل الكتلة / الأيونات في أجهزة تحويل الطاقة21،22.
أنتجت هذه الدراسة مادة خافضة للتوتر السطحي وعامل معقد من كحول الفينيل (PVA) لتصنيع ZnO NPs ومركبات النانو الثنائية القائمة على ZnO (NCs) من خلال نهج SG-SCS الصديق للبيئة. تم تقدير التقاطع غير المتجانس بين الأكاسيد ، الذي يلعب دورا حيويا في نقل الشحنة بناء على نظرية HSAB. تم استخدام تقنيات التوصيف لفهم الخصائص الهيكلية والبصرية والصرفولوجية للمواد. تم اختبار كفاءة تحلل المادة على أصباغ AO8 المستقرة والسامة.
Protocol
1. تخليق المواد النانوية
- ZnO-Mn2O3 تخليق النانو المركب
- قم بتصنيع المركبات النانوية باستخدام كحول بولي فينيل كخافض للتوتر السطحي ونهج SG-SCS بمساعدة عامل التعقيد. للحصول على توضيح بياني لنهج SG-SCS، انظر الشكل التكميلي S1.
- قم بإذابة 1.5 جم من بوليمر PVA في 100 مل من الماء المقطر مع التحريك المستمر على محرك مغناطيسي لمدة 15 دقيقة عند 115 درجة مئوية23.
- صب محاليل سلائف الملح ، سداسي هيدرات نترات الزنك بتركيز 90٪ حجم / حجم ، وكبريتات المنغنيز بتركيز 10٪ v / v في محلول PVA المذاب أعلاه مع التحريك المستمر لمدة 10 دقائق تقريبا وخفض درجة الحرارة إلى 70 درجة مئوية.
ملاحظة: تم خلط سلائف الملح في وقت واحد لموازنة تفاعل السلائف النانوية لاتباع نهج المنشطات16،24. تم تخفيض درجة الحرارة إلى 70 درجة مئوية للتحكم في النمو المتسارع للجسيمات النانوية وتجميعها ، وفقا لنموذج La Mar25،26. - عمر سول هيدروكسيد المعدن المطور (الجسيمات الغروية) عن طريق إبقائه في منطقة مغلقة ومظلمة لمدة يومين. ثم قم بتجفيف المحلول عن طريق التسخين عند 110 درجة مئوية (في الهواء) لتشكيل مادة هلامية.
ملاحظة: يعمل بوليمر PVA كبنية ، يوجه القوالب وعوامل المعقدة ، مما يساعد في التشتت المتجانس للكاتيونات المعدنية ، وبدء عملية الاحتراق ومنع خصائص التجميع / التكتل. - قم بتعريض الجل للاحتراق في الهواء عن طريق تسخين الفرن إلى درجة حرارة اشتعال ~ 150-250 درجة مئوية (يتم فحص درجة الحرارة التقريبية باستخدام مقياس حرارة بسيط). درجة حرارة الاشتعال هي درجة الحرارة الدنيا المطلوبة لبدء الاحتراق. أثناء الاحتراق ، استخدم الشفاطات لجمع جميع المنتجات الثانوية للغازات السامة التي تؤثر على صحة الإنسان.
ملاحظة: تم تنشيط عملية الاحتراق عن طريق تكوين مجمعات بين بوليمر PVA وسلائف النترات ، والتي تعمل كوقود لتسهيل عملية الاحتراق. - تكلس المواد المحترقة لمدة 3 ساعات عند 500 درجة مئوية في فرن دثر ، محسن باستخدام تقنية تحليل القياس الحراري التفاضلي (DTG). DTG يتحلل الشوائب غير المحترقة ويحسن بلورة المواد27.
- توليف ZnO و Mn2O3 NPs
- قم بتصنيع أكاسيد المعادن العارية باستخدام نهج سول جل. قم بتجميع ZnO و Mn2O3 بدون PVA باستخدام جميع الخطوات المذكورة سابقا ، الخطوات 1.1.1.-1.1.6 ، باستثناء الخطوة 1.1.2. نظرا لعدم وجود مجمعات النترات المعدنية وبوليمر PVA ، لا تحدث أي عملية انتشار ذاتي أثناء خطوة التجفيف النهائية.
2. توصيف NP
- تحديد نسبة قياس الجاذبية الحرارية ، وتحديدا القياس الحراري الحراري / الحراري التفاضلي (تحليل DT / DTA) ، في جو النيتروجين بمعدل تدفق 20.0 مل / دقيقة ووقت منحدر 50 درجة مئوية / دقيقة لدراسة الاستقرار الحراري وسلوك التحلل ل NPs و NCs.
- قم بإجراء التحليل الطيفي لتحويل فورييه بالأشعة تحت الحمراء (FTIR) باستخدام كريات KBr في حدود 400-4000 سم −1 لدراسة سلوك المجموعة الوظيفية السطحية ل NPs و NCs.
- إجراء حيود الأشعة السينية (XRD) لدراسة التركيب البلوري ل PVA و NPs و NCs.
- استخدم Brunauer-Emmett-Teller (BET; N2 متساوي الحرارة بالامتصاص والامتصاص) لحساب مساحة السطح المحددة للعينات في نطاق الضغط النسبي (P / Po) من 0.05-0.35. تحديد توزيعات حجم المسام للعينات باستخدام طريقة Barrett-Joyner-Halenda (BJH). أخيرا ، قم بقياس امتصاص N2 لجميع NPs و NCs عند -196.15 درجة مئوية.
- استخدم المجهر الإلكتروني الماسح مع التحليل الطيفي للأشعة السينية المشتتة للطاقة (SEM-EDX) والفحص المجهري الإلكتروني عالي الدقة (HRTEM) لدراسة الأشكال وإجراء الدراسات التركيبية ل NPs و NCs.
- قم بإجراء تحليل طيفي الإلكترون الضوئي بالأشعة السينية (XPS) على نظام متكامل مع عدسة الغمر المغناطيسي الحاصلة على براءة اختراع من Kratos ، ونظام تحييد الشحنة ، ومحلل المرآة الكروية. معايرة ذروة الطاقات بناء على طاقة الكربون الخارجي.
ملاحظة: اعتمد الباحث جميع الإجراءات والبروتوكولات القياسية أثناء عملية التوصيف.
3. دراسات تحلل الدفعات
- قم بإجراء تجربة التحفيز الضوئي عن طريق إذابة 20 جزء في المليون من صبغة AO8 في 250 مل من المحلول المائي (مذيب الماء) مع 0.06 جم من المحفزات الضوئية ZnO NPs و NCs.
- استخدم تجربة التحلل كموصل في مفاعل زجاجي دائري مقاس 176.6 سم2 . في هذه التجربة، استخدم مصباح بخار زئبق متوسط الضغط (مصباح زئبق) كمصدر للضوء (λmax = 365 نانومتر، 125 واط)28. قبل الإضاءة ، حرك تعليق التفاعل باستمرار في الظلام لمدة 30 دقيقة لإنشاء توازن الامتزاز / الامتصاص ل AO8 / CR على NPs / NCs.
- قم بإشعاع العينات مباشرة عن طريق تركيز الضوء على خليط التفاعل من مسافة 20 سم. استخدم أداة تقليب مغناطيسية عند 110 دورة في الدقيقة لخلط المحلول باستمرار. التحكم في درجة حرارة المفاعل الكلي أثناء التجربة باستخدام دوران المياه.
- ارسم 5 مل من محلول الصبغة كل 15 دقيقة لقياس تركيزاتها في الوقت t بواسطة مقياس الطيف الضوئي للأشعة فوق البنفسجية. احسب النسبة المئوية لكفاءة التحلل التحلل الضوئي باستخدام المعادلة:
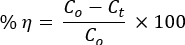
حيث Co و Ct هما تركيزات التشعيع الأولية وبعد الوقت t ، على التوالي ، لمحلول الأصباغ AO8 و CR ؛ η هي كفاءة إزالة اللون للصور ، - استخدم المعادلة الحركية الزائفة من الدرجة الأولى لدراسة ديناميكيات التفاعل:
الحركية الزائفة من الدرجة الأولى: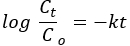
حيث Co و Ct هما التركيزان الأوليان والتوازن لصبغة AO8 (مجم / لتر) ، على التوالي ، k هو ثابت المعدل ، و t هو الوقت بالدقائق.
النتائج
يوضح الشكل 1 أ الثبات الحراري للNCs الثنائية قبل أن تحلل أداة DTG التكلس في الغلاف الجوي N2 . سلسلة من تبخير جزيئات H2O الممتصة ، والاضمحلال داخل الجزيئات ، وهيدروكسيدات المعادن أو / و تحلل السلسلة الجانبية PVA ، وتحلل السلسلة الرئيسية بين الجزيئية / PVA ، وأخيرا ، حدث الجزء البلوري لإعطاء الكربون والهيدروكربونات والرماد29،30.
أظهرت NCs فقدان الاستقرار فوق 720 درجة مئوية. كانت زوايا حيود نمط XRD مع المستويات البلورية المقابلة لها متوافقة مع الهيكل السداسي ل ZnO NPs (ICSD: 00-036-1451; الشكل 1 ب). أظهرت ZnO NPs قمم حادة مقارنة بالمواد المركبة ، مما يشير إلى الخصائص الأقل بلورية ل NCs31. تم تشكيل الهياكل البلورية ل ZnO (الشكل 1C) و Mn2O3 (الشكل 1C) باستخدام برنامج التصوير VESTA 3D.
ثم تم حساب المتوسط التقريبي لأحجام البلورات باستخدام صيغة ديباي شيرر:
D = Kλ / (β cos θ)
حيث λ هو الطول الموجي لإشعاع الأشعة السينية (لإشعاع Cu Kα ، λ = 0.15418 نانومتر) ، K هو الثابت ، β هو عرض الخط عند الحد الأقصى لنصف الارتفاع ، و θ هي زاوية الحيود32. الأحجام التقريبية ل ZnO NPs و NCs هي 59 نانومتر و 23 نانومتر ، على التوالي.
يشير عدم وجود تحولات الذروة ل NCs بالنسبة إلى ZnO إلى تكوين تقاطعات غير متجانسة محلية فقط بين الأكاسيد ، مما يفي بنظرية بيرسون HSAB16،17،33. لم يتم ملاحظة قمم XRD من PVA أيضا في أنماط XRD من ZnO و NCs. أظهر هذا تحللا كاملا ل PVA عند 500 درجة مئوية ، كما تم التحقق من صحته في تحليل DTG.
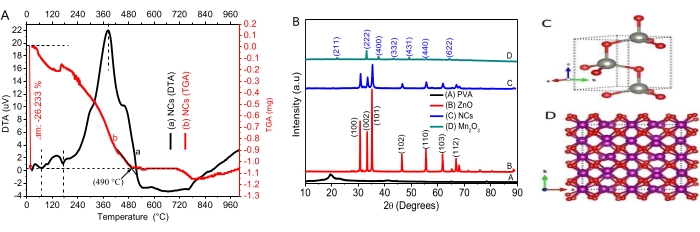
من بين نماذج شكل المسام الأساسية ، يبدو أن مخططات BET الخاصة ب ZnO NPs و NCs لها أشكال أسطوانية (الشكل 2 ب) 34. من بين الأنواع الستة من متساوي الحرارة بالامتاز وأربعة أنواع من حلقات التباطؤ من تصنيف IUPAC ، تمت مطابقة NPs و NCs مع متساوي حرارة الامتزاز من النوع IV وحلقة التباطؤ H335. تظهر الزيادة الحادة عند الضغط النسبي البالغ 0.8 P / P0 الحدوث المتزامن لتوزيعات حجم المسام المتوسطة المسامية والكبيرةالمسامية 36.
تظهر مخططات توزيع حجم المسام Barrett-Joyner-Halenda (BJH) هيمنة توزيع حجم المسام المتوسطة المسامية (الشكل 2 داخلي) 34. يمكن تعيين نطاقات الامتصاص لأطياف FTIR لكل من ZnO NPs و NCs عند ~ 3650 سم −1 و ~ 1650 سم −1 إلى اهتزازات مجموعات الهيدروكسيل وجزيئات الماء ، على التوالي (الشكل 2 ب). من المحتمل أن تؤثر السمات المورفولوجية والتركيبية والهيكلية ل NPs و NCs على عدد وموقع القمم. يعتقد أن التعديل المورفولوجي من البعد الكروي إلى جسيمات أحادية أو ثنائية أو ثلاثية الأبعاد يسبب اتساع وانقسام النطاقات37،38. بالنسبة إلى ZnO NPs ، تم تقسيم قمم الامتصاص إلى قسمين ، بينما بالنسبة ل NCs ، لوحظت ذروة واحدة فقط عند 450 سم −1. يعتمد تحول الرقم الموجي على قوة وضعف رابطة المعدن والأكسجين39. يؤكد ذروة التحول نحو الرقم الموجي / التردد المنخفض ل NCs (3560 سم −1) مقارنة ب ZnO (3655 سم −1) ضعف الرابطة المعدنية والأكسجين بسبب إدخال Mn2O3 المرحلة40. يمكن أن يكون ظهور القمم الأخرى بسبب الشوائب الانتقالية الناتجة أثناء التوليف 41.
يوضح الشكل 3 أ ، ب صور التسويق عبر محرك البحث لمواد ZnO و NC. كشفت صور SEM عن مسامية أعلى ل NCs من ZnO. هذه النتيجة تتوافق مع تفسير BET. كلما كانت المواد أكثر مسامية ، زادت عيوب السطح / المواقع النشطة ، ونقل الشحنة ، وكفاءة امتصاص الضوء المرئي. علاوة على ذلك ، تحقق التحليل التركيبي بواسطة تقنية EDX من حقيقة تركيبات عناصر Zn و Mn و O التي يمكن التنبؤ بها (الشكل 3C) ، مع ملاحظة القمم الرئيسية ذات الصلة عند 1 كيلو فولت و 0.5 كيلو فولت و 0.45 كيلو فولت. تم الكشف عن العناصر C و S على أنها شوائب.
أكد طيف XPS من ZnO NPs و NCs (الشكل التكميلي S1) وجود الحالات الكيميائية Zn 2p و Mn 2p و O 1s و C 1s. تؤكد المنطقة المدارية Mn 2p عالية الدقة على NCs أن الحالات الكيميائية ل Mn 2 p3/2 و Mn 2 p1/2 موجودة في طاقات الربط 641.1 eV و 653.2 eV ، على التوالي42. تمثل طاقة الانقسام التقريبية البالغة 12.1 فولت بين Mn 2p3/2 و Mn 2p1/2 قيمة نموذجية ل Mn3 + 43. أخيرا ، تظهر طاقة ربط Zn 2p في NCs (1022.7 eV) تحولا إيجابيا مقارنة بطاقة ZnO النقي (1022.0 eV). يرجع هذا التحول إلى نقل الإلكترون من مستوى فيرمي ل ZnO إلى مستوى فيرمي ل Fe2O3 أو / و Mn2O344،45،46.
تشير صور TEM (الشكل 3D) إلى أن أحجام NCs المركبة كانت في نطاق النانومتر (~ 20 - 50 نانومتر) ، بما يتفق مع تحليل XRD. تصور صور TEM أيضا وجود بلورات مزدوجة (بلوريتان مختلفتان الحجم) مفصولة بحدود تعرف باسم المرفقالموجه 47. يسمح هذا المرفق للجسيمات بمشاركة اتجاه بلوري مشترك47،48 ويساعد في حدوث قدرة نقل الشحنة المستمر49. تشير بقع الحيود الموجودة بالضبط على حلقة SAED إلى بلورة ZnO NPs. تمثل البقع خارج الحلقة وجود Mn2O3 (الشكل 3E) 50.
تتوافق قيم التباعد بين المستويين المقاسة من SAED ل NCs مع هيكل Wurtzite ZnO السداسي (الشكل 3E داخلي). تتطابق قيمة التباعد d البالغة 0.34 نانومتر من صورة HRTEM مع 221 طائرة من α-Mn2O3 (الشكل 3F) 51،52. كشفت أخطاء التكديس المكتشفة على صورة IFFT ل HRTEM عن الخصائص المسامية ل NCs (صور IFFT للشكل 3E الداخلي). من ناحية أخرى ، لم يشاهد الهامش الشبكي ل ZnO بالنسبة إلى NCs. ربما يرجع ذلك إلى الاختيار العشوائي للبلورة أثناء الدقة.
يوضح الشكل 4 أ ، ب أنشطة التحلل الضوئي ل ZnO NPs و NCs لتحلل AO8. حدثت نسبة صغيرة من الامتزاز في الظلام أثناء توازن الامتزاز / الامتزاز. أظهر كل من ZnO و NCs أنشطة تحفيزية ضوئية جيدة على صبغة AO8.
البيانات المعتمدة على الوقت (Ct / Co مقابل t و log (Ct / Co) مقابل t) في الشكل 4C والداخلية ، على التوالي. تم استنتاج ثابت المعدل ، k ، قيم ZnO و ZnO-Mn2O3 NCs التي تم الحصول عليها لتكون 0.0058 دقيقة −1 و 0.0087 دقيقة −1 ، على التوالي. ترتبط الأنشطة التحفيزية الضوئية الجيدة ل ZnO NPs ببعض العيوب (الشواغر) التي تمنع إعادة التركيب e− / h + . تظهر إمكانات الأكسدة والاختزال لأكاسيد الزنك والمنغنيز قبل وبعد الوصلة غير المتجانسة في الشكل 4D (على اليسار).
لاحظت الدراسة أن فجوات نطاقات Mn2O3 (مستوى فيرمي بالقرب من VB) و ZnO (مستوى فيرمي بالقرب من CB) تتحرك لأعلى ولأسفل ، على التوالي لتحقيق استقرار مستوى فيرمي ، وأخيرا ، تحقيق التوازن ، كما هو موضح في الشكل 4C (يمين). من المحتمل أن يكون النشاط المحفز الضوئي ل NCs الثنائية على صبغة AO8 بسبب تكوين محاذاة نطاق فجوة مكسورة مناسبة (النوع الثالث). علاوة على ذلك ، فإن نوع الفجوة المكسورة للوصلة غير المتجانسة ينقل الإلكترونات من إمكانات CB الأكثر سلبية ل ZnO إلى إمكانات VB الأكثر سلبية ل Mn2O353،54. وبالتالي ، تمت زيادة الفصل بين e− و h + لتعزيز كفاءة التحلل55.
على الرغم من أن موضع حافة النطاق يعتمد على الشحنة السطحية ، إلا أن أكاسيد معدن أشباه الموصلات لها طاقة فجوة نطاق نموذجية ، والتي تمتص ترددا محددا من الضوء56. بالنسبة لأشباه الموصلات ، فإن وجود CB سالب أكثر من إمكانات الاختزال H + / H2 والمزيد من VB الإيجابي من إمكانات الاختزال O2 / H2O أمر بالغ الأهمية لتحلل الملوثات57. يظهر وجود خاصية نقل شحنة جيدة تكوين تقاطعات غير متجانسة / اتصال محلي بين أكاسيد المعادن ، والتي لها تأثير ملحوظ على تناقص إعادة التركيب e - / h + . تشير نتائج الدراسة والمراجعات إلى آلية تحلل مقترحة محتملة للNCs بعد التقاطع غير المتجانس33،46 ، كما هو موضح في الشكل 4D.
الشكل 1. تحليل استقرار المواد. (أ) قطع التحليل الحراري الوزني / التحليل الحراري الوزني / DTA من PVA-ZnO/Mn2O3 قبل التكلس. (ب) مخططات XRD من PVA و ZnO و PVA-ZnO/Mn2O3 و Mn2O3 ؛ الهياكل البلورية ذات النمط الكروي والعصا من (C) ZnO و (D) Mn2O3 التي تم إنشاؤها باستخدام برنامج برنامج التصوير VESTA 3D (الأحمر للذرة O) المكلس عند 500 درجة مئوية. تم تعديل هذا الرقم من28. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 2. الخصائص التركيبية وتحليل الترابط الكيميائي. (أ) قطع أراضي BET من ZnO وMn 2O3 و PVA-ZnO / Mn2O3 المكلس عند 500 درجة مئوية. يوضح الشكل الداخلي مخططات BJH. (ب) أطياف FT-IR لعينات ZnO NPs و PVA-ZnO/Mn2O3 المكلس عند 500 درجة مئوية. تم تعديل هذا الرقم من28. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
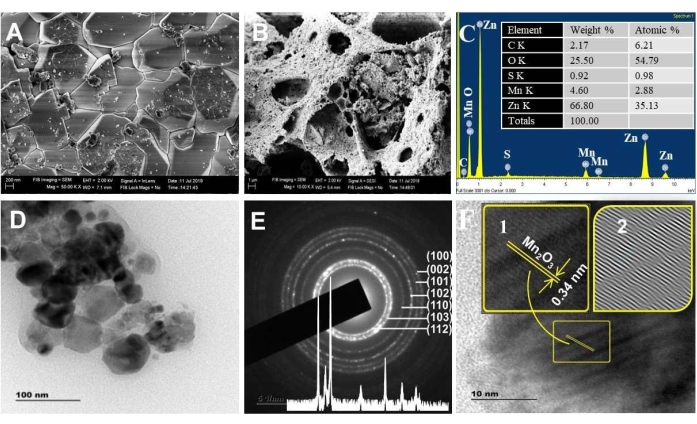
الشكل 3. التحليل المورفولوجي. صورة SEM ل (A) ZnO و (B) ZnO / Mn2O3 ، (C) أطياف EDXS المكلس عند 500 درجة مئوية. Inset in C هو الوزن الأولي ٪ والنتيجة الذرية. (د) صور TEM و (E) SAED و (F) صور HRTEM المكلس عند 500 درجة مئوية. الداخل في E هو نمط XRD. الداخل في F هو الأطراف الشبكية المكبرة (1) ونمط IFFT (2). تم تعديل هذا الرقم من28. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
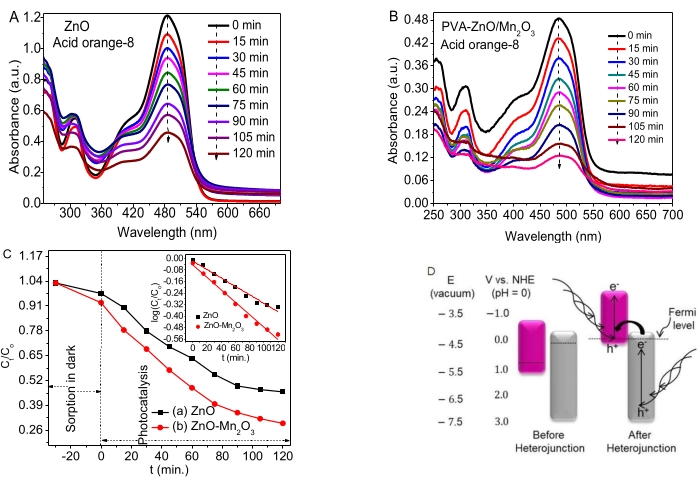
الشكل 4. أنشطة التحفيز الضوئي ل ZnO NPs و ZnO-Mn2O3 NCs (A ، B) الامتصاص مقابل مخططات الطول الموجي ل ZnO و ZnO / Mn2O3 ، على التوالي. (ج) مخطط بيانات الحركية المعتمدة على الوقت Ct / C مقابل t والسجل (Ct / Co) مقابل t. (د) نوع الفجوة المكسورة لآلية مقترحة محتملة (يسار ، قبل التقاطع غير المتجانس واليمين ، بعد التقاطع غير المتجانس). تم تعديل هذا الرقم من28. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي S1. يوضح الرسم التخطيطي تخليق الاحتراق بمساعدة العامل الموجه للهندسة المعمارية والذي ينتج مادة نانوية مسامية نشطة لنقل الكتلة / الأيونات. (أ) محلول السلائف؛ (ب) الجل المتكون عند الجفاف عند 110 درجة مئوية ؛ (ج) انفجار الناتج الثانوي الغازي على مزيد من التسخين لإشعال درجة الحرارة ؛ (د) المنتج الثانوي المسامي المستقر الناتج عند التكليس عند 500 درجة مئوية ، وقد تم تعديل هذا الرقم من28. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
يصف البروتوكول الحالي تخليق البلورات النانوية باستخدام استراتيجية من أسفل إلى أعلى مع شكل وحجم وهيكل دقيقين. لاحظت الدراسة أن تنوي ونمو البلورات النانوية كانا مهمين قبل تكوين البلورات النانوية. هنا ، تم تصنيع أكاسيد ZnO والمنغنيز بناء على نظرية مجموعة LaMer25 ، والتي تفترض عملية تكوين البلورات النانوية بعد تقليل السلائف إلى ذرات ونوى ، مما يؤدي إلى تكوين البذور لإنتاج بلورات نانوية. في هذا الصدد ، يعتمد الشكل والحجم العام للبلورات النانوية على نمو البذور وخصائص البذور وإعادة تنشيط المواد الخافضة للتوتر السطحي / عامل السد. يمكن أن يعمل كحول البولي فينيل كعامل اختزال وسد / تثبيت58،59. وفي الوقت نفسه ، على عكس نهج SG-SCS التقليدي ، الذي يستخدم الوقود كمؤكسد ، تم استخدام بوليمر PVA فقط كعامل تعقيد وسد دون استخدام أي وقود. في هذه الحالة ، تم استخدام الماء كمذيب ، وهو أمر غير شائع حيث استخدمت دراسات أخرى مذيبات سامة ومسببة للسرطان وطفرات.
عدلت هذه الدراسة تفاعل الزنك والمنغنيز بناء على نظرية الأحماض والقواعد الصلبة واللينة (HSAB)16،24. تم استخدام مخدرات كبريتات المنغنيز الأقل تفاعلا وقابلية للذوبان لتشكيل تقاطع موضعي غير متجانس مع سلائف نترات الزنك الأكثر تفاعلا. بدأت تنوي الزنك ، وانتشرت ذرات المنغنيز وربطتها بالمواقع السطحية المناسبة (الخطوات ومكامن الخلل)26.
يمكن استخدام المخفضات أو مؤكسدات الملح المحايدة / القائمة على الكلوريد أو المؤكسدة / النترات ك SG-SCS. كمعلومات ، تحتاج السلائف القائمة على المخفض والمحايد / الكلور إلى مؤكسدات إضافية وتطلق حمض الهيدروكلوريك ، مما يؤدي إلى تلوث المنتجات النهائية. بشكل عام ، سلائف النترات هي أفضل مؤكسد ، مع خصائص حاسمة مثل إمكانات الأكسدة الكافية ودرجة حرارة التحلل المستقرة ، والتي تساعد في تكوين منتج نقي60 ، والذوبان النبيل61. أنتجت سلائف الكبريتات المستخدمة للتحكم في التفاعل في هذا العمل شوائب تتطلب درجة حرارة تحلل عالية (انظر تحليل EDX ، الشكل 3C). نظرا لأن ملح النترات له إمكانات تشكيل مؤكسدة ومعقدةمناسبة 61 ، فمن المقترح استخدام سلائف النترات وغيرها من الظروف لموازنة تفاعل المضيف المنشط بدلا من الملح السطحي.
اتبعت SG-SCS في هذه الدراسة سلسلة من الخطوات ، بما في ذلك التكوين الغروي / سول ، والجفاف (تكوين الهلام) ، وتفاعل الاحتراق المستدامذاتيا 1،62. أدى ذلك إلى تطور الغازات التي تعمل على تحسين خصائص المسامية / التركيب للمنتج63 ، وأخيرا ، إخماد التفاعل عن طريق تطور الغازات (انظر الشكل التكميلي 1). أثناء عملية SG-SCS ، قد تشكل عمليات الاحتراق هيكلا إسفنجيا / شبيها بالرغوة عن طريق الاحتراق في العديد من النقاط أو هيكل سلكي طويل من خلال الاحتراق في بقعة / نقطة. علاوة على ذلك ، يساعد تكليس المواد المحترقة في تحلل الشوائب غير المحترقة ويحسن بلورةالمواد 27.
قدمت هذه الدراسة نهج تخليق احتراق المحلول (SCS) كمنهجية جديدة موفرة للوقت والطاقة لإنتاج مواد نانوية عالية الثبات ومسامية يمكن تطبيقها بفعالية في بيئة قابلة للتطوير صناعيا. نجحت إجراءات SG-SCS في تصنيع NCs الثنائية المسامية القائمة على ZnO. لاحظت الدراسة أن طريقة sol-gel حسنت SAS ل NCs المركبة. تم التحقق من مسامية NCs من خلال صورة SEM وحلقة SAED وتحليل BET ، بينما تم تحديد درجة حرارة تحلل PVA المحسنة ل NCs على أنها 500 درجة مئوية من تحليل DTG. أكد تحليل صور XRD و TEM أن أحجام البلورات ل NPs و NCs كانت على مستوى النانو. تم تطبيق تحليلات EDX و XPS و HRTEM للتحقيق التركيبي والواقعي. في النهاية ، أظهرت NCs الثنائية تدهورا جيدا لصبغة AO8 ، مما يثبت كفاءتها. بشكل عام ، يمكن تصنيع أي مادة بشكل معقول من خلال معالجة العيوب المذكورة ، ويمكن أن توفر SCS طريقة أقل تكلفة وسهلة وموفرة للوقت / الطاقة لتشغيل أجهزة الطاقة في المستقبل.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
نود أن نتوجه بخالص الشكر إلى جامعة أداما للعلوم والتكنولوجيا على دعمها في هذا العمل. تم توفير التمويل من مشروع دعم الباحثين بجامعة الطائف رقم (TURSP-2020/44) ، جامعة الطائف ، الطائف ، المملكة العربية السعودية.
Materials
| Name | Company | Catalog Number | Comments |
| Acid orange 8 | Sigma-Aldrich | 65%, | |
| Chlorine | Sigma-Aldrich | 7782-50-5 | |
| Dithienogermole | Sigma-Aldrich | 773881-43-9 | |
| HCl | Sigma-Aldrich | 7647-01-0 | |
| Manganese nitrate (10%) salt | Sigma-Aldrich | 15710-66-4 | 10% |
| Manganese sulfate monohydrate | Sigma-Aldrich | Density: 2.95 g/cm³; solubility in water: 70 g/100 mL (70 °C); 99.95%, MnSO4.H2O | |
| Poly (vinyl alcohol) | Sigma-Aldrich | 9002-89-5 | Density: 1.19–1.31 g/cm³ @20 °C, soluble in water only @ > 80 °C |
| Zinc nitrate hexahydrate (90%) | Sigma-Aldrich | 10196-18-6 | 98%; Density: 2.065 g/cm³ @20 °C; solubility in water: 184.3 g/100 mL @20 °C |
| Instruments used | |||
| Materials name | Model | Analysis | |
| BET (N2 adsorption-desorption isotherms) | Quanta chrome instrument. | Textural properties | |
| DT/DTA | Shimadzu DTG-60H | Measure thermal stability | |
| FTIR | Perkin Elmer FT-IR, Spectrum 65 | Chemical bonding information | |
| HRTEM | JEOL TEM 2100 HRTEM | Morphological, size, and composition analysis | |
| SEM-EDX | SEM-EDX-EVO 18 with low vacuum facility and ALTO 1000 cryo attachment | Morphological analysis | |
| XPS | AXIS ULTRA from AXIS 165 | ||
| XRD | Shimadzu, XRD-7000 | Crystallinity, structure, and approximate average crystallite size | |
| Common software used | |||
| Name | Company | Use | |
| Mendeley | Mendeley-Desktop-1.19.8-win32 | For citing references | |
| Origin | OriginPro 8 | XRD, BET, UV-vis-DRS data analysis |
References
- Khort, A., et al. Corrosion and transformation of solution combustion synthesized Co, Ni and CoNi nanoparticles in synthetic freshwater with and without natural organic matter. Scientific Reports. 11 (1), 7860 (2021).
- Pype, M., Lawrence, M. G., Keller, J., Gernjak, W. Reverse osmosis integrity monitoring in water reuse: The challenge to verify virus removal - A review. Water Research. 98, 384-395 (2016).
- Adeleye, A. S., et al. Engineered nanomaterials for water treatment and remediation: Costs, benefits, and applicability. Chemical Engineering Journal. 286, 640-662 (2016).
- Gómez-Pastora, J., et al. Review and perspectives on the use of magnetic nanophotocatalysts (MNPCs) in water treatment. Chemical Engineering Journal. 310 (2), 407-427 (2017).
- Nadeem, M. S., et al. Enhancement in the photocatalytic and antimicrobial properties of ZnO nanoparticles by structural variations and energy bandgap tuning through Fe and Co co-doping. Ceramics International. 47 (8), 11109-11121 (2021).
- Nadeem, M. S., et al. Energy-levels well-matched direct Z-scheme ZnNiNdO/CdS heterojunction for elimination of diverse pollutants from wastewater and microbial disinfection. Environmental Science and Pollution Research International. , (2022).
- Munawar, T., Iqbal, F., Yasmeen, S., Mahmood, K., Hussain, A. Multi metal oxide NiO-CdO-ZnO nanocomposite-Synthesis, structural, optical, electrical properties and enhanced sunlight driven photocatalytic activity. Ceramics International. 46 (2), 2421-2437 (2020).
- Srinivasa, N., et al. Facile synthesis of Ni/NiO nanocomposites: The effect of Ni content in NiO upon the oxygen evolution reaction within alkaline media. RSC Advances. 11 (24), 14654-14664 (2021).
- Chen, P., et al. Solution combustion synthesis of ternary Ni/WC/C composites with efficient electrocatalytic oxygen reduction performance. RSC Advances. 11 (61), 38718-38726 (2021).
- Nagvenkar, A. P., Perelshtein, I., Piunno, Y., Mantecca, P., Gedanken, A. Sonochemical one-step synthesis of polymer-capped metal oxide nanocolloids: Antibacterial activity and cytotoxicity. ACS Omega. 4 (9), 13631-13639 (2019).
- Janotti, A., Van de Walle, C. G. Fundamentals of zinc oxide as a semiconductor. Reports on Progress in Physics. 72 (12), 126501 (2009).
- Abebe, B., Murthy, H. C. A., Amare, E. Enhancing the photocatalytic efficiency of ZnO: Defects, heterojunction, and optimization. Environmental Nanotechnology, Monitoring. & Management. 14, 100336 (2020).
- Abebe, B., Murthy, H. C. A., Zereffa, E. A. Multifunctional application of PVA-aided Zn-Fe-Mn coupled oxide nanocomposite. Nanoscale Research Letters. 16, 1 (2021).
- Shekofteh-Gohari, M., Habibi-Yangjeh, A. Fe3O4/ZnO/CoWO4 nanocomposites: Novel magnetically separable visible-light-driven photocatalysts with enhanced activity in degradation of different dye pollutants. Ceramics International. 43 (3), 3063-3071 (2017).
- Saravanan, R., Gupta, V. K. K., Narayanan, V., Stephen, A. Visible light degradation of textile effluent using novel catalyst ZnO/γ-Mn2O3. Journal of the Taiwan Institute of Chemical Engineers. 45 (4), 1910-1917 (2014).
- Buonsanti, R., Milliron, D. J. Chemistry of doped colloidal nanocrystals. Chemistry of Materials. 25 (8), 1305-1317 (2013).
- Hu, H., He, H., Zhang, J., Hou, X., Wu, P. Optical sensing at the nanobiointerface of metal ion-optically-active nanocrystals. Nanoscale. 10 (11), 5035-5046 (2018).
- Deganello, F., Tyagi, A. K. Solution combustion synthesis, energy and environment: Best parameters for better materials. Progress in Crystal Growth and Characterization of Materials. 64 (2), 23-61 (2018).
- Buonsanti, R., et al. Assembly of ligand-stripped nanocrystals into precisely controlled mesoporous architectures. Nano Letters. 12 (7), 3872-3877 (2012).
- Li, F., Ran, J., Jaroniec, M., Qiao, S. Z. Solution combustion synthesis of metal oxide nanomaterials for energy storage and conversion. Nanoscale. 7 (42), 17590-17610 (2015).
- Williams, T. E., et al. Nearest-neighbour nanocrystal bonding dictates framework stability or collapse in colloidal nanocrystal frameworks. Chemical Communications. 53 (35), 4853-4856 (2017).
- Helms, B. A., Williams, T. E., Buonsanti, R., Milliron, D. J. Colloidal nanocrystal frameworks. Advanced Materials. 27 (38), 5820-5829 (2015).
- Liu, B., et al. Synthesis of ZnO nano-powders via a novel PVA-assisted freeze-drying process. RSC Advances. 6 (111), 110349-110355 (2016).
- Abebe, B., Murthy, H. C. A. Insights into ZnO-based doped porous nanocrystal frameworks. RSC Advances. 12 (10), 5816-5833 (2022).
- LaMer, V. K., Dinegar, R. H. Theory, production and mechanism of formation of monodispersed hydrosols. Journal of the American Chemical Society. 72 (11), 4847-4854 (1950).
- Jun, Y. -. S., et al. Classical and nonclassical nucleation and growth mechanisms for nanoparticle formation. Annual Review of Physical Chemistry. 73, 453-477 (2022).
- Gao, Y., Meng, F., Li, X., Wen, J. Z., Li, Z. Factors controlling nanosized Ni-Al 2 O 3 catalysts synthesized by solution combustion for slurry-phase CO methanation: the ratio of reducing valences to oxidizing valences in redox systems. Catalysis Science & Technology. 6 (21), 7800-7811 (2016).
- Abebe, B., Zereffa, E. A., Murthy, H. C. A. Synthesis of poly(vinyl alcohol)-aided ZnO/Mn 2 O 3 nanocomposites for acid orange-8 dye degradation: Mechanism and antibacterial activity. ACS Omega. 6 (1), 954-964 (2021).
- Kumar, S., Krishnakumar, B., Sobral, A. J. F. N., Koh, J. Bio-based ( chitosan / PVA / ZnO ) nanocomposites fi lm Thermally stable and photoluminescence material for removal of organic dye. Carbohydrate Polymers. 205, 559-564 (2019).
- Dai, Y., et al. Enhanced mechanical, thermal, and UV-shielding properties of poly(vinyl alcohol)/metal-organic framework nanocomposites. RSC Advances. 8 (67), 38681-38688 (2018).
- Munawar, T., et al. Novel tri-phase heterostructured ZnO-Yb2O3-Pr2O3 nanocomposite; structural, optical, photocatalytic and antibacterial studies. Ceramics International. 46 (8), 11101-11114 (2020).
- Mukhtar, F., et al. Enhancement in carrier separation of ZnO-Ho2O3-Sm2O3 hetrostuctured nanocomposite with rGO and PANI supported direct dual Z-scheme for antimicrobial inactivation and sunlight driven photocatalysis. Advanced Powder Technology. 32 (10), 3770-3787 (2021).
- Lachheb, H., et al. Electron transfer in ZnO-Fe 2 O 3 aqueous slurry systems and its effects on visible light photocatalytic activity. Catalysis Science & Technology. 7 (18), 4041-4047 (2017).
- Thommes, M., et al. Physisorption of gases, with special reference to the evaluation of surface area and pore size distribution (IUPAC Technical Report). Pure and Applied Chemistry. 87 (9-10), 1051-1069 (2015).
- Kumar, P., Kim, K. -. H., Kwon, E. E., Szulejko, J. E. Metal-organic frameworks for the control and management of air quality: advances and future direction. Journal of Materials Chemistry A. 4 (2), 345-361 (2016).
- Liu, J., et al. NiO-PTA supported on ZIF-8 as a highly effective catalyst for hydrocracking of Jatropha oil. Scientific Reports. 6, 23667 (2016).
- Fatehah, M. O., Aziz, H. A., Stoll, S. Stability of ZnO nanoparticles in solution. Influence of pH, dissolution, aggregation and disaggregation effects. Journal of Colloid Science and Biotechnology. 3 (1), 75-84 (2014).
- Sigoli, F. A., Davolos, M. R., Jafelicci, M. Morphological evolution of zinc oxide originating from zinc hydroxide carbonate. Journal of Alloys and Compounds. 262-263, 292-295 (1997).
- Wachs, I. E. Raman and IR studies of surface metal oxide species on oxide supports: Supported metal oxide catalysts. Catalysis Today. 27 (3-4), 437-455 (1996).
- Parler, C. M., Ritter, J. A., Amiridis, M. D. Infrared spectroscopic study of sol-gel derived mixed-metal oxides. Journal of Non-Crystalline Solids. 279 (2-3), 119-125 (2001).
- Anžlovar, A., Kogej, K., Crnjak Orel, Z., Žigon, M. Polyol mediated nano size zinc oxide and nanocomposites with poly(methyl methacrylate). Express Polymer Letters. 5 (7), 604-619 (2011).
- Saravanan, R., et al. ZnO/Ag/Mn 2 O 3 nanocomposite for visible light-induced industrial textile effluent degradation, uric acid and ascorbic acid sensing and antimicrobial activity. RSC Advances. 5 (44), 34645-34651 (2015).
- Yang, G., Yan, W., Wang, J., Yang, H. Fabrication and formation mechanism of Mn 2 O 3 hollow nanofibers by single-spinneret electrospinning. CrystEngComm. 16 (30), 6907-6913 (2014).
- Liu, Y., et al. A magnetically separable photocatalyst based on nest-like γ-Fe 2 O 3 /ZnO double-shelled hollow structures with enhanced photocatalytic activity. Nanoscale. 4 (1), 183-187 (2012).
- Hu, Y., et al. A microwave-assisted rapid route to synthesize ZnO/ZnS core-shell nanostructures via controllable surface sulfidation of ZnO nanorods. CrystEngComm. 13 (10), 3438-3443 (2011).
- Zhang, J., et al. Synthesis and gas sensing properties of α-Fe 2 O 3 @ ZnO core-shell nanospindles. Nanotechnology. 22 (18), 185501 (2011).
- Penn, R. L. Imperfect oriented attachment: Dislocation generation in defect-free nanocrystals. Science. 281 (5379), 969-971 (1998).
- Zhang, J., Huang, F., Lin, Z. Progress of nanocrystalline growth kinetics based on oriented attachment. Nanoscale. 2 (1), 18-34 (2009).
- Zeng, Z., et al. A fluorescence-electrochemical study of carbon nanodots (CNDs) in bio- and photoelectronic applications and energy gap investigation. Physical Chemistry Chemical Physics. 19 (30), 20101-20109 (2017).
- Zhai, T., et al. Controllable synthesis of hierarchical ZnO nanodisks for highly photocatalytic activity. CrystEngComm. 14 (5), 1850-1855 (2012).
- Li, N., et al. Efficient removal of chromium from water by Mn3O4 @ZnO/Mn3O4 composite under simulated sunlight irradiation: Synergy of photocatalytic reduction and adsorption. Applied Catalysis B: Environmental. 214, 126-136 (2017).
- Abebe, B. Polymer assisted colloidal nanocrystal framework synthesis: Sol-gel approach. Materials Research Express. 8 (12), 125005 (2021).
- Jiamprasertboon, A., et al. Heterojunction α-Fe2O3/ZnO films with enhanced photocatalytic properties grown by aerosol-assisted chemical vapour deposition. Chemistry - A European Journal. 25 (48), 11337-11345 (2019).
- Mukhtar, F., et al. Dual S-scheme heterojunction ZnO-V2O5-WO3 nanocomposite with enhanced photocatalytic and antimicrobial activity. Materials Chemistry and Physics. 263, 124372 (2021).
- Marschall, R. Semiconductor composites: Strategies for enhancing charge carrier separation to improve photocatalytic activity. Advanced Functional Materials. 24 (17), 2421-2440 (2013).
- Beranek, R. (Photo)electrochemical methods for the determination of the band edge positions of TiO 2-based nanomaterials. Advances in Physical Chemistry. 2011, 786759 (2011).
- Hoffmann, M. R., Martin, S. T., Choi, W., Bahnemann, D. W. Environmental applications of semiconductor photocatalysis. Chemical Reviews. 95 (1), 69-96 (1995).
- Wu, Y., Wang, D., Li, Y. Understanding of the major reactions in solution synthesis of functional nanomaterials. Science China Materials. 59, 938-996 (2016).
- Xia, Y., Xiong, Y., Lim, B., Skrabalak, S. E. Shape-controlled synthesis of metal nanocrystals: Simple chemistry meets complex physics. Angewandte Chemie. 48 (1), 60-103 (2008).
- Kim, S. J., Yoon, S., Kim, H. J. Review of solution-processed oxide thin-film transistors. Japanese Journal of Applied Physics. 53, (2014).
- Zhang, J., Guo, Q., Liu, Y., Cheng, Y. Preparation and characterization of Fe2O3/Al2O3 using the solution combustion approach for chemical looping combustion. Industrial & Engineering Chemistry Research. 51 (39), 12773-12781 (2012).
- Novitskaya, E., Kelly, J. P., Bhaduri, S., Graeve, O. A. A review of solution combustion synthesis: an analysis of parameters controlling powder characteristics. International Materials Reviews. 66 (3), 188-214 (2021).
- González-Cortés, S. L., Imbert, F. E. Fundamentals, properties and applications of solid catalysts prepared by solution combustion synthesis (SCS). Applied Catalysis A: General. 452, 117-131 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved