Method Article
Photocatalytic Activities를 위한 Metal Oxide Heterojunction
요약
이종접합(heterojunction)의 개발은 시간/에너지 효율적인 과정인 용액 연소 합성의 광촉매 활성을 촉진합니다. 이 프로토콜에는 재료의 특성을 평가하기 위해 고급 분석 특성화 기술이 사용되었으며 나노 복합재는 향상된 산성 주황색-8 염료 분해를 입증했습니다.
초록
합성 기술과 최적의 특성, 특히 산업 규모의 응용 분야에 대한 개선에 대한 상당한 글로벌 요구가 있습니다. Sol-gel 기반 용액 연소 합성(SG-SCS)은 정렬된 다공성 물질을 생산하는 간단한 방법입니다. 이와 관련하여 Pearson의 경질 및 연산 및 염기 이론은 적절한 이종 접합을 형성하기 위해 숙주-도펀트 반응성을 선택하는 데 도움이 됩니다.
이종접합(heterojunction)의 형성은 또한 재료의 필수 특성을 변화시켜 전하 전달 또는 시너지 활동을 통해 광촉매를 개선합니다. 500°C의 소성 온도는 시차 열중량 비율 분석(DTG)을 통한 안정성 평가 결과를 기반으로 하는 이 공정에 이상적입니다.
생성된 나노 입자(NP) 및 나노 복합체(NC)의 나노 크기 치수는 X선 회절 및 고해상도 투과 전자 현미경(HRTEM)을 사용하여 검증되었습니다. 또한, 주사 전자 현미경 현미경 및 BET 분석을 통해 재료의 다공성 특성을 확인했습니다. HRTEM, X선 광전자 분광법 및 에너지 분산 X선 조사를 통해 재료 조성을 확립했습니다. 이 연구는 NC가 노출된 ZnO보다 산성 주황색 8(AO8) 색상을 더 효율적으로 저하시킨다는 것을 발견했습니다.
서문
환경 보호는 전 세계적으로 기업의 급속한 성장과 함께 주요 관심사가 되었습니다. 결과적으로, 나노 기술 기반 나노 물질 (NM)과 그 합성은 현대 과학 세계에서 벌크 물질에 대한 연구자들의 관심을 끌었습니다1. 유기 및 무기 오염 물질을 처리하기 위해 여러 물리 화학적 접근 방식이 적용되었습니다 2,3. 이와 관련하여, 2차 오염을 일으키지 않고 독소를 용해하는 단순성과 능력으로 인해 이종 광촉매는 적응형 복원 기술4로 간주됩니다. 연구에 따르면 적절한 밴드갭 반도체 사이의 이종접합 또는 도핑을 설계했으며, 이는 구성 요소의 전자-정공 재결합, 표면적 및 부피를 줄이는 데 도움이 됩니다. 이 조건은 이후 염료 5,6,7의 광촉매 분해를 증가시켰다. 최근 연구에서는 이종접합(heterojunctions)/하이브리드(hybrid)8,9를 통한 시너지 및 충전기 전달 개선 역할도 보고되었으며, 반도체 금속 산화물은 다기능 응용을 위한 고유한 물리적, 화학적 특성을 입증했습니다10. 결과적으로, TiO2 및 산화 아연 NP (ZnO NPs)는 연구자들 사이에서 상당한 관심을 받았습니다11,12.
단일 재료와 비교했을 때, 이종접합(heterojunction)의 형성은 재료의 표면적과 부피 비율을 증가시키고 재료의 광촉매 및 항균 성능을 개선하기 위한 고유한 선호 사항 중 하나가 되었습니다. 또한, 이진 이종 접합의 시너지 효과는 이진 이종 접합13,14에 비해 광생성 전자/정공 쌍의 분리를 향상시킵니다. 연구에 따르면 Mn2O3 와 ZnO NP15 사이의 이종 접합은 안정성과 기판 흡착 용량을 향상시키고 합성 된 NP에서 전하 전달 저항을 감소시킵니다. 또한 여러 연구에서 Pearson의 HSAB(Hard and Soft Acids and Bases) 이론을 기반으로 하는 숙주-도펀트 반응성을 사용하여 이종 접합 또는 도펀트 형성을 테스트했습니다. 경질 루이스 산 (예 : Mn (III))은 물과 같은 경질 염기 용매가있는 경우 Zn (II) 숙주 격자의 경계선으로 확산 할 수 없다는 것이 밝혀졌습니다16 , 17 . 그들은 숙주 표면에 흡착되고 산화되어 소성 시 하이브리드를 형성합니다.
그 잠재력으로 인해, 산업적으로 확장 가능한 재료 합성 응용 분야에 대한 현재 전 세계의 초점은 접근 방식과 중요한 전망을 개선하는 데 있습니다13. 용액 연소 합성(SCS)은 이온/질량 수송 현상19에서 중요한 역할을 하는 규칙적으로 정렬된 다공성 물질18을 생성하는 간단하고 시간/에너지 효율적인 방법입니다. SCS는 Pearson의 HSAB(Hard and Soft Acids and Based) 이론을 기반으로 하는 적절한 도펀트 호스트 분포 또는 이종접합으로 구성됩니다. 도핑/이종접합은 재료의 광학적, 자기적, 전기적 특성을 조정할 수 있으며, 이후 효과적인 전하 전달 및/또는 시너지 역할을 통해 재료의 적용을 높일 수 있습니다20. 아키텍처 지시제(ADA) 지원 SCS는 또한 에너지 변환 장치에서 질량/이온 수송에 사용되는 주문된 콜로이드 나노결정 프레임워크(CNF)를 생산할 수 있습니다21,22.
본 연구는 환경 친화적인 SG-SCS 접근법을 통해 ZnO NP와 ZnO 기반 이원 나노복합체(NC) 이종접합을 합성하기 위해 폴리비닐알코올(PVA) 계면활성제 및 착화제를 제조했습니다. 전하 전달에서 중요한 역할을 하는 산화물 간의 이종접합은 HSAB 이론에 기초하여 추정되었습니다. 특성화 기술을 사용하여 재료의 구조적, 광학적, 형태학적 특성을 이해했습니다. 이 물질의 분해 효율은 안정한 AO8 염료와 독성 AO8 염료 모두에서 테스트되었습니다.
프로토콜
1. 나노 물질 합성
- ZnO-Mn2O3 나노 복합 합성
- 폴리비닐 알코올을 계면활성제로 사용하고 착화제 보조 SG-SCS 접근법을 사용하여 나노복합체를 합성합니다. SG-SCS 접근 방식에 대한 그래픽 설명은 보충 그림 S1을 참조하십시오.
- 115°C에서 약 15분 동안 자석 교반기에서 연속 교반하면서 증류수 100mL에 PVA 중합체 1.5g을 용해시킵니다23.
- 염 전구체 용액, 90% v/v 농도의 질산아연, 10%v/v 농도의 황산망간을 약 10분 동안 연속 교반하면서 위에 용해된 PVA 용액에 붓고 온도를 70°C로 낮추십시오.
참고 : 핵 형성 도핑 접근법16,24을 따르기 위해 나노 복합 전구체 반응성의 균형을 맞추기 위해 염 전구체를 동시에 혼합했다. 온도는 70 °C로 La Mar 모형25,26에 따라서 nanoparticles의 가속한 성장 및 응집을 통제하기 위하여 감소되었습니다. - 수산화물 금속에서 생성된 졸(콜로이드 입자)을 밀폐되고 어두운 곳에 2일 동안 보관하여 노화시킵니다. 그런 다음 110°C(공기 중)로 가열하여 용액을 탈수하여 젤을 형성합니다.
참고: PVA 폴리머는 금속 양이온의 균일한 분산을 지원하고 연소 과정을 시작하며 응집/응집 특성을 방지하는 데 도움이 되는 주형물 및 착화제를 지시하는 아키텍처 역할을 합니다. - 오븐을 ~150-250 °C의 점화 온도로 가열하여 젤을 공기 중에서 연소시킵니다(간단한 온도계를 사용하여 대략적인 온도 확인). 점화 온도는 연소를 시작하는 데 필요한 최소 온도입니다. 연소 중에는 후드를 사용하여 인체 건강에 영향을 미치는 모든 독성 가스 부산물을 수집하십시오.
참고: 연소 과정은 연소 과정을 촉진하는 연료 역할을 하는 PVA 폴리머와 질산염 전구체 사이에 복합체를 형성하여 활성화되었습니다. - 머플 퍼니스에서 500°C에서 3시간 동안 연소된 물질을 소성하고 DTG(Differential thermogravimetry) 분석 기술을 사용하여 최적화했습니다. DTG는 연소되지 않은 불순물을 분해하고 재료의 결정도를 향상시킵니다27.
- 베어 ZnO 및 Mn2O3 NP 합성
- sol-gel 접근법을 사용하여 베어 메탈 산화물을 합성합니다. 1.1.2단계를 제외하고 앞에서 언급한 모든 단계(1.1.1.6.-1.1.6)를 사용하여 PVA 없이 베어 ZnO 및 Mn2O3 를 합성합니다. 금속 질산염 및 PVA 폴리머 복합체가 없기 때문에 최종 건조 단계에서 자체 전파 공정이 발생하지 않습니다.
2. NP 특성화
- 질소 분위기에서 20.0mL/분 유속과 50°C/분 램프 시간으로 열중량 측정 비율, 특히 열 중량 측정/시차 열(DT/DTA 분석)을 측정하여 NP 및 NC의 열 안정성과 열화 거동을 연구합니다.
- 400-4000cm-1 범위의 KBr 펠릿을 사용하여 푸리에 변환-적외선 분광법(FTIR)을 수행하여 NP 및 NC의 표면 작용기 거동을 연구합니다.
- X선 회절(XRD)을 수행하여 PVA, NP 및 NC의 결정학적 구조를 연구합니다.
- Brunauer-Emmett-Teller(BET; N2 흡착-탈착 등온선) 방법을 사용하여 상대 압력(P/P o) 범위 0.05-0.35에서 샘플의 비표면적을 계산합니다. BJH(Barrett-Joyner-Harenda) 방법을 사용하여 샘플의 공극 크기 분포를 결정합니다. 마지막으로 -196.15°C에서 모든 NP 및 NC의N2 흡착을 측정합니다.
- 에너지 분산 X선 분광법(SEM-EDX) 및 고해상도 투과 전자 현미경(HRTEM)을 사용한 주사 전자 현미경을 사용하여 형태를 연구하고 NP 및 NC의 구성 연구를 수행합니다.
- Kratos의 특허 받은 자기 침지 렌즈, 전하 중화 시스템 및 구형 미러 분석기와 통합된 시스템에서 X선 광전자 분광법(XPS) 분석을 수행합니다. 외부 탄소의 에너지를 기반으로 피크 에너지를 보정합니다.
참고: 연구원은 특성화 과정에서 모든 표준 절차와 프로토콜을 채택했습니다.
3. 배치 분해 연구
- 250mL의 수용액(수성 용매)에 20ppm의 AO8 염료를 0.06g의 ZnO NP 및 NC 광촉매와 함께 용해시켜 광촉매 실험을 수행합니다.
- 열화 실험을 176.6cm2 원형 유리 반응기에서 도체로 사용합니다. 이 실험에서는 중압 수은 증기 램프(Hg 램프)를 광원으로 사용합니다(λ최대 = 365nm, 125W)28. 조명 전에 NP/NC에서 AO8/CR의 흡착/탈착 평형을 생성하기 위해 30분 동안 어둠 속에서 반응 현탁액을 지속적으로 저어줍니다.
- 20cm 거리에서 반응 혼합물에 빛을 집중시켜 샘플을 직접 조사합니다. 110rpm에서 자기 교반기를 사용하여 용액을 지속적으로 혼합합니다. 물 순환을 사용하여 실험하는 동안 전체 반응기의 온도를 제어합니다.
- 15분마다 5mL의 염료 용액을 추출하여 UV-vis 분광 광도계로 시간 t 의 농도를 측정합니다. 다음 방정식을 사용하여 photocatalytic degradation efficiency의 백분율을 계산합니다.
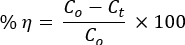
여기서, Co 및 Ct는 각각 AO8 및 CR 염료 용액의 초기 및 시간 t 조사 후 농도입니다. 그리고 η 사진 탈색 효율입니다. - 유사 1차 운동 방정식을 사용하여 반응 역학을 연구합니다.
의사 - 1차 동역학: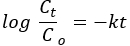
여기서 Co 및 Ct는 각각 AO8 염료의 초기 및 평형 농도(mg/L)이고, k는 속도 상수이며, t는 시간(분)입니다.
결과
그림 1A는 DTG 기기가 N2 대기에서 소성을 분석하기 전에 이진 NC의 열 안정성을 보여줍니다. 흡착 된 H2O 분자의 기화, 분자 내 붕괴, 금속 수산화물 또는 / 및 PVA 측쇄 분해, 분자 간 / PVA 주쇄 분해 및 마지막으로 결정 부분이 탄소, 탄화수소 및 회분29,30을 제공하기 위해 발생했다.
NC는 720°C 이상에서 안정성 손실을 보였다. XRD 패턴과 해당 결정면의 회절각은 ZnO NP의 육각형 구조와 일치했습니다(ICSD: 00-036-1451; 그림 1B). ZnO NP는 복합체에 비해 날카로운 피크를 나타냈으며, 이는 NC31의 결정질 특성이 적다는 것을 나타냅니다. ZnO (그림 1C) 및 Mn2O3 (그림 1C)의 결정 구조는 VESTA 3D 이미징 프로그램 소프트웨어를 사용하여 형성되었습니다.
그런 다음 대략적인 평균 결정립 크기는 Debye-Scherrer의 공식을 사용하여 계산되었습니다.
D = Kλ/(β cos θ)
여기서 λ는 X선 방사선의 파장(Cu Kα 방사선의 경우 λ = 0.15418nm)이고, K 는 상수, β는 최대 절반 높이에서의 선 너비, θ는 회절각32입니다. ZnO NP 및 NC의 대략적인 크기는 각각 59nm 및 23nm입니다.
ZnO에 비해 NC에 대한 피크 이동이 없다는 것은 산화물 사이의 국소 이종 접합 만 형성됨을 나타내며 Pearson의 HSAB 이론16 , 17 , 33을 충족합니다. PVA의 XRD 피크는 ZnO 및 NC의 XRD 패턴에서도 관찰되지 않았습니다. 이는 DTG 분석에서 검증된 바와 같이 500°C에서 PVA의 완전한 분해를 보여주었습니다.
기본 기공 형상 모델 중 ZnO NP 및 NC의 BET 플롯은 원통형 모양을 갖는 것으로 나타났습니다(그림 2B)34. IUPAC 분류의 6가지 유형의 흡착 등온선과 4가지 유형의 히스테리시스 루프 중에서 NP 및 NC는 IV형 흡착 등온선 및 H3 히스테리시스 루프35와 일치했습니다. 0.8 P/P0 의 상대 압력에서 급격한 증가는 메조다공성 및 거대다공성 공극 크기 분포의 동시 발생을 보여줍니다36.
BJH(Barrett-Joyner-Halenda) 기공 크기 분포 플롯은 메조다공성 기공 크기 분포의 지배를 보여줍니다(그림 2, 삽입 사진)34. ~3650 cm-1 및 ~1650 cm-1에서 ZnO NP와 NC 모두에 대한 FTIR 스펙트럼의 흡수 대역은 각각 수산기 및 물 분자의 진동에 할당될 수 있습니다(그림 2B). NP와 NC의 형태학적, 구성적, 구조적 특징은 피크의 수와 위치에 영향을 미칠 수 있습니다. 구형 차원에서 1차원, 2차원 또는 3차원 입자로의 형태학적 변형은 띠의 넓어짐과 분할을 유발하는 것으로 여겨집니다37,38. ZnO NP의 경우 흡수 피크가 두 부분으로 나뉘는 반면 NC의 경우 450cm-1에서 하나의 피크만 관찰되었습니다. 파수 이동은 금속-산소 결합39의 강도와 약점에 따라 달라집니다. ZnO (3655 cm-1)에 비해 NC (3560 cm-1)에 대한 더 낮은 파수 / 주파수로의 피크 이동은 Mn2O3 상40의 도입으로 인한 금속-산소 결합의 약화를 확증합니다. 다른 피크의 출현은 합성 41 중에 생성된 전이 불순물 때문일 수 있습니다.
도 3A,B는 ZnO 및 NC 물질의 SEM 이미지를 보여줍니다. SEM 이미지는 ZnO보다 NC에 대한 다공성이 더 높다는 것을 보여주었습니다. 이 결과는 BET 해석을 따릅니다. 다공성이 많은 재료일수록 표면 결함/활성 부위, 전하 전달 및 가시광선 흡수 효율이 커집니다. 또한 EDX 기법에 의한 조성 분석은 1keV, 0.5keV 및 0.45keV에서 각각의 주요 피크를 관찰하여 예측 가능한 Zn, Mn 및 O 원소 조성(그림 3C)의 현실을 확인했습니다. 원소 C와 S는 불순물로 검출되었습니다.
ZnO NP 및 NC의 XPS 스펙트럼 (보충 그림 S1)은 Zn 2p, Mn 2p, O 1s 및 C 1s 화학적 상태의 존재를 확인했다. NC의 고해상도 Mn 2p 궤도 영역은 Mn2 p3/2 및 Mn 2 p1/2의 화학적 상태가 각각 641.1 eV 및 653.2 eV의 결합 에너지에 존재한다는 것을 확증합니다42. Mn 2p3/2와 Mn 2p1/2 사이의 12.1eV의 대략적인 분할 에너지는 Mn3+43의 일반적인 값을 나타냅니다. 마지막으로, NC(1022.7 eV)에서 Zn 2p의 결합 에너지는 순수한 ZnO(1022.0 eV)에 비해 양의 이동을 보여줍니다. 이 이동은 ZnO의 페르미 수준에서 Fe2O3 또는 / 및 Mn2O344,45,46의 페르미 수준으로의 전자 전달에 기인합니다.
TEM 이미지(그림 3D)는 합성된 NC의 크기가 XRD 분석과 일치하는 나노미터 범위(~20 - 50nm)에 있음을 나타냅니다. TEM 이미지는 또한 배향 부착물(oriented attachment)(47)로 알려진 경계에 의해 분리된 쌍둥이 결정체(두 개의 서로 다른 크기의 결정체)의 존재를 시각화합니다. 이 부착은 입자가 공통 결정학적 배향47,48을 공유할 수 있도록 하고 연속 전하 전달 능력(49)의 발생을 돕습니다. SAED 고리에 정확히 존재하는 회절 반점은 ZnO NP의 결정도를 나타냅니다. 고리 바깥쪽의 반점은Mn2, O, 3 (그림 3E)의 존재를 나타낸다.50.
NC용 SAED에서 측정된 평면 간 간격 값은 육각형 wurtzite ZnO 구조를 따릅니다(그림 3E 삽입). HRTEM 이미지에서 0.34nm의 d-간격 값은 α-Mn2O3 (그림 3F) 51,52의 221 개 평면과 일치합니다. HRTEM의 IFFT 이미지에서 감지된 적층 결함은 NC의 다공성 특성을 보여주었습니다(그림 3E 삽입의 IFFT 이미지). 반면에, ZnO에 대한 격자 줄무늬는 NC에 대해서는 나타나지 않았습니다. 이것은 아마도 해상도 동안 결정립의 무작위 선택 때문일 수 있습니다.
도 4A,B는 AO8을 분해하기 위한 ZnO, NP 및 NC의 광분해 활성을 나타낸다. 소량의 흡착은 흡착/탈착 평형 동안 어둠 속에서 발생했습니다. ZnO와 NC는 모두 AO8 염료에서 우수한 광촉매 활성을 보였다.
시간 종속 데이터(C, t/C, o 대 t 및 로그(C, t/C, o) 대 t)는 각각 그림 4C와 삽입에 나와 있습니다. 얻어진 ZnO 및 ZnO-Mn2O3 NC에 대한속도 상수 k는 각각 0.0058 min-1 및 0.0087 min-1로 추론되었다. ZnO NP의 우수한 광촉매 활성은 e-/h+ 재결합을 방지하는 일부 결함(공석)과 관련이 있습니다. 이종접합 전후의 아연과 망간 산화물에 대한 산화환원 전위는 그림 4D(왼쪽)에 나와 있습니다.
이 연구는 그림 4C(오른쪽)에서 볼 수 있듯이 Mn2O3(VB 근처의 페르미 수준)와 ZnO(CB 근처의 페르미 수준)의 밴드갭이 각각 위아래로 이동하여 페르미 수준 안정성을 달성하고 최종적으로 평형을 달성하는 것을 관찰했습니다. AO8 염료에서 이진 NC의 광촉매 활성은 아마도 적절한 끊어진 갭 (유형 III) 밴드 정렬의 형성 때문일 것입니다. 또한, 이종접합의 끊어진 갭 유형은 ZnO의 더 음의 CB 전위에서 Mn2O353,54 의 더 음의 VB 전위로 전자를 전달합니다. 결과적으로, e− 및 h+ 분리를 증가시켜 분해 효율을 향상시켰다55.
밴드 에지 위치는 표면 전하에 따라 달라지지만, 반도체 금속 산화물은 특정 주파수의 빛을 흡수하는 전형적인 밴드갭 에너지를 가지고 있습니다56. 반도체의 경우, H+/H2 환원 전위보다 음의 CB가 더 많고 O2/H2O 환원 전위보다 양의 VB가 더 많은 것이 오염 물질 분해에 결정적이다57. 양호한 전하 전달 특성의 존재는 금속 산화물 사이의 이종접합/국소 접촉의 형성을 보여주며, 이는 e-/h+ 재결합 감소에 눈에 띄는 영향을 미칩니다. 연구 결과와 검토는 그림 4D에서 볼 수 있듯이 이종접합33,46 이후 NC의 가능한 제안된 저하 메커니즘을 제안합니다.
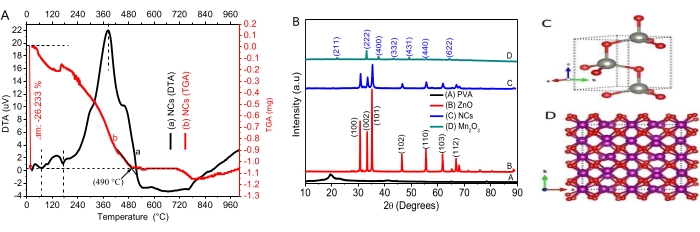
그림 1. 재료 안정성 분석. (A) 소성 전 PVA-ZnO/Mn2O3 의 TGA/DTA 플롯. (B) PVA, ZnO, PVA-ZnO/Mn2O3및Mn2O3의 XRD 패턴; 500 °C에서 소성 된 VESTA 3D 이미징 프로그램 소프트웨어 (빨간색은 O 원자)를 사용하여 생성 된 (C) ZnO 및 (D) Mn2O3 의 볼 앤 스틱 스타일 결정 구조. 이 수치는28에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 2. 질감 특성 및 화학 결합 분석. (A) 500 ° C에서 소성 된 ZnO, Mn2O 3 및 PVA-ZnO/ Mn2O3 의 BET 플롯. 삽입 그림은 BJH 플롯을 보여줍니다. (B) 500 °C에서 소성 된 ZnO NP 및 PVA-ZnO / Mn2O3 샘플의 FT-IR 스펙트럼. 이 수치는28에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
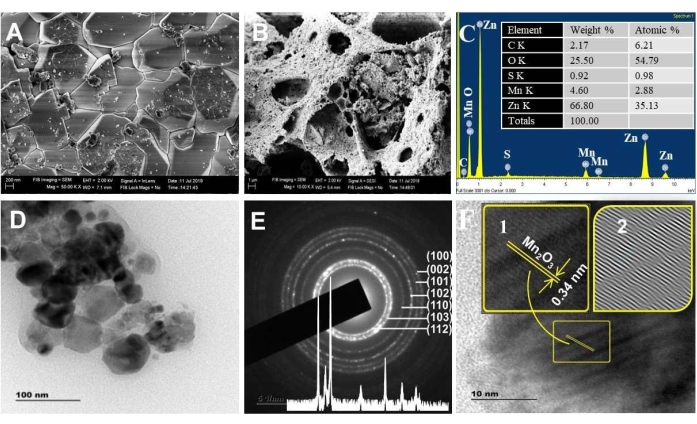
그림 3. 형태학적 분석. (A) ZnO 및 (B) ZnO/Mn2O3, (C) EDXS 스펙트럼의 SEM 이미지는 500°C에서 소성됩니다. C에 삽입된 것은 원소 중량 %와 원자 % 결과입니다. (D) TEM, (E) SAED 및 (F) HRTEM 이미지는 500 ° C에서 소성됩니다. E의 삽입은 XRD 패턴입니다. F의 삽입은 확대된 격자 줄무늬(1)와 IFFT 패턴(2)입니다. 이 수치는28에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
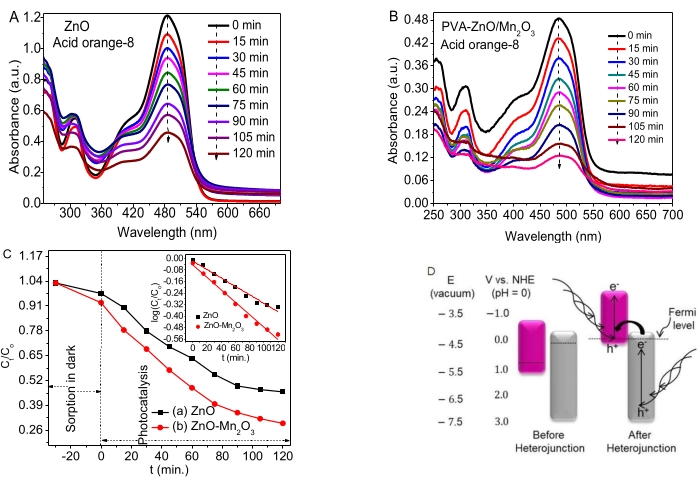
그림 4. ZnO NP 및 ZnO-Mn2O3 NC (A, B) 흡광도 대 ZnO 및 ZnO / Mn2O3 의 파장 플롯. (C) C,t/C, o 대 t 및 로그(C, t/C, o) 대 t 시간 종속 역학 데이터 플롯. (D) 가능한 제안된 메커니즘의 끊어진 갭 유형(왼쪽, 이종접합 전, 오른쪽, 이종접합 후). 이 수치는28에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 S1. 개략도는 고귀한 질량/이온 수송 활성 다공성 나노 스케일 물질을 생산하는 아키텍처 지시 에이전트 보조 용액 연소 합성을 보여줍니다. (A) 전구체 용액; (B) 110°C에서 탈수시 형성된 겔; (C) 기체 부산물의 폭발온도를 점화하기 위해 더 가열하는 단계; (D) 500°C에서 소성 시 생성되는 안정한 다공성 부산물.이 수치는28에서 수정되었습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
현재 프로토콜은 정확한 모양, 크기 및 구조를 가진 상향식 전략을 사용하여 나노 결정의 합성을 설명합니다. 이 연구는 나노 결정을 형성하기 전에 나노 결정의 핵 형성과 성장이 중요하다는 것을 관찰했습니다. 여기서, ZnO와 망간 산화물은 LaMer의 그룹 이론25에 기초하여 합성되었으며, 이는 전구체를 원자와 핵으로 환원시킨 후 나노 결정이 형성되는 과정을 가정하고, 나노 결정을 생성하기 위해 씨앗을 형성합니다. 이와 관련하여, 나노 결정의 전체적인 모양과 크기는 씨앗의 성장, 씨앗의 특성, 계면 활성제 / 캡핑 제의 재 활성화에 의존합니다. 폴리비닐 알코올은 환원 및 캡핑/안정화제로 작용할 수 있습니다58,59. 한편, 연료를 옥시던트로 사용하는 기존의 SG-SCS 방식과 달리 연료를 전혀 사용하지 않고 PVA 폴리머만을 착화 및 캡핑제로 사용했다. 이 경우 물이 용매로 사용되었는데, 다른 연구에서는 독성, 암 유발 및 돌연변이 유발 용매를 사용했기 때문에 일반적이지 않습니다.
이 연구는 HSAB(Hard and Soft Acids and Bases) 이론16,24에 따라 아연과 망간의 반응성을 수정했습니다. 반응성이 낮고 용해성 황산 망간 도펀트는 반응성이 더 높은 질산 아연 전구체와 국소 이종 접합을 형성하는 데 사용되었습니다. 그것은 아연의 핵 형성을 시작했고, 망간 원자는 확산되어 적절한 표면 부위 (계단 및 꼬임)에 부착되었습니다 (26).
감속제, 중성/염화물 기반 또는 산화제/질산염 기반 염 산화제는 SG-SCS로 사용할 수 있습니다. 참고로, 감속제 및 중성/염소 기반 전구체는 추가 산화제가 필요하고 HCl을 방출하여 최종 제품이 오염됩니다. 일반적으로 질산염 전구체는 적절한 산화 전위 및 안정적인 분해 온도와 같은 중요한 특성을 가진 최고의 산화제이며, 이는 순수한 생성물(60) 및 고귀한 용해도(61)를 형성하는 데 도움이 됩니다. 이 작업에서 반응성을 제어하는 데 사용된 황산염 전구체는 높은 분해 온도를 필요로 하는 불순물을 생성했습니다(EDX 분석, 그림 3C 참조). 질산염은 적절한 산화 및 복합체 형성 전위(61)를 갖기 때문에, 질산염 전구체 및 기타 조건이 표면 염 대신에 숙주-도펀트 반응성의 균형을 맞추기 위해 사용되는 것이 제안된다.
이 연구에서 SG-SCS는 콜로이드/졸 형성, 탈수(겔 형성) 및 자체 유지 연소 반응을 포함한 일련의 단계를 따랐습니다 1,62. 이것은 생성물63의 다공성/질감 특성을 개선하는 가스의 진화를 초래했고, 최종적으로 가스 진화에 의한 반응의 소멸을 초래했습니다(보충 그림 1 참조). SG-SCS 공정 중 연소 과정은 여러 지점에서 연소하여 해면질/거품 구조를 형성하거나 한 지점/지점에서 연소를 통해 긴 와이어 구조를 형성할 수 있습니다. 또한, 연소된 물질의 소성은 연소되지 않은 불순물을 분해하는 데 도움이 되고 물질의 결정도를 향상시킵니다(27).
이 연구는 산업적으로 확장 가능한 환경에서 효과적으로 적용할 수 있는 매우 안정적이고 다공성 나노 물질을 생산하기 위한 새로운 시간 및 에너지 효율적인 방법론으로 용액 연소 합성(SCS) 접근 방식을 제시했습니다. SG-SCS 절차는 다공성 ZnO 기반 이진 NC를 성공적으로 합성했습니다. 이 연구는 졸-겔 방법이 합성된 NC에 대한 SAS를 개선한 것을 관찰했습니다. NC의 다공성은 SEM image, SAED ring, BET 분석을 통해 검증하였으며, NC에 최적화된 PVA 열화 온도는 DTG 분석을 통해 500°C로 확인하였다. XRD 및 TEM 이미지 분석을 통해 NP 및 NC의 결정립 크기가 나노 수준임을 확인했습니다. EDX, XPS 및 HRTEM 분석은 구성 및 실제성 조사에 적용되었습니다. 궁극적으로 바이너리 NC는 우수한 AO8 염료 분해를 보여 효율성을 입증했습니다. 일반적으로 언급된 단점을 해결하여 모든 재료를 합리적으로 합성할 수 있으며, SCS는 향후 에너지 장치에 전력을 공급하는 데 비용이 적게 들고 간편하며 시간/에너지 효율적인 방법을 제공할 수 있습니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 작업에 도움을 주신 Adama Science and Technology University에 감사드립니다. 자금은 사우디아라비아 타이프에 있는 타이프 대학교의 타이프 대학교 연구원 지원 프로젝트 번호(TURSP-2020/44)에서 제공되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Acid orange 8 | Sigma-Aldrich | 65%, | |
| Chlorine | Sigma-Aldrich | 7782-50-5 | |
| Dithienogermole | Sigma-Aldrich | 773881-43-9 | |
| HCl | Sigma-Aldrich | 7647-01-0 | |
| Manganese nitrate (10%) salt | Sigma-Aldrich | 15710-66-4 | 10% |
| Manganese sulfate monohydrate | Sigma-Aldrich | Density: 2.95 g/cm³; solubility in water: 70 g/100 mL (70 °C); 99.95%, MnSO4.H2O | |
| Poly (vinyl alcohol) | Sigma-Aldrich | 9002-89-5 | Density: 1.19–1.31 g/cm³ @20 °C, soluble in water only @ > 80 °C |
| Zinc nitrate hexahydrate (90%) | Sigma-Aldrich | 10196-18-6 | 98%; Density: 2.065 g/cm³ @20 °C; solubility in water: 184.3 g/100 mL @20 °C |
| Instruments used | |||
| Materials name | Model | Analysis | |
| BET (N2 adsorption-desorption isotherms) | Quanta chrome instrument. | Textural properties | |
| DT/DTA | Shimadzu DTG-60H | Measure thermal stability | |
| FTIR | Perkin Elmer FT-IR, Spectrum 65 | Chemical bonding information | |
| HRTEM | JEOL TEM 2100 HRTEM | Morphological, size, and composition analysis | |
| SEM-EDX | SEM-EDX-EVO 18 with low vacuum facility and ALTO 1000 cryo attachment | Morphological analysis | |
| XPS | AXIS ULTRA from AXIS 165 | ||
| XRD | Shimadzu, XRD-7000 | Crystallinity, structure, and approximate average crystallite size | |
| Common software used | |||
| Name | Company | Use | |
| Mendeley | Mendeley-Desktop-1.19.8-win32 | For citing references | |
| Origin | OriginPro 8 | XRD, BET, UV-vis-DRS data analysis |
참고문헌
- Khort, A., et al. Corrosion and transformation of solution combustion synthesized Co, Ni and CoNi nanoparticles in synthetic freshwater with and without natural organic matter. Scientific Reports. 11 (1), 7860 (2021).
- Pype, M., Lawrence, M. G., Keller, J., Gernjak, W. Reverse osmosis integrity monitoring in water reuse: The challenge to verify virus removal - A review. Water Research. 98, 384-395 (2016).
- Adeleye, A. S., et al. Engineered nanomaterials for water treatment and remediation: Costs, benefits, and applicability. Chemical Engineering Journal. 286, 640-662 (2016).
- Gómez-Pastora, J., et al. Review and perspectives on the use of magnetic nanophotocatalysts (MNPCs) in water treatment. Chemical Engineering Journal. 310 (2), 407-427 (2017).
- Nadeem, M. S., et al. Enhancement in the photocatalytic and antimicrobial properties of ZnO nanoparticles by structural variations and energy bandgap tuning through Fe and Co co-doping. Ceramics International. 47 (8), 11109-11121 (2021).
- Nadeem, M. S., et al. Energy-levels well-matched direct Z-scheme ZnNiNdO/CdS heterojunction for elimination of diverse pollutants from wastewater and microbial disinfection. Environmental Science and Pollution Research International. , (2022).
- Munawar, T., Iqbal, F., Yasmeen, S., Mahmood, K., Hussain, A. Multi metal oxide NiO-CdO-ZnO nanocomposite-Synthesis, structural, optical, electrical properties and enhanced sunlight driven photocatalytic activity. Ceramics International. 46 (2), 2421-2437 (2020).
- Srinivasa, N., et al. Facile synthesis of Ni/NiO nanocomposites: The effect of Ni content in NiO upon the oxygen evolution reaction within alkaline media. RSC Advances. 11 (24), 14654-14664 (2021).
- Chen, P., et al. Solution combustion synthesis of ternary Ni/WC/C composites with efficient electrocatalytic oxygen reduction performance. RSC Advances. 11 (61), 38718-38726 (2021).
- Nagvenkar, A. P., Perelshtein, I., Piunno, Y., Mantecca, P., Gedanken, A. Sonochemical one-step synthesis of polymer-capped metal oxide nanocolloids: Antibacterial activity and cytotoxicity. ACS Omega. 4 (9), 13631-13639 (2019).
- Janotti, A., Van de Walle, C. G. Fundamentals of zinc oxide as a semiconductor. Reports on Progress in Physics. 72 (12), 126501 (2009).
- Abebe, B., Murthy, H. C. A., Amare, E. Enhancing the photocatalytic efficiency of ZnO: Defects, heterojunction, and optimization. Environmental Nanotechnology, Monitoring. & Management. 14, 100336 (2020).
- Abebe, B., Murthy, H. C. A., Zereffa, E. A. Multifunctional application of PVA-aided Zn-Fe-Mn coupled oxide nanocomposite. Nanoscale Research Letters. 16, 1 (2021).
- Shekofteh-Gohari, M., Habibi-Yangjeh, A. Fe3O4/ZnO/CoWO4 nanocomposites: Novel magnetically separable visible-light-driven photocatalysts with enhanced activity in degradation of different dye pollutants. Ceramics International. 43 (3), 3063-3071 (2017).
- Saravanan, R., Gupta, V. K. K., Narayanan, V., Stephen, A. Visible light degradation of textile effluent using novel catalyst ZnO/γ-Mn2O3. Journal of the Taiwan Institute of Chemical Engineers. 45 (4), 1910-1917 (2014).
- Buonsanti, R., Milliron, D. J. Chemistry of doped colloidal nanocrystals. Chemistry of Materials. 25 (8), 1305-1317 (2013).
- Hu, H., He, H., Zhang, J., Hou, X., Wu, P. Optical sensing at the nanobiointerface of metal ion-optically-active nanocrystals. Nanoscale. 10 (11), 5035-5046 (2018).
- Deganello, F., Tyagi, A. K. Solution combustion synthesis, energy and environment: Best parameters for better materials. Progress in Crystal Growth and Characterization of Materials. 64 (2), 23-61 (2018).
- Buonsanti, R., et al. Assembly of ligand-stripped nanocrystals into precisely controlled mesoporous architectures. Nano Letters. 12 (7), 3872-3877 (2012).
- Li, F., Ran, J., Jaroniec, M., Qiao, S. Z. Solution combustion synthesis of metal oxide nanomaterials for energy storage and conversion. Nanoscale. 7 (42), 17590-17610 (2015).
- Williams, T. E., et al. Nearest-neighbour nanocrystal bonding dictates framework stability or collapse in colloidal nanocrystal frameworks. Chemical Communications. 53 (35), 4853-4856 (2017).
- Helms, B. A., Williams, T. E., Buonsanti, R., Milliron, D. J. Colloidal nanocrystal frameworks. Advanced Materials. 27 (38), 5820-5829 (2015).
- Liu, B., et al. Synthesis of ZnO nano-powders via a novel PVA-assisted freeze-drying process. RSC Advances. 6 (111), 110349-110355 (2016).
- Abebe, B., Murthy, H. C. A. Insights into ZnO-based doped porous nanocrystal frameworks. RSC Advances. 12 (10), 5816-5833 (2022).
- LaMer, V. K., Dinegar, R. H. Theory, production and mechanism of formation of monodispersed hydrosols. Journal of the American Chemical Society. 72 (11), 4847-4854 (1950).
- Jun, Y. -. S., et al. Classical and nonclassical nucleation and growth mechanisms for nanoparticle formation. Annual Review of Physical Chemistry. 73, 453-477 (2022).
- Gao, Y., Meng, F., Li, X., Wen, J. Z., Li, Z. Factors controlling nanosized Ni-Al 2 O 3 catalysts synthesized by solution combustion for slurry-phase CO methanation: the ratio of reducing valences to oxidizing valences in redox systems. Catalysis Science & Technology. 6 (21), 7800-7811 (2016).
- Abebe, B., Zereffa, E. A., Murthy, H. C. A. Synthesis of poly(vinyl alcohol)-aided ZnO/Mn 2 O 3 nanocomposites for acid orange-8 dye degradation: Mechanism and antibacterial activity. ACS Omega. 6 (1), 954-964 (2021).
- Kumar, S., Krishnakumar, B., Sobral, A. J. F. N., Koh, J. Bio-based ( chitosan / PVA / ZnO ) nanocomposites fi lm Thermally stable and photoluminescence material for removal of organic dye. Carbohydrate Polymers. 205, 559-564 (2019).
- Dai, Y., et al. Enhanced mechanical, thermal, and UV-shielding properties of poly(vinyl alcohol)/metal-organic framework nanocomposites. RSC Advances. 8 (67), 38681-38688 (2018).
- Munawar, T., et al. Novel tri-phase heterostructured ZnO-Yb2O3-Pr2O3 nanocomposite; structural, optical, photocatalytic and antibacterial studies. Ceramics International. 46 (8), 11101-11114 (2020).
- Mukhtar, F., et al. Enhancement in carrier separation of ZnO-Ho2O3-Sm2O3 hetrostuctured nanocomposite with rGO and PANI supported direct dual Z-scheme for antimicrobial inactivation and sunlight driven photocatalysis. Advanced Powder Technology. 32 (10), 3770-3787 (2021).
- Lachheb, H., et al. Electron transfer in ZnO-Fe 2 O 3 aqueous slurry systems and its effects on visible light photocatalytic activity. Catalysis Science & Technology. 7 (18), 4041-4047 (2017).
- Thommes, M., et al. Physisorption of gases, with special reference to the evaluation of surface area and pore size distribution (IUPAC Technical Report). Pure and Applied Chemistry. 87 (9-10), 1051-1069 (2015).
- Kumar, P., Kim, K. -. H., Kwon, E. E., Szulejko, J. E. Metal-organic frameworks for the control and management of air quality: advances and future direction. Journal of Materials Chemistry A. 4 (2), 345-361 (2016).
- Liu, J., et al. NiO-PTA supported on ZIF-8 as a highly effective catalyst for hydrocracking of Jatropha oil. Scientific Reports. 6, 23667 (2016).
- Fatehah, M. O., Aziz, H. A., Stoll, S. Stability of ZnO nanoparticles in solution. Influence of pH, dissolution, aggregation and disaggregation effects. Journal of Colloid Science and Biotechnology. 3 (1), 75-84 (2014).
- Sigoli, F. A., Davolos, M. R., Jafelicci, M. Morphological evolution of zinc oxide originating from zinc hydroxide carbonate. Journal of Alloys and Compounds. 262-263, 292-295 (1997).
- Wachs, I. E. Raman and IR studies of surface metal oxide species on oxide supports: Supported metal oxide catalysts. Catalysis Today. 27 (3-4), 437-455 (1996).
- Parler, C. M., Ritter, J. A., Amiridis, M. D. Infrared spectroscopic study of sol-gel derived mixed-metal oxides. Journal of Non-Crystalline Solids. 279 (2-3), 119-125 (2001).
- Anžlovar, A., Kogej, K., Crnjak Orel, Z., Žigon, M. Polyol mediated nano size zinc oxide and nanocomposites with poly(methyl methacrylate). Express Polymer Letters. 5 (7), 604-619 (2011).
- Saravanan, R., et al. ZnO/Ag/Mn 2 O 3 nanocomposite for visible light-induced industrial textile effluent degradation, uric acid and ascorbic acid sensing and antimicrobial activity. RSC Advances. 5 (44), 34645-34651 (2015).
- Yang, G., Yan, W., Wang, J., Yang, H. Fabrication and formation mechanism of Mn 2 O 3 hollow nanofibers by single-spinneret electrospinning. CrystEngComm. 16 (30), 6907-6913 (2014).
- Liu, Y., et al. A magnetically separable photocatalyst based on nest-like γ-Fe 2 O 3 /ZnO double-shelled hollow structures with enhanced photocatalytic activity. Nanoscale. 4 (1), 183-187 (2012).
- Hu, Y., et al. A microwave-assisted rapid route to synthesize ZnO/ZnS core-shell nanostructures via controllable surface sulfidation of ZnO nanorods. CrystEngComm. 13 (10), 3438-3443 (2011).
- Zhang, J., et al. Synthesis and gas sensing properties of α-Fe 2 O 3 @ ZnO core-shell nanospindles. Nanotechnology. 22 (18), 185501 (2011).
- Penn, R. L. Imperfect oriented attachment: Dislocation generation in defect-free nanocrystals. Science. 281 (5379), 969-971 (1998).
- Zhang, J., Huang, F., Lin, Z. Progress of nanocrystalline growth kinetics based on oriented attachment. Nanoscale. 2 (1), 18-34 (2009).
- Zeng, Z., et al. A fluorescence-electrochemical study of carbon nanodots (CNDs) in bio- and photoelectronic applications and energy gap investigation. Physical Chemistry Chemical Physics. 19 (30), 20101-20109 (2017).
- Zhai, T., et al. Controllable synthesis of hierarchical ZnO nanodisks for highly photocatalytic activity. CrystEngComm. 14 (5), 1850-1855 (2012).
- Li, N., et al. Efficient removal of chromium from water by Mn3O4 @ZnO/Mn3O4 composite under simulated sunlight irradiation: Synergy of photocatalytic reduction and adsorption. Applied Catalysis B: Environmental. 214, 126-136 (2017).
- Abebe, B. Polymer assisted colloidal nanocrystal framework synthesis: Sol-gel approach. Materials Research Express. 8 (12), 125005 (2021).
- Jiamprasertboon, A., et al. Heterojunction α-Fe2O3/ZnO films with enhanced photocatalytic properties grown by aerosol-assisted chemical vapour deposition. Chemistry - A European Journal. 25 (48), 11337-11345 (2019).
- Mukhtar, F., et al. Dual S-scheme heterojunction ZnO-V2O5-WO3 nanocomposite with enhanced photocatalytic and antimicrobial activity. Materials Chemistry and Physics. 263, 124372 (2021).
- Marschall, R. Semiconductor composites: Strategies for enhancing charge carrier separation to improve photocatalytic activity. Advanced Functional Materials. 24 (17), 2421-2440 (2013).
- Beranek, R. (Photo)electrochemical methods for the determination of the band edge positions of TiO 2-based nanomaterials. Advances in Physical Chemistry. 2011, 786759 (2011).
- Hoffmann, M. R., Martin, S. T., Choi, W., Bahnemann, D. W. Environmental applications of semiconductor photocatalysis. Chemical Reviews. 95 (1), 69-96 (1995).
- Wu, Y., Wang, D., Li, Y. Understanding of the major reactions in solution synthesis of functional nanomaterials. Science China Materials. 59, 938-996 (2016).
- Xia, Y., Xiong, Y., Lim, B., Skrabalak, S. E. Shape-controlled synthesis of metal nanocrystals: Simple chemistry meets complex physics. Angewandte Chemie. 48 (1), 60-103 (2008).
- Kim, S. J., Yoon, S., Kim, H. J. Review of solution-processed oxide thin-film transistors. Japanese Journal of Applied Physics. 53, (2014).
- Zhang, J., Guo, Q., Liu, Y., Cheng, Y. Preparation and characterization of Fe2O3/Al2O3 using the solution combustion approach for chemical looping combustion. Industrial & Engineering Chemistry Research. 51 (39), 12773-12781 (2012).
- Novitskaya, E., Kelly, J. P., Bhaduri, S., Graeve, O. A. A review of solution combustion synthesis: an analysis of parameters controlling powder characteristics. International Materials Reviews. 66 (3), 188-214 (2021).
- González-Cortés, S. L., Imbert, F. E. Fundamentals, properties and applications of solid catalysts prepared by solution combustion synthesis (SCS). Applied Catalysis A: General. 452, 117-131 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유