Method Article
Heterojunción de óxido metálico para actividades fotocatalíticas
En este artículo
Resumen
El desarrollo de una heterojunción impulsa las actividades fotocatalíticas de la síntesis de combustión en solución, que es un proceso eficiente en tiempo y energía. En este protocolo se utilizaron técnicas avanzadas de caracterización analítica para evaluar las características de los materiales, y los nanocompuestos demostraron una mejor degradación del colorante ácido naranja-8.
Resumen
Existe una importante demanda mundial de mejoras en las técnicas de síntesis y sus características óptimas, especialmente para aplicaciones a escala industrial. La síntesis de combustión en solución basada en sol-gel (SG-SCS) es un método simple para producir materiales porosos ordenados. En este sentido, la teoría de ácidos y bases duros y blandos de Pearson ayuda a seleccionar la reactividad del huésped-dopante para formar una heterojunción adecuada.
La formación de una heterojunción también cambia las propiedades esenciales de los materiales, mejorando la fotocatálisis a través de la transferencia de carga o actividades sinérgicas. Una temperatura de calcinación de 500 °C es ideal para este proceso basándose en los resultados de la evaluación de la estabilidad mediante un análisis de relación termogravimétrica diferencial (DTG).
Las dimensiones a nanoescala de las nanopartículas (NPs) y nanocomposites (NCs) generados se validaron mediante difracción de rayos X y microscopía electrónica de transmisión de alta resolución (HRTEM). Además, las micrografías de microscopía electrónica de barrido y los análisis BET confirmaron la naturaleza porosa de los materiales. Las investigaciones HRTEM, espectroscopía de fotoelectrones de rayos X y rayos X de dispersión de energía establecieron la composición de los materiales. El estudio encontró que los NC degradaron el color naranja ácido 8 (AO8) de manera más eficiente que el ZnO desnudo.
Introducción
La protección del medio ambiente se ha convertido en una preocupación importante con el rápido aumento de las empresas en todo el mundo. En consecuencia, los nanomateriales (NM) basados en la nanotecnología y su síntesis han atraído la atención de los investigadores sobre los materiales a granel en el mundo científico moderno1. Varios enfoques fisicoquímicos han sido adaptados para el tratamiento de contaminantes orgánicos e inorgánicos 2,3. En este sentido, debido a su simplicidad y capacidad de disolver toxinas sin crear contaminación secundaria, la fotocatálisis heterogénea se considera una técnica de remediación adaptativa4. Los estudios han diseñado una heterounión o dopaje entre semiconductores de banda prohibida adecuados, lo que ayuda a reducir la recombinación electrón-hueco, el área de superficie y el volumen del constituyente. Posteriormente, esta condición aumentó la degradación fotocatalítica de los colorantes 5,6,7. Trabajos recientes también han informado de un papel sinérgico y de mejora de la transferencia de cargadores a través de heterouniones/híbridos 8,9, y los óxidos metálicos semiconductores demuestran propiedades físicas y químicas únicas para aplicaciones multifuncionales10. Como resultado, elTiO2 y las NPs de óxido de zinc (NnO NPs) han recibido una atención significativa11,12 entre los investigadores.
En comparación con los materiales individuales, la formación de una heterounión se ha convertido en una de las preferencias únicas para aumentar el área de superficie y la relación de volumen de los materiales y mejorar el rendimiento fotocatalítico y antibacteriano de un material. Además, el impacto sinérgico de las heterouniones binarias mejora la separación de los pares electrón/hueco fotogenerados en comparación con las heterouniones binarias13,14. Los estudios han demostrado que una heterounión entre Mn2O3 y ZnO NPs15 mejora la estabilidad y la capacidad de adsorción del sustrato y reduce la resistencia a la transferencia de carga en las NP sintetizadas. Además, varios estudios han utilizado la reactividad del huésped-dopante basada en la teoría de ácidos y bases duros y blandos (HSAB) de Pearson para probar la heterojunción o la formación de dopantes. Se encontró que los ácidos duros de Lewis (como el Mn(III)) no pueden difundirse en el límite de la red huésped de Zn (II) en presencia de un solvente de base dura como el agua16,17. Se adsorben en la superficie del huésped y se oxidan para formar un híbrido tras la calcinación.
Debido a su potencial, el enfoque global actual para las aplicaciones industrialmente escalables de la síntesis de materiales se centra en mejorar el enfoque y sus perspectivas críticas13. La síntesis de combustión en solución (SCS) es un método simple, eficiente en tiempo y energía para crear materiales porosos ordenados regularmente18, que juegan un papel importante en el fenómeno de transporte de iones/masa19. El SCS comprende una distribución decente de dopante-huésped o heterojunción basada en la teoría de ácidos y bases duros y blandos (HSAB) de Pearson. El dopaje/heterojunción puede ajustar las propiedades ópticas, magnéticas y eléctricas de los materiales, impulsando posteriormente la aplicación de materiales a través de una transferencia de carga efectiva y/o funciones sinérgicas20. El SCS asistido por agente directivo de arquitectura (ADA) también puede producir marcos de nanocristales coloidales ordenados (CNF) utilizados para el transporte de masa/iones en dispositivos de conversión de energía 21,22.
Este estudio produjo un surfactante y agente complejante de alcohol polivinílico (PVA) para sintetizar NPs de ZnO y heterojunción de nanocompuestos binarios (NCs) basados en ZnO a través de un enfoque SG-SCS respetuoso con el medio ambiente. La heterojunción entre los óxidos, que desempeña un papel vital en la transferencia de carga, se estimó con base en la teoría HSAB. Se utilizaron técnicas de caracterización para comprender las propiedades estructurales, ópticas y morfológicas de los materiales. La eficiencia de degradación del material se probó tanto en tintes AO8 estables como tóxicos.
Protocolo
1. Síntesis de nanomateriales
- Síntesis de nanocompuestos ZnO-Mn2O3
- Sintetizar nanocompuestos utilizando alcohol polivinílico como surfactante y un enfoque SG-SCS asistido por agentes complejantes. Para una ilustración gráfica del enfoque SG-SCS, véase la figura complementaria S1.
- Disuelva 1,5 g de polímero PVA en 100 ml de agua destilada con agitación continua en un agitador magnético durante unos 15 minutos a 115 °C23.
- Vierta las soluciones precursoras de sal, el nitrato de zinc hexahidratado a una concentración del 90% v/v y el sulfato de manganeso a una concentración del 10% v/v en la solución de PVA disuelta anteriormente con agitación continua durante unos 10 minutos y disminuya la temperatura a 70 °C.
NOTA: Los precursores de sal se mezclaron simultáneamente para equilibrar la reactividad de los precursores nanocompuestos para seguir el enfoque de nucleación-dopaje16,24. La temperatura se redujo a 70 °C para controlar el crecimiento acelerado y la agregación de las nanopartículas, siguiendo el modelo de La Mar25,26. - Envejezca el sol (partículas coloidales) desarrolladas por el hidróxido metálico manteniéndolo en un área cerrada y oscura durante 2 días. A continuación, deshidrata la solución calentándola a 110 °C (en el aire) para formar un gel.
NOTA: El polímero PVA actúa como una arquitectura, dirigiendo plantillas y agentes complejantes, que ayudan en la dispersión homogénea de cationes metálicos, iniciando el proceso de combustión y evitando las propiedades de agregación/aglomeración. - Someter el gel a la combustión en el aire calentando el horno a una temperatura de ignición de ~150-250 °C (temperatura aproximada comprobada con un termómetro simple). La temperatura de ignición es la temperatura mínima requerida para iniciar la combustión. Durante la combustión, use campanas para recolectar todos los subproductos de gases tóxicos que afectan la salud humana.
NOTA: El proceso de combustión se activó formando complejos entre el polímero PVA y los precursores de nitratos, que actúan como combustible para facilitar el proceso de combustión. - Calcinar los materiales quemados durante 3 h a 500 °C en un horno de mufla, optimizado mediante la técnica analítica de termogravimetría diferencial (DTG). El DTG descompone las impurezas no quemadas y mejora la cristalinidad de los materiales27.
- Síntesis de ZnO desnudo y Mn2O3 NPs
- Sintetice óxidos de metal desnudo utilizando el enfoque sol-gel. Sintetice ZnO y Mn2O3 desnudos sin PVA utilizando todos los pasos mencionados anteriormente, pasos 1.1.1.-1.1.6., excepto el paso 1.1.2. Debido a la ausencia de los complejos de nitrato metálico y polímero PVA, no se produce ningún proceso de autopropagación durante el paso final de secado.
2. Caracterización de NP
- Determinar la relación termogravimétrica, específicamente la térmica termogravimétrica/térmica diferencial (análisis DT/DTA), en una atmósfera de nitrógeno a un caudal de 20.0 mL/min y un tiempo de rampa de 50 °C/min para estudiar la estabilidad térmica y el comportamiento de degradación de los NPs y NCs.
- Realizar la espectroscopia infrarroja por transformada de Fourier (FTIR) utilizando pellets KBr en el rango de 400-4000 cm-1 para estudiar el comportamiento del grupo funcional de superficie de NPs y NCs.
- Realizar difracción de rayos X (XRD) para estudiar la estructura cristalográfica de PVA, NP y NC.
- Utilice el Brunauer-Emmett-Teller (BET; N2 isotermas de adsorción-desorción) para calcular el área superficial específica de las muestras en el rango de presión relativa (P/Po) de 0,05-0,35. Determine las distribuciones del tamaño de los poros de las muestras utilizando el método de Barrett-Joyner-Halenda (BJH). Por último, mida la sorción de N2 de todas las NP y NC a -196,15 °C.
- Utilice la microscopía electrónica de barrido con espectroscopía de rayos X de dispersión de energía (SEM-EDX) y la microscopía electrónica de transmisión de alta resolución (HRTEM) para estudiar las morfologías y realizar estudios de composición de las NP y NC.
- Realice un análisis de espectroscopia de fotoelectrones de rayos X (XPS) en un sistema integrado con una lente de inmersión magnética patentada por Kratos, un sistema de neutralización de carga y un analizador de espejo esférico. Calibrar las energías máximas en función de la energía del carbono externo.
NOTA: El investigador adoptó todos los procedimientos y protocolos estándar durante el proceso de caracterización.
3. Estudios de degradación de lotes
- Realice el experimento fotocatalítico disolviendo 20 ppm de colorante AO8 en 250 mL de solución acuosa (solvente acuoso) con 0.06 g de fotocatalizadores de ZnO NPs y NCs.
- Utilice el experimento de degradación como conductor en un reactor de vidrio circular de 176,6cm2 . Para este experimento, utilice una lámpara de vapor de mercurio de presión media (lámpara de Hg) como fuente de luz (λmax = 365 nm, 125 W)28. Antes de la iluminación, agite la suspensión de reacción continuamente en la oscuridad durante 30 minutos para crear el equilibrio de adsorción/desorción de AO8/CR en las NPs/NCs.
- Irradie las muestras directamente enfocando la luz en la mezcla de reacción desde una distancia de 20 cm. Utilice un agitador magnético a 110 rpm para mezclar continuamente la solución. Controle la temperatura del reactor general durante el experimento utilizando la circulación de agua.
- Extraiga 5 mL de la solución de colorante cada 15 min para medir sus concentraciones en el tiempo t con un espectrofotómetro UV-vis. Calcule el porcentaje de eficiencia de la degradación fotocatalítica utilizando la ecuación:
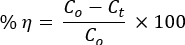
donde Co y Ct son las concentraciones de irradiación inicial y después del tiempo t , respectivamente, de la solución de colorantes AO8 y CR; y η es la eficiencia de la decoloración de la foto, - Utilice la ecuación cinética de pseudo-primer orden para estudiar la dinámica de reacción:
Cinética pseudo - de primer orden: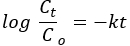
donde Co y Ct son las concentraciones inicial y de equilibrio del colorante AO8 (mg/L), respectivamente, k es la constante de velocidad y t es el tiempo en minutos.
Resultados
La Figura 1A muestra las estabilidades térmicas de los NC binarios antes de que un instrumento DTG analice la calcinación en la atmósfera N2. Se produjo una secuencia de vaporización de moléculas deH2O adsorbidas, desintegración intramolecular, hidróxidos metálicos y/o descomposición de la cadena lateral del PVA, descomposición de la cadena principal intermolecular/PVA y, finalmente, la parte cristalina dio carbono, hidrocarburos y cenizas29,30.
Los NC mostraron una pérdida de estabilidad por encima de 720 °C. Los ángulos de difracción del patrón XRD con sus correspondientes planos cristalinos cumplían con la estructura hexagonal de las NPs de ZnO (ICSD: 00-036-1451; Figura 1B). Las NPs de ZnO exhibieron picos agudos en comparación con los compuestos, lo que indica las propiedades menos cristalinas de las NCs31. Las estructuras cristalinas de ZnO (Figura 1C) y Mn2O3 (Figura 1C) se formaron utilizando el software del programa de imágenes VESTA 3D.
A continuación, se calcularon los tamaños medios aproximados de los cristalitos utilizando la fórmula de Debye-Scherrer:
D = Kλ/(β cos θ)
donde λ es la longitud de onda de la radiación de rayos X (para la radiación Cu Kα, λ = 0,15418 nm), K es la constante, β es el ancho de línea a la media altura máxima y θ es el ángulo de difracción32. Los tamaños aproximados para las NP y NC de ZnO son 59 nm y 23 nm, respectivamente.
La ausencia de cambios de pico para los NC en relación con el ZnO indica la formación de solo heterouniones locales entre óxidos, cumpliendo con la teoría HSAB de Pearson 16,17,33. Los picos XRD de PVA tampoco se observaron en los patrones XRD de ZnO y NCs. Esto mostró una descomposición completa del PVA a 500 °C, según lo validado en el análisis DTG.
Entre los modelos básicos de forma de poro, los gráficos BET de NPs y NCs de ZnO parecían tener formas cilíndricas (Figura 2B)34. Entre los seis tipos de isotermas de adsorción y los cuatro tipos de bucles de histéresis de la clasificación IUPAC, las NP y NC se emparejaron con la isoterma de adsorción tipo IV y el bucle de histéresis H335. El brusco aumento a la presión relativa de 0,8 P/P0 muestra la co-ocurrencia de distribuciones de tamaño de poro mesoporosas y macroporosas36.
Los gráficos de distribución del tamaño de poro de Barrett-Joyner-Halenda (BJH) muestran el dominio de la distribución del tamaño de poro mesoporoso (recuadro de la Figura 2)34. Las bandas de absorción de los espectros FTIR para NPs y NCs de ZnO a ~3650 cm-1 y ~1650 cm-1 se pueden asignar a las vibraciones de los grupos hidroxilo y las moléculas de agua, respectivamente (Figura 2B). Las características morfológicas, composicionales y estructurales de las NP y NC posiblemente influyan en el número y la posición de los picos. Se cree que la modificación morfológica de la dimensión esférica a partículas unidimensionales o tridimensionales causa la amplitud y la división de las bandas37,38. Para las NPs de ZnO, los picos de absorción se dividieron en dos partes, mientras que para las NCs, solo se observó un pico a 450 cm-1. El cambio del número de onda depende de la fuerza y debilidad del enlace metal-oxígeno39. El cambio de pico hacia un número de onda/frecuencia más bajo para NC (3560 cm-1) en comparación con ZnO (3655 cm-1) corrobora el debilitamiento del enlace metal-oxígeno debido a la introducción de la fase40 deMn2O3. La aparición de otros picos podría deberse a las impurezas transitorias producidas durante la síntesis 41.
La Figura 3A,B muestra las imágenes SEM de materiales ZnO y NC. Las imágenes SEM revelaron una mayor porosidad para los NC que para el ZnO. Este resultado cumple con la interpretación de BET. Cuanto más porosos sean los materiales, mayores serán los defectos superficiales/sitios activos, la transferencia de carga y la eficiencia de absorción de luz visible. Además, el análisis composicional por la técnica EDX verificó la realidad de las composiciones elementales predecibles de Zn, Mn y O (Figura 3C), con la observación de los respectivos picos principales a 1 keV, 0,5 keV y 0,45 keV. Los elementos C y S se detectaron como impurezas.
El espectro XPS de ZnO NPs y NCs (Figura Suplementaria S1) confirmó la existencia de estados químicos Zn 2p, Mn 2p, O1s y C 1s. La región orbital de alta resolución de Mn 2p en los NC corrobora que los estados químicos de Mn 2 p3/2 y Mn 2 p1/2 están presentes a las energías de enlace de 641,1 eV y 653,2 eV, respectivamente42. La energía de división aproximada de 12,1 eV entre Mn 2p3/2 y Mn 2p1/2 representa un valor típico para Mn3+43. Por último, la energía de enlace del Zn 2p en los NC (1022,7 eV) muestra un cambio positivo en comparación con la del ZnO puro (1022,0 eV). Este cambio se debe a la transferencia de electrones del nivel de Fermi de ZnO al nivel de Fermi de Fe2O3 o/o Mn2O3 44,45,46.
Las imágenes TEM (Figura 3D) indican que los tamaños de los NC sintetizados estaban en el rango nanométrico (~20 - 50 nm), lo que coincide con el análisis XRD. Las imágenes TEM también visualizan la presencia de cristalitos gemelos (dos cristalitos de diferentes tamaños) separados por un límite conocido como accesorio orientado47. Esta unión permite que las partículas compartan una orientación cristalográfica común47,48 y ayuda en la ocurrencia de la capacidad de transferencia de carga continua49. Los puntos de difracción presentes exactamente en el anillo SAED indican la cristalinidad de las NP de ZnO. Las manchas fuera del anillo representan la presencia de Mn2O3 (Figura 3E)50.
Los valores de espaciamiento interplanar medidos de SAED para NC cumplen con la estructura hexagonal de Wurtzita ZnO (recuadro de la Figura 3E). El valor de espaciado d de 0,34 nm de la imagen HRTEM coincide con los 221 planos de α-Mn2O3 (Figura 3F)51,52. Las fallas de apilamiento detectadas en la imagen IFFT de HRTEM revelaron las propiedades porosas de los NC (imágenes IFFT del recuadro de la Figura 3E). Por otro lado, la franja de celosía para el ZnO no se observó para los NC. Esto se debe posiblemente a la selección aleatoria del cristalito durante la resolución.
La Figura 4A,B muestra las actividades de fotodegradación de las NPs y NCs de ZnO para degradar el AO8. Un pequeño porcentaje de adsorción ocurrió en la oscuridad durante el equilibrio de adsorción/desorción. Tanto el ZnO como los NCs mostraron buenas actividades fotocatalíticas en el colorante AO8.
Los datos dependientes del tiempo (Ct/Co vs. t y log (Ct/Co) vs. t) se dan en la Figura 4C y en el recuadro, respectivamente. Se dedujo que los valores de la constante de velocidad, k, para los NC de ZnO y ZnO-Mn2O3 fueron 0,0058 min−1 y 0,0087 min−1, respectivamente. Las buenas actividades fotocatalíticas de las NPs de ZnO se asocian con algunos defectos (vacantes) que impiden la recombinación e-/h+ . Los potenciales redox para los óxidos de zinc y manganeso antes y después de la heterounión se muestran en la Figura 4D (izquierda).
El estudio observó que las bandas prohibidas de Mn2O3 (nivel de Fermi cerca del VB) y ZnO (nivel de Fermi cerca del CB) se mueven hacia arriba y hacia abajo, respectivamente para alcanzar su estabilidad de nivel de Fermi y, finalmente, alcanzar el equilibrio, como se ve en la Figura 4C (derecha). La actividad fotocatalítica de los NC binarios sobre el colorante AO8 probablemente se deba a la formación de una alineación de banda de separación rota (tipo III) adecuada. Además, el tipo de heterojunción de espacio roto transfiere los electrones del potencial CB más negativo del ZnO al potencial VB más negativo de Mn2O353,54. En consecuencia, se incrementó la separación e− y h+ para mejorar la eficiencia de la degradación55.
A pesar de que la posición del borde de la banda depende de la carga de la superficie, los óxidos metálicos semiconductores tienen una energía de banda prohibida típica, que absorbe una frecuencia específica de luz56. En el caso de los semiconductores, tener un potencial de reducción de CB más negativo que el de H+/H2 y un potencial de reducción de VB más positivo que el de O2/H2O es crucial para la degradación de los contaminantes57. La presencia de una buena propiedad de transferencia de carga muestra la formación de heterouniones/contacto local entre óxidos metálicos, lo que tiene una influencia notable en la disminución de la recombinación e-/h+. Los resultados del estudio y las revisiones sugieren un posible mecanismo de degradación propuesto de los NC después de la heterounión33,46, como se muestra en la Figura 4D.
Figura 1. Análisis de estabilidad de materiales. (A) Parcelas TGA/DTA de PVA-ZnO/Mn2O3 antes de la calcinación. (B) Patrones XRD de PVA, ZnO, PVA-ZnO/Mn2O3 y Mn2O3; las estructuras cristalinas de estilo esférico de (C) ZnO y (D) Mn2O3 creadas utilizando el software del programa de imágenes VESTA 3D (el rojo es para el átomo de O) calcinadas a 500 °C. Esta cifra ha sido modificada de28. Haga clic aquí para ver una versión más grande de esta figura.
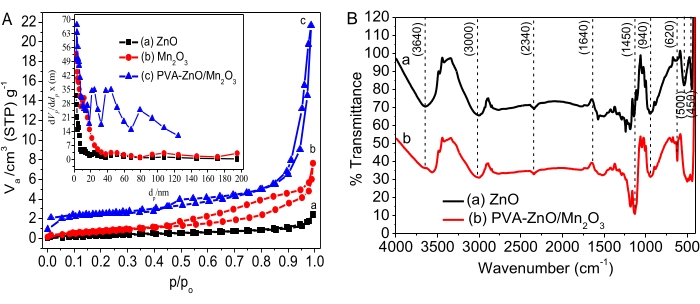
Figura 2. Análisis de propiedades texturales y uniones químicas. (A) Las parcelas BET de ZnO, Mn2O3 y PVA-ZnO/Mn2O3 calcinadas a 500 °C. La figura del recuadro muestra los gráficos de BJH. (B) Espectros FT-IR de NnO NPs y muestras de PVA-ZnO/Mn2O3 calcinadas a 500 °C. Esta cifra ha sido modificada de28. Haga clic aquí para ver una versión más grande de esta figura.
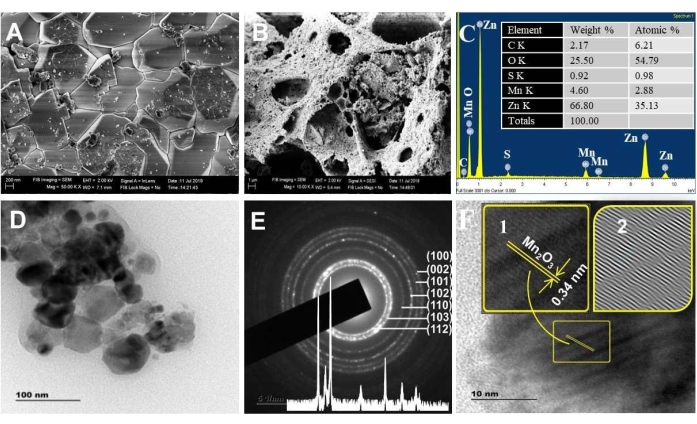
Figura 3. Análisis morfológico. Imagen SEM de los espectros (A) ZnO y (B) ZnO/Mn2O3, (C) EDXS calcinados a 500 °C. El recuadro en C es el resultado del % de peso elemental y el % atómico. (D) Imágenes TEM, (E) SAED y (F) HRTEM calcinadas a 500 °C. El recuadro en E es el patrón XRD; el recuadro en F son los flecos de celosía ampliados (1) y el patrón IFFT (2). Esta cifra ha sido modificada de28. Haga clic aquí para ver una versión más grande de esta figura.
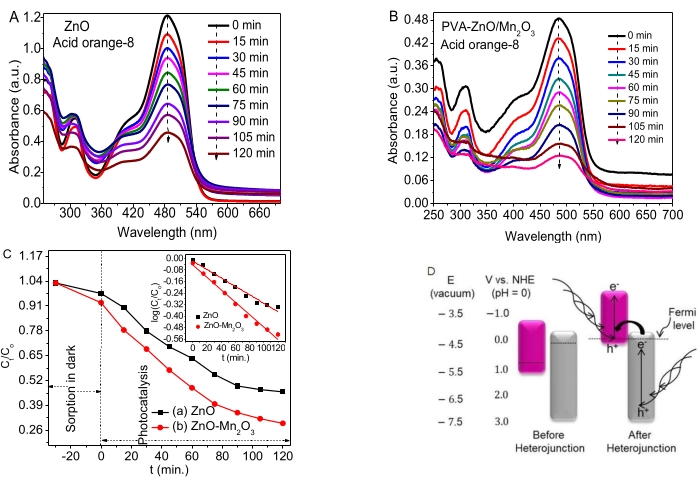
Figura 4. Actividades fotocatalíticas de las NPs de ZnO y la absorbancia de ZnO-Mn2O3 NCs (A, B) frente a los diagramas de longitud de onda de ZnO y ZnO/Mn2O3, respectivamente. (C) El gráfico de datos cinéticos dependiente del tiempo C, T/C, O, vs. t (D) Un tipo de espacio roto de un posible mecanismo propuesto (izquierda, antes de la heterounión y derecha, después de la heterounión). Esta cifra ha sido modificada de28. Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria S1. El diagrama esquemático ilustra la síntesis de combustión asistida por solución asistida por agente directivo de arquitectura que produce un material poroso poroso activo a nanoescala noble para el transporte de masa/iones. A) solución precursora; (B) el gel formado tras la deshidratación a 110 °C; (C) explosión de subproducto gaseoso en el calentamiento posterior para encender la temperatura; (D) el subproducto poroso estable producido por la calcinación a 500 °C. Esta cifra ha sido modificada de28. Haga clic aquí para descargar este archivo.
Discusión
El presente protocolo describe la síntesis de nanocristales utilizando una estrategia de abajo hacia arriba con forma, tamaño y estructura precisos. El estudio observó que la nucleación y el crecimiento de los nanocristales eran significativos antes de formar los nanocristales. Aquí, los óxidos de ZnO y manganeso se sintetizaron sobre la base de la teoría del grupo25 de LaMer, que postula el proceso de formación de nanocristales después de reducir los precursores en átomos y núcleos, lo que lleva a la formación de semillas para producir nanocristales. En este sentido, la forma y el tamaño generales de los nanocristales dependen del crecimiento de las semillas, las propiedades de las semillas y la reactivación de los tensioactivos/agentes de recubrimiento. El alcohol polivinílico puede actuar como agente reductor y taponador/estabilizador58,59. Mientras tanto, a diferencia del enfoque convencional SG-SCS, que utiliza combustible como oxidante, solo se utilizó el polímero PVA como agente complejante y taponador sin utilizar ningún combustible. En este caso, se utilizó agua como disolvente, lo que no es común ya que otros estudios han utilizado disolventes tóxicos, cancerígenos y mutagénicos.
Este estudio modificó la reactividad del zinc y el manganeso con base en la teoría de los ácidos y bases duros y blandos (HSAB)16,24. El dopante de sulfato de manganeso, menos reactivo y soluble, se utilizó para formar una heterounión local con el precursor de nitrato de zinc más reactivo. Inició la nucleación del zinc, y los átomos de manganeso se difundieron y se unieron a los sitios superficiales adecuados (escalones y torceduras)26.
Los reductores, oxidantes de sal a base de neutro/cloruro u oxidante/nitrato, se pueden utilizar como SG-SCS. A título informativo, los precursores reductores y neutros/basados en cloro necesitan oxidantes adicionales y liberan HCl, lo que provoca la contaminación de los productos finales. En general, el precursor de nitrato es el mejor oxidante, con propiedades cruciales como un potencial oxidante adecuado y una temperatura de descomposición estable, que ayudan a formar el producto puro60 y la solubilidad noble61. El precursor de sulfato utilizado para controlar la reactividad en este trabajo produjo impurezas que requieren una alta temperatura de descomposición (ver el análisis EDX, Figura 3C). Dado que la sal de nitrato tiene un potencial oxidante y formador de complejosadecuado 61, se sugiere que se utilicen precursores de nitrato y otras condiciones para equilibrar la reactividad del huésped-dopante en lugar de la sal de superficie.
El SG-SCS en este estudio siguió una secuencia de pasos, incluyendo la formación coloidal/solar, la deshidratación (formación de gel) y la reacción de combustión autosostenida 1,62. Esto dio lugar a la evolución de gases que mejoran las propiedades de porosidad/textura del producto63 y, finalmente, a la extinción de la reacción por la evolución de los gases (véase la Figura suplementaria 1). Durante el proceso SG-SCS, los procesos de combustión pueden formar una estructura esponjosa/espumante mediante la combustión en muchos puntos o una estructura de alambre largo mediante la combustión en un punto/punto. Además, la calcinación de los materiales quemados ayuda a descomponer las impurezas no quemadas y mejora la cristalinidad de los materiales27.
Este estudio presentó el enfoque de síntesis de combustión en solución (SCS) como una metodología novedosa y eficiente en el tiempo y la energía para producir nanomateriales altamente estables y porosos que se pueden aplicar de manera efectiva en un entorno industrialmente escalable. Los procedimientos SG-SCS sintetizaron con éxito los NC binarios porosos basados en ZnO. El estudio observó que el método sol-gel mejoró el SAS para los NC sintetizados. La porosidad de los NC se verificó a través de la imagen SEM, el anillo SAED y el análisis BET, mientras que la temperatura de degradación optimizada del PVA para los NC se identificó como 500 °C a partir del análisis DTG. El análisis de imágenes XRD y TEM confirmó que los tamaños de cristalitos de las NPs y NCs estaban en el nivel nano. Se aplicaron los análisis EDX, XPS y HRTEM para la investigación de composición y actualidad. Al final, los NC binarios mostraron una buena degradación del tinte AO8, lo que demuestra su eficiencia. En general, cualquier material podría sintetizarse razonablemente abordando los inconvenientes mencionados, y SCS podría proporcionar un método menos costoso, sin esfuerzo y eficiente en tiempo / energía para alimentar dispositivos de energía en el futuro.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer a la Universidad de Ciencia y Tecnología de Adama por su apoyo en este trabajo. La financiación fue proporcionada por el Proyecto de Apoyo a los Investigadores de la Universidad de Taif número (TURSP-2020/44), Universidad de Taif, Taif, Arabia Saudita.
Materiales
| Name | Company | Catalog Number | Comments |
| Acid orange 8 | Sigma-Aldrich | 65%, | |
| Chlorine | Sigma-Aldrich | 7782-50-5 | |
| Dithienogermole | Sigma-Aldrich | 773881-43-9 | |
| HCl | Sigma-Aldrich | 7647-01-0 | |
| Manganese nitrate (10%) salt | Sigma-Aldrich | 15710-66-4 | 10% |
| Manganese sulfate monohydrate | Sigma-Aldrich | Density: 2.95 g/cm³; solubility in water: 70 g/100 mL (70 °C); 99.95%, MnSO4.H2O | |
| Poly (vinyl alcohol) | Sigma-Aldrich | 9002-89-5 | Density: 1.19–1.31 g/cm³ @20 °C, soluble in water only @ > 80 °C |
| Zinc nitrate hexahydrate (90%) | Sigma-Aldrich | 10196-18-6 | 98%; Density: 2.065 g/cm³ @20 °C; solubility in water: 184.3 g/100 mL @20 °C |
| Instruments used | |||
| Materials name | Model | Analysis | |
| BET (N2 adsorption-desorption isotherms) | Quanta chrome instrument. | Textural properties | |
| DT/DTA | Shimadzu DTG-60H | Measure thermal stability | |
| FTIR | Perkin Elmer FT-IR, Spectrum 65 | Chemical bonding information | |
| HRTEM | JEOL TEM 2100 HRTEM | Morphological, size, and composition analysis | |
| SEM-EDX | SEM-EDX-EVO 18 with low vacuum facility and ALTO 1000 cryo attachment | Morphological analysis | |
| XPS | AXIS ULTRA from AXIS 165 | ||
| XRD | Shimadzu, XRD-7000 | Crystallinity, structure, and approximate average crystallite size | |
| Common software used | |||
| Name | Company | Use | |
| Mendeley | Mendeley-Desktop-1.19.8-win32 | For citing references | |
| Origin | OriginPro 8 | XRD, BET, UV-vis-DRS data analysis |
Referencias
- Khort, A., et al. Corrosion and transformation of solution combustion synthesized Co, Ni and CoNi nanoparticles in synthetic freshwater with and without natural organic matter. Scientific Reports. 11 (1), 7860 (2021).
- Pype, M., Lawrence, M. G., Keller, J., Gernjak, W. Reverse osmosis integrity monitoring in water reuse: The challenge to verify virus removal - A review. Water Research. 98, 384-395 (2016).
- Adeleye, A. S., et al. Engineered nanomaterials for water treatment and remediation: Costs, benefits, and applicability. Chemical Engineering Journal. 286, 640-662 (2016).
- Gómez-Pastora, J., et al. Review and perspectives on the use of magnetic nanophotocatalysts (MNPCs) in water treatment. Chemical Engineering Journal. 310 (2), 407-427 (2017).
- Nadeem, M. S., et al. Enhancement in the photocatalytic and antimicrobial properties of ZnO nanoparticles by structural variations and energy bandgap tuning through Fe and Co co-doping. Ceramics International. 47 (8), 11109-11121 (2021).
- Nadeem, M. S., et al. Energy-levels well-matched direct Z-scheme ZnNiNdO/CdS heterojunction for elimination of diverse pollutants from wastewater and microbial disinfection. Environmental Science and Pollution Research International. , (2022).
- Munawar, T., Iqbal, F., Yasmeen, S., Mahmood, K., Hussain, A. Multi metal oxide NiO-CdO-ZnO nanocomposite-Synthesis, structural, optical, electrical properties and enhanced sunlight driven photocatalytic activity. Ceramics International. 46 (2), 2421-2437 (2020).
- Srinivasa, N., et al. Facile synthesis of Ni/NiO nanocomposites: The effect of Ni content in NiO upon the oxygen evolution reaction within alkaline media. RSC Advances. 11 (24), 14654-14664 (2021).
- Chen, P., et al. Solution combustion synthesis of ternary Ni/WC/C composites with efficient electrocatalytic oxygen reduction performance. RSC Advances. 11 (61), 38718-38726 (2021).
- Nagvenkar, A. P., Perelshtein, I., Piunno, Y., Mantecca, P., Gedanken, A. Sonochemical one-step synthesis of polymer-capped metal oxide nanocolloids: Antibacterial activity and cytotoxicity. ACS Omega. 4 (9), 13631-13639 (2019).
- Janotti, A., Van de Walle, C. G. Fundamentals of zinc oxide as a semiconductor. Reports on Progress in Physics. 72 (12), 126501 (2009).
- Abebe, B., Murthy, H. C. A., Amare, E. Enhancing the photocatalytic efficiency of ZnO: Defects, heterojunction, and optimization. Environmental Nanotechnology, Monitoring. & Management. 14, 100336 (2020).
- Abebe, B., Murthy, H. C. A., Zereffa, E. A. Multifunctional application of PVA-aided Zn-Fe-Mn coupled oxide nanocomposite. Nanoscale Research Letters. 16, 1 (2021).
- Shekofteh-Gohari, M., Habibi-Yangjeh, A. Fe3O4/ZnO/CoWO4 nanocomposites: Novel magnetically separable visible-light-driven photocatalysts with enhanced activity in degradation of different dye pollutants. Ceramics International. 43 (3), 3063-3071 (2017).
- Saravanan, R., Gupta, V. K. K., Narayanan, V., Stephen, A. Visible light degradation of textile effluent using novel catalyst ZnO/γ-Mn2O3. Journal of the Taiwan Institute of Chemical Engineers. 45 (4), 1910-1917 (2014).
- Buonsanti, R., Milliron, D. J. Chemistry of doped colloidal nanocrystals. Chemistry of Materials. 25 (8), 1305-1317 (2013).
- Hu, H., He, H., Zhang, J., Hou, X., Wu, P. Optical sensing at the nanobiointerface of metal ion-optically-active nanocrystals. Nanoscale. 10 (11), 5035-5046 (2018).
- Deganello, F., Tyagi, A. K. Solution combustion synthesis, energy and environment: Best parameters for better materials. Progress in Crystal Growth and Characterization of Materials. 64 (2), 23-61 (2018).
- Buonsanti, R., et al. Assembly of ligand-stripped nanocrystals into precisely controlled mesoporous architectures. Nano Letters. 12 (7), 3872-3877 (2012).
- Li, F., Ran, J., Jaroniec, M., Qiao, S. Z. Solution combustion synthesis of metal oxide nanomaterials for energy storage and conversion. Nanoscale. 7 (42), 17590-17610 (2015).
- Williams, T. E., et al. Nearest-neighbour nanocrystal bonding dictates framework stability or collapse in colloidal nanocrystal frameworks. Chemical Communications. 53 (35), 4853-4856 (2017).
- Helms, B. A., Williams, T. E., Buonsanti, R., Milliron, D. J. Colloidal nanocrystal frameworks. Advanced Materials. 27 (38), 5820-5829 (2015).
- Liu, B., et al. Synthesis of ZnO nano-powders via a novel PVA-assisted freeze-drying process. RSC Advances. 6 (111), 110349-110355 (2016).
- Abebe, B., Murthy, H. C. A. Insights into ZnO-based doped porous nanocrystal frameworks. RSC Advances. 12 (10), 5816-5833 (2022).
- LaMer, V. K., Dinegar, R. H. Theory, production and mechanism of formation of monodispersed hydrosols. Journal of the American Chemical Society. 72 (11), 4847-4854 (1950).
- Jun, Y. -. S., et al. Classical and nonclassical nucleation and growth mechanisms for nanoparticle formation. Annual Review of Physical Chemistry. 73, 453-477 (2022).
- Gao, Y., Meng, F., Li, X., Wen, J. Z., Li, Z. Factors controlling nanosized Ni-Al 2 O 3 catalysts synthesized by solution combustion for slurry-phase CO methanation: the ratio of reducing valences to oxidizing valences in redox systems. Catalysis Science & Technology. 6 (21), 7800-7811 (2016).
- Abebe, B., Zereffa, E. A., Murthy, H. C. A. Synthesis of poly(vinyl alcohol)-aided ZnO/Mn 2 O 3 nanocomposites for acid orange-8 dye degradation: Mechanism and antibacterial activity. ACS Omega. 6 (1), 954-964 (2021).
- Kumar, S., Krishnakumar, B., Sobral, A. J. F. N., Koh, J. Bio-based ( chitosan / PVA / ZnO ) nanocomposites fi lm Thermally stable and photoluminescence material for removal of organic dye. Carbohydrate Polymers. 205, 559-564 (2019).
- Dai, Y., et al. Enhanced mechanical, thermal, and UV-shielding properties of poly(vinyl alcohol)/metal-organic framework nanocomposites. RSC Advances. 8 (67), 38681-38688 (2018).
- Munawar, T., et al. Novel tri-phase heterostructured ZnO-Yb2O3-Pr2O3 nanocomposite; structural, optical, photocatalytic and antibacterial studies. Ceramics International. 46 (8), 11101-11114 (2020).
- Mukhtar, F., et al. Enhancement in carrier separation of ZnO-Ho2O3-Sm2O3 hetrostuctured nanocomposite with rGO and PANI supported direct dual Z-scheme for antimicrobial inactivation and sunlight driven photocatalysis. Advanced Powder Technology. 32 (10), 3770-3787 (2021).
- Lachheb, H., et al. Electron transfer in ZnO-Fe 2 O 3 aqueous slurry systems and its effects on visible light photocatalytic activity. Catalysis Science & Technology. 7 (18), 4041-4047 (2017).
- Thommes, M., et al. Physisorption of gases, with special reference to the evaluation of surface area and pore size distribution (IUPAC Technical Report). Pure and Applied Chemistry. 87 (9-10), 1051-1069 (2015).
- Kumar, P., Kim, K. -. H., Kwon, E. E., Szulejko, J. E. Metal-organic frameworks for the control and management of air quality: advances and future direction. Journal of Materials Chemistry A. 4 (2), 345-361 (2016).
- Liu, J., et al. NiO-PTA supported on ZIF-8 as a highly effective catalyst for hydrocracking of Jatropha oil. Scientific Reports. 6, 23667 (2016).
- Fatehah, M. O., Aziz, H. A., Stoll, S. Stability of ZnO nanoparticles in solution. Influence of pH, dissolution, aggregation and disaggregation effects. Journal of Colloid Science and Biotechnology. 3 (1), 75-84 (2014).
- Sigoli, F. A., Davolos, M. R., Jafelicci, M. Morphological evolution of zinc oxide originating from zinc hydroxide carbonate. Journal of Alloys and Compounds. 262-263, 292-295 (1997).
- Wachs, I. E. Raman and IR studies of surface metal oxide species on oxide supports: Supported metal oxide catalysts. Catalysis Today. 27 (3-4), 437-455 (1996).
- Parler, C. M., Ritter, J. A., Amiridis, M. D. Infrared spectroscopic study of sol-gel derived mixed-metal oxides. Journal of Non-Crystalline Solids. 279 (2-3), 119-125 (2001).
- Anžlovar, A., Kogej, K., Crnjak Orel, Z., Žigon, M. Polyol mediated nano size zinc oxide and nanocomposites with poly(methyl methacrylate). Express Polymer Letters. 5 (7), 604-619 (2011).
- Saravanan, R., et al. ZnO/Ag/Mn 2 O 3 nanocomposite for visible light-induced industrial textile effluent degradation, uric acid and ascorbic acid sensing and antimicrobial activity. RSC Advances. 5 (44), 34645-34651 (2015).
- Yang, G., Yan, W., Wang, J., Yang, H. Fabrication and formation mechanism of Mn 2 O 3 hollow nanofibers by single-spinneret electrospinning. CrystEngComm. 16 (30), 6907-6913 (2014).
- Liu, Y., et al. A magnetically separable photocatalyst based on nest-like γ-Fe 2 O 3 /ZnO double-shelled hollow structures with enhanced photocatalytic activity. Nanoscale. 4 (1), 183-187 (2012).
- Hu, Y., et al. A microwave-assisted rapid route to synthesize ZnO/ZnS core-shell nanostructures via controllable surface sulfidation of ZnO nanorods. CrystEngComm. 13 (10), 3438-3443 (2011).
- Zhang, J., et al. Synthesis and gas sensing properties of α-Fe 2 O 3 @ ZnO core-shell nanospindles. Nanotechnology. 22 (18), 185501 (2011).
- Penn, R. L. Imperfect oriented attachment: Dislocation generation in defect-free nanocrystals. Science. 281 (5379), 969-971 (1998).
- Zhang, J., Huang, F., Lin, Z. Progress of nanocrystalline growth kinetics based on oriented attachment. Nanoscale. 2 (1), 18-34 (2009).
- Zeng, Z., et al. A fluorescence-electrochemical study of carbon nanodots (CNDs) in bio- and photoelectronic applications and energy gap investigation. Physical Chemistry Chemical Physics. 19 (30), 20101-20109 (2017).
- Zhai, T., et al. Controllable synthesis of hierarchical ZnO nanodisks for highly photocatalytic activity. CrystEngComm. 14 (5), 1850-1855 (2012).
- Li, N., et al. Efficient removal of chromium from water by Mn3O4 @ZnO/Mn3O4 composite under simulated sunlight irradiation: Synergy of photocatalytic reduction and adsorption. Applied Catalysis B: Environmental. 214, 126-136 (2017).
- Abebe, B. Polymer assisted colloidal nanocrystal framework synthesis: Sol-gel approach. Materials Research Express. 8 (12), 125005 (2021).
- Jiamprasertboon, A., et al. Heterojunction α-Fe2O3/ZnO films with enhanced photocatalytic properties grown by aerosol-assisted chemical vapour deposition. Chemistry - A European Journal. 25 (48), 11337-11345 (2019).
- Mukhtar, F., et al. Dual S-scheme heterojunction ZnO-V2O5-WO3 nanocomposite with enhanced photocatalytic and antimicrobial activity. Materials Chemistry and Physics. 263, 124372 (2021).
- Marschall, R. Semiconductor composites: Strategies for enhancing charge carrier separation to improve photocatalytic activity. Advanced Functional Materials. 24 (17), 2421-2440 (2013).
- Beranek, R. (Photo)electrochemical methods for the determination of the band edge positions of TiO 2-based nanomaterials. Advances in Physical Chemistry. 2011, 786759 (2011).
- Hoffmann, M. R., Martin, S. T., Choi, W., Bahnemann, D. W. Environmental applications of semiconductor photocatalysis. Chemical Reviews. 95 (1), 69-96 (1995).
- Wu, Y., Wang, D., Li, Y. Understanding of the major reactions in solution synthesis of functional nanomaterials. Science China Materials. 59, 938-996 (2016).
- Xia, Y., Xiong, Y., Lim, B., Skrabalak, S. E. Shape-controlled synthesis of metal nanocrystals: Simple chemistry meets complex physics. Angewandte Chemie. 48 (1), 60-103 (2008).
- Kim, S. J., Yoon, S., Kim, H. J. Review of solution-processed oxide thin-film transistors. Japanese Journal of Applied Physics. 53, (2014).
- Zhang, J., Guo, Q., Liu, Y., Cheng, Y. Preparation and characterization of Fe2O3/Al2O3 using the solution combustion approach for chemical looping combustion. Industrial & Engineering Chemistry Research. 51 (39), 12773-12781 (2012).
- Novitskaya, E., Kelly, J. P., Bhaduri, S., Graeve, O. A. A review of solution combustion synthesis: an analysis of parameters controlling powder characteristics. International Materials Reviews. 66 (3), 188-214 (2021).
- González-Cortés, S. L., Imbert, F. E. Fundamentals, properties and applications of solid catalysts prepared by solution combustion synthesis (SCS). Applied Catalysis A: General. 452, 117-131 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados