Method Article
В пробирке Анализ уничтожения эритроцитов, инфицированных плазмодием, цитотоксическими лимфоцитами
В этой статье
Резюме
Здесь мы описываем новый метод, помогающий выяснить механизмы клеточного иммунитета к плазмодию на стадии инфекции в крови. Это анализ in vitro , который измеряет уничтожение инфицированных эритроцитов цитотоксическими лимфоцитами.
Аннотация
Малярия является одной из основных проблем общественного здравоохранения, ежегодно регистрируя более 200 миллионов случаев заболевания во всем мире. Несмотря на многолетние научные усилия, защитный иммунитет к малярии до сих пор плохо изучен, в основном из-за методологических ограничений долгосрочного культивирования Plasmodium, особенно для Plasmodium vivax. Большинство исследований было сосредоточено на адаптивной иммунной защите от малярии с помощью антител, которые играют ключевую роль в борьбе с малярией. Однако стерильная защита, индуцированная аттенуированными вакцинами Plasmodium sporozoits, связана с клеточным ответом, главным образом на цитотоксические Т-лимфоциты, такие как CD8+ и гамма-дельта-Т-клетки (γδ T). Следовательно, необходимо разработать новые методологии, чтобы лучше понять функции клеточного иммунного ответа и, таким образом, поддержать будущую терапию и разработку вакцин. Чтобы найти новую стратегию анализа этого клеточно-опосредованного иммунитета к инфекции Plasmodium на стадии крови, наша группа создала анализ in vitro, который измеряет уничтожение инфицированных эритроцитов (iRBC) цитотоксическими лимфоцитами. Этот анализ может быть использован для изучения механизмов клеточного иммунного ответа против различных видов Plasmodium spp. в стадии крови. Врожденные и адаптивные цитотоксические иммунные клетки могут непосредственно уничтожать iRBC и внутриклеточного паразита по механизму эффектор: мишень. Целевые эритроциты помечаются для оценки жизнеспособности клеток и культивируются совместно с эффекторными клетками (CD8+ T, γδ T, NK-клетками и т. д.). Процент лизиса рассчитывается на основе тестируемых условий по сравнению с контролем спонтанного лизиса в анализе на основе проточной цитометрии. В конечном счете, эта методология анализа убийства является важным шагом вперед в понимании клеточного иммунитета к малярии на стадии крови, помогая выявить новые потенциальные терапевтические цели и ускорить разработку вакцин против малярии.
Введение
Малярия остается глобальным кризисом в области здравоохранения: в 2020 г. было зарегистрировано более 240 миллионов случаев заболевания малярией и 627 000 случаев смерти, связанных с малярией1. В настоящее время существует пять паразитических видов, которые могут вызывать малярию у людей, из которых Plasmodium falciparum и Plasmodium vivax являются двумя наиболее распространенными видами. Во время инфекции Plasmodium печень или преэритроцитарная стадия протекает бессимптомно, и симптомы возникают только во время бесполого цикла паразита на эритроцитарной стадии. На этой стадии инфекции тысячи мерозоитов, полученных из печени, высвобождаются в кровоток и заражают эритроциты (эритроциты). В эритроцитах паразиты дифференцируются на трофозоиты и шизонты путем шизогонии, пока шизонты не разорвут эритроцит, высвобождая новообразованные мерозоиты, повторяя этот круговорот крови. Повторяющиеся циклы инвазии, репликации и высвобождения мерозоита приводят к экспоненциальному росту популяции паразитов и, в конечном итоге, вызывают симптомы заболевания2.
Важной проблемой в изучении иммунного ответа на малярию является то, что Plasmodium spp. То, что заражает людей, не заражает модели лабораторных животных. Таким образом, образцы пациентов, инфицированных плазмодием, должны быть собраны свежими и немедленно обработаны и проанализированы. Однако в эндемичных по малярии районах ресурсы для доступа к иммунологическим и молекулярным механизмам ограничены. Из-за этих ограничений грызуны широко используются в качестве экспериментальных моделей для исследования иммунного ответа против инфекции Plasmodium. В то время как P. berghei и P. chabaudi часто используются в качестве суррогатов инфекции P. falciparum, нелетальный штамм P. yoelii 17XNL также имеет много общих черт с P. vivax, таких как инфекция с ограничением ретикулоцитов 3,4. Разработка анализов Plasmodium in vitro, которые могут быть использованы для образцов, полученных на моделях человека или животных, ценна для лучшего понимания патогенеза малярии и сравнения иммунологического ответа, вызванного различными видами паразита.
Защитный противомалярийный иммунитет до конца не изучен ни на предэритроцитарной стадии, ни на стадии крови. Известно, что воздействие повторных инфекций приводит к частичному приобретению иммунитета, но стерильный иммунитет вырабатываетсяредко5. В течение десятилетий антиплазмодиев протективный иммунитет был в основном связан с индукцией нейтрализующих или опсонизирующих антител, которые предотвращают вторжение паразитов в клетки-хозяева или приводят к фагоцитозу антигенпрезентирующими клетками, соответственно6. В результате большинство усилий по производству противомалярийных вакцин до сих пор основывалось на индуцировании защитных и длительных антител 7,8. Однако стерильная защита, индуцированная вакцинацией аттенуированным спорозоитом, напрямую коррелирует с активацией и экспансией цитотоксических Т-лимфоцитов 8,9.
Недавно некоторые исследования свежевыделенных образцов пациентов и культур in vitro показали, что врожденные или адаптивные цитотоксические иммунные клетки, такие как CD8 + T10, γδ T 11 и NK-клетки12, могут напрямую уничтожать инфицированные плазмодием эритроциты и его внутриклеточного паразита в соотношении эффектор: цель. Эти основополагающие результаты определили совершенно новый иммунный эффекторный механизм в контексте малярии. Чтобы проанализировать этот новый противомалярийный иммунитет, важно изучить цитотоксические эффекторные механизмы клеток-киллеров против инфицированных эритроцитов (iRBC) при естественной инфекции или вакцинации.
Здесь мы представляем анализ in vitro , который измеряет цитотоксическую активность лимфоцитов против малярии на стадии крови. Этот анализ может помочь выяснить механизмы клеточного иммунного ответа против стадии эритроцитов Plasmodium . Клетки-мишени, iRBCs, помечаются сукцинимидиловым эфиром карбоксифлуоресцеина (CFSE) для оценки жизнеспособности клеток, а затем культивируются совместно с эффекторными клетками, такими как цитотоксические лимфоциты (CTL). Затем эта кокультура оценивается с помощью проточной цитометрии с использованием флуоресцентных маркеров для определенных типов клеток. Наконец, процент лизиса iRBC с помощью CTL рассчитывается путем деления экспериментального условия на спонтанный разрыв эритроцитов и контроль спонтанного лизиса, который происходит во время инкубации без эффекторной клетки. В целом, эта методология анализа убийства может способствовать лучшему пониманию клеточно-опосредованного иммунитета к малярии.
протокол
Все процедуры были проведены в соответствии с политикой Фонда Освальдо Круза и Национального этического совета (CAAE: 59902816.7.0000.5091). Человеческие протоколы были разработаны в сотрудничестве с группой клинических исследований из Исследовательского центра тропической медицины Рондонии (CEPEM), которая отвечала за регистрацию пациентов в исследовании. Информированное согласие было получено от всех пациентов.
Для исследования на животных процедуры были выполнены в соответствии с принципами поведения Бразильского практического руководства по уходу за животными и их использованию в научных и дидактических целях Национального совета по контролю за экспериментами на животных (CONCEA). Протоколы были одобрены Советом по экспериментам на животных Фиокруса (протокол CEUA LW15/20-2).
1. Сбор образцов крови человека и выделение PBMC
- Соберите кровь пациентов, инфицированных плазмодием, в эвакуированную пробирку для сбора крови объемом 10 мл с гепарином натрия. Поскольку у пациентов с малярией проявляется лимфопения, в образце крови объемом 10 мл имеется 5-9 x 106 мононуклеарных клеток периферической крови (PBMC). Поскольку CD8+ Т-клетки или γδ Т-клетки составляют ~ 10% PBMC, предпочтительно собирают 50-100 мл крови на пациента.
ПРИМЕЧАНИЕ: Следует учитывать минимум 1 x 105 эффекторных клеток/состояние. - Рассчитайте процент iRBC по мазку крови, как описано ниже.
- Добавьте 5 мкл общей крови к прозрачному предметному стеклу и подготовьте мазок крови. Выполняют быстрое паноптическое окрашивание по типу Романовского или окрашивание по Май-Гюнвальду-Гимзе. Здесь используется набор для быстрого окрашивания паноптики, который состоит из трех реагентов: реагента А (фиксация), реагента В (цитоплазматическое окрашивание) и реагента С (ядерное и цитоплазматическое дифференциальное окрашивание).
- Медленно опустите предметное стекло в раствор A на 10 раз, затем на 4 раза в раствор B и, наконец, на 10 раз в раствор C. Слейте излишки реагента с предметных стекол между растворами. После погружения в раствор С промойте предметное стекло в проточной водопроводной воде и дайте ему высохнуть.
- Под вертикальным световым микроскопом со 100-кратным погружением в масло подсчитайте 1000 эритроцитов в последовательных квадратах и рассчитайте процент паразитемии, используя следующее уравнение:
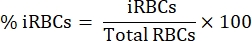
- Разбавьте 15 мл крови в пропорции 1:1 в стерильном фосфатно-буферном физиологическом растворе (PBS).
- Добавьте 15 мл среды для разделения лимфоцитов (плотность 1,077 г / мл) в пробирку объемом 50 мл. Аккуратно наложите 30 мл разбавленного образца крови на раствор центрифугирующей среды. При наслоении образца не допускайте смешивания образца крови и среды для разделения лимфоцитов.
- Центрифугируйте пробирки при 400 x g в течение 40 мин при 22 °C, с низким ускорением и без настройки разрыва.
- Снимите верхний слой, содержащий плазму, с помощью стерильной пипетки, оставляя слой мононуклеарной клетки нетронутым. Перенесите слой мононуклеарных клеток (PBMC) в стерильную пробирку с помощью стерильной пипетки.
- Не выбрасывайте пробирку, содержащую гранулу крови, так как она будет использоваться позже для выделения инфицированных эритроцитов. На этом этапе обязательно храните эритроциты при комнатной температуре (RT). Никогда не давайте им остыть.
- Промойте клетки дважды, добавив PBS и центрифугу при 350 x g в течение 10 мин, с установлением перерыва. Ресуспендировать клеточную гранулу в 5 мл среды RPMI с добавлением пенициллина/стрептомицина и 10% эмбриональной бычьей сыворотки (FBS; полная среда).
- Подсчитайте PBMC в присутствии раствора трипанового синего, чтобы проверить жизнеспособность клеток, используя гемацитометр (камеру Нейбауэра) или автоматический счетчик клеток. Не учитывайте окрашенные в синий цвет клетки, так как они представляют собой умирающие клетки, которые поглощают трипановый синий.
- Отрегулируйте концентрацию клеток до10-7 клеток/мл, используя полную среду. Очистите желаемые цитотоксические популяции лимфоцитов (CD8+ Т-клетки, NK-клетки, γδ-Т-клетки) с помощью магнитной изоляции шариков в соответствии с протоколом производителя реагента.
2. Изоляция эритроцитов человека
ПРИМЕЧАНИЕ: Для выделения эритроцитов, инфицированных человеком, рекомендуется начинать с образцов крови, которые имеют не менее 2% паразитемии, предпочтительно с большим количеством на стадии трофозоита / раннего паразита шизонта.
- Приготовьте PERCOLL (далее именуемую разделительной средой с градиентом плотности) в рекомендуемой концентрации, как описано ниже.
- Добавьте 90 мл 100% разделительной среды с градиентом плотности и 10 мл 10x PBS, чтобы получить 90% изотоническую среду для разделения градиента плотности.
- Для разделения ретикулоцитов, инфицированных P. vivax, подготовьте среду для разделения с градиентомплотности 45%. Добавьте 50 мл 90% изотонической среды для разделения градиента плотности и 50 мл 1x PBS, чтобы получить среду для разделения 45% градиента плотности.
- Для разделения эритроцитов, инфицированных P. falciparum, подготовьте среду для разделения с градиентом плотности 65%. Добавьте 72 мл 90% изотонической среды для разделения градиента плотности и 28 мл 1x PBS, чтобы получить среду для разделения с градиентом плотности 65%.
- Для разделения неинфицированных ретикулоцитов подготовьте среду для разделения с градиентом плотности 70%. Добавьте 78 мл 90% изотонической среды для разделения градиента плотности и 22 мл 1x PBS, чтобы получить среду для разделения 70% градиента плотности.
- Нагрейте на водяной бане разделительную среду с градиентом плотности до 37 °C.
- После удаления слоя PBMC осторожно удалите как можно большую часть верхнего слоя центрифугирующей среды, не касаясь клеток. С помощью стеклянной пастеровской пипетки осторожно удалите верхний слой нейтрофилов, не нарушая гранулы эритроцитов, и оцените объем гранул. Добавьте в 4 раза больше объема гранул эритроцитов в полной среде RT и ресуспендировать.
- Во вторую коническую пробирку объемом 50 мл добавьте в 5 раз больший объем гранул 45%, 65% или 70% градиентной разделительной среды в зависимости от типа изолируемой клетки. Аккуратно нанесите суспензию эритроцитов поверх слоя среды разделения градиента плотности.
- Отжим в течение 15 минут при 850 x g, с низким ускорением и без настройки перерыва. Соберите мутный красно-коричневый слой, лежащий между надосадочной жидкостью и разделительной средой с градиентом плотности, с помощью пипетки объемом 5 мл. Переложить в стерильную пробирку объемом 15 мл.
- Промойте клетки, добавив RT полную среду до 15 мл, и отжимайте в течение 10 минут при 860 x g. Повторите стирку, добавив 10 мл RT полной среды, и отжимайте вниз. Откажитесь от надосадочной жидкости и подготовьте мазок крови из гранулы, чтобы проверить обогащение iRBC, выполнив шаг 1.2.
- Ресуспендируйте гранулу в 1 мл полной среды RT и оставьте при комнатной температуре, подсчитывая клетки. Добавьте 10 мкл клеточной суспензии в гемоцитометр (камеру Нейбауэра) и подсчитайте эритроциты в центральной области, разделенной на 25 средних квадратов. Отрегулируйте концентрацию клеток до 1 x 107 iRBCs/мл в полной среде RT.
3. Экспериментальная малярийная инфекция у мышей
- Разморозьте аликвоту криоконсервированного P. yoelii 17XNL: PyGFP (MRA-817), штамма, экспрессирующего GFP, полученного из MR4 / ATCC, и введите 100 мкл внутрибрюшинно (внутривенно) 8-недельной самке мыши C57BL / 6.
- Следите за паразитемией каждые 3 дня, собирая кровь в хвостовой вене.
- Проколите сосуд иглой скос вверх, войдя в вену под небольшим углом, начиная с дистального конца хвоста.
- Соберите образец крови с помощью пипетки или капиллярной трубки объемом до 5 или 10 мл, затем надавите вручную, чтобы остановить кровотечение.
- Подготовьте мазок крови (как описано в шаге 1.2) до тех пор, пока паразитемия не достигнет 10-15% инфицированных эритроцитов.
- Соберите 10 мкл крови путем прокалывания хвостовой вены и разбавьте до 100 мкл PBS для внутривенного введения второй мыши-донора.
ПРИМЕЧАНИЕ: Криоконсервированные паразиты должны быть разморожены и переданы мышам дважды, прежде чем использовать их для экспериментальных инфекций. - Когда второе прохождение достигнет 15% паразитемии, соберите пять капель крови методом клипирования хвоста и разведите в 1 мл PBS. Приготовьте раствор для инфекции, отрегулировав концентрацию до 1 x 106 iRBCs / мл в стерильном PBS, и введите внутримышечно 100 мкл (1 x 105 iRBCs) раствора каждой мыши, необходимой для эксперимента.
- Мониторинг паразитемии каждые 2-3 дня, пока она не достигнет ~ 30% iRBCs, что происходит примерно через 12 дней после заражения. Когда мыши достигнут желаемой паразитемии, соберите кровь с помощью пункции сердца, как описано ниже.
- Аспирируйте 100 мкл раствора гепарина (30 ЕД/мл) в шприц объемом 1 мл иглой 26 г.
- Обезболивают мышей ингаляционно 5% изофлураном и подтверждают отсутствие рефлексов. Положите мышь на бок и перпендикулярно введите иглу чуть ниже локтя, через ребра и в сердце. Медленно вытащите поршень шприца и вращайте иглу до получения 0,5-1 мл крови.
- Провести гуманную эвтаназию путем вывиха шейки матки под наркозом. Асептически очистите левую сторону мыши 70% этанолом. Хирургическими ножницами сделайте надрез на левой стороне мыши, проходящей через кожу и брюшину. Найдите селезенку и удалите ее.
- Поместите селезенку мыши в чашку Петри с 5 мл полной среды, чтобы очистить желаемую популяцию эффекторных клеток (например, CD8 + Т-клеток).
4. Получение свежих цельных спленоцитов мыши
- В чашке Петри аккуратно нарежьте селезенку на мелкие кусочки с помощью ножниц или бритвы.
- Поместите клеточный фильтр 100 мкМ на коническую трубку объемом 50 мл и перенесите иссеченную селезенку в клеточный фильтр с помощью пипетки. Разомните селезенку через ситечко с помощью поршня шприца.
- Промойте клетки через сетчатое фильтр 10 мл готового носителя. Центрифугируют клетки при 300 x g в течение 10 мин при 4 °C, затем удаляют надосадочную жидкость.
- Ресуспендировать клеточную гранулу в 2 мл холодного буфера для лизиса 1x эритроцитов. Выдерживают суспензию в течение 5 мин на льду.
- Промойте клеточную суспензию 10 мл полного носителя с температурой 4 °C. Повторите этап промывки три раза и удалите все клеточные сгустки между промывками селезенки у мышей, инфицированных плазмодием.
- Центрифугируют клетки при 400 x g в течение 5 мин при 4 °C, затем удаляют надосадочную жидкость.
ПРИМЕЧАНИЕ: Плазмодий-инфицированная селезенка увеличена и заполнена фагоцитарными клетками, содержащими деградированный гемоглобин и гемозоин. - Чтобы избежать каких-либо проблем во время выделения эффекторных клеток магнитными шариками, используйте следующие шаги для удаления обогащенных гемозоином фагоцитарных клеток и гемозоина. Ресуспендируйте клетки селезенки с помощью буфера MACS и отрегулируйте концентрацию до 1 x 108 клеток / мл. Поместите колонку LS или LD в магнитное поле. Подготовьте колонку, промыв 3 мл буфера MACS.
- Нанесите клеточную суспензию на колонку. Трижды промойте колонку 3 мл буфера MACS. Собирают проточные отверстия, содержащие клетки селезенки.
- Подсчитайте спленоциты в растворе трипанового синего и проверьте жизнеспособность клеток в гемацитометре (камере Нейбауэра) или автоматическом счетчике клеток. Отрегулируйте концентрацию клеток до 1 x 107 клеток/мл в полной среде RT.
5. Цитотоксическая очистка эффекторных клеток (отрицательный отбор CD8a + Т-клеток)
ПРИМЕЧАНИЕ: Существует множество реагентов положительного и отрицательного отбора, которые могут очищать цитотоксические эффекторные клетки (клетки CD8+ T, γδ T, NK, iNKT, MAIT). В этом протоколе мы используем отрицательный отбор Т-клеток селезенки CD8a+ и следуем инструкциям производителя.
- Центрифугируют все спленоциты в дозе 400 x g в течение 10 мин при 4 °C и удаляют надосадочную жидкость. Ресуспендируют клеточную гранулу в 40 мкл буфера MACS.
- Добавьте 10 мкл коктейля биотин-антитело. Хорошо перемешать и выдерживать 5 минут на льду.
- Добавьте 30 мкл буфера MACS. Добавьте 20 мкл микрогранул антибиотина. Хорошо перемешать и выдержать 10 минут на льду.
- Добавьте 400 мкл буфера MACS и приступайте к разделению магнитных ячеек. Поместите колонку MACS LS в опору магнитного поля. Подготовьте колонку, промыв 3 мл буфера MACS.
- Нанесите клеточную суспензию на колонку. Трижды промойте колонку 3 мл буфера MACS. Соберите проточный поток, содержащий все немеченые клетки, которые являются обогащенными CD8a + Т-клетками.
- Подсчитайте CD8a+ Т-клетки в растворе трипанового синего и проверьте жизнеспособность клеток в гемацитометре (камере Нойбауэра) или автоматическом счетчике клеток. Отрегулируйте концентрацию клеток до 1 x10,7 клеток/мл в полной среде RT.
6. Выделение инфицированных эритроцитов P. yoelii
- Центрифугируют собранную кровь в пробирке объемом 1,5 мл в дозе 850 г в течение 3 мин. Выбросьте сыворотку и ресуспендируйте кровь в 1 мл 1x RPMI без FBS.
- Поместите колонку LS в опору магнитного поля и промойте 3 мл 1x RPMI. Пропустите суспензию эритроцитов через колонну. Чтобы выделить больше iRBC, повторно нанесите проточный (3 мл RPMI и 1 мл разбавленной крови) в колонку.
- Промыть дважды, запивая 5 мл 1x RPMI. Выполните шаги промывки, добавив аликвоты буфера, как только резервуар колонны опустеет. Не допускайте пересыхания столбиков.
- Добавьте 5 мл RPMI, снимите колонку и продуйте iRBC в новую пробирку объемом 15 мл. Подсчитайте iRBC и отрегулируйте концентрацию до 1 x 107 эритроцитов / мл.
7. Маркировка эритроцитов CFSE и подготовка к проточной цитометрии
ПРИМЕЧАНИЕ: Начните протокол маркировки эритроцитов с удвоенным количеством клеток, которые будут использоваться для эксперимента, поскольку ~ 50% клеток обычно теряются на этапах промывки после этапа маркировки CFSE. Чтобы установить автофлуоресценцию эритроцитов/эритроцитов, включите контрольный образец немеченых клеток.
- Разбавьте CFSE до конечной концентрации 10 мМ в 1x оборотах в минуту без FBS. Промойте клетки один раз с помощью 1x RPMI без FBS в пробирке объемом 15 мл.
- Ресуспендировать эритроциты в 500 мкл 1x RPMI без FBS и добавить 500 мкл разбавленного CFSE. Инкубировать в течение 8 мин при РТ, в защищенном от света месте.
- Промыть три раза, добавив 14 мл полной среды (10% FBS RPMI) с последующим центрифугированием при 850 x g в течение 10 мин. Ресуспендируют клетки в полной среде до концентрации 1-5 х 106 / мл. Инкубировать в течение 1 ч при РТ.
8. Кокультура цитотоксических лимфоцитов и эритроцитов и подготовка к проточной цитометрии
ПРИМЕЧАНИЕ: Если будет измеряться вовлечение специфических рецепторов или молекул, инкубируйте специфические блокирующие и контролирующие изотип антитела (10 мг / мл) с эффекторными клетками в течение 30 минут перед совместной культурой.
- Поместите ячейки в 96-луночную пластину с круглым дном. Добавьте очищенные лимфоциты и меченные CFSE iRBC в желаемом соотношении эффектор-клетка-мишень к конечному объему 200 мкл и гомогенизируйте. Подготовьте каждое условие в трех экземплярах.
ПРИМЕЧАНИЕ: Мы предлагаем отрегулировать концентрацию iRBC до 1-5 x 104 клеток/мл и выбрать соотношение на основе количества очищенных клеток (например, 0,5:1, 2,5:1 и 5:1). - Включите контроль спонтанного лизиса, который является мишенью iRBC без эффектора, чтобы оценить любой спонтанный лизис, так как он будет использоваться для представления 100% условия жизнеспособности клеток.
- Вращайте пластину в течение 1 минуты при 360 x g , чтобы максимизировать контакт с клетками. Инкубировать при 37 °C и 5%CO2 в течение 4 часов.
ПРИМЕЧАНИЕ: Условия гипоксии (низкий уровеньO2), систематически используемые для культивирования P. falciparum , не должны использоваться, поскольку эффекторные клетки не выживают в этой среде. Напротив, паразиты Plasmodium жизнеспособны в окружающем воздухе при 5% CO2 до 12 часов. - Отжимайте в течение 5 минут при 850 x g и переверните пластину, чтобы удалить надосадочную жидкость.
ПРИМЕЧАНИЕ: При желании надосадочную жидкость можно использовать для измерения любых растворимых факторов, высвобождаемых в кокультуре. - Пометьте эритроциты антителами против мыши Ter119 1:200 (или CD235 1:100 против человека для образцов человека) и CD8+ Т-клетками антителами против CD8 1:200 или против CD3 1:200 (против мыши или человека) в течение 30 мин при 4 °C в 1x PBS, содержащем 3% FBS (буфер FACS).
ПРИМЕЧАНИЕ: Флуорофор антител следует выбирать на основе реагента клеточного индикатора/клеточной пролиферации (например, меченного CFSE iRBC, APC-Cy7 анти-Ter119 и PerCP-Cy5.5 анти-CD8a). - Промойте клетки буфером FACS и открутите в течение 5 мин при 850 x g. Перенесите образцы в пробирки FACS и добавьте 30 мкл счетных шариков в отдельные пробирки . Гомогенизируйте бусины путем вихряния в течение 30 с.
9. Проточная цитометрия
- Анализируйте образцы с помощью лазерного прибора 405/488/561/640.
- Для клеток человека, меченных CFSE (FITC), PE античеловеческим γδ TCR и PE-Cy7 античеловеческим антителом CD235a, используйте фильтры 530/30 (FITC), 575/25 (PE) и 780/60 (PE-Cy7) в цитометре с тремя лазерами (синий, красный, желто-зеленый).
- Для клеток мыши, помеченных CFSE (FITC), PerCP-Cy5.5 антимышиный CD8a и APC-Cy7 антимышиный Ter119, используйте фильтры 530/30 (FITC), 695/40 (PerCP-Cy5.5) и 780/60 (APC-Cy7) в установке с тремя лазерными цитометрами.
- Выберите популяцию счетных бусин в качестве стоп-ворот, чтобы получить минимум 20 000 событий в стоп-воротах, которые должны быть одинаковыми для всех условий. Выполняйте анализ и компенсацию с помощью соответствующего программного обеспечения для сбора/анализа проточной цитометрии.
- Установите стратегию стробирования, как описано ниже.
- Отбирайте одиночные ячейки (синглеты), исключая мусор, используя отношение высоты пика FSC (H) к площади (A). Выберите эритроциты и исключите лимфоциты из анализа на основе флуоресценции маркера эритроцитов (Ter119 или CD235a) и лимфоцит-специфического антитела (CD8a).
- В предыдущем стробировании эритроцитов выбирайте жизнеспособные эритроциты на основе положительного окрашивания CFSE. Проанализируйте данные с помощью программного обеспечения для анализа данных проточного цитометра.
10. Расчет и статистика
- Чтобы рассчитать процент лизиса iRBC, следуйте стратегии стробирования, описанной в шаге 9. Процент жизнеспособных эритроцитов - это частота CFSE-положительных клеток внутри ворот эритроцитов на основе положительной флуоресценции Ter119 (мышь) или CD235a (человек).
- Используйте контроль спонтанного лизиса, эритроциты без эффекторных клеток, условие в качестве контроля для оценки спонтанного разрыва эритроцитов. Это состояние будет считаться лизисом эритроцитов (100% жизнеспособность). Используйте следующую формулу для расчета процента лизиса эритроцитов в каждом тестируемом состоянии:
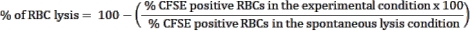
ПРИМЕЧАНИЕ: Во время инкубации культуры некоторые инфицированные эритроциты могут спонтанно лизироваться или разрываться паразитом. Используйте CFSE-положительную эритроцитическую частоту состояния спонтанного лизиса, который не содержит эффекторных клеток, в качестве исходного уровня цитотоксичности лимфоцитов. - Рассчитайте среднее значение троек для каждого состояния и определите статистическую значимость с помощью двусторонней ANOVA при многократных сравнениях.
Результаты
Описана применяемая методология выделения меченных CFSE инфицированных плазмодием эритроцитов в кокультуральном анализе с цитотоксическими лимфоцитами. Во-первых, мы предоставляем схематическое представление о том, как выполнять протокол, используя человеческие образцы, инфицированные P. vivax (рис. 1). Затем иллюстрированная блок-схема того, как продолжить работу с протоколом в экспериментальной модели малярии с использованием мыши C57BL / 6, инфицированной P. yoelii (рис. 2). На рисунке 3 показаны ожидаемые результаты (до и после) для шага 6 протокола (обогащение эритроцитов, инфицированных P. yoelii, с помощью магнитных колонок). Наконец, на рисунке 4 показан репрезентативный анализ проточной цитометрии с подробным описанием стратегии стробирования, необходимой для оценки процента лизиса эритроцитов, как описано на шаге 9. Таким образом, в этом разделе освещаются различные методы, используемые здесь, описывая весь процесс сбора, сборки и анализа данных для оценки уничтожения iRBC цитотоксическими лимфоцитами.
Лизис эритроцитов, инфицированных плазмодием человека, цитотоксическими клетками
Схематическое изображение протокола для оценки убийства цитотоксическими клетками, инфицированных плазмодием человека, показано на рисунке 1. Для измерения лизиса клеток PBMC у пациентов, инфицированных плазмодием, очищали с использованием разделительной среды с последующей магнитной очисткой интересующей популяции цитотоксических лимфоцитов (CTL) (например, CD8 + T, γδ T, NK, iNKT, клетки MAIT и т. д.). Гранулы эритроцитов, оставшиеся от выделения PBMC, использовали для обогащения эритроцитов, инфицированных плазмодием, с использованием среды разделения градиента плотности (65% P. falciparum; 45% P. vivax). iRBC помечали CFSE и инкубировали с лимфоцитами или без них в течение 4 ч при 37 ° C, 5% CO2. После периода кокультуры все эритроциты (инфицированные или нет) были помечены антителами CD235a человека (для эритроцитов) и CTL-специфическими антителами (например, анти-CD8, анти-γδTCR и т. д.) перед анализом проточной цитометрии. Сбор и анализ образцов человека были аналогичны тем, которые были продемонстрированы для образцов мышей на рисунке 4.
Лизис эритроцитов, инфицированных P. yoelii, цитотоксическими CD8+ Т-клетками
Блок-схема экспериментальной процедуры оценки цитотоксического эффекторного механизма в экспериментальной модели малярии показана на рисунке 2 вместе с репрезентативными экспериментальными данными, показанными на рисунках 3 и 4. Мышей C57BL/6 инфицировали 1 x 105iRBC P. yoelii (Py), и паразитемию контролировали до тех пор, пока она не достигла примерно 30%. Py-iRBC были выделены из крови с использованием магнитной сепарации, поскольку субпродукт паразита гема, гемозоин, обогащен железом и функционирует как парамагнитные частицы в магнитном поле13. Чистоту обогащенного образца анализировали с помощью мазка крови в сравнении с образцом до колонки (рис. 3). Затем iRBC были помечены клеточно-индикаторным реагентом CFSE. Параллельно цитотоксические CD8+ Т-клетки очищали от спленоцитов с помощью набора магнитно-отрицательного отбора. В качестве контроля тот же протокол использовался для очистки CD8+ Т-клеток у неинфицированных мышей. Эффекторные (CD8+ T) и целевые (меченые CFSE Py-iRBC) клетки инкубировали при различных соотношениях эффектор:мишень (E:T: 0,5:1, 2,5:1 и 5:1) в течение 4 ч при 37 °C 5%CO2. В конце кокультуры каждое условие было помечено антителами против мыши Ter119 для эритроцитов и анти-CD8a для цитотоксических клеток. Стратегия стробирования и результаты выборки представлены на рисунке 4.
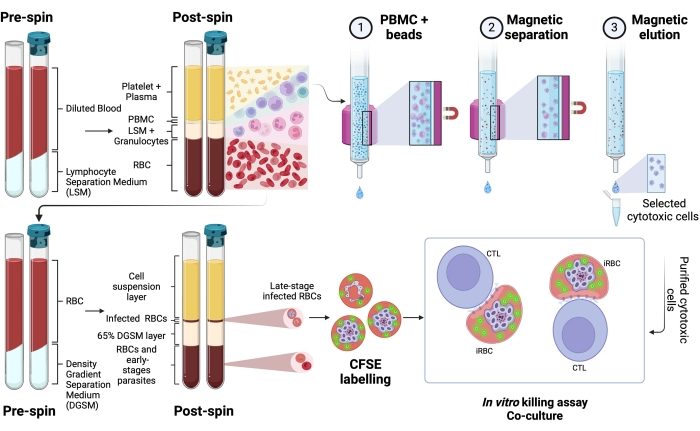
Рисунок 1. Схема анализа уничтожения in vitro. Пример эксперимента с анализом убийства. Кровь, инфицированная плазмодием, собирается и обрабатывается с использованием градиентной среды разделения. После центрифугирования слой PBMC собирают, и цитотоксические клетки (CTL) очищают с помощью магнитных шариков. Слой эритроцитов снова обрабатывается с использованием разделительных сред с градиентом плотности. После центрифугирования слой Plasmodium-iRBC собирают и маркируют CFSE. После этого очищенные CTL и iRBC совместно культивировали в течение 4 ч при 37 ° C, 5% CO2 с последующей клеточно-специфической маркировкой и анализом в проточном цитометре. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
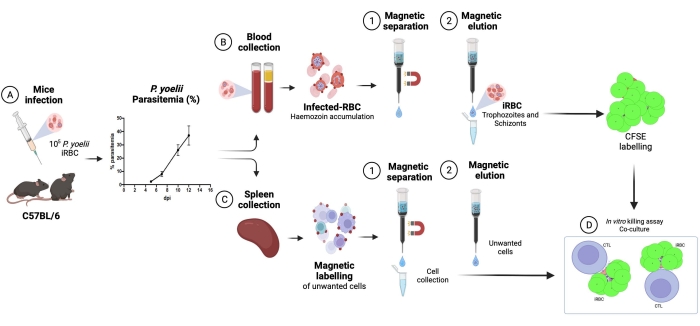
Рисунок 2. Экспериментальная модель малярии для анализа убийства. Во-первых, мыши C57BL/6 были инфицированы 105 эритроцитами, инфицированными PyX17NL. Затем паразитемия контролируется мазком крови до пика инфекции (30-40% эритроцитов), примерно через 12 дней после заражения (dpi). На следующий день мышей обескровили и усыпили для сбора селезенки. Кровь обрабатывали, а инфицированные эритроциты обогащали магнитной сепарацией с последующей маркировкой CFSE (вверху справа). Селезенку обрабатывали для выделения цитотоксических лимфоцитов методом отрицательного отбора с использованием магнитных шариков. После этого очищенные цитотоксические лимфоциты и эритроциты совместно культивировали в течение 4 ч при 37 ° C, 5% CO2 с последующей клеточно-специфической маркировкой и анализом в проточном цитометре. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
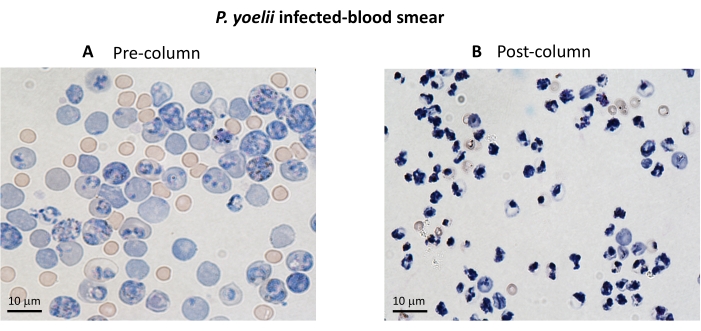
Рисунок 3. Обогащение iRBC с помощью магнитных колонок. iRBC были очищены от мышей, инфицированных P. yoelii, с использованием колонок LS. Очищение подчеркивается мазками крови из крови, собранной до (А) и после обогащения колонки (В ). Масштабная линейка = 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4. Оценка процента лизиса клеток P. yoelii-iRBC CD8+ лимфоцитами. Стратегия стробирования для процента лизиса клеток. (A) Установите тормозные ворота в популяцию счетных бусин (~ 20 000 событий). (B) Контроль спонтанного лизиса, эритроцитов без лимфоцитов. Начните стратегию стробирования с выбора отдельных ячеек, исключая мусор, на основе отношения высоты пика FSC к площади, а затем выберите популяцию эритроцитов в APC-Cy7 Ter119 положительный и PerCP-Cy5.5 CD8 отрицательный. Затем выберите живые iRBC как CFSE (FITC) с высоким положительным результатом. (C) Пример анализа эксперимента с использованием различных эффекторных: целевых соотношений, отображающих процент живых эритроцитов после кокультуры. (D) Графическое представление процента лизиса эритроцитов, рассчитанного на основе формулы, описанной в разделе 10. Сравнение значимости между группами (цитотоксический CD8 или наивный CD8) оценивали с помощью двусторонней ANOVA с множественными сравнениями. P < 0,0001 (****). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Здесь мы описываем анализ in vitro для измерения уничтожения эритроцитов, инфицированных плазмодием, цитотоксическими лимфоцитами. Этот анализ может помочь выяснить механизмы клеточного защитного иммунитета к эритроцитарной стадии малярийного паразита. Основным преимуществом этой методологии является то, что она обеспечивает количественный анализ клеточно-опосредованного уничтожения iRBC, который может быть использован для решения многих вопросов о том, как иммунные клетки взаимодействуют с различными видами Plasmodium.
Важно отметить, что этот метод может быть использован для изучения P. vivax и других паразитов Plasmodium, которые не поддерживаются в культуре in vitro 14,15. Кроме того, этот протокол может быть адаптирован к любым видам Plasmodium и различным хозяевам, таким как люди, мыши и приматы. Методы, основанные на проточной цитометрии, широко используются для оценки цитотоксической активации клеток, продукции цитокинов и дегрануляции10,11,16, но текущий метод является единственным, который исследует лизис эритроцитов путем прямого контакта клеток с клетками-киллерами.
Существует также множество методов, таких как микроскопия, полимеразная цепная реакция (ПЦР) и проточная цитометрия, которые используются для изучения малярии путем измерения паразитемии, инвазии и противомалярийной активности. Однако для анализа клеточно-опосредованной цитотоксичности эритроцитов современные методы, использующие Cr51 или высвобождение гемоглобина, недостаточно чувствительны для оценки лизиса эритроцитов. Высвобождение ЛДГ также может быть использовано для оценки уничтожения эритроцитов некоторыми CTL, такими как CD8 + Т-клетки, но измерение ЛДГ не является точным методом, поскольку активированные врожденные или врожденные клетки могут убивать друг друга в качестве регуляторного механизма.
CFSE широко используется для отслеживания клеток или изучения пролиферации клеток в проточной цитометрии или флуоресцентной микроскопии17. Поскольку эритроциты не размножаются18, интенсивность флуоресценции CFSE должна уменьшаться с лизисом клеток. Проточная цитометрия является очень точным методом, поскольку она может обнаруживать очень низкие уровни специфических маркеров, и поэтому она широко используется для отслеживания паразитемии и инвазии при малярийной инфекции 19,20,21,22,23. Самое главное, что проточная цитометрия может измерять множество параметров в одной клетке и сортировать клетки по разным популяциям. Добавляя количественные стандартные реагенты (счетные шарики) к каждому образцу, можно нормализовать количество приобретенных событий и получить абсолютное количество клеток24. Этот метод позволяет провести надежное количественное сравнение между экспериментальными условиями, что имеет решающее значение для предлагаемого в настоящее время протокола.
Некоторые важные шаги для этого протокола включают обеспечение качества образца, обеспечение надлежащего окрашивания клеток и включение контроля для нормализации расчетов. Для очистки инфицированных эритроцитов требуется большое количество свежих образцов крови. К очистке среды для разделения в градиенте плотности следует подходить осторожно, так как ее концентрация имеет решающее значение для получения желаемых эритроцитов плазмодия. Наложение крови на разделительную среду градиента плотности также должно производиться как можно медленнее, а сбор красного слоя кольца должен производиться осторожно, чтобы избежать потери iRBC. Чтобы облегчить процесс очистки, следует использовать образец крови с высоким уровнем паразитемии, так как количество эритроцитов будет выше. Следует отметить, что в протоколе выделения эритроцитов с использованием магнитных полей будут очищены только зрелые стадии паразита (трофозоиты или шизонты средней и поздней стадии), которые продуцируют значительные количества гемозоина. В результате ни одна кольцевая ступень не будет собрана, а это может повлиять на конечный результат.
Окрашивание клеток следует проводить осторожно, чтобы избежать потери или лизиса клеток. Перед окрашиванием следует избегать длительного хранения или фиксации. Важно отметить, что экспериментальные условия должны выполняться в трех экземплярах с использованием последовательных соотношений эффектор:мишень и соответствующих контрольных элементов, таких как немеченое условие спонтанного лизиса и контроль гипотезы. Добавление шариков для подсчета клеток имеет решающее значение, поскольку оно обеспечивает простой способ определения концентрации клеток или абсолютного количества клеток для каждого образца. Во время сбора проточного цитометра обязательно установите количество событий, которые должны быть собраны в затворе счетных шариков, чтобы нормализовать количество клеток в каждом образце после совместного культивирования.
Поскольку, по меньшей мере, 1 x 105 эффекторных клеток необходимы для получения стабильных результатов в анализе кокультуры, одним из возможных ограничений описанной методики является ограниченное количество клеток после очистки, что может быть проблемой, особенно при работе с редкими клеточными популяциями. Действительно, это относится к очистке iRBC, так как для этого требуется очень высокая паразитемия, которую не так легко получить, особенно при работе с образцами человека в эндемичных районах.
Одним из улучшений протокола может быть время инкубации кокультуры. Хотя ранее мы использовали 12-часовое время инкубации10,11, недавно мы заметили, что 4 ч достаточно для дифференциации экспериментальных условий, тем самым сокращая время потенциального спонтанного лизиса и улучшая воспроизводимость результатов.
Механизмы, участвующие в прямом уничтожении эритроцитов, инфицированных плазмодием, постепенно раскрываются. Наша группа была первой, кто показал, что CD8+ Т-клетки могут распознавать и убивать ретикулоциты, инфицированные P.vivax, через презентацию HLA-I инфицированной клеткой11. Недавно другое исследование показало, что γδ Т-клетки распознают эритроциты, инфицированные P. falciparum, посредством распознавания фосфоантигена бутирофилином, молекулой, присутствующей на поверхности iRBCs10. В обоих исследованиях лизис эритроцитов зависит от гранулизина и гранзима В и приводит к внутриклеточному уничтожению паразитов.
Несмотря на то, что за прошедшие годы было разработано множество методов для измерения паразитемии, инвазии, противомалярийной активности и взаимодействия клеток изображения, ни один из них не смог проанализировать прямое уничтожение эритроцитов цитотоксическими клетками в количественном анализе на основе проточной цитометрии 19,20,21. Мы использовали инновационный подход для оценки способности лизиса клеток при малярии путем маркировки CFSE эритроцитов, инфицированных плазмодием, и оценки лизиса iRBC в определенный период кокультуры с лимфоцитами. Таким образом, этот анализ уничтожения in vitro представляет собой новую стратегию для выяснения механизмов клеточно-опосредованного иммунитета к малярии на стадии крови, что поможет продвинуть изучение новых терапевтических мишеней и разработку противомалярийных вакцин.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Мы благодарим доктора Делио Перейру и сотрудников Исследовательского центра тропической медицины Рондонии (CEPEM) за регистрацию пациентов с малярией и сбор крови, а также Фелицию Хо за помощь в редактировании рукописи. Следующий реагент был получен через BEI Resources, NIAID, NIH: Plasmodium yoelii subsp. yoelii, штамм 17XNL: PyGFP, MRA-817, предоставленный Аной Родригес. Это исследование было поддержано Бразильским исследовательским фондом Lemann, Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) - 437851/2018-4, стипендиями (CJ, GC, CG) и Fundação de Amparo do Estado de Minas Gerais (FAPEMIG) - APQ-00653-16, APQ-02962-18; Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) - стипендия (LL).
Материалы
| Name | Company | Catalog Number | Comments |
| 100 μM cell strainer | Corning | 431752 | |
| 96 Well Round (U) Bottom Plate | Thermo Scientific | 12-565-65 | |
| Anti-human CD235a (Glycophorin A) Antibody | Biolegend | 349114 | Used - APC anti-human CD235, dilution 1:100 |
| Anti-human CD3 Antibody | Biolegend | 317314 | Used - PB anti-human CD3, dilution 1:200 |
| Anti-human CD8 Antibody | Biolegend | 344714 | Used - APC/Cy7 anti-human CD8, dilution 1:200 |
| Anti-human TCR Vδ2 Antibody | Biolegend | 331408 | Used - PE anti-human TCR Vδ2, dilution 1:200 |
| Anti-mouse CD8a Antibody | Biolegend | 100733 | Used- PerCP/Cyanine5.5 anti-mouse CD8a, dilution 1:200 |
| Anti-mouse TER-119/Erythroid Cells Antibody | Biolegend | 116223 | Used - APC/Cyanine7 anti-mouse TER-119, dilution 1:200 |
| CellTrace CFSE Cell Proliferation Kit | Invitrogen | C34554 | |
| Fetal Bovine Serum, qualified | Gibco | 26140079 | |
| Ficoll-Paque Plus | Cytiva | 17144003 | Lymphocyte Separation Medium (LSM) |
| Heparin Sodium Injection, USP | meithel pharma | 71228-400-003 | Used - 2000 USP units/2mL |
| Isoflurane | Piramal critical care | 66794-0013-25 | |
| LS MACS Column | Miltenyi Biotec | 130-042-401 | |
| LSRFortessa Cell Analyzer | BD Bioscience | ||
| Percoll | Cytiva | 17089101 | Density Gradient Separation Medium (DGSM) |
| QuadroMACS Separator | Miltenyi Biotec | 130-090-976 | |
| RPMI 1640 Medium | Gibco | 11875093 | |
| Sodium bicarbonate, powder, BioReagent | Sigma-Aldrich | S5761 | |
| Syringe With Sub-Q needle - 1mL, 26 gauge; | BD | 14-829-10F | |
| Vacutainer Heparin Tube Glass Green 10 ml | BD | 366480 |
Ссылки
- WHO. Global Technical Strategy for Malaria 2016-2030, 2021 Update. World Health Organization. , (2021).
- Hafalla, J. C., Silvie, O., Matuschewski, K. Cell biology and immunology of malaria. Immunological Reviews. 240 (1), 297-316 (2011).
- Belnoue, E., et al. Vaccination with live Plasmodium yoelii blood stage parasites under chloroquine cover induces cross-stage immunity against malaria liver stage. Journal of Immunology. 181 (12), 8552-8558 (2008).
- Leong, Y. W., Lee, E. Q. H., Rénia, L., Malleret, B. Rodent malaria erythrocyte preference assessment by an ex vivo tropism assay. Frontiers in Cellular and Infection Microbiology. 11, 680136 (2021).
- Ladeia-Andrade, S., Ferreira, M. U., De Carvalho, M. E., Curado, I., Coura, J. R. Age-dependent acquisition of protective immunity to malaria in riverine populations of the amazon basin of Brazil. The American Journal of Tropical Medicine and Hygiene. 80 (3), 452-459 (2009).
- Antonelli, L. R., et al. The immunology of Plasmodium vivax malaria. Immunological Reviews. 293 (1), 163-189 (2020).
- Kazmin, D., et al. Systems analysis of protective immune responses to RTS, S malaria vaccination in humans. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2425-2430 (2017).
- Epstein, J. E., et al. Live attenuated malaria vaccine designed to protect through hepatic CD8+ T cell immunity. Science. 334 (6055), 475-480 (2011).
- Draper, S. J., et al. Malaria vaccines: recent advances and new horizons. Cell Host & Microbe. 24 (1), 43-56 (2018).
- Junqueira, C., et al. γδ T cells suppress Plasmodium falciparum blood-stage infection by direct killing and phagocytosis. Nature Immunology. 22 (3), 347-357 (2021).
- Junqueira, C., et al. Cytotoxic CD8+ T cells recognize and kill Plasmodium vivax-infected reticulocytes. Nature Medicine. 24 (9), 1330-1336 (2018).
- Arora, G., et al. NK cells inhibit Plasmodium falciparum growth in red blood cells via antibody-dependent cellular cytotoxicity. eLife. 7, 36806 (2018).
- Paul, F., Roath, S., Melville, D., Warhurst, D. C., Osisanya, J. O. S. Separation of malaria-infected erythrocytes from whole blood: use of a selective high-gradient magnetic separation technique. Lancet. 2 (8237), 70-71 (1981).
- Shaw-Saliba, K., et al. Insights into an optimization of Plasmodium vivax Sal-1 in vitro culture: the aotus primate model. PLOS Neglected Tropical Diseases. 10 (7), 0004870 (2016).
- Mehlotra, R. K., et al. Long-term in vitro culture of Plasmodium vivax isolates from Madagascar maintained in Saimiri boliviensis blood. Malaria Journal. 16 (1), 442 (2017).
- Hojo-Souza, N. S., et al. Contributions of IFN-γ and granulysin to the clearance of Plasmodium yoelii blood stage. PLOS Pathogens. 16 (9), 1008840 (2020).
- Parish, C. R., Glidden, M. H., Quah, B. J. C., Warren, H. S. Use of the intracellular fluorescent dye CFSE to monitor lymphocyte migration and proliferation. Current Protocols in Immunology. 84 (1), 4-9 (2009).
- Migliaccio, A. R. Erythroblast enucleation. Haematologica. 95 (12), 1985 (2010).
- Grimberg, B. T., Erickson, J. J., Sramkoski, R. M., Jacobberger, J. W., Zimmerman, P. A. Monitoring Plasmodium falciparum growth and development by UV flow cytometry using an optimized Hoechst-thiazole orange staining strategy. Cytometry Part A:The Journal of the International Society for Analytical Cytology. 73 (6), 546-554 (2008).
- Pattanapanyasat, K., et al. Culture of malaria parasites in two different red blood cell populations using biotin and flow cytometry. Cytometry:The Journal of the International Society for Analytical Cytology. 25 (3), 287-294 (1996).
- Bianco, A. E., Battye, F. L., Brown, G. V. Plasmodium falciparum: rapid quantification of parasitemia in fixed malaria cultures by flow cytometry. Experimental Parasitology. 62 (2), 275-282 (1986).
- Jacobberger, J. W., Horan, P. K., Hare, J. D. Analysis of malaria parasite-infected blood by flow cytometry. Cytometry:The Journal of the International Society for Analytical Cytology. 4 (3), 228-237 (1983).
- Bei, A. K., et al. A flow cytometry-based assay for measuring invasion of red blood cells by Plasmodium falciparum. American Journal of Hematology. 85 (4), 234 (2010).
- Montes, M., Jaensson, E. A., Orozco, A. F., Lewis, D. E., Corry, D. B. A general method for bead-enhanced quantitation by flow cytometry. Journal of Immunological Methods. 317 (1-2), 45-55 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены