Method Article
في المختبر فحص خلايا الدم الحمراء المصابة بالبلازموديوم التي تقتلها الخلايا الليمفاوية السامة للخلايا
In This Article
Summary
نصف هنا طريقة جديدة للمساعدة في توضيح آليات المناعة الخلوية للبلازميوم خلال مرحلة الدم من العدوى. هذا اختبار في المختبر يقيس قتل خلايا الدم الحمراء المصابة بواسطة الخلايا الليمفاوية السامة للخلايا.
Abstract
الملاريا هي مصدر قلق رئيسي للصحة العامة ، حيث تقدم أكثر من 200 مليون حالة سنويا في جميع أنحاء العالم. على الرغم من سنوات من الجهود العلمية ، لا تزال المناعة الوقائية للملاريا غير مفهومة بشكل جيد ، ويرجع ذلك أساسا إلى القيود المنهجية لثقافة البلازموديوم طويلة الأجل ، وخاصة بالنسبة للمتصورة النشيطة. ركزت معظم الدراسات على حماية المناعة التكيفية ضد الملاريا بواسطة الأجسام المضادة ، والتي تلعب دورا رئيسيا في السيطرة على الملاريا. ومع ذلك ، فإن الحماية المعقمة التي تسببها لقاحات Plasmodium sporozoites الموهنة مرتبطة بالاستجابة الخلوية ، بشكل رئيسي للخلايا الليمفاوية التائية السامة ، مثل خلايا CD8 + وخلايا جاما دلتا تي (γδ T). وبالتالي ، يجب تطوير منهجيات جديدة لفهم وظائف الاستجابة المناعية الخلوية بشكل أفضل وبالتالي دعم العلاج المستقبلي وتطوير اللقاح. لإيجاد استراتيجية جديدة لتحليل هذه المناعة الخلوية لعدوى مرحلة الدم بالمتصورة ، أنشأت مجموعتنا مقايسة في المختبر تقيس قتل خلايا الدم الحمراء المصابة (iRBC) بواسطة الخلايا الليمفاوية السامة للخلايا. يمكن استخدام هذا الفحص لدراسة آليات الاستجابة المناعية الخلوية ضد المتصورة المختلفة في مرحلة الدم. يمكن للخلايا المناعية السامة للخلايا الفطرية والتكيفية القضاء مباشرة على iRBCs والطفيلي داخل الخلايا في آلية المستجيب: الهدف. يتم تصنيف iRBCs المستهدفة لتقييم صلاحية الخلية ، ويتم زراعتها مع الخلايا المستجيبة (خلايا CD8 + T ، γδ T ، NK ، إلخ). يتم حساب نسبة التحلل بناء على الظروف المختبرة ، مقارنة بالتحكم في التحلل التلقائي في الفحص القائم على قياس التدفق الخلوي. في نهاية المطاف ، تعد منهجية فحص القتل هذه تقدما كبيرا في فهم المناعة الخلوية للملاريا في مرحلة الدم ، مما يساعد على الكشف عن أهداف علاجية محتملة جديدة وتسريع تطوير لقاحات الملاريا.
Introduction
لا تزال الملاريا تمثل أزمة صحية عالمية ، حيث تم الإبلاغ عن أكثر من 240 مليون حالة و 627000 حالة وفاة مرتبطة بالملاريا في عام 20201. يوجد حاليا خمسة أنواع طفيلية يمكن أن تسبب الملاريا لدى البشر ، منها المتصورة المنجلية والمتصورة النشيطة هما النوعان الأكثر انتشارا. أثناء عدوى المتصورة ، يكون الكبد أو مرحلة ما قبل كرات الدم الحمراء بدون أعراض ، وتحدث الأعراض فقط أثناء الدورة اللاجنسية للطفيلي في مرحلة كرات الدم الحمراء. في مرحلة العدوى هذه ، يتم إطلاق الآلاف من الميروزويتات المشتقة من مرحلة الكبد في مجرى الدم وتصيب خلايا الدم الحمراء (كرات الدم الحمراء). في كرات الدم الحمراء ، تتمايز الطفيليات إلى تروفوزويتات وشيزونتس عن طريق الفصام ، حتى تمزق الفصام كريات الدم الحمراء ، وتطلق الميروزويت المشكلة حديثا ، مكررة دورة الدم هذه. تؤدي الدورات المتكررة للغزو والتكرار وإطلاق الميروزويت إلى نمو هائل في عدد الطفيليات وتؤدي في النهاية إلى ظهور أعراض المرض2.
أحد التحديات المهمة في دراسة الاستجابة المناعية للملاريا هو أن المتصورة النيابة. التي تصيب البشر لا تصيب نماذج المختبر. وبالتالي ، يجب جمع عينات المرضى المصابين بالبلازموديوم طازجة ومعالجتها وتحليلها على الفور. ومع ذلك، في المناطق الموبوءة بالملاريا، تكون الموارد المتاحة للوصول إلى الآليات المناعية والجزيئية محدودة. بسبب هذه القيود ، تستخدم القوارض على نطاق واسع كنماذج تجريبية للتحقيق في الاستجابة المناعية ضد عدوى البلازموديوم. في حين أن P. berghei و P. chabaudi غالبا ما يستخدمان كبدائل لعدوى P. falciparum ، فإن السلالة غير المميتة من P. yoelii 17XNL لها أيضا العديد من الميزات المشتركة مع P. vivax ، مثل العدوى الشبكيةالمقيدة 3,4. إن تطوير مقايسات البلازموديوم في المختبر ، والتي يمكن استخدامها للعينات المشتقة من النماذج البشرية أو الحيوانية ، له قيمة في اكتساب فهم أفضل للتسبب في الملاريا ومقارنة الاستجابة المناعية التي تثيرها الأنواع المختلفة من الطفيلي.
المناعة الوقائية المضادة للملاريا ليست مفهومة تماما سواء في مرحلة ما قبل كريات الدم الحمراء ولا في مرحلة الدم. من المعروف أن التعرض للعدوى المتكررة يؤدي إلى مناعة مكتسبة جزئية ، ولكن نادرا ما يتم تطوير المناعة المعقمة5. لعقود من الزمان ، ارتبطت المناعة الوقائية المضادة للبلازموديوم بشكل أساسي بتحريض الأجسام المضادة المعادلة أو المرئية التي تمنع غزو الطفيليات للخلايا المضيفة أو تؤدي إلى البلعمة بواسطة الخلايا المقدمة للمستضد ، على التوالي6. ونتيجة لذلك، اعتمدت معظم الجهود المبذولة لإنتاج لقاحات مضادة للملاريا حتى الآن على تحفيز الأجسام المضادة الوقائية وطويلة الأمد 7,8. ومع ذلك ، فإن الحماية المعقمة الناجمة عن التطعيم مع sporozoite الموهن ترتبط ارتباطا مباشرا مع تنشيط وتوسيع الخلايا الليمفاوية التائية السامةللخلايا 8,9.
في الآونة الأخيرة ، أظهرت بعض الدراسات التي أجريت على عينات المرضى المعزولة حديثا والثقافات في المختبر أن الخلايا المناعية السامة للخلايا الفطرية أو التكيفية مثل CD8 + T10 و γδ T 11 و NK12 يمكن أن تقضي مباشرة على كرات الدم الحمراء المصابة بالبلازموديوم وطفيلياتها داخل الخلايا بطريقة المستجيب: النسبة المستهدفة. حددت هذه النتائج الأساسية آلية مستجيب مناعي جديدة تماما في سياق الملاريا. لتشريح هذه المناعة الجديدة المضادة للملاريا ، من الضروري استكشاف آليات المستجيب السام للخلايا القاتلة ضد كرات الدم الحمراء المصابة (iRBCs) في العدوى الطبيعية أو التطعيم.
نقدم هنا مقايسة في المختبر تقيس النشاط السام للخلايا الليمفاوية ضد الملاريا في مرحلة الدم. يمكن أن يساعد هذا الفحص بعد ذلك في توضيح آليات الاستجابة المناعية الخلوية ضد مرحلة كريات الدم الحمراء المتصورة . يتم تمييز الخلايا المستهدفة ، iRBCs ، بإستر كربوكسي فلوريسئين سكسينيميديل (CFSE) لتقييم صلاحية الخلية ، ثم يتم زراعتها مع الخلايا المستجيبة مثل الخلايا الليمفاوية السامة للخلايا (CTL). ثم يتم تقييم هذه الثقافة المشتركة عن طريق قياس التدفق الخلوي ، باستخدام علامات الفلورسنت لأنواع معينة من الخلايا. أخيرا ، يتم حساب النسبة المئوية لتحلل iRBC بواسطة CTL بقسمة الحالة التجريبية على التمزق التلقائي لكرات الدم الحمراء والتحكم في التحلل التلقائي ، والذي يحدث أثناء الحضانة بدون الخلية المستجيبة. بشكل عام ، يمكن أن تساهم منهجية فحص القتل هذه في فهم أفضل لمناعة الملاريا بوساطة الخلايا.
Protocol
تم إجراء جميع الإجراءات وفقا لسياسات مؤسسة أوزوالدو كروز والمجلس الأخلاقي الوطني (CAAE: 59902816.7.0000.5091). تم تطوير البروتوكولات البشرية بالتعاون مع مجموعة البحث السريري من مركز أبحاث الطب الاستوائي في روندونيا (CEPEM) ، الذي كان مسؤولا عن تسجيل المرضى في الدراسة. تم الحصول على موافقة مستنيرة من جميع المرضى.
بالنسبة للدراسة على الحيوانات ، تم تنفيذ الإجراءات وفقا لمبادئ السلوك الواردة في دليل الممارسة البرازيلي لرعاية واستخدام الحيوانات للأغراض العلمية والتعليمية للمجلس الوطني لمراقبة التجارب على الحيوانات (CONCEA). تمت الموافقة على البروتوكولات من قبل مجلس فيوكروز للتجارب على الحيوانات (بروتوكول CEUA LW15 / 20-2).
1. جمع عينات الدم البشري وعزل PBMC
- جمع دم المرضى المصابين بالبلازموديوم في أنبوب جمع الدم المفرغ سعة 10 مل مع هيبارين الصوديوم. نظرا لأن مرضى الملاريا يظهرون اللمفاويات ، فهناك مجموعة من 5-9 × 106 خلايا أحادية النواة في الدم المحيطي (PBMCs) في عينة دم سعة 10 مل. نظرا لأن خلايا CD8 + T أو الخلايا التائية γδ تشكل ~ 10٪ من PBMCs ، يفضل جمع 50-100 مل من الدم / المريض.
ملاحظة: يجب مراعاة ما لا يقل عن 1 × 105 خلايا / حالة مستجيبة. - احسب النسبة المئوية ل iRBCs عن طريق لطاخة الدم كما هو موضح أدناه.
- أضف 5 ميكرولتر من إجمالي الدم إلى شريحة واضحة وقم بإعداد مسحة الدم. أداء وصمة عار سريعة من نوع Romanowsky أو بقعة May-Günwald-Giemsa. هنا ، يتم استخدام مجموعة البقع السريعة الشاملة ، والتي تتكون من ثلاثة كواشف: الكاشف A (التثبيت) ، الكاشف B (صبغة السيتوبلازم) ، والكاشف C (الصبغة التفاضلية النووية والسيتوبلازمية).
- اغمس الشريحة ببطء في المحلول A 10x ، ثم 4x في المحلول B ، وأخيرا 10x في المحلول C. صفي أي كاشف زائد من الشرائح بين المحاليل. بعد الغمس في المحلول C ، اشطف الشريحة في ماء الصنبور الجاري واتركها تجف.
- تحت مجهر ضوئي مستقيم مع هدف غمر الزيت 100x ، عد 1000 كرات الدم الحمراء في مربعات متسلسلة واحسب النسبة المئوية للطفيلي باستخدام المعادلة التالية:
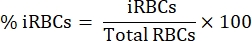
- تمييع 15 مل من الدم بنسبة 1: 1 في محلول ملحي معقم مخزن بالفوسفات (PBS).
- أضف 15 مل من وسط فصل الخلايا الليمفاوية (كثافة 1.077 جم / مل) إلى أنبوب 50 مل. ضع بعناية 30 مل من عينة الدم المخففة على محلول وسط الطرد المركزي. عند وضع طبقات من العينة ، لا تدع عينة الدم ووسط فصل الخلايا اللمفاوية يختلطان.
- أجهزة الطرد المركزي الأنابيب عند 400 × جم لمدة 40 دقيقة عند 22 درجة مئوية ، مع تسارع منخفض وعدم وجود إعداد استراحة.
- اسحب الطبقة العليا التي تحتوي على البلازما باستخدام ماصة معقمة ، تاركا طبقة الخلية أحادية النواة دون عائق. نقل طبقة الخلايا أحادية النواة (PBMCs) إلى أنبوب معقم باستخدام ماصة معقمة.
- لا تتخلص من الأنبوب الذي يحتوي على حبيبات الدم حيث سيتم استخدامه لاحقا لعزل كرات الدم الحمراء المصابة. من هذه الخطوة ، تأكد من الاحتفاظ بكرات الدم الحمراء في درجة حرارة الغرفة (RT). لا تدعهم يبردون.
- اغسل الخلايا مرتين عن طريق إضافة PBS وأجهزة الطرد المركزي عند 350 × جم لمدة 10 دقائق ، مع إعداد الاستراحة. يعاد تعليق حبيبات الخلية في 5 مل من وسط RPMI المكمل بالبنسلين / الستربتومايسين و 10٪ مصل بقري جنيني (FBS ؛ وسط كامل).
- عد PBMCs في وجود محلول تريبان الأزرق للتحقق من صلاحية الخلية ، باستخدام مقياس الدم (غرفة نيوباور) أو عداد الخلايا الآلي. لا تحسب الخلايا الملطخة باللون الأزرق لأنها تمثل خلايا ميتة تمتص التريبان الأزرق.
- اضبط تركيز الخلية على 107 خلايا / مل باستخدام وسط كامل. تنقية مجموعات الخلايا الليمفاوية السامة للخلايا المرغوبة (خلايا CD8 + T ، خلايا NK ، خلايا γδ T) باستخدام عزل الحبيبات المغناطيسية وفقا لبروتوكول الشركة المصنعة للكاشف.
2. عزل كرات الدم الحمراء البشرية
ملاحظة: بالنسبة لعزل كرات الدم الحمراء المصابة بالإنسان ، يوصى بالبدء بعينات الدم التي تحتوي على 2٪ على الأقل من طفيليات الدم ، ويفضل مع المزيد في مرحلة طفيلي تروفوزويت / طفيلي الفصام المبكر.
- قم بإعداد PERCOLL (من المشار إليه فيما بعد باسم وسيط فصل تدرج الكثافة) بالتركيز الموصى به كما هو موضح أدناه.
- أضف 90 مل من وسط فصل التدرج الكثيف 100٪ و 10 مل من 10x PBS للحصول على 90٪ وسط فصل تدرج الكثافة متساوي التوتر.
- بالنسبة لفصل الخلايا الشبكية المصابة ب P. vivax ، قم بإعداد وسائط فصل متدرجة الكثافةبنسبة 45٪. أضف 50 مل من وسط فصل التدرج متساوي التوتر بنسبة 90٪ و 50 مل من 1x PBS للحصول على وسط فصل تدرج الكثافة بنسبة 45٪.
- لفصل كريات الدم الحمراء المصابة بالمتصورة المنجلية ، قم بإعداد وسائط فصل متدرجة الكثافة بنسبة 65٪. أضف 72 مل من وسط فصل التدرج بكثافة متساوية التوتر بنسبة 90٪ و 28 مل من 1x PBS للحصول على وسط فصل تدرج الكثافة بنسبة 65٪.
- لفصل الخلايا الشبكية غير المصابة ، قم بإعداد وسائط فصل متدرجة الكثافة بنسبة 70٪. أضف 78 مل من وسط فصل التدرج بكثافة متساوية التوتر بنسبة 90٪ و 22 مل من 1x PBS للحصول على وسط فصل تدرج الكثافة بنسبة 70٪.
- قم بتسخين وسط فصل تدرج الكثافة إلى 37 درجة مئوية في حمام مائي.
- بعد إزالة طبقة PBMC ، قم بإزالة أكبر قدر ممكن من الطبقة العليا من وسط الطرد المركزي بعناية دون لمس الخلايا. باستخدام ماصة باستور الزجاجية ، قم بإزالة طبقة العدلات العلوية بعناية دون إزعاج حبيبات كرات الدم الحمراء وتقدير حجم الحبيبات. أضف 4x حجم حبيبات RBC لوسط RT الكامل وأعد الاستخدام.
- في أنبوب مخروطي ثان سعة 50 مل ، أضف 5 أضعاف حجم الحبيبات بنسبة 45٪ أو 65٪ أو 70٪ من وسط فصل التدرج الكثافة، اعتمادا على نوع الخلية المراد عزلها. ضع طبقة تعليق كرات الدم الحمراء أعلى الطبقة المتوسطة لفصل تدرج الكثافة بعناية.
- تدور لمدة 15 دقيقة عند 850 × جم ، مع تسارع منخفض وعدم وجود إعداد استراحة. اجمع الطبقة الحمراء / البنية الغائمة الموجودة بين وسط فصل الطافي وتدرج الكثافة باستخدام ماصة سعة 5 مل. نقل إلى أنبوب معقم 15 مل.
- اغسل الخلايا بإضافة وسط RT كامل يصل إلى 15 مل وقم بتدويره لأسفل لمدة 10 دقائق عند 860 × جم. كرر الغسيل بإضافة 10 مل من RT وسط كامل وقم بتدويره لأسفل. تخلص من المادة الطافية وقم بإعداد مسحة دم من الحبيبات للتحقق من إثراء iRBC ، باتباع الخطوة 1.2.
- أعد تعليق الحبيبات في 1 مل من وسط RT الكامل واتركها في درجة حرارة الغرفة أثناء عد الخلايا. أضف 10 ميكرولتر من تعليق الخلية في مقياس الدم (غرفة نيوباور) واحسب كرات الدم الحمراء في المنطقة المركزية مقسمة إلى 25 مربعا متوسطا. اضبط تركيز الخلية على 1 × 107 iRBCs / مل في وسائط RT الكاملة.
3. عدوى الملاريا التجريبية في الفئران
- قم بإذابة حصة P. yoelii 17XNL: PyGFP (MRA-817) المحفوظة بالتبريد ، وهي سلالة معبرة عن GFP تم الحصول عليها من MR4 / ATCC ، وحقن 100 ميكرولتر داخل الصفاق (i.p.) في أنثى فأر C57BL / 6 تبلغ من العمر 8 أسابيع.
- اتبع عبء الطفيليات كل 3 أيام عن طريق جمع الدم في الوريد الذيل.
- ثقب الوعاء مع شطبة الإبرة ، ودخول الوريد بزاوية ضحلة تبدأ من الطرف البعيد من الذيل.
- اجمع عينة الدم باستخدام ماصة أو أنبوب شعري يصل إلى 5 أو 10 مل ، ثم اضغط يدويا لوقف النزيف.
- تحضير لطاخة الدم (كما هو موضح في الخطوة 1.2) حتى يصل الطفيلي إلى 10٪ -15٪ من كرات الدم الحمراء المصابة.
- اجمع 10 ميكرولتر من الدم عن طريق وخز الوريد الذيلي وقم بتخفيفه إلى 100 ميكرولتر من PBS لحقنه في الفأر المتبرع الثاني.
ملاحظة: يجب إذابة الطفيليات المحفوظة بالتبريد وتمريرها في الفئران مرتين قبل استخدامها للعدوى التجريبية. - عندما يصل الممر الثاني إلى 15٪ من طفيليات الدم ، اجمع خمس قطرات من الدم بطريقة قص الذيل وقم بتخفيفها في 1 مل من PBS. قم بإعداد محلول العدوى عن طريق ضبط التركيز إلى 1 × 106 iRBCs / mL في PBS المعقم وحقن i.p. 100 μL (1 x 105 iRBCs) من المحلول في كل فأر مطلوب للتجربة.
- مراقبة الطفيليات كل 2-3 أيام حتى تصل إلى ~ 30٪ iRBCs ، والتي تحدث بعد حوالي 12 يوما من الإصابة. عندما تصل الفئران إلى طفيلي الدم المطلوب ، قم بجمع الدم عن طريق ثقب القلب كما هو موضح أدناه.
- نضح 100 ميكرولتر من محلول الهيبارين (30 وحدة / مل) في حقنة 1 مل بإبرة 26 جم.
- تخدير الماوس عن طريق الاستنشاق مع 5 ٪ isoflurane وتأكيد عدم وجود ردود الفعل. ضع الماوس على جانبه وأدخل الإبرة بشكل عمودي أسفل الكوع مباشرة ، من خلال الضلوع ، وفي القلب. اسحب مكبس المحقنة ببطء وقم بتدوير الإبرة حتى يتم الحصول على 0.5-1 مل من الدم.
- أداء القتل الرحيم الإنساني عن طريق خلع عنق الرحم تحت التخدير. قم بتنظيف الجانب الأيسر من الماوس باستخدام 70٪ من الإيثانول. باستخدام المقص الجراحي ، قم بعمل قطع على الجانب الأيسر من الماوس يمر عبر الجلد والبريتوني. حدد موقع الطحال وقم بإزالته.
- ضع طحال الفأر في طبق بتري مع 5 مل من الوسط الكامل لتنقية عدد الخلايا المستجيبة المرغوبة (على سبيل المثال ، خلايا CD8 + T).
4. الحصول على طحال الفأر الكامل الطازج
- في طبق بتري ، قم بقطع الطحال بعناية إلى قطع صغيرة باستخدام مقص أو ماكينة حلاقة.
- ضع مصفاة خلية 100 ميكرومتر فوق أنبوب مخروطي سعة 50 مل وانقل الطحال المستأصل إلى مصفاة الخلية باستخدام ماصة. هرس الطحال من خلال مصفاة مع حقنة المكبس.
- اغسل الخلايا من خلال المصفاة ب 10 مل من الوسائط الكاملة. قم بطرد الخلايا عند 300 × جم لمدة 10 دقائق عند 4 درجات مئوية ، ثم تخلص من المادة الطافية.
- أعد تعليق حبيبات الخلية في 2 مل من المخزن المؤقت لتحلل RBC البارد 1x. احتضان التعليق لمدة 5 دقائق على الجليد.
- اغسل معلق الخلية بوسائط كاملة سعة 10 مل من 4 درجات مئوية. كرر خطوة الغسيل ثلاث مرات وقم بإزالة أي جلطات خلوية بين غسلات الطحال من الفئران المصابة بالبلازموديوم.
- قم بطرد الخلايا عند 400 × جم لمدة 5 دقائق عند 4 درجات مئوية ، ثم تخلص من المادة الطافية.
ملاحظة: يتم تضخم الطحال المصاب بالبلازموديوم وامتلائه بالخلايا البلعمية التي تحتوي على الهيموجلوبين والهيموزوين المتدهورين. - لتجنب أي مشاكل أثناء عزل الخرزة المغناطيسية للخلايا المستجيبة، استخدم الخطوات التالية لإزالة الخلايا البلعمية الغنية بالهيموزوين والهيموزوين. أعد تعليق الخلايا الطحالية باستخدام المخزن المؤقت MACS واضبط التركيز على 1 × 108 خلايا / مل. ضع عمود LS أو LD في المجال المغناطيسي. قم بإعداد العمود عن طريق الشطف باستخدام 3 مل من المخزن المؤقت MACS.
- تطبيق تعليق الخلية على العمود. اغسل العمود ثلاث مرات باستخدام 3 مل من المخزن المؤقت MACS. اجمع التدفق الذي يحتوي على الخلايا الطحالية.
- عد الخلايا الطحالية في محلول تريبان الأزرق وتحقق من صلاحية الخلية في مقياس الدم (غرفة نيوباور) أو عداد الخلايا الآلي. اضبط تركيز الخلية على 1 × 107 خلايا / مل في وسائط RT الكاملة.
5. تنقية الخلايا المستجيبة السامة للخلايا (اختيار سلبي للخلية التائية CD8a + T)
ملاحظة: هناك العديد من كواشف الانتقاء الإيجابية والسلبية التي يمكنها تنقية الخلايا المستجيبة السامة للخلايا (خلايا CD8 + T و γδ T و NK و iNKT و MAIT). في هذا البروتوكول ، نستخدم مجموعة سلبية من خلايا CD8a + T الطحالية ونتبع تعليمات الشركة المصنعة.
- أجهزة الطرد المركزي جميع خلايا الطحال عند 400 × جم لمدة 10 دقائق عند 4 درجات مئوية وتخلص من المادة الطافية. أعد تعليق حبيبات الخلية في 40 ميكرولتر من المخزن المؤقت MACS.
- أضف 10 ميكرولتر من كوكتيل الأجسام المضادة للبيوتين. تخلط جيدا وتحتضن لمدة 5 دقائق على الجليد.
- أضف 30 ميكرولتر من المخزن المؤقت MACS. أضف 20 ميكرولتر من الخرز الصغير المضاد للبيوتين. تخلط جيدا وتحتضن لمدة 10 دقائق على الجليد.
- أضف 400 ميكرولتر من المخزن المؤقت MACS وانتقل إلى فصل الخلايا المغناطيسية. ضع عمود MACS LS في دعم المجال المغناطيسي. قم بإعداد العمود عن طريق الشطف باستخدام 3 مل من المخزن المؤقت MACS.
- تطبيق تعليق الخلية على العمود. اغسل العمود ثلاث مرات باستخدام 3 مل من المخزن المؤقت MACS. اجمع التدفق الذي يحتوي على جميع الخلايا غير المسماة ، وهي خلايا CD8a + T المخصبة.
- عد خلايا CD8a + T في محلول أزرق تريبان وتحقق من صلاحية الخلية في مقياس الدم (غرفة نيوباور) أو عداد الخلايا الآلي. اضبط تركيز الخلية على 1 × 107 خلايا / مل في وسائط RT الكاملة.
6. P. yoelii المصابة بعزل كرات الدم الحمراء
- أجهزة الطرد المركزي الدم الذي تم جمعه في أنبوب 1.5 مل عند 850 × جم لمدة 3 دقائق. تخلصي من المصل وأعيدي تعليق الدم في 1 مل من 1x RPMI بدون FBS.
- ضع عمود LS في دعامة المجال المغناطيسي واشطفه ب 3 مل من 1x RPMI. مرر تعليق RBC عبر العمود. لعزل المزيد من كرات الدم المتقلبة ، أعد تطبيق التدفق (3 مل من RPMI و 1 مل من الدم المخفف) في العمود.
- يغسل مرتين مع 5 مل من 1x RPMI. قم بتنفيذ خطوات الغسيل عن طريق إضافة قسامات عازلة بمجرد أن يكون خزان العمود فارغا. لا تدع أي أعمدة تجف.
- أضف 5 مل من RPMI ، وقم بإزالة العمود ، وقم بتطهير iRBCs في أنبوب جديد سعة 15 مل. عد كرات الدم المعزولة واضبط التركيز على 1 × 107 كرات الدم الحمراء / مل.
7. وضع العلامات CFSE من كرات الدم الحمراء والتحضير لقياس التدفق الخلوي
ملاحظة: ابدأ بروتوكول وضع العلامات RBC بضعف عدد الخلايا التي سيتم استخدامها للتجربة ، حيث يتم فقد ~ 50٪ من الخلايا عادة في خطوات الغسيل بعد خطوة وضع العلامات CFSE. لتحديد التألق الذاتي لكرات الدم الحمراء / iRBCs ، قم بتضمين عينة تحكم من الخلايا غير المصنفة.
- خفف CFSE إلى تركيز نهائي قدره 10 مللي مول في 1x RPMI بدون FBS. اغسل الخلايا مرة واحدة باستخدام 1x RPMI بدون FBS في أنبوب سعة 15 مل.
- أعد تعليق كرات الدم الحمراء في 500 ميكرولتر من 1x RPMI بدون FBS وأضف 500 ميكرولتر من CFSE المخفف. احتضان لمدة 8 دقائق في RT ، محمية من الضوء.
- اغسل ثلاث مرات بإضافة 14 مل من الوسط الكامل (10٪ FBS RPMI) ، متبوعا بالطرد المركزي عند 850 × جم لمدة 10 دقائق. أعد تعليق الخلايا في وسط كامل إلى تركيز 1-5 × 106 / مل. احتضان لمدة 1 ساعة في RT.
8. زراعة الخلايا الليمفاوية السامة للخلايا / كرات الدم الحمراء والتحضير لقياس التدفق الخلوي
ملاحظة: إذا تم قياس مشاركة مستقبلات أو جزيئات معينة ، فقم باحتضان الأجسام المضادة المحددة للحجب والتحكم في النمط المتماثل (10 مجم / مل) مع الخلايا المستجيبة لمدة 30 دقيقة قبل الزراعة المشتركة.
- لوحة الخلايا في لوحة 96 بئر مستديرة القاع. أضف الخلايا الليمفاوية المنقاة و iRBCs المسمى CFSE في نسبة الخلية المستجيبة المستهدفة المرغوبة إلى حجم نهائي يبلغ 200 ميكرولتر وقم بالتجانس. تحضير كل شرط في ثلاث نسخ.
ملاحظة: نقترح تعديل تركيز iRBC إلى 1-5 × 104 خلايا / مل واختيار النسبة بناء على رقم الخلية المنقى (على سبيل المثال ، 0.5: 1 ، 2.5: 1 ، و 5: 1). - قم بتضمين التحكم في التحلل التلقائي ، وهو iRBCs المستهدف بدون المستجيب ، لتقييم أي تحلل تلقائي ، حيث سيتم استخدام هذا لتمثيل حالة صلاحية الخلية بنسبة 100٪.
- قم بتدوير اللوحة لمدة 1 دقيقة عند 360 × جم لزيادة ملامسة الخلية إلى أقصى حد. احتضان في 37 درجة مئوية و 5 ٪ CO2 لمدة 4 ساعات.
ملاحظة: لا ينبغي استخدام حالات نقص الأكسجة (انخفاض O2) ، المستخدمة بشكل منهجي لثقافة P. falciparum ، لأن الخلايا المستجيبة لا تعيش في هذه البيئة. في المقابل ، تكون طفيليات البلازموديوم قابلة للحياة في الهواء المحيط في 5٪ CO2 لمدة تصل إلى 12 ساعة. - أدر لمدة 5 دقائق عند 850 × جم واقلب اللوحة لإزالة المادة الطافية.
ملاحظة: إذا رغبت في ذلك ، يمكن استخدام المادة الطافية لقياس أي عوامل قابلة للذوبان يتم إطلاقها في الزراعة المشتركة. - قم بتسمية كرات الدم الحمراء بالأجسام المضادة للفأر Ter119 1: 200 (أو CD235 1: 100 المضادة للإنسان للعينات البشرية) وخلايا CD8 + T بالأجسام المضادة ل CD8 1: 200 أو الأجسام المضادة ل CD3 1: 200 (المضادة للفأر أو الإنسان) لمدة 30 دقيقة عند 4 درجات مئوية في 1x PBS يحتوي على 3٪ FBS (مخزن FACS مؤقت).
ملاحظة: يجب اختيار فلوروفور الجسم المضاد بناء على كاشف تتبع الخلية / تكاثر الخلايا (على سبيل المثال ، iRBC المسمى ب CFSE ، و APC-Cy7 anti-Ter119 ، و PerCP-Cy5.5 anti-CD8a). - اغسل الخلايا بمخزن مؤقت FACS وقم بتدويرها لأسفل لمدة 5 دقائق عند 850 × جم. نقل العينات إلى أنابيب FACS وإضافة 30 ميكرولتر من حبات العد إلى الأنابيب الفردية . تجانس حبات العد عن طريق الدوامة لمدة 30 ثانية.
9. قياس التدفق الخلوي
- تحليل العينات باستخدام أداة ليزر 405/488/561/640.
- بالنسبة للخلايا البشرية الموسومة ب CFSE (FITC) و PE المضادة للإنسان γδ TCR و PE-Cy7 الأجسام المضادة CD235a المضادة للإنسان ، استخدم مرشحات 530/30 (FITC) و 575/25 (PE) و 780/60 (PE-Cy7) في مقياس خلوي ثلاثي الليزر (أزرق ، أحمر ، أصفر - أخضر).
- بالنسبة لخلايا الماوس المسماة ب CFSE (FITC) و PerCP-Cy5.5 المضاد للماوس CD8a و APC-Cy7 المضاد للماوس Ter119 ، استخدم مرشحات 530/30 (FITC) و 695/40 (PerCP-Cy5.5) و 780/60 (APC-Cy7) في إعداد مقياس الخلايا ثلاثي الليزر.
- اختر عد حبات السكان كبوابة توقف للحصول على ما لا يقل عن 20000 حدث في بوابة التوقف ، والتي يجب أن تكون متطابقة لجميع الظروف. إجراء التحليل والتعويض باستخدام برنامج اقتناء / تحليل قياس التدفق الخلوي المناسب.
- قم بتعيين استراتيجية البوابات كما هو موضح أدناه.
- حدد خلايا مفردة (مفردة)، باستثناء الحطام باستخدام نسبة ارتفاع ذروة FSC (H) إلى المساحة (A). حدد كرات الدم الحمراء واستبعد الخلايا الليمفاوية من التحليل القائم على مضان علامة كرات الدم الحمراء (Ter119 أو CD235a) والجسم المضاد الخاص بالخلايا الليمفاوية (CD8a).
- في بوابة كرات الدم الحمراء السابقة ، حدد كرات الدم الحمراء القابلة للتطبيق بناء على تلطيخ CFSE الإيجابي. تحليل البيانات باستخدام برنامج تحليل بيانات مقياس التدفق الخلوي.
10. الحساب والإحصاءات
- لحساب النسبة المئوية لتحلل iRBC ، اتبع استراتيجية البوابة الموضحة في الخطوة 9. النسبة المئوية لكرات الدم الحمراء القابلة للحياة هي تردد الخلايا الإيجابية ل CFSE داخل بوابة كرات الدم الحمراء بناء على التألق الإيجابي Ter119 (الماوس) أو CD235a (البشري).
- استخدم التحكم في التحلل التلقائي ، كرات الدم الحمراء بدون خلايا مستجيبة ، كعنصر تحكم لتقدير التمزق التلقائي لكرات الدم الحمراء. سيتم اعتبار هذا الشرط تحلل كرات الدم الحمراء (قابلية البقاء بنسبة 100٪). استخدم الصيغة التالية لحساب النسبة المئوية لتحلل كرات الدم الحمراء في كل حالة تم اختبارها:
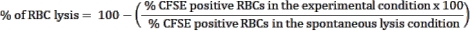
ملاحظة: أثناء حضانة الاستزراع ، قد تتحلل بعض كرات الدم الحمراء المصابة تلقائيا أو تمزقها الطفيلي. استخدم تردد كرات الدم الحمراء الإيجابي CFSE لحالة التحلل التلقائي ، والذي لا يحتوي على خلايا مستجيبة ، كخط أساس للسمية الخلوية للخلايا الليمفاوية. - احسب متوسط النسخ الثلاثية لكل حالة وحدد الدلالة الإحصائية باستخدام ANOVA ثنائي الاتجاه في مقارنات متعددة.
النتائج
هنا ، يتم وصف المنهجية المطبقة لعزل كرات الدم الحمراء المصابة بالبلازموديوم المسمى CFSE في مقايسة الزراعة المشتركة مع الخلايا الليمفاوية السامة للخلايا. أولا ، نقدم تمثيلا تخطيطيا لكيفية تنفيذ البروتوكول ، باستخدام عينات بشرية مصابة ب P. vivax (الشكل 1). بعد ذلك ، مخطط انسيابي مصور حول كيفية المضي قدما في البروتوكول في نموذج تجريبي للملاريا باستخدام فأر C57BL / 6 مصاب ب P. yoelii (الشكل 2). في الشكل 3 ، يتم عرض النتائج المتوقعة (قبل وبعد) للخطوة 6 من البروتوكول (إثراء كرات الدم الحمراء المصابة ب P. yoelii باستخدام أعمدة مغناطيسية). أخيرا ، يوضح الشكل 4 تحليلا تمثيليا لقياس التدفق الخلوي ، يوضح بالتفصيل استراتيجية البوابة اللازمة لتقييم النسبة المئوية لتحلل كرات الدم الحمراء ، كما هو موضح في الخطوة 9. لذلك ، يسلط هذا القسم الضوء على التقنيات المختلفة المستخدمة هنا ، واصفا العملية الكاملة للاكتساب والتجميع وتحليل البيانات لتقييم قتل iRBC بواسطة الخلايا الليمفاوية السامة للخلايا.
تحلل كرات الدم الحمراء المصابة بالبلازموديوم بواسطة الخلايا السامة للخلايا
يوضح الشكل 1 تمثيلا تخطيطيا لبروتوكول تقييم قتل كرات الدم الحمراء البشرية المصابة بالبلازموديوم بواسطة الخلايا السامة للخلايا. لقياس تحلل الخلايا ، تم تنقية PBMC من المرضى المصابين بالبلازموديوم باستخدام وسط الفصل ، تليها التنقية المغناطيسية للخلايا الليمفاوية السامة للخلايا (CTL) ذات الأهمية (على سبيل المثال ، خلايا CD8 + T ، γδ T ، NK ، iNKT ، MAIT ، إلخ). تم استخدام حبيبات كرات الدم الحمراء المتبقية من عزل PBMC لإثراء كرات الدم الحمراء المصابة بالبلازموديوم باستخدام وسط فصل تدرج الكثافة (65٪ P. falciparum ؛ 45٪ P. vivax). تم تصنيف iRBCs مع CFSE وتم تحضينها مع أو بدون الخلايا الليمفاوية لمدة 4 ساعات عند 37 درجة مئوية ، 5٪ CO2. بعد فترة الاستزراع المشترك ، تم تصنيف جميع كرات الدم الحمراء (المصابة أم لا) بالأجسام المضادة CD235a المضادة للإنسان (لكرات الدم الحمراء) والأجسام المضادة الخاصة ب CTL (على سبيل المثال ، anti-CD8 ، anti- γδTCR ، إلخ) قبل تحليل قياس التدفق الخلوي. كان الحصول على العينات البشرية وتحليلها مشابها لتلك الموضحة لعينات الفئران في الشكل 4.
تحلل كرات الدم الحمراء المصاب ب P. yoelii بواسطة خلايا CD8 + T السامة للخلايا
يوضح الشكل 2 مخططا انسيابيا للإجراء التجريبي لتقييم آلية المستجيب السام للخلايا في نموذج الملاريا التجريبي، إلى جانب البيانات التجريبية التمثيلية الموضحة في الشكل 3 والشكل 4. أصيبت الفئران C57BL / 6 ب 1 × 105P. yoelii (Py) iRBCs ، وتم رصد الطفيليات حتى وصلت إلى حوالي 30٪. تم عزل Py-iRBCs من الدم باستخدام الفصل المغناطيسي ، حيث أن المنتج الفرعي للهيم الطفيلي ، الهيموزوين ، غني بالحديد ويعمل كجسيمات بارامغناطيسية في مجال مغناطيسي13. تم تحليل نقاء العينة المخصبة عن طريق مسحة الدم مقارنة بعينة ما قبل العمود (الشكل 3). ثم تم تصنيف iRBCs بكاشف تتبع الخلية CFSE. في موازاة ذلك ، تم تنقية الخلايا التائية CD8 + السامة للخلايا من الخلايا الطحالية باستخدام مجموعة اختيار سلبية مغناطيسية. كعنصر تحكم ، تم استخدام نفس البروتوكول لتنقية الخلايا التائية CD8 + من الفئران غير المصابة. تم تحضين الخلايا المستجيبة (CD8 + T) والخلايا المستهدفة (Py-iRBC المسمى ب CFSE) عند نسب مستجيب: مستهدفة مختلفة (E: T: 0.5: 1 ، 2.5: 1 ، و 5: 1) لمدة 4 ساعات عند 37 درجة مئوية 5٪ CO2. في نهاية الزراعة المشتركة ، تم تصنيف كل حالة بأجسام مضادة للفأر Ter119 لكرات الدم الحمراء ومضادة ل CD8a للخلايا السامة للخلايا. يتم تمثيل استراتيجية البوابات ونتائج العينة في الشكل 4.
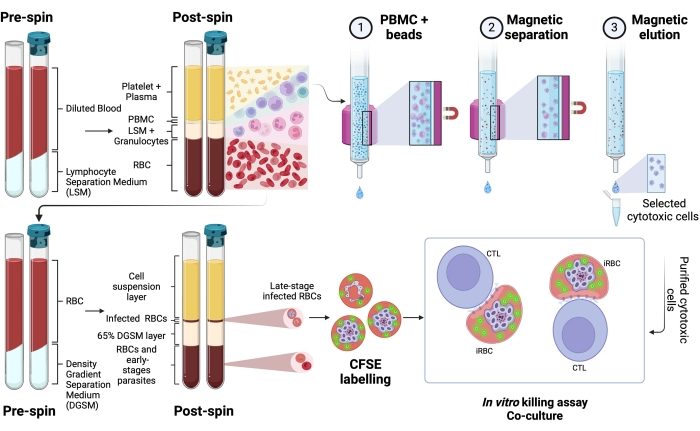
الشكل 1. رسم تخطيطي لمقايسة القتل في المختبر. مثال على تجربة فحص القتل. يتم جمع الدم المصاب بالبلازموديوم ومعالجته باستخدام وسط تدرج الفصل. بعد الطرد المركزي ، يتم جمع طبقة PBMC ، وتم تنقية الخلايا السامة للخلايا (CTLs) باستخدام الخرز المغناطيسي. تتم معالجة طبقة كرات الدم الحمراء مرة أخرى باستخدام وسائط فصل تدرج الكثافة. بعد الطرد المركزي ، يتم جمع طبقة Plasmodium-iRBC ووسمها ب CFSE. بعد ذلك ، تم استزراع CTL و iRBCs المنقى لمدة 4 ساعات عند 37 درجة مئوية ، 5٪ CO2 ، متبوعا بوضع العلامات والتحليل الخاص بالخلية في مقياس التدفق الخلوي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
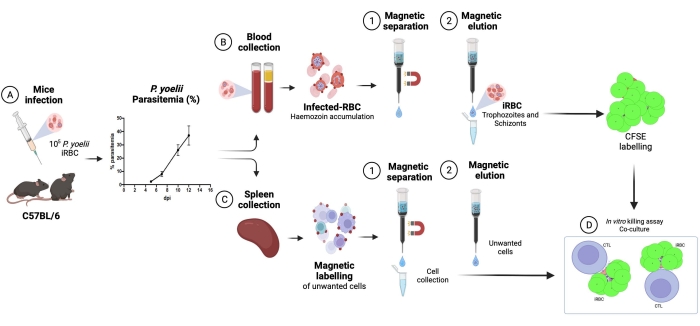
الشكل 2. نموذج تجريبي للملاريا لقتل المقايسة. أولا ، أصيبت الفئران C57BL / 6 ب 105 خلايا دم حمراء مصابة ب PyX17NL. بعد ذلك ، يتم مراقبة الطفيليات عن طريق مسحة الدم ، حتى ذروة العدوى (30٪ -40٪ iRBCs) ، بعد حوالي 12 يوما من الإصابة (نقطة في البوصة). في اليوم التالي ، نزفت الفئران والقتل الرحيم لجمع الطحال. تمت معالجة الدم ، وتم إثراء كرات الدم الحمراء المصابة عن طريق الفصل المغناطيسي ، متبوعا بوضع العلامات باستخدام CFSE (أعلى اليمين). تمت معالجة الطحال لعزل الخلايا الليمفاوية السامة للخلايا ، عن طريق الاختيار السلبي باستخدام الخرز المغناطيسي. بعد ذلك ، تم استزراع الخلايا الليمفاوية السامة للخلايا المنقى و iRBCs لمدة 4 ساعات عند 37 درجة مئوية ، 5٪ CO2 ، متبوعا بوضع العلامات والتحليل الخاص بالخلية في مقياس التدفق الخلوي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
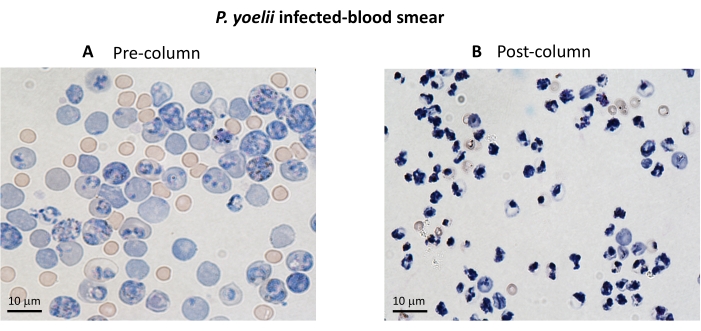
الشكل 3. إثراء iRBC باستخدام الأعمدة المغناطيسية. تم تنقية iRBCs من الفئران المصابة ب P. yoelii باستخدام أعمدة LS. يتم تسليط الضوء على التنقية من خلال مسحات الدم من الدم التي تم جمعها قبل (أ ) وبعد (ب) تخصيب العمود. شريط المقياس = 10 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 4. تقييم نسبة تحلل الخلايا من P. yoelii-iRBCs بواسطة الخلايا الليمفاوية CD8 +. استراتيجية البوابات لنسبة تحلل الخلية. (أ) اضبط بوابة التوقف في عد عدد حبات الخرز (~ 20000 حدث). ب: التحكم في التحلل التلقائي، iRBCs بدون الخلايا الليمفاوية. ابدأ استراتيجية البوابة عن طريق تحديد الخلايا المفردة ، باستثناء الحطام ، بناء على نسبة ارتفاع ذروة FSC إلى المساحة ، متبوعا باختيار مجموعة كرات الدم الحمراء في APC-Cy7 Ter119 إيجابية و PerCP-Cy5.5 CD8 سلبية. ثم حدد iRBCs الحية مثل CFSE (FITC) إيجابية عالية. (ج) مثال على تحليل التجربة باستخدام مستجيب مختلف: النسب المستهدفة ، مع عرض النسبة المئوية لكرات الدم الحمراء الحية بعد الزراعة المشتركة. (د) تمثيل رسومي لنسبة تحلل كرات الدم الحمراء محسوبة بناء على الصيغة الموضحة في القسم 10. تم تقييم مقارنة الأهمية بين المجموعات (CD8 السامة للخلايا أو CD8 الساذجة) بواسطة ANOVA ثنائي الاتجاه مع مقارنات متعددة. P < 0.0001 (****). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
نصف هنا مقايسة في المختبر لقياس قتل خلايا الدم الحمراء المصابة بالبلازموديوم بواسطة الخلايا الليمفاوية السامة. يمكن أن يساعد هذا الفحص في توضيح آليات المناعة الخلوية الوقائية لمرحلة كريات الدم الحمراء لطفيلي الملاريا. الميزة الرئيسية لهذه المنهجية هي أنها توفر مقايسة كمية للقتل بوساطة الخلية من iRBCs التي يمكن استخدامها لمعالجة العديد من الأسئلة حول كيفية تفاعل الخلايا المناعية مع مختلف المتصورة spp.
الأهم من ذلك ، يمكن استخدام هذه الطريقة لدراسة P. vivax وطفيليات البلازموديوم الأخرى التي لا يتم الحفاظ عليها في الثقافة المختبرية 14،15. بالإضافة إلى ذلك ، يمكن تكييف هذا البروتوكول مع أي نوع من المتصورة والمضيفين المختلفين ، مثل البشر والفئران والرئيسيات غير البشرية. تستخدم الطرق القائمة على قياس التدفق الخلوي على نطاق واسع لتقييم تنشيط الخلايا السامة للخلايا ، وإنتاج السيتوكين ، وإزالة التحلل10،11،16 ، ولكن الطريقة الحالية هي الطريقة الوحيدة التي تستكشف تحلل كرات الدم الحمراء عن طريق الاتصال المباشر للخلايا مع الخلايا القاتلة.
هناك أيضا العديد من الطرق ، مثل الفحص المجهري ، وتفاعل البوليميراز المتسلسل (PCR) ، وقياس التدفق الخلوي ، والتي تستخدم لدراسة الملاريا عن طريق قياس طفيليات الدم والغزو والنشاط المضاد للملاريا. ومع ذلك ، لتحليل السمية الخلوية الخلوية لكرات الدم الحمراء ، فإن الطرق الحالية التي تستخدم Cr51 أو إطلاق الهيموجلوبين ليست حساسة بما يكفي لتقييم تحلل كرات الدم الحمراء. يمكن أيضا استخدام إطلاق LDH لتقييم قتل كرات الدم الحمراء بواسطة بعض CTLs مثل خلايا CD8 + T ، ولكن قياس LDH ليس طريقة دقيقة لأن الخلايا الفطرية أو الفطرية المنشطة قد تقتل بعضها البعض كآلية تنظيمية.
يستخدم CFSE على نطاق واسع لتتبع الخلايا أو استكشاف تكاثر الخلايا في قياس التدفق الخلوي أو المجهر الفلوري17. نظرا لأن كرات الدم الحمراء لا تتكاثر18 ، يجب أن تنخفض شدة مضان CFSE مع تحلل الخلية. يعد قياس التدفق الخلوي تقنية دقيقة للغاية حيث يمكنها اكتشاف مستويات منخفضة جدا من علامات محددة ، وبالتالي فقد تم استخدامها على نطاق واسع لتتبع الطفيليات والغزو في عدوى الملاريا19،20،21،22،23. الأهم من ذلك ، يمكن لقياس التدفق الخلوي قياس العديد من المعلمات في خلية واحدة وفرز الخلايا إلى مجموعات سكانية مختلفة. من خلال إضافة الكواشف القياسية الكمية (عد الخرزات) لكل عينة ، يمكن للمرء تطبيع عدد الأحداث المكتسبة والحصول على عدد الخلايا المطلق24. تسمح هذه الطريقة بإجراء مقارنة كمية موثوقة بين الظروف التجريبية ، وهو أمر بالغ الأهمية للبروتوكول المقترح حاليا.
تتضمن بعض الخطوات الحاسمة لهذا البروتوكول ضمان جودة العينة ، وضمان تلطيخ الخلايا بشكل صحيح ، وتضمين عناصر تحكم لتطبيع الحسابات. مطلوب كمية كبيرة من عينات الدم الطازجة لتنقية كرات الدم الحمراء المصابة. يجب التعامل مع تنقية وسط فصل التدرج الكثافي بعناية لأن تركيزه أمر بالغ الأهمية للحصول على كرات الدم المتصلبة iRBCs المطلوبة. يجب أيضا أن يتم تراكب الدم على وسط فصل تدرج الكثافة ببطء قدر الإمكان ، ويجب أن يتم حصاد الطبقة الحمراء الحلقية بعناية لتجنب فقدان iRBCs. لتسهيل عملية التنقية ، يجب استخدام عينة دم عالية من الطفيليات لأن كمية كرات الدم المتقلبة ستكون أعلى. تجدر الإشارة إلى أنه في بروتوكول عزل كرات الدم الحمراء باستخدام المجالات المغناطيسية ، سيتم تنقية المراحل الناضجة الطفيلية فقط (تروفوزويتات المرحلة المتوسطة المتأخرة أو الفصام) التي تنتج كميات كبيرة من الهيموزوين. نتيجة لذلك ، لن يتم جمع أي مرحلة حلقة ، وقد يؤثر ذلك على النتيجة النهائية.
يجب إجراء تلطيخ الخلايا بعناية لتجنب فقدان أو تحلل الخلايا. يجب تجنب التخزين المطول أو التثبيت قبل تلطيخه. من المهم ملاحظة أن الظروف التجريبية يجب أن يتم إجراؤها في ثلاث نسخ باستخدام المستجيب التسلسلي: نسب الهدف والضوابط المناسبة ، مثل حالة التحلل التلقائي غير المسمى والتحكم في الفرضية. تعد إضافة حبات عد الخلايا أمرا بالغ الأهمية لأنها توفر طريقة سهلة لتحديد تركيز الخلايا أو عدد الخلايا المطلق لكل عينة. أثناء الحصول على مقياس التدفق الخلوي ، تأكد من تعيين عدد الأحداث التي سيتم جمعها في بوابة حبات العد لتطبيع عدد الخلايا في كل عينة بعد الزراعة المشتركة.
نظرا لأن هناك حاجة إلى ما لا يقل عن 1 × 105 خلايا مستجيبة للحصول على نتائج متسقة في مقايسة الثقافة المشتركة ، فإن أحد القيود المحتملة للمنهجية الموصوفة هو العدد المحدود من الخلايا بعد التنقية ، والتي يمكن أن تكون مصدر قلق خاصة عند العمل مع مجموعات الخلايا النادرة. في الواقع ، ينطبق هذا على تنقية iRBC ، لأنه يتطلب وجود طفيلي مرتفع للغاية لا يمكن الحصول عليه بسهولة ، خاصة عند العمل مع عينات بشرية في المناطق الموبوءة.
قد يكون أحد التحسينات في البروتوكول هو وقت حضانة الاستزراع المشترك. على الرغم من أننا استخدمنا سابقا وقت حضانة 12 ساعة10,11 ، فقد لاحظنا مؤخرا أن 4 ساعات كافية للتمييز بين الظروف التجريبية ، وبالتالي تقليل وقت التحلل التلقائي المحتمل وتحسين قابلية استنساخ النتائج.
ويجري تدريجيا الكشف عن الآليات التي ينطوي عليها القتل المباشر لكرات الدم الحمراء المصابة بالبلازميديوم. كانت مجموعتنا أول من أظهر أن خلايا CD8 + T يمكنها التعرف على الخلايا الشبكية المصابة ب P.vivax وقتلها عبر عرض HLA-I بواسطة الخليةالمصابة 11. في الآونة الأخيرة ، أظهرت دراسة أخرى أن الخلايا التائية γδ تتعرف على كرات الدم الحمراء المصابة ب P. falciparum من خلال التعرف على المستضد الفوسفاتي بواسطة butyrophylin ، وهو جزيء موجود على سطح iRBCs10. في كلتا الدراستين ، يعتمد تحلل كرات الدم الحمراء على الجرانوليسين والجرانزيم B ، ويؤدي إلى قتل الطفيليات داخل الخلايا.
على الرغم من تطوير العديد من الطرق على مر السنين لقياس طفيليات الدم ، والغزو ، والنشاط المضاد للملاريا ، وتفاعل الخلايا المرئية ، إلا أن أيا منها لم يكن قادرا على تحليل القتل المباشر ل iRBCs بواسطة الخلايا السامة للخلايا في مقايسة قياس التدفق الخلويالكمي 19،20،21. استخدمنا نهجا مبتكرا لتقييم قدرة تحلل الخلايا في الملاريا عن طريق وضع علامات CFSE على كرات الدم الحمراء المصابة بالبلازموديوم وتقييم تحلل iRBC في فترة محددة من الزراعة المشتركة مع الخلايا الليمفاوية. لذلك ، يقدم اختبار القتل في المختبر استراتيجية جديدة لتوضيح آليات المناعة الخلوية للملاريا في مرحلة الدم ، مما سيساعد على تقدم دراسة الأهداف العلاجية الجديدة وتطوير لقاحات الملاريا.
Disclosures
يعلن المؤلفون عدم وجود مصالح متنافسة.
Acknowledgements
نشكر الدكتور ديليو بيريرا وأعضاء مركز أبحاث الطب الاستوائي في روندونيا (CEPEM) على تسجيل مرضى الملاريا وجمع الدم وفيليسيا هو للمساعدة في مراجعة المخطوطات. تم الحصول على الكاشف التالي من خلال BEI Resources و NIAID و NIH: Plasmodium yoelii subsp. yoelii ، Strain 17XNL: PyGFP ، MRA- 817 ، بمساهمة آنا رودريغيز. تم دعم هذا البحث من قبل صندوق ليمان البرازيل للأبحاث ، والمجلس الوطني للتنمية العلمية والتكنولوجية (CNPq) - 437851 / 2018-4 ، والزمالات (CJ ، GC ، CG) ، ومؤسسة أمبارو دو إستادو دي ميناس جيرايس (FAPEMIG) - APQ-00653-16 ، APQ-02962-18 ؛ Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) - زمالة (LL).
Materials
| Name | Company | Catalog Number | Comments |
| 100 μM cell strainer | Corning | 431752 | |
| 96 Well Round (U) Bottom Plate | Thermo Scientific | 12-565-65 | |
| Anti-human CD235a (Glycophorin A) Antibody | Biolegend | 349114 | Used - APC anti-human CD235, dilution 1:100 |
| Anti-human CD3 Antibody | Biolegend | 317314 | Used - PB anti-human CD3, dilution 1:200 |
| Anti-human CD8 Antibody | Biolegend | 344714 | Used - APC/Cy7 anti-human CD8, dilution 1:200 |
| Anti-human TCR Vδ2 Antibody | Biolegend | 331408 | Used - PE anti-human TCR Vδ2, dilution 1:200 |
| Anti-mouse CD8a Antibody | Biolegend | 100733 | Used- PerCP/Cyanine5.5 anti-mouse CD8a, dilution 1:200 |
| Anti-mouse TER-119/Erythroid Cells Antibody | Biolegend | 116223 | Used - APC/Cyanine7 anti-mouse TER-119, dilution 1:200 |
| CellTrace CFSE Cell Proliferation Kit | Invitrogen | C34554 | |
| Fetal Bovine Serum, qualified | Gibco | 26140079 | |
| Ficoll-Paque Plus | Cytiva | 17144003 | Lymphocyte Separation Medium (LSM) |
| Heparin Sodium Injection, USP | meithel pharma | 71228-400-003 | Used - 2000 USP units/2mL |
| Isoflurane | Piramal critical care | 66794-0013-25 | |
| LS MACS Column | Miltenyi Biotec | 130-042-401 | |
| LSRFortessa Cell Analyzer | BD Bioscience | ||
| Percoll | Cytiva | 17089101 | Density Gradient Separation Medium (DGSM) |
| QuadroMACS Separator | Miltenyi Biotec | 130-090-976 | |
| RPMI 1640 Medium | Gibco | 11875093 | |
| Sodium bicarbonate, powder, BioReagent | Sigma-Aldrich | S5761 | |
| Syringe With Sub-Q needle - 1mL, 26 gauge; | BD | 14-829-10F | |
| Vacutainer Heparin Tube Glass Green 10 ml | BD | 366480 |
References
- WHO. Global Technical Strategy for Malaria 2016-2030, 2021 Update. World Health Organization. , (2021).
- Hafalla, J. C., Silvie, O., Matuschewski, K. Cell biology and immunology of malaria. Immunological Reviews. 240 (1), 297-316 (2011).
- Belnoue, E., et al. Vaccination with live Plasmodium yoelii blood stage parasites under chloroquine cover induces cross-stage immunity against malaria liver stage. Journal of Immunology. 181 (12), 8552-8558 (2008).
- Leong, Y. W., Lee, E. Q. H., Rénia, L., Malleret, B. Rodent malaria erythrocyte preference assessment by an ex vivo tropism assay. Frontiers in Cellular and Infection Microbiology. 11, 680136 (2021).
- Ladeia-Andrade, S., Ferreira, M. U., De Carvalho, M. E., Curado, I., Coura, J. R. Age-dependent acquisition of protective immunity to malaria in riverine populations of the amazon basin of Brazil. The American Journal of Tropical Medicine and Hygiene. 80 (3), 452-459 (2009).
- Antonelli, L. R., et al. The immunology of Plasmodium vivax malaria. Immunological Reviews. 293 (1), 163-189 (2020).
- Kazmin, D., et al. Systems analysis of protective immune responses to RTS, S malaria vaccination in humans. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2425-2430 (2017).
- Epstein, J. E., et al. Live attenuated malaria vaccine designed to protect through hepatic CD8+ T cell immunity. Science. 334 (6055), 475-480 (2011).
- Draper, S. J., et al. Malaria vaccines: recent advances and new horizons. Cell Host & Microbe. 24 (1), 43-56 (2018).
- Junqueira, C., et al. γδ T cells suppress Plasmodium falciparum blood-stage infection by direct killing and phagocytosis. Nature Immunology. 22 (3), 347-357 (2021).
- Junqueira, C., et al. Cytotoxic CD8+ T cells recognize and kill Plasmodium vivax-infected reticulocytes. Nature Medicine. 24 (9), 1330-1336 (2018).
- Arora, G., et al. NK cells inhibit Plasmodium falciparum growth in red blood cells via antibody-dependent cellular cytotoxicity. eLife. 7, 36806 (2018).
- Paul, F., Roath, S., Melville, D., Warhurst, D. C., Osisanya, J. O. S. Separation of malaria-infected erythrocytes from whole blood: use of a selective high-gradient magnetic separation technique. Lancet. 2 (8237), 70-71 (1981).
- Shaw-Saliba, K., et al. Insights into an optimization of Plasmodium vivax Sal-1 in vitro culture: the aotus primate model. PLOS Neglected Tropical Diseases. 10 (7), 0004870 (2016).
- Mehlotra, R. K., et al. Long-term in vitro culture of Plasmodium vivax isolates from Madagascar maintained in Saimiri boliviensis blood. Malaria Journal. 16 (1), 442 (2017).
- Hojo-Souza, N. S., et al. Contributions of IFN-γ and granulysin to the clearance of Plasmodium yoelii blood stage. PLOS Pathogens. 16 (9), 1008840 (2020).
- Parish, C. R., Glidden, M. H., Quah, B. J. C., Warren, H. S. Use of the intracellular fluorescent dye CFSE to monitor lymphocyte migration and proliferation. Current Protocols in Immunology. 84 (1), 4-9 (2009).
- Migliaccio, A. R. Erythroblast enucleation. Haematologica. 95 (12), 1985 (2010).
- Grimberg, B. T., Erickson, J. J., Sramkoski, R. M., Jacobberger, J. W., Zimmerman, P. A. Monitoring Plasmodium falciparum growth and development by UV flow cytometry using an optimized Hoechst-thiazole orange staining strategy. Cytometry Part A:The Journal of the International Society for Analytical Cytology. 73 (6), 546-554 (2008).
- Pattanapanyasat, K., et al. Culture of malaria parasites in two different red blood cell populations using biotin and flow cytometry. Cytometry:The Journal of the International Society for Analytical Cytology. 25 (3), 287-294 (1996).
- Bianco, A. E., Battye, F. L., Brown, G. V. Plasmodium falciparum: rapid quantification of parasitemia in fixed malaria cultures by flow cytometry. Experimental Parasitology. 62 (2), 275-282 (1986).
- Jacobberger, J. W., Horan, P. K., Hare, J. D. Analysis of malaria parasite-infected blood by flow cytometry. Cytometry:The Journal of the International Society for Analytical Cytology. 4 (3), 228-237 (1983).
- Bei, A. K., et al. A flow cytometry-based assay for measuring invasion of red blood cells by Plasmodium falciparum. American Journal of Hematology. 85 (4), 234 (2010).
- Montes, M., Jaensson, E. A., Orozco, A. F., Lewis, D. E., Corry, D. B. A general method for bead-enhanced quantitation by flow cytometry. Journal of Immunological Methods. 317 (1-2), 45-55 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved