Method Article
In vitro Dosage de la destruction des globules rouges infectés par le plasmodium par des lymphocytes cytotoxiques
Dans cet article
Résumé
Nous décrivons ici une nouvelle méthode pour aider à élucider les mécanismes de l’immunité cellulaire à Plasmodium pendant le stade sanguin de l’infection. Il s’agit d’un test in vitro qui mesure la destruction des globules rouges infectés par les lymphocytes cytotoxiques.
Résumé
Le paludisme est un problème majeur de santé publique, présentant plus de 200 millions de cas par an dans le monde. Malgré des années d’efforts scientifiques, l’immunité protectrice contre le paludisme est encore mal comprise, principalement en raison des limites méthodologiques de la culture à long terme de Plasmodium, en particulier pour Plasmodium vivax. La plupart des études se sont concentrées sur la protection immunitaire adaptative contre le paludisme par des anticorps, qui jouent un rôle clé dans la lutte contre le paludisme. Cependant, la protection stérile induite par les vaccins atténués contre les sporozoïtes de Plasmodium est liée à la réponse cellulaire, principalement aux lymphocytes T cytotoxiques, tels que les lymphocytes T CD8+ et gamma delta (γδ T). Par conséquent, de nouvelles méthodologies doivent être développées pour mieux comprendre les fonctions de la réponse immunitaire cellulaire et ainsi soutenir la thérapie future et le développement de vaccins. Pour trouver une nouvelle stratégie pour analyser cette immunité à médiation cellulaire contre l’infection au stade sanguin de Plasmodium, notre groupe a établi un test in vitro qui mesure la destruction des globules rouges infectés (iRBC) par les lymphocytes cytotoxiques. Ce test peut être utilisé pour étudier les mécanismes de réponse immunitaire cellulaire contre différents Plasmodium spp. au stade sanguin. Les cellules immunitaires cytotoxiques innées et adaptatives peuvent éliminer directement les iRBC et le parasite intracellulaire dans un mécanisme effecteur:cible. Les iRBC cibles sont marqués pour évaluer la viabilité cellulaire et cocultivés avec des cellules effectrices (cellules CD8+ T, γδ T, NK, etc.). Le pourcentage de lyse est calculé en fonction des conditions testées, par rapport à un contrôle de lyse spontanée dans un test basé sur la cytométrie de flux. En fin de compte, cette méthodologie de test de destruction est une avancée majeure dans la compréhension de l’immunité à médiation cellulaire contre le paludisme au stade sanguin, aidant à découvrir de nouvelles cibles thérapeutiques potentielles et à accélérer le développement de vaccins contre le paludisme.
Introduction
Le paludisme reste une crise sanitaire mondiale, avec plus de 240 millions de cas et 627 000 décès liés au paludisme signalés en 20201. Il existe actuellement cinq espèces parasitaires qui peuvent causer le paludisme chez l’homme, dont Plasmodium falciparum et Plasmodium vivax sont les deux espèces les plus répandues. Au cours de l’infection à Plasmodium , le foie ou le stade pré-érythrocytaire est asymptomatique et les symptômes ne surviennent que pendant le cycle asexué du parasite au stade érythrocytaire. À ce stade de l’infection, des milliers de mérozoïtes dérivés du stade hépatique sont libérés dans la circulation sanguine et infectent les globules rouges (GR). Dans le globule rouge, les parasites se différencient en trophozoïtes et schizontes par schizogone, jusqu’à ce que les schizontes rompent l’érythrocyte, libérant des mérozoïtes nouvellement formés, répétant ce cycle sanguin. Des cycles répétés d’invasion, de réplication et de libération de mérozoïte entraînent une croissance exponentielle de la population parasitaire et déclenchent finalement des symptômes de la maladie2.
Un défi important dans l’étude de la réponse immunitaire au paludisme est que le Plasmodium spp. qui infecte les humains n’infecte pas les modèles animaux de laboratoire. Ainsi, les échantillons de patients infectés par Plasmodium doivent être prélevés frais et immédiatement traités et analysés. Cependant, dans les zones d’endémie palustre, les ressources pour accéder aux mécanismes immunologiques et moléculaires sont limitées. En raison de ces limitations, les rongeurs sont largement utilisés comme modèles expérimentaux pour étudier la réponse immunitaire contre l’infection à Plasmodium. Alors que P. berghei et P. chabaudi sont souvent utilisés comme substituts pour l’infection à P. falciparum, la souche non létale de P. yoelii 17XNL a également de nombreuses caractéristiques en commun avec P. vivax, telles que l’infection restreinte aux réticulocytes 3,4. Le développement des tests in vitro de Plasmodium, qui peuvent être utilisés pour des échantillons dérivés de modèles humains ou animaux, est précieux pour mieux comprendre la pathogenèse du paludisme et comparer la réponse immunologique provoquée par différentes espèces du parasite.
L’immunité antipaludique protectrice n’est pas complètement comprise, ni au stade pré-érythrocytaire, ni au stade sanguin. On sait que l’exposition à des infections répétées entraîne une immunité acquise partielle, mais l’immunité stérile est rarement développée5. Pendant des décennies, l’immunité protectrice anti-Plasmodium a été principalement associée à l’induction d’anticorps neutralisants ou opsonisants qui empêchent l’invasion parasitaire des cellules hôtes ou conduisent à la phagocytose par les cellules présentatrices d’antigènes, respectivement6. En conséquence, la plupart des efforts déployés jusqu’à présent pour produire des vaccins antipaludiques ont reposé sur l’induction d’anticorps protecteurs et durables 7,8. Cependant, la protection stérile induite par la vaccination avec un sporozoïte atténué est directement corrélée à l’activation et à l’expansion des lymphocytes T cytotoxiques 8,9.
Récemment, certaines études portant sur des échantillons de patients fraîchement isolés et des cultures in vitro ont démontré que les cellules immunitaires cytotoxiques innées ou adaptatives comme les cellules CD8+ T 10, γδ T11 et NK12 peuvent éliminer directement les globules rouges infectés par Plasmodium et son parasite intracellulaire de manière effecteur/cible. Ces découvertes fondamentales ont défini un mécanisme effecteur immunitaire entièrement nouveau dans le contexte du paludisme. Pour disséquer cette nouvelle immunité antipaludique, il est essentiel d’explorer les mécanismes effecteurs cytotoxiques des cellules tueuses contre les globules rouges infectés (iRBC) dans l’infection naturelle ou la vaccination.
Nous présentons ici un test in vitro qui mesure l’activité cytotoxique des lymphocytes contre le paludisme au stade sanguin. Ce test peut alors aider à élucider les mécanismes de la réponse immunitaire cellulaire contre le stade érythrocytaire Plasmodium . Les cellules cibles, les iRBC, sont marquées avec de l’ester de carboxyfluorescéine succinimidyl (CFSE) pour évaluer la viabilité cellulaire, puis sont cocultivées avec des cellules effectrices comme les lymphocytes cytotoxiques (CTL). Cette coculture est ensuite évaluée par cytométrie de flux, à l’aide de marqueurs fluorescents pour des types cellulaires spécifiques. Enfin, le pourcentage de lyse iRBC par CTL est calculé en divisant la condition expérimentale par la rupture spontanée des globules rouges et le contrôle de la lyse spontanée, qui se produit pendant l’incubation sans la cellule effectrice. Dans l’ensemble, cette méthodologie de dosage meurtrier peut contribuer à une meilleure compréhension de l’immunité palustre à médiation cellulaire.
Protocole
Toutes les procédures ont été menées conformément aux politiques de la Fondation Oswaldo Cruz et du Conseil national d’éthique (CAAE: 59902816.7.0000.5091). Les protocoles humains ont été développés en collaboration avec le groupe de recherche clinique du Centre de recherche en médecine tropicale de Rondônia (CEPEM), chargé du recrutement des patients dans l’étude. Le consentement éclairé a été obtenu de tous les patients.
Pour l’étude animale, les procédures ont été effectuées conformément aux principes de conduite du Guide de pratique brésilien pour le soin et l’utilisation des animaux à des fins scientifiques et didactiques du Conseil national pour le contrôle de l’expérimentation animale (CONCEA). Les protocoles ont été approuvés par le Conseil d’expérimentation animale de Fiocruz (protocole CEUA LW15/20-2).
1. Prélèvement d’échantillons de sang humain et isolement PBMC
- Prélever le sang des patients infectés par Plasmodium dans un tube de prélèvement de sang sous vide de 10 ml contenant de l’héparine sodique. Comme les patients atteints de paludisme présentent une lymphopénie, il existe une gamme de 5-9 x 106 cellules mononucléées du sang périphérique (PBMC) dans un échantillon de sang de 10 mL. Puisque les lymphocytes T CD8+ ou les lymphocytes T γδ représentent ~10 % des PBMC, prélever de préférence 50 à 100 mL de sang/patient.
REMARQUE: Un minimum de 1 x 105 cellules effectrices / condition doit être envisagé. - Calculer le pourcentage de globules rouges par frottis sanguin comme décrit ci-dessous.
- Ajouter 5 μL de sang total à une lame transparente et préparer un frottis sanguin. Effectuez une coloration rapide panoptique de type Romanowsky ou une coloration May-Günwald-Giemsa. Ici, le kit de coloration rapide panoptique est utilisé, qui est composé de trois réactifs: le réactif A (fixation), le réactif B (coloration cytoplasmique) et le réactif C (coloration différentielle nucléaire et cytoplasmique).
- Trempez lentement la lame dans la solution A 10x, puis 4x dans la solution B, et enfin 10x dans la solution C. Égoutter tout excès de réactif des lames entre les solutions. Après avoir trempé dans la solution C, rincer la lame à l’eau courante du robinet et laisser sécher.
- Sous un microscope à lumière verticale avec un objectif d’immersion dans l’huile 100x, compter 1000 globules rouges dans des carrés séquentiels et calculer le pourcentage de parasitémie à l’aide de l’équation suivante:
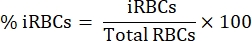
- Diluer 15 mL de sang dans une proportion de 1:1 dans une solution saline tamponnée au phosphate (PBS) stérile.
- Ajouter 15 mL de milieu de séparation lymphocytaire (densité de 1,077 g/mL) dans un tube de 50 mL. Déposer délicatement les 30 mL d’échantillon de sang dilué sur la solution du milieu de centrifugation. Lors de la superposition de l’échantillon, ne laissez pas l’échantillon de sang et le milieu de séparation des lymphocytes se mélanger.
- Centrifuger les tubes à 400 x g pendant 40 min à 22 °C, avec une faible accélération et aucun réglage de rupture.
- Aspirer la couche supérieure contenant le plasma à l’aide d’une pipette stérile, en laissant la couche cellulaire mononucléaire intacte. Transférer la couche de cellules mononucléaires (PBMC) dans un tube stérile à l’aide d’une pipette stérile.
- Ne jetez pas le tube contenant la pastille de sang, car il sera utilisé plus tard pour l’isolement des globules rouges infectés. À partir de cette étape, assurez-vous de conserver les globules rouges à température ambiante (RT). Ne les laissez jamais refroidir.
- Lavez les cellules deux fois en ajoutant du PBS et centrifugez à 350 x g pendant 10 min, avec réglage de rupture. Resuspendre la pastille cellulaire dans 5 mL de milieu RPMI supplémenté avec de la pénicilline/streptomycine et 10 % de sérum fœtal bovin (FBS; milieu complet).
- Compter les PBMC en présence d’une solution de bleu de trypan pour vérifier la viabilité cellulaire, à l’aide d’un hémocytomètre (chambre de Neubauer) ou d’un compteur cellulaire automatisé. Ne comptez pas les cellules colorées en bleu car elles représentent des cellules mourantes, qui absorbent le bleu trypan.
- Ajuster la concentration cellulaire à 107 cellules/ml en utilisant le milieu complet. Purifier les populations de lymphocytes cytotoxiques souhaitées (cellules T CD8+ , cellules NK, cellules T γδ) en utilisant l’isolation des billes magnétiques conformément au protocole du fabricant de réactifs.
2. Isolement humain des globules rouges
REMARQUE: Pour l’isolement des globules rouges infectés par l’homme, il est recommandé de commencer par des échantillons de sang qui présentent un minimum de 2% de parasitémie, de préférence avec plus au stade trophozoïte / parasite schizont précoce.
- Préparer le PERCOLL (ci-après appelé milieu de séparation par gradient de densité) à la concentration recommandée décrite ci-dessous.
- Ajouter 90 mL de milieu de séparation à gradient de densité de 100 % et 10 mL de PBS 10x pour obtenir un milieu de séparation à gradient de densité isotonique de 90 %.
- Pour la séparation des réticulocytes infectés par P. vivax, préparer un milieu de séparation àgradient de densité à 45 %. Ajouter 50 mL de milieu de séparation à gradient de densité isotonique à 90 % et 50 mL de 1x PBS pour obtenir un milieu de séparation à gradient de densité de 45 %.
- Pour la séparation érythrocytaire infectée par P. falciparum, préparer des milieux de séparation à gradient de densité à 65 %. Ajouter 72 mL de milieu de séparation à gradient de densité isotonique à 90 % et 28 mL de 1x PBS pour obtenir un milieu de séparation à gradient de densité de 65 %.
- Pour la séparation des réticulocytes non infectés, préparer un milieu de séparation à gradient de densité à 70 %. Ajouter 78 mL de milieu de séparation à gradient de densité isotonique à 90 % et 22 mL de 1x PBS pour obtenir un milieu de séparation à gradient de densité de 70 %.
- Réchauffer le milieu de séparation du gradient de densité à 37 °C au bain-marie.
- Après avoir retiré la couche PBMC, retirez soigneusement la plus grande partie possible de la couche supérieure du milieu de centrifugation sans toucher les cellules. À l’aide d’une pipette Pasteur en verre, retirez délicatement la couche supérieure de neutrophiles sans perturber la pastille de globule de globule et estimez le volume des granulés. Ajouter 4x le volume de granulés de RBC du milieu complet RT et remettre en suspension.
- Dans un deuxième tube conique de 50 mL, ajouter 5x le volume de pastilles de milieu de séparation à gradient de densité de 45 %, 65 % ou 70 % selon le type de cellule à isoler. Déposer soigneusement la suspension de globules rouges sur la couche de milieu de séparation du gradient de densité.
- Rotation pendant 15 min à 850 x g, avec une faible accélération et aucun réglage de pause. Prélever la couche rouge/brune trouble située entre le surnageant et le milieu de séparation du gradient de densité à l’aide d’une pipette de 5 mL. Transvaser dans un tube stérile de 15 mL.
- Laver les cellules en ajoutant un milieu complet RT jusqu’à 15 ml et faire tourner vers le bas pendant 10 minutes à 860 x g. Répétez le lavage en ajoutant 10 ml de milieu complet RT et essorez. Jeter le surnageant et préparer un frottis sanguin à partir de la pastille pour vérifier l’enrichissement en iRB, après l’étape 1.2.
- Remettez la pastille en suspension dans 1 mL de milieu complet RT et laissez reposer à température ambiante pendant le comptage des cellules. Ajouter 10 μL de suspension cellulaire dans un hémocytomètre (chambre de Neubauer) et compter les globules rouges dans la zone centrale subdivisée en 25 carrés moyens. Ajuster la concentration de la cellule à 1 x 107 iRBCs/mL dans un milieu RT complet.
3. Infection palustre expérimentale chez la souris
- Décongeler une partie aliquote de P. yoelii 17XNL:PyGFP (MRA-817) cryoconservée, une souche exprimant la GFP obtenue à partir de MR4/ATCC, et injecter 100 μL par voie intrapéritonéale (i.p.) à une souris C57BL/6 femelle âgée de 8 semaines.
- Suivez le fardeau parasitémique tous les 3 jours par prélèvement sanguin de la veine de la queue.
- Percer le vaisseau avec le biseauté de l’aiguille, en entrant dans la veine à un angle peu profond commençant à l’extrémité distale de la queue.
- Prélevez l’échantillon de sang à l’aide d’une pipette ou d’un tube capillaire jusqu’à 5 ou 10 mL, puis appliquez une pression manuelle pour arrêter le saignement.
- Préparez un frottis sanguin (tel que décrit à l’étape 1.2) jusqu’à ce que la parasitémie atteigne 10 % à 15 % des globules rouges infectés.
- Prélever 10 μL de sang par autopiqueur de la queue et diluer à 100 μL de PBS pour injecter dans la deuxième souris donneuse.
NOTE: Les parasites cryoconservés doivent être décongelés et passés chez la souris deux fois avant d’être utilisés pour des infections expérimentales. - Lorsque le deuxième passage atteint 15% de parasitémie, prélever cinq gouttes de sang par la méthode de coupe de la queue et diluer dans 1 mL de PBS. Préparer une solution infectieuse en ajustant la concentration à 1 x 106 iRBCs/mL dans du PBS stérile et injecter i.p. 100 μL (1 x 105 iRBCs) de la solution dans chaque souris requise pour l’expérience.
- Surveillez la parasitémie tous les 2-3 jours jusqu’à ce qu’elle atteigne ~30% iRBC, ce qui se produit environ 12 jours après l’infection. Lorsque les souris atteignent la parasitémie souhaitée, prélever du sang par ponction cardiaque comme décrit ci-dessous.
- Aspirer 100 μL de solution d’héparine (30 U/mL) dans une seringue de 1 mL avec une aiguille de 26 G.
- Anesthésier la souris par inhalation avec 5% d’isoflurane et confirmer l’absence de réflexes. Placez la souris sur le côté et insérez perpendiculairement l’aiguille juste en dessous du coude, à travers les côtes et dans le cœur. Retirez lentement le piston de la seringue et tournez l’aiguille jusqu’à ce que 0,5 à 1 ml de sang soit obtenu.
- Pratiquer l’euthanasie humaine par luxation cervicale sous anesthésie. Nettoyez de manière aseptique le côté gauche de la souris avec de l’éthanol à 70%. Avec des ciseaux chirurgicaux, faites une incision sur le côté gauche de la souris en passant par la peau et le péritoine. Localisez la rate et retirez-la.
- Placer la rate de souris dans une boîte de Pétri contenant 5 mL de milieu complet pour purifier la population de cellules effectrices désirée (p. ex. lymphocytes T CD8+ ).
4. Obtention de splénocytes de souris entiers frais
- Dans la boîte de Pétri, coupez soigneusement la rate en petits morceaux à l’aide de ciseaux ou d’un rasoir.
- Placer une crépine cellulaire de 100 μM sur un tube conique de 50 ml et transférer la rate excisée dans la crépine cellulaire à l’aide d’une pipette. Écraser la rate à travers la passoire avec un piston de seringue.
- Lavez les cellules à travers la passoire avec 10 ml de média complet. Centrifuger les cellules à 300 x g pendant 10 min à 4 °C, puis jeter le surnageant.
- Remettez en suspension la pastille cellulaire dans 2 mL de tampon de lyse de RBC froid 1x. Incuber la suspension pendant 5 min sur glace.
- Laver la suspension cellulaire avec 10 ml de média complet à 4 °C. Répétez l’étape de lavage trois fois et retirez tous les caillots cellulaires entre les lavages pour la rate des souris infectées par Plasmodium.
- Centrifuger les cellules à 400 x g pendant 5 min à 4 °C, puis jeter le surnageant.
REMARQUE: Les rates infectées par Plasmodium sont élargies et remplies de cellules phagocytaires contenant de l’hémoglobine et de l’hémozoïne dégradées. - Pour éviter tout problème lors de l’isolement des cellules effectrices par billes magnétiques, procédez comme suit pour éliminer les cellules phagocytaires enrichies en hémozoïne et l’hémozoïne. Remettez les cellules spléniques en suspension avec un tampon MACS et ajustez la concentration à 1 x 108 cellules/mL. Placez une colonne LS ou LD dans le champ magnétique. Préparer la colonne en rinçant avec 3 mL de tampon MACS.
- Appliquez la suspension cellulaire sur la colonne. Lavez la colonne trois fois avec 3 ml de tampon MACS. Recueillir les flux à travers contenant les cellules spléniques.
- Compter les splénocytes dans une solution de bleu trypan et vérifier la viabilité cellulaire dans un hémocytomètre (chambre de Neubauer) ou un compteur cellulaire automatisé. Ajuster la concentration cellulaire à 1 x 107 cellules/ml dans un milieu RT complet.
5. Purification des cellules effectrices cytotoxiques (sélection négative des lymphocytes T CD8a+ )
REMARQUE: Il existe de nombreux réactifs de sélection positive et négative qui peuvent purifier les cellules effectrices cytotoxiques (cellules CD8+ T, γδ T, NK, iNKT, MAIT). Dans ce protocole, nous utilisons une sélection négative de lymphocytes T CD8a+ spléniques et suivons les instructions du fabricant.
- Centrifuger tous les splénocytes à 400 x g pendant 10 min à 4 °C et éliminer le surnageant. Remettez en suspension la pastille de la cellule dans 40 μL de tampon MACS.
- Ajouter 10 μL d’un cocktail biotine-anticorps. Bien mélanger et incuber pendant 5 min sur glace.
- Ajouter 30 μL de tampon MACS. Ajouter 20 μL de microbilles anti-biotine. Bien mélanger et incuber pendant 10 min sur la glace.
- Ajouter 400 μL de tampon MACS et procéder à la séparation des cellules magnétiques. Placez la colonne MACS LS dans le support de champ magnétique. Préparer la colonne en rinçant avec 3 mL de tampon MACS.
- Appliquez la suspension cellulaire sur la colonne. Lavez la colonne trois fois avec 3 ml de tampon MACS. Recueillir le flux continu contenant toutes les cellules non marquées, qui sont les cellules T CD8a + enrichies.
- Compter les lymphocytes T CD8a+ dans une solution de bleu trypan et vérifier la viabilité cellulaire dans un hémocytomètre (chambre de Neubauer) ou un compteur cellulaire automatisé. Ajuster la concentration cellulaire à 1 x 107 cellules/ml dans un milieu RT complet.
6. Isolement des globules rouges infectés par P. yoelii
- Centrifuger le sang recueilli dans un tube de 1,5 mL à 850 x g pendant 3 min. Jeter le sérum et remettre le sang en suspension dans 1 mL de 1x RPMI sans FBS.
- Placer la colonne LS dans le support du champ magnétique et rincer avec 3 mL de 1x RPMI. Passez la suspension RBC dans la colonne. Pour isoler plus de globules iRBC, réappliquer le flux continu (3 mL de RPMI et 1 mL de sang dilué) dans la colonne.
- Laver deux fois avec 5 ml de 1x RPMI. Effectuez les étapes de lavage en ajoutant des aliquotes tampons dès que le réservoir de la colonne est vide. Ne laissez pas les colonnes sécher.
- Ajouter 5 mL de RPMI, retirer la colonne et purger les iRBC dans un nouveau tube de 15 mL. Compter les iRBC et ajuster la concentration à 1 x 107 globules rouges/mL.
7. Marquage CFSE des globules rouges et préparation à la cytométrie en flux
REMARQUE: Démarrez le protocole d’étiquetage RBC avec deux fois le nombre de cellules qui seront utilisées pour l’expérience, car ~ 50% des cellules sont généralement perdues dans les étapes de lavage suivant l’étape d’étiquetage CFSE. Pour établir l’autofluorescence des globules rouges/iRBC, inclure un échantillon témoin de cellules non marquées.
- Diluer le CFSE jusqu’à une concentration finale de 10 mM dans 1x RPMI sans FBS. Lavez les cellules une fois avec 1x RPMI sans FBS dans un tube de 15 mL.
- Resuspendre les globules rouges dans 500 μL de 1x RPMI sans FBS et ajouter 500 μL de CFSE dilué. Incuber pendant 8 min à RT, à l’abri de la lumière.
- Laver trois fois en ajoutant 14 mL de milieu complet (10 % FBS RPMI), suivi d’une centrifugation à 850 x g pendant 10 min. Resuspendre les cellules dans un milieu complet à une concentration de 1-5 x 106/ mL. Incuber pendant 1 h à RT.
8. Coculture lymphocytaire/globules cytotoxiques et préparation à la cytométrie en flux
REMARQUE : Si l’implication de récepteurs ou de molécules spécifiques doit être mesurée, incuber les anticorps de blocage et de contrôle d’isotype spécifiques (10 mg/mL) avec les cellules effectrices pendant 30 minutes avant la coculture.
- Plaquez les cellules dans une plaque à fond rond de 96 puits. Ajouter les lymphocytes purifiés et les iRBC marqués CFSE dans le rapport effecteur-cellule cible souhaité jusqu’à un volume final de 200 μL et homogénéiser. Préparez chaque condition en trois exemplaires.
REMARQUE : Nous suggérons d’ajuster la concentration de globules rouges à 1-5 x 104 cellules/mL et de choisir le rapport en fonction du nombre de cellules purifiées (p. ex. 0,5:1, 2,5:1 et 5:1). - Inclure le contrôle de la lyse spontanée, qui est la cible des iRBC sans l’effecteur, pour évaluer toute lyse spontanée, car cela sera utilisé pour représenter une condition de viabilité cellulaire à 100%.
- Faites tourner la plaque pendant 1 min à 360 x g pour maximiser le contact avec la cellule. Incuber à 37 °C et 5% de CO2 pendant 4 h.
NOTE: Les conditions d’hypoxie (faible O2), systématiquement utilisées pour la culture de P. falciparum , ne doivent pas être utilisées car les cellules effectrices ne survivent pas dans cet environnement. En revanche, les parasites Plasmodium sont viables dans l’air ambiant dans 5% de CO2 jusqu’à 12 h. - Tourner pendant 5 min à 850 x g et retourner la plaque pour retirer le surnageant.
REMARQUE: Si vous le souhaitez, le surnageant peut être utilisé pour mesurer les facteurs solubles libérés dans la coculture. - Étiqueter les globules rouges avec des anticorps anti-souris Ter119 1:200 (ou anti-CD235 1:100 pour les échantillons humains) et des lymphocytes T CD8+ avec des anticorps anti-CD8 1:200 ou anti-CD3 1:200 (anti-souris ou humains) pendant 30 min à 4 °C dans 1x PBS contenant 3% FBS (tampon FACS).
REMARQUE : L’anticorps fluorophore doit être choisi en fonction du traceur cellulaire/réactif de prolifération cellulaire (p. ex. iRBC marqué au CFSE, anti-Ter119 APC-Cy7 et anti-CD8a PerCP-Cy5.5). - Laver les cellules avec un tampon FACS et faire tourner vers le bas pendant 5 minutes à 850 x g. Transférer les échantillons dans des tubes FACS et ajouter 30 μL de billes de comptage dans des tubes individuels . Homogénéiser les perles de comptage en tourbillonnant pendant 30 s.
9. Cytométrie de flux
- Analysez des échantillons à l’aide d’un instrument laser 405/488/561/640.
- Pour les cellules humaines marquées avec des anticorps CFSE (FITC), PE anti-humain γδ TCR et PE-Cy7 anti-humain CD235a, utilisez des filtres 530/30 (FITC), 575/25 (PE) et 780/60 (PE-Cy7) dans un cytomètre de configuration à trois lasers (bleu, rouge, jaune-vert).
- Pour les cellules de souris marquées avec CFSE (FITC), PerCP-Cy5.5 anti-souris CD8a et APC-Cy7 anti-souris Ter119, utilisez des filtres 530/30 (FITC), 695/40 (PerCP-Cy5.5) et 780/60 (APC-Cy7) dans la configuration du cytomètre à trois lasers.
- Choisissez la population de perles de comptage comme porte d’arrêt pour acquérir un minimum de 20 000 événements dans la porte d’arrêt, qui devrait être identique pour toutes les conditions. Effectuer l’analyse et la compensation à l’aide d’un logiciel approprié d’acquisition / analyse de cytométrie en flux.
- Définissez la stratégie de contrôle comme décrit ci-dessous.
- Sélectionnez des cellules individuelles (singulets), à l’exclusion des débris en utilisant le rapport FSC hauteur de crête (H) / surface (A). Sélectionnez les globules rouges et excluez les lymphocytes de l’analyse basée sur la fluorescence du marqueur RBC (Ter119 ou CD235a) et de l’anticorps spécifique des lymphocytes (CD8a).
- Dans les points de contrôle RBC précédents, sélectionnez des globules rouges viables en fonction de la coloration positive du CFSE. Analysez les données avec un logiciel d’analyse de données de cytomètre en flux.
10. Calcul et statistiques
- Pour calculer le pourcentage de lyse iRBi, suivez la stratégie d’établissement de points de contrôle décrite à l’étape 9. Le pourcentage de globules rouges viables est la fréquence des cellules CFSE-positives à l’intérieur de la grille RBC basée sur la fluorescence positive Ter119 (souris) ou CD235a (humaine).
- Utiliser le témoin de lyse spontanée, les globules rouges sans cellules effectrices, comme témoin pour estimer la rupture spontanée des globules rouges. Cette condition sera considérée comme une lyse des globules rouges (viabilité à 100 %). Utilisez la formule suivante pour calculer le pourcentage de lyse des globules rouges dans chaque affection testée :
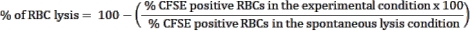
REMARQUE : Pendant l’incubation de la culture, certains globules rouges infectés peuvent se lyser spontanément ou être rompus par le parasite. Utiliser la fréquence des globules rouges positifs pour le CFSE de la condition de lyse spontanée, qui ne contient pas de cellules effectrices, comme base de référence pour la cytotoxicité des lymphocytes. - Calculez la moyenne des triplicates pour chaque affection et déterminez la signification statistique à l’aide de l’ANOVA bidirectionnelle lors de comparaisons multiples.
Résultats
Ici, la méthodologie appliquée pour l’isolement des globules rouges infectés par Plasmodium marqués au CFSE dans un essai de coculture avec des lymphocytes cytotoxiques est décrite. Tout d’abord, nous fournissons une représentation schématique de la façon d’exécuter le protocole, en utilisant des échantillons humains infectés par P. vivax (Figure 1). Ensuite, un organigramme illustré sur la façon de procéder avec le protocole dans un modèle expérimental de paludisme utilisant une souris C57BL/6 infectée par P. yoelii (Figure 2). La figure 3 montre les résultats attendus (avant et après) pour l’étape 6 du protocole (enrichissement des globules rouges infectés par P. yoelii à l’aide de colonnes magnétiques). Enfin, la figure 4 montre une analyse de cytométrie en flux représentative, détaillant la stratégie de contrôle nécessaire pour évaluer le pourcentage de lyse des globules rouges, tel que décrit à l’étape 9. Par conséquent, cette section met en évidence les différentes techniques utilisées ici, décrivant l’ensemble du processus d’acquisition, d’assemblage et d’analyse des données pour évaluer la destruction des iRBC par les lymphocytes cytotoxiques.
Lyse des globules rouges infectés par le plasmodium humain par des cellules cytotoxiques
Une représentation schématique du protocole d’évaluation de la destruction des globules rouges infectés par Plasmodium humain par des cellules cytotoxiques est présentée à la figure 1. Pour mesurer la lyse cellulaire, la PBMC de patients infectés par Plasmodium a été purifiée à l’aide du milieu de séparation, suivie d’une purification magnétique de la population de lymphocytes cytotoxiques (CTL) d’intérêt (par exemple, CD8+ T, γδ T, NK, iNKT, cellules MAIT, etc.). La pastille de globules rouges restant de l’isolement PBMC a été utilisée pour enrichir les globules rouges infectés par Plasmodium en utilisant un milieu de séparation par gradient de densité (65 % P. falciparum; 45 % P. vivax). Les iRBC ont été marqués avec CFSE et incubés avec ou sans lymphocytes pendant 4 h à 37 °C, 5% de CO2. Après la période de coculture, tous les globules rouges (infectés ou non) ont été marqués avec des anticorps anti-humains CD235a (pour les globules rouges) et des anticorps spécifiques CTL (par exemple, anti-CD8, anti-γδTCR, etc.) avant l’analyse par cytométrie de flux. L’acquisition et l’analyse d’échantillons humains étaient semblables à celles démontrées pour des échantillons de souris à la figure 4.
Lyse des globules rouges infectés par P. yoelii par des lymphocytes T CD8+ cytotoxiques
Un organigramme de la procédure expérimentale pour évaluer le mécanisme effecteur cytotoxique dans le modèle expérimental du paludisme est présenté à la figure 2, ainsi que les données expérimentales représentatives présentées à la figure 3 et à la figure 4. Les souris C57BL/6 ont été infectées par 1 x 105P. yoelii (Py) iRBC, et la parasitémie a été surveillée jusqu’à ce qu’elle atteigne environ 30%. Les Py-iRBC ont été isolés du sang par séparation magnétique, car le sous-produit de l’hème parasite, l’hémozoïne, est enrichi en fer et fonctionne comme des particules paramagnétiques dans un champ magnétique13. La pureté de l’échantillon enrichi a été analysée par frottis sanguin par rapport à l’échantillon précolonne (Figure 3). Les iRBC ont ensuite été marqués avec le réactif traceur cellulaire CFSE. En parallèle, des lymphocytes T CD8+ cytotoxiques ont été purifiés à partir de splénocytes à l’aide d’un kit de sélection magnétique négatif. Comme témoin, le même protocole a été utilisé pour la purification des lymphocytes T CD8+ de souris non infectées. Les cellules effectrices (T CD8+) et cibles (Py-iRBC marquées par le CFSE) ont été incubées à différents rapports effecteur:cible (E:T : 0,5:1, 2,5:1 et 5:1) pendant 4 h à 37 °C 5 % de CO2. À la fin de la coculture, chaque condition a été marquée avec des anticorps anti-souris Ter119 pour les globules rouges et anti-CD8a pour les cellules cytotoxiques. La stratégie d’établissement de points de contrôle et les résultats de l’échantillon sont représentés à la figure 4.
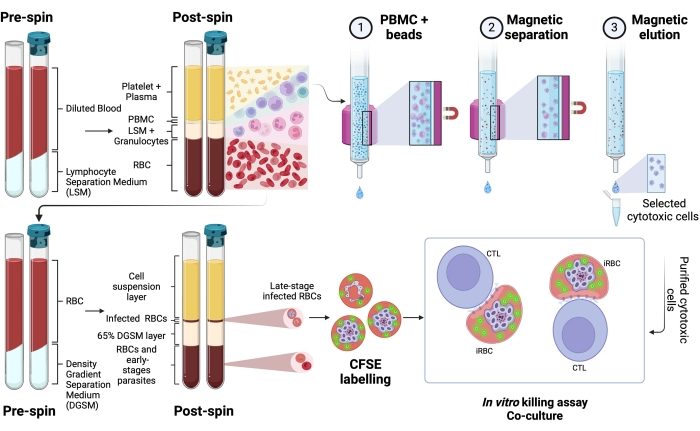
Graphique 1. Schéma du test de mise à mort in vitro. Exemple d’expérience d’essai de mise à mort. Le sang infecté par le plasmodium est recueilli et traité à l’aide d’un milieu de gradient de séparation. Après centrifugation, la couche PBMC est collectée et les cellules cytotoxiques (CTL) ont été purifiées à l’aide de billes magnétiques. La couche RBC est à nouveau traitée à l’aide d’un milieu de séparation à gradient de densité. Après centrifugation, la couche de Plasmodium-iRBC est collectée et marquée au CFSE. Par la suite, les CTL et les iRBC purifiés ont été cocultivés pendant 4 h à 37 °C, 5% de CO2, suivis d’un marquage spécifique à la cellule et d’une analyse dans un cytomètre en flux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
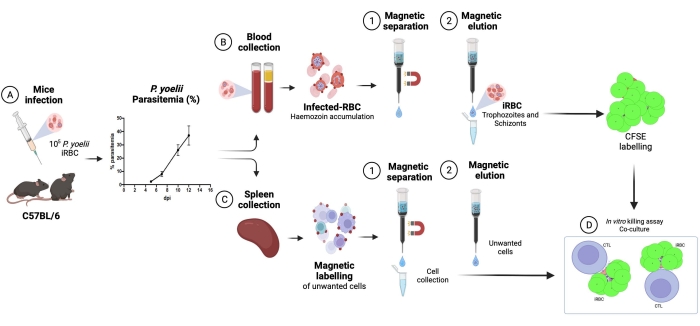
Graphique 2. Modèle expérimental de lutte contre le paludisme pour le test de mise à mort. Tout d’abord, les souris C57BL / 6 ont été infectées par 105 globules rouges infectés par PyX17NL. Ensuite, la parasitémie est surveillée par frottis sanguin, jusqu’au pic de l’infection (30%-40% iRBC), environ 12 jours après l’infection (dpi). Le lendemain, des souris ont été saignées et euthanasiées pour la collecte de la rate. Le sang a été traité et les globules rouges infectés ont été enrichis par séparation magnétique, suivie d’un marquage avec CFSE (en haut à droite). La rate a été traitée pour l’isolement des lymphocytes cytotoxiques, par sélection négative à l’aide de billes magnétiques. Ensuite, les lymphocytes cytotoxiques purifiés et les iRBC ont été cocultivés pendant 4 heures à 37 °C, 5% de CO2, suivis d’un marquage spécifique à la cellule et d’une analyse dans un cytomètre en flux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
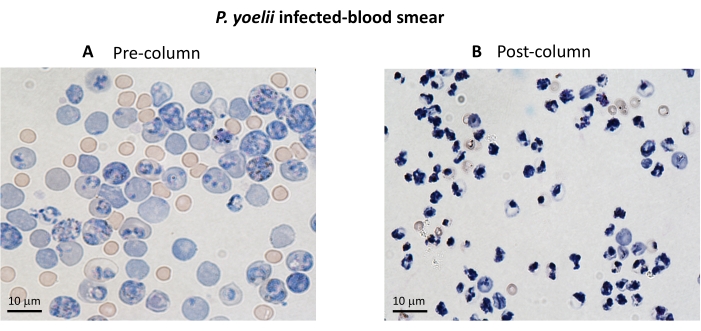
Graphique 3. Enrichissement iRBC à l’aide de colonnes magnétiques. Les iRBC ont été purifiés à partir de souris infectées par P. yoelii à l’aide de colonnes LS. La purification est mise en évidence par des frottis sanguins sur le sang prélevé avant (A) et après (B) l’enrichissement de la colonne. Barre d’échelle = 10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 4. Évaluation du pourcentage de lyse cellulaire de P. yoelii-iRBCs par les lymphocytes CD8+ . La stratégie de déclenchement pour le pourcentage de lyse cellulaire. (A) Placez la porte d’arrêt dans la population de perles de comptage (~20 000 événements). (B) Contrôler la lyse spontanée, les iRBC sans lymphocytes. Commencez la stratégie de déclenchement en sélectionnant les cellules individuelles, à l’exclusion des débris, en fonction du rapport hauteur maximale FSC sur surface, puis en sélectionnant la population de globules rouges dans APC-Cy7 Ter119 positif et PerCP-Cy5.5 CD8 négatif. Sélectionnez ensuite les iRBC en direct comme CFSE (FITC) high positive. (C) Exemple d’analyse expérimentale utilisant différents rapports effecteur: cible, affichant le pourcentage de globules rouges vivants après la coculture. (D) Représentation graphique du pourcentage de lyse des globules rouges calculé selon la formule décrite à l’article 10. La comparaison de la signification entre les groupes (CD8 cytotoxique ou CD8 naïf) a été évaluée par ANOVA bidirectionnelle avec des comparaisons multiples. P < 0,0001 (****). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Nous décrivons ici un test in vitro pour mesurer la destruction des globules rouges infectés par Plasmodium par les lymphocytes cytotoxiques. Ce test peut aider à élucider les mécanismes de l’immunité protectrice cellulaire au stade érythrocytaire du parasite du paludisme. Le principal avantage de cette méthodologie est qu’elle fournit un test quantitatif de la destruction cellulaire des iRBC qui peut être utilisé pour répondre à de nombreuses questions sur la façon dont les cellules immunitaires interagissent avec différents Plasmodium spp.
Il est important de noter que cette méthode peut être utilisée pour étudier P. vivax et d’autres parasites Plasmodium qui ne sont pas maintenus en culture in vitro 14,15. De plus, ce protocole peut être adapté à toutes les espèces de Plasmodium et aux différents hôtes, tels que les humains, les souris et les primates non humains. Les méthodes basées sur la cytométrie en flux sont largement utilisées pour évaluer l’activation cellulaire cytotoxique, la production de cytokines et la dégranulation10,11,16, mais la méthode actuelle est la seule qui explore la lyse des globules rouges par contact cellulaire direct avec les cellules tueuses.
Il existe également de nombreuses méthodes, telles que la microscopie, la réaction en chaîne de la polymérase (PCR) et la cytométrie en flux, qui sont utilisées pour étudier le paludisme en mesurant la parasitémie, l’invasion et l’activité antipaludique. Cependant, pour analyser la cytotoxicité à médiation cellulaire des globules rouges, les méthodes actuelles qui utilisent le Cr51 ou la libération d’hémoglobine ne sont pas suffisamment sensibles pour évaluer la lyse des globules rouges. La libération de LDH peut également être utilisée pour évaluer la destruction des globules rouges par certains LTC comme les lymphocytes T CD8+ , mais la mesure de la LDH n’est pas une méthode précise, car les cellules innées ou innées activées peuvent s’entretuer comme mécanisme de régulation.
Le CFSE est largement utilisé pour suivre les cellules ou explorer la prolifération cellulaire en cytométrie en flux ou en microscopie fluorescente17. Étant donné que les globules rouges ne prolifèrent pas18, l’intensité de fluorescence du CFSE devrait diminuer avec la lyse cellulaire. La cytométrie de flux est une technique très précise car elle peut détecter de très faibles niveaux de marqueurs spécifiques, et elle a donc été largement utilisée pour suivre la parasitémie et l’invasion de l’infection palustre 19,20,21,22,23. Plus important encore, la cytométrie de flux peut mesurer de nombreux paramètres dans une seule cellule et trier les cellules en différentes populations. En ajoutant des réactifs étalons quantitatifs (billes de comptage) à chaque échantillon, on peut normaliser le nombre d’événements acquis et obtenir un nombre absolude cellules 24. Cette méthode permet une comparaison quantitative fiable entre les conditions expérimentales, ce qui est essentiel pour le protocole actuellement proposé.
Certaines étapes critiques pour ce protocole comprennent l’assurance de la qualité de l’échantillon, la coloration appropriée des cellules et l’inclusion de contrôles pour normaliser les calculs. Une grande quantité d’échantillons de sang frais est nécessaire pour purifier les globules rouges infectés. La purification du milieu de séparation à gradient de densité doit être abordée avec prudence car sa concentration est essentielle pour obtenir les iRBC de Plasmodium souhaités. La superposition de sang sur le milieu de séparation du gradient de densité doit également être effectuée aussi lentement que possible, et la récolte de la couche rouge de l’anneau doit être effectuée avec soin pour éviter de perdre des iRBC. Pour faciliter le processus de purification, un échantillon sanguin de parasitémie élevée doit être utilisé car la quantité de cRBCi sera plus élevée. Il convient de noter que dans le protocole d’isolement des globules rouges utilisant des champs magnétiques, seuls les stades matures du parasite (trophozoïtes ou schizontes à stade moyen-tardif) qui produisent des quantités significatives d’hémozoïne seront purifiés. En conséquence, aucun étage d’anneau ne sera collecté, ce qui peut affecter le résultat final.
La coloration cellulaire doit être effectuée avec soin pour éviter la perte ou la lyse des cellules. Le stockage ou la fixation prolongée doit être évité avant la coloration. Il est important de noter que les conditions expérimentales doivent être réalisées en triple exemplaire à l’aide de rapports effecteur/cible en série et de contrôles appropriés, tels qu’une condition de lyse spontanée non marquée et un contrôle d’hypothèse. L’ajout de billes de comptage de cellules est crucial car il fournit un moyen facile de déterminer la concentration de cellules ou le nombre absolu de cellules pour chaque échantillon. Lors de l’acquisition du cytomètre en flux, assurez-vous de régler le nombre d’événements à collecter dans la porte des billes de comptage pour normaliser le nombre de cellules dans chaque échantillon après la coculture.
Étant donné qu’au moins 1 x 105 cellules effectrices sont nécessaires pour obtenir des résultats cohérents dans un test de coculture, une limitation possible de la méthodologie décrite est le nombre limité de cellules après la purification, ce qui peut être une préoccupation en particulier lorsque l’on travaille avec des populations de cellules rares. En effet, cela s’applique à la purification iGR, car elle nécessite d’avoir une parasitémie très élevée qui n’est pas si facile à obtenir, en particulier lorsque l’on travaille avec des échantillons humains dans des zones endémiques.
Une amélioration du protocole peut être le temps d’incubation de la coculture. Bien que nous utilisions auparavant un temps d’incubation de12 h 10,11, nous avons récemment observé que 4 h suffisaient pour différencier les conditions expérimentales, réduisant ainsi le temps de lyse spontanée potentielle et améliorant la reproductibilité des résultats.
Les mécanismes impliqués dans la destruction directe des globules rouges infectés par Plasmodium sont progressivement découverts. Notre groupe a été le premier à montrer que les lymphocytes T CD8+ peuvent reconnaître et tuer les réticulocytes infectés par P. vivax via la présentation HLA-I par la cellule infectée11. Récemment, une autre étude a démontré que les lymphocytes T γδ reconnaissent les globules rouges infectés par P. falciparum par la reconnaissance phosphoantigénique par la butyrophyline, une molécule présente à la surface des iRBC10. Dans les deux études, la lyse des globules rouges dépend de la granulysine et de la granzyme B et entraîne la destruction intracellulaire des parasites.
Bien que de nombreuses méthodes aient été mises au point au fil des ans pour mesurer la parasitémie, l’invasion, l’activité antipaludique et l’interaction des cellules imageuses, aucune n’a été capable d’analyser la destruction directe des iRBC par des cellules cytotoxiques dans un essai quantitatif basé sur la cytométrie en flux 19,20,21. Nous avons utilisé une approche innovante pour évaluer la capacité de lyse cellulaire dans le paludisme par marquage CFSE des globules rouges infectés par Plasmodium et évaluation de la lyse iRBC dans une période spécifique de coculture avec des lymphocytes. Par conséquent, ce test de destruction in vitro présente une nouvelle stratégie pour clarifier les mécanismes de l’immunité à médiation cellulaire contre le paludisme au stade sanguin, ce qui contribuera à faire progresser l’étude de nouvelles cibles thérapeutiques et le développement de vaccins contre le paludisme.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Nous remercions le Dr Dhelio Pereira et les membres du Centre de recherche en médecine tropicale de Rondônia (CEPEM) pour le recrutement des patients atteints de paludisme et la collecte de sang et Felicia Ho pour son aide à la révision des manuscrits. Le réactif suivant a été obtenu par BEI Resources, NIAID, NIH: Plasmodium yoelii subsp. yoelii, Strain 17XNL:PyGFP, MRA- 817, contribution d’Ana Rodriguez. Cette recherche a été soutenue par Lemann Brazil Research Fund, Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) - 437851/2018-4, bourses (CJ, GC, CG), et Fundação de Amparo do Estado de Minas Gerais (FAPEMIG) - APQ-00653-16, APQ-02962-18; Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) - fellowship (LL).
matériels
| Name | Company | Catalog Number | Comments |
| 100 μM cell strainer | Corning | 431752 | |
| 96 Well Round (U) Bottom Plate | Thermo Scientific | 12-565-65 | |
| Anti-human CD235a (Glycophorin A) Antibody | Biolegend | 349114 | Used - APC anti-human CD235, dilution 1:100 |
| Anti-human CD3 Antibody | Biolegend | 317314 | Used - PB anti-human CD3, dilution 1:200 |
| Anti-human CD8 Antibody | Biolegend | 344714 | Used - APC/Cy7 anti-human CD8, dilution 1:200 |
| Anti-human TCR Vδ2 Antibody | Biolegend | 331408 | Used - PE anti-human TCR Vδ2, dilution 1:200 |
| Anti-mouse CD8a Antibody | Biolegend | 100733 | Used- PerCP/Cyanine5.5 anti-mouse CD8a, dilution 1:200 |
| Anti-mouse TER-119/Erythroid Cells Antibody | Biolegend | 116223 | Used - APC/Cyanine7 anti-mouse TER-119, dilution 1:200 |
| CellTrace CFSE Cell Proliferation Kit | Invitrogen | C34554 | |
| Fetal Bovine Serum, qualified | Gibco | 26140079 | |
| Ficoll-Paque Plus | Cytiva | 17144003 | Lymphocyte Separation Medium (LSM) |
| Heparin Sodium Injection, USP | meithel pharma | 71228-400-003 | Used - 2000 USP units/2mL |
| Isoflurane | Piramal critical care | 66794-0013-25 | |
| LS MACS Column | Miltenyi Biotec | 130-042-401 | |
| LSRFortessa Cell Analyzer | BD Bioscience | ||
| Percoll | Cytiva | 17089101 | Density Gradient Separation Medium (DGSM) |
| QuadroMACS Separator | Miltenyi Biotec | 130-090-976 | |
| RPMI 1640 Medium | Gibco | 11875093 | |
| Sodium bicarbonate, powder, BioReagent | Sigma-Aldrich | S5761 | |
| Syringe With Sub-Q needle - 1mL, 26 gauge; | BD | 14-829-10F | |
| Vacutainer Heparin Tube Glass Green 10 ml | BD | 366480 |
Références
- WHO. Global Technical Strategy for Malaria 2016-2030, 2021 Update. World Health Organization. , (2021).
- Hafalla, J. C., Silvie, O., Matuschewski, K. Cell biology and immunology of malaria. Immunological Reviews. 240 (1), 297-316 (2011).
- Belnoue, E., et al. Vaccination with live Plasmodium yoelii blood stage parasites under chloroquine cover induces cross-stage immunity against malaria liver stage. Journal of Immunology. 181 (12), 8552-8558 (2008).
- Leong, Y. W., Lee, E. Q. H., Rénia, L., Malleret, B. Rodent malaria erythrocyte preference assessment by an ex vivo tropism assay. Frontiers in Cellular and Infection Microbiology. 11, 680136 (2021).
- Ladeia-Andrade, S., Ferreira, M. U., De Carvalho, M. E., Curado, I., Coura, J. R. Age-dependent acquisition of protective immunity to malaria in riverine populations of the amazon basin of Brazil. The American Journal of Tropical Medicine and Hygiene. 80 (3), 452-459 (2009).
- Antonelli, L. R., et al. The immunology of Plasmodium vivax malaria. Immunological Reviews. 293 (1), 163-189 (2020).
- Kazmin, D., et al. Systems analysis of protective immune responses to RTS, S malaria vaccination in humans. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2425-2430 (2017).
- Epstein, J. E., et al. Live attenuated malaria vaccine designed to protect through hepatic CD8+ T cell immunity. Science. 334 (6055), 475-480 (2011).
- Draper, S. J., et al. Malaria vaccines: recent advances and new horizons. Cell Host & Microbe. 24 (1), 43-56 (2018).
- Junqueira, C., et al. γδ T cells suppress Plasmodium falciparum blood-stage infection by direct killing and phagocytosis. Nature Immunology. 22 (3), 347-357 (2021).
- Junqueira, C., et al. Cytotoxic CD8+ T cells recognize and kill Plasmodium vivax-infected reticulocytes. Nature Medicine. 24 (9), 1330-1336 (2018).
- Arora, G., et al. NK cells inhibit Plasmodium falciparum growth in red blood cells via antibody-dependent cellular cytotoxicity. eLife. 7, 36806 (2018).
- Paul, F., Roath, S., Melville, D., Warhurst, D. C., Osisanya, J. O. S. Separation of malaria-infected erythrocytes from whole blood: use of a selective high-gradient magnetic separation technique. Lancet. 2 (8237), 70-71 (1981).
- Shaw-Saliba, K., et al. Insights into an optimization of Plasmodium vivax Sal-1 in vitro culture: the aotus primate model. PLOS Neglected Tropical Diseases. 10 (7), 0004870 (2016).
- Mehlotra, R. K., et al. Long-term in vitro culture of Plasmodium vivax isolates from Madagascar maintained in Saimiri boliviensis blood. Malaria Journal. 16 (1), 442 (2017).
- Hojo-Souza, N. S., et al. Contributions of IFN-γ and granulysin to the clearance of Plasmodium yoelii blood stage. PLOS Pathogens. 16 (9), 1008840 (2020).
- Parish, C. R., Glidden, M. H., Quah, B. J. C., Warren, H. S. Use of the intracellular fluorescent dye CFSE to monitor lymphocyte migration and proliferation. Current Protocols in Immunology. 84 (1), 4-9 (2009).
- Migliaccio, A. R. Erythroblast enucleation. Haematologica. 95 (12), 1985 (2010).
- Grimberg, B. T., Erickson, J. J., Sramkoski, R. M., Jacobberger, J. W., Zimmerman, P. A. Monitoring Plasmodium falciparum growth and development by UV flow cytometry using an optimized Hoechst-thiazole orange staining strategy. Cytometry Part A:The Journal of the International Society for Analytical Cytology. 73 (6), 546-554 (2008).
- Pattanapanyasat, K., et al. Culture of malaria parasites in two different red blood cell populations using biotin and flow cytometry. Cytometry:The Journal of the International Society for Analytical Cytology. 25 (3), 287-294 (1996).
- Bianco, A. E., Battye, F. L., Brown, G. V. Plasmodium falciparum: rapid quantification of parasitemia in fixed malaria cultures by flow cytometry. Experimental Parasitology. 62 (2), 275-282 (1986).
- Jacobberger, J. W., Horan, P. K., Hare, J. D. Analysis of malaria parasite-infected blood by flow cytometry. Cytometry:The Journal of the International Society for Analytical Cytology. 4 (3), 228-237 (1983).
- Bei, A. K., et al. A flow cytometry-based assay for measuring invasion of red blood cells by Plasmodium falciparum. American Journal of Hematology. 85 (4), 234 (2010).
- Montes, M., Jaensson, E. A., Orozco, A. F., Lewis, D. E., Corry, D. B. A general method for bead-enhanced quantitation by flow cytometry. Journal of Immunological Methods. 317 (1-2), 45-55 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon