Method Article
In vitro Saggio dell'uccisione dei globuli rossi infetti da plasmodio da parte di linfociti citotossici
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui descriviamo un nuovo metodo per aiutare a chiarire i meccanismi dell'immunità cellulare al Plasmodium durante la fase ematica dell'infezione. Questo è un test in vitro che misura l'uccisione dei globuli rossi infetti da parte dei linfociti citotossici.
Abstract
La malaria è una delle principali preoccupazioni per la salute pubblica, presentando oltre 200 milioni di casi all'anno in tutto il mondo. Nonostante anni di sforzi scientifici, l'immunità protettiva alla malaria è ancora poco conosciuta, principalmente a causa dei limiti metodologici della coltura di Plasmodium a lungo termine, in particolare per il Plasmodium vivax. La maggior parte degli studi si è concentrata sulla protezione dell'immunità adattativa contro la malaria da parte degli anticorpi, che svolgono un ruolo chiave nel controllo della malaria. Tuttavia, la protezione sterile indotta dai vaccini attenuati contro gli sporozoiti del Plasmodium è correlata alla risposta cellulare, principalmente ai linfociti T citotossici, come le cellule T CD8+ e gamma delta (γδ T). Pertanto, devono essere sviluppate nuove metodologie per comprendere meglio le funzioni della risposta immunitaria cellulare e quindi supportare la terapia futura e lo sviluppo di vaccini. Per trovare una nuova strategia per analizzare questa immunità cellulo-mediata all'infezione da stadio ematico del Plasmodium, il nostro gruppo ha stabilito un test in vitro che misura l'uccisione dei globuli rossi infetti (iRBC) da parte dei linfociti citotossici. Questo test può essere utilizzato per studiare i meccanismi di risposta immunitaria cellulare contro diversi Plasmodium spp. nella fase del sangue. Le cellule immunitarie citotossiche innate e adattative possono eliminare direttamente gli iRBC e il parassita intracellulare in un meccanismo effettore:bersaglio. Gli iRBC bersaglio sono marcati per valutare la vitalità cellulare e cocoltati con cellule effettrici (cellule CD8+ T, γδ T, cellule NK, ecc.). La percentuale di lisi viene calcolata in base alle condizioni testate, rispetto a un controllo spontaneo della lisi in un test basato sulla citometria a flusso. In definitiva, questa metodologia di analisi dell'uccisione è un importante progresso nella comprensione dell'immunità cellulo-mediata alla malaria in fase ematica, aiutando a scoprire nuovi potenziali bersagli terapeutici e accelerare lo sviluppo di vaccini contro la malaria.
Introduzione
La malaria rimane una crisi sanitaria globale, con oltre 240 milioni di casi e 627.000 decessi correlati alla malaria segnalati nel 20201. Attualmente ci sono cinque specie parassitarie che possono causare la malaria negli esseri umani, tra cui Plasmodium falciparum e Plasmodium vivax sono le due specie più diffuse. Durante l'infezione da Plasmodium , il fegato o lo stadio pre-eritrocitico è asintomatico e i sintomi si verificano solo durante il ciclo asessuato del parassita nella fase eritrocitica. In questa fase dell'infezione, migliaia di merozoiti derivati dallo stadio epatico vengono rilasciati nel flusso sanguigno e infettano i globuli rossi (RBC). Nei globuli rossi, i parassiti si differenziano in trofozoiti e schizonti per schizogonia, fino a quando gli schizonti rompono l'eritrocita, rilasciando merozoiti appena formati, ripetendo questo ciclo sanguigno. Cicli ripetuti di invasione, replicazione e rilascio di merozoiti provocano una crescita esponenziale della popolazione di parassiti e alla fine innescano i sintomi della malattia2.
Una sfida importante nello studio della risposta immunitaria alla malaria è che il Plasmodium spp. che infetta gli esseri umani non infetta i modelli animali da laboratorio. Pertanto, i campioni di pazienti infetti da plasmodio devono essere raccolti freschi e immediatamente elaborati e analizzati. Tuttavia, nelle aree endemiche della malaria, le risorse per accedere ai meccanismi immunologici e molecolari sono limitate. A causa di queste limitazioni, i roditori sono ampiamente utilizzati come modelli sperimentali per studiare la risposta immunitaria contro l'infezione da Plasmodium. Mentre P. berghei e P. chabaudi sono spesso usati come surrogati per l'infezione da P. falciparum, il ceppo non letale di P. yoelii 17XNL ha anche molte caratteristiche in comune con P. vivax, come l'infezione limitata ai reticolociti 3,4. Lo sviluppo di saggi in vitro di Plasmodium, che possono essere utilizzati per campioni derivati da modelli umani o animali, è prezioso per ottenere una migliore comprensione della patogenesi della malaria e confrontare la risposta immunologica suscitata da diverse specie del parassita.
L'immunità antimalarica protettiva non è completamente compresa né allo stadio pre-eritrocitico né allo stadio sanguigno. È noto che l'esposizione a infezioni ripetute provoca un'immunità acquisita parziale, ma l'immunità sterile è raramente sviluppata5. Per decenni, l'immunità protettiva anti-Plasmodium è stata principalmente associata all'induzione di anticorpi neutralizzanti o opsonizzanti che impediscono l'invasione parassitaria delle cellule ospiti o portano alla fagocitosi da parte delle cellule presentanti l'antigene, rispettivamente6. Di conseguenza, la maggior parte degli sforzi per produrre vaccini antimalarici finora si sono basati sull'induzione di anticorpi protettivi e di lunga durata 7,8. Tuttavia, la protezione sterile indotta dalla vaccinazione con uno sporozoite attenuato è direttamente correlata con l'attivazione e l'espansione dei linfociti T citotossici 8,9.
Recentemente, alcuni studi su campioni di pazienti appena isolati e colture in vitro hanno dimostrato che le cellule immunitarie citotossiche innate o adattative come CD8 + T 10, γδ T11 e cellule NK12 possono eliminare direttamente i globuli rossi infetti da plasmodio e il suo parassita intracellulare in modo effettore:rapporto bersaglio. Questi risultati seminali hanno definito un meccanismo effettore immunitario completamente nuovo nel contesto della malaria. Per analizzare questa nuova immunità antimalarica, è essenziale esplorare i meccanismi effettori citotossici delle cellule killer contro i globuli rossi infetti (iRBC) nell'infezione naturale o nella vaccinazione.
Qui presentiamo un test in vitro che misura l'attività citotossica dei linfociti contro la malaria nella fase del sangue. Questo test può quindi aiutare a chiarire i meccanismi della risposta immunitaria cellulare contro lo stadio eritrocitario del Plasmodium . Le cellule bersaglio, iRBC, sono marcate con carbossifluoresceina succinimidil estere (CFSE) per valutare la vitalità cellulare e sono quindi cocoltivate con cellule effettrici come i linfociti citotossici (CTL). Questa cocoltura viene quindi valutata mediante citometria a flusso, utilizzando marcatori fluorescenti per specifici tipi di cellule. Infine, la percentuale di lisi di iRBC da CTL viene calcolata dividendo la condizione sperimentale per la rottura spontanea dei globuli rossi e il controllo spontaneo della lisi, che si verifica durante l'incubazione senza la cellula effettrice. Nel complesso, questa metodologia di analisi dell'uccisione può contribuire a una migliore comprensione dell'immunità alla malaria cellulo-mediata.
Protocollo
Tutte le procedure sono state condotte seguendo le politiche della Fondazione Oswaldo Cruz e del Consiglio Etico Nazionale (CAAE: 59902816.7.0000.5091). I protocolli umani sono stati sviluppati in collaborazione con il gruppo di ricerca clinica del Centro di ricerca per la medicina tropicale di Rondônia (CEPEM), che era incaricato di arruolare i pazienti nello studio. Il consenso informato è stato ottenuto da tutti i pazienti.
Per lo studio sugli animali, le procedure sono state eseguite seguendo i principi di condotta della Guida pratica brasiliana per la cura e l'uso degli animali per scopi scientifici e didattici del Consiglio nazionale per il controllo della sperimentazione animale (CONCEA). I protocolli sono stati approvati dal Fiocruz Animal Experimentation Council (protocollo CEUA LW15/20-2).
1. Raccolta di campioni di sangue umano e isolamento PBMC
- Raccogliere il sangue dei pazienti infetti da Plasmodium in una provetta evacuata da 10 ml con eparina di sodio. Poiché i pazienti affetti da malaria mostrano linfopenia, esiste un intervallo di 5-9 x 106 cellule mononucleate del sangue periferico (PBMC) in un campione di sangue da 10 ml. Poiché le cellule T CD8+ o le cellule T γδ costituiscono ~ 10% delle PBMC, raccogliere preferibilmente 50-100 ml di sangue / paziente.
NOTA: Deve essere considerato un minimo di 1 x 105 cellule effettrici / condizione. - Calcolare la percentuale di globuli rossi mediante striscio di sangue come descritto di seguito.
- Aggiungere 5 μL di sangue totale a un vetrino trasparente e preparare uno striscio di sangue. Eseguire la macchia veloce panottica di tipo Romanowsky o la macchia May-Günwald-Giemsa. Qui viene utilizzato il kit di colorazione rapida panottica, composto da tre reagenti: reagente A (fissazione), reagente B (colorazione citoplasmatica) e reagente C (colorazione differenziale nucleare e citoplasmatica).
- Immergere lentamente il vetrino nella soluzione A 10x, poi 4x nella soluzione B e infine 10x nella soluzione C. Eliminare eventuali reagenti in eccesso dai vetrini tra le soluzioni. Dopo aver immerso nella soluzione C, sciacquare il vetrino con acqua corrente del rubinetto e lasciarlo asciugare.
- Sotto un microscopio ottico verticale con un obiettivo di immersione in olio 100x, contare 1000 globuli rossi in quadrati sequenziali e calcolare la percentuale di parassitemia utilizzando la seguente equazione:
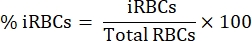
- Diluire 15 ml di sangue in proporzione 1:1 in soluzione salina sterile tamponata fosfato (PBS).
- Aggiungere 15 mL di mezzo di separazione dei linfociti (densità di 1,077 g/ml) in un tubo da 50 ml. Disporre accuratamente i 30 ml di campione di sangue diluito sulla soluzione del mezzo di centrifugazione. Quando si stratifica il campione, non lasciare che il campione di sangue e il mezzo di separazione dei linfociti si mescolino.
- Centrifugare i tubi a 400 x g per 40 minuti a 22 °C, con bassa accelerazione e senza interruzione di impostazione.
- Estrarre lo strato superiore contenente plasma con una pipetta sterile, lasciando indisturbato lo strato di cellule mononucleate. Trasferire lo strato di cellule mononucleate (PBMC) in un tubo sterile utilizzando una pipetta sterile.
- Non gettare il tubo contenente il pellet di sangue poiché verrà utilizzato in seguito per l'isolamento dei globuli rossi infetti. Da questo passaggio, assicurarsi di mantenere i globuli rossi a temperatura ambiente (RT). Non lasciarli mai raffreddare.
- Lavare le celle due volte aggiungendo PBS e centrifugare a 350 x g per 10 minuti, con impostazione di pausa. Risospendere il pellet cellulare in 5 ml di terreno RPMI integrato con penicillina/streptomicina e siero bovino fetale al 10% (FBS; mezzo completo).
- Contare le PBMC in presenza di una soluzione di tripano blu per verificare la vitalità cellulare, utilizzando un ematocitometro (camera di Neubauer) o un contatore automatico delle cellule. Non contare le cellule macchiate di blu in quanto rappresentano cellule morenti, che assorbono il blu tripano.
- Regolare la concentrazione cellulare a 107 cellule/ml utilizzando il mezzo completo. Purificare le popolazioni di linfociti citotossici desiderate (cellule T CD8 + , cellule NK, cellule T γδ) utilizzando l'isolamento delle sfere magnetiche secondo il protocollo del produttore del reagente.
2. Isolamento dei globuli rossi umani
NOTA: Per l'isolamento dei globuli rossi infetti dall'uomo, si raccomanda di iniziare con campioni di sangue che hanno un minimo del 2% di parassitemia, preferenzialmente con più nella fase di trofozoite / parassita schizonte precoce.
- Preparare il PERCOLL (di seguito denominato mezzo di separazione del gradiente di densità) alla concentrazione raccomandata come descritto di seguito.
- Aggiungere 90 ml di mezzo di separazione del gradiente di densità al 100% e 10 ml di PBS 10x per ottenere un mezzo di separazione del gradiente di densità isotonica al 90%.
- Per la separazione dei reticolociti infetti da P. vivax, preparare i mezzi di separazione con gradiente di densitàdel 45%. Aggiungere 50 ml di mezzo di separazione del gradiente di densità isotonica al 90% e 50 ml di 1x PBS per ottenere un mezzo di separazione del gradiente di densità del 45%.
- Per la separazione degli eritrociti infetti da P. falciparum, preparare un mezzo di separazione del gradiente di densità del 65%. Aggiungere 72 ml di mezzo di separazione del gradiente di densità isotonica al 90% e 28 ml di 1x PBS per ottenere un mezzo di separazione del gradiente di densità del 65%.
- Per la separazione dei reticolociti non infetti, preparare un mezzo di separazione con gradiente di densità del 70%. Aggiungere 78 ml di mezzo di separazione del gradiente di densità isotonica al 90% e 22 ml di 1x PBS per ottenere un mezzo di separazione del gradiente di densità del 70%.
- Riscaldare il mezzo di separazione del gradiente di densità a 37 °C a bagnomaria.
- Dopo aver rimosso lo strato PBMC, rimuovere con attenzione il più possibile lo strato superiore del mezzo di centrifugazione senza toccare le cellule. Con una pipetta Pasteur in vetro, rimuovere con attenzione lo strato superiore di neutrofili senza disturbare il pellet RBC e stimare il volume del pellet. Aggiungere 4 volte il volume del pellet RBC del mezzo completo RT e risospendere.
- In un secondo tubo conico da 50 ml, aggiungere 5 volte il volume del pellet del 45%, 65% o 70% del mezzo di separazione del gradiente di densità a seconda del tipo di cella da isolare. Posizionare accuratamente la sospensione RBC sopra lo strato medio di separazione del gradiente di densità.
- Girare per 15 minuti a 850 x g, con bassa accelerazione e nessuna impostazione di interruzione. Raccogliere lo strato rosso/marrone nuvoloso che si trova tra il supernatante e il mezzo di separazione del gradiente di densità con una pipetta da 5 ml. Trasferire in un tubo sterile da 15 ml.
- Lavare le celle aggiungendo RT mezzo completo fino a 15 ml e centrifugare per 10 minuti a 860 x g. Ripetere il lavaggio aggiungendo 10 ml di RT completo e centrifugare. Scartare il surnatante e preparare uno striscio di sangue dal pellet per verificare l'arricchimento di iRBC, seguendo il passaggio 1.2.
- Risospendere il pellet in 1 mL di terreno RT completo e lasciarlo riposare a temperatura ambiente mentre si contano le celle. Aggiungere 10 μL di sospensione cellulare in un emocitometro (camera Neubauer) e contare i globuli rossi nell'area centrale suddivisa in 25 quadrati medi. Regolare la concentrazione cellulare a 1 x 107 iRBC/mL in RT mezzi completi.
3. Infezione sperimentale da malaria nel topo
- Scongelare un'aliquota di P. yoelii 17XNL:PyGFP crioconservato (MRA-817), un ceppo che esprime GFP ottenuto da MR4/ATCC, e iniettare 100 μL per via intraperitoneale (i.p.) in una femmina di topo C57BL/6 di 8 settimane.
- Seguire il carico di parassitemia ogni 3 giorni dalla raccolta di sangue pungidito della vena della coda.
- Forare la nave con l'ago smussato, entrando nella vena con un angolo poco profondo a partire dall'estremità distale della coda.
- Raccogliere il campione di sangue con una pipetta o un tubo capillare fino a 5 o 10 ml, quindi applicare una pressione manuale per fermare l'emorragia.
- Preparare uno striscio di sangue (come descritto nella fase 1.2) fino a quando la parassitemia raggiunge il 10% -15% dei globuli rossi infetti.
- Raccogliere 10 μL di sangue mediante pungidimento della vena caudale e diluire a 100 μL di PBS per iniettare i.p. nel secondo topo donatore.
NOTA: I parassiti crioconservati devono essere scongelati e passati nei topi due volte prima di essere utilizzati per infezioni sperimentali. - Quando il secondo passaggio raggiunge il 15% di parassitemia, raccogliere cinque gocce di sangue con il metodo di taglio della coda e diluire in 1 ml di PBS. Preparare una soluzione di infezione regolando la concentrazione a 1 x 106 iRBC/mL in PBS sterile e iniettare i.p. 100 μL (1 x 105 iRBC) della soluzione in ciascun topo necessario per l'esperimento.
- Monitorare la parassitemia ogni 2-3 giorni fino a raggiungere ~ 30% iRBC, che si verifica circa 12 giorni dopo l'infezione. Quando i topi raggiungono la parassitemia desiderata, raccogliere il sangue mediante puntura cardiaca come descritto di seguito.
- Aspirare 100 μL di soluzione di eparina (30 U/ml) in una siringa da 1 mL con un ago da 26 G.
- Anestetizzare il topo per inalazione con isoflurano al 5% e confermare l'assenza di riflessi. Posizionare il mouse su un lato e inserire perpendicolarmente l'ago appena sotto il gomito, attraverso le costole e nel cuore. Estrarre lentamente lo stantuffo della siringa e ruotare l'ago fino ad ottenere 0,5-1 mL di sangue.
- Eseguire l'eutanasia umana mediante lussazione cervicale in anestesia. Pulire asetticamente il lato sinistro del mouse con etanolo al 70%. Con le forbici chirurgiche, fai un taglio sul lato sinistro del mouse che passa attraverso la pelle e il peritoneo. Individua la milza e rimuovila.
- Posizionare la milza di topo in una capsula di Petri con 5 ml di terreno completo per purificare la popolazione di cellule effettrici desiderata (ad esempio, cellule T CD8 + ).
4. Ottenere splenociti di topo interi freschi
- Nella capsula di Petri, tagliare con cura la milza in piccoli pezzi usando le forbici o un rasoio.
- Posizionare un filtro cellulare da 100 μM su un tubo conico da 50 mL e trasferire la milza asportata nel filtro cellulare con una pipetta. Schiacciare la milza attraverso il colino con uno stantuffo della siringa.
- Lavare le cellule attraverso il filtro con 10 ml di materiale completo. Centrifugare le cellule a 300 x g per 10 minuti a 4 °C, quindi eliminare il surnatante.
- Risospendere il pellet cellulare in 2 ml di tampone di lisi a freddo 1x RBC. Incubare la sospensione per 5 minuti sul ghiaccio.
- Lavare la sospensione cellulare con 10 mL di mezzo completo a 4 °C. Ripetere la fase di lavaggio tre volte e rimuovere eventuali coaguli di cellule tra i lavaggi per la milza da topi infetti da Plasmodium.
- Centrifugare le cellule a 400 x g per 5 minuti a 4 °C, quindi eliminare il surnatante.
NOTA: Le milze infette da plasmodio sono ingrandite e riempite con cellule fagocitiche contenenti emoglobina ed emozoina degradate. - Per evitare problemi durante l'isolamento delle sfere magnetiche delle cellule effettrici, attenersi alla seguente procedura per rimuovere le cellule fagocitiche arricchite di emozoina e l'emozoina. Risospendere le celle spleniche con tampone MACS e regolare la concentrazione a 1 x 108 celle/ml. Posizionare una colonna LS o LD nel campo magnetico. Preparare la colonna risciacquando con 3 ml di tampone MACS.
- Applicare la sospensione cellulare sulla colonna. Lavare la colonna tre volte con 3 ml di tampone MACS. Raccogliere il flusso attraverso contenente le cellule spleniche.
- Contare gli splenociti in una soluzione di tripano blu e controllare la vitalità cellulare in un ematocitometro (camera Neubauer) o contatore cellulare automatizzato. Regolare la concentrazione cellulare a 1 x 107 cellule/mL in RT mezzi completi.
5. Purificazione delle cellule effettrici citotossiche (selezione negativa delle cellule T CD8a + )
NOTA: Esistono molti reagenti di selezione positivi e negativi che possono purificare le cellule effettrici citotossiche (cellule CD8+ T, γδ T, NK, iNKT, MAIT). In questo protocollo, utilizziamo una selezione negativa di cellule T CD8a + spleniche e seguiamo le istruzioni del produttore.
- Centrifugare tutti gli splenociti a 400 x g per 10 minuti a 4 °C ed eliminare il surnatante. Risospendere il pellet cellulare in 40 μL di tampone MACS.
- Aggiungere 10 μL di un cocktail di anticorpi alla biotina. Mescolare bene e incubare per 5 minuti su ghiaccio.
- Aggiungere 30 μL di buffer MACS. Aggiungere 20 μL di microsfere anti-biotina. Mescolare bene e incubare per 10 minuti sul ghiaccio.
- Aggiungere 400 μL di tampone MACS e procedere alla separazione delle celle magnetiche. Posizionare la colonna MACS LS nel supporto del campo magnetico. Preparare la colonna risciacquando con 3 ml di tampone MACS.
- Applicare la sospensione cellulare sulla colonna. Lavare la colonna tre volte con 3 ml di tampone MACS. Raccogliere il flow-through contenente tutte le cellule non etichettate, che sono le cellule T CD8a + arricchite.
- Contare le cellule T CD8a + in una soluzione di tripano blu e controllare la vitalità cellulare in un ematocitometro (camera Neubauer) o contatore cellulare automatizzato. Regolare la concentrazione cellulare a 1 x 107 cellule/ml in RT mezzi completi.
6. P. yoelii infetto RBC isolamento
- Centrifugare il sangue raccolto in una provetta da 1,5 ml a 850 x g per 3 minuti. Eliminare il siero e risospendere il sangue in 1 mL di 1x RPMI senza FBS.
- Posizionare la colonna LS nel supporto del campo magnetico e risciacquare con 3 ml di 1x RPMI. Passare la sospensione RBC attraverso la colonna. Per isolare più globuli rossi, riapplicare il flowthrough (3 ml di RPMI e 1 mL di sangue diluito) nella colonna.
- Lavare due volte con 5 ml di 1x RPMI. Eseguire le fasi di lavaggio aggiungendo aliquote tampone non appena il serbatoio della colonna è vuoto. Non lasciare asciugare le colonne.
- Aggiungere 5 mL di RPMI, rimuovere la colonna ed eliminare gli iRBC in un nuovo tubo da 15 ml. Contare gli iRBC e regolare la concentrazione a 1 x 107 RBC / ml.
7. Marcatura CFSE dei globuli rossi e preparazione per la citometria a flusso
NOTA: Avviare il protocollo di etichettatura RBC con il doppio del numero di celle che verranno utilizzate per l'esperimento, poiché ~ 50% delle celle viene in genere perso nelle fasi di lavaggio successive alla fase di etichettatura CFSE. Per stabilire l'autofluorescenza dei globuli rossi/iRBC, includere un campione di controllo di cellule non marcate.
- Diluire CFSE ad una concentrazione finale di 10 mM in 1x RPMI senza FBS. Lavare le celle una volta con 1x RPMI senza FBS in un tubo da 15 ml.
- Risospendere i globuli rossi in 500 μL di 1x RPMI senza FBS e aggiungere 500 μL di CFSE diluito. Incubare per 8 minuti a RT, al riparo dalla luce.
- Lavare tre volte aggiungendo 14 ml di mezzo completo (10% RPMI FBS), seguito da centrifugazione a 850 x g per 10 minuti. Risospendere le cellule in mezzo completo ad una concentrazione di 1-5 x 106 / ml. Incubare per 1 ora a RT.
8. Cocoltura di linfociti/globuli rossi citotossici e preparazione per citometria a flusso
NOTA: Se verrà misurato il coinvolgimento di specifici recettori o molecole, incubare gli anticorpi specifici bloccanti e di controllo isotipo (10 mg/ml) con le cellule effettrici per 30 minuti prima della cocoltura.
- Placcare le celle in una piastra a fondo rotondo a 96 pozzetti. Aggiungere i linfociti purificati e gli iRBC marcati con CFSE nel rapporto effettore-cellula bersaglio desiderato ad un volume finale di 200 μL e omogeneizzare. Preparare ogni condizione in triplice copia.
NOTA: Suggeriamo di regolare la concentrazione di iRBC a 1-5 x 104 cellule / ml e scegliere il rapporto in base al numero di cellule purificate (ad esempio, 0,5: 1, 2,5: 1 e 5: 1). - Includere il controllo della lisi spontanea, che è il bersaglio degli iRBC senza l'effettore, per valutare qualsiasi lisi spontanea, poiché questo verrà utilizzato per rappresentare una condizione di vitalità cellulare al 100%.
- Ruotare la piastra per 1 minuto a 360 x g per massimizzare il contatto cellulare. Incubare a 37 °C e 5% di CO2 per 4 ore.
NOTA: Le condizioni di ipossia (basso O2), utilizzate sistematicamente per la coltura di P. falciparum , non devono essere utilizzate poiché le cellule effettrici non sopravvivono in questo ambiente. Al contrario, i parassiti Plasmodium sono vitali nell'aria ambiente al 5% di CO2 fino a 12 ore. - Ruotare per 5 minuti a 850 x g e capovolgere la piastra per rimuovere il surnatante.
NOTA: Se lo si desidera, il surnatante può essere utilizzato per misurare qualsiasi fattore solubile rilasciato nella cocoltura. - Etichettare i globuli rossi con anticorpi anti-topo Ter119 1:200 (o anti-umano CD235 1:100 per campioni umani) e cellule T CD8+ con anticorpi anti-CD8 1:200 o anti-CD3 1:200 (anti-topo o umano) per 30 minuti a 4 °C in 1x PBS contenente il 3% di FBS (tampone FACS).
NOTA: Il fluoroforo anticorpale deve essere selezionato in base al tracciante cellulare/reagente di proliferazione cellulare (ad esempio, iRBC marcato con CFSE, APC-Cy7 anti-Ter119 e PerCP-Cy5.5 anti-CD8a). - Lavare le celle con tampone FACS e centrifugare per 5 minuti a 850 x g. Trasferire i campioni in provette FACS e aggiungere 30 μL di sfere di conteggio alle singole provette . Omogeneizzare le perline di conteggio mediante vortice per 30 s.
9. Citometria a flusso
- Analizza i campioni utilizzando uno strumento laser 405/488/561/640.
- Per le cellule umane marcate con CFSE (FITC), PE anti-umano γδ TCR e PE-Cy7 anti-umano CD235a, utilizzare filtri 530/30 (FITC), 575/25 (PE) e 780/60 (PE-Cy7) in un citometro a configurazione a tre laser (blu, rosso, giallo-verde).
- Per le cellule di topo marcate con CFSE (FITC), PerCP-Cy5.5 anti-mouse CD8a e APC-Cy7 anti-mouse Ter119, utilizzare i filtri 530/30 (FITC), 695/40 (PerCP-Cy5.5) e 780/60 (APC-Cy7) nella configurazione del citometro a tre laser.
- Scegli la popolazione di perline di conteggio come cancello di arresto per acquisire un minimo di 20.000 eventi nel cancello di arresto, che dovrebbe essere identico per tutte le condizioni. Eseguire analisi e compensazione utilizzando un software di acquisizione/analisi della citometria a flusso appropriato.
- Impostare la strategia di gating come descritto di seguito.
- Selezionare singole celle (singoletto), escludendo i detriti utilizzando il rapporto FSC tra altezza di picco (H) e area (A). Selezionare i globuli rossi ed escludere i linfociti dall'analisi basata sulla fluorescenza del marcatore RBC (Ter119 o CD235a) e dell'anticorpo specifico dei linfociti (CD8a).
- Nel precedente RBC gating, selezionare RBC vitali in base alla colorazione positiva CFSE. Analizza i dati con il software di analisi dei dati del citometro a flusso.
10. Calcolo e statistiche
- Per calcolare la percentuale di lisi iRBC, seguire la strategia di gating descritta nel passaggio 9. La percentuale di globuli rossi vitali è la frequenza delle cellule CFSE-positive all'interno del gate RBC basata sulla fluorescenza positiva di Ter119 (topo) o CD235a (umano).
- Utilizzare il controllo della lisi spontanea, i globuli rossi senza cellule effettrici, condizione come controllo per stimare la rottura spontanea dei globuli rossi. Questa condizione sarà considerata lisi dei globuli rossi (vitalità al 100%). Utilizzare la seguente formula per calcolare la percentuale di lisi dei globuli rossi in ogni condizione testata:
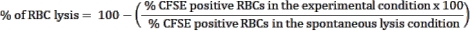
NOTA: Durante l'incubazione della coltura, alcuni globuli rossi infetti possono liarsi spontaneamente o essere rotti dal parassita. Utilizzare la frequenza dei globuli rossi positivi alla CFSE della condizione di lisi spontanea, che non contiene cellule effettrici, come linea di base per la citotossicità dei linfociti. - Calcolare la media delle triplicate per ciascuna condizione e determinare la significatività statistica utilizzando ANOVA bidirezionale a confronti multipli.
Risultati
Qui viene descritta la metodologia applicata per l'isolamento di globuli rossi infetti da plasmodio marcati con CFSE in un test di cocoltura con linfociti citotossici. In primo luogo, forniamo una rappresentazione schematica di come eseguire il protocollo, impiegando campioni umani infetti da P. vivax (Figura 1). Quindi, un diagramma di flusso illustrato su come procedere con il protocollo in un modello sperimentale di malaria utilizzando un topo C57BL / 6 infetto da P. yoelii (Figura 2). Nella Figura 3 sono mostrati i risultati attesi (prima e dopo) per la fase 6 del protocollo (arricchimento di globuli rossi infetti da P. yoelii mediante colonne magnetiche). Infine, la Figura 4 mostra un'analisi rappresentativa della citometria a flusso, che descrive in dettaglio la strategia di gating necessaria per valutare la percentuale di lisi dei globuli rossi, come descritto nella fase 9. Pertanto, questa sezione evidenzia le diverse tecniche utilizzate qui, descrivendo l'intero processo di acquisizione, assemblaggio e analisi dei dati per valutare l'uccisione di iRBC da parte dei linfociti citotossici.
Lievisi dei globuli rossi infetti da plasmodio umano da cellule citotossiche
Una rappresentazione schematica del protocollo per valutare l'uccisione di globuli rossi umani infetti da Plasmodium da parte di cellule citotossiche è mostrata nella Figura 1. Per misurare la lisi cellulare, la PBMC di pazienti infetti da Plasmodium è stata purificata utilizzando il mezzo di separazione, seguita dalla purificazione magnetica della popolazione di linfociti citotossici (CTL) di interesse (ad esempio, cellule CD8+ T, γδ T, NK, iNKT, MAIT, ecc.). Il pellet dei globuli rossi rimanente dall'isolamento PBMC è stato utilizzato per arricchire i globuli rossi infetti da plasmodio utilizzando il mezzo di separazione del gradiente di densità (65% P. falciparum; 45% P. vivax). Gli iRBC sono stati marcati con CFSE e incubati con o senza linfociti per 4 ore a 37 °C, 5% CO2. Dopo il periodo di cocoltura, tutti i globuli rossi (infetti o meno) sono stati marcati con anticorpi anti-umani CD235a (per i globuli rossi) e anticorpi specifici CTL (ad esempio, anti-CD8, anti- γδTCR, ecc.) prima dell'analisi citometrica a flusso. L'acquisizione e l'analisi di campioni umani sono state simili a quelle dimostrate per i campioni di topo nella Figura 4.
Lisi dei globuli rossi infettati da P. yoelii mediante cellule T CD8+ citotossiche
Un diagramma di flusso della procedura sperimentale per valutare il meccanismo effettore citotossico nel modello sperimentale di malaria è mostrato in Figura 2, insieme a dati sperimentali rappresentativi mostrati in Figura 3 e Figura 4. I topi C57BL / 6 sono stati infettati con 1 x 105P. yoelii (Py) iRBC e la parassitemia è stata monitorata fino a raggiungere circa il 30%. I Py-iRBC sono stati isolati dal sangue usando la separazione magnetica, poiché il sottoprodotto dell'eme parassita, l'emozoina, è arricchito di ferro e funziona come particelle paramagnetiche in un campo magnetico13. La purezza del campione arricchito è stata analizzata mediante striscio di sangue rispetto al campione pre-colonna (Figura 3). Gli iRBC sono stati quindi marcati con il reagente tracciante cellulare CFSE. In parallelo, le cellule T CD8+ citotossiche sono state purificate dagli splenociti utilizzando un kit di selezione magnetica negativa. Come controllo, lo stesso protocollo è stato utilizzato per la purificazione delle cellule T CD8 + da topi non infetti. Le cellule effettrici (CD8+ T) e bersaglio (Py-iRBC marcate con CFSE) sono state incubate a diversi rapporti effettore:bersaglio (E:T: 0,5:1, 2,5:1 e 5:1) per 4 ore a 37 °C 5% CO2. Alla fine della cocoltura, ogni condizione è stata marcata con anticorpi anti-topo Ter119 per i globuli rossi e anti-CD8a per le cellule citotossiche. La strategia di gating e i risultati di esempio sono rappresentati nella Figura 4.
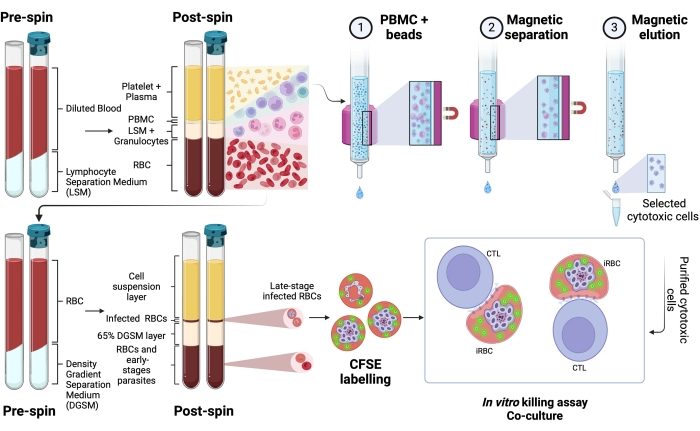
Figura 1. Schema del saggio di uccisione in vitro. Esempio di esperimento di saggio di uccisione. Il sangue infetto da plasmodio viene raccolto e trattato utilizzando un mezzo a gradiente di separazione. Dopo la centrifugazione, lo strato di PBMC viene raccolto e le cellule citotossiche (CTL) vengono purificate utilizzando sfere magnetiche. Il livello RBC viene nuovamente elaborato utilizzando il mezzo di separazione del gradiente di densità. Dopo la centrifugazione, lo strato di Plasmodium-iRBC viene raccolto ed etichettato con CFSE. Successivamente, i CTL e gli iRBC purificati sono stati cocoltivati per 4 ore a 37 °C, 5% di CO2, seguiti da marcatura e analisi specifiche per le cellule in un citometro a flusso. Fare clic qui per visualizzare una versione ingrandita di questa figura.
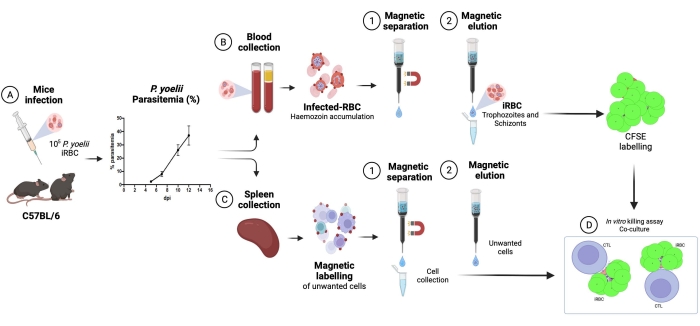
Figura 2. Modello sperimentale di malaria per il saggio di uccisione. In primo luogo, i topi C57BL / 6 sono stati infettati da 105 globuli rossi infetti da PyX17NL. Quindi, la parassitemia viene monitorata mediante striscio di sangue, fino al picco dell'infezione (30% -40% iRBC), circa 12 giorni dopo l'infezione (dpi). Il giorno successivo, i topi sono stati dissanguati e sottoposti a eutanasia per la raccolta della milza. Il sangue è stato elaborato e i globuli rossi infetti sono stati arricchiti mediante separazione magnetica, seguita da etichettatura con CFSE (in alto a destra). La milza è stata elaborata per l'isolamento dei linfociti citotossici, mediante selezione negativa utilizzando sfere magnetiche. Successivamente, i linfociti citotossici purificati e gli iRBC sono stati cocoltivati per 4 ore a 37 °C, 5% di CO2, seguiti da marcatura e analisi specifiche per cellule in un citometro a flusso. Fare clic qui per visualizzare una versione ingrandita di questa figura.
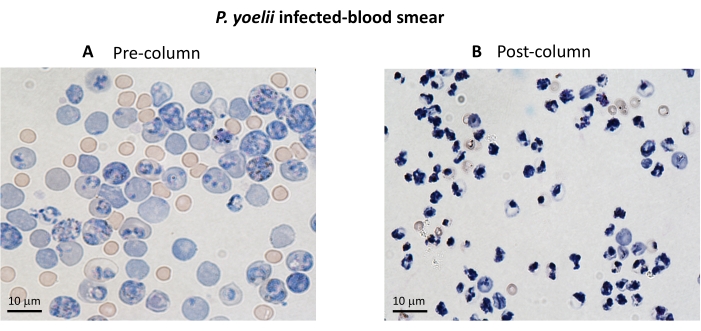
Figura 3. Arricchimento di iRBC mediante colonne magnetiche. Gli iRBC sono stati purificati da topi infetti da P. yoelii utilizzando colonne LS. La purificazione è evidenziata da strisci di sangue da sangue raccolto prima ( A ) e dopo (B) arricchimento della colonna. Barra di scala = 10 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4. Valutazione della percentuale di lisi cellulare di P. yoelii-iRBCs mediante linfociti CD8+. La strategia di gating per la percentuale di lisi cellulare. (A) Impostare il cancello di arresto nella popolazione di perline di conteggio (~ 20.000 eventi). (B) Controllare la lisi spontanea, gli iRBC senza linfociti. Inizia la strategia di gating selezionando le singole celle, esclusi i detriti, in base al rapporto altezza di picco FSC / area, seguita dalla selezione della popolazione RBC in APC-Cy7 Ter119 positivo e PerCP-Cy5.5 CD8 negativo. Quindi selezionare iRBC live come CFSE (FITC) high positive. (C) Esempio di analisi dell'esperimento utilizzando diversi rapporti effettore: target, visualizzando la percentuale di RBC vivi dopo la cocultura. (D) Rappresentazione grafica della percentuale di lisi dei globuli rossi calcolata sulla base della formula descritta nella sezione 10. Il confronto di significatività tra i gruppi (CD8 citotossico o CD8 naïve) è stato valutato mediante ANOVA bidirezionale con confronti multipli. P < 0,0001 (****). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Qui descriviamo un test in vitro per misurare l'uccisione dei globuli rossi infetti da plasmodio da parte dei linfociti citotossici. Questo test può aiutare a chiarire i meccanismi dell'immunità protettiva cellulare allo stadio eritrocitico del parassita della malaria. Il principale vantaggio di questa metodologia è che fornisce un test quantitativo dell'uccisione cellulo-mediata degli iRBC che può essere utilizzato per affrontare molte domande su come le cellule immunitarie interagiscono con diversi Plasmodium spp.
È importante sottolineare che questo metodo può essere utilizzato per studiare P. vivax e altri parassiti del Plasmodium che non sono mantenuti in coltura in vitro 14,15. Inoltre, questo protocollo può essere adattato a qualsiasi specie di Plasmodium e diversi ospiti, come esseri umani, topi e primati non umani. I metodi basati sulla citometria a flusso sono ampiamente utilizzati per valutare l'attivazione delle cellule citotossiche, la produzione di citochine e la degranulazione10,11,16, ma il metodo attuale è l'unico che esplora la lisi dei globuli rossi mediante contatto cellulare diretto con cellule killer.
Ci sono anche molti metodi, come la microscopia, la reazione a catena della polimerasi (PCR) e la citometria a flusso, che vengono utilizzati per studiare la malaria misurando la parassitemia, l'invasione e l'attività antimalarica. Tuttavia, per analizzare la citotossicità cellulo-mediata dei globuli rossi, i metodi attuali che utilizzano Cr51 o il rilascio di emoglobina non sono abbastanza sensibili per valutare la lisi dei globuli rossi. Il rilascio di LDH può anche essere utilizzato per valutare l'uccisione di globuli rossi da parte di alcuni CTL come le cellule T CD8 + , ma la misurazione di LDH non è un metodo accurato in quanto le cellule innate attivate o simili innate possono uccidersi a vicenda come meccanismo regolatore.
La CFSE è ampiamente utilizzata per tracciare le cellule o esplorare la proliferazione cellulare nella citometria a flusso o nella microscopia fluorescente17. Poiché i globuli rossi non proliferano18, l'intensità della fluorescenza CFSE dovrebbe diminuire con la lisi cellulare. La citometria a flusso è una tecnica molto accurata in quanto può rilevare livelli molto bassi di marcatori specifici, e quindi è stata ampiamente utilizzata per tracciare la parassitemia e l'invasione nell'infezione da malaria 19,20,21,22,23. Ancora più importante, la citometria a flusso può misurare molti parametri in una singola cellula e ordinare le cellule in diverse popolazioni. Aggiungendo reagenti standard quantitativi (sfere di conteggio) a ciascun campione, è possibile normalizzare il numero di eventi acquisiti e ottenere conteggi cellulari assoluti24. Questo metodo consente un confronto quantitativo affidabile tra le condizioni sperimentali, che è fondamentale per il protocollo attualmente proposto.
Alcuni passaggi critici per questo protocollo includono garantire la qualità del campione, garantire la corretta colorazione delle cellule e includere controlli per normalizzare i calcoli. È necessaria una grande quantità di campioni di sangue fresco per purificare i globuli rossi infetti. La purificazione del mezzo di separazione del gradiente di densità deve essere affrontata con attenzione poiché la sua concentrazione è fondamentale per ottenere i Plasmodium iRBC desiderati. Anche la sovrapposizione di sangue sul mezzo di separazione del gradiente di densità deve essere eseguita il più lentamente possibile e la raccolta dello strato rosso dell'anello deve essere eseguita con attenzione per evitare di perdere iRBC. Per facilitare il processo di purificazione, è necessario utilizzare un campione di sangue ad alta parassitemia poiché la quantità di globuli rossi sarà più elevata. Va notato che nel protocollo di isolamento dei globuli rossi che utilizza campi magnetici, saranno purificati solo gli stadi maturi del parassita (trofozoiti medio-tardivi o schizonti) che producono quantità significative di emozoina. Di conseguenza, qualsiasi fase dell'anello non verrà raccolta e ciò potrebbe influire sul risultato finale.
La colorazione cellulare deve essere eseguita con attenzione per evitare la perdita o la lisi delle cellule. La conservazione prolungata o la fissazione devono essere evitate prima della colorazione. È importante notare che le condizioni sperimentali devono essere eseguite in triplice copia utilizzando rapporti effettore/target seriale e controlli appropriati, come una condizione di lisi spontanea non etichettata e un controllo di ipotesi. L'aggiunta di perline per il conteggio delle cellule è fondamentale in quanto fornisce un modo semplice per determinare la concentrazione di cellule o la conta assoluta delle cellule per ciascun campione. Durante l'acquisizione del citometro a flusso, assicurarsi di impostare il numero di eventi da raccogliere nel gate delle sfere di conteggio per normalizzare il numero di cellule in ciascun campione dopo la cocoltura.
Poiché sono necessarie almeno 1 x 105 cellule effettrici per risultati coerenti in un test di cocoltura, una possibile limitazione della metodologia descritta è il numero limitato di cellule dopo la purificazione, che può essere un problema soprattutto quando si lavora con popolazioni cellulari rare. In effetti, questo vale per la purificazione degli iRBC, in quanto richiede di avere una parassitemia molto elevata che non è così facile da ottenere, specialmente quando si lavora con campioni umani in aree endemiche.
Un miglioramento del protocollo potrebbe essere il tempo di incubazione della cocultura. Sebbene in precedenza abbiamo utilizzato un tempo di incubazione di 12 ore10,11, abbiamo recentemente osservato che 4 ore sono sufficienti per differenziare le condizioni sperimentali, riducendo così il tempo per la potenziale lisi spontanea e migliorando la riproducibilità dei risultati.
I meccanismi coinvolti nell'uccisione diretta dei globuli rossi infetti da Plasmodium vengono gradualmente scoperti. Il nostro gruppo è stato il primo a dimostrare che le cellule T CD8 + possono riconoscere e uccidere i reticolociti infetti da P.vivax tramite la presentazione HLA-I da parte della cellula infetta11. Recentemente, un altro studio ha dimostrato che le cellule T γδ riconoscono i globuli rossi infetti da P. falciparum attraverso il riconoscimento del fosfoantigene da parte della butirrofillina, una molecola presente sulla superficie degli iRBC10. In entrambi gli studi, la lisi dei globuli rossi è dipendente dalla granulisina e dal granzima B e porta all'uccisione intracellulare dei parassiti.
Sebbene molti metodi siano stati sviluppati nel corso degli anni per misurare la parassitemia, l'invasione, l'attività antimalarica e l'interazione delle cellule dell'immagine, nessuno è stato in grado di analizzare l'uccisione diretta dei globuli rossi da parte delle cellule citotossiche in un saggio quantitativo basato sulla citometria a flusso 19,20,21. Abbiamo utilizzato un approccio innovativo per valutare la capacità di lisi cellulare nella malaria mediante marcatura CFSE di globuli rossi infetti da plasmodio e valutazione della lisi iRBC in un periodo specifico di cocoltura con linfociti. Pertanto, questo test di uccisione in vitro presenta una nuova strategia per chiarire i meccanismi dell'immunità cellulo-mediata alla malaria in fase ematica, che contribuirà a far progredire lo studio di nuovi bersagli terapeutici e lo sviluppo di vaccini contro la malaria.
Divulgazioni
Gli autori non dichiarano interessi concorrenti.
Riconoscimenti
Ringraziamo il Dr. Dhelio Pereira e i membri del Centro di Ricerca per la Medicina Tropicale di Rondônia (CEPEM) per l'arruolamento dei pazienti affetti da malaria e la raccolta del sangue e Felicia Ho per aver aiutato con la revisione del manoscritto. Il seguente reagente è stato ottenuto tramite BEI Resources, NIAID, NIH: Plasmodium yoelii subsp. yoelii, Ceppo 17XNL:PyGFP, MRA- 817, con il contributo di Ana Rodriguez. Questa ricerca è stata sostenuta da Lemann Brazil Research Fund, Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) - 437851/2018-4, borse di studio (CJ, GC, CG) e Fundação de Amparo do Estado de Minas Gerais (FAPEMIG) - APQ-00653-16, APQ-02962-18; Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) - fellowship (LL).
Materiali
| Name | Company | Catalog Number | Comments |
| 100 μM cell strainer | Corning | 431752 | |
| 96 Well Round (U) Bottom Plate | Thermo Scientific | 12-565-65 | |
| Anti-human CD235a (Glycophorin A) Antibody | Biolegend | 349114 | Used - APC anti-human CD235, dilution 1:100 |
| Anti-human CD3 Antibody | Biolegend | 317314 | Used - PB anti-human CD3, dilution 1:200 |
| Anti-human CD8 Antibody | Biolegend | 344714 | Used - APC/Cy7 anti-human CD8, dilution 1:200 |
| Anti-human TCR Vδ2 Antibody | Biolegend | 331408 | Used - PE anti-human TCR Vδ2, dilution 1:200 |
| Anti-mouse CD8a Antibody | Biolegend | 100733 | Used- PerCP/Cyanine5.5 anti-mouse CD8a, dilution 1:200 |
| Anti-mouse TER-119/Erythroid Cells Antibody | Biolegend | 116223 | Used - APC/Cyanine7 anti-mouse TER-119, dilution 1:200 |
| CellTrace CFSE Cell Proliferation Kit | Invitrogen | C34554 | |
| Fetal Bovine Serum, qualified | Gibco | 26140079 | |
| Ficoll-Paque Plus | Cytiva | 17144003 | Lymphocyte Separation Medium (LSM) |
| Heparin Sodium Injection, USP | meithel pharma | 71228-400-003 | Used - 2000 USP units/2mL |
| Isoflurane | Piramal critical care | 66794-0013-25 | |
| LS MACS Column | Miltenyi Biotec | 130-042-401 | |
| LSRFortessa Cell Analyzer | BD Bioscience | ||
| Percoll | Cytiva | 17089101 | Density Gradient Separation Medium (DGSM) |
| QuadroMACS Separator | Miltenyi Biotec | 130-090-976 | |
| RPMI 1640 Medium | Gibco | 11875093 | |
| Sodium bicarbonate, powder, BioReagent | Sigma-Aldrich | S5761 | |
| Syringe With Sub-Q needle - 1mL, 26 gauge; | BD | 14-829-10F | |
| Vacutainer Heparin Tube Glass Green 10 ml | BD | 366480 |
Riferimenti
- WHO. Global Technical Strategy for Malaria 2016-2030, 2021 Update. World Health Organization. , (2021).
- Hafalla, J. C., Silvie, O., Matuschewski, K. Cell biology and immunology of malaria. Immunological Reviews. 240 (1), 297-316 (2011).
- Belnoue, E., et al. Vaccination with live Plasmodium yoelii blood stage parasites under chloroquine cover induces cross-stage immunity against malaria liver stage. Journal of Immunology. 181 (12), 8552-8558 (2008).
- Leong, Y. W., Lee, E. Q. H., Rénia, L., Malleret, B. Rodent malaria erythrocyte preference assessment by an ex vivo tropism assay. Frontiers in Cellular and Infection Microbiology. 11, 680136 (2021).
- Ladeia-Andrade, S., Ferreira, M. U., De Carvalho, M. E., Curado, I., Coura, J. R. Age-dependent acquisition of protective immunity to malaria in riverine populations of the amazon basin of Brazil. The American Journal of Tropical Medicine and Hygiene. 80 (3), 452-459 (2009).
- Antonelli, L. R., et al. The immunology of Plasmodium vivax malaria. Immunological Reviews. 293 (1), 163-189 (2020).
- Kazmin, D., et al. Systems analysis of protective immune responses to RTS, S malaria vaccination in humans. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2425-2430 (2017).
- Epstein, J. E., et al. Live attenuated malaria vaccine designed to protect through hepatic CD8+ T cell immunity. Science. 334 (6055), 475-480 (2011).
- Draper, S. J., et al. Malaria vaccines: recent advances and new horizons. Cell Host & Microbe. 24 (1), 43-56 (2018).
- Junqueira, C., et al. γδ T cells suppress Plasmodium falciparum blood-stage infection by direct killing and phagocytosis. Nature Immunology. 22 (3), 347-357 (2021).
- Junqueira, C., et al. Cytotoxic CD8+ T cells recognize and kill Plasmodium vivax-infected reticulocytes. Nature Medicine. 24 (9), 1330-1336 (2018).
- Arora, G., et al. NK cells inhibit Plasmodium falciparum growth in red blood cells via antibody-dependent cellular cytotoxicity. eLife. 7, 36806 (2018).
- Paul, F., Roath, S., Melville, D., Warhurst, D. C., Osisanya, J. O. S. Separation of malaria-infected erythrocytes from whole blood: use of a selective high-gradient magnetic separation technique. Lancet. 2 (8237), 70-71 (1981).
- Shaw-Saliba, K., et al. Insights into an optimization of Plasmodium vivax Sal-1 in vitro culture: the aotus primate model. PLOS Neglected Tropical Diseases. 10 (7), 0004870 (2016).
- Mehlotra, R. K., et al. Long-term in vitro culture of Plasmodium vivax isolates from Madagascar maintained in Saimiri boliviensis blood. Malaria Journal. 16 (1), 442 (2017).
- Hojo-Souza, N. S., et al. Contributions of IFN-γ and granulysin to the clearance of Plasmodium yoelii blood stage. PLOS Pathogens. 16 (9), 1008840 (2020).
- Parish, C. R., Glidden, M. H., Quah, B. J. C., Warren, H. S. Use of the intracellular fluorescent dye CFSE to monitor lymphocyte migration and proliferation. Current Protocols in Immunology. 84 (1), 4-9 (2009).
- Migliaccio, A. R. Erythroblast enucleation. Haematologica. 95 (12), 1985 (2010).
- Grimberg, B. T., Erickson, J. J., Sramkoski, R. M., Jacobberger, J. W., Zimmerman, P. A. Monitoring Plasmodium falciparum growth and development by UV flow cytometry using an optimized Hoechst-thiazole orange staining strategy. Cytometry Part A:The Journal of the International Society for Analytical Cytology. 73 (6), 546-554 (2008).
- Pattanapanyasat, K., et al. Culture of malaria parasites in two different red blood cell populations using biotin and flow cytometry. Cytometry:The Journal of the International Society for Analytical Cytology. 25 (3), 287-294 (1996).
- Bianco, A. E., Battye, F. L., Brown, G. V. Plasmodium falciparum: rapid quantification of parasitemia in fixed malaria cultures by flow cytometry. Experimental Parasitology. 62 (2), 275-282 (1986).
- Jacobberger, J. W., Horan, P. K., Hare, J. D. Analysis of malaria parasite-infected blood by flow cytometry. Cytometry:The Journal of the International Society for Analytical Cytology. 4 (3), 228-237 (1983).
- Bei, A. K., et al. A flow cytometry-based assay for measuring invasion of red blood cells by Plasmodium falciparum. American Journal of Hematology. 85 (4), 234 (2010).
- Montes, M., Jaensson, E. A., Orozco, A. F., Lewis, D. E., Corry, D. B. A general method for bead-enhanced quantitation by flow cytometry. Journal of Immunological Methods. 317 (1-2), 45-55 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon