Method Article
체외 세포독성 림프구에 의한 변형체 감염 적혈구 사멸 분석
요약
여기서 우리는 감염의 혈액 단계에서 Plasmodium 에 대한 세포 면역의 메커니즘을 밝히는 데 도움이되는 새로운 방법을 설명합니다. 이것은 세포 독성 림프구에 의한 감염된 적혈구 사멸을 측정하는 시험관 내 분석입니다.
초록
말라리아는 전 세계적으로 연간 2억 건 이상의 사례가 발생하는 주요 공중 보건 문제입니다. 수년간의 과학적 노력에도 불구하고 말라리아에 대한 보호 면역은 주로 장기 Plasmodium 배양의 방법론적 한계, 특히 Plasmodium vivax의 한계 로 인해 여전히 잘 이해되지 않고 있습니다. 대부분의 연구는 말라리아 통제에 중요한 역할을 하는 항체에 의한 말라리아에 대한 적응 면역 보호에 초점을 맞추었습니다. 그러나 약독화 Plasmodium sporozoites 백신에 의해 유도된 멸균 보호는 주로 CD8+ 및 감마 델타 T 세포(γδ T)와 같은 세포독성 T 림프구에 대한 세포 반응과 관련이 있습니다. 따라서 세포 면역 반응의 기능을 더 잘 이해하고 향후 치료법 및 백신 개발을 지원하기 위한 새로운 방법론을 개발해야 합니다. Plasmodium 혈액 단계 감염에 대한 이 세포 매개 면역을 분석하기 위한 새로운 전략을 찾기 위해 우리 그룹은 세포독성 림프구에 의한 감염된 적혈구(iRBC) 사멸을 측정하는 시험관 내 분석을 확립했습니다. 이 분석은 혈액 단계에서 다른 Plasmodium spp.에 대한 세포 면역 반응 메커니즘을 연구하는 데 사용할 수 있습니다. 선천성 및 적응성 세포독성 면역 세포는 이펙터:표적 메커니즘에서 iRBC와 세포내 기생충을 직접 제거할 수 있습니다. 표적 iRBC를 표지하여 세포 생존율을 평가하고 이펙터 세포(CD8+ T, γδ T, NK 세포 등)와 공동 배양합니다. 용해 백분율은 유세포 분석 기반 분석에서 자발적인 용해 제어와 비교하여 테스트된 조건을 기반으로 계산됩니다. 궁극적으로, 이 사멸 분석 방법론은 혈액 단계 말라리아에 대한 세포 매개 면역을 이해하는 데 있어 중요한 발전이며, 새로운 잠재적 치료 표적을 발견하고 말라리아 백신 개발을 가속화하는 데 도움이 됩니다.
서문
말라리아는 2020년에 2억 4천만 건 이상의 사례와 627,000명의 말라리아 관련 사망자가 보고된 글로벌 보건 위기로 남아 있습니다1. 현재 인간에게 말라리아를 일으킬 수 있는 5종의 기생충이 있으며, 그 중 Plasmodium falciparum 과 Plasmodium vivax 가 가장 널리 퍼진 두 종입니다. Plasmodium 감염 동안 간 또는 적혈구 전 단계는 무증상이며 증상은 적혈구 단계에서 기생충의 무성 주기 동안에만 발생합니다. 이 감염 단계에서 간 단계에서 파생된 수천 개의 메로조이트가 혈류로 방출되어 적혈구(RBC)를 감염시킵니다. RBC에서 기생충은 분열증에 의해 영양체와 분열체로 분화되며, 분열증이 적혈구를 파열시켜 새로 형성된 메로조이트를 방출하여 이 혈액 주기를 반복합니다. 침입, 복제, 메로조이트 방출의 반복적인 주기는 기생충 개체수의 기하급수적인 증가를 초래하고 궁극적으로 질병 증상을 유발한다2.
말라리아에 대한 면역 반응을 연구하는 데 있어 중요한 과제는 Plasmodium spp. 인간을 감염시키는 것은 실험실 동물 모델을 감염시키지 않습니다. 따라서 Plasmodium에 감염된 환자 샘플을 신선하게 수집하고 즉시 처리 및 분석해야 합니다. 그러나 말라리아 발병 지역에서는 면역학적 및 분자적 메커니즘에 접근할 수 있는 자원이 제한적입니다. 이러한 한계로 인해 설치류는 변형체 감염에 대한 면역 반응을 조사하기 위한 실험 모델로 널리 사용됩니다. P. berghei와 P. chabaudi는 종종 P. falciparum 감염의 대리모로 사용되지만, P. yoelii 17XNL의 치명적이지 않은 균주는 망상 적혈구 제한 감염과 같은 P. vivax와 공통점이 많다 3,4. 인간 또는 동물 모델 유래 샘플에 사용할 수 있는 Plasmodium in vitro 분석의 개발은 말라리아의 발병기전을 더 잘 이해하고 다른 종의 기생충에 의해 유도된 면역학적 반응을 비교하는 데 중요합니다.
보호 항 말라리아 면역은 적혈구 전 단계나 혈액 단계에서 완전히 이해되지 않습니다. 반복적인 감염에 노출되면 부분적인 후천성 면역이 발생하는 것으로 알려져 있으나 무균 면역은 거의 발달하지 않는다5. 수십 년 동안, 항변형체 보호 면역은 주로 숙주 세포의 기생충 침입을 막거나 항원 제시 세포에 의한 식균 작용을 유발하는 중화 또는 옵소닌화 항체의 유도와 관련이 있었다6. 그 결과, 지금까지 항말라리아 백신을 생산하기 위한 대부분의 노력은 보호적이고 오래 지속되는 항체를 유도하는 데 의존해 왔다 7,8. 그러나, 약독화된 포자소체에 의한 백신 접종에 의해 유도된 무균 보호는 세포독성 T 림프구의 활성화 및 확장과 직접적으로 상관관계가 있다 8,9.
최근에, 갓 분리된 환자 샘플 및 시험관 내 배양에 대한 일부 연구에서는 CD8+ T10, γδ T 11 및 NK 세포12와 같은 선천적 또는 적응성 세포독성 면역 세포가 이펙터:표적 비율 방식으로 변형체에 감염된 적혈구 및 그 세포내 기생충을 직접 제거할 수 있음을 입증했습니다. 이러한 중요한 발견은 말라리아의 맥락에서 완전히 새로운 면역 이펙터 메커니즘을 정의했습니다. 이 새로운 항말라리아 면역을 해부하기 위해서는 자연 감염 또는 백신 접종에서 감염된 적혈구(iRBC)에 대한 킬러 세포의 세포독성 이펙터 메커니즘을 탐색하는 것이 필수적입니다.
여기에서 우리는 혈액 단계에서 말라리아에 대한 림프구의 세포 독성 활성을 측정하는 시험관 내 분석을 제시합니다. 이 분석은 Plasmodium 적혈구 단계에 대한 세포 면역 반응의 메커니즘을 밝히는 데 도움이 될 수 있습니다. 표적 세포인 iRBC는 세포 생존율을 평가하기 위해 카르복시플루오레세인 숙신이미딜 에스테르(CFSE)로 표지된 다음 세포독성 림프구(CTL)와 같은 이펙터 세포와 함께 배양됩니다. 그런 다음 이 공동 배양은 특정 세포 유형에 대한 형광 마커를 사용하여 유세포 분석으로 평가됩니다. 마지막으로, CTL에 의한 iRBC 용해의 백분율은 실험 조건을 RBC의 자발적 파열과 이펙터 세포 없이 배양하는 동안 발생하는 자발적 용해 조절로 나누어 계산합니다. 전반적으로, 이 사멸 분석 방법론은 세포 매개 말라리아 면역에 대한 더 나은 이해에 기여할 수 있습니다.
프로토콜
모든 절차는 오스왈도 크루즈 재단과 국가 윤리 위원회(CAAE: 59902816.7.0000.5091)의 정책에 따라 수행되었습니다. 인간 프로토콜은 연구에 환자 등록을 담당한 론도니아 열대 의학 연구 센터(CEPEM)의 임상 연구 그룹과 협력하여 개발되었습니다. 모든 환자로부터 정보에 입각한 동의를 얻었습니다.
동물 연구를 위해 절차는 CONCEA(National Council for the Control of Animal Experimentation)의 과학적 및 교훈적 목적을 위한 동물 관리 및 사용에 대한 브라질 실행 지침의 행동 원칙에 따라 수행되었습니다. 프로토콜은 Fiocruz Animal Experimentation Council (CEUA 프로토콜 LW15 / 20-2)에 의해 승인되었습니다.
1. 인간 혈액 샘플 수집 및 PBMC 분리
- 나트륨 헤파린을 가진 10개 mL에 있는 Plasmodium 감염 환자의 혈액을 대피한 혈액 수집 관에서 모으십시오. 말라리아 환자가 림프구 감소증을 나타내기 때문에 10mL 혈액 샘플에 5-9 x10 6 개의 말초 혈액 단핵 세포(PBMC) 범위가 있습니다. CD8+ T 세포 또는 γδ T 세포는 PBMC의 ~10%를 구성하므로 바람직하게는 50-100mL의 혈액/환자를 수집합니다.
알림: 최소 1 x 105 이펙터 셀/조건을 고려해야 합니다. - 아래에 설명된 대로 혈액 도말에 의한 iRBC의 백분율을 계산합니다.
- 총 혈액 5μL를 투명 슬라이드에 넣고 혈액 도말을 준비합니다. Romanowsky 유형 panoptic fast stain 또는 May-Günwald-Giemsa 염색을 수행합니다. 여기서는 시약 A(고정), 시약 B(세포질 염색) 및 시약 C(핵 및 세포질 차등 염색)의 세 가지 시약으로 구성된 panoptic fast stain 키트를 사용합니다.
- 슬라이드를 용액 A에 10x, 용액 B에 4x, 마지막으로 용액 C에 10x로 천천히 담그고 용액 사이의 슬라이드에서 과도한 시약을 배출합니다. 용액 C에 담근 후 흐르는 수돗물에 슬라이드를 헹구고 건조시킵니다.
- 100x 오일 이멀젼 대물렌즈가 있는 정립 광학 현미경에서 1000개의 적혈구를 순차적 정사각형으로 세고 다음 방정식을 사용하여 기생충혈증의 백분율을 계산합니다.
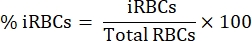
- 멸균 인산염 완충 식염수(PBS)에 1:1 비율로 혈액 15mL를 희석합니다.
- 15mL의 림프구 분리 배지(밀도 1.077g/mL)를 50mL 튜브에 추가합니다. 희석된 혈액 샘플 30mL를 원심분리 매체 용액에 조심스럽게 겹칩니다. 샘플을 레이어링할 때 혈액 샘플과 림프구 분리 배지가 혼합되지 않도록 합니다.
- 튜브를 400 x g 에서 22°C에서 40분 동안 원심분리하고 낮은 가속도 및 파손 설정 없이 합니다.
- 멸균 피펫을 사용하여 혈장이 포함된 상층을 제거하고 단핵 세포층을 방해하지 않습니다. 멸균 피펫을 사용하여 단핵 세포 층(PBMC)을 멸균 튜브로 옮깁니다.
- 혈액 펠릿이 들어 있는 튜브는 나중에 감염된 적혈구 격리에 사용되므로 버리지 마십시오. 이 단계에서 적혈구를 실온(RT)으로 유지해야 합니다. 절대 식히지 마십시오.
- PBS를 첨가하고 350 x g 에서 10분 동안 원심분리하여 세포를 2회 세척하고 휴식 설정으로 세척합니다. 페니실린/스트렙토마이신과 10% 소 태아 혈청(FBS, 완전 배지)이 보충된 RPMI 배지 5mL에 세포 펠릿을 재현탁합니다.
- 트립판 블루 용액이 있는 상태에서 PBMC를 계수하여 혈구계(Neubauer chamber) 또는 자동 세포 계수기를 사용하여 세포 생존율을 확인합니다. 파란색으로 염색된 세포는 트리판 블루를 흡수하는 죽어가는 세포를 나타내므로 계산하지 마십시오.
- 완전 배지를 사용하여 세포 농도를 107 cells/mL로 조정합니다. 시약 제조업체 프로토콜에 따라 마그네틱 비드 분리를 사용하여 원하는 세포독성 림프구 집단(CD8+ T 세포, NK 세포, γδ T 세포)을 정제합니다.
2. 인간 적혈구 분리
참고: 인간에 감염된 적혈구 분리의 경우, 최소 2%의 기생충혈증이 있는 혈액 샘플로 시작하는 것이 좋으며, 우선적으로 영양체/초기 분열증 기생충 단계에서 더 많은 혈액을 사용하는 것이 좋습니다.
- PERCOLL(이하, 밀도 구배 분리 매질이라 함)을 아래에 기재된 권장 농도로 준비한다.
- 90% 등장성 밀도 구배 분리 배지 90mL와 10x PBS 10mL를 추가하여 90% 등장성 밀도 구배 분리 배지를 얻습니다.
- P. vivax에 감염된 망상적혈구 분리를 위해45% 밀도 구배 분리 배지를 준비합니다. 90% 등장성 밀도 구배 분리 배지 50mL와 1x PBS 50mL를 추가하여 45% 밀도 구배 분리 배지를 얻습니다.
- P. falciparum 감염 적혈구 분리를 위해 65% 밀도 구배 분리 배지를 준비합니다. 72mL의 90% 등장성 밀도 구배 분리 배지와 28mL의 1x PBS를 추가하여 65% 밀도 구배 분리 배지를 얻습니다.
- 감염되지 않은 망상적혈구 분리를 위해 70% 밀도 구배 분리 배지를 준비합니다. 78mL의 90% 등장성 밀도 구배 분리 배지와 22mL의 1x PBS를 추가하여 70% 밀도 구배 분리 배지를 얻습니다.
- 밀도 구배 분리 배지를 수조에서 37°C로 가온한다.
- PBMC 층을 제거한 후, 세포를 건드리지 않고 가능한 한 많은 원심분리 매체의 최상층을 조심스럽게 제거한다. 유리 파스퇴르 피펫을 사용하여 RBC 펠릿을 방해하지 않고 상부 호중구 층을 조심스럽게 제거하고 펠릿 부피를 추정합니다. RT complete 배지의 RBC 펠릿 부피의 4배를 추가하고 다시 현탁합니다.
- 두 번째 50mL 코니컬 튜브에 분리할 세포 유형에 따라 펠릿 부피의 45배, 65% 또는 70% 밀도 구배 분리 배지를 추가합니다. 밀도 구배 분리 매체 층 위에 RBC 현탁액을 조심스럽게 겹칩니다.
- 850 x g에서 15분 동안 회전하며 낮은 가속도와 브레이크 설정이 없습니다. 5mL 피펫으로 상층액과 밀도 구배 분리 배지 사이에 있는 흐린 빨간색/갈색 층을 수집합니다. 멸균된 15mL 튜브로 옮깁니다.
- RT 완전 배지를 최대 15mL까지 첨가하여 세포를 세척하고 860 x g에서 10분 동안 스핀다운합니다. RT 완전 배지 10mL를 첨가하여 세척을 반복하고 스핀다운합니다. 상청액을 버리고 1.2단계에 따라 펠릿에서 혈액 도말을 준비하여 iRBC 농축을 확인합니다.
- 펠릿을 1mL의 RT 완전 배지에 재현탁하고 세포를 계수하는 동안 실온에 둡니다. 혈구계(Neubauer chamber)에 10μL의 세포 현탁액을 넣고 25개의 중간 정사각형으로 세분화된 중앙 영역의 적혈구를 계산합니다. RT complete 배지에서 세포 농도를 1 x 107 iRBCs/mL로 조정합니다.
3. 마우스의 실험적 말라리아 감염
- MR4/ATCC에서 얻은 GFP 발현 균주인 냉동보존된 P. yoelii 17XNL:PyGFP(MRA-817)의 분취량을 해동하고 8주령의 암컷 C57BL/6 마우스에 100μL를 복강내(i.p.) 주사 합니다.
- 기생충혈증 부담을 3일마다 꼬리 정맥 채혈로 추적합니다.
- 바늘 베벨로 혈관을 뚫고 꼬리의 말단부에서 시작하여 얕은 각도로 정맥으로 들어갑니다.
- 피펫 또는 모세관으로 혈액 샘플을 최대 5mL 또는 10mL까지 채취한 다음 수동 압력을 가하여 출혈을 멈춥니다.
- 기생충혈증이 감염된 적혈구의 1.2%-10%에 도달할 때까지 혈액 도말 검사(15단계에 설명된 대로)를 준비합니다.
- 꼬리 정맥 채혈로 혈액 10μL를 수집하고 PBS 100μL로 희석하여 두 번째 기증자 마우스에 주입합니다.
참고: 냉동보존된 기생충은 실험적 감염에 사용하기 전에 해동하고 생쥐에 두 번 통과시켜야 합니다. - 두 번째 계대가 기생충 혈증의 15 %에 도달하면 꼬리 클리핑 방법으로 5 방울의 혈액을 수집하고 PBS 1mL로 희석합니다. 멸균 PBS에서 농도를 1 x 106 iRBCs/mL로 조정하여 감염 용액을 준비하고 실험에 필요한 각 마우스에 i.p. 100μL(1 x 105 iRBC)의 용액을 주입합니다.
- 기생충혈증이 감염 후 약 12일 후에 발생하는 ~30% iRBC에 도달할 때까지 2-3일마다 모니터링합니다. 마우스가 원하는 기생충 혈증에 도달하면 아래에 설명 된대로 심장 천자로 혈액을 수집합니다.
- 100μL의 헤파린 용액(30U/mL)을 26G 바늘로 1mL 주사기에 흡인합니다.
- 5 % 이소 플루 란으로 흡입하여 마우스를 마취시키고 반사 신경이 없는지 확인하십시오. 마우스를 옆으로 눕히고 바늘을 팔꿈치 바로 아래, 갈비뼈를 통해 심장에 수직으로 삽입합니다. 주사기 플런저를 천천히 빼내고 0.5-1mL의 혈액이 얻어질 때까지 바늘을 돌립니다.
- 마취하에 자궁 경부 탈구에 의한 인도적 안락사를 수행하십시오. 마우스의 왼쪽을 70% 에탄올로 무균적으로 세척합니다. 수술 용 가위로 피부와 복막을 통과하는 마우스의 왼쪽을 자릅니다. 비장을 찾아 제거하십시오.
- 마우스 비장을 5mL의 완전 배지가 있는 페트리 접시에 넣어 원하는 이펙터 세포 집단(예: CD8+ T 세포)을 정제합니다.
4. 신선한 전체 마우스 비장 세포 얻기
- 페트리 접시에서 가위 또는 면도기를 사용하여 비장을 작은 조각으로 조심스럽게 자릅니다.
- 100μM 세포 스트레이너를 50mL 원뿔형 튜브 위에 놓고 절제된 비장을 피펫으로 세포 스트레이너로 옮깁니다. 주사기 플런저로 스트레이너를 통해 비장을 으깬다.
- 10mL의 완전 배지로 여과기를 통해 세포를 세척합니다. 세포를 4°C에서 10분 동안 300 x g 에서 원심분리한 다음, 상청액을 버린다.
- 세포 펠릿을 2mL의 차가운 1x RBC 용해 완충액에 재현탁합니다. 얼음 위에서 5분 동안 현탁액을 배양합니다.
- 세포 현탁액을 4°C의 10 mL 완전 배지로 세척한다. 세척 단계를 세 번 반복하고 Plasmodium에 감염된 마우스의 비장에 대한 세척 사이에 세포 혈전을 제거합니다.
- 세포를 4°C에서 5분 동안 400 x g 에서 원심분리한 다음, 상층액을 버린다.
참고: 변형체에 감염된 비장은 확대되고 분해된 헤모글로빈과 헤모조인을 포함하는 식세포로 채워집니다. - 이펙터 세포의 자기 비드 분리 중에 문제를 방지하려면 다음 단계를 사용하여 헤모조인이 풍부한 식세포 및 헤모조인을 제거합니다. MACS 완충액으로 비장 세포를 재현탁하고 농도를 1 x 108 cells/mL로 조정합니다. 자기장에 LS 또는 LD 컬럼을 놓습니다. 3mL의 MACS 버퍼로 헹구어 컬럼을 준비합니다.
- 세포 현탁액을 컬럼에 바릅니다. 3mL의 MACS 완충액으로 컬럼을 세 번 세척합니다. 비장 세포를 포함하는 유동 스루를 수집합니다.
- 트리판 블루 용액에서 비장 세포를 계수하고 혈구 측정기 (Neubauer chamber) 또는 자동 세포 계수기에서 세포 생존율을 확인합니다. RT complete 배지에서 세포 농도를 1 x 107 cells/mL로 조정합니다.
5. 세포독성 이펙터 세포 정제(CD8a+ T 세포 음성 선택)
참고: 세포독성 이펙터 세포(CD8+ T, γδ T, NK, iNKT, MAIT 세포)를 정제할 수 있는 많은 양성 및 음성 선택 시약이 있습니다. 이 프로토콜에서는 비장 CD8a+ T 세포의 음성 선택을 사용하고 제조업체 지침을 따릅니다.
- 모든 비장세포를 4°C에서 10분 동안 400 x g 로 원심분리하고 상층액을 버린다. 40μL의 MACS 완충액에 세포 펠릿을 재현탁합니다.
- 10 μL의 비오틴-항체 칵테일을 추가합니다. 잘 섞고 얼음에서 5분 동안 배양합니다.
- 30μL의 MACS 버퍼를 추가합니다. 20 μL의 항-비오틴 마이크로-비드를 추가합니다. 잘 섞고 얼음에서 10 분 동안 배양하십시오.
- 400 μL의 MACS 버퍼를 첨가하고 자기 세포 분리를 진행한다. MACS LS 컬럼을 자기장 지지대에 놓습니다. 3mL의 MACS 버퍼로 헹구어 컬럼을 준비합니다.
- 세포 현탁액을 컬럼에 바릅니다. 3mL의 MACS 완충액으로 컬럼을 세 번 세척합니다. 표지되지 않은 모든 세포(농축된 CD8a+ T 세포)를 포함하는 플로우 스루를 수집합니다.
- 트립판 블루 용액에서 CD8a+ T 세포를 계수하고 혈구계(Neubauer chamber) 또는 자동 세포 계수기에서 세포 생존율을 확인합니다. RT complete 배지에서 세포 농도를 1 x 107 cells/mL로 조정합니다.
6. P. yoelii 감염된 RBC 분리
- 수집된 혈액을 1.5mL 튜브에 850 x g 의 3분 동안 원심분리합니다. 혈청을 버리고 FBS 없이 1x RPMI 1mL에 혈액을 재현탁합니다.
- LS 컬럼을 자기장 지지대에 놓고 3mL의 1x RPMI로 헹굽니다. 컬럼을 통해 RBC 서스펜션을 통과시킵니다. 더 많은 iRBC를 분리하려면 플로우 스루(RPMI 3mL 및 희석된 혈액 1mL)를 컬럼에 다시 적용합니다.
- 5mL의 1x RPMI로 두 번 세척합니다. 컬럼 저장소가 비워지는 즉시 버퍼 분취량을 추가하여 세척 단계를 수행합니다. 어떤 기둥도 말리지 마십시오.
- 5mL의 RPMI를 추가하고, 컬럼을 제거하고, iRBC를 새 15mL 튜브로 퍼지합니다. iRBC를 세고 농도를 1 x 107 RBCs/mL로 조정합니다.
7. 적혈구의 CFSE 표지 및 유세포 분석 준비
알림: CFSE 라벨링 단계 후 세척 단계에서 일반적으로 세포의 ~50%가 손실되기 때문에 실험에 사용할 셀 수의 두 배로 RBC 라벨링 프로토콜을 시작합니다. 적혈구/iRBC의 자가형광을 확립하려면 표지되지 않은 세포의 대조군 샘플을 포함시키십시오.
- CFSE를 FBS 없이 1x RPMI에서 10mM의 최종 농도로 희석합니다. 15mL 튜브에서 FBS 없이 1x RPMI로 세포를 한 번 세척합니다.
- FBS 없이 500μL의 1x RPMI에 적혈구를 다시 중단하고 희석된 CFSE 500μL를 추가합니다. 빛으로부터 보호되는 RT에서 8 분 동안 배양하십시오.
- 14 mL의 완전 배지 (10% FBS RPMI)를 첨가하여 3회 세척한 후, 850 x g 에서 10분 동안 원심분리하였다. 세포를 완전 배지에서 1-5 x 106/mL의 농도로 재현탁합니다. RT에서 1 시간 동안 배양하십시오.
8. 세포독성 림프구/RBC 공배양 및 유세포 분석 준비
참고: 특정 수용체 또는 분자의 침범을 측정할 경우 특정 차단 및 이소타입 대조군 항체(10mg/mL)를 이펙터 세포와 함께 30분 동안 배양한 후 배양합니다.
- 96웰 둥근 바닥 플레이트에 세포를 플레이트합니다. 정제된 림프구 및 CFSE 표지된 iRBC를 원하는 이펙터-표적 세포 비율에 200μL의 최종 부피에 첨가하고 균질화합니다. 각 조건을 세 번 준비하십시오.
참고: iRBC 농도를 1-5 x 104 cells/mL로 조정하고 정제된 세포 수(예: 0.5:1, 2.5:1 및 5:1)를 기준으로 비율을 선택하는 것이 좋습니다. - 임의의 자발적 용해를 평가하기 위해 이펙터가 없는 표적 iRBC인 자발적 용해 대조군을 포함하는데, 이는 100% 세포 생존율 조건을 나타내기 위해 사용될 것이기 때문이다.
- 플레이트를 360 x g 에서 1분 동안 회전시켜 세포 접촉을 최대화합니다. 37°C 및 5%CO2에서 4시간 동안 배양합니다.
참고: P. falciparum 배양에 체계적으로 사용되는 저산소증 조건(낮은 O2)은 이펙터 세포가 이 환경에서 생존하지 못하기 때문에 사용해서는 안 됩니다. 대조적으로, Plasmodium 기생충은 5 % CO2 에서 최대 12 시간 동안 대기 중에서 생존 할 수 있습니다. - 850 x g 에서 5분 동안 회전하고 플레이트를 뒤집어 상층액을 제거합니다.
참고: 원하는 경우 상청액을 사용하여 공동 배양에서 방출된 용해성 인자를 측정할 수 있습니다. - 적혈구를 항-마우스 Ter119 1:200(또는 인간 샘플의 경우 항-인간 CD235 1:100)으로 라벨링하고 CD8+ T 세포를 항-CD8 1:200 또는 항-CD3 1:200 항체(항-마우스 또는 인간)로 3% FBS(FACS 버퍼)를 함유하는 1x PBS에서 4°C에서 30분 동안 라벨링합니다.
참고: 항체 형광단은 세포 추적자/세포 증식 시약(예: CFSE 표지 iRBC, APC-Cy7 항-Ter119 및 PerCP-Cy5.5 항-CD8a)을 기반으로 선택해야 합니다. - 세포를 FACS 완충액으로 세척하고 850 x g에서 5분 동안 스핀다운합니다 . 샘플을 FACS 튜브로 옮기고 30μL의 계수 비드를 개별 튜브에 추가합니다. 카운트 비드를 30초 동안 볼텍싱하여 균질화합니다.
9. 유세포 분석
- 405/488/561/640 레이저 기기를 사용하여 샘플을 분석합니다.
- CFSE(FITC), PE 항-인간 γδ TCR 및 PE-Cy7 항-인간 CD235a 항체로 표지된 인간 세포의 경우, 3-레이저(청색, 적색, 황록색) 구성 세포분석기에서 530/30(FITC), 575/25(PE) 및 780/60(PE-Cy7) 필터를 사용합니다.
- CFSE(FITC), PerCP-Cy5.5 항-마우스 CD8a 및 APC-Cy7 항-마우스 Ter119로 표지된 마우스 세포의 경우 3-레이저 세포분석기 설정에서 530/30(FITC), 695/40(PerCP-Cy5.5) 및 780/60(APC-Cy7) 필터를 사용합니다.
- 카운팅 비드 모집단을 정지 게이트로 선택하여 정지 게이트에서 최소 20,000개의 이벤트를 획득하며, 이는 모든 조건에 대해 동일해야 합니다. 적절한 유세포 분석 수집/분석 소프트웨어를 사용하여 분석 및 보정을 수행합니다.
- 아래 설명된 대로 게이팅 전략을 설정합니다.
- FSC 피크 높이(H) 대 면적(A) 비율을 사용하여 파편을 제외한 단일 세포(singlets)를 선택합니다. 적혈구를 선택하고 적혈구 마커(Ter119 또는 CD235a) 및 림프구 특이적 항체(CD8a)의 형광을 기반으로 분석에서 림프구를 제외합니다.
- 이전 RBC 게이팅에서 CFSE 양성 염색을 기반으로 실행 가능한 적혈구를 선택합니다. 유세포 분석기 데이터 분석 소프트웨어로 데이터를 분석합니다.
10. 계산 및 통계
- iRBC 용해 비율을 계산하려면 9단계에서 설명한 게이팅 전략을 따르십시오. 생존 가능한 적혈구의 백분율은 Ter119(마우스) 또는 CD235a(인간) 양성 형광을 기반으로 하는 RBC 게이트 내부의 CFSE 양성 세포의 빈도입니다.
- 자발적 용해 대조군, 이펙터 세포가 없는 적혈구, 조건을 대조군으로 사용하여 RBC 자연 파열을 추정합니다. 이 조건은 RBC 용해(100% 생존율)로 간주됩니다. 다음 공식을 사용하여 각 테스트 조건에서 RBC 용해 비율을 계산합니다.
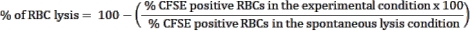
참고: 배양 배양 중에 일부 감염된 적혈구는 기생충에 의해 자발적으로 용해되거나 파열될 수 있습니다. 이펙터 세포가 없는 자발적 용해 조건의 CFSE 양성 RBC 빈도를 림프구 세포독성의 기준선으로 사용합니다. - 각 조건에 대한 삼중의 평균을 계산하고 다중 비교에서 이원 ANOVA를 사용하여 통계적 유의성을 결정합니다.
결과
여기에서는 세포독성 림프구와의 공동 배양 분석에서 CFSE 표지 된 변형체 감염 적혈구를 분리하기 위한 적용 방법론을 설명합니다. 먼저, P. vivax 에 감염된 인간 샘플을 사용하여 프로토콜을 수행하는 방법에 대한 개략도를 제공합니다(그림 1). 그런 다음 P. yoelii 에 감염된 C57BL/6 마우스를 사용하여 말라리아 실험 모델에서 프로토콜을 진행하는 방법에 대한 그림 순서도(그림 2). 그림 3에는 프로토콜의 6단계(자기 컬럼을 사용한 P. yoelii 감염 적혈구의 농축)에 대한 예상 결과(전후)가 나와 있습니다. 마지막으로, 그림 4는 9단계에서 설명한 대로 RBC 용해 비율을 평가하는 데 필요한 게이팅 전략을 자세히 설명하는 대표적인 유세포 분석 분석을 보여줍니다. 따라서 이 섹션에서는 세포독성 림프구에 의한 iRBC 사멸을 평가하기 위한 획득, 조립 및 데이터 분석의 전체 프로세스를 설명하면서 여기에 사용된 다양한 기술을 강조합니다.
인간 변형체에 감염된 적혈구는 세포독성 세포에 의한 용해
세포독성 세포에 의한 인간 변형체에 감염된 적혈구의 사멸을 평가하기 위한 프로토콜의 개략도가 그림 1에 나와 있습니다. 세포 용해를 측정하기 위해, 분리 배지를 사용하여 Plasmodium 감염 환자의 PBMC를 정제한 다음, 관심 세포독성 림프구(CTL) 집단(예: CD8+ T, γδ T, NK, iNKT, MAIT 세포 등)을 자기 정제했습니다. PBMC 분리로부터 남아있는 적혈구의 펠릿은 밀도 구배 분리 배지 (65 % P. falciparum; 45 % P. vivax)를 사용하여 Plasmodium에 감염된 적혈구를 농축하는 데 사용되었습니다. iRBCs를 CFSE로 표지하고, 37°C, 5%CO2에서 4시간 동안 림프구와 함께 또는 림프구 없이 인큐베이션하였다. 공동 배양 기간 후, 모든 적혈구(감염 여부)를 유세포 분석 전에 항-인간 CD235a 항체(적혈구의 경우) 및 CTL 특이적 항체(예: 항-CD8, 항-γδTCR 등)로 표지했습니다. 인간 샘플의 획득 및 분석은 그림 4의 마우스 샘플에 대해 입증된 것과 유사했습니다.
세포독성 CD8+ T 세포에 의한 P. yoelii 감염 RBC 용해
실험 말라리아 모델에서 세포독성 이펙터 메카니즘을 평가하기 위한 실험 절차의 흐름도는 도 3 및 도 4에 제시된 대표적인 실험 데이터와 함께 도 2에 도시되어 있다. C57BL/6 마우스를 1 x 105P. yoelii (Py) iRBCs에 감염시키고, 기생충혈증이 약 30%에 도달할 때까지 모니터링하였다. Py-iRBC는 기생충 헴 부산물인 헤모조인(hemozoin)이 철이 풍부하고 자기장에서 상자성 입자로 기능하기 때문에 자기 분리를 사용하여 혈액에서 분리되었습니다13. 농축된 샘플의 순도는 사전 컬럼 샘플과 비교하여 혈액 도말에 의해 분석되었습니다(그림 3). 그런 다음 iRBC를 세포 추적자 시약 CFSE로 표지했습니다. 동시에, 세포독성 CD8+ T 세포는 자기 음성 선택 키트를 사용하여 비장세포로부터 정제되었습니다. 대조군으로서, 감염되지 않은 마우스로부터의 CD8+ T 세포 정제를 위해 동일한 프로토콜을 사용하였다. 이펙터(CD8+ T) 및 표적(CFSE-표지된 Py-iRBC) 세포를 37°C 5%CO2에서 4시간 동안 상이한 이펙터:표적 비율(E:T: 0.5:1, 2.5:1 및 5:1)에서 배양했습니다. 공동 배양이 끝날 때, 각 조건은 적혈구에 대한 항체 항-마우스 Ter119 및 세포독성 세포에 대한 항-CD8a로 표지되었습니다. 게이팅 전략과 샘플 결과는 그림 4에 나와 있습니다.
그림 1. 시험관 내 사멸 분석의 개략도. 사멸 분석 실험의 예. 변형체에 감염된 혈액은 분리 구배 배지를 사용하여 수집 및 처리됩니다. 원심분리 후, PBMC 층을 수집하고, 세포독성 세포(CTL)를 마그네틱 비드를 사용하여 정제하였다. RBC 층은 밀도 구배 분리 매체를 사용하여 다시 한번 처리된다. 원심분리 후, Plasmodium-iRBC 층을 수집하고 CFSE로 표지합니다. 그 후, 정제된 CTL 및 iRBC를 37°C, 5%CO2에서 4시간 동안 공동 배양하고, 세포-특이적 표지 및 유세포 분석기에서 분석하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 2. 사멸 분석을 위한 실험적 말라리아 모델. 먼저, C57BL/6 마우스를 10개의5 PyX17NL-감염된 적혈구로 감염시켰다. 그런 다음 기생충혈증은 감염 후 약 12일(dpi)에 감염이 최고조에 달할 때까지(30%-40% iRBC) 혈액 도말에 의해 모니터링됩니다. 다음날, 마우스를 피를 흘리고 비장 수집을 위해 안락사시켰다. 혈액을 처리하고 감염된 적혈구를 자기 분리로 농축한 다음 CFSE(오른쪽 상단)로 표지했습니다. 비장을 세포독성 림프구 분리를 위해, 마그네틱 비드를 이용한 음성 선택에 의해 처리하였다. 그 후, 정제된 세포독성 림프구 및 iRBCs를 37°C, 5%CO2에서 4시간 동안 공동 배양한 후, 유세포 분석기에서 세포별 표지 및 분석을 수행하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
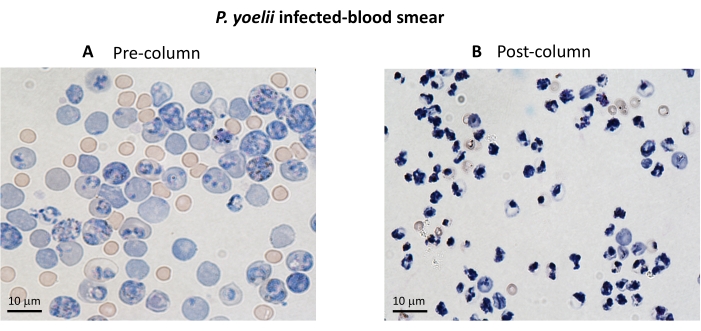
그림 3. 마그네틱 컬럼을 사용한 iRBC 농축. iRBCs를 LS 컬럼을 사용하여 P. yoelii 감염된 마우스로부터 정제하였다. 정제는 (A) 컬럼 농축 전과 ( B) 후에 수집 된 혈액의 혈액 도말에 의해 강조됩니다. 스케일 바 = 10 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4. CD8+ 림프구에 의한 P. yoelii-iRBC의 세포 용해 비율 평가. 세포 용해 비율에 대한 게이팅 전략. (A) 정지 게이트를 카운팅 비즈 모집단(~20,000 이벤트)으로 설정합니다. (B) 림프구가 없는 자연 용해, iRBC를 제어합니다. FSC 피크 높이 대 면적 비율에 따라 파편을 제외한 단일 세포를 선택한 다음 APC-Cy7 Ter119 양성 및 PerCP-Cy5.5 CD8 음성에서 RBC 집단을 선택하여 게이팅 전략을 시작합니다. 그런 다음 라이브 iRBC를 CFSE(FITC) 높은 긍정으로 선택합니다. (c) 상이한 이펙터를 사용한 실험 분석: 공배양 후의 살아있는 적혈구의 백분율을 표시하는 표적 비율. (D) 섹션 10에 설명된 공식에 기초하여 계산된 RBC 용해 백분율의 그래픽 표현. 그룹(세포독성 CD8 또는 나이브 CD8) 간의 유의성 비교는 다중 비교를 통해 양방향 ANOVA에 의해 평가되었습니다. P < 0.0001 (****)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에서는 세포독성 림프구에 의한 변형체 감염 적혈구 사멸을 측정하기 위한 시험관 내 분석에 대해 설명합니다. 이 분석은 말라리아 기생충의 적혈구 단계에 대한 세포 보호 면역 메커니즘을 밝히는 데 도움이 될 수 있습니다. 이 방법론의 주요 장점은 면역 세포가 다른 Plasmodium spp.와 상호 작용하는 방법에 대한 많은 질문을 해결하는 데 사용할 수 있는 iRBC의 세포 매개 사멸에 대한 정량적 분석을 제공한다는 것입니다.
중요하게도, 이 방법은 시험관 내 배양이 유지되지 않는 P. vivax 및 기타 Plasmodium 기생충을 연구하는 데 사용될 수 있다14,15. 또한, 이 프로토콜은 모든 변형체 종 및 인간, 생쥐 및 비인간 영장류와 같은 상이한 숙주에 적용될 수 있다. 유세포 분석 기반 방법은 세포 독성 세포 활성화, 사이토카인 생산 및 탈과립을 평가하는 데 널리 사용되지만10,11,16, 현재의 방법은 킬러 세포와 직접 세포 접촉에 의한 RBC 용해를 탐색하는 유일한 방법입니다.
또한 현미경 검사, 중합효소연쇄반응(PCR), 유세포 분석과 같은 많은 방법이 기생충혈증, 침입 및 항말라리아 활성을 측정하여 말라리아를 연구하는 데 사용됩니다. 그러나, 적혈구의 세포 매개 세포독성을 분석하기 위해,Cr51 또는 헤모글로빈 방출을 사용하는 현재의 방법은 적혈구 용해를 평가하기에 충분히 민감하지 않다. LDH 방출은 CD8+ T 세포와 같은 일부 CTL에 의한 적혈구 사멸을 평가하는 데에도 사용될 수 있지만, 활성화된 선천적 또는 선천적 유사 세포가 조절 메커니즘으로 서로를 죽일 수 있기 때문에 LDH 측정은 정확한 방법이 아닙니다.
CFSE는 유세포 분석 또는 형광 현미경에서 세포를 추적하거나 세포 증식을 탐색하는 데 널리 사용된다17. 적혈구는 증식하지 않기 때문에18, CFSE 형광 강도는 세포 용해와 함께 감소해야 한다. 유세포 분석은 매우 낮은 수준의 특정 마커를 검출할 수 있기 때문에 매우 정확한 기술이므로 말라리아 감염 19,20,21,22,23에서 기생충혈증과 침입을 추적하는 데 널리 사용되었습니다. 가장 중요한 것은 유세포 분석이 단일 세포에서 많은 매개변수를 측정하고 세포를 다른 집단으로 분류할 수 있다는 것입니다. 각 샘플에 정량적 표준 시약(계수 비드)을 추가함으로써, 획득된 이벤트의 수를 정규화하고 절대 세포 수를 얻을 수 있습니다24. 이 방법을 사용하면 실험 조건 간의 신뢰할 수 있는 정량적 비교가 가능하며, 이는 현재 제안된 프로토콜에 매우 중요합니다.
이 프로토콜의 몇 가지 중요한 단계에는 샘플 품질 보장, 적절한 세포 염색 보장, 계산 정규화를 위한 제어 포함이 포함됩니다. 감염된 적혈구를 정제하려면 많은 양의 신선한 혈액 샘플이 필요합니다. 밀도 구배 분리 배지 정제는 농도가 원하는 Plasmodium iRBC를 얻는 데 중요하므로 신중하게 접근해야 합니다. 밀도 구배 분리 배지에 혈액을 덮는 작업도 가능한 한 천천히 수행해야 하며, 고리 적층 수확은 iRBC가 손실되지 않도록 조심스럽게 수행되어야 합니다. 정제 과정을 더 쉽게 하려면 iRBC의 양이 더 많기 때문에 높은 기생충혈증 혈액 샘플을 사용해야 합니다. 자기장을 사용하는 RBC 격리 프로토콜에서는 상당한 양의 헤모조인을 생성하는 기생충 성숙 단계(중-후기 단계 영양체 또는 분열증)만 정제된다는 점에 유의해야 합니다. 결과적으로 링 단계가 수집되지 않으며 이는 최종 결과에 영향을 미칠 수 있습니다.
세포 염색은 세포의 손실이나 용해를 방지하기 위해 조심스럽게 수행해야 합니다. 염색하기 전에 장기간 보관하거나 고정하는 것을 피해야 합니다. 실험 조건은 연속 이펙터:표적 비율과 표지되지 않은 자발적 용해 조건 및 가설 제어와 같은 적절한 제어를 사용하여 세 번 수행해야 한다는 점에 유의하는 것이 중요합니다. 세포 계수 비드의 추가는 각 샘플에 대한 세포 농도 또는 절대 세포 수를 쉽게 결정할 수 있는 방법을 제공하기 때문에 매우 중요합니다. 유세포 분석기 획득 중에 계수 비드 게이트에서 수집할 이벤트 수를 설정하여 공동 배양 후 각 샘플의 세포 수를 정규화해야 합니다.
공배양 분석에서 일관된 결과를 얻으려면 최소 1 x 105 개의 이펙터 세포가 필요하기 때문에 설명된 방법론의 한 가지 가능한 한계는 정제 후 세포 수가 제한되어 있다는 것이며, 이는 특히 희귀 세포 집단으로 작업할 때 문제가 될 수 있습니다. 실제로 이것은 iRBC 정제에 적용되는데, 특히 풍토병 지역에서 인간 샘플로 작업할 때 쉽게 얻을 수 없는 매우 높은 기생충혈증이 필요하기 때문입니다.
하나의 프로토콜 개선은 공동 배양 배양 시간일 수 있습니다. 이전에는 12시간의 배양 시간(10,11)을 사용했지만, 최근에는 4시간이면 실험 조건을 구별할 수 있어 잠재적인 자연 용해 시간이 단축되고 결과의 재현성이 향상된다는 것을 관찰했습니다.
Plasmodium에 감염된 적혈구의 직접적인 사멸과 관련된 메커니즘이 점차 밝혀지고 있습니다. 우리 그룹은 CD8+ T 세포가 감염된 세포11에 의한 HLA-I 제시를 통해 P.vivax에 감염된 망상적혈구를 인식하고 죽일 수 있음을 처음으로 보여주었습니다. 최근 또 다른 연구에서는 γδ T 세포가 iRBC10의 표면에 존재하는 분자인 부티로필린에 의한 인산항원 인식을 통해 P. falciparum에 감염된 적혈구를 인식한다는 것을 입증했습니다. 두 연구 모두에서 RBC 용해는 과립류 및 그랜자임 B 의존적이며 세포내 기생충 사멸을 유도합니다.
기생충혈증, 침습, 항말라리아 활성 및 이미지 세포 상호작용을 측정하기 위해 수년에 걸쳐 많은 방법이 개발되었지만 정량적 유세포 분석기반 분석에서 세포독성 세포에 의한 iRBC의 직접적인 사멸을 분석할 수 있는 방법은 없었습니다 19,20,21. 우리는 Plasmodium에 감염된 적혈구의 CFSE 표지 및 림프구와의 특정 동시 배양 기간에 iRBC 용해 평가를 통해 말라리아의 세포 용해 능력을 평가하기 위해 혁신적인 접근 방식을 사용했습니다. 따라서 이 시험관 내 사멸 분석은 혈액 단계 말라리아에 대한 세포 매개 면역 메커니즘을 명확히 하기 위한 새로운 전략을 제시하며, 이는 새로운 치료 표적 연구와 말라리아 백신 개발을 발전시키는 데 도움이 될 것입니다.
공개
저자는 경쟁 이익을 선언하지 않습니다.
감사의 말
말라리아 환자 등록 및 채혈을 위해 Dhelio Pereira 박사와 Rondônia 열대 의학 연구 센터 (CEPEM) 회원들과 원고 수정을 도와 주신 Felicia Ho에게 감사드립니다. 다음 시약은 BEI Resources, NIAID, NIH를 통해 입수하였다: Plasmodium yoelii subsp. yoelii, Strain 17XNL:PyGFP, MRA-817, Ana Rodriguez에 의해 기여됨. 이 연구는 Lemann Brazil Research Fund, Conselho Nacional de Desenvolvimento Científico e Tecnológico(CNPq) - 437851/2018-4, 펠로우십(CJ, GC, CG) 및 Fundação de Amparo do Estado de Minas Gerais(FAPEMIG) - APQ-00653-16, APQ-02962-18; Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) - 친교 (LL).
자료
| Name | Company | Catalog Number | Comments |
| 100 μM cell strainer | Corning | 431752 | |
| 96 Well Round (U) Bottom Plate | Thermo Scientific | 12-565-65 | |
| Anti-human CD235a (Glycophorin A) Antibody | Biolegend | 349114 | Used - APC anti-human CD235, dilution 1:100 |
| Anti-human CD3 Antibody | Biolegend | 317314 | Used - PB anti-human CD3, dilution 1:200 |
| Anti-human CD8 Antibody | Biolegend | 344714 | Used - APC/Cy7 anti-human CD8, dilution 1:200 |
| Anti-human TCR Vδ2 Antibody | Biolegend | 331408 | Used - PE anti-human TCR Vδ2, dilution 1:200 |
| Anti-mouse CD8a Antibody | Biolegend | 100733 | Used- PerCP/Cyanine5.5 anti-mouse CD8a, dilution 1:200 |
| Anti-mouse TER-119/Erythroid Cells Antibody | Biolegend | 116223 | Used - APC/Cyanine7 anti-mouse TER-119, dilution 1:200 |
| CellTrace CFSE Cell Proliferation Kit | Invitrogen | C34554 | |
| Fetal Bovine Serum, qualified | Gibco | 26140079 | |
| Ficoll-Paque Plus | Cytiva | 17144003 | Lymphocyte Separation Medium (LSM) |
| Heparin Sodium Injection, USP | meithel pharma | 71228-400-003 | Used - 2000 USP units/2mL |
| Isoflurane | Piramal critical care | 66794-0013-25 | |
| LS MACS Column | Miltenyi Biotec | 130-042-401 | |
| LSRFortessa Cell Analyzer | BD Bioscience | ||
| Percoll | Cytiva | 17089101 | Density Gradient Separation Medium (DGSM) |
| QuadroMACS Separator | Miltenyi Biotec | 130-090-976 | |
| RPMI 1640 Medium | Gibco | 11875093 | |
| Sodium bicarbonate, powder, BioReagent | Sigma-Aldrich | S5761 | |
| Syringe With Sub-Q needle - 1mL, 26 gauge; | BD | 14-829-10F | |
| Vacutainer Heparin Tube Glass Green 10 ml | BD | 366480 |
참고문헌
- WHO. Global Technical Strategy for Malaria 2016-2030, 2021 Update. World Health Organization. , (2021).
- Hafalla, J. C., Silvie, O., Matuschewski, K. Cell biology and immunology of malaria. Immunological Reviews. 240 (1), 297-316 (2011).
- Belnoue, E., et al. Vaccination with live Plasmodium yoelii blood stage parasites under chloroquine cover induces cross-stage immunity against malaria liver stage. Journal of Immunology. 181 (12), 8552-8558 (2008).
- Leong, Y. W., Lee, E. Q. H., Rénia, L., Malleret, B. Rodent malaria erythrocyte preference assessment by an ex vivo tropism assay. Frontiers in Cellular and Infection Microbiology. 11, 680136 (2021).
- Ladeia-Andrade, S., Ferreira, M. U., De Carvalho, M. E., Curado, I., Coura, J. R. Age-dependent acquisition of protective immunity to malaria in riverine populations of the amazon basin of Brazil. The American Journal of Tropical Medicine and Hygiene. 80 (3), 452-459 (2009).
- Antonelli, L. R., et al. The immunology of Plasmodium vivax malaria. Immunological Reviews. 293 (1), 163-189 (2020).
- Kazmin, D., et al. Systems analysis of protective immune responses to RTS, S malaria vaccination in humans. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2425-2430 (2017).
- Epstein, J. E., et al. Live attenuated malaria vaccine designed to protect through hepatic CD8+ T cell immunity. Science. 334 (6055), 475-480 (2011).
- Draper, S. J., et al. Malaria vaccines: recent advances and new horizons. Cell Host & Microbe. 24 (1), 43-56 (2018).
- Junqueira, C., et al. γδ T cells suppress Plasmodium falciparum blood-stage infection by direct killing and phagocytosis. Nature Immunology. 22 (3), 347-357 (2021).
- Junqueira, C., et al. Cytotoxic CD8+ T cells recognize and kill Plasmodium vivax-infected reticulocytes. Nature Medicine. 24 (9), 1330-1336 (2018).
- Arora, G., et al. NK cells inhibit Plasmodium falciparum growth in red blood cells via antibody-dependent cellular cytotoxicity. eLife. 7, 36806 (2018).
- Paul, F., Roath, S., Melville, D., Warhurst, D. C., Osisanya, J. O. S. Separation of malaria-infected erythrocytes from whole blood: use of a selective high-gradient magnetic separation technique. Lancet. 2 (8237), 70-71 (1981).
- Shaw-Saliba, K., et al. Insights into an optimization of Plasmodium vivax Sal-1 in vitro culture: the aotus primate model. PLOS Neglected Tropical Diseases. 10 (7), 0004870 (2016).
- Mehlotra, R. K., et al. Long-term in vitro culture of Plasmodium vivax isolates from Madagascar maintained in Saimiri boliviensis blood. Malaria Journal. 16 (1), 442 (2017).
- Hojo-Souza, N. S., et al. Contributions of IFN-γ and granulysin to the clearance of Plasmodium yoelii blood stage. PLOS Pathogens. 16 (9), 1008840 (2020).
- Parish, C. R., Glidden, M. H., Quah, B. J. C., Warren, H. S. Use of the intracellular fluorescent dye CFSE to monitor lymphocyte migration and proliferation. Current Protocols in Immunology. 84 (1), 4-9 (2009).
- Migliaccio, A. R. Erythroblast enucleation. Haematologica. 95 (12), 1985 (2010).
- Grimberg, B. T., Erickson, J. J., Sramkoski, R. M., Jacobberger, J. W., Zimmerman, P. A. Monitoring Plasmodium falciparum growth and development by UV flow cytometry using an optimized Hoechst-thiazole orange staining strategy. Cytometry Part A:The Journal of the International Society for Analytical Cytology. 73 (6), 546-554 (2008).
- Pattanapanyasat, K., et al. Culture of malaria parasites in two different red blood cell populations using biotin and flow cytometry. Cytometry:The Journal of the International Society for Analytical Cytology. 25 (3), 287-294 (1996).
- Bianco, A. E., Battye, F. L., Brown, G. V. Plasmodium falciparum: rapid quantification of parasitemia in fixed malaria cultures by flow cytometry. Experimental Parasitology. 62 (2), 275-282 (1986).
- Jacobberger, J. W., Horan, P. K., Hare, J. D. Analysis of malaria parasite-infected blood by flow cytometry. Cytometry:The Journal of the International Society for Analytical Cytology. 4 (3), 228-237 (1983).
- Bei, A. K., et al. A flow cytometry-based assay for measuring invasion of red blood cells by Plasmodium falciparum. American Journal of Hematology. 85 (4), 234 (2010).
- Montes, M., Jaensson, E. A., Orozco, A. F., Lewis, D. E., Corry, D. B. A general method for bead-enhanced quantitation by flow cytometry. Journal of Immunological Methods. 317 (1-2), 45-55 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유