Method Article
In vitro Ensaio de Morte de Hemácias Infectadas por Plasmodium por Linfócitos Citotóxicos
Neste Artigo
Resumo
Aqui descrevemos um novo método para ajudar a elucidar os mecanismos de imunidade celular ao Plasmodium durante a fase sanguínea da infecção. Este é um ensaio in vitro que mede a morte de hemácias infectadas por linfócitos citotóxicos.
Resumo
A malária é um importante problema de saúde pública, apresentando mais de 200 milhões de casos por ano em todo o mundo. Apesar de anos de esforços científicos, a imunidade protetora contra a malária ainda é pouco compreendida, principalmente devido às limitações metodológicas da cultura de Plasmodium a longo prazo, especialmente para Plasmodium vivax. A maioria dos estudos tem se concentrado na proteção da imunidade adaptativa contra a malária por anticorpos, que desempenham um papel fundamental no controle da malária. Entretanto, a proteção estéril induzida pelas vacinas atenuadas contra esporozoítos de Plasmodium está relacionada à resposta celular, principalmente aos linfócitos T citotóxicos, como as células T CD8+ e gama delta (γδ T). Assim, novas metodologias devem ser desenvolvidas para melhor compreender as funções da resposta imune celular e, assim, subsidiar futuras terapias e o desenvolvimento de vacinas. Para encontrar uma nova estratégia para analisar essa imunidade mediada por células à infecção por Plasmodium no estádio sanguíneo, nosso grupo estabeleceu um ensaio in vitro que mede a morte de hemácias infectadas (iRBC) por linfócitos citotóxicos. Este ensaio pode ser usado para estudar mecanismos de resposta imune celular contra diferentes Plasmodium spp. Células imunes citotóxicas inatas e adaptativas podem eliminar diretamente as hemácias e o parasita intracelular em um mecanismo efetor :alvo. As hemácias alvo são marcadas para avaliar a viabilidade celular e cocultivadas com células efetoras (células CD8+ T, γδ T, NK, etc.). A porcentagem de lise é calculada com base nas condições testadas, em comparação com um controle de lise espontânea em um ensaio baseado em citometria de fluxo. Em última análise, esta metodologia de ensaio de morte é um grande avanço na compreensão da imunidade mediada por células à malária em estágio sanguíneo, ajudando a descobrir novos alvos terapêuticos potenciais e acelerar o desenvolvimento de vacinas contra a malária.
Introdução
A malária continua sendo uma crise de saúde global, com mais de 240 milhões de casos e 627.000 mortes relacionadas à malária relatadas em 20201. Atualmente, existem cinco espécies parasitas que podem causar malária em humanos, das quais Plasmodium falciparum e Plasmodium vivax são as duas espécies mais prevalentes. Durante a infecção por Plasmodium , o fígado ou estágio pré-eritrocítico é assintomático, e os sintomas só ocorrem durante o ciclo assexuado do parasita na fase eritrocitária. Nesta fase de infecção, milhares de merozoítos derivados da fase hepática são liberados na corrente sanguínea e infectam os glóbulos vermelhos (hemácias). Nas hemácias, os parasitas diferenciam-se em trofozoítos e esquizoítos por esquizogonia, até que os esquizontes rompam o eritrócito, liberando merozoítos recém-formados, repetindo esse ciclo sanguíneo. Ciclos repetidos de invasão, replicação e liberação de merozoítos resultam em um crescimento exponencial da população de parasitos e, finalmente, desencadeiam sintomas da doença2.
Um desafio importante no estudo da resposta imune à malária é que o Plasmodium spp. que infecta humanos não infecta modelos animais de laboratório. Assim, amostras de pacientes infectados por Plasmodium devem ser coletadas frescas e imediatamente processadas e analisadas. No entanto, em áreas endêmicas de malária, os recursos para acessar mecanismos imunológicos e moleculares são limitados. Devido a essas limitações, roedores são amplamente utilizados como modelos experimentais para investigar a resposta imune contra a infecção por Plasmodium. Enquanto P. berghei e P. chabaudi são frequentemente usados como substitutos para a infecção por P. falciparum, a cepa não-letal de P. yoelii 17XNL também tem muitas características em comum com P. vivax, como infecção restrita a reticulócitos 3,4. O desenvolvimento de ensaios in vitro de Plasmodium, que podem ser utilizados para amostras derivadas de modelos humanos ou animais, é valioso para obter uma melhor compreensão da patogênese da malária e comparar a resposta imunológica provocada por diferentes espécies do parasita.
A imunidade protetora antimalárica não é completamente compreendida nem na fase pré-eritrocitária nem na fase sanguínea. Sabe-se que a exposição a infecções repetidas resulta em imunidade parcial adquirida, mas a imunidade estéril raramente é desenvolvida5. Durante décadas, a imunidade protetora anti-Plasmodium esteve associada principalmente à indução de anticorpos neutralizantes ou opsonizantes que impedem a invasão parasitária das células hospedeiras ou levam à fagocitose por células apresentadoras de antígenos, respectivamente6. Como resultado, a maioria dos esforços para produzir vacinas antimaláricas até o momento tem contado com a indução de anticorpos protetores e de longa duração 7,8. Entretanto, a proteção estéril induzida pela vacinação com esporozoíto atenuado correlaciona-se diretamente com a ativação e expansão de linfócitos T citotóxicos 8,9.
Recentemente, alguns estudos com amostras de pacientes recém-isoladas e culturas in vitro demonstraram que células imunes citotóxicas inatas ou adaptativas, como células CD8+ T 10, γδ T11 e NK12, podem eliminar diretamente hemácias infectadas por Plasmodium e seu parasita intracelular de maneira efetor:alvo. Esses achados seminais definiram um mecanismo efetor imunológico inteiramente novo no contexto da malária. Para dissecar essa nova imunidade antimalárica, é essencial explorar mecanismos efetores citotóxicos de células assassinas contra hemácias infectadas (iRBCs) em infecção natural ou vacinação.
Apresentamos aqui um ensaio in vitro que mede a atividade citotóxica dos linfócitos contra a malária na fase sanguínea. Este ensaio pode então ajudar a elucidar os mecanismos da resposta imune celular contra o estágio eritrocitário do Plasmodium . As células-alvo, iRBCs, são marcadas com éster succinimidílico de carboxifluoresceína (CFSE) para avaliar a viabilidade celular, e são então cocultivadas com células efetoras como linfócitos citotóxicos (CTL). Esta cocultura é então avaliada por citometria de fluxo, usando marcadores fluorescentes para tipos celulares específicos. Finalmente, a porcentagem de lise de iRBC por CTL é calculada dividindo-se a condição experimental pela ruptura espontânea das hemácias e controle da lise espontânea, que ocorre durante a incubação sem a célula efetora. Em geral, esta metodologia de ensaio de morte pode contribuir para uma melhor compreensão da imunidade da malária mediada por células.
Protocolo
Todos os procedimentos foram realizados seguindo as políticas da Fundação Oswaldo Cruz e do Conselho Nacional de Ética (CAAE: 59902816.7.0000.5091). Os protocolos em humanos foram desenvolvidos em colaboração com o grupo de pesquisa clínica do Centro de Pesquisa em Medicina Tropical de Rondônia (CEPEM), responsável pela inclusão dos pacientes no estudo. Todos os pacientes assinaram o termo de consentimento livre e esclarecido.
Para o estudo com animais, os procedimentos foram realizados seguindo os princípios de conduta do Guia Brasileiro de Práticas para Cuidados e Uso de Animais para Fins Científicos e Didáticos do Conselho Nacional de Controle de Experimentação Animal (CONCEA). Os protocolos foram aprovados pelo Conselho de Experimentação Animal da Fiocruz (CEUA protocolo LW15/20-2).
1. Coleta de amostras de sangue humano e isolamento de CMSP
- Coletar sangue de pacientes infectados por Plasmodium em um tubo de coleta de sangue evacuado de 10 mL com heparina sódica. Como os pacientes com malária apresentam linfopenia, há uma variação de 5-9 x 106 células mononucleares do sangue periférico (PBMCs) em uma amostra de sangue de 10 mL. Como as células T CD8+ ou γδ T compõem ~10% das CMSP, preferencialmente coletam 50-100 mL de sangue/paciente.
NOTA: Um mínimo de 1 x 105 células/condição efetoras deve ser considerado. - Calcule a porcentagem de hemácias por esfregaço de sangue, conforme descrito abaixo.
- Adicione 5 μL de sangue total a uma lâmina transparente e prepare um esfregaço de sangue. Realizar coloração rápida panóptica tipo Romanowsky ou coloração May-Günwald-Giemsa. Aqui, utiliza-se o kit de coloração rápida panóptica, que é composto por três reagentes: reagente A (fixação), reagente B (coloração citoplasmática) e reagente C (coloração diferencial nuclear e citoplasmática).
- Mergulhe lentamente a lâmina na solução A 10x, depois 4x na solução B e, finalmente, 10x na solução C. Escorra qualquer excesso de reagente das lâminas entre as soluções. Depois de mergulhar na solução C, enxágue a lâmina em água corrente da torneira e deixe secar.
- Sob um microscópio de luz vertical com objetiva de imersão em óleo de 100x, conte 1000 hemácias em quadrados sequenciais e calcule a porcentagem de parasitemia usando a seguinte equação:
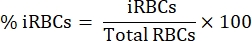
- Diluir 15 mL de sangue na proporção 1:1 em solução salina estéril tamponada com fosfato (PBS).
- Adicionar 15 mL de meio de separação de linfócitos (densidade de 1,077g/mL) a um tubo de 50 mL. Colocar cuidadosamente os 30 ml de amostra de sangue diluído na solução do meio de centrifugação. Ao colocar a amostra em camadas, não deixe que a amostra de sangue e o meio de separação de linfócitos se misturem.
- Centrifugar os tubos a 400 x g por 40 min a 22 °C, com baixa aceleração e sem ajuste de ruptura.
- Retirar a camada superior que contém plasma usando uma pipeta estéril, deixando a camada de células mononucleares intacta. Transfira a camada de células mononucleares (PBMCs) para um tubo estéril usando uma pipeta estéril.
- Não descarte o tubo contendo a pastilha de sangue, pois ele será usado posteriormente para o isolamento de hemácias infectadas. A partir desta etapa, certifique-se de manter as hemácias à temperatura ambiente (TR). Nunca os deixe esfriar.
- Lave as células duas vezes adicionando PBS e centrífuga a 350 x g por 10 min, com ajuste de quebra. Ressuspender o pellet celular em 5 mL de meio RPMI suplementado com penicilina/estreptomicina e 10% de soro fetal bovino (SFB; meio completo).
- Contar as CMSP na presença de solução de azul de tripano para verificar a viabilidade celular, usando um hemacitômetro (câmara de Neubauer) ou contador automático de células. Não conte as células coradas de azul, pois estas representam células moribundas, que absorvem o azul de tripano.
- Ajustar a concentração celular para 107 células/mL usando meio completo. Purificar as populações de linfócitos citotóxicos desejados (células T CD8+ , células NK, células T γδ) usando o isolamento de esferas magnéticas conforme protocolo do fabricante do reagente.
2. Isolamento de hemácias humanas
NOTA: Para o isolamento de hemácias infectadas por humanos, recomenda-se iniciar com amostras de sangue que tenham um mínimo de 2% de parasitemia, preferencialmente com mais no estágio de trofozoíto/esquizoíto inicial do parasita.
- Preparar o PERCOLL (doravante designado por meio de separação por gradiente de densidade) na concentração recomendada, conforme descrito abaixo.
- Adicionar 90 mL de meio de separação de gradiente de densidade de 100% e 10 mL de PBS 10x para obter meio de separação de gradiente de densidade isotônico de 90%.
- Para a separação de reticulócitos infectados por P. vivax, prepare meios de separação com gradiente de densidadede 45%. Adicionar 50 mL de meio de separação de gradiente de densidade isotônico de 90% e 50 mL de PBS 1x para obter meio de separação de gradiente de densidade de 45%.
- Para a separação de eritrócitos infectados por P. falciparum, prepare meios de separação com gradiente de densidade de 65%. Adicionar 72 mL de meio de separação de gradiente de densidade isotônico de 90% e 28 mL de PBS 1x para obter 65% de meio de separação de gradiente de densidade.
- Para a separação de reticulócitos não infectados, prepare meios de separação de gradiente de densidade de 70%. Adicionar 78 mL de meio de separação de gradiente de densidade isotônico de 90% e 22 mL de PBS 1x para obter meio de separação de gradiente de densidade de 70%.
- Aqueça o meio de separação do gradiente de densidade a 37 °C em banho-maria.
- Após a remoção da camada de PBMC, remova cuidadosamente o máximo possível da camada superior do meio de centrifugação sem tocar nas células. Com uma pipeta de vidro Pasteur, remova cuidadosamente a camada superior de neutrófilos sem perturbar a pelota de hemácias e estime o volume da pelota. Adicione 4x o volume da pastilha de RBC do meio RT completo e ressuspenda.
- Em um segundo tubo cônico de 50 mL, adicionar 5x o volume do pellet de 45%, 65% ou 70% de meio de separação do gradiente de densidade, dependendo do tipo de célula a ser isolada. Coloque a suspensão RBC sobre a camada média de separação do gradiente de densidade cuidadosamente.
- Gire por 15 min a 850 x g, com baixa aceleração e sem ajuste de ruptura. Recolher a camada turva vermelha/castanha situada entre o sobrenadante e o meio de separação do gradiente de densidade com uma pipeta de 5 ml. Transfira para um tubo estéril de 15 mL.
- Lave as células adicionando RT meio completo até 15 mL e gire para baixo por 10 min a 860 x g. Repita a lavagem adicionando 10 mL de RT meio completo e gire para baixo. Eliminar o sobrenadante e preparar um esfregaço de sangue a partir do pellet para verificar o enriquecimento de iRBC, seguindo o passo 1.2.
- Ressuspender o pellet em 1 mL de meio RT completo e deixar descansar à temperatura ambiente enquanto se contam as células. Adicionar 10 μL de suspensão celular em um hemocitômetro (câmara de Neubauer) e contar as hemácias na área central subdividida em 25 quadrados médios. Ajustar a concentração celular para 1 x 107 iRBCs/mL em meio RT completo.
3. Infecção experimental por malária em camundongos
- Descongelar uma alíquota de P. yoelii criopreservada 17XNL:PyGFP (MRA-817), uma cepa que expressa GFP obtida de MR4/ATCC, e injetar 100 μL intraperitonealmente (i.p.) em uma fêmea de camundongo C57BL/6 com 8 semanas de idade.
- Acompanhar a carga parasitêmica a cada 3 dias por meio da coleta de sangue da veia caudal.
- Puncionar o vaso com o bisel da agulha para cima, entrando na veia em um ângulo raso que começa na extremidade distal da cauda.
- Coletar a amostra de sangue com uma pipeta ou tubo capilar até 5 ou 10 mL, em seguida, aplicar pressão manual para parar o sangramento.
- Preparar um esfregaço de sangue (conforme descrito na etapa 1.2) até que a parasitemia atinja 10%-15% das hemácias infectadas.
- Coletar 10 μL de sangue pela veia caudal e diluir para 100 μL de PBS para injeção i.p. no segundo camundongo doador.
NOTA: Os parasitas criopreservados devem ser descongelados e passados em camundongos duas vezes antes de serem usados para infecções experimentais. - Quando a segunda passagem atingir 15% de parasitemia, coletar cinco gotas de sangue pelo método de corte de cauda e diluir em 1 mL de PBS. Preparar uma solução de infecção ajustando a concentração para 1 x 106 iRBCs/mL em PBS estéril e injetar i.p. 100 μL (1 x 105 iRBCs) da solução em cada camundongo necessário para o experimento.
- Monitorar a parasitemia a cada 2-3 dias até atingir ~30% de hemácias, o que ocorre aproximadamente 12 dias após a infecção. Quando os camundongos atingirem a parasitemia desejada, coletar sangue por punção cardíaca conforme descrito abaixo.
- Aspirar 100 μL de solução de heparina (30 U/mL) em uma seringa de 1 mL com uma agulha de 26 G.
- Anestesiar o camundongo por inalação com isoflurano a 5% e confirmar a ausência de reflexos. Coloque o rato de lado e introduza perpendicularmente a agulha logo abaixo do cotovelo, através das costelas e no coração. Puxe o êmbolo da seringa lentamente e gire a agulha até obter 0,5-1 mL de sangue.
- Realizar eutanásia humanizada por luxação cervical sob anestesia. Limpar assepticamente o lado esquerdo do rato com etanol a 70%. Com tesoura cirúrgica, faça um corte no lado esquerdo do rato passando pela pele e peritônio. Localize o baço e remova-o.
- Coloque o baço de camundongo em uma placa de Petri com 5 mL de meio completo para purificar a população de células efetoras desejada (por exemplo, células T CD8+ ).
4. Obtenção de esplenócitos frescos de camundongos inteiros
- Na placa de Petri, corte cuidadosamente o baço em pequenos pedaços usando uma tesoura ou uma navalha.
- Coloque um filtro de células de 100 μM sobre um tubo cônico de 50 mL e transfira o baço excisado para o filtro de células com uma pipeta. Amasse o baço através do coador com um êmbolo de seringa.
- Lave as células através do filtro com 10 mL de meio completo. Centrifugar as células a 300 x g durante 10 minutos a 4 °C e, em seguida, eliminar o sobrenadante.
- Ressuspender o pellet de células em 2 mL de tampão de lise RBC 1x frio. Incubar a suspensão por 5 min no gelo.
- Lavar a suspensão celular com 10 ml de meio completo a 4 °C. Repita a etapa de lavagem três vezes e remova quaisquer coágulos celulares entre as lavagens para baços de camundongos infectados por Plasmodium.
- Centrifugar as células a 400 x g durante 5 min a 4 °C e, em seguida, eliminar o sobrenadante.
NOTA: Os baços infectados por plasmódio são aumentados e preenchidos por células fagocíticas contendo hemoglobina e hemozoína degradadas. - Para evitar quaisquer problemas durante o isolamento do grânulo magnético das células efetoras, use as seguintes etapas para remover as células fagocíticas enriquecidas com hemozoína e a hemozoína. Ressuspender as células esplênicas com tampão MACS e ajustar a concentração para 1 x 108 células/mL. Coloque uma coluna LS ou LD no campo magnético. Preparar a coluna enxaguando com 3 mL de tampão MACS.
- Aplique a suspensão da célula na coluna. Lavar a coluna três vezes com 3 mL de tampão MACS. Coletar fluxo-através contendo as células esplênicas.
- Contar os esplenócitos em uma solução de azul de tripano e verificar a viabilidade celular em um hemacitômetro (câmara de Neubauer) ou contador automático de células. Ajustar a concentração celular para 1 x 107 células/mL em meio RT completo.
5. Purificação citotóxica de células efetoras (seleção negativa de células T CD8a+ )
NOTA: Existem muitos reagentes de seleção positivos e negativos que podem purificar células efetoras citotóxicas (células CD8+ T, γδ T, NK, iNKT, MAIT). Neste protocolo, usamos uma seleção negativa de células T CD8a+ esplênicas e seguimos as instruções do fabricante.
- Centrifugar todos os esplenócitos a 400 x g durante 10 minutos a 4 °C e eliminar o sobrenadante. Ressuspender o pellet de célula em 40 μL de tampão MACS.
- Adicione 10 μL de um coquetel de anticorpos de biotina. Misture bem e incube por 5 min no gelo.
- Adicionar 30 μL de tampão MACS. Adicionar 20 μL de microesferas anti-biotina. Misture bem e incube por 10 min no gelo.
- Adicionar 400 μL de tampão MACS e proceder à separação magnética da célula. Coloque a coluna MACS LS no suporte do campo magnético. Preparar a coluna enxaguando com 3 mL de tampão MACS.
- Aplique a suspensão da célula na coluna. Lavar a coluna três vezes com 3 mL de tampão MACS. Coletar o fluxo-através contendo todas as células não marcadas, que são as células T CD8a+ enriquecidas.
- Contar as células T CD8a+ em uma solução de azul de tripano e verificar a viabilidade celular em um hemacitômetro (câmara de Neubauer) ou contador automático de células. Ajustar a concentração celular para 1 x 107 células/mL em meio RT completo.
6. Isolamento de hemácias infectadas por P. yoelii
- Centrifugar o sangue coletado em tubo de 1,5 mL a 850 x g por 3 min. Descarte o soro e ressuspenda o sangue em 1 mL de 1x RPMI sem SFB.
- Coloque a coluna LS no suporte do campo magnético e enxágue com 3 mL de 1x RPMI. Passe a suspensão RBC através da coluna. Para isolar mais hemácias, reaplique o fluxo (3 mL de RPMI e 1 mL de sangue diluído) na coluna.
- Lavar duas vezes com 5 mL de 1x RPMI. Execute as etapas de lavagem adicionando alíquotas de buffer assim que o reservatório da coluna estiver vazio. Não deixe nenhuma coluna secar.
- Adicionar 5 mL de RPMI, remover a coluna e purgar as hemácias em um novo tubo de 15 mL. Conte as hemácias e ajuste a concentração para 1 x 107 hemácias/mL.
7. Marcação CFSE de hemácias e preparação para citometria de fluxo
NOTA: Inicie o protocolo de marcação RBC com o dobro do número de células que serão usadas para o experimento, uma vez que ~50% das células são tipicamente perdidas nas etapas de lavagem após a etapa de marcação CFSE. Para estabelecer a autofluorescência das hemácias/iRBCs, incluir uma amostra controle de células não marcadas.
- Diluir o CFSE até uma concentração final de 10 mM em 1x RPMI sem FBS. Lavar as células uma vez com 1x RPMI sem FBS em um tubo de 15 mL.
- Ressuspender as hemácias em 500 μL de 1x RPMI sem FBS e adicionar 500 μL de CFSE diluído. Incubar por 8 min em TR, protegido da luz.
- Lavar três vezes adicionando 14 mL de meio completo (10% FBS RPMI), seguido de centrifugação a 850 x g por 10 min. Ressuspender as células em meio completo para uma concentração de 1-5 x 106/ mL. Incubar por 1 h no TR.
8. Cocultura citotóxica de linfócitos/hemácias e preparação para citometria de fluxo
OBS: Se o envolvimento de receptores ou moléculas específicas for medido, incubar os anticorpos específicos de bloqueio e controle isotípico (10 mg/mL) com as células efetoras por 30 min antes do cocultivo.
- Plaqueie as células em uma placa de fundo redondo de 96 poços. Adicione os linfócitos purificados e as hemácias marcadas com CFSE na relação efetor-célula alvo desejada a um volume final de 200 μL e homogeneize. Prepare cada condição em triplicata.
NOTA: Sugerimos ajustar a concentração de iRBC para 1-5 x 104 células/mL e escolher a proporção com base no número de células purificadas (por exemplo, 0,5:1, 2,5:1 e 5:1). - Incluir o controle de lise espontânea, que é o alvo de hemácias sem o efetor, para avaliar qualquer lise espontânea, pois esta será utilizada para representar uma condição de viabilidade celular de 100%.
- Gire a placa por 1 min a 360 x g para maximizar o contato celular. Incubar a 37 °C e 5% CO2 durante 4 h.
NOTA: Condições de hipóxia (baixo O2), sistematicamente utilizadas para cultura de P. falciparum , não devem ser utilizadas, uma vez que as células efetoras não sobrevivem neste ambiente. Em contraste, os parasitas do Plasmodium são viáveis em ar ambiente em 5% de CO2 por até 12 h. - Gire por 5 min a 850 x g e vire a placa para remover o sobrenadante.
NOTA: Se desejado, o sobrenadante pode ser usado para medir quaisquer fatores solúveis liberados na cocultura. - Rotular as hemácias com anticorpos anti-camundongo Ter119 1:200 (ou anti-humano CD235 1:100 para amostras humanas) e células T CD8+ com anticorpos anti-CD8 1:200 ou anti-CD3 1:200 (anti-camundongo ou humano) por 30 min a 4 °C em 1x PBS contendo 3% de FBS (tampão FACS).
NOTA: O fluoróforo do anticorpo deve ser selecionado com base no traçador celular/reagente de proliferação celular (por exemplo, iRBC marcado com CFSE, APC-Cy7 anti-Ter119 e PerCP-Cy5.5 anti-CD8a). - Lave as células com tampão FACS e gire para baixo por 5 min a 850 x g. Transfira as amostras para tubos FACS e adicione 30 μL de contas de contagem a tubos individuais . Homogeneizar as contas de contagem por vórtice por 30 s.
9. Citometria de fluxo
- Analise amostras usando um instrumento laser 405/488/561/640.
- Para células humanas marcadas com CFSE (FITC), PE anti-humano γδ TCR, e PE-Cy7 anticorpo humano CD235a, use filtros 530/30 (FITC), 575/25 (PE) e 780/60 (PE-Cy7) em um citômetro de configuração de três lasers (Azul, Vermelho, Amarelo-Verde).
- Para células de camundongo marcadas com CFSE (FITC), PerCP-Cy5.5 anti-mouse CD8a e APC-Cy7 anti-mouse Ter119, use filtros 530/30 (FITC), 695/40 (PerCP-Cy5.5) e 780/60 (APC-Cy7) na configuração do citômetro de três lasers.
- Escolha a contagem da população de contas como o portão de parada para adquirir um mínimo de 20.000 eventos no portão de parada, que deve ser idêntico para todas as condições. Realizar análise e compensação usando software apropriado de aquisição/análise de citometria de fluxo.
- Defina a estratégia de fechamento conforme descrito abaixo.
- Selecione células únicas (singletes), excluindo detritos usando a relação altura de pico (H) para área (A) do FSC. Selecionar hemácias e excluir os linfócitos da análise com base na fluorescência do marcador eritrocitário (Ter119 ou CD235a) e do anticorpo linfocitário específico (CD8a).
- No fechamento anterior de hemácias, selecione hemácias viáveis com base na coloração positiva de CFSE. Analise os dados com o software de análise de dados do citômetro de fluxo.
10. Cálculo e estatística
- Para calcular a porcentagem de lise de eritrócitos, siga a estratégia de gating descrita na etapa 9. A porcentagem de hemácias viáveis é a frequência de células positivas para CFSE dentro da porta de eritrócitos com base na fluorescência positiva para Ter119 (camundongo) ou CD235a (humano).
- Utilizar o controle de lise espontânea, hemácias sem células efetoras, condição como controle para estimar a ruptura espontânea das hemácias. Esta condição será considerada lise eritrocitária (100% de viabilidade). Use a seguinte fórmula para calcular a porcentagem de lise eritrocitária em cada condição testada:
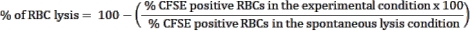
NOTA: Durante a incubação da cultura, algumas hemácias infectadas podem lisar espontaneamente ou ser rompidas pelo parasita. Use a frequência de eritrócitos CFSE positiva da condição de lise espontânea, que não contém células efetoras, como linha de base para a citotoxicidade de linfócitos. - Calcular a média de triplicatas para cada condição e determinar a significância estatística usando ANOVA two-way em comparações múltiplas.
Resultados
Aqui, a metodologia aplicada para o isolamento de hemácias infectadas por Plasmodium marcadas com CFSE em um ensaio de cocultura com linfócitos citotóxicos é descrita. Primeiramente, apresentamos uma representação esquemática de como realizar o protocolo, empregando amostras humanas infectadas com P. vivax (Figura 1). Em seguida, um fluxograma ilustrado sobre como proceder com o protocolo em um modelo experimental de malária usando um camundongo C57BL/6 infectado com P. yoelii (Figura 2). Na Figura 3, são apresentados os resultados esperados (antes e depois) para a etapa 6 do protocolo (enriquecimento de hemácias infectadas por P. yoelii utilizando colunas magnéticas). Finalmente, a Figura 4 mostra uma análise representativa da citometria de fluxo, detalhando a estratégia de gating necessária para avaliar a porcentagem de lise eritrocitária, conforme descrito na etapa 9. Portanto, esta seção destaca as diferentes técnicas aqui utilizadas, descrevendo todo o processo de aquisição, montagem e análise dos dados para avaliar a morte de eritrócitos por linfócitos citotóxicos.
Lise de hemácias infectadas por Plasmodium humano por células citotóxicas
Uma representação esquemática do protocolo para avaliar a morte de hemácias humanas infectadas por Plasmodium por células citotóxicas é mostrada na Figura 1. Para medir a lise celular, as CMSP de pacientes infectados por Plasmodium foram purificadas usando o meio de separação, seguido de purificação magnética da população de linfócitos citotóxicos (CTL) de interesse (por exemplo, células CD8+ T, γδ T, NK, iNKT, MAIT, etc.). A pelota remanescente das hemácias remanescentes do isolamento das CMSP foi utilizada para enriquecer hemácias infectadas por Plasmodium usando meio de separação por gradiente de densidade (65% P. falciparum; 45% P. vivax). As hemácias foram marcadas com CFSE e incubadas com ou sem linfócitos por 4 h a 37 °C, 5% CO2. Após o período de cocultura, todas as hemácias (infectadas ou não) foram marcadas com anticorpo anti-CD235a humano (para as hemácias) e anticorpos CTL-específicos (por exemplo, anti-CD8, anti-γδTCR, etc.) antes da análise por citometria de fluxo. A aquisição e análise das amostras humanas foram semelhantes às demonstradas para amostras de camundongos na Figura 4.
Lise de hemácias infectadas por P. yoelii por células T CD8+ citotóxicas
Um fluxograma do procedimento experimental para avaliar o mecanismo efetor citotóxico no modelo experimental de malária é mostrado na Figura 2, juntamente com dados experimentais representativos mostrados na Figura 3 e na Figura 4. Camundongos C57BL/6 foram infectados com 1 x 105eritrócitos de P. yoelii (Py) e a parasitemia foi monitorada até atingir cerca de 30%. As hemácias foram isoladas do sangue por separação magnética, pois o subproduto heme do parasita, a hemozoína, é enriquecido com ferro e funciona como partículas paramagnéticas em campo magnético13. A pureza da amostra enriquecida foi analisada por esfregaço sanguíneo em comparação com a amostra pré-coluna (Figura 3). As hemácias foram então marcadas com o reagente traçador celular CFSE. Paralelamente, células T CD8+ citotóxicas foram purificadas de esplenócitos usando um kit de seleção magnética negativa. Como controle, o mesmo protocolo foi utilizado para purificação de células T CD8+ de camundongos não infectados. Células efetoras (T CD8+) e alvo (Py-iRBC marcadas com CFSE) foram incubadas em diferentes relações efetor :alvo (E:T: 0,5:1, 2,5:1 e 5:1) por 4 h a 37 °C 5% CO2. Ao final da cocultura, cada condição foi marcada com anticorpos anti-camundongo Ter119 para hemácias e anti-CD8a para células citotóxicas. A estratégia de gating e os resultados da amostra estão representados na Figura 4.
Gráfico 1. Esquema do ensaio de morte in vitro. Exemplo de experimento de ensaio de matança. O sangue infectado por plasmódio é coletado e processado usando um meio de gradiente de separação. Após a centrifugação, a camada de CMSP é coletada, e as células citotóxicas (CTLs) foram purificadas usando esferas magnéticas. A camada de hemácias é novamente processada usando meios de separação de gradiente de densidade. Após a centrifugação, a camada de Plasmodium-iRBC é coletada e marcada com CFSE. Em seguida, as CTL purificadas e as iRBCs foram cocultivadas por 4 h a 37 °C, 5% CO2, seguidas de marcação e análise em citômetro de fluxo. Clique aqui para ver uma versão maior desta figura.
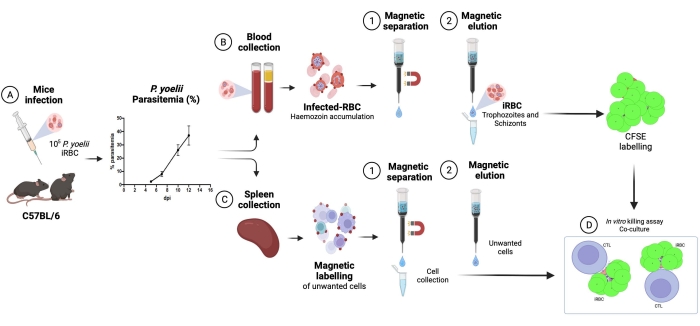
Gráfico 2. Modelo experimental de malária para ensaio de morte. Primeiro, camundongos C57BL/6 foram infectados com 105 hemácias infectadas com PyX17NL. Em seguida, a parasitemia é monitorada por esfregaço sanguíneo, até o pico da infecção (30%-40% de hemácias), aproximadamente 12 dias pós-infecção (dpi). No dia seguinte, os camundongos foram sangrados e eutanasiados para coleta de baço. O sangue foi processado e as hemácias infectadas foram enriquecidas por separação magnética, seguida de marcação com CFSE (canto superior direito). O baço foi processado para isolamento de linfócitos citotóxicos, por seleção negativa utilizando esferas magnéticas. Em seguida, os linfócitos citotóxicos purificados e as hemácias foram cocultivadas por 4 h a 37 °C, 5% de CO2, seguidas de marcação e análise em citômetro de fluxo. Clique aqui para ver uma versão maior desta figura.
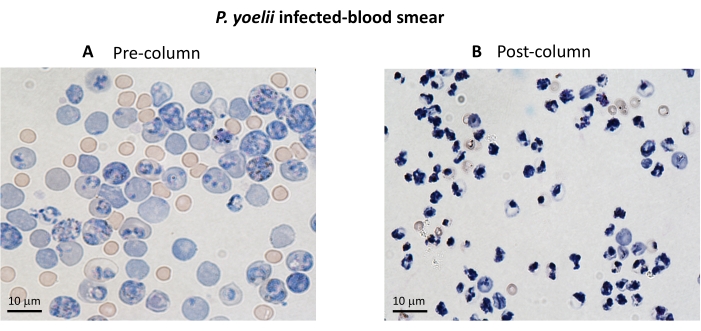
Gráfico 3. Enriquecimento de iRBC utilizando colunas magnéticas. As iRBCs foram purificadas de camundongos infectados por P. yoelii usando colunas LS. A purificação é destacada por esfregaços sanguíneos de sangue coletado antes ( A ) e após (B) enriquecimento da coluna. Barra de escala = 10 μm. Clique aqui para ver uma versão maior desta figura.

Gráfico 4. Avaliação da porcentagem de lise celular de P. yoelii-iRBCs por linfócitos CD8+. A estratégia de gating para porcentagem de lise celular. (A) Coloque o portão de parada na contagem da população de contas (~20.000 eventos). (B) Controle de lise espontânea, hemácias sem linfócitos. Iniciar a estratégia de gating selecionando as células únicas, excluindo debris, com base na razão altura/área do pico FSC, seguido pela seleção da população de hemácias em APC-Cy7 Ter119 positivo e PerCP-Cy5.5 CD8 negativo. Em seguida, selecione iRBCs ao vivo como CFSE (FITC) alto positivo. (C) Exemplo de análise de experimentos usando diferentes razões efetoras: alvo, exibindo a porcentagem de hemácias vivas após o cocultivo. (D) Representação gráfica da percentagem de lise eritrocitária calculada com base na fórmula descrita na secção 10. A comparação de significância entre os grupos (CD8 citotóxico ou CD8 virgen) foi avaliada por ANOVA two-way com comparações múltiplas. P < 0,0001 (****). Clique aqui para ver uma versão maior desta figura.
Discussão
Aqui descrevemos um ensaio in vitro para medir a morte de hemácias infectadas por Plasmodium por linfócitos citotóxicos. Este ensaio pode ajudar a elucidar os mecanismos da imunidade protetora celular ao estágio eritrocítico do parasita da malária. A principal vantagem desta metodologia é que ela fornece um ensaio quantitativo da morte mediada por células de iRBCs que pode ser usado para abordar muitas questões sobre como as células imunes interagem com diferentes Plasmodium spp.
É importante ressaltar que esse método pode ser utilizado para estudar o P. vivax e outros parasitas do Plasmodium que não são mantidos em cultura in vitro 14,15. Além disso, esse protocolo pode ser adaptado a qualquer espécie de Plasmodium e diferentes hospedeiros, como humanos, camundongos e primatas não humanos. Métodos baseados em citometria de fluxo são amplamente utilizados para avaliar a ativação citotóxica celular, produção de citocinas e degranulação10,11,16, mas o método atual é o único que explora a lise de hemácias por contato direto de células assassinas.
Existem também muitos métodos, como microscopia, reação em cadeia da polimerase (PCR) e citometria de fluxo, que são usados para estudar a malária medindo parasitemia, invasão e atividade antimalárica. No entanto, para analisar a citotoxicidade mediada por células de hemácias, os métodos atuais que usam Cr51 ou liberação de hemoglobina não são sensíveis o suficiente para avaliar a lise de hemácias. A liberação de LDH também pode ser usada para avaliar a morte de eritrócitos por algumas CTLs como células T CD8+ , mas medir LDH não é um método preciso, pois células inatas ativadas ou inatas podem matar umas às outras como um mecanismo regulatório.
A EFCF é amplamente utilizada para rastrear células ou explorar a proliferação celular em citometria de fluxo ou microscopia fluorescente17. Como as hemácias não proliferam18, a intensidade da fluorescência da CFSE deve diminuir com a lise celular. A citometria de fluxo é uma técnica muito acurada, pois pode detectar níveis muito baixos de marcadores específicos, e por isso tem sido amplamente utilizada para rastrear parasitemia e invasão na infecção por malária 19,20,21,22,23. Mais importante, a citometria de fluxo pode medir muitos parâmetros em uma única célula e classificar as células em diferentes populações. Adicionando-se reagentes quantitativos padronizados (contagem de contas) a cada amostra, pode-se normalizar o número de eventos adquiridos e obter contagens absolutas de células24. Este método permite uma comparação quantitativa confiável entre as condições experimentais, o que é crítico para o protocolo atualmente proposto.
Algumas etapas críticas para esse protocolo incluem garantir a qualidade da amostra, garantir a coloração celular adequada e incluir controles para normalizar os cálculos. Uma grande quantidade de amostras de sangue fresco é necessária para purificar as hemácias infectadas. A purificação do meio de separação por gradiente de densidade deve ser abordada com cuidado, pois sua concentração é crítica para a obtenção das hemácias desejadas para Plasmodium. A sobreposição de sangue no meio de separação do gradiente de densidade também deve ser feita o mais lentamente possível, e a coleta da camada vermelha do anel deve ser feita com cuidado para evitar a perda de hemácias. Para facilitar o processo de purificação, uma amostra de sangue de alta parasitemia deve ser usada, pois a quantidade de hemácias será maior. Deve-se notar que, no protocolo de isolamento de hemácias usando campos magnéticos, apenas os estágios maduros do parasita (trofozoítos ou esquizontos em estágio médio-tardio) que produzem quantidades significativas de hemozoína serão purificados. Como resultado, qualquer estágio do anel não será coletado, e isso pode afetar o resultado final.
A coloração celular deve ser realizada com cuidado para evitar perda ou lise das células. O armazenamento ou fixação prolongados devem ser evitados antes da coloração. É importante notar que as condições experimentais devem ser realizadas em triplicata usando relações efetor seriado:alvo e controles apropriados, como uma condição de lise espontânea não marcada e um controle de hipótese. A adição de esferas de contagem celular é crucial, pois fornece uma maneira fácil de determinar a concentração de células ou contagens absolutas de células para cada amostra. Durante a aquisição do citômetro de fluxo, certifique-se de definir o número de eventos a serem coletados na porta de contagem de contas para normalizar o número de células em cada amostra após o cocultivo.
Uma vez que pelo menos 1 x 105 células efetoras são necessárias para resultados consistentes em um ensaio de cocultura, uma possível limitação da metodologia descrita é o número limitado de células após a purificação, o que pode ser uma preocupação especialmente quando se trabalha com populações celulares raras. De fato, isso se aplica à purificação de iRBC, pois requer uma parasitemia muito alta que não é tão facilmente obtida, especialmente quando se trabalha com amostras humanas em áreas endêmicas.
Uma melhoria do protocolo pode ser o tempo de incubação da cocultura. Embora tenhamos utilizado previamente um tempo de incubação de 12 h10,11, recentemente observamos que 4 h é suficiente para diferenciar as condições experimentais, reduzindo o tempo para potencial lise espontânea e melhorando a reprodutibilidade dos resultados.
Os mecanismos envolvidos na morte direta de hemácias infectadas por Plasmodium estão sendo gradualmente descobertos. Nosso grupo foi o primeiro a mostrar que células T CD8+ podem reconhecer e matar reticulócitos infectados por P.vivax via apresentação HLA-I pela célula infectada11. Recentemente, outro estudo demonstrou que as células T γδ reconhecem hemácias infectadas por P. falciparum através do reconhecimento de fosfoantígenos pela butirofilina, molécula presente na superfície das hemácias10. Em ambos os estudos, a lise eritrocitária é dependente de granulisina e granzima B e leva à morte de parasitas intracelulares.
Embora muitos métodos tenham sido desenvolvidos ao longo dos anos para medir parasitemia, invasão, atividade antimalárica e interação celular por imagem, nenhum foi capaz de analisar a morte direta de hemácias por células citotóxicas em um ensaio quantitativo baseado em citometria de fluxo 19,20,21. Utilizamos uma abordagem inovadora para avaliar a capacidade de lise celular na malária por marcação CFSE de hemácias infectadas por Plasmodium e avaliação da lise de iRBC em um período específico de cocultura com linfócitos. Portanto, este ensaio de morte in vitro apresenta uma nova estratégia para esclarecer os mecanismos da imunidade mediada por células à malária em estágio sanguíneo, o que ajudará a avançar o estudo de novos alvos terapêuticos e o desenvolvimento de vacinas contra a malária.
Divulgações
Os autores declaram não haver interesses concorrentes.
Agradecimentos
Agradecemos ao Dr. Dhelio Pereira e aos membros do Centro de Pesquisa em Medicina Tropical de Rondônia (CEPEM) pelo cadastramento e coleta de sangue dos pacientes com malária e à Felicia Ho pelo auxílio na revisão do manuscrito. O seguinte reagente foi obtido através da BEI Resources, NIAID, NIH: Plasmodium yoelii subsp . Esta pesquisa foi financiada pelo Fundo Lemann de Amparo à Pesquisa do Brasil, Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) - 437851/2018-4, bolsas (CJ, GC, CG) e Fundação de Amparo do Estado de Minas Gerais (FAPEMIG) - APQ-00653-16, APQ-02962-18; Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) - fellowship (LL).
Materiais
| Name | Company | Catalog Number | Comments |
| 100 μM cell strainer | Corning | 431752 | |
| 96 Well Round (U) Bottom Plate | Thermo Scientific | 12-565-65 | |
| Anti-human CD235a (Glycophorin A) Antibody | Biolegend | 349114 | Used - APC anti-human CD235, dilution 1:100 |
| Anti-human CD3 Antibody | Biolegend | 317314 | Used - PB anti-human CD3, dilution 1:200 |
| Anti-human CD8 Antibody | Biolegend | 344714 | Used - APC/Cy7 anti-human CD8, dilution 1:200 |
| Anti-human TCR Vδ2 Antibody | Biolegend | 331408 | Used - PE anti-human TCR Vδ2, dilution 1:200 |
| Anti-mouse CD8a Antibody | Biolegend | 100733 | Used- PerCP/Cyanine5.5 anti-mouse CD8a, dilution 1:200 |
| Anti-mouse TER-119/Erythroid Cells Antibody | Biolegend | 116223 | Used - APC/Cyanine7 anti-mouse TER-119, dilution 1:200 |
| CellTrace CFSE Cell Proliferation Kit | Invitrogen | C34554 | |
| Fetal Bovine Serum, qualified | Gibco | 26140079 | |
| Ficoll-Paque Plus | Cytiva | 17144003 | Lymphocyte Separation Medium (LSM) |
| Heparin Sodium Injection, USP | meithel pharma | 71228-400-003 | Used - 2000 USP units/2mL |
| Isoflurane | Piramal critical care | 66794-0013-25 | |
| LS MACS Column | Miltenyi Biotec | 130-042-401 | |
| LSRFortessa Cell Analyzer | BD Bioscience | ||
| Percoll | Cytiva | 17089101 | Density Gradient Separation Medium (DGSM) |
| QuadroMACS Separator | Miltenyi Biotec | 130-090-976 | |
| RPMI 1640 Medium | Gibco | 11875093 | |
| Sodium bicarbonate, powder, BioReagent | Sigma-Aldrich | S5761 | |
| Syringe With Sub-Q needle - 1mL, 26 gauge; | BD | 14-829-10F | |
| Vacutainer Heparin Tube Glass Green 10 ml | BD | 366480 |
Referências
- WHO. Global Technical Strategy for Malaria 2016-2030, 2021 Update. World Health Organization. , (2021).
- Hafalla, J. C., Silvie, O., Matuschewski, K. Cell biology and immunology of malaria. Immunological Reviews. 240 (1), 297-316 (2011).
- Belnoue, E., et al. Vaccination with live Plasmodium yoelii blood stage parasites under chloroquine cover induces cross-stage immunity against malaria liver stage. Journal of Immunology. 181 (12), 8552-8558 (2008).
- Leong, Y. W., Lee, E. Q. H., Rénia, L., Malleret, B. Rodent malaria erythrocyte preference assessment by an ex vivo tropism assay. Frontiers in Cellular and Infection Microbiology. 11, 680136 (2021).
- Ladeia-Andrade, S., Ferreira, M. U., De Carvalho, M. E., Curado, I., Coura, J. R. Age-dependent acquisition of protective immunity to malaria in riverine populations of the amazon basin of Brazil. The American Journal of Tropical Medicine and Hygiene. 80 (3), 452-459 (2009).
- Antonelli, L. R., et al. The immunology of Plasmodium vivax malaria. Immunological Reviews. 293 (1), 163-189 (2020).
- Kazmin, D., et al. Systems analysis of protective immune responses to RTS, S malaria vaccination in humans. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2425-2430 (2017).
- Epstein, J. E., et al. Live attenuated malaria vaccine designed to protect through hepatic CD8+ T cell immunity. Science. 334 (6055), 475-480 (2011).
- Draper, S. J., et al. Malaria vaccines: recent advances and new horizons. Cell Host & Microbe. 24 (1), 43-56 (2018).
- Junqueira, C., et al. γδ T cells suppress Plasmodium falciparum blood-stage infection by direct killing and phagocytosis. Nature Immunology. 22 (3), 347-357 (2021).
- Junqueira, C., et al. Cytotoxic CD8+ T cells recognize and kill Plasmodium vivax-infected reticulocytes. Nature Medicine. 24 (9), 1330-1336 (2018).
- Arora, G., et al. NK cells inhibit Plasmodium falciparum growth in red blood cells via antibody-dependent cellular cytotoxicity. eLife. 7, 36806 (2018).
- Paul, F., Roath, S., Melville, D., Warhurst, D. C., Osisanya, J. O. S. Separation of malaria-infected erythrocytes from whole blood: use of a selective high-gradient magnetic separation technique. Lancet. 2 (8237), 70-71 (1981).
- Shaw-Saliba, K., et al. Insights into an optimization of Plasmodium vivax Sal-1 in vitro culture: the aotus primate model. PLOS Neglected Tropical Diseases. 10 (7), 0004870 (2016).
- Mehlotra, R. K., et al. Long-term in vitro culture of Plasmodium vivax isolates from Madagascar maintained in Saimiri boliviensis blood. Malaria Journal. 16 (1), 442 (2017).
- Hojo-Souza, N. S., et al. Contributions of IFN-γ and granulysin to the clearance of Plasmodium yoelii blood stage. PLOS Pathogens. 16 (9), 1008840 (2020).
- Parish, C. R., Glidden, M. H., Quah, B. J. C., Warren, H. S. Use of the intracellular fluorescent dye CFSE to monitor lymphocyte migration and proliferation. Current Protocols in Immunology. 84 (1), 4-9 (2009).
- Migliaccio, A. R. Erythroblast enucleation. Haematologica. 95 (12), 1985 (2010).
- Grimberg, B. T., Erickson, J. J., Sramkoski, R. M., Jacobberger, J. W., Zimmerman, P. A. Monitoring Plasmodium falciparum growth and development by UV flow cytometry using an optimized Hoechst-thiazole orange staining strategy. Cytometry Part A:The Journal of the International Society for Analytical Cytology. 73 (6), 546-554 (2008).
- Pattanapanyasat, K., et al. Culture of malaria parasites in two different red blood cell populations using biotin and flow cytometry. Cytometry:The Journal of the International Society for Analytical Cytology. 25 (3), 287-294 (1996).
- Bianco, A. E., Battye, F. L., Brown, G. V. Plasmodium falciparum: rapid quantification of parasitemia in fixed malaria cultures by flow cytometry. Experimental Parasitology. 62 (2), 275-282 (1986).
- Jacobberger, J. W., Horan, P. K., Hare, J. D. Analysis of malaria parasite-infected blood by flow cytometry. Cytometry:The Journal of the International Society for Analytical Cytology. 4 (3), 228-237 (1983).
- Bei, A. K., et al. A flow cytometry-based assay for measuring invasion of red blood cells by Plasmodium falciparum. American Journal of Hematology. 85 (4), 234 (2010).
- Montes, M., Jaensson, E. A., Orozco, A. F., Lewis, D. E., Corry, D. B. A general method for bead-enhanced quantitation by flow cytometry. Journal of Immunological Methods. 317 (1-2), 45-55 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados