Method Article
במבחנה בדיקה של הרג תאי דם אדומים נגועים בפלסמודיום על ידי לימפוציטים ציטוטוקסיים
In This Article
Summary
כאן אנו מתארים שיטה חדשה כדי לעזור להבהיר את מנגנוני החסינות התאית פלסמודיום בשלב הדם של זיהום. זוהי בדיקת מבחנה המודדת הרג תאי דם אדומים נגועים על ידי לימפוציטים ציטוטוקסיים.
Abstract
מלריה היא דאגה מרכזית לבריאות הציבור, ומציגה יותר מ -200 מיליון מקרים בשנה ברחבי העולם. למרות שנים של מאמצים מדעיים, חסינות מגינה למלריה עדיין אינה מובנת, בעיקר בשל מגבלות מתודולוגיות של תרבית פלסמודיום ארוכת טווח, במיוחד עבור פלסמודיום vivax. רוב המחקרים התמקדו בהגנה על מערכת החיסון הנרכשת מפני מלריה על ידי נוגדנים, הממלאים תפקיד מפתח בשליטה במלריה. עם זאת, ההגנה הסטרילית המושרה על ידי חיסונים מוחלשים נגד פלסמודיום ספורוזואיטים קשורה לתגובה תאית, בעיקר ללימפוציטים ציטוטוקסיים מסוג T, כגון CD8+ ותאי T מסוג גמא דלתא (γδ T). לפיכך, יש לפתח מתודולוגיות חדשות כדי להבין טוב יותר את הפונקציות של התגובה החיסונית התאית ובכך לתמוך בטיפול עתידי ופיתוח חיסונים. כדי למצוא אסטרטגיה חדשה לניתוח חסינות תאית זו לזיהום פלסמודיום בשלב הדם, הקבוצה שלנו הקימה בדיקה במבחנה המודדת הרג תאי דם אדומים נגועים (iRBC) על ידי לימפוציטים ציטוטוקסיים. בדיקה זו יכולה לשמש לחקר מנגנוני תגובה חיסונית תאית נגד פלסמודיום spp. שונים בשלב הדם. תאי חיסון ציטוטוקסיים מולדים ונרכשים יכולים לחסל ישירות iRBCs ואת הטפיל התוך-תאי במנגנון effector:target. iRBCs מטרה מסומנים כדי להעריך את כדאיות התא, ומתורבת יחד עם תאי אפקט (CD8+ T, γδ T, תאי NK וכו '). אחוז הליזה מחושב על בסיס התנאים שנבדקו, בהשוואה לבקרת ליזה ספונטנית בבדיקה מבוססת ציטומטריית זרימה. בסופו של דבר, מתודולוגיית בדיקת הרג זו היא התקדמות משמעותית בהבנת חסינות תאית למלריה בשלב הדם, ומסייעת לחשוף מטרות טיפוליות פוטנציאליות חדשות ולהאיץ את הפיתוח של חיסונים נגד מלריה.
Introduction
המלריה נותרה משבר בריאותי עולמי, עם יותר מ -240 מיליון מקרים ו -627,000 מקרי מוות הקשורים למלריה שדווחו בשנת 20201. כיום ישנם חמישה מינים טפיליים שיכולים לגרום למלריה בבני אדם, מתוכם פלסמודיום פלציפרום ופלסמודיום ויווקס הם שני המינים הנפוצים ביותר. במהלך זיהום פלסמודיום, הכבד או השלב הפרה-אריתרוציטי הוא אסימפטומטי, והתסמינים מתרחשים רק במהלך המחזור הא-מיני של הטפיל בשלב האריתרוציטי. בשלב זיהום זה, אלפי מרוזואיטים שמקורם בשלב הכבד משתחררים לזרם הדם ומדביקים תאי דם אדומים (RBC). ב RBC, הטפילים להבדיל trophozoites ו schizonts על ידי schizogony, עד schizonts לקרוע את אריתרוציטים, שחרור merozoites שזה עתה נוצרו, חוזר על מחזור הדם הזה. מחזורים חוזרים ונשנים של פלישה, שכפול ושחרור מרוזואיטים גורמים לגידול אקספוננציאלי באוכלוסיית הטפילים ובסופו של דבר מעוררים תסמיני מחלה2.
אתגר חשוב בחקר התגובה החיסונית למלריה הוא כי פלסמודיום spp. שמדביק בני אדם אינו מדביק מודלים של חיות מעבדה. לפיכך, דגימות חולים נגועים פלסמודיום חייב להיאסף טרי מיד מעובד ומנותח. עם זאת, באזורים אנדמיים למלריה, המשאבים לגישה למנגנונים אימונולוגיים ומולקולריים מוגבלים. בשל מגבלות אלה, מכרסמים נמצאים בשימוש נרחב כמודלים ניסיוניים כדי לחקור את התגובה החיסונית נגד זיהום פלסמודיום. בעוד P. berghei ו- P. chabaudi משמשים לעתים קרובות כפונדקאיות לזיהום P. falciparum, לזן הלא קטלני של P. yoelii 17XNL יש גם תכונות רבות במשותף עם P. vivax, כגון זיהום מוגבל רטיקולוציטים 3,4. הפיתוח של מבחני פלסמודיום במבחנה, שניתן להשתמש בהם עבור דגימות שמקורן במודלים אנושיים או בעלי חיים, הוא בעל ערך בהשגת הבנה טובה יותר של הפתוגנזה של מלריה והשוואת התגובה החיסונית המתעוררת על ידי מינים שונים של הטפיל.
חסינות מגן נגד מלריה אינו מובן לחלוטין לא בשלב טרום אריתרוציטי ולא בשלב הדם. ידוע כי חשיפה לזיהומים חוזרים גורמת לחסינות נרכשת חלקית, אך חסינות סטרילית כמעט ולא מתפתחת5. במשך עשרות שנים, חסינות מגן נגד פלסמודיום היה קשור בעיקר עם אינדוקציה של נוגדנים מנטרלים או opsonizing המונעים פלישת טפילים של תאים מארחים או להוביל phagocytosis על ידי תאים מציגי אנטיגן, בהתאמה6. כתוצאה מכך, רוב המאמצים לייצר חיסונים נגד מלריה עד כה הסתמכו על השראת נוגדנים מגנים וארוכי טווח 7,8. עם זאת, ההגנה הסטרילית המושרה על ידי חיסון עם ספורוזואיט מוחלש מתואמת ישירות עם הפעלה והרחבה של לימפוציטים ציטוטוקסיים מסוג T 8,9.
לאחרונה, כמה מחקרים של דגימות חולים שבודדו לאחרונה ותרביות במבחנה הוכיחו כי תאים חיסוניים ציטוטוקסיים מולדים או אדפטיביים כמו CD8+ T10, γδ T 11 ותאי NK12 יכולים לחסל ישירות RBCs נגועים בפלסמודיום ואת הטפיל התוך-תאי שלו באופן של יחס אפקטור:מטרה. ממצאים ראשוניים אלה הגדירו מנגנון השפעה חיסוני חדש לחלוטין בהקשר של מלריה. כדי לנתח את החסינות החדשה הזו נגד מלריה, חיוני לחקור מנגנוני השפעה ציטוטוקסיים של תאי הרג נגד RBCs נגועים (iRBCs) בזיהום טבעי או חיסון.
כאן אנו מציגים בדיקה חוץ גופית המודדת את הפעילות ציטוטוקסית של לימפוציטים נגד מלריה בשלב הדם. בדיקה זו יכולה לעזור להבהיר את מנגנוני התגובה החיסונית התאית נגד שלב אריתרוציטים פלסמודיום . תאי המטרה, iRBCs, מסומנים ב-carboxyfluorescein succinimidyl ester (CFSE) כדי להעריך את כדאיות התא, ולאחר מכן עוברים תרבית משותפת עם תאים משפיעים כמו לימפוציטים ציטוטוקסיים (CTL). תרבות משותפת זו מוערכת לאחר מכן על ידי ציטומטריית זרימה, תוך שימוש בסמנים פלואורסצנטיים עבור סוגי תאים ספציפיים. לבסוף, אחוז הליזה iRBC על ידי CTL מחושב על ידי חלוקת מצב הניסוי על ידי קרע ספונטני של RBCs ובקרת ליזה ספונטנית, המתרחשת במהלך הדגירה ללא התא המשפיע. בסך הכל, מתודולוגיית בדיקת הרג זו יכולה לתרום להבנה טובה יותר של חסינות מלריה בתיווך תאים.
Protocol
כל ההליכים נערכו בהתאם למדיניות קרן אוסוולדו קרוז והמועצה האתית הלאומית (CAAE: 59902816.7.0000.5091). הפרוטוקולים האנושיים פותחו בשיתוף פעולה עם קבוצת המחקר הקליני ממרכז המחקר לרפואה טרופית של רונדוניה (CEPEM), שהיה אחראי על רישום החולים למחקר. התקבלה הסכמה מדעת מכל החולים.
לצורך המחקר בבעלי חיים, בוצעו הליכים בהתאם לעקרונות ההתנהגות של מדריך הפרקטיקה הברזילאי לטיפול ושימוש בבעלי חיים למטרות מדעיות ודידקטיות של המועצה הלאומית לבקרת ניסויים בבעלי חיים (CONCEA). הפרוטוקולים אושרו על ידי המועצה לניסויים בבעלי חיים של פיוקרוז (פרוטוקול CEUA LW15/20-2).
1. איסוף דגימות דם אנושיות ובידוד PBMC
- לאסוף דם של חולים נגועים פלסמודיום בצינור איסוף דם מפונה 10 מ"ל עם הפרין נתרן. כאשר חולי מלריה מציגים לימפופניה, יש טווח של 5-9 x 106 תאי דם חד-גרעיניים היקפיים (PBMCs) בדגימת דם של 10 מ"ל. מכיוון שתאי T CD8+ או תאי T γδ מהווים ~ 10% מה- PBMCs, עדיף לאסוף 50-100 מ"ל דם / חולה.
הערה: יש לשקול מינימום של 1 x 105 תאים משפיעים / מצב. - חשב את אחוז iRBCs על ידי כתם דם כמתואר להלן.
- הוסף 5 μL של דם הכולל לשקופית ברורה ולהכין כתם דם. בצע כתם מהיר פנאופטי מסוג רומנובסקי או כתם מאי-גונוולד-גימסה. כאן נעשה שימוש בערכת הכתם המהירה הפנאופטית, המורכבת משלושה ריאגנטים: מגיב A (קיבוע), מגיב B (כתם ציטופלזמי) וריאגנט C (כתם דיפרנציאלי גרעיני וציטופלזמי).
- טבלו באיטיות את המגלשה בתמיסה A 10x, לאחר מכן 4x בתמיסה B, ולבסוף 10x בתמיסה C. סננו את כל עודפי הריאגנט מהשקופיות בין התמיסות. לאחר טבילה בתמיסה C, שטפו את המגלשה במי ברז זורמים והניחו לה להתייבש.
- תחת מיקרוסקופ אור זקוף עם יעד טבילה של שמן פי 100, ספרו 1000 RBCs בריבועים רציפים וחשבו את אחוז הטפילים באמצעות המשוואה הבאה:
- לדלל 15 מ"ל של דם ביחס של 1:1 במי מלח סטריליים חוצצים פוספט (PBS).
- הוסף 15 מ"ל של מדיום הפרדת לימפוציטים (צפיפות של 1.077g/mL) לצינור של 50 מ"ל. בזהירות שכבה 30 מ"ל של דגימת דם מדולל על פתרון בינוני צנטריפוגה. בעת שכבות המדגם, אין לתת את דגימת הדם ואת הפרדת הלימפוציטים בינוני להתערבב.
- צנטריפוגה את הצינורות ב 400 x גרם במשך 40 דקות ב 22 ° C, עם תאוצה נמוכה וללא הגדרת הפסקה.
- משוך את השכבה העליונה המכילה פלזמה באמצעות פיפטה סטרילית, ומשאיר את שכבת התא המונוגרעיני ללא הפרעה. מעבירים את שכבת התאים החד-גרעיניים (PBMCs) לצינור סטרילי באמצעות פיפטה סטרילית.
- אין להשליך את הצינורית המכילה את גלולת הדם מכיוון שהיא תשמש מאוחר יותר לבידוד RBC נגוע. משלב זה, הקפד לשמור על RBCs בטמפרטורת החדר (RT). לעולם אל תתנו להם להתקרר.
- שטפו את התאים פעמיים על ידי הוספת PBS וצנטריפוגה במהירות של 350 x גרם למשך 10 דקות, עם הגדרת הפסקה. יש להשהות מחדש את גלולת התא ב-5 מ"ל של מדיום RPMI בתוספת פניצילין/סטרפטומיצין וסרום בקר עוברי 10% (FBS; מדיום מלא).
- ספור את PBMCs בנוכחות תמיסה כחולה טריפאן כדי לבדוק את כדאיות התא, באמצעות hemacytometer (תא נויבאואר) או מונה תאים אוטומטי. אין לספור את התאים המוכתמים בכחול מכיוון שהם מייצגים תאים גוססים, אשר סופגים טריפאן כחול.
- התאם את ריכוז התא ל -107 תאים / מ"ל באמצעות מדיום מלא. לטהר את אוכלוסיות הלימפוציטים ציטוטוקסיים הרצויות (תאי T CD8+ , תאי NK, תאי T γδ) באמצעות בידוד חרוזים מגנטיים בהתאם לפרוטוקול יצרן מגיב.
2. בידוד RBC אנושי
הערה: לבידוד RBC נגוע בבני אדם, מומלץ להתחיל עם דגימות דם שיש בהן מינימום של 2% פרזיטמיה, עדיפות עם יותר בשלב הטפיל טרופוזואיט / סכיזונט מוקדם.
- הכינו את ה-PERCOLL (מכאן ואילך ייקרא מדיום הפרדת שיפוע צפיפות) בריכוז המומלץ כמתואר להלן.
- הוסף 90 מ"ל של מדיום הפרדת שיפוע צפיפות 100% ו- 10 מ"ל של 10x PBS לקבלת מדיום הפרדת שיפוע צפיפות איזוטונית של 90%.
- עבור הפרדת רטיקולוציטים נגועים ב- P. vivax, הכינו מדיית הפרדה הדרגתית בצפיפותשל 45%. הוסף 50 מ"ל של מדיום הפרדת שיפוע צפיפות איזוטונית 90% ו- 50 מ"ל של PBS 1x לקבלת מדיום הפרדת שיפוע צפיפות של 45%.
- עבור הפרדת אריתרוציטים נגועים ב- P. falciparum, הכינו אמצעי הפרדה הדרגתי בצפיפות של 65%. הוסף 72 מ"ל של מדיום הפרדת שיפוע צפיפות איזוטונית 90% ו- 28 מ"ל של PBS 1x לקבלת מדיום הפרדת שיפוע צפיפות של 65%.
- להפרדת רטיקולוציטים לא נגועים, הכינו מדיית הפרדה הדרגתית בצפיפות של 70%. הוסף 78 מ"ל של מדיום הפרדת שיפוע צפיפות איזוטונית 90% ו- 22 מ"ל של PBS 1x לקבלת מדיום הפרדת שיפוע צפיפות של 70%.
- חממו את הפרדת שיפוע הצפיפות בינונית ל -37 מעלות צלזיוס באמבט מים.
- לאחר הסרת שכבת PBMC, יש להסיר בזהירות כמה שיותר מהשכבה העליונה של אמצעי הצנטריפוגה מבלי לגעת בתאים. בעזרת פיפטה פסטר מזכוכית, הסר בזהירות את שכבת הנויטרופילים העליונה מבלי להפריע לגלולת RBC ולהעריך את נפח הכדור. הוסף פי 4 מנפח כדורי RBC של RT להשלים בינוני ולהשהות מחדש.
- בצינור חרוטי שני של 50 מ"ל, הוסף פי 5 מנפח הגלולה של 45%, 65% או 70% צפיפות מדיום ההפרדה ההדרגתית בהתאם לסוג התא כדי לבודד. שכבו בזהירות את מתלה RBC על גבי השכבה הבינונית של הפרדת שיפוע הצפיפות.
- סחרור במשך 15 דקות ב- 850 x g, עם האצה נמוכה וללא הגדרת הפסקה. אספו את השכבה האדומה/חומה העכורה הנמצאת בין מדיום ההפרדה ההדרגתי סופרנאטנט לצפיפות בעזרת פיפטה בנפח 5 מ"ל. מעבירים לצינור סטרילי של 15 מ"ל.
- שטף את התאים על-ידי הוספת RT שלם בינוני עד 15 מ"ל וסחרור כלפי מטה במשך 10 דקות במהירות 860 x גרם. חזור על הכביסה על ידי הוספת 10 מ"ל של RT בינוני מלא וסחרור כלפי מטה. יש להשליך את הסופרנאטנט ולהכין כתם דם מהגלולה כדי לבדוק העשרת iRBC, לאחר שלב 1.2.
- להשעות מחדש את הגלולה ב 1 מ"ל של RT להשלים בינוני ולתת לשבת בטמפרטורת החדר תוך ספירת התאים. הוסף 10 μL של תרחיף תאים בהמוציטומטר (תא נויבאואר) וספור את RBCs באזור המרכזי מחולק ל -25 ריבועים בינוניים. התאם את ריכוז התאים ל- 1 x 107 iRBCs/mL במדיה מלאה RT.
3. זיהום מלריה ניסיוני בעכבר
- הפשירו אליציטוט של P. yoelii 17XNL:PyGFP (MRA-817), זן המבטא GFP המתקבל מ-MR4/ATCC, והזריקו 100 μL תוך צפקי (כלומר) בנקבת עכבר C57BL/6 בת 8 שבועות.
- עקוב אחר נטל הטפילים כל 3 ימים על ידי איסוף דם בווריד הזנב.
- לנקב את הכלי עם משופע המחט כלפי מעלה, נכנס הווריד בזווית רדודה החל בקצה הדיסטלי של הזנב.
- לאסוף את דגימת הדם עם פיפטה או צינור נימי עד 5 או 10 מ"ל, ולאחר מכן להפעיל לחץ ידני כדי לעצור את הדימום.
- הכינו כתם דם (כמתואר בשלב 1.2) עד שהפרזיטמיה תגיע ל-10%-15% מה-RBCs הנגועים.
- לאסוף 10 μL של דם על ידי נתיב ורידים זנב לדלל ל 100 μL של PBS כדי i.p. להזריק לתוך העכבר התורם השני.
הערה: טפילים שמורים בהקפאה צריכים להיות מופשרים ומועברים בעכברים פעמיים לפני השימוש בהם לזיהומים ניסיוניים. - כאשר המעבר השני מגיע ל -15% של טפילים, לאסוף חמש טיפות דם בשיטת גזיזת הזנב לדלל ב 1 מ"ל של PBS. הכינו תמיסת זיהום על ידי התאמת הריכוז ל-1 x 106 iRBCs/mL ב-PBS סטרילי והזריקו i.p. 100 μL (1 x 105 iRBCs) של התמיסה לכל עכבר הדרוש לניסוי.
- עקוב אחר פרזיטמיה כל 2-3 ימים עד שהוא מגיע ~ 30% iRBCs, אשר מתרחשת כ 12 ימים לאחר ההדבקה. כאשר העכברים מגיעים לטפיל הרצוי, לאסוף דם על ידי ניקוב לב כמתואר להלן.
- לשאוף 100 μL של תמיסת הפרין (30 U / mL) לתוך מזרק 1 מ"ל עם מחט 26 גרם.
- להרדים את העכבר על ידי שאיפה עם 5% isoflurane ולאשר את היעדר רפלקסים. הניחו את העכבר על צדו והכניסו בניצב את המחט ממש מתחת למרפק, דרך הצלעות ולתוך הלב. משוך את בוכנה מזרק לאט לסובב את המחט עד 0.5-1 מ"ל של דם מתקבל.
- לבצע המתת חסד אנושית על ידי נקע צוואר הרחם תחת הרדמה. נקה את הצד השמאלי של העכבר עם 70% אתנול. עם מספריים כירורגיים, לעשות חתך בצד שמאל של העכבר עובר דרך העור ואת הצפק. אתר את הטחול והסר אותו.
- הניחו את טחול העכבר בצלחת פטרי עם 5 מ"ל של תווך מלא כדי לטהר את אוכלוסיית תאי ההשפעה הרצויה (למשל, תאי T CD8+ ).
4. השגת טחול עכבר שלם טרי
- בצלחת פטרי, בזהירות לחתוך את הטחול לחתיכות קטנות באמצעות מספריים או סכין גילוח.
- מניחים מסננת תאים בגודל 100 מיקרומטר מעל צינור חרוטי בנפח 50 מ"ל ומעבירים את הטחול שנכרת למסננת התא בעזרת פיפטה. מועכים את הטחול דרך המסננת עם בוכנה מזרק.
- לשטוף את התאים דרך מסננת עם 10 מ"ל של מדיה מלאה. צנטריפוגה את התאים ב 300 x גרם במשך 10 דקות ב 4 ° C, ולאחר מכן להשליך את supernatant.
- להשעות מחדש את גלולת התא ב 2 מ"ל של קר 1x RBC lysis buffer. דוגרים על המתלים במשך 5 דקות על קרח.
- לשטוף את השעיית התא עם 10 מ"ל של 4 ° C מדיה מלאה. חזור על שלב השטיפה שלוש פעמים והסר קרישי תאים בין שטיפות לטחול מעכברים נגועים בפלסמודיום.
- צנטריפוגה את התאים ב 400 x גרם במשך 5 דקות ב 4 ° C, ולאחר מכן להשליך את supernatant.
הערה: טחול נגוע פלסמודיום מוגדל ומלא תאים phagocytic המכילים המוגלובין מפורק המוזואין. - כדי למנוע בעיות במהלך בידוד החרוזים המגנטי של תאי האפקטורים, השתמש בשלבים הבאים כדי להסיר תאים פגוציטיים מועשרים בהמוזואין והמוזואין. השהה מחדש את התאים הטפלניים עם מאגר MACS והתאם את הריכוז ל- 1 x 108 תאים / מ"ל. מקם עמודת LS או LD בשדה המגנטי. הכן את העמוד על ידי שטיפה עם 3 מ"ל של מאגר MACS.
- החל את השעיית התא על העמודה. שטוף את העמודה שלוש פעמים עם 3 מ"ל של מאגר MACS. לאסוף זרימה דרך המכיל את התאים splenic.
- ספרו את הטחול בתמיסה כחולה טריפאן ובדקו את כדאיות התא בהמציטומטר (תא נויבאואר) או מונה תאים אוטומטי. התאם את ריכוז התאים ל- 1 x 107 תאים/מ"ל במדיה מלאה RT.
5. טיהור תאי אפקט ציטוטוקסי (בחירה שלילית של תאי CD8a + T)
הערה: ישנם ריאגנטים רבים של ברירה חיובית ושלילית שיכולים לטהר תאי השפעה ציטוטוקסיים (CD8+ T, γδ T, NK, iNKT, תאי MIT). בפרוטוקול זה, אנו משתמשים במבחר שלילי של תאי CD8a + T ספלניים ועוקבים אחר הוראות היצרן.
- צנטריפוגה את כל הטחול ב 400 x גרם במשך 10 דקות ב 4 ° C ולהשליך את supernatant. להשעות מחדש את גלולת התא ב 40 μL של מאגר MACS.
- מוסיפים 10 μL של קוקטייל נוגדנים ביוטין. מערבבים היטב ודגרים במשך 5 דקות על קרח.
- הוסף 30 μL של מאגר MACS. הוסף 20 μL של מיקרו-חרוזים אנטי-ביוטין. מערבבים היטב ודגרים במשך 10 דקות על קרח.
- הוסף 400 μL של מאגר MACS והמשך להפרדת תאים מגנטית. מקם את עמודת MACS LS בתמיכה בשדה המגנטי. הכן את העמוד על ידי שטיפה עם 3 מ"ל של מאגר MACS.
- החל את השעיית התא על העמודה. שטוף את העמודה שלוש פעמים עם 3 מ"ל של מאגר MACS. אסוף את הזרימה המכילה את כל התאים ללא תווית, שהם תאי CD8a + T מועשרים.
- ספור את תאי CD8a+ T בתמיסה כחולה טריפאן ובדוק את כדאיות התא בהמציטומטר (תא נויבאואר) או מונה תאים אוטומטי. התאם את ריכוז התא ל- 1 x 107 תאים/מ"ל במדיה מלאה RT.
6. P. yoelii נגוע בידוד RBC
- צנטריפוגה את הדם שנאסף בצינור 1.5 מ"ל ב 850 x גרם במשך 3 דקות. להשליך את הסרום ולהשעות מחדש את הדם ב 1 מ"ל של 1x RPMI ללא FBS.
- מקם את עמוד ה-LS בתמיכת השדה המגנטי ושטוף ב-3 מ"ל של 1x סל"ד. העבר את מתלה RBC דרך הטור. כדי לבודד יותר iRBCs, להחיל מחדש את זרימת (3 מ"ל של RPMI ו 1 מ"ל של דם מדולל) לתוך העמודה.
- יש לשטוף פעמיים עם 5 מ"ל של 1x סל"ד. בצע שלבי שטיפה על ידי הוספת aliquots חיץ ברגע מאגר עמודה ריק. אל תתנו לעמודים להתייבש.
- הוסף 5 מ"ל של סל"ד, הסר את העמודה, ולטהר את iRBCs לתוך צינור חדש 15 מ"ל. ספרו את ה-iRBCs וכווננו את הריכוז ל-1 x 107 RBCs/mL.
7. תיוג CFSE של RBCs והכנה לציטומטריית זרימה
הערה: התחל את פרוטוקול התיוג של RBC עם מספר כפול של תאים שישמשו לניסוי, מכיוון ש~50% מהתאים בדרך כלל הולכים לאיבוד בשלבי הכביסה שלאחר שלב התיוג CFSE. כדי לקבוע את האוטופלואורסצנטיות של RBCs/iRBCs, כלול דגימת בקרה של תאים ללא תווית.
- לדלל CFSE לריכוז סופי של 10 mM בסל"ד 1x ללא FBS. לשטוף את התאים פעם אחת עם 1x RPMI ללא FBS בצינור 15 מ"ל.
- להשעות מחדש את RBCs ב 500 μL של 1x RPMI ללא FBS ולהוסיף 500 μL של CFSE מדולל. יש לדגור במשך 8 דקות ב-RT, מוגן מאור.
- שטפו שלוש פעמים על ידי הוספת 14 מ"ל של מדיום מלא (10% FBS RPMI), ולאחר מכן צנטריפוגה ב 850 x גרם במשך 10 דקות. להשעות את התאים בתווך מלא לריכוז של 1-5 x 106/ מ"ל. דגירה במשך שעה אחת ב- RT.
8. לימפוציטים ציטוטוקסיים / RBC coculture והכנה לציטומטריית זרימה
הערה: אם תימדד מעורבותם של קולטנים או מולקולות ספציפיים, דגרו על נוגדני החסימה והאיזוטיפ הספציפיים (10 מ"ג/מ"ל) עם תאי ההשפעה במשך 30 דקות לפני התרבות המשותפת.
- לוחים את התאים בצלחת בעלת תחתית עגולה של 96 בארות. הוסף את הלימפוציטים המטוהרים ואת iRBCs המסומנים ב- CFSE ביחס הרצוי לתאי אפקטור-יעד לנפח סופי של 200 μL והומוגניזה. הכינו כל תנאי בשלשה.
הערה: אנו מציעים להתאים את ריכוז iRBC ל- 1-5 x 104 תאים/מ"ל ולבחור את היחס בהתבסס על מספר התא המטוהר (לדוגמה, 0.5:1, 2.5:1 ו- 5:1). - כלול את בקרת הליזה הספונטנית, שהיא iRBCs המטרה ללא המשפיע, כדי להעריך כל ליזה ספונטנית, שכן זה ישמש כדי לייצג מצב של 100% כדאיות התא.
- סובב את הצלחת למשך דקה אחת במהירות של 360 x גרם כדי למקסם את המגע עם התא. יש לדגור בטמפרטורה של 37°C ו-5%CO2 למשך 4 שעות.
הערה: אין להשתמש בתנאי היפוקסיה (O2 נמוך), המשמשים באופן שיטתי לתרבית P. falciparum , מכיוון שתאי ההשפעה אינם שורדים בסביבה זו. לעומת זאת, טפילי פלסמודיום הם קיימא באוויר הסביבה ב 5% CO2 עד 12 שעות. - סובבים במשך 5 דקות ב 850 x גרם ולהפוך את הצלחת כדי להסיר את supernatant.
הערה: אם רוצים, ניתן להשתמש בסופרנאטנט כדי למדוד את כל הגורמים המסיסים המשתחררים בתרבות המשותפת. - תייג את RBCs עם נוגדנים נגד עכבר Ter119 1:200 (או CD235 1:100 נגד עכבר עבור דגימות אנושיות) ותאי CD8+ T עם נוגדנים נגד CD8 1:200 או נגד CD3 1:200 (נגד עכבר או אדם) למשך 30 דקות ב 4 ° C ב 1x PBS המכיל 3% FBS (מאגר FACS).
הערה: יש לבחור את פלואורופור הנוגדנים בהתבסס על מגיב נותב התא / מגיב התפשטות התאים (לדוגמה, iRBC עם תווית CFSE, APC-Cy7 anti-Ter119 ו- PerCP-Cy5.5 anti-CD8a). - שטפו את התאים עם מאגר FACS וסובבו כלפי מטה במשך 5 דקות במהירות של 850 x גרם. העבירו את הדגימות לצינורות FACS והוסיפו 30 μL של חרוזי ספירה לצינורות בודדים . הומוגניזציה של חרוזי הספירה על ידי מערבולות במשך 30 שניות.
9. ציטומטריית זרימה
- נתח דגימות באמצעות מכשיר לייזר 405/488/561/640.
- עבור תאים אנושיים המסומנים עם CFSE (FITC), PE anti-human γδ TCR ונוגדן PE-Cy7 anti-human CD235a, יש להשתמש במסננים 530/30 (FITC), 575/25 (PE) ו-780/60 (PE-Cy7) בציטומטר בתצורת שלושה לייזרים (כחול, אדום, צהוב-ירוק).
- עבור תאי עכבר המסומנים במסנני CFSE (FITC), PerCP-Cy5.5 נגד עכבר CD8a ו-APC-Cy7 נגד עכבר Ter119, השתמש במסננים 530/30 (FITC), 695/40 (PerCP-Cy5.5) ו- 780/60 (APC-Cy7) במערך הציטומטר של שלוש לייזר.
- בחר את אוכלוסיית ספירת החרוזים כשער העצירה כדי להשיג מינימום של 20,000 אירועים בשער העצירה, אשר צריך להיות זהה לכל התנאים. ביצוע ניתוח ופיצוי באמצעות תוכנה מתאימה לרכישה/ניתוח של ציטומטריית זרימה.
- הגדר את אסטרטגיית ה- gating כמתואר להלן.
- בחר תאים בודדים (סינגלטים), למעט פסולת באמצעות יחס גובה שיא FSC (H) לשטח (A). בחר RBCs ולא לכלול את הלימפוציטים מניתוח המבוסס על פלואורסצנטיות של סמן RBC (Ter119 או CD235a) ואת הנוגדן הספציפי ללימפוציטים (CD8a).
- ב- RBC הקודם, בחר RBCs קיימא בהתבסס על צביעה חיובית של CFSE. נתח את הנתונים באמצעות תוכנה לניתוח נתוני ציטומטר זרימה.
10. חישוב וסטטיסטיקה
- כדי לחשב את אחוז הליזה iRBC, בצע את אסטרטגיית gating המתוארת בשלב 9. אחוז RBCs קיימא הוא התדירות של תאים חיוביים CFSE בתוך שער RBC מבוסס על Ter119 (עכבר) או CD235a (אדם) פלואורסצנטיות חיובית.
- השתמש בבקרת ליזה ספונטנית, RBCs ללא תאים משפיעים, מצב כבקרה כדי להעריך קרע ספונטני RBC. מצב זה ייחשב RBC lysis (100% כדאיות). השתמש בנוסחה הבאה כדי לחשב את אחוז הליזה של RBC בכל מצב שנבדק:
הערה: במהלך הדגירה בתרבית, חלק מה-RBCs הנגועים עשויים לשכב או להיקרע באופן ספונטני על ידי הטפיל. השתמש בתדירות RBC חיובית ל- CFSE של מצב הליזה הספונטנית, שאינה מכילה תאים משפיעים, כבסיס לציטוטוקסיות לימפוציטים. - חשב את הממוצע של טריפליקטים עבור כל תנאי וקבע מובהקות סטטיסטית באמצעות ANOVA דו-כיווני בהשוואות מרובות.
תוצאות
כאן מתוארת המתודולוגיה היישומית לבידוד RBCs נגועים בפלסמודיום עם CFSE בבדיקת תרבות משותפת עם לימפוציטים ציטוטוקסיים. ראשית, אנו מספקים ייצוג סכמטי של אופן ביצוע הפרוטוקול, תוך שימוש בדגימות אנושיות שנדבקו ב-P. vivax (איור 1). לאחר מכן, תרשים זרימה מאויר כיצד להמשיך עם הפרוטוקול במודל ניסויי של מלריה באמצעות עכבר C57BL/6 שנדבק ב-P. yoelii (איור 2). באיור 3 מוצגות התוצאות הצפויות (לפני ואחרי) עבור שלב 6 של הפרוטוקול (העשרה של RBCs נגועים ב-P. yoelii באמצעות עמודות מגנטיות). לבסוף, איור 4 מציג ניתוח ציטומטריית זרימה מייצגת, המפרט את אסטרטגיית ה-gating הדרושה להערכת אחוז הליזה של RBC, כפי שמתואר בשלב 9. לכן, חלק זה מדגיש את הטכניקות השונות המשמשות כאן, ומתאר את כל התהליך של רכישה, הרכבה וניתוח נתונים כדי להעריך הרג iRBC על ידי לימפוציטים ציטוטוקסיים.
ליזה של RBCs נגועים בפלסמודיום אנושי על ידי תאים ציטוטוקסיים
ייצוג סכמטי של הפרוטוקול להערכת הרג RBCs נגועים בפלסמודיום על-ידי תאים ציטוטוקסיים מוצג באיור 1. כדי למדוד ליזה של תאים, PBMC מחולים נגועים בפלסמודיום טוהר באמצעות מדיום ההפרדה, ואחריו טיהור מגנטי של אוכלוסיית הלימפוציטים ציטוטוקסיים (CTL) המעניינת (למשל, CD8+ T, γδ T, NK, iNKT, תאי MAIT וכו '). כדוריות ה-RBC שנותרו מבידוד PBMC שימשו להעשרת RBCs נגועים בפלסמודיום באמצעות מדיום הפרדת שיפוע צפיפות (65% P. falciparum; 45% P. vivax). iRBCs סומנו עם CFSE והודגרו עם או בלי לימפוציטים במשך 4 שעות ב 37 ° C, 5% CO2. לאחר תקופת התרבות המשותפת, כל RBCs (נגועים או לא) תויגו עם נוגדן CD235a אנטי אנושי (עבור RBCs) ונוגדנים ספציפיים CTL (למשל, נגד CD8, anti- γδTCR, וכו ') לפני ניתוח ציטומטריה זרימה. הרכישה והניתוח של דגימות אנושיות היו דומים לאלה שהודגמו עבור דגימות עכברים באיור 4.
P. yoelii-נגוע RBC ליזה על ידי תאי T ציטוטוקסיים CD8+
תרשים זרימה של ההליך הניסויי להערכת מנגנון האפקט ציטוטוקסי במודל המלריה הניסיוני מוצג באיור 2, יחד עם נתונים ניסיוניים מייצגים שמוצגים באיור 3 ובאיור 4. עכברי C57BL/6 נדבקו ב-iRBCs 1 x 105P. yoelii (Py), והפרזיטמיה נוטרה עד שהגיעה לכ-30%. Py-iRBCs בודדו מהדם באמצעות הפרדה מגנטית, שכן תת-תוצר הטפיל הם, המוזואין, מועשר בברזל ומתפקד כחלקיקים פאראמגנטיים בשדה מגנטי13. טוהר הדגימה המועשרת נותח על-ידי כתם דם בהשוואה לדגימה שלפני העמודה (איור 3). iRBCs סומנו לאחר מכן עם מגיב נותב התא CFSE. במקביל, תאי T ציטוטוקסיים CD8+ טוהרו מטחול באמצעות ערכת ברירה מגנטית שלילית. כבקרה, אותו פרוטוקול שימש לטיהור תאי CD8+ T מעכברים לא נגועים. תאי אפקטור (CD8+ T) ויעד (Py-iRBC המסומן ב-CFSE) הודגרו ביחסי אפקטור:מטרה שונים (E:T: 0.5:1, 2.5:1 ו-5:1) במשך 4 שעות ב-37°C 5% CO2. בסוף הקוקולטורציה, כל מצב סומן עם נוגדנים נגד עכבר Ter119 עבור RBCs ואנטי CD8a עבור תאים ציטוטוקסיים. אסטרטגיית ה-gating ותוצאות המדגם מיוצגות באיור 4.
איור 1. סכמטי של מבחן ההרג במבחנה. דוגמה לניסוי מבחן הריגה. דם נגוע פלסמודיום נאסף ומעובד באמצעות מדיום שיפוע הפרדה. לאחר הצנטריפוגה נאספת שכבת PBMC, ותאים ציטוטוקסיים (CTLs) טוהרו באמצעות חרוזים מגנטיים. שכבת RBC מעובדת שוב באמצעות מדיית הפרדות הדרגתיות של צפיפות. לאחר צנטריפוגה, שכבת פלסמודיום-iRBC נאספת ומסומנת עם CFSE. לאחר מכן, CTL ו- iRBCs מטוהרים עברו תרבית משותפת במשך 4 שעות ב- 37 ° C, 5% CO2, ולאחר מכן תיוג ספציפי לתא וניתוח בציטומטר זרימה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור 2. מודל מלריה ניסיוני להריגת אסי. ראשית, עכברי C57BL/6 נדבקו ב-105 תאי דם אדומים נגועים ב-PyX17NL. לאחר מכן, פרזיטמיה מנוטרת על ידי כתם דם, עד שיא הזיהום (30%-40% iRBCs), כ -12 ימים לאחר ההדבקה (dpi). למחרת, עכברים דיממו והומתו לצורך איסוף טחול. הדם עובד, ו-RBCs נגועים הועשרו על ידי הפרדה מגנטית, ואחריה תיוג עם CFSE (למעלה מימין). הטחול עובד לבידוד לימפוציטים ציטוטוקסיים, על ידי ברירה שלילית באמצעות חרוזים מגנטיים. לאחר מכן, הלימפוציטים ציטוטוקסיים מטוהרים ו- iRBCs תורבתו במשך 4 שעות ב- 37 ° C, 5% CO2, ולאחר מכן תיוג ספציפי לתא וניתוח בציטומטר זרימה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
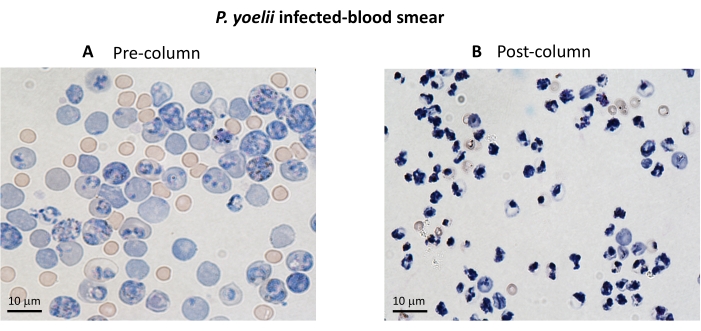
איור 3. העשרת iRBC באמצעות עמודים מגנטיים. ה-iRBCs טוהרו מעכברים נגועים ב-P. yoelii באמצעות עמודות LS. הטיהור מודגש על ידי מריחות דם מדם שנאסף לפני ( A ) ואחרי (B) העשרת עמודות. סרגל קנה מידה = 10 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4. הערכה של אחוז ליזה התא של P. yoelii-iRBCs על ידי לימפוציטים CD8+. אסטרטגיית gating עבור אחוז ליזה התא. (A) הגדר את שער העצירה לאוכלוסיית ספירת החרוזים (~ 20,000 אירועים). (B) שליטה בליזה ספונטנית, iRBCs ללא לימפוציטים. התחל את אסטרטגיית gating על ידי בחירת התאים הבודדים, למעט פסולת, בהתבסס על יחס גובה שיא FSC לשטח, ולאחר מכן בחירת אוכלוסיית RBC ב- APC-Cy7 Ter119 חיובי ו- PerCP-Cy5.5 CD8 שלילי. לאחר מכן בחר iRBCs חיים כ- CFSE (FITC) חיובי גבוה. (C) ניתוח ניסוי לדוגמה באמצעות אפקט שונה: יחסי מטרה, המציגים את אחוז RBC החי לאחר התרבות המשותפת. (ד) ייצוג גרפי של אחוז הליזה של RBC המחושב על בסיס הנוסחה המתוארת בסעיף 10. השוואת המובהקות בין הקבוצות (CD8 ציטוטוקסי או CD8 נאיבי) הוערכה על ידי ANOVA דו-כיווני עם השוואות מרובות. P < 0.0001 (****). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
כאן אנו מתארים בדיקת מבחנה למדידת הרג תאי דם אדומים נגועים בפלסמודיום על ידי לימפוציטים ציטוטוקסיים. בדיקה זו יכולה לעזור להבהיר את מנגנוני ההגנה התאית לשלב האריתרוציטי של טפיל המלריה. היתרון העיקרי של מתודולוגיה זו הוא שהיא מספקת בדיקה כמותית של הרג בתיווך תאים של iRBCs שניתן להשתמש בהם כדי לענות על שאלות רבות על האופן שבו תאי מערכת החיסון מתקשרים עם פלסמודיום spp שונים.
חשוב לציין, שיטה זו יכולה לשמש לחקר P. vivax וטפילי פלסמודיום אחרים שאינם מתוחזקים בתרבות חוץ גופית 14,15. בנוסף, פרוטוקול זה יכול להיות מותאם לכל מיני פלסמודיום ופונדקאים שונים, כגון בני אדם, עכברים ופרימטים שאינם אנושיים. שיטות מבוססות ציטומטריית זרימה נמצאות בשימוש נרחב להערכת הפעלת תאים ציטוטוקסיים, ייצור ציטוקינים ודגרנולציה10,11,16, אך השיטה הנוכחית היא היחידה החוקרת ליזה RBC על ידי מגע ישיר של התא עם תאי הרג.
ישנן גם שיטות רבות, כגון מיקרוסקופיה, תגובת שרשרת פולימראז (PCR) וציטומטריית זרימה, המשמשות לחקר מלריה על ידי מדידת טפילות, פלישה ופעילות נגד מלריה. עם זאת, כדי לנתח את ציטוטוקסיות התא בתיווך RBCs, השיטות הנוכחיות המשתמשות Cr51 או שחרור המוגלובין אינן רגישות מספיק כדי להעריך ליזה RBC. שחרור LDH עשוי לשמש גם להערכת הריגת RBC על ידי כמה CTL כמו תאי CD8+ T, אך מדידת LDH אינה שיטה מדויקת מכיוון שתאים מולדים או מולדים מופעלים עשויים להרוג זה את זה כמנגנון ויסות.
CFSE נמצא בשימוש נרחב כדי לעקוב אחר תאים או לחקור את התפשטות התאים בציטומטריית זרימה או במיקרוסקופ פלואורסצנטי17. מכיוון ש-RBCs אינם מתרבים18, עוצמת הפלואורסצנטיות של CFSE אמורה לרדת עם ליזה של תאים. ציטומטריית זרימה היא טכניקה מדויקת מאוד מכיוון שהיא יכולה לזהות רמות נמוכות מאוד של סמנים ספציפיים, ולכן נעשה בה שימוש נרחב למעקב אחר פרזיטמיה ופלישה בזיהום מלריה 19,20,21,22,23. והכי חשוב, ציטומטריית זרימה יכולה למדוד פרמטרים רבים בתא בודד ולמיין תאים לאוכלוסיות שונות. על ידי הוספת ריאגנטים סטנדרטיים כמותיים (ספירת חרוזים) לכל דגימה, ניתן לנרמל את מספר האירועים שנרכשו ולקבל ספירת תאים מוחלטת24. שיטה זו מאפשרת השוואה כמותית אמינה בין תנאי הניסוי, שהיא קריטית לפרוטוקול המוצע כיום.
כמה צעדים קריטיים עבור פרוטוקול זה כוללים הבטחת איכות הדגימה, הבטחת צביעת תאים נאותה, כולל בקרות כדי לנרמל את החישובים. כמות גדולה של דגימות דם טריות נדרשת כדי לטהר RBCs נגועים. יש לגשת בזהירות לטיהור בינוני של הפרדת שיפוע הצפיפות מכיוון שריכוזו קריטי להשגת הפלסמודיום iRBCs הרצויים. שכבת הדם על מדיום הפרדת שיפוע הצפיפות חייבת להיעשות גם היא לאט ככל האפשר, וקצירת השכבה האדומה הטבעתית חייבת להיעשות בזהירות כדי למנוע אובדן iRBCs. כדי להקל על תהליך הטיהור, יש להשתמש בדגימת דם גבוהה של טפיל מכיוון שכמות iRBCs תהיה גבוהה יותר. יש לציין כי בפרוטוקול בידוד RBC באמצעות שדות מגנטיים, רק שלבים בוגרים של טפיל (trophozoites או schizonts בשלב אמצעי-מאוחר) המייצרים כמויות משמעותיות של המוזואין יטוהרו. כתוצאה מכך, כל שלב טבעת לא ייאסף, וזה עשוי להשפיע על התוצאה הסופית.
צביעת תאים צריכה להתבצע בזהירות כדי למנוע אובדן או ליזה של תאים. יש להימנע מאחסון או קיבוע ממושך לפני הכתמה. חשוב לציין כי תנאי הניסוי צריכים להתבצע בטריפליקט באמצעות יחסי אפקט סדרתי:מטרה ובקרות מתאימות, כגון מצב ליזה ספונטני ללא תווית ובקרת השערות. התוספת של חרוזי ספירת תאים היא חיונית מכיוון שהיא מספקת דרך קלה לקבוע את ריכוז התאים או ספירת תאים מוחלטת עבור כל דגימה. במהלך רכישת ציטומטר זרימה, הקפד להגדיר את מספר האירועים שייאספו בשער ספירת החרוזים כדי לנרמל את מספר התאים בכל דגימה לאחר תרבית משותפת.
מכיוון שלפחות 1 x 105 תאי השפעה נדרשים לתוצאות עקביות בבדיקת קו-תרבות, מגבלה אפשרית אחת של המתודולוגיה המתוארת היא המספר המוגבל של תאים לאחר טיהור, אשר יכול להיות דאגה במיוחד כאשר עובדים עם אוכלוסיות תאים נדירים. ואכן, זה חל על טיהור iRBC, כפי שהוא דורש בעל טפיל גבוה מאוד כי הוא לא כל כך קל להשיג, במיוחד כאשר עובדים עם דגימות אנושיות באזורים אנדמיים.
שיפור פרוטוקול אחד עשוי להיות זמן הדגירה של התרבות המשותפת. למרות שהשתמשנו בעבר בזמן דגירה של12 שעות 10,11, לאחרונה ראינו כי 4 שעות מספיקות כדי להבדיל בין תנאי הניסוי, ובכך להפחית את הזמן לליזה ספונטנית פוטנציאלית ולשפר את יכולת השחזור של התוצאות.
המנגנונים המעורבים בהרג ישיר של RBCs נגועים בפלסמודיום נחשפים בהדרגה. הקבוצה שלנו הייתה הראשונה להראות כי תאי CD8+ T יכולים לזהות ולהרוג רטיקולוציטים נגועים ב- P.vivax באמצעות מצגת HLA-I על ידי התא הנגוע11. לאחרונה, מחקר אחר הראה כי תאי γδ T מזהים RBCs נגועים ב- P. falciparum באמצעות זיהוי פוספואנטיגן על ידי butyrophylin, מולקולה הקיימת על פני השטח של iRBCs10. בשני המחקרים, RBC lysis תלוי בגרנוליסין ובגראנזים B, ומוביל להרג טפילים תוך תאי.
למרות ששיטות רבות פותחו במהלך השנים למדידת טפילים, פלישה, פעילות נגד מלריה ואינטראקציה בין תאי תמונה, אף אחת מהן לא הצליחה לנתח את ההרג הישיר של iRBCs על ידי תאים ציטוטוקסיים בבדיקה כמותית מבוססת ציטומטריה של זרימה 19,20,21. השתמשנו בגישה חדשנית להערכת קיבולת ליזה של תאים במלריה על ידי תיוג CFSE של RBCs נגועים בפלסמודיום והערכה של ליזה iRBC בתקופה ספציפית של תרבות משותפת עם לימפוציטים. לכן, בדיקה זו של הרג חוץ גופי מציגה אסטרטגיה חדשנית להבהרת מנגנוני החסינות התאית למלריה בשלב הדם, אשר תסייע לקדם את המחקר של מטרות טיפוליות חדשות ופיתוח חיסונים נגד מלריה.
Disclosures
המחברים מצהירים כי אין אינטרסים מתחרים.
Acknowledgements
אנו מודים לד"ר דליו פריירה ולחברי מרכז המחקר לרפואה טרופית של רונדוניה (CEPEM) על רישום חולי מלריה ואיסוף דם ולפלישיה הו על עזרתם בתיקון כתב היד. המגיב הבא הושג באמצעות BEI Resources, NIAID, NIH: Plasmodium yoelii subsp. yoelii, זן 17XNL:PyGFP, MRA- 817, נתרם על ידי אנה רודריגז. מחקר זה נתמך על ידי קרן המחקר Lemann Brazil, Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) - 437851/2018-4, מלגות (CJ, GC, CG), ו- Fundação de Amparo do Estado de Minas Gerais (FAPEMIG) - APQ-00653-16, APQ-02962-18; Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) - fellowship (LL).
Materials
| Name | Company | Catalog Number | Comments |
| 100 μM cell strainer | Corning | 431752 | |
| 96 Well Round (U) Bottom Plate | Thermo Scientific | 12-565-65 | |
| Anti-human CD235a (Glycophorin A) Antibody | Biolegend | 349114 | Used - APC anti-human CD235, dilution 1:100 |
| Anti-human CD3 Antibody | Biolegend | 317314 | Used - PB anti-human CD3, dilution 1:200 |
| Anti-human CD8 Antibody | Biolegend | 344714 | Used - APC/Cy7 anti-human CD8, dilution 1:200 |
| Anti-human TCR Vδ2 Antibody | Biolegend | 331408 | Used - PE anti-human TCR Vδ2, dilution 1:200 |
| Anti-mouse CD8a Antibody | Biolegend | 100733 | Used- PerCP/Cyanine5.5 anti-mouse CD8a, dilution 1:200 |
| Anti-mouse TER-119/Erythroid Cells Antibody | Biolegend | 116223 | Used - APC/Cyanine7 anti-mouse TER-119, dilution 1:200 |
| CellTrace CFSE Cell Proliferation Kit | Invitrogen | C34554 | |
| Fetal Bovine Serum, qualified | Gibco | 26140079 | |
| Ficoll-Paque Plus | Cytiva | 17144003 | Lymphocyte Separation Medium (LSM) |
| Heparin Sodium Injection, USP | meithel pharma | 71228-400-003 | Used - 2000 USP units/2mL |
| Isoflurane | Piramal critical care | 66794-0013-25 | |
| LS MACS Column | Miltenyi Biotec | 130-042-401 | |
| LSRFortessa Cell Analyzer | BD Bioscience | ||
| Percoll | Cytiva | 17089101 | Density Gradient Separation Medium (DGSM) |
| QuadroMACS Separator | Miltenyi Biotec | 130-090-976 | |
| RPMI 1640 Medium | Gibco | 11875093 | |
| Sodium bicarbonate, powder, BioReagent | Sigma-Aldrich | S5761 | |
| Syringe With Sub-Q needle - 1mL, 26 gauge; | BD | 14-829-10F | |
| Vacutainer Heparin Tube Glass Green 10 ml | BD | 366480 |
References
- WHO. Global Technical Strategy for Malaria 2016-2030, 2021 Update. World Health Organization. , (2021).
- Hafalla, J. C., Silvie, O., Matuschewski, K. Cell biology and immunology of malaria. Immunological Reviews. 240 (1), 297-316 (2011).
- Belnoue, E., et al. Vaccination with live Plasmodium yoelii blood stage parasites under chloroquine cover induces cross-stage immunity against malaria liver stage. Journal of Immunology. 181 (12), 8552-8558 (2008).
- Leong, Y. W., Lee, E. Q. H., Rénia, L., Malleret, B. Rodent malaria erythrocyte preference assessment by an ex vivo tropism assay. Frontiers in Cellular and Infection Microbiology. 11, 680136 (2021).
- Ladeia-Andrade, S., Ferreira, M. U., De Carvalho, M. E., Curado, I., Coura, J. R. Age-dependent acquisition of protective immunity to malaria in riverine populations of the amazon basin of Brazil. The American Journal of Tropical Medicine and Hygiene. 80 (3), 452-459 (2009).
- Antonelli, L. R., et al. The immunology of Plasmodium vivax malaria. Immunological Reviews. 293 (1), 163-189 (2020).
- Kazmin, D., et al. Systems analysis of protective immune responses to RTS, S malaria vaccination in humans. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2425-2430 (2017).
- Epstein, J. E., et al. Live attenuated malaria vaccine designed to protect through hepatic CD8+ T cell immunity. Science. 334 (6055), 475-480 (2011).
- Draper, S. J., et al. Malaria vaccines: recent advances and new horizons. Cell Host & Microbe. 24 (1), 43-56 (2018).
- Junqueira, C., et al. γδ T cells suppress Plasmodium falciparum blood-stage infection by direct killing and phagocytosis. Nature Immunology. 22 (3), 347-357 (2021).
- Junqueira, C., et al. Cytotoxic CD8+ T cells recognize and kill Plasmodium vivax-infected reticulocytes. Nature Medicine. 24 (9), 1330-1336 (2018).
- Arora, G., et al. NK cells inhibit Plasmodium falciparum growth in red blood cells via antibody-dependent cellular cytotoxicity. eLife. 7, 36806 (2018).
- Paul, F., Roath, S., Melville, D., Warhurst, D. C., Osisanya, J. O. S. Separation of malaria-infected erythrocytes from whole blood: use of a selective high-gradient magnetic separation technique. Lancet. 2 (8237), 70-71 (1981).
- Shaw-Saliba, K., et al. Insights into an optimization of Plasmodium vivax Sal-1 in vitro culture: the aotus primate model. PLOS Neglected Tropical Diseases. 10 (7), 0004870 (2016).
- Mehlotra, R. K., et al. Long-term in vitro culture of Plasmodium vivax isolates from Madagascar maintained in Saimiri boliviensis blood. Malaria Journal. 16 (1), 442 (2017).
- Hojo-Souza, N. S., et al. Contributions of IFN-γ and granulysin to the clearance of Plasmodium yoelii blood stage. PLOS Pathogens. 16 (9), 1008840 (2020).
- Parish, C. R., Glidden, M. H., Quah, B. J. C., Warren, H. S. Use of the intracellular fluorescent dye CFSE to monitor lymphocyte migration and proliferation. Current Protocols in Immunology. 84 (1), 4-9 (2009).
- Migliaccio, A. R. Erythroblast enucleation. Haematologica. 95 (12), 1985 (2010).
- Grimberg, B. T., Erickson, J. J., Sramkoski, R. M., Jacobberger, J. W., Zimmerman, P. A. Monitoring Plasmodium falciparum growth and development by UV flow cytometry using an optimized Hoechst-thiazole orange staining strategy. Cytometry Part A:The Journal of the International Society for Analytical Cytology. 73 (6), 546-554 (2008).
- Pattanapanyasat, K., et al. Culture of malaria parasites in two different red blood cell populations using biotin and flow cytometry. Cytometry:The Journal of the International Society for Analytical Cytology. 25 (3), 287-294 (1996).
- Bianco, A. E., Battye, F. L., Brown, G. V. Plasmodium falciparum: rapid quantification of parasitemia in fixed malaria cultures by flow cytometry. Experimental Parasitology. 62 (2), 275-282 (1986).
- Jacobberger, J. W., Horan, P. K., Hare, J. D. Analysis of malaria parasite-infected blood by flow cytometry. Cytometry:The Journal of the International Society for Analytical Cytology. 4 (3), 228-237 (1983).
- Bei, A. K., et al. A flow cytometry-based assay for measuring invasion of red blood cells by Plasmodium falciparum. American Journal of Hematology. 85 (4), 234 (2010).
- Montes, M., Jaensson, E. A., Orozco, A. F., Lewis, D. E., Corry, D. B. A general method for bead-enhanced quantitation by flow cytometry. Journal of Immunological Methods. 317 (1-2), 45-55 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved