Method Article
Применение РНК-интерференции у сосновой нематоды, Bursaphelenchus xylophilus
В этой статье
Резюме
Здесь мы представляем подробный метод замачивания интерференции РНК у Bursaphelenchus xylophilus для облегчения изучения функций генов.
Аннотация
Сосновая нематода, Bursaphelenchus xylophilus, является одним из самых разрушительных инвазивных видов во всем мире, вызывая увядание и возможную гибель сосен. Несмотря на признание их экономического и экологического значения, до сих пор было невозможно изучить подробные функции генов растительно-паразитических нематод (PPNs) с использованием традиционной прямой генетики и трансгенных методов. Однако, как обратная генетическая технология, РНК-интерференция (РНКи) облегчает изучение функциональных генов нематод, включая B. xylophilus.
В этой статье описывается новый протокол для РНКи гена ppm-1 у B. xylophilus, который, как сообщается, играет решающую роль в развитии и размножении других патогенных нематод. Для РНКи промотор Т7 связывали с 5'-терминалом целевого фрагмента полимеразной цепной реакцией (ПЦР), а двухцепочечную РНК (дцРНК) синтезировали путем транскрипции in vitro . Впоследствии доставка дцРНК осуществлялась путем замачивания нематод в растворе дцРНК, смешанном с синтетическими нейростимуляторами. Синхронизированную молодь B. xylophilus (приблизительно 20 000 особей) промывали и вымачивали в дцРНК (0,8 мкг/мл) в буфере замачивания в течение 24 ч в темноте при 25 °C.
Такое же количество нематод поместили в замачивающий буфер без дцРНК в качестве контроля. Между тем, другое идентичное количество нематод было помещено в замачивающий буфер с зеленым флуоресцентным белком (gfp) гена dsRNA в качестве контроля. После замачивания уровень экспрессии целевых транскриптов определяли с помощью количественной ПЦР в режиме реального времени. Эффекты РНКi были затем подтверждены с помощью микроскопического наблюдения фенотипов и сравнения размеров тела взрослых среди групп. Текущий протокол может помочь продвинуть исследования, чтобы лучше понять функции генов B. xylophilus и других паразитических нематод для разработки стратегий контроля с помощью генной инженерии.
Введение
Растительно-паразитические нематоды (ППН) представляют собой постоянную угрозу продовольственной безопасности и лесным экосистемам. Они наносят около 100 миллиардов долларов США экономических потерь каждый год1, наиболее проблематичными из которых являются в первую очередь корневые нематоды, цисты нематоды и нематоды соснового дерева. Сосновая нематода, Bursaphelenchus xylophilus, является мигрирующей, эндопаразитарной нематодой, которая является возбудителем болезни соснового увядания2. Он нанес большой вред сосновым лесам во всем мире3. Используя терминологию Van Megen et al.4, B. xylophilus является членом Parasitaphelenchidae и принадлежит к кладе 10, тогда как большинство других крупных паразитов растений принадлежат к кладе 12.
Как независимый и недавно эволюционировавший паразит растений, B. xylophilus является привлекательной моделью для сравнительных исследований. На сегодняшний день были проведены значительные исследования корневых нематод и цистых нематод, принадлежащих к кладе 12, которые являются облигатными, сидячими эндопаразитами и являются одними из наиболее интенсивно изученных нематод. Однако проведение дальнейших исследований в этой важной области сопряжено с серьезной проблемой: функция генов паразитизма является узким местом исследований. Функциональные исследования обычно включают эктопическую экспрессию и эксперименты с нокдауном, но полагаются на эффективные протоколы генетической трансформации для нематоды. В результате обратная генетика в PPN почти исключительно полагается на глушение генов RNAi.
РНКи, механизм, широко присутствующий в эукариотических клетках, подавляет экспрессию генов, вводя двухцепочечную РНК (дцРНК)5. На сегодняшний день посттранскрипционный механизм глушения генов, индуцированный дцРНК, обнаружен у всех изученных эукариот, а технология РНКи, как инструмент исследований функциональной геномики и других приложений, быстро развивалась у многих организмов. С момента открытия механизма RNAi у Caenorhabditis elegans в 1998году 6 методы RNAi стали эффективными методами идентификации функции генов нематод и предложены в качестве нового способа эффективного контроля патогенных нематод7.
РНКи технически пропитывает молодь в дцРНК; однако эффективность и воспроизводимость этого подхода широко варьируются в зависимости от вида нематод игена-мишени 8. Глушение 20 генов, участвующих в РНК-путях корневого узла нематоды, Meloidogyne incognita, было исследовано с использованием длинных дцРНК в качестве триггеров, что привело к разнообразным ответам, включая увеличение и отсутствие изменений в экспрессии некоторых генов9. Эти результаты показывают, что гены-мишени могут по-разному реагировать на нокдаун РНКи, что требует исчерпывающей оценки их пригодности в качестве мишеней для борьбы с нематодами с помощью РНКи. Тем не менее, в настоящее время существует мало исследований по биологии развития и репродуктивной биологии B. xylophilus.
В качестве продолжения предыдущей работы 10,11,12,13 мы описываем здесь протокол применения РНКи для изучения функции гена ppm-1 B. xylophilus, включая синтез дцРНК, синтетическое нейростимуляторное замачивание и количественное обнаружение полимеразной цепной реакции (qPCR). Знания, полученные в результате этого экспериментального подхода, вероятно, будут заметно способствовать пониманию основных биологических систем и предотвращению болезни соснового увядания.
протокол
Исследование было одобрено советом по экспериментам на животных Чжэцзянского сельскохозяйственного и лесного университета. Изолят B. xylophilus NXY61 был первоначально извлечен из больного Pinus massoniana в районе Нинбо провинции Чжэцзян, Китай11.
1. Клонирование генов
ПРИМЕЧАНИЕ: Смотрите Таблицу материалов для получения подробной информации о грунтовках, используемых в этом протоколе.
- Собирайте нематод.
- Культивируйте штамм B. xylophilus на мицелии Botrytis cinerea на пластинах картофельного декстрозы агара (КПК) при 25 °C в течение 3-5 дней.
- Соберите нематод с помощью метода воронки Беллмана14.
- Поместите зажатую резиновую трубку под воронку и поместите два слоя фильтровальной бумаги в горловину воронки. Перенесите грибковые культуры в воронку и добавьте воду, чтобы погрузить грибковый мат. Подождите 2 часа, затем соберите нематод.
- Извлеките общую РНК из нематод с помощью реагента для полной экстракции РНК (см. Таблицу материалов)11 в соответствии со следующими шагами.
- Добавьте 500 мкл экстракционного реагента и 100 мкл магнитных шариков в 2 мл центрифужной трубки. Аспирировать 20 мкл нематод и перенести образец в шлифовальную машину для измельчения при 9000 × г в течение 30 с. Инкубировать в течение 5 мин, а затем центрифугу в течение 10 мин при 12 000 × г и 4 °C.
- Перенесите супернатант на новую центрифужную трубку. Добавьте 100 мкл хлороформа, закройте трубку крышкой и перемешайте, перевернув трубку несколько раз. Инкубировать в течение 3 мин, а затем центрифугу в течение 10 мин при 12 000 × г при 4 °C.
- Перенесите супернатант на новую центрифужную трубку. Добавьте 250 мкл изопропилового спирта и энергично вихрь. Центрифуга при 12 000 × г в течение 10 мин.
- Выбросьте супернатант. Добавьте 500 мкл 75% этанола, чтобы промыть РНК, а затем вихрь образца. Центрифугируйте его в течение 5 мин при 12 000 × г и 4 °C.
- Высушите гранулу РНК на воздухе в течение 5 мин.
- Повторно суспендировать гранулу в 30 мкл воды, не содержащей РНКазы.
- Рассчитайте концентрацию РНК по формуле: A260 × разбавление × 40 = мкг РНК/мл. Рассчитайте соотношение A260/A280.
ПРИМЕЧАНИЕ: Соотношение ~2 считается чистым.
- Выполните обратную транскрипцию РНК хорошего качества для получения шаблона кДНК.
- Спроектируйте и используйте пару специфических праймеров, ppm-1-F/R (см. Таблицу материалов), для усиления частичной кодирующей последовательности гена Bx-ppm-1 у B. xylophilus (номер присоединения GenBank QTZ96795).
- Клонирование последовательностей гена ppm-1 в вектор pGEM-Teasy, содержащий промотор T7, следуя стандартному протоколу клонирования11.
- Настройте реакции ПЦР следующим образом: 2 мкл кДНК, 25 мкл 2x Ex Taq Polymerase Premix, 2 мкл каждого праймера (10 пмоль/л) и стерильная дистиллированная вода до конечного объема 50 мкл.
- Выполните процедуру амплификации следующим образом: 5 мин при 94 °C; затем 35 циклов по 30 с при 94 °C, 30 с при 55 °C и 1 мин при 72 °C; и заключительный этап удлинения при 72 °C в течение 5 мин.
- Клонируйте усиленные продукты в вектор pGEM-T Easy для секвенирования.
2. Синтез дцРНК
- Подготовьте шаблон ДНК для синтеза дцРНК с помощью ПЦР с праймерами, предназначенными для добавления промоутеров Т7 с обоих концов. Добавьте последовательность промоутеров T7 к 5-дюймовому концу праймеров.
- Используйте плазмиду, содержащую фрагмент гена ppm-1 (894 bp), в качестве шаблона для ПЦР и восстановите фрагмент, содержащий промоторT7 11. Используйте процедуру и систему ПЦР, описанную выше.
- Используйте набор транскрипции in vitro для синтеза дцРНК11.
- Разморозьте замороженные реагенты на льду.
- Добавьте 2 мкл 10-кратного реакционного буфера, 2 мкл смеси ферментов и 1 мкг ДНК в трубку центрифуги. Добавьте воду без нуклеазы для получения стандартной реакции 4 мкл. Затем смешайте равные объемы четырех растворов рибонуклеотидов (АТФ, CTP, ГТФ и УТП) вместе и добавьте 8 мкл смеси в пробирку. Тщательно перемешать и инкубировать при 37 °C в течение 4 ч.
- Добавить 1 мкл ДНКазы, хорошо перемешать и инкубировать в течение 15 мин при 37 °C.
- Остановите реакцию и добавьте 30 мкл воды без нуклеазы и 30 мкл раствора осаждения LiCl для осаждения РНК. Тщательно перемешать. Инкубировать при -20 °C в течение ночи.
- Центрифуга в течение 15 мин при 12 000 × г и 4 °C. Выбросьте супернатант.
- Добавьте 1 мл 75% этанола для промывания РНК. Вращайте образец и центрифугируйте его в течение 10 мин при 12 000 × г и 4 °C.
- Высушите гранулу РНК на воздухе в течение 3 мин.
- Повторно суспендировать гранулу в 30 мкл воды, не содержащей РНКазы.
- Проанализируйте качество дцРНК с помощью спектрофотометра. Пипетка 1 мкл образца дцРНК на измерительный пьедестал и установка длины волны на 340 нм. Визуализируйте продукты на 1,0% агарозном геле.
3. РНК путем замачивания
- Смешайте 4 мкл 5-кратного замачивающего буфера (0,05% желатина, 5,5 мМ KH2PO4, 2,1 мМ NaCl, 4,7 мМ NH4Cl, 3 мМ спермидина) с дцРНК и ddH2Oдля получения общего объема 20 мкл и конечной концентрации РНК 0,8 мкг/мл.
- Приобретают личинки J2.
- Соберите нематод из грибковых культур и переложите их в стеклянную чашку Петри диаметром 6 см. Добавьте 10 мл воды в блюдо, чтобы нематоды могли свободно плавать. Держите нематод в посуде в течение 30 минут и дождитесь, пока яйца прилипнут ко дну.
- Удалите воду и нематод осторожно, следя за тем, чтобы не потревожить яйца. Повторяйте шаги до тех пор, пока все личинки и взрослые особи не будут удалены, оставив в блюде только яйца.
- Высиживайте собранные яйца в течение 24 ч в темноте при 25 °C для получения личинок J2. Соберите личинок J2, поместите их в трубку и трижды промойте их ddH2O для эксперимента RNAi15.
- Перенесите личинки J2 в трубку объемом 2 мл, содержащую раствор дцРНК, и добавьте раствор резорцина (завернутый в фольгу и растворенный в воде) для получения конечной концентрации 1,0%. Инкубируйте личинок центрифугированием при 15 × г на встряхивающем столе в течение 24 ч при 25 °C, чтобы убедиться, что личинки эффективно поглощают дцРНК.
- Замочите такое же количество нематод в буфере для замачивания без зонда дцРНК или с помощью зонда дцРНК GFP в качестве контроля. Используют ген GFP (gfp, M62653.1) в качестве неэндогенного контроля и синтезируют дцРНК gfp с помощью ген-специфических праймеров T7-GFP-F/R.
4. Обнаружение qPCR
- Очистите личинки J2 с помощью ddH2O, в том числе с целевой генной интерференцией, генной интерференцией GFP и нетронутой контрольной группой. Извлеките общее количество РНК из каждой группы с помощью метода, описанного выше.
- Запустите qPCR.
- Спроектируйте грунтовки q-ppm-1-F/R с помощью необходимого программного обеспечения (см. Таблицу материалов).
- Настройте реакцию qPCR в 12 мкл, содержащих 1 мкл кДНК, 6 мкл флуоресцентного премикса, 0,4 мкл каждого праймера (10 пмоль/л) и стерильную дистиллированную воду.
- Выполняют qPCR следующим образом: 2 мин при 95 °C; затем 40 циклов по 10 с при 95 °C, 30 с при 55 °C и 1 мин при 72 °C.
- Используйте ген actb (номер присоединения GenBank EU100952) и ген tbb-2 (номер присоединения GenBank MT769316) или другие гены в качестве внутренних эталонных генов для оценки изменений уровня экспрессии генов после RNAi15.
- В соответствии со значением порога цикла (Ct) и кривой растворения используйте метод 2-ΔΔCt для оценки относительного уровня экспрессии гена-мишени и проверки эффективности интерференции.
- Вычтите значение Ct внутреннего эталонного гена каждого образца из значения Ct гена-мишени, чтобы получить значение ΔCt. Затем вычтите значение ΔCt интерференционной группы из значения ΔCt контрольной группы, чтобы получить значение ΔΔCt.
ПРИМЕЧАНИЕ: Значение ΔΔCt, превышающее 0, указывает на эффективность интерференции.
- Вычтите значение Ct внутреннего эталонного гена каждого образца из значения Ct гена-мишени, чтобы получить значение ΔCt. Затем вычтите значение ΔCt интерференционной группы из значения ΔCt контрольной группы, чтобы получить значение ΔΔCt.
5. Оцените длину тела взрослых нематод после РНК
- После RNAi культивируйте личинок J2 до зрелого возраста на газонах B. cinerea в пластинах PDA в течение 60 ч при 25 °C15.
- Соберите взрослых особей с помощью метода воронки Беллмана (см. шаг 1.1.2.1)14.
- Получайте изображения взрослых нематод под микроскопом и используйте программное обеспечение ImageJ (или другое измерительное программное обеспечение) для измерения длины тела.
- Измерьте длину с помощью ImageJ, выбрав «Анализировать | Установите масштаб. Если расстояние известно, введите значение длины нарисованной прямой линии. Введите единицу длины.
- Установите флажок Глобальный (используйте этот стандарт для всех изображений) и нажмите кнопку ОК , чтобы выбрать длину, которая будет измеряться прямой линией на измеряемом изображении.
- Используйте команду Ctrl+M (измерение) для отображения результатов и записи их в окне результатов .
- Проведите измерения 50 самцов и 50 самок нематод для статистического анализа12.
- Анализируйте данные, вычисляя среднее и стандартное отклонение для каждой выборки. Сравните средства выборок из разных групп с помощью t-теста Студента.
Результаты
Анализ экспрессии ppm-1 B. xylophilus после РНКи
Относительный уровень экспрессии гена ppm-1 B. xylophilus , пропитанного gFP dsRNA и пропитанного целевым геном dsRNA, составлял 0,92 и 0,52 соответственно (уровень экспрессии гена ppm-1 контрольной группы, получавшей DdH2O, был установлен на 1) (Рисунок 1). Таким образом, экзогенная дцРНК не оказывает влияния на экспрессию ppm-1 B. xylophilus; однако ppm-1 дцРНК может эффективно ингибировать экспрессию гена-мишени.
Влияние экспрессии ppm-1 на рост и развитие B. xylophilus
После РНКи размер взрослых заметно уменьшился (рисунок 2), в результате чего образовался мутантный фенотип СМА (небольшой размер тела). Хотя люди, получавшие РНКи, развивались до половой зрелости, их длина тела была значительно меньше, чем у нормальных взрослых. В частности, после RNAi у нематод J2-стадии средняя длина тела самок и самцов составляла 544,61 мкм и 526,24 мкм соответственно. Напротив, средняя длина тела женщин и мужчин в контрольной группе составила 971,86 мкм и 912,31 мкм соответственно (рисунок 3), что представляет собой значительные различия (P = 0,0322).
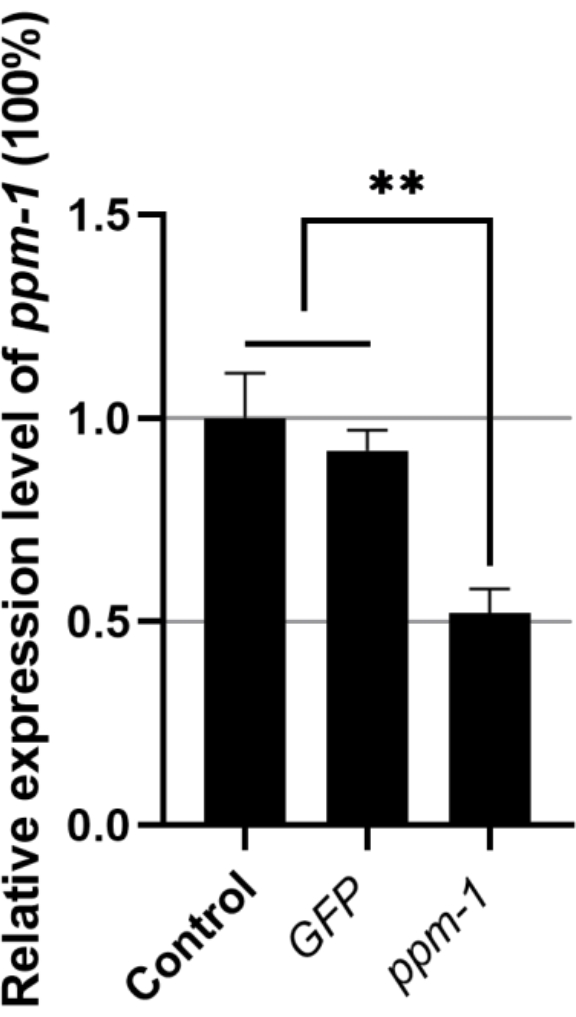
Рисунок 1: Экспрессия гена ppm-1 после RNAi Bursaphelenchus xylophilus. **P < 0,001. Сокращения: РНКи = РНК-интерференция; GFP = зеленый флуоресцентный белок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Уменьшение длины тела взрослых особей после интерференции ppm-1 у Bursaphelenchus xylophilus. Изображения взрослого мужчины (А) и женщины (С) группы РНКи. Изображения взрослого мужчины (B) и женщины (D) контрольной группы. Шкала стержней = 50 мкм. Аббревиатура: RNAi = РНК-интерференция. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
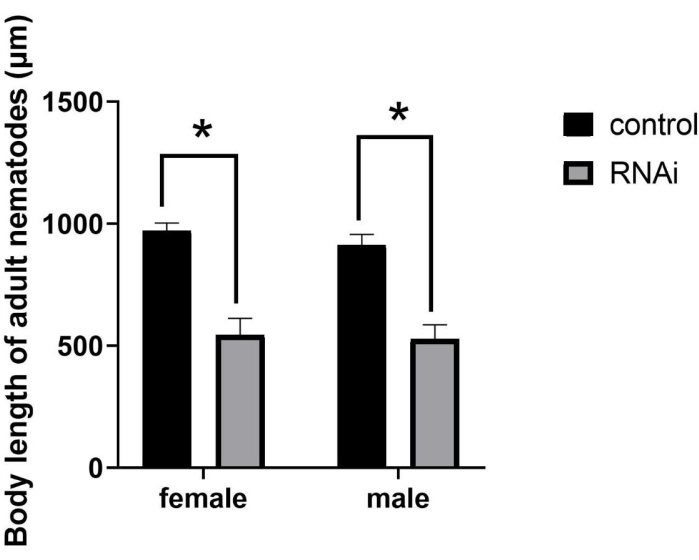
Рисунок 3: Количественная оценка и статистический анализ длины тела взрослых особей Bursaphelenchus xylophilus после РНКи гена ppm-1 . (*P = 0,0322). Аббревиатура: RNAi = РНК-интерференция. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Хотя история жизни и паразитарная среда B. xylophilus отличаются от других нематод, были проведены ограниченные исследования молекулярного патогенеза этого растительного патогенеза. Несмотря на большой прогресс, достигнутый в применении технологии редактирования генома CRISPR / Cas9 у C. elegans и других нематод, на сегодняшний день только технология RNAi, примененная к B. xylophilus, была опубликована на сегодняшний день17. RNAi является одним из самых мощных инструментов, доступных для изучения функции генов нематод, и широко используется в исследованиях, разъясняющих функцию гена B. xylophilus, пути сигнальной трансдукции и генную терапию 18,19,20. В отличие от подходов к нокауту генов, используемых в моделях беспозвоночных, РНAi-опосредованный нокдаун генов-мишеней у нематод позволяет быстро оценить функцию генов.
Существует три способа проведения РНКи у C. elegans: инъекция6, замачивание21 и кормление6. Поскольку личинки J2 питаются только после заражения, метод замачивания обычно используется для РНКи растительно-паразитических нематод. Ключевым шагом в методе замачивания является добавление нервно-паралитического вещества, чтобы стимулировать нематод к питанию. Урвин впервые использовал октопамин для стимуляции J2 двух видов пероральных кист нематод, Globodera pallida и Heterodera glycines, что привело к поглощению дцРНК из замачивающегораствора 22. Этот же метод был успешно использован для индуцирования J2 корневой нематоды Meloidogyne incognita для поглощения дцРНК 23. Резорцин также может индуцировать поглощение дцРНК J2 M. incognita и может быть более эффективным, чем октопамин для этой нематоды24. Кроме того, добавление спермидина к буферу замачивания с длительным временем инкубации улучшило эффективность РНКi у нематод25. После 24 ч замачивания дцРНК эффективно входит в B. xylophilus, тем самым заглушая ген ppm-1 .
Этот протокол, таким образом, обеспечивает ссылку для будущего изучения РНКи других растительно-паразитических нематод с поведением фагоцитоза. Кроме того, эффект суспензии встряхивающего стола играет важную роль в максимизации преимущества метода замачивания. Этот метод может позволить одновременно лечить большое количество нематод. RNAi легче эксплуатировать, когда он сосредоточен на генах-мишенях, для которых мутанты не могут быть легко получены, и для оценки эффектов в разных точках развития, потому что нематоды могут быть пропитаны на любом этапе жизни. Таким образом, РНКи могут быть использованы для изучения функции конкретного гена на определенной стадии развития. Wang et al. проанализировали влияние MAPK на плодовитость B. xylophilus и его важную роль в росте и развитии нематод с использованием всасывания дцРНК26. Qiu et al. обнаружили, что скорость миграции и плодовитость B. xylophilus у сосен снизились после понижения регуляции гена Bxpel1 , что указывает на то, что этот ген является важным патогенным фактором B. xylophilus27.
Однако не все РНКи у нематод работают через дцРНК. Дулович и Стрейт применяли малые интерферирующие РНК (siRNAs), а не более длинные dsRNAs, чтобы успешно мешать Strongyloides ratti28. Ограничение использования дцРНК для РНКi в стронгилоидах может быть связано с отсутствием генов, таких как rsd-6, sid-1 или sid-2 , которые, как известно, участвуют в поглощении дцРНК. РНКи также связан с недостатками позиционного эффекта и временного и неполного нокаута и имеет ограниченную эффективность для некоторых генов и типов клеток (таких как нейроны)29. Однако до тех пор, пока не будет достигнут прорыв в трансгенной технологии B. xylophilus , RNAi представляет собой относительно эффективную исследовательскую стратегию.
РНКи показал большой потенциал для защиты растений. Используя технологию RNAi, трансгенный картофель, способный продуцировать дцРНК, которая нацелена на гены корневого узла нематоды, был выведен для получения полной устойчивости к корневым узлам нематод30. Экспрессия дцРНК, нацеленных на гены насекомых, может обеспечить защиту растений в отсутствие химических инсектицидов и дает дополнительное преимущество, заключающееся в том, что они не продуцируют чужеродные белки с почти неограниченным числом генов-мишеней31. Таким образом, ускоренные исследования в области применения РНКи для борьбы с вредителями обеспечат лучшую биобезопасность для борьбы с нематодами растений, чем трансгенные методы или другие методы химического контроля.
В заключение, этот протокол описывает подготовку дцРНК гена ppm-1 для достижения РНКI путем непосредственного замачивания личинок B. xylophilus в растворе дцРНК. Интерференционный эффект был подтвержден на основе значительного уменьшения размера тела личинок после того, как они превратились во взрослых особей по сравнению с контролем, демонстрируя, что ген ppm-1 оказывает влияние на рост и развитие B. xylophilus. Это исследование обеспечивает теоретическую основу для дальнейшего выявления функции ppm-1 с дополнительной практической ценностью в руководстве биологическим контролем этого растительного паразита. Считается, что с дальнейшим раскрытием и совершенствованием механизма технологии РНКи ее применение в области борьбы с B. xylophilus будет иметь широкие перспективы.
Раскрытие информации
Никаких конфликтов интересов объявлено не было.
Благодарности
Это исследование финансировалось Национальным фондом естественных наук Китая (31870637, 31200487) и совместно финансировалось Чжэцзянским ключевым исследовательским планом (2019C02024, LGN22C160004).
Материалы
| Name | Company | Catalog Number | Comments |
| Baermann funnel | n/a | n/a | to isolate nematodes |
| Beacon Designer 7.9 | Shanghai kangyusheng information technology co. | n/a | to design qPCR primers |
| Botrytis cinerea | n/a | n/a | as food for nematodes |
| Bursaphelenchus xylophilus | n/a | n/a | its number was NXY61 and was it was originally extracted from diseased Pinus massoniana in Ningbo, Zhejiang province, China. |
| constant temperature incubator | Shanghai Jing Hong Laboratory Instrument Co. | H1703544 | to cultur nematodes |
| Electrophoresis apparatus | Bio-Rad Laboratories | 1704466 | to achieve electrophoretic analysis |
| Ethanol, 75% | Sinopharm Chemical Reagent Co. | 80176961 | to extract RNA |
| Ex Taq Polymerase Premix | Takara Bio Inc. | RR030A | for PCR |
| Ex Taq Polymerase Premix | Takara Bio Inc. | RR390A | for PCR |
| Gel imager | LongGene Scientific Instruments Co. | LG2020 | to make nucleic acid bands visible |
| GraphPad Prism 8 | GraphPad Prism | n/a | to analyze the data and make figurs |
| High Speed Centrifuge | Hangzhou Allsheng Instruments Co. | AS0813000 | centrifug |
| High-flux tissue grinder | Bertin | to extract RNA | |
| ImageJ software | National Institutes of Health | n/a | to measure the body lengths |
| isopropyl alcohol | Shanghai Aladdin Biochemical Technology Co. | L1909022 | to extract RNA |
| Leica DM4B microscope | Leica Microsystems Inc. | to observe nematodes | |
| magnetic beads | Aoran science technology co. | 150010C | to extract RNA |
| MEGAscript T7 High Yield Transcription Kit | Thermo Fisher Scientific Inc. | AM1333 | to synthesize dsRNA in vitro |
| NanoDrop ND-2000 spectrophotometer | Thermo Fisher Scientific Inc. | NanoDrop 2000/2000C | to analyze the quality of the dsRNA |
| PCR Amplifier | Bio-Rad Life Medical Products Co. | 1851148 | to amplify nucleic acid sequence |
| Petri dishes | n/a | n/a | to cultur nematodes |
| pGEM-T Easy vector | Promega Corporation | A1360 | for cloning |
| Potato Dextrose Agar (Medium) | n/a | n/a | to cultur Botrytis cinerea |
| Prime Script RT reagent Kit with gDNA Eraser | Takara Bio Inc. | RR047B | to synthetic cDNA |
| Primer Premier 5.0 | PREMIER Biosoft | n/a | to design PCR primers |
| primers:ppm-1-F/R | Tsingke Biotechnology Co. | n/a | F: 5'-GATGCGAAGTTGCCAATCATTCT -3'; R: 5'- CCAGATCCAGTCCACCATACACC -3 |
| q-ppm-1-F/R | Tsingke Biotechnology Co. | n/a | F: 5'-CATCCGAATGGCAATACAG-3'; R: 5'-ACTATCCTCAGCGTTAGC-3' |
| Real-time thermal cycler qTOWER 2.2 | Analytique Jena Instruments (Beijing) Co. | for qPCR | |
| shaking table | Shanghai Zhicheng analytical instrument manufacturing co. | to soak nematodes | |
| stereoscopic microscope | Chongqing Optec Instrument Co. | 1814120 | to observe nematodes |
| T7-GFP-F/R | Tsingke Biotechnology Co. | n/a | F: 5'-TAATACGACTCACTATAGGGAAA GGAGAAGAACTTTTCAC-3'; R: 5'-TAATACGACTCACTATAGGGCTG TTACAAACTCAAGAAGG-3' |
| T7 promoter | Tsingke Biotechnology Co. | n/a | TAATACGACTCACTATAGGG |
| Takara MiniBEST Agarose Gel DNA Extraction Kit | Takara Bio Inc. | 9762 | to recover DNA |
| TaKaRa TB Green Premix Ex Taq (Tli RNaseH Plus) | Takara Bio Inc. | RR820A | for qPCR |
| trichloroethane | Shanghai LingFeng Chemical Reagent Co. | to extract RNA | |
| TRIzol Reagent | Thermo Fisher Scientific Inc. | 15596026 | total RNA extraction reagent,to extract RNA |
Ссылки
- Nicol, J. M., Jones, J., Gheysen, G., Fenoll, C., et al. Current nematode threats to world agriculture. Genomics and Molecular Genetics of Plant-Nematode Interactions. , 21-43 (2011).
- Jones, J. T., et al. Top 10 plant-parasitic nematodes in molecular plant pathology. Molecular Plant Pathology. 14 (9), 946-961 (2013).
- Kikuchi, T., et al. Genomic insights into the origin of parasitism in the emerging plant pathogen Bursaphelenchus xylophilus. PLoS Pathogens. 7 (9), 1002219 (2011).
- Megen, H. V., et al. A phylogenetic tree of nematodes based on about 1200 full-length small subunit ribosomal DNA sequences. Nematology. 11 (6), 927-950 (2009).
- Niu, J. H., Jian, H., Xu, J. M., Guo, Y. D., Liu, Q. RNAi technology extends its reach: Engineering plant resistance against harmful eukaryotes. African Journal of Biotechnology. 9 (45), 7573-7582 (2010).
- Fire, A., et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 91 (6669), 806-811 (1998).
- Shahid, M., Imran, A., Mazhar, H., Yusuf, Z., Rob, W. B. Engineering novel traits in plants through RNA interference. Trends in Plant Science. 11 (11), 559-565 (2006).
- Marmonier, A., et al. In vitro acquisition of specific small interfering RNAs inhibits the expression of some target genes in the plant ectoparasite Xiphinema index. International Journal of Molecular Sciences. 20 (13), 3266 (2019).
- Iqbal, S., Fosu-Nyarko, J., Jones, M. G. K. Attempt to silence genes of the RNAi pathways of the root-knot nematode, Meloidogyne incognita results in diverse responses including increase and no change in expression of some genes. Frontiers in Plant Science. 11, 328 (2020).
- Zhou, L. F., et al. Molecular characterization and functional analysis of akt-1 in pinewood nematode, Bursaphelenchus xylophilus. Forest Pathology. 51 (1), 12647 (2021).
- Zhou, L. F., et al. The role of mab-3 in spermatogenesis and ontogenesis of pinewood nematode, Bursaphelenchus xylophilus. Pest Management Science. 77 (1), 138-147 (2021).
- Tang, J., et al. Bxy-fuca encoding α-L-fucosidase plays crucial roles in development and reproduction of the pathogenic pinewood nematode, Bursaphelenchus xylophilus. Pest Management Science. 76 (1), 205-214 (2020).
- Wang, J. H., et al. Molecular characterization and functional analysis of daf-8 in the pinewood nematode, Bursaphelenchus xylophilus. Journal of Forestry Research. , (2021).
- Viglierchio, D. R., Schmitt, R. V. On the methodology of nematode extraction from field samples: Baermann funnel modifications. Journal of Nematology. 15 (3), 438-444 (1983).
- Zhu, N., et al. Observation and quantification of mating behavior in the pinewood nematode, Bursaphelenchus xylophilus. Journal of Visualized Experiments: JoVE. (118), e54842 (2016).
- Zhou, L. F., Chen, F. M., Ye, J. R., Pan, H. Y. Selection of reliable reference genes for RT-qPCR analysis of Bursaphelenchus mucronatus gene expression from different habitats and developmental stages. Frontiers in Genetics. 9, 269-279 (2018).
- Wang, M., et al. Double-stranded RNA-mediated interference of dumpy genes in Bursaphelenchus xylophilus by feeding on filamentous fungal transformants. International Journal for Parasitology. 46 (5-6), 351-360 (2016).
- Ma, H. B., Lu, Q., Liang, J., Zhang, X. Y. Functional analysis of the cellulose gene of the pine wood nematode, Bursaphelenchus xylophilus, using RNA interference. Genetics and Molecular Research: GMR. 10 (3), 1931-1941 (2011).
- Cheng, X. Y., Dai, S. M., Xiao, L., Xie, B. Y. Influence of cellulase gene knock down by dsRNA interference on the development and reproduction of the pine wood nematode, Bursaphelenchus xylophilus. Nematology. 12 (12), 225-233 (2010).
- Xue, Q., Wu, X. Q., Zhang, W. J., Deng, L. N., Wu, M. M. Cathepsin L-like cysteine proteinase genes are associated with the development and pathogenicity of pine wood nematode, Bursaphelenchus xylophilus. International Journal of Molecular Sciences. 20 (1), 215 (2019).
- Tabara, H., Grishok, A., Mello, C. C. RNAi in C. elegans: Soaking in the genome sequence. Science. 282 (5388), 430-431 (1998).
- Urwin, P. E., Lilley, C. J., Atkinson, H. J. Ingestion of double-stranded RNA by pre parasitic juvenile cyst nematodes leads to RNA interference. Molecular Plant-Microbe Interactions: MPMI. 15 (8), 747-752 (2002).
- Bakhetia, M., Charlton, W., Atkinson, H. J., McPherson, M. J. RNA interference of dual oxidase in the plant nematode Meloidogyne incognita. Molecular Plant-Microbe Interactions: MPMI. 18 (10), 1099-1106 (2005).
- Rosso, M. N., Dubrana, M. P., Cimbolini, N., Jaubert, S., Abad, P. Application of RNA interference to root-knot nematode genes encoding esophageal gland proteins. Molecular Plant-Microbe Interactions: MPMI. 18 (7), 615-620 (2005).
- Chen, Q., Rehman, S., Smant, G., Jones, J. T. Functional analysis of pathogenicity proteins of the potato cyst nematode Globodera rostochiensis using RNAi. Molecular Plant-Microbe Interactions: MPMI. 18 (7), 621-625 (2005).
- Wang, D. D., Li, Y., Li, J., Xie, B. Y., Chen, G. H. Molecular clone and its RNAi interference effect analysis of mapk gene in Bursaphelenchus xylophilus ( in Chinese). Acta Phytopathologica Sinica. 46 (5), 662-669 (2016).
- Qiu, X., Wu, X., Huang, L., Ye, J. R. Influence of Bxpel1 gene silencing by dsRNA interference on the development and pathogenicity of the pine wood nematode, Bursaphelenchus xylophilus. International Journal of Molecular Sciences. 17 (1), 125 (2016).
- Dulovic, A., Streit, A. RNAi-mediated knockdown of daf-12 in the model parasitic nematode Strongyloides ratti. PLoS Pathogens. 15 (3), 1007705 (2019).
- Li, L., Zhao, H., Cui, Y., Wei, H., Li, M. Research progress of gene editing technology. Life Science Research. 21 (3), 268-274 (2017).
- Bindhya, C. Y., Karuppannan, V., Kuppuswamy, S. Host-generated double stranded RNA induces RNAi in plant-parasitic nematodes and protects the host from infection. Molecular and Biochemical Parasitology. 148 (2), 219-222 (2006).
- Jiang, Z., Sher, A. K., David, G. H., Ralph, B. Next-generation insect-resistant plants: RNAi-mediated crop protection. Trends in Biotechnology. 35 (9), 871-882 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены