Method Article
パインウッド線虫、ブルサフェレンコス・キシロフィルスにおけるRNA干渉の応用
要約
ここでは、遺伝子機能の研究を容易にするために、 ブルサフェレンコス・キシロフィルス におけるRNA干渉の詳細な浸漬方法を紹介します。
要約
マツノザイセンチュウ、Bursaphelenchus xylophilusは、世界で最も破壊的な侵入種の1つであり、松の木のしおれと最終的な死を引き起こします。経済的・環境的意義は認識されているものの、植物寄生線虫(PPN)の詳細な遺伝子機能を従来の順遺伝学やトランスジェニック法を用いて研究することは、これまで不可能であった。しかし、逆遺伝学技術として、RNA干渉(RNAi)は、B. xylophilusを含む線虫の機能遺伝子の研究を容易にする。
この論文では、他の病原性線虫の発生と繁殖に重要な役割を果たすことが報告されているB. xylophilusのppm-1遺伝子のRNAiの新しいプロトコルを概説する。RNAiについては、ポリメラーゼ連鎖反応(PCR)により標的断片の5'末端にT7プロモーターを連結し、インビトロ転写により二本鎖RNA(dsRNA)を合成した。続いて、dsRNA送達は、合成神経刺激剤と混合したdsRNA溶液に線虫を浸すことによって達成された。B. xylophilusの同期幼体(約20,000個体)を洗浄し、25°Cの暗所で24時間、浸漬バッファー中のdsRNA(0.8μg/mL)に浸した。
同量の線虫を、対照としてdsRNAを含まない浸漬緩衝液に入れた。一方、別の同量の線虫を、対照として緑色蛍光タンパク質(gfp)遺伝子dsRNAを含む浸漬緩衝液に入れた。浸漬後、標的転写産物の発現量を、リアルタイム定量PCRを用いて決定した。RNAiの効果は、表現型の顕微鏡観察および群間の成人の体の大きさの比較を用いて確認された。現在のプロトコルは、 B. xylophilus および他の寄生線虫の遺伝子の機能をよりよく理解するための研究を、遺伝子工学による制御戦略の開発に向けて進めるのに役立つ可能性がある。
概要
植物寄生性線虫(PPN)は、食料安全保障と森林生態系に対する継続的な脅威です。彼らは毎年推定1,000億米ドルの経済的損失を引き起こし、そのうち最も問題となるのは主に根結び線虫、嚢胞線虫、および松林線虫です。マツノザイセンチュウ、 Bursaphelenchus xylophilusは、渡り鳥、内寄生性線虫であり、これはマツ材線虫病2の原因病原体である。それは世界中の松林に大きな害を及ぼしています3.Van Megen et al.4の用語を使用すると、 B. xylophilus はParasitaphelenchidaeのメンバーであり、クレード10に属していますが、他のほとんどの主要な植物寄生虫はクレード12に属しています。
独立した最近進化した植物寄生虫として、 B. xylophilus は比較研究のための魅力的なモデルです。今日まで、クレード12に属する根結び線虫および嚢胞線虫に関する実質的な研究があり、これらは義務的で座りがちな内部寄生虫であり、最も激しく研究された線虫のいくつかである。しかし、この重要な分野でさらなる研究を行うことには、寄生遺伝子の機能が研究のボトルネックであるという大きな課題が伴います。機能研究には、一般に、異所性発現およびノックダウン/アウト実験が含まれるが、線虫の効果的な遺伝的形質転換プロトコルに依存する。その結果、PPNにおける逆遺伝学は、RNAiによる遺伝子サイレンシングにほぼ独占的に依存している。
RNAiは、真核細胞に広く存在するメカニズムで、二本鎖RNA(dsRNA)を導入することで遺伝子発現をサイレンシングします5。現在までに、dsRNAによって誘導される転写後遺伝子サイレンシング機構は、研究されたすべての真核生物において見出されており、RNAi技術は、機能ゲノミクス研究およびその他の応用のツールとして、多くの生物において急速に発展してきた。1998年に カエノラブディティス・エレガンス でRNAi機構が発見されて以来6、RNAi技術は線虫の遺伝子機能を同定するための有効な方法となり、病原性線虫を効果的に防除する新しい方法として提案されている7。
RNAiは技術的に容易にdsRNAに幼体を浸すのに十分である。しかしながら、このアプローチの有効性および再現性は、線虫種および標的遺伝子8によって大きく異なる。根結び線虫 Meloidogyne incognitaのRNAi経路に関与する20の遺伝子のサイレンシングを、長いdsRNAをトリガーとして用いて調査し、その結果、いくつかの遺伝子の発現の増加および変化なしを含む多様な応答をもたらした9。これらの結果は、標的遺伝子がRNAiノックダウンに対して異なる反応を示す可能性があり、RNAiを介した線虫防除の標的としての適合性の徹底的な評価を必要とすることを示している。しかし、現在、 B. xylophilusの発生および生殖生物学に関する研究は不足しています。
以前の研究10、11、12、13の続きとして、dsRNAの合成、合成神経刺激剤浸漬、定量的ポリメラーゼ連鎖反応(qPCR)検出を含む、B. xylophilusのppm-1遺伝子の機能を研究するためにRNAiを適用するためのプロトコルをここで説明する。この実験的アプローチから得られた知識は、基本的な生物学的システムの理解と松枯れ症の予防に著しく貢献する可能性が高い。
プロトコル
この研究は、浙江省農林大学の動物実験評議会によって承認されました。 B. xylophilus 分離NXY61は、もともと中国浙江省の寧波地域にある病気の Pinus massoniana から抽出されました11。
1. 遺伝子クローニング
注: このプロトコルで使用されるプライマーの詳細については、 材料表 を参照してください。
- 線虫を集める。
- ジャガイモデキストロース寒天(PDA)プレート上の灰色かび病菌の菌糸体上のB.キシロフィラス株を25°Cで3〜5日間培養する。
- ベルマン漏斗法14を用いて線虫を採取する。
- クランプされたゴムチューブを漏斗の下に置き、漏斗の口に2層のろ紙を置きます。真菌培養物を漏斗に移し、水を加えて真菌マットを浸す。2時間待ってから、線虫を集める。
- 全RNA抽出試薬( 材料表参照)11 を用いて線虫から全RNAを抽出し、以下の工程に従って抽出する。
- 500 μL の抽出試薬と 100 μL の磁気ビーズを 2 mL の遠沈管に加えます。線虫の20μLを吸引し、サンプルをグラインダーに移し、9,000 × g で30秒間粉砕する。5分間インキュベートし、次いで12,000 × g および4°Cで10分間遠心分離する。
- 上清を新しい遠沈管に移す。クロロホルムを100μL加え、チューブにキャップを掛け、チューブを数回ひっくり返して混合する。3分間インキュベートした後、4°Cで12,000× g で10分間遠心分離する。
- 上清を新しい遠沈管に移す。イソプロピルアルコール250μLを加え、激しく渦を巻きます。12,000 × g で10分間遠心分離する。
- 上清を捨てる。500 μL の 75% エタノールを加えて RNA を洗浄し、サンプルをボルテックスします。12,000 × g および4°Cで5分間遠心分離する。
- RNAペレットを5分間風乾する。
- ペレットを30 μLのRNaseフリー水に再懸濁します。
- 40 = μg RNA/mL のA260 ×希釈×式を使用して RNA 濃度を計算します。A260/A280 比を計算します。
注: ~2 の比率は純粋であると見なされます。
- 良質なRNAの逆転写を行い、cDNA鋳型を得る。
- 一対の特異的プライマーppm-1-F/R(材料表参照)を設計して使用し、B. xylophilus(GenBankアクセッション番号QTZ96795)のBx-ppm-1遺伝子の部分コード配列を増幅します。
- ppm-1遺伝子配列を、標準クローニングプロトコル11に従ってT7プロモーターを含むpGEM-Teasyベクターにクローニングする。
- PCR 反応は、2 μL の cDNA、25 μL の 2x Ex Taq ポリメラーゼプレミックス、2 μL の各プライマー (10 pmol/l)、滅菌蒸留水を最終容量 50 μL になるようにセットアップします。
- 以下のように増幅手順を行う:94°Cで5分間;続いて、94°Cで30秒、55°Cで30秒、72°Cで1分のサイクルを35サイクル繰り返しました。72°Cで5分間の最終伸長工程を行った。
- 増幅産物をシーケンシング用のpGEM-T Easyベクターにクローニングします。
2. dsRNAの合成
- 両末端にT7プロモーター部位を付加するように設計されたプライマーを用いたPCRを用いて、dsRNA合成用のDNAテンプレートを調製する。プライマーの5'末端にT7プロモーター配列を付加する。
- ppm-1遺伝子断片(894 bp)を含むプラスミドをPCRの鋳型として使用し、T7プロモーター11を含む断片を回収する。上記のPCR手順およびシステムを使用する。
- インビトロ転写キットを使用してdsRNA11を合成します。
- 凍結した試薬を氷上で解凍する。
- 10 x 反応バッファー 2 μL、酵素ミックス 2 μL、および DNA 1 μg を遠沈管に加えます。ヌクレアーゼフリーの水を加えて、標準的な4μLの反応を生じさせる。次いで、等量の4つのリボヌクレオチド溶液(ATP、CTP、GTP、およびUTP)を一緒に混合し、混合物の8μLをチューブに加える。十分に混合し、37°Cで4時間インキュベートする。
- 1 μLのDNaseを加え、よく混合し、37°Cで15分間インキュベートする。
- 反応を停止し、ヌクレアーゼフリー水30 μLおよびLiCl沈殿溶液30 μLを加えてRNAを沈殿させた。徹底的に混ぜる。-20°Cで一晩インキュベートする。
- 遠心分離機を12,000 × g および4°Cで15分間遠心分離する。 上清を捨てる。
- 1mLの75%エタノールを加えてRNAを洗浄する。試料をボルテックスし、12,000 × g および4°Cで10分間遠心分離する。
- RNAペレットを3分間風乾する。
- ペレットを30 μLのRNaseフリー水に再懸濁します。
- 分光光度計を用いてdsRNAの品質を分析する。dsRNAサンプル1 μLを測定台座上にピペットで入れ、波長を340 nmに設定した。1.0%アガロースゲルで製品を視覚化します。
3. 浸漬によるRNAi
- 4 μL の 5x 浸漬バッファー (0.05% ゼラチン、5.5 mM KH 2 PO 4、2.1 mM NaCl、4.7 mM NH4 Cl、3 mM スペルミジン) をdsRNA および ddH2O と混合し、全量 20 μL、最終RNA 濃度 0.8 μg/mL を生成します。
- J2幼虫を獲得する。
- 真菌培養物から線虫を収集し、直径6cmのガラス製ペトリ皿に移す。線虫が自由に泳ぐことができるように、皿に10mLの水を加える。線虫を皿に30分間保管し、卵が底に付着するのを待ちます。
- 水と線虫を慎重に取り除き、卵を邪魔しないようにしてください。すべての幼虫と成虫が取り除かれるまで手順を繰り返し、卵だけを皿に残します。
- 採取した卵を25°Cの暗所で24時間孵化させ、J2幼虫を得た。J2幼虫を集めてチューブに入れ、RNAi実験15のためにddH2Oで3回洗浄する。
- DsRNA溶液を入れた2mLチューブにJ2幼虫を移し、レゾルシノール溶液(ブリキ箔で包んで水に溶解)を加えて最終濃度1.0%とした。幼虫がdsRNAを効果的に吸収することを確実にするために、25°Cで24時間、振動台上で15×g の遠心分離で幼虫をインキュベートする。
- 同量の線虫を、dsRNAプローブを使用せずに、または対照としてGFP dsRNAプローブを使用して浸漬バッファーに浸します。GFP遺伝子(gfp、M62653.1)を非内在性コントロールとして使用し、遺伝子特異的プライマーT7-GFP-F/Rを用いてgfpのdsRNAを合成する。
4. qPCR 検出
- J2幼虫をddH2Oで洗浄し、標的遺伝子干渉、GFP遺伝子干渉、および妨害されていない対照群を含む。上述の方法を用いて各群から全RNAを抽出する。
- qPCR を開始します。
- q-ppm-1-F/Rプライマーを目的のソフトウェアを使用して設計します(材料表を参照)。
- 1 μL の cDNA、6 μL の蛍光プレミックス、0.4 μL の各プライマー (10 pmol/l)、および滅菌蒸留水を含む 12 μL で qPCR 反応をセットアップします。
- 次のようにqPCRを実行します:95°Cで2分間;その後、95°Cで10秒、55°Cで30秒、72°Cで1分のサイクルを40サイクル行った。
- actb遺伝子(GenBank受託番号EU100952)やtbb-2遺伝子(GenBank受託番号MT769316)、またはその他の遺伝子を内部参照遺伝子として用い、RNAi15後の遺伝子発現量の変化を評価した。
- サイクル閾値(Ct)値と溶解曲線に従って、2-ΔΔCt 法を用いて標的遺伝子の相対発現量を推定し、干渉効率を検証します。
- 標的遺伝子のCt値から各試料の内部参照遺伝子のCt値を減算し、ΔCt値を求めた。そして、対照群のΔCt値から干渉群のΔCt値を減算し、ΔΔCt値を求める。
メモ: 0 より大きい ΔΔCt 値は、干渉が有効であることを示します。
- 標的遺伝子のCt値から各試料の内部参照遺伝子のCt値を減算し、ΔCt値を求めた。そして、対照群のΔCt値から干渉群のΔCt値を減算し、ΔΔCt値を求める。
5. RNAiに続く線虫成虫の体長の評価
- RNAi後、J2幼虫を B.シネレア 芝生上で成虫になるまでPDAプレート中で25°Cで60時間培養する。
- ベルマン漏斗法(ステップ1.1.2.1参照)14を使用して成虫を集める。
- 顕微鏡下で成虫線虫の画像を取得し、ImageJソフトウェア(または他の測定ソフトウェア)を使用して体長を測定します。
- ImageJ を使用して長さを測定するには、[ |を解析] を選択します。スケールを設定します。距離がわかっている場合は、描画された直線の長さの値を入力します。長さの単位を入力します。
- [グローバル] チェック ボックスをオンにし (すべての画像にこの標準を使用)、 [OK] をクリックして、測定する画像に直線で測定する長さを選択します。
- Ctrl+M (測定) コマンドを使用して結果を表示し、結果ウィンドウに記録します。
- 統計分析のために50匹の雄線虫と50匹の雌線虫の測定を行う12。
- 各サンプルの平均と標準偏差を計算してデータを分析します。スチューデントのt検定を使用して、異なるグループのサンプルの平均を比較し ます。
結果
RNAi後のB.キシロフィルスのppm-1発現の解析
GFP dsRNAを浸したB.キシロフィラスのppm-1遺伝子の相対発現量と、標的遺伝子dsRNAを浸したものの相対発現量は、それぞれ0.92および0.52であった(ddH2O処理対照群のppm-1遺伝子発現量を1とした)(図1)。したがって、外因性dsRNAは、B.キシロフィルスのppm-1発現に影響を及ぼさない。しかしながら、ppm-1 dsRNAは、標的遺伝子の発現を効果的に阻害することができる。
B.キシロフィルスの成長および発達に対するppm-1発現の効果
RNAiの後、成体のサイズは著しく減少し(図2)、SMA(小さな体サイズの)変異表現型が生じた。RNAi治療を受けた個体は性的成熟期に発達したが、その体長は正常な成人よりもかなり小さかった。具体的には、J2期線虫におけるRNAi後、雌および雄の平均体長は、それぞれ544.61μmおよび526.24μmであった。対照的に、対照群の女性および男性の平均体長は、それぞれ971.86μmおよび912.31μmであり(図3)、有意差(P =0.0322)を表す。
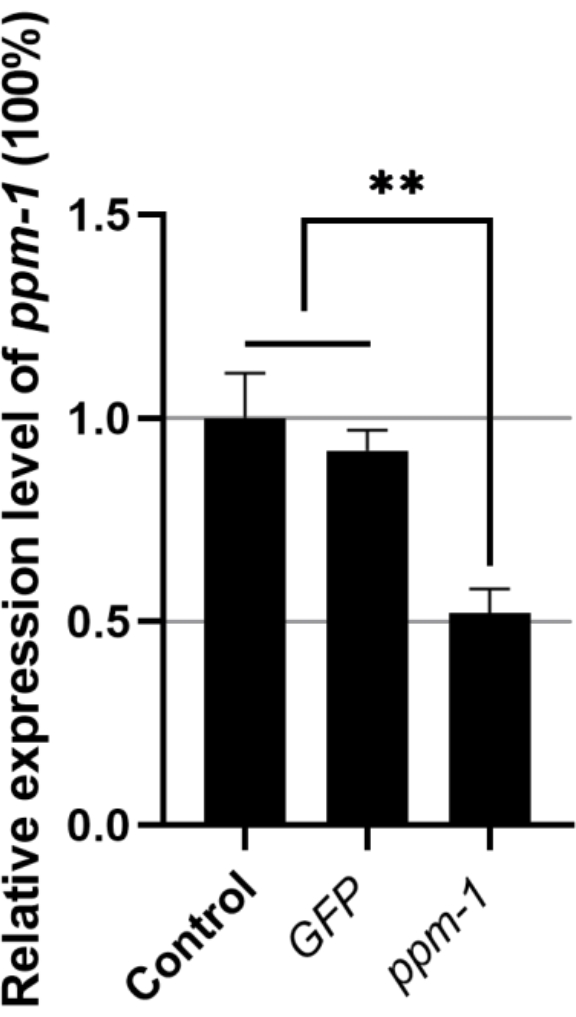
図1:ブルサフェレンコス・キシロフィルスのRNAiに続くppm-1遺伝子の発現。 **P < 0.001 です。略語: RNAi = RNA干渉;GFP = 緑色蛍光タンパク質。この図の拡大版を表示するには、ここをクリックしてください。

図2:ブルサフェレンコス・キシロフィルスにおけるppm-1の干渉後の成人の体長減少。 RNAi群の成人男性(A)および女性(C)の画像。対照群の成人男性(B)および女性(D)の画像。スケールバー = 50 μm。略語: RNAi = RNA 干渉。この図の拡大版を表示するには、ここをクリックしてください。
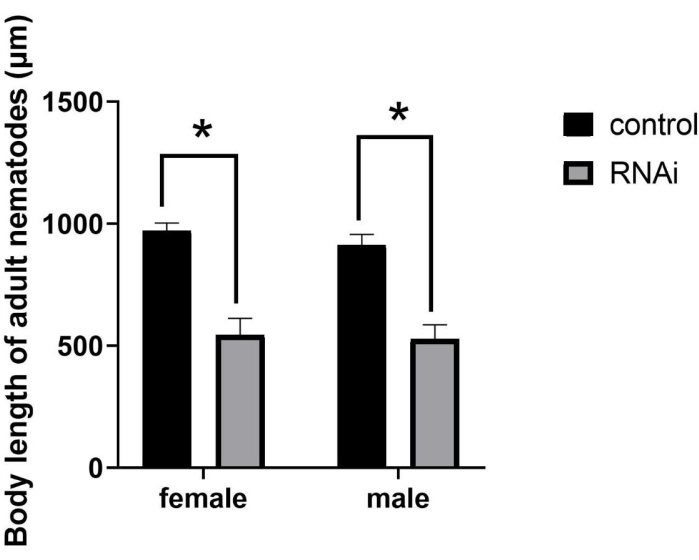
図3:ppm-1遺伝子のRNAi後のブルサフェレンコス・キシロフィルスの成人の体長の定量化と統計解析。 (*P = 0.0322)略語: RNAi = RNA 干渉。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
B. xylophilusの生活史や寄生環境は他の線虫の生活史や寄生環境は異なりますが、この植物病原菌の分子病因に関する研究は限られてきました。 C. elegansおよび他の線虫におけるCRISPR/Cas9ゲノム編集技術の適用において大きな進歩があったにもかかわらず、B. xylophilusに適用されたRNAi技術のみが現在までに公開されている17。RNAiは線虫の遺伝子機能を研究するために利用可能な最も強力なツールの1つであり、B. xylophilus遺伝子機能、シグナル伝達経路、および遺伝子治療を解明する研究に広く使用されている18,19,20。無脊椎動物モデルで使用される遺伝子ノックアウトアプローチとは対照的に、線虫における標的遺伝子のRNAi媒介ノックダウンは、遺伝子機能の迅速な評価を可能にする。
C. elegansでRNAiを行うには、注射6、浸漬21、摂食6の3つの方法があります。J2幼虫は感染後にのみ餌をやるので、植物寄生線虫のRNAiには通常浸漬法が用いられる。浸漬法における重要なステップは、線虫を刺激して摂食させる神経剤を添加することである。アーウィンは最初にオクトパミンを使用して、2つの口腔嚢胞線虫種、Globodera pallida、およびHeterodera glycinesのJ2を刺激し、その結果、浸漬溶液22からのdsRNAの取り込みをもたらした。同じ方法が、根結び線虫メロイドギン・インコグニータのJ2を誘導してdsRNA23を吸収させるために首尾よく用いられている。レゾルシノールはまた、M. incognitaのJ2によるdsRNAの取り込みを誘導することができ、この線虫24に対してタコパミンよりも効果的であり得る。さらに、長いインキュベーション時間を有する浸漬緩衝液へのスペルミジンの添加は、線虫25におけるRNAiの効率を改善した。浸漬の24時間後、dsRNAは効果的にB.キシロフィルスに入り、それによってppm-1遺伝子をサイレンシングする。
したがって、このプロトコールは、貪食作用を有する他の植物寄生線虫のRNAiの将来の研究のための参照を提供する。また、振動台による吊り下げ効果は、浸漬法の利点を最大限に引き出す上で重要な役割を果たしている。この方法は、多数の線虫の同時処理を可能にすることができる。RNAiは、変異体が得られにくい標的遺伝子に着目し、線虫はどのライフステージでも浸すことができるため、発生のさまざまな時点での効果を評価すると、操作が容易になります。したがって、RNAiは、特定の発生段階における特定の遺伝子の機能を研究するために使用することができる。Wangらは、dsRNA浸漬を用いて、B. xylophilusの繁殖力に対するMAPKの影響と線虫の成長と発達におけるその重要な役割を分析した26。Qiuらは、Bxpel1遺伝子のダウンレギュレーション後に、松の木におけるB. xylophilusの移動速度と繁殖力が低下することを発見し、これはこの遺伝子がB. xylophilusの重要な病原性因子であることを示している27。
しかし、線虫中のすべてのRNAiがdsRNAを介して機能するわけではない。DulovicとStreitは、より長いdsRNAではなく小さな干渉RNA(siRNA)を適用して 、Strongyloides ratti28の干渉に成功した。 ストロンギロイデス におけるRNAiにdsRNAを使用することの制限は、dsRNAの取り込みに関与することが知られている rsd-6、sid-1、または sid-2 などの遺伝子が存在しないことに関連している可能性がある。RNAiはまた、位置的効果および一時的で不完全なノックアウトの欠点と関連しており、一部の遺伝子および細胞型(ニューロンなど)に対して有効性が限られている29。しかし、 B. xylophilus のトランスジェニック技術のブレークスルーが達成されるまで、RNAiは比較的効果的な研究戦略を表しています。
RNAiは作物保護に大きな可能性を示しています。RNAi技術を用いて、根結び線虫遺伝子を標的とするdsRNAを産生することができるトランスジェニックジャガイモが、根結び線虫に対する完全な耐性を産生するように飼育されている30。昆虫遺伝子を標的とするdsRNAの発現は、化学殺虫剤の非存在下で作物保護を提供することができ、ほぼ無制限の数の標的遺伝子を有する外来タンパク質を産生しないというさらなる利点を提供する31。したがって、有害生物防除のための応用RNAiの分野における加速された研究は、トランスジェニック法または他の化学的防除方法よりも植物線虫防除のためのより良いバイオセキュリティを提供するであろう。
結論として、このプロトコールは、B. xylophilusの幼虫をdsRNA溶液に直接浸すことによってRNAiを達成するppm−1遺伝子のdsRNAの調製を記載する。この干渉効果は、成虫に発達した後の幼虫の体の大きさが対照と比較して有意に減少したことに基づいて確認され、ppm-1遺伝子がB. xylophilusの成長および発達に効果を発揮することが実証された。この研究は、ppm-1の機能をさらに明らかにするための理論的基礎を提供し、この植物寄生虫の生物学的防除を導く上でさらなる実用的価値を提供する。RNAi技術メカニズムのさらなる開示と改善により、B. xylophilus制御の分野におけるその応用は広い見通しを持つと考えられている。
開示事項
利益相反は宣言されませんでした。
謝辞
この研究は、中国国家自然科学財団(31870637、31200487)から資金提供を受け、浙江省主要研究計画(2019C02024、LGN22C160004)によって共同出資されました。
資料
| Name | Company | Catalog Number | Comments |
| Baermann funnel | n/a | n/a | to isolate nematodes |
| Beacon Designer 7.9 | Shanghai kangyusheng information technology co. | n/a | to design qPCR primers |
| Botrytis cinerea | n/a | n/a | as food for nematodes |
| Bursaphelenchus xylophilus | n/a | n/a | its number was NXY61 and was it was originally extracted from diseased Pinus massoniana in Ningbo, Zhejiang province, China. |
| constant temperature incubator | Shanghai Jing Hong Laboratory Instrument Co. | H1703544 | to cultur nematodes |
| Electrophoresis apparatus | Bio-Rad Laboratories | 1704466 | to achieve electrophoretic analysis |
| Ethanol, 75% | Sinopharm Chemical Reagent Co. | 80176961 | to extract RNA |
| Ex Taq Polymerase Premix | Takara Bio Inc. | RR030A | for PCR |
| Ex Taq Polymerase Premix | Takara Bio Inc. | RR390A | for PCR |
| Gel imager | LongGene Scientific Instruments Co. | LG2020 | to make nucleic acid bands visible |
| GraphPad Prism 8 | GraphPad Prism | n/a | to analyze the data and make figurs |
| High Speed Centrifuge | Hangzhou Allsheng Instruments Co. | AS0813000 | centrifug |
| High-flux tissue grinder | Bertin | to extract RNA | |
| ImageJ software | National Institutes of Health | n/a | to measure the body lengths |
| isopropyl alcohol | Shanghai Aladdin Biochemical Technology Co. | L1909022 | to extract RNA |
| Leica DM4B microscope | Leica Microsystems Inc. | to observe nematodes | |
| magnetic beads | Aoran science technology co. | 150010C | to extract RNA |
| MEGAscript T7 High Yield Transcription Kit | Thermo Fisher Scientific Inc. | AM1333 | to synthesize dsRNA in vitro |
| NanoDrop ND-2000 spectrophotometer | Thermo Fisher Scientific Inc. | NanoDrop 2000/2000C | to analyze the quality of the dsRNA |
| PCR Amplifier | Bio-Rad Life Medical Products Co. | 1851148 | to amplify nucleic acid sequence |
| Petri dishes | n/a | n/a | to cultur nematodes |
| pGEM-T Easy vector | Promega Corporation | A1360 | for cloning |
| Potato Dextrose Agar (Medium) | n/a | n/a | to cultur Botrytis cinerea |
| Prime Script RT reagent Kit with gDNA Eraser | Takara Bio Inc. | RR047B | to synthetic cDNA |
| Primer Premier 5.0 | PREMIER Biosoft | n/a | to design PCR primers |
| primers:ppm-1-F/R | Tsingke Biotechnology Co. | n/a | F: 5'-GATGCGAAGTTGCCAATCATTCT -3'; R: 5'- CCAGATCCAGTCCACCATACACC -3 |
| q-ppm-1-F/R | Tsingke Biotechnology Co. | n/a | F: 5'-CATCCGAATGGCAATACAG-3'; R: 5'-ACTATCCTCAGCGTTAGC-3' |
| Real-time thermal cycler qTOWER 2.2 | Analytique Jena Instruments (Beijing) Co. | for qPCR | |
| shaking table | Shanghai Zhicheng analytical instrument manufacturing co. | to soak nematodes | |
| stereoscopic microscope | Chongqing Optec Instrument Co. | 1814120 | to observe nematodes |
| T7-GFP-F/R | Tsingke Biotechnology Co. | n/a | F: 5'-TAATACGACTCACTATAGGGAAA GGAGAAGAACTTTTCAC-3'; R: 5'-TAATACGACTCACTATAGGGCTG TTACAAACTCAAGAAGG-3' |
| T7 promoter | Tsingke Biotechnology Co. | n/a | TAATACGACTCACTATAGGG |
| Takara MiniBEST Agarose Gel DNA Extraction Kit | Takara Bio Inc. | 9762 | to recover DNA |
| TaKaRa TB Green Premix Ex Taq (Tli RNaseH Plus) | Takara Bio Inc. | RR820A | for qPCR |
| trichloroethane | Shanghai LingFeng Chemical Reagent Co. | to extract RNA | |
| TRIzol Reagent | Thermo Fisher Scientific Inc. | 15596026 | total RNA extraction reagent,to extract RNA |
参考文献
- Nicol, J. M., Jones, J., Gheysen, G., Fenoll, C., et al. Current nematode threats to world agriculture. Genomics and Molecular Genetics of Plant-Nematode Interactions. , 21-43 (2011).
- Jones, J. T., et al. Top 10 plant-parasitic nematodes in molecular plant pathology. Molecular Plant Pathology. 14 (9), 946-961 (2013).
- Kikuchi, T., et al. Genomic insights into the origin of parasitism in the emerging plant pathogen Bursaphelenchus xylophilus. PLoS Pathogens. 7 (9), 1002219 (2011).
- Megen, H. V., et al. A phylogenetic tree of nematodes based on about 1200 full-length small subunit ribosomal DNA sequences. Nematology. 11 (6), 927-950 (2009).
- Niu, J. H., Jian, H., Xu, J. M., Guo, Y. D., Liu, Q. RNAi technology extends its reach: Engineering plant resistance against harmful eukaryotes. African Journal of Biotechnology. 9 (45), 7573-7582 (2010).
- Fire, A., et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 91 (6669), 806-811 (1998).
- Shahid, M., Imran, A., Mazhar, H., Yusuf, Z., Rob, W. B. Engineering novel traits in plants through RNA interference. Trends in Plant Science. 11 (11), 559-565 (2006).
- Marmonier, A., et al. In vitro acquisition of specific small interfering RNAs inhibits the expression of some target genes in the plant ectoparasite Xiphinema index. International Journal of Molecular Sciences. 20 (13), 3266 (2019).
- Iqbal, S., Fosu-Nyarko, J., Jones, M. G. K. Attempt to silence genes of the RNAi pathways of the root-knot nematode, Meloidogyne incognita results in diverse responses including increase and no change in expression of some genes. Frontiers in Plant Science. 11, 328 (2020).
- Zhou, L. F., et al. Molecular characterization and functional analysis of akt-1 in pinewood nematode, Bursaphelenchus xylophilus. Forest Pathology. 51 (1), 12647 (2021).
- Zhou, L. F., et al. The role of mab-3 in spermatogenesis and ontogenesis of pinewood nematode, Bursaphelenchus xylophilus. Pest Management Science. 77 (1), 138-147 (2021).
- Tang, J., et al. Bxy-fuca encoding α-L-fucosidase plays crucial roles in development and reproduction of the pathogenic pinewood nematode, Bursaphelenchus xylophilus. Pest Management Science. 76 (1), 205-214 (2020).
- Wang, J. H., et al. Molecular characterization and functional analysis of daf-8 in the pinewood nematode, Bursaphelenchus xylophilus. Journal of Forestry Research. , (2021).
- Viglierchio, D. R., Schmitt, R. V. On the methodology of nematode extraction from field samples: Baermann funnel modifications. Journal of Nematology. 15 (3), 438-444 (1983).
- Zhu, N., et al. Observation and quantification of mating behavior in the pinewood nematode, Bursaphelenchus xylophilus. Journal of Visualized Experiments: JoVE. (118), e54842 (2016).
- Zhou, L. F., Chen, F. M., Ye, J. R., Pan, H. Y. Selection of reliable reference genes for RT-qPCR analysis of Bursaphelenchus mucronatus gene expression from different habitats and developmental stages. Frontiers in Genetics. 9, 269-279 (2018).
- Wang, M., et al. Double-stranded RNA-mediated interference of dumpy genes in Bursaphelenchus xylophilus by feeding on filamentous fungal transformants. International Journal for Parasitology. 46 (5-6), 351-360 (2016).
- Ma, H. B., Lu, Q., Liang, J., Zhang, X. Y. Functional analysis of the cellulose gene of the pine wood nematode, Bursaphelenchus xylophilus, using RNA interference. Genetics and Molecular Research: GMR. 10 (3), 1931-1941 (2011).
- Cheng, X. Y., Dai, S. M., Xiao, L., Xie, B. Y. Influence of cellulase gene knock down by dsRNA interference on the development and reproduction of the pine wood nematode, Bursaphelenchus xylophilus. Nematology. 12 (12), 225-233 (2010).
- Xue, Q., Wu, X. Q., Zhang, W. J., Deng, L. N., Wu, M. M. Cathepsin L-like cysteine proteinase genes are associated with the development and pathogenicity of pine wood nematode, Bursaphelenchus xylophilus. International Journal of Molecular Sciences. 20 (1), 215 (2019).
- Tabara, H., Grishok, A., Mello, C. C. RNAi in C. elegans: Soaking in the genome sequence. Science. 282 (5388), 430-431 (1998).
- Urwin, P. E., Lilley, C. J., Atkinson, H. J. Ingestion of double-stranded RNA by pre parasitic juvenile cyst nematodes leads to RNA interference. Molecular Plant-Microbe Interactions: MPMI. 15 (8), 747-752 (2002).
- Bakhetia, M., Charlton, W., Atkinson, H. J., McPherson, M. J. RNA interference of dual oxidase in the plant nematode Meloidogyne incognita. Molecular Plant-Microbe Interactions: MPMI. 18 (10), 1099-1106 (2005).
- Rosso, M. N., Dubrana, M. P., Cimbolini, N., Jaubert, S., Abad, P. Application of RNA interference to root-knot nematode genes encoding esophageal gland proteins. Molecular Plant-Microbe Interactions: MPMI. 18 (7), 615-620 (2005).
- Chen, Q., Rehman, S., Smant, G., Jones, J. T. Functional analysis of pathogenicity proteins of the potato cyst nematode Globodera rostochiensis using RNAi. Molecular Plant-Microbe Interactions: MPMI. 18 (7), 621-625 (2005).
- Wang, D. D., Li, Y., Li, J., Xie, B. Y., Chen, G. H. Molecular clone and its RNAi interference effect analysis of mapk gene in Bursaphelenchus xylophilus ( in Chinese). Acta Phytopathologica Sinica. 46 (5), 662-669 (2016).
- Qiu, X., Wu, X., Huang, L., Ye, J. R. Influence of Bxpel1 gene silencing by dsRNA interference on the development and pathogenicity of the pine wood nematode, Bursaphelenchus xylophilus. International Journal of Molecular Sciences. 17 (1), 125 (2016).
- Dulovic, A., Streit, A. RNAi-mediated knockdown of daf-12 in the model parasitic nematode Strongyloides ratti. PLoS Pathogens. 15 (3), 1007705 (2019).
- Li, L., Zhao, H., Cui, Y., Wei, H., Li, M. Research progress of gene editing technology. Life Science Research. 21 (3), 268-274 (2017).
- Bindhya, C. Y., Karuppannan, V., Kuppuswamy, S. Host-generated double stranded RNA induces RNAi in plant-parasitic nematodes and protects the host from infection. Molecular and Biochemical Parasitology. 148 (2), 219-222 (2006).
- Jiang, Z., Sher, A. K., David, G. H., Ralph, B. Next-generation insect-resistant plants: RNAi-mediated crop protection. Trends in Biotechnology. 35 (9), 871-882 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved