Method Article
יישום של הפרעת RNA בנמטודת אורן, בורסהפלנצ'וס קסילופילוס
In This Article
Summary
כאן, אנו מציגים שיטת השרייה מפורטת של הפרעת RNA ב Bursaphelenchus xylophilus כדי להקל על המחקר של תפקודי גנים.
Abstract
נמטודת עצי האורן, Bursaphelenchus xylophilus, היא אחד המינים הפולשים ההרסניים ביותר בעולם, וגורמת בסופו של דבר למותם של עצי אורן. למרות ההכרה בחשיבותם הכלכלית והסביבתית, עד כה לא ניתן היה לחקור את תפקודי הגנים המפורטים של נמטודות טפיליות צמחיות (PPNs) באמצעות גנטיקה קונבנציונלית קדימה ושיטות מהונדסות. עם זאת, כטכנולוגיה של גנטיקה הפוכה, הפרעות RNA (RNAi) מקלות על חקר הגנים הפונקציונליים של נמטודות, כולל B. xylophilus.
מאמר זה מתווה פרוטוקול חדש ל-RNAi של הגן ppm-1 ב-B . xylophilus, אשר דווח כי הוא ממלא תפקידים מכריעים בהתפתחות וברבייה של נמטודות פתוגניות אחרות. עבור RNAi, מקדם T7 היה מקושר למסוף 5′ של מקטע המטרה על ידי תגובת שרשרת פולימראז (PCR), ורנ"א דו-גדילי (dsRNA) סונתז על ידי שעתוק במבחנה . לאחר מכן, אספקת dsRNA הושגה על ידי השריית הנמטודות בתמיסת dsRNA מעורבבת עם נוירוסטימולנטים סינתטיים. צעירים מסונכרנים של B. xylophilus (כ-20,000 פרטים) נשטפו והושרו ב-dsRNA (0.8 מיקרוגרם/מ"ל) במאגר ההשריה במשך 24 שעות בחושך בטמפרטורה של 25 מעלות צלזיוס.
אותה כמות של נמטודות הוכנסה למאגר ספוג ללא dsRNA כבקרה. בינתיים, כמות זהה נוספת של נמטודות הוכנסה למאגר ספוג עם הגן dsRNA של חלבון פלואורסצנטי ירוק (gfp) כבקרה. לאחר ההשרייה, רמת הביטוי של תמלילי היעד נקבעה באמצעות PCR כמותי בזמן אמת. ההשפעות של RNAi אושרו לאחר מכן באמצעות תצפית מיקרוסקופית של הפנוטיפים והשוואה של גודל הגוף של המבוגרים בין הקבוצות. הפרוטוקול הנוכחי יכול לסייע בקידום המחקר כדי להבין טוב יותר את תפקודם של הגנים של B. xylophilus ונמטודות טפיליות אחרות לקראת פיתוח אסטרטגיות בקרה באמצעות הנדסה גנטית.
Introduction
נמטודות טפיליות-צמחיות (PPNs) מהוות איום מתמשך על ביטחון המזון ועל המערכות האקולוגיות של היערות. הם גורמים להפסדים כלכליים של כ-100 מיליארד דולר בכל שנה1, כאשר הבעייתיים שבהם הם בעיקר נמטודות שורשים, נמטודות ציסטות ונמטודות מעץ אורן. נמטודת עץ האורן, Bursaphelenchus xylophilus, היא נמטודה נודדת, אנדופרזיטית, שהיא הפתוגן הסיבתי של מחלת אורן נבול2. הוא גרם נזק רב ליערות אורנים ברחבי העולם3. אם נשתמש בטרמינולוגיה של Van Megen et al.4, B. xylophilus הוא חבר ב-Parasitaphelenchidae ושייך לקלייד 10, בעוד שרוב טפילי הצמחים הגדולים האחרים שייכים לקלייד 12.
כטפיל צמחי עצמאי שהתפתח לאחרונה, ב. קסילופילוס הוא מודל אטרקטיבי למחקרים השוואתיים. עד כה, היה מחקר משמעותי על נמטודות קשר שורש ונמטודות ציסטות השייכות לקלייד 12, שהן אנדופרזיטים מחייבים, בישיבה והן חלק מהנמטודות הנחקרות ביותר. עם זאת, ביצוע מחקר נוסף בתחום חשוב זה טומן בחובו אתגר גדול: תפקודם של גנים של טפילות הוא צוואר בקבוק מחקרי. מחקרים פונקציונליים כוללים בדרך כלל ביטוי חוץ רחמי וניסויי נוק-דאון/אאוט, אך מסתמכים על פרוטוקולי טרנספורמציה גנטית יעילים עבור הנמטודה. כתוצאה מכך, גנטיקה הפוכה ב-PPNs מסתמכת כמעט אך ורק על השתקת גנים על ידי RNAi.
RNAi, מנגנון הקיים באופן נרחב בתאים אאוקריוטים, משתיק ביטוי גנים על ידי החדרת RNA דו-גדילי (dsRNA)5. עד כה, מנגנון השתקת הגנים שלאחר ההדבקה המושרה על ידי dsRNA נמצא בכל האאוקריוטים שנחקרו, וטכנולוגיית RNAi, ככלי למחקר גנומי פונקציונלי ויישומים אחרים, התפתחה במהירות באורגניזמים רבים. מאז גילוי מכונות ה- RNAi ב- Caenorhabditis elegans בשנת 19986, טכניקות RNAi הפכו לשיטות יעילות לזיהוי תפקוד הגן של נמטודות ומוצעות כדרך חדשה לשלוט ביעילות בנמטודות פתוגניות7.
מבחינה טכנית, ה-RNAi סופג את הצעירים ב-dsRNA; עם זאת, היעילות והשכפול של גישה זו משתנות מאוד עם מיני הנמטודות ועם גן המטרה8. השתקה של 20 גנים המעורבים במסלולי ה-RNAi של נמטודת קשר השורש, Meloidogyne incognita, נחקרה באמצעות dsRNAs ארוכים כטריגרים, וכתוצאה מכך תגובות מגוונות, כולל עלייה וללא שינוי בביטוי של גנים מסוימים9. תוצאות אלה מראות כי גני מטרה עשויים להגיב להפלת RNAi באופן שונה, מה שמחייב הערכה ממצה של התאמתם כמטרות לבקרת נמטודות באמצעות RNAi. עם זאת, יש כיום מיעוט של מחקר על הביולוגיה ההתפתחותית והרבייה של ב 'קסילופילוס.
כהמשך לעבודה קודמת10,11,12,13, אנו מתארים כאן פרוטוקול ליישום RNAi כדי לחקור את תפקוד הגן ppm-1 של B. xylophilus, כולל סינתזה של dsRNA, השריית נוירוסטימולנטים סינתטיים וזיהוי תגובת שרשרת פולימראז כמותית (qPCR). הידע שיתקבל מגישה ניסיונית זו צפוי לתרום רבות להבנת מערכות ביולוגיות בסיסיות ולמניעת מחלת האורנים.
Protocol
המחקר אושר על ידי המועצה לניסויים בבעלי חיים של אוניברסיטת ג'ג'יאנג לחקלאות וייעור. B. xylophilus מבודד NXY61 הופק במקור מפינוס מסוניאנה חולה באזור נינגבו במחוז ג'ה-ג'יאנג, סין11.
1. שיבוט גנים
הערה: עיין בטבלת החומרים לקבלת פרטים על הפריימרים המשמשים בפרוטוקול זה.
- לאסוף נמטודות.
- תרבית את זן B. xylophilus על התפטיר של Botrytis cinerea על צלחות דקסטרוז אגר תפוחי אדמה (PDA) ב 25 מעלות צלזיוס במשך 3-5 ימים.
- אסוף את הנמטודות בשיטת משפך בלמן14.
- מניחים צינור גומי מהודק מתחת למשפך ומניחים שתי שכבות של נייר סינון בפתח המשפך. העבירו את תרביות הפטריות למשפך והוסיפו מים לטבילת מחצלת הפטריות. המתן שעתיים, ולאחר מכן לאסוף את הנמטודות.
- חלץ את סך הרנ"א מהנמטודות באמצעות מגיב מיצוי RNA כולל (ראה טבלת החומרים)11 בהתאם לשלבים הבאים.
- הוסף 500 μL של מגיב מיצוי ו 100 μL של חרוזים מגנטיים לצינור צנטריפוגה 2 מ"ל. שאפו 20 μL של הנמטודות והעבירו את הדגימה למטחנה לטחינה ב 9,000 × גרם במשך 30 שניות. דגירה במשך 5 דקות ולאחר מכן צנטריפוגה במשך 10 דקות ב 12,000 × גרם ו 4 מעלות צלזיוס.
- העבירו את הסופר-נאטנט לצינור צנטריפוגה חדש. מוסיפים 100 μL של כלורופורם, מכסים את הצינור ומערבבים על ידי היפוך הצינור מספר פעמים. דגירה במשך 3 דקות ולאחר מכן צנטריפוגה במשך 10 דקות ב 12,000 × גרם ב 4 מעלות צלזיוס.
- העבירו את הסופר-נאטנט לצינור צנטריפוגה חדש. מוסיפים 250 μL של אלכוהול איזופרופיל ומערבולת במרץ. צנטריפוגה ב-12,000 × גרם למשך 10 דקות.
- השליכו את הסופר-נטנט. הוסף 500 μL של 75% אתנול כדי לשטוף את הרנ"א ולאחר מכן מערבל את הדגימה. צנטריפוגה זה במשך 5 דקות ב 12,000 × גרם ו 4 מעלות צלזיוס.
- יש לייבש באוויר את גלולת ה-RNA במשך 5 דקות.
- יש לתלות את הכדור ב-30 μL של מים נטולי RNase.
- חישוב ריכוז הרנ"א באמצעות הנוסחה: A260 דילול × × 40 = מיקרוגרם RNA/mL. חשב את היחס A260/A280.
הערה: יחס של ~2 נחשב טהור.
- בצע שעתוק הפוך של RNA באיכות טובה כדי לקבל את תבנית cDNA.
- תכנן והשתמש בזוג פריימרים ספציפיים, ppm-1-F/R (ראה טבלת החומרים), כדי להגביר את רצף הקידוד החלקי של הגן Bx-ppm-1 ב- B. xylophilus (מספר ההצטרפות של GenBank QTZ96795).
- שכפלו את רצפי הגנים ppm-1 לווקטור pGEM-Teasy המכיל את מקדם T7 בעקבות פרוטוקול שיבוטסטנדרטי 11.
- הגדר את תגובות ה-PCR באופן הבא: 2 μL של cDNA, 25 μL של 2x Ex Taq Polymerase Premix, 2 μL של כל פריימר (10 pmol/l), ומים מזוקקים סטריליים לנפח סופי של 50 μL.
- בצע את הליך ההגברה כדלקמן: 5 דקות ב 94 מעלות צלזיוס; ואחריו 35 מחזורים של 30 שניות ב-94 מעלות צלזיוס, 30 שניות ב-55 מעלות צלזיוס, ודקה אחת ב-72 מעלות צלזיוס; ושלב הארכה סופי ב-72 מעלות צלזיוס למשך 5 דקות.
- שכפלו את המוצרים המוגברים לווקטור pGEM-T Easy לריצוף.
2. סינתזה של dsRNA
- הכן את תבנית הדנ"א לסינתזת dsRNA באמצעות PCR עם פריימרים שנועדו להוסיף אתרי מקדם T7 בשני הקצוות. הוסף את רצף מקדם T7 לסוף 5' של הפריימרים.
- השתמש בפלסמיד המכיל את מקטע הגן ppm-1 (894 bp) כתבנית עבור PCR ושחזר את השבר המכיל את מקדם T711. השתמש בהליך PCR ובמערכת שתוארו לעיל.
- השתמש בערכת שעתוק במבחנה כדי לסנתז dsRNA11.
- הפשירו את הריאגנטים הקפואים על הקרח.
- הוסף 2 μL של 10x מאגר תגובה, 2 μL של תערובת אנזימים, ו 1 מיקרוגרם של DNA לצינור צנטריפוגה. הוסיפו מים נטולי נוקלאז כדי לייצר תגובה סטנדרטית של 4 μL. לאחר מכן, ערבבו נפחים שווים של ארבעת תמיסות הריבונוקלאוטידים (ATP, CTP, GTP ו-UTP) יחד והוסיפו 8 μL של התערובת לצינור. מערבבים היטב ודוגרים בטמפרטורה של 37 מעלות צלזיוס למשך 4 שעות.
- הוסיפו 1 μL של DNase, ערבבו היטב ודגרו במשך 15 דקות בטמפרטורה של 37 מעלות צלזיוס.
- עצרו את התגובה והוסיפו 30 μL של מים נטולי נוקלאז ו-30 μL של תמיסת משקעים LiCl כדי לזרז את ה-RNA. מערבבים היטב. דגירה ב-20°C- למשך הלילה.
- צנטריפוגה במשך 15 דקות ב 12,000 × גרם ו 4 מעלות צלזיוס. השליכו את הסופר-נטנט.
- הוסף 1 מ"ל של 75% אתנול כדי לשטוף את ה- RNA. מערבלים את הדגימה וצנטריפוגה במשך 10 דקות ב 12,000 × גרם ו 4 מעלות צלזיוס.
- יש לייבש באוויר את גלולת ה-RNA למשך 3 דקות.
- יש לתלות את הכדור ב-30 μL של מים נטולי RNase.
- נתח את איכות ה- dsRNA באמצעות ספקטרופוטומטר. Pipette 1 μL של דגימת dsRNA על מעמד המדידה ולהגדיר את אורך הגל ל 340 ננומטר. דמיינו את המוצרים על ג'ל אגרוז 1.0%.
3. RNAi על ידי השרייה
- יש לערבב 4 μL של מאגר השרייה 5x (0.05% ג'לטין, 5.5 mM KH 2 PO 4, 2.1 mM NaCl, 4.7 mM NH4 Cl, 3 mM זרעונידין) עם dsRNA ו-ddH2O כדי לייצר נפח כולל של 20 μLוריכוז RNA סופי של 0.8 מיקרוגרם למ"ל.
- לרכוש זחלי J2.
- אוספים את הנמטודות מתרביות הפטריות ומעבירים אותן לצלחת פטרי זכוכית בקוטר 6 ס"מ. הוסיפו 10 מ"ל מים למנה כדי להבטיח שהנמטודות יוכלו לשחות בחופשיות. שומרים את הנמטודות בצלחת במשך 30 דקות ומחכים שהביצים יידבקו לתחתית.
- הסר את המים והנמטודות בזהירות, תוך הקפדה לא להפריע לביצים. חזור על השלבים עד שכל הזחלים והבוגרים יוסרו, וישאירו רק את הביצים בצלחת.
- בקעו את הביצים שנאספו במשך 24 שעות בחושך בטמפרטורה של 25 מעלות צלזיוס כדי להשיג זחלי J2. אספו את זחלי J2, הניחו אותם בצינור ושטפו אותם שלוש פעמים עם ddH2O לניסוי RNAi15.
- מעבירים את זחלי J2 לצינור 2 מ"ל המכיל את תמיסת ה-dsRNA ומוסיפים תמיסת רסורצינול (עטופה בפח ומומסת במים) כדי לייצר ריכוז סופי של 1.0%. דגרו את הזחלים עם צנטריפוגה ב-15 × גרם על שולחן רועד במשך 24 שעות ב-25 מעלות צלזיוס כדי להבטיח שהזחלים יספגו ביעילות את ה-dsRNA.
- השרו את אותה כמות של נמטודות במאגר ההשריה ללא בדיקת dsRNA או עם בדיקת GFP dsRNA כבקרה. השתמש בגן GFP (gfp, M62653.1) כבקרה לא אנדוגנית וסנתז את ה- dsRNA של gfp באמצעות פריימרים ספציפיים לגן T7-GFP-F/R.
4. זיהוי qPCR
- נקו את זחלי J2 עם ddH2O, כולל אלה עם הפרעה לגני המטרה, הפרעות גנטיות GFP וקבוצת הביקורת ללא הפרעה. חלץ את סך הרנ"א מכל קבוצה בשיטה שתוארה לעיל.
- הפעל את ה- qPCR.
- תכנן את פריימרים q-ppm-1-F/R באמצעות התוכנה הרצויה (ראה טבלת חומרים).
- הגדר את תגובת qPCR ב-12 μL המכילה 1 μL של cDNA, 6 μL של פרמיקס פלואורסצנטי, 0.4 μL של כל פריימר (10 pmol/l), ומים מזוקקים סטריליים.
- בצע qPCR באופן הבא: 2 דקות ב 95 °C; ואחריו 40 מחזורים של 10 שניות ב-95 מעלות צלזיוס, 30 שניות ב-55 מעלות צלזיוס ודקה אחת ב-72 מעלות צלזיוס.
- השתמש בגן actb (מספר ההצטרפות של GenBank EU100952) ובגן tbb-2 (מספר ההצטרפות של GenBank MT769316), או בגנים אחרים, כגני ייחוס פנימיים כדי להעריך את השינויים ברמת ביטוי הגנים לאחר RNAi15.
- על פי ערך סף המחזור (Ct) ועקומת הפירוק, השתמש בשיטת 2-ΔΔCt כדי להעריך את רמת הביטוי היחסית של גן המטרה ולאמת את יעילות ההפרעה.
- הפחת את ערך ה- Ct של גן הייחוס הפנימי של כל דגימה מערך ה- Ct של גן המטרה כדי לקבל את ערך ה- ΔCt. לאחר מכן, הפחת את ערך ΔCt של קבוצת ההפרעות מערך ΔCt של קבוצת הביקורת כדי לקבל את הערך ΔΔCt.
הערה: ערך ΔΔCt הגדול מ- 0 מציין שההפרעה יעילה.
- הפחת את ערך ה- Ct של גן הייחוס הפנימי של כל דגימה מערך ה- Ct של גן המטרה כדי לקבל את ערך ה- ΔCt. לאחר מכן, הפחת את ערך ΔCt של קבוצת ההפרעות מערך ΔCt של קבוצת הביקורת כדי לקבל את הערך ΔΔCt.
5. להעריך את אורך הגוף של מבוגרים נמטודה בעקבות RNAi
- לאחר RNAi, תרבו את זחלי J2 עד לבגרותם על מדשאות B. cinerea בצלחות PDA במשך 60 שעות ב 25 מעלות צלזיוס15.
- אסוף את המבוגרים בשיטת משפך בלמן (ראה שלב 1.1.2.1)14.
- רכשו תמונות של הנמטודות הבוגרות תחת מיקרוסקופ והשתמשו בתוכנת ImageJ (או תוכנת מדידה אחרת) כדי למדוד את אורכי הגוף.
- מדוד את האורך באמצעות ImageJ על-ידי בחירה באפשרות נתח | הגדר קנה מידה. אם המרחק ידוע, הזן את ערך האורך של הקו הישר המצויר. הזן את יחידת האורך.
- סמן את תיבת הסימון כללי (השתמש בתקן זה עבור כל התמונות) ולחץ על אישור כדי לבחור את האורך שיש למדוד באמצעות קו ישר בתמונה שיש למדוד.
- השתמש בפקודה Ctrl+M (מדידה) כדי להציג את התוצאות ולהקליט אותן בחלון התוצאות .
- קח מדידות של 50 נמטודות זכריות ו -50 נקבות לניתוח סטטיסטי12.
- נתח את הנתונים על-ידי חישוב הממוצע וסטיית התקן עבור כל מדגם. השווה את האמצעים של הדגימות מהקבוצות השונות באמצעות מבחן t של סטודנט.
תוצאות
ניתוח של ביטוי ppm-1 של B. xylophilus לאחר RNAi
רמת הביטוי היחסית של הגן ppm-1 של B. xylophilus ספוג ב-GFP dsRNA וספוג ב-dsRNA של גן המטרה הייתה 0.92 ו-0.52, בהתאמה (רמת הביטוי של הגן ppm-1 בקבוצת הביקורת שטופלה ב-ddH2O נקבעה ל-1) (איור 1). לפיכך, ל-dsRNA אקסוגני אין השפעה על הביטוי ppm-1 של B. xylophilus; עם זאת, ppm-1 dsRNA יכול לעכב ביעילות את הביטוי של גן המטרה.
השפעת ביטוי ppm-1 על גדילה והתפתחות של ב. קסילופילוס
לאחר RNAi, גודלם של הבוגרים הצטמצם במידה ניכרת (איור 2), וכתוצאה מכך הפנוטיפ המוטנטי SMA (גודל גוף קטן). למרות שאנשים שטופלו ב-RNAi התפתחו לבגרות מינית, אורך גופם היה קטן משמעותית ממבוגרים רגילים. באופן ספציפי, לאחר RNAi בנמטודות בשלב J2, אורך הגוף הממוצע של נקבות וזכרים היה 544.61 מיקרומטר ו-526.24 מיקרומטר, בהתאמה. לעומת זאת, אורך הגוף הממוצע של נקבות וזכרים בקבוצת הביקורת היה 971.86 מיקרומטר ו-912.31 מיקרומטר, בהתאמה (איור 3), מה שמייצג הבדלים משמעותיים (P = 0.0322).
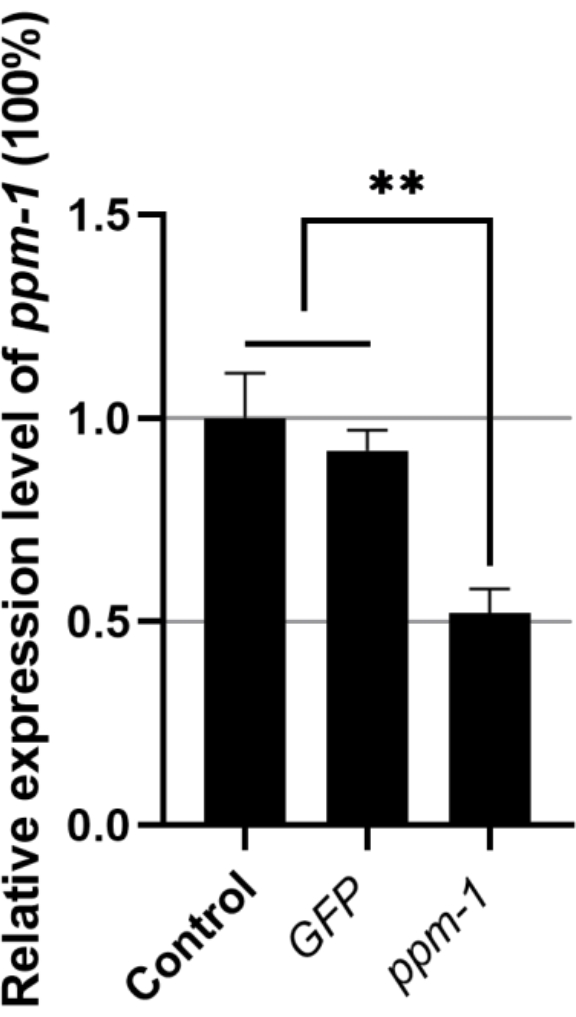
איור 1: ביטוי של הגן ppm-1 בעקבות RNAi של Bursaphelenchus xylophilus. **P < 0.001. קיצורים: RNAi = הפרעת RNA; GFP = חלבון פלואורסצנטי ירוק. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: הפחתה באורך הגוף של מבוגרים לאחר הפרעה של ppm-1 ב-Bursaphelenchus xylophilus. תמונות של זכר בוגר (A) ונקבה (C) מקבוצת RNAi. תמונות של זכר בוגר (B) ונקבה (D) של קבוצת הביקורת. סרגלי קנה מידה = 50 מיקרומטר. קיצור: RNAi = הפרעת RNA. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
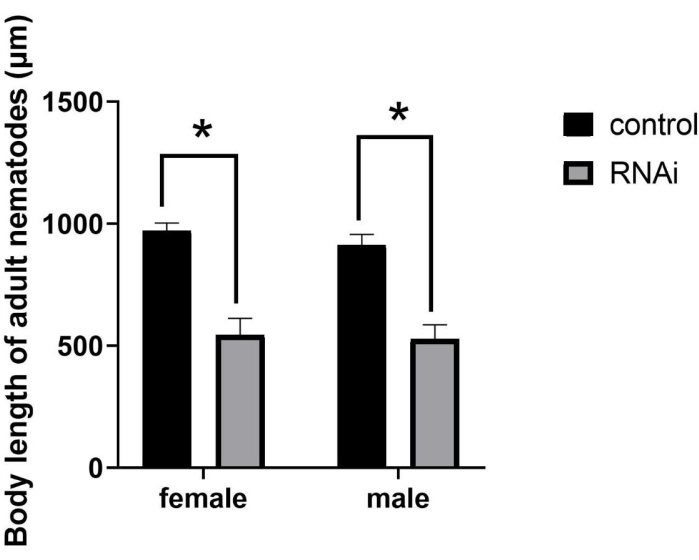
איור 3: כימות וניתוח סטטיסטי של אורך הגוף של מבוגרים של Bursaphelenchus xylophilus לאחר RNAi של הגן ppm-1 . (*P = 0.0322). קיצור: RNAi = הפרעת RNA. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
למרות שהיסטוריית החיים והסביבה הטפילית של B. xylophilus שונים מאלו של נמטודות אחרות, היה מחקר מוגבל על הפתוגנזה המולקולרית של פתוגן צמח זה. למרות ההתקדמות הרבה שהושגה ביישום טכנולוגיית עריכת הגנום CRISPR/Cas9 ב-C. elegans ובנמטודות אחרות, רק טכנולוגיית RNAi המיושמת על B. xylophilus פורסמה עד כה17. RNAi הוא אחד הכלים החזקים ביותר הזמינים לחקר תפקוד הגן של נמטודות ונמצא בשימוש נרחב במחקר המבהיר את תפקוד הגן B. xylophilus, מסלולי התמרת אותות וטיפול גנטי18,19,20. בניגוד לגישות נוקאאוט הגנים המשמשות במודלים של חסרי חוליות, נוקאאוט בתיווך RNAi של גני מטרה בנמטודות מאפשר הערכה מהירה של תפקוד הגנים.
ישנן שלוש דרכים לבצע RNAi ב- C. elegans: הזרקה 6, השריית21 והאכלה6. מאחר שזחלי J2 ניזונים רק לאחר זיהום, שיטת ההשריה משמשת בדרך כלל ל-RNAi של נמטודות טפיליות-צמחיות. שלב המפתח בשיטת ההשריה הוא להוסיף סוכן עצבים כדי לעורר את הנמטודות להאכיל. אורווין השתמש לראשונה בתמנון כדי לעורר את J2 של שני מיני נמטודות ציסטה דרך הפה, Globodera pallida, ו- Heterodera glycines, וכתוצאה מכך ספיגת dsRNA מתמיסת ההשריה22. אותה שיטה שימשה בהצלחה כדי לגרום ל-J2 של נמטודת קשר השורש Meloidogyne incognita לספוג dsRNA 23. רסורצינול יכול גם לגרום לספיגת dsRNA על ידי J2 של M. incognita ועשוי להיות יעיל יותר מתוקטופמין עבור נמטודהזו 24. יתר על כן, הוספת זרעונידין למאגר ההשריה עם זמן דגירה ממושך שיפרה את היעילות של RNAi בנמטודות25. לאחר 24 שעות של השרייה, dsRNA נכנס ביעילות ל- B. xylophilus, ובכך משתיק את הגן ppm-1.
פרוטוקול זה, אם כן, מספק התייחסות למחקר עתידי של RNAi של נמטודות צמחיות-טפיליות אחרות עם התנהגות phagocytosis. בנוסף, אפקט ההשעיה של שולחן ההשריה ממלא תפקיד חשוב במקסום היתרון של שיטת ההשרייה. שיטה זו יכולה לאפשר טיפול בו זמנית של מספר רב של נמטודות. RNAi קל יותר לתפעול כאשר מתמקדים בגני המטרה שעבורם לא ניתן להשיג מוטציות בקלות ולהערכת ההשפעות בנקודות שונות בהתפתחות מכיוון שניתן לספוג נמטודות בכל שלב בחיים. לפיכך, RNAi יכול לשמש כדי לחקור את הפונקציה של גן מסוים בשלב התפתחותי מסוים. Wang et al. ניתחו את ההשפעה של MAPK על הפוריות של B. xylophilus ואת תפקידו החשוב בצמיחה והתפתחות של נמטודות באמצעות dsRNA ספוג26. Qiu et al. מצאו כי מהירות הנדידה והפריון של B. xylophilus בעצי אורן ירדו לאחר ירידה בוויסות של הגן Bxpel1, מה שמצביע על כך שגן זה הוא גורם פתוגני חשוב של B. xylophilus27.
עם זאת, לא כל ה-RNAi בנמטודות פועל באמצעות dsRNA. דולוביץ' וסטרייט השתמשו ב-RNA מתערבים קטנים (siRNAs) במקום ב-dsRNAs הארוכים יותר כדי להפריע בהצלחה ל-Strongyloides ratti28. המגבלה של שימוש ב-dsRNA עבור RNAi ב-Strongyloides עשויה להיות קשורה להיעדר גנים כגון rsd-6, sid-1 או sid-2 שידוע כי הם מעורבים בספיגת dsRNA. RNAi קשור גם לחסרונות של אפקט מיקום ונוקאאוט זמני ולא שלם ויש לו יעילות מוגבלת עבור גנים וסוגי תאים מסוימים (כגון נוירונים)29. עם זאת, עד פריצת דרך בטכנולוגיה מהונדסת של B. xylophilus מושגת, RNAi מייצג אסטרטגיית מחקר יעילה יחסית.
RNAi הראה פוטנציאל גדול להגנת הצומח. באמצעות טכנולוגיית RNAi, תפוחי אדמה מהונדסים המסוגלים לייצר dsRNA המכוון לגנים של נמטודות קשר שורש גודלו כדי לייצר עמידות מלאה לנמטודות קשר שורש30. ביטוי של dsRNAs המכוונים לגנים של חרקים יכול לספק הגנת הצומח בהיעדר קוטלי חרקים כימיים ומציע את היתרון הנוסף של אי ייצור חלבונים זרים, עם מספר כמעט בלתי מוגבל של גני מטרה31. לכן, מחקר מואץ בתחום ה-RNAi היישומי להדברת מזיקים יספק ביטחון ביולוגי טוב יותר להדברת נמטודות צמחיות מאשר שיטות מהונדסות או שיטות הדברה כימיות אחרות.
לסיכום, פרוטוקול זה מתאר את הכנת dsRNA של הגן ppm-1 להשגת RNAi על ידי השרייה ישירה של הזחלים של B. xylophilus בתמיסת dsRNA. אפקט ההפרעה אושר על סמך הפחתה משמעותית בגודל הגוף של הזחלים לאחר שהם התפתחו למבוגרים בהשוואה לזה של הבקרה, מה שמוכיח כי הגן ppm-1 מפעיל השפעות על הצמיחה וההתפתחות של B. xylophilus. מחקר זה מספק בסיס תיאורטי לחשיפה נוספת של הפונקציה של ppm-1 עם ערך מעשי נוסף בהנחיית ההדברה הביולוגית של טפיל צמח זה. הוא האמין כי עם גילוי נוסף ושיפור של מנגנון הטכנולוגיה RNAi, היישום שלה בתחום של ב. xylophilus שליטה יהיה סיכויים רחבים.
Disclosures
לא הוכרזו ניגודי עניינים.
Acknowledgements
מחקר זה מומן על ידי הקרן הלאומית למדעי הטבע של סין (31870637, 31200487) ומומן במשותף על ידי תוכנית המחקר המרכזית של ג'ה-ג'יאנג (2019C02024, LGN22C160004).
Materials
| Name | Company | Catalog Number | Comments |
| Baermann funnel | n/a | n/a | to isolate nematodes |
| Beacon Designer 7.9 | Shanghai kangyusheng information technology co. | n/a | to design qPCR primers |
| Botrytis cinerea | n/a | n/a | as food for nematodes |
| Bursaphelenchus xylophilus | n/a | n/a | its number was NXY61 and was it was originally extracted from diseased Pinus massoniana in Ningbo, Zhejiang province, China. |
| constant temperature incubator | Shanghai Jing Hong Laboratory Instrument Co. | H1703544 | to cultur nematodes |
| Electrophoresis apparatus | Bio-Rad Laboratories | 1704466 | to achieve electrophoretic analysis |
| Ethanol, 75% | Sinopharm Chemical Reagent Co. | 80176961 | to extract RNA |
| Ex Taq Polymerase Premix | Takara Bio Inc. | RR030A | for PCR |
| Ex Taq Polymerase Premix | Takara Bio Inc. | RR390A | for PCR |
| Gel imager | LongGene Scientific Instruments Co. | LG2020 | to make nucleic acid bands visible |
| GraphPad Prism 8 | GraphPad Prism | n/a | to analyze the data and make figurs |
| High Speed Centrifuge | Hangzhou Allsheng Instruments Co. | AS0813000 | centrifug |
| High-flux tissue grinder | Bertin | to extract RNA | |
| ImageJ software | National Institutes of Health | n/a | to measure the body lengths |
| isopropyl alcohol | Shanghai Aladdin Biochemical Technology Co. | L1909022 | to extract RNA |
| Leica DM4B microscope | Leica Microsystems Inc. | to observe nematodes | |
| magnetic beads | Aoran science technology co. | 150010C | to extract RNA |
| MEGAscript T7 High Yield Transcription Kit | Thermo Fisher Scientific Inc. | AM1333 | to synthesize dsRNA in vitro |
| NanoDrop ND-2000 spectrophotometer | Thermo Fisher Scientific Inc. | NanoDrop 2000/2000C | to analyze the quality of the dsRNA |
| PCR Amplifier | Bio-Rad Life Medical Products Co. | 1851148 | to amplify nucleic acid sequence |
| Petri dishes | n/a | n/a | to cultur nematodes |
| pGEM-T Easy vector | Promega Corporation | A1360 | for cloning |
| Potato Dextrose Agar (Medium) | n/a | n/a | to cultur Botrytis cinerea |
| Prime Script RT reagent Kit with gDNA Eraser | Takara Bio Inc. | RR047B | to synthetic cDNA |
| Primer Premier 5.0 | PREMIER Biosoft | n/a | to design PCR primers |
| primers:ppm-1-F/R | Tsingke Biotechnology Co. | n/a | F: 5'-GATGCGAAGTTGCCAATCATTCT -3'; R: 5'- CCAGATCCAGTCCACCATACACC -3 |
| q-ppm-1-F/R | Tsingke Biotechnology Co. | n/a | F: 5'-CATCCGAATGGCAATACAG-3'; R: 5'-ACTATCCTCAGCGTTAGC-3' |
| Real-time thermal cycler qTOWER 2.2 | Analytique Jena Instruments (Beijing) Co. | for qPCR | |
| shaking table | Shanghai Zhicheng analytical instrument manufacturing co. | to soak nematodes | |
| stereoscopic microscope | Chongqing Optec Instrument Co. | 1814120 | to observe nematodes |
| T7-GFP-F/R | Tsingke Biotechnology Co. | n/a | F: 5'-TAATACGACTCACTATAGGGAAA GGAGAAGAACTTTTCAC-3'; R: 5'-TAATACGACTCACTATAGGGCTG TTACAAACTCAAGAAGG-3' |
| T7 promoter | Tsingke Biotechnology Co. | n/a | TAATACGACTCACTATAGGG |
| Takara MiniBEST Agarose Gel DNA Extraction Kit | Takara Bio Inc. | 9762 | to recover DNA |
| TaKaRa TB Green Premix Ex Taq (Tli RNaseH Plus) | Takara Bio Inc. | RR820A | for qPCR |
| trichloroethane | Shanghai LingFeng Chemical Reagent Co. | to extract RNA | |
| TRIzol Reagent | Thermo Fisher Scientific Inc. | 15596026 | total RNA extraction reagent,to extract RNA |
References
- Nicol, J. M., Jones, J., Gheysen, G., Fenoll, C., et al. Current nematode threats to world agriculture. Genomics and Molecular Genetics of Plant-Nematode Interactions. , 21-43 (2011).
- Jones, J. T., et al. Top 10 plant-parasitic nematodes in molecular plant pathology. Molecular Plant Pathology. 14 (9), 946-961 (2013).
- Kikuchi, T., et al. Genomic insights into the origin of parasitism in the emerging plant pathogen Bursaphelenchus xylophilus. PLoS Pathogens. 7 (9), 1002219 (2011).
- Megen, H. V., et al. A phylogenetic tree of nematodes based on about 1200 full-length small subunit ribosomal DNA sequences. Nematology. 11 (6), 927-950 (2009).
- Niu, J. H., Jian, H., Xu, J. M., Guo, Y. D., Liu, Q. RNAi technology extends its reach: Engineering plant resistance against harmful eukaryotes. African Journal of Biotechnology. 9 (45), 7573-7582 (2010).
- Fire, A., et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 91 (6669), 806-811 (1998).
- Shahid, M., Imran, A., Mazhar, H., Yusuf, Z., Rob, W. B. Engineering novel traits in plants through RNA interference. Trends in Plant Science. 11 (11), 559-565 (2006).
- Marmonier, A., et al. In vitro acquisition of specific small interfering RNAs inhibits the expression of some target genes in the plant ectoparasite Xiphinema index. International Journal of Molecular Sciences. 20 (13), 3266 (2019).
- Iqbal, S., Fosu-Nyarko, J., Jones, M. G. K. Attempt to silence genes of the RNAi pathways of the root-knot nematode, Meloidogyne incognita results in diverse responses including increase and no change in expression of some genes. Frontiers in Plant Science. 11, 328 (2020).
- Zhou, L. F., et al. Molecular characterization and functional analysis of akt-1 in pinewood nematode, Bursaphelenchus xylophilus. Forest Pathology. 51 (1), 12647 (2021).
- Zhou, L. F., et al. The role of mab-3 in spermatogenesis and ontogenesis of pinewood nematode, Bursaphelenchus xylophilus. Pest Management Science. 77 (1), 138-147 (2021).
- Tang, J., et al. Bxy-fuca encoding α-L-fucosidase plays crucial roles in development and reproduction of the pathogenic pinewood nematode, Bursaphelenchus xylophilus. Pest Management Science. 76 (1), 205-214 (2020).
- Wang, J. H., et al. Molecular characterization and functional analysis of daf-8 in the pinewood nematode, Bursaphelenchus xylophilus. Journal of Forestry Research. , (2021).
- Viglierchio, D. R., Schmitt, R. V. On the methodology of nematode extraction from field samples: Baermann funnel modifications. Journal of Nematology. 15 (3), 438-444 (1983).
- Zhu, N., et al. Observation and quantification of mating behavior in the pinewood nematode, Bursaphelenchus xylophilus. Journal of Visualized Experiments: JoVE. (118), e54842 (2016).
- Zhou, L. F., Chen, F. M., Ye, J. R., Pan, H. Y. Selection of reliable reference genes for RT-qPCR analysis of Bursaphelenchus mucronatus gene expression from different habitats and developmental stages. Frontiers in Genetics. 9, 269-279 (2018).
- Wang, M., et al. Double-stranded RNA-mediated interference of dumpy genes in Bursaphelenchus xylophilus by feeding on filamentous fungal transformants. International Journal for Parasitology. 46 (5-6), 351-360 (2016).
- Ma, H. B., Lu, Q., Liang, J., Zhang, X. Y. Functional analysis of the cellulose gene of the pine wood nematode, Bursaphelenchus xylophilus, using RNA interference. Genetics and Molecular Research: GMR. 10 (3), 1931-1941 (2011).
- Cheng, X. Y., Dai, S. M., Xiao, L., Xie, B. Y. Influence of cellulase gene knock down by dsRNA interference on the development and reproduction of the pine wood nematode, Bursaphelenchus xylophilus. Nematology. 12 (12), 225-233 (2010).
- Xue, Q., Wu, X. Q., Zhang, W. J., Deng, L. N., Wu, M. M. Cathepsin L-like cysteine proteinase genes are associated with the development and pathogenicity of pine wood nematode, Bursaphelenchus xylophilus. International Journal of Molecular Sciences. 20 (1), 215 (2019).
- Tabara, H., Grishok, A., Mello, C. C. RNAi in C. elegans: Soaking in the genome sequence. Science. 282 (5388), 430-431 (1998).
- Urwin, P. E., Lilley, C. J., Atkinson, H. J. Ingestion of double-stranded RNA by pre parasitic juvenile cyst nematodes leads to RNA interference. Molecular Plant-Microbe Interactions: MPMI. 15 (8), 747-752 (2002).
- Bakhetia, M., Charlton, W., Atkinson, H. J., McPherson, M. J. RNA interference of dual oxidase in the plant nematode Meloidogyne incognita. Molecular Plant-Microbe Interactions: MPMI. 18 (10), 1099-1106 (2005).
- Rosso, M. N., Dubrana, M. P., Cimbolini, N., Jaubert, S., Abad, P. Application of RNA interference to root-knot nematode genes encoding esophageal gland proteins. Molecular Plant-Microbe Interactions: MPMI. 18 (7), 615-620 (2005).
- Chen, Q., Rehman, S., Smant, G., Jones, J. T. Functional analysis of pathogenicity proteins of the potato cyst nematode Globodera rostochiensis using RNAi. Molecular Plant-Microbe Interactions: MPMI. 18 (7), 621-625 (2005).
- Wang, D. D., Li, Y., Li, J., Xie, B. Y., Chen, G. H. Molecular clone and its RNAi interference effect analysis of mapk gene in Bursaphelenchus xylophilus ( in Chinese). Acta Phytopathologica Sinica. 46 (5), 662-669 (2016).
- Qiu, X., Wu, X., Huang, L., Ye, J. R. Influence of Bxpel1 gene silencing by dsRNA interference on the development and pathogenicity of the pine wood nematode, Bursaphelenchus xylophilus. International Journal of Molecular Sciences. 17 (1), 125 (2016).
- Dulovic, A., Streit, A. RNAi-mediated knockdown of daf-12 in the model parasitic nematode Strongyloides ratti. PLoS Pathogens. 15 (3), 1007705 (2019).
- Li, L., Zhao, H., Cui, Y., Wei, H., Li, M. Research progress of gene editing technology. Life Science Research. 21 (3), 268-274 (2017).
- Bindhya, C. Y., Karuppannan, V., Kuppuswamy, S. Host-generated double stranded RNA induces RNAi in plant-parasitic nematodes and protects the host from infection. Molecular and Biochemical Parasitology. 148 (2), 219-222 (2006).
- Jiang, Z., Sher, A. K., David, G. H., Ralph, B. Next-generation insect-resistant plants: RNAi-mediated crop protection. Trends in Biotechnology. 35 (9), 871-882 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved