Method Article
تطبيق تداخل الحمض النووي الريبي في نيماتودا خشب الصنوبر ، Bursaphelenchus xylophilus
In This Article
Summary
هنا ، نقدم طريقة نقع مفصلة لتداخل الحمض النووي الريبي في Bursaphelenchus xylophilus لتسهيل دراسة وظائف الجينات.
Abstract
الديدان الخيطية من خشب الصنوبر ، Bursaphelenchus xylophilus ، هي واحدة من أكثر الأنواع الغازية تدميرا في جميع أنحاء العالم ، مما تسبب في ذبول أشجار الصنوبر وموتها في نهاية المطاف. على الرغم من الاعتراف بأهميتها الاقتصادية والبيئية ، فقد كان من المستحيل حتى الآن دراسة الوظائف الجينية التفصيلية للديدان الخيطية الطفيلية النباتية (PPNs) باستخدام علم الوراثة التقليدي الأمامي والطرق المعدلة وراثيا. ومع ذلك ، كتقنية علم الوراثة العكسية ، يسهل تداخل الحمض النووي الريبي (RNAi) دراسة الجينات الوظيفية للديدان الخيطية ، بما في ذلك B. xylophilus.
تحدد هذه الورقة بروتوكولا جديدا للحمض النووي الريبي للجين ppm-1 في B. xylophilus ، والذي تم الإبلاغ عنه للعب أدوار حاسمة في تطوير وتكاثر الديدان الخيطية المسببة للأمراض الأخرى. بالنسبة ل RNAi ، تم ربط مروج T7 بطرف 5 ′ للجزء المستهدف بواسطة تفاعل البوليميراز المتسلسل (PCR) ، وتم تصنيع الحمض النووي الريبي المزدوج (dsRNA) عن طريق النسخ في المختبر . في وقت لاحق ، تم إنجاز تسليم dsRNA عن طريق نقع الديدان الخيطية في محلول dsRNA مختلطة مع المنشطات العصبية الاصطناعية. تم غسل الأحداث المتزامنة من B. xylophilus (حوالي 20000 فرد) ونقعها في dsRNA (0.8 ميكروغرام / مل) في المخزن المؤقت للنقع لمدة 24 ساعة في الظلام عند 25 درجة مئوية.
تم وضع نفس الكمية من الديدان الخيطية في مخزن مؤقت للنقع بدون dsRNA كعنصر تحكم. وفي الوقت نفسه ، تم وضع كمية أخرى مماثلة من الديدان الخيطية في مخزن مؤقت للنقع مع جين بروتين الفلورسنت الأخضر (gfp) dsRNA كعنصر تحكم. بعد النقع ، تم تحديد مستوى التعبير عن النصوص المستهدفة باستخدام تفاعل البوليميراز المتسلسل الكمي في الوقت الفعلي. ثم تم تأكيد آثار الحمض النووي الريبي باستخدام الملاحظة المجهرية للأنماط الظاهرية ومقارنة حجم جسم البالغين بين المجموعات. يمكن أن يساعد البروتوكول الحالي في تطوير الأبحاث لفهم وظائف جينات B. xylophilus وغيرها من الديدان الخيطية الطفيلية بشكل أفضل نحو تطوير استراتيجيات التحكم من خلال الهندسة الوراثية.
Introduction
تشكل الديدان الخيطية الطفيلية النباتية (PPNs) تهديدا مستمرا للأمن الغذائي والنظم الإيكولوجية للغابات. فهي تسبب خسائر اقتصادية تقدر بنحو 100 مليار دولار أمريكي كل عام1 ، وأكثرها إشكالية هي في المقام الأول الديدان الخيطية ذات العقدة الجذرية ، والديدان الخيطية الكيسية ، والديدان الخيطية من خشب الصنوبر. الديدان الخيطية من خشب الصنوبر ، Bursaphelenchus xylophilus ، هي نيماتودا مهاجرة ، طفيليات داخلية ، وهي الممرض السببي لمرض ذبول الصنوبر2. وقد تسبب في ضرر كبير لغابات الصنوبر في جميع أنحاء العالم3. باستخدام مصطلحات Van Megen et al.4 ، B. xylophilus هو عضو في Parasitaphelenchidae وينتمي إلى clade 10 ، في حين أن معظم الطفيليات النباتية الرئيسية الأخرى تنتمي إلى clade 12.
كطفيلي نباتي مستقل ومتطور مؤخرا ، يعد B. xylophilus نموذجا جذابا للدراسات المقارنة. وحتى الآن، أجريت بحوث كبيرة على الديدان الخيطية ذات عقدة الجذر والديدان الخيطية الكيسية التي تنتمي إلى الفصيلة 12، وهي طفيليات داخلية ملزمة ومستقرة وهي من أكثر الديدان الخيطية التي تمت دراستها بشكل مكثف. ومع ذلك ، فإن إجراء المزيد من الأبحاث في هذا المجال المهم يأتي مع تحد كبير: وظيفة جينات التطفل هي عنق الزجاجة البحثي. تشمل الدراسات الوظيفية عموما التعبير خارج الرحم وتجارب الضربة القاضية / الخروج ولكنها تعتمد على بروتوكولات التحول الجيني الفعالة للديدان الخيطية. ونتيجة لذلك ، يعتمد علم الوراثة العكسي في PPNs بشكل حصري تقريبا على إسكات الجينات بواسطة RNAi.
RNAi ، وهي آلية موجودة على نطاق واسع في الخلايا حقيقية النواة ، تسكت التعبير الجيني عن طريق إدخال الحمض النووي الريبي المزدوج (dsRNA)5. حتى الآن ، تم العثور على آلية إسكات الجينات بعد النسخ التي يسببها dsRNA في جميع حقيقيات النوى المدروسة ، وتطورت تقنية RNAi ، كأداة لأبحاث الجينوم الوظيفي والتطبيقات الأخرى ، بسرعة في العديد من الكائنات الحية. منذ اكتشاف آلية RNAi في Caenorhabditis elegans في عام 19986 ، أصبحت تقنيات RNAi طرقا فعالة لتحديد الوظيفة الجينية للديدان الخيطية ويتم اقتراحها كطريقة جديدة للسيطرة الفعالة على الديدان الخيطية المسببة للأمراض7.
RNAi هو من الناحية الفنية سهلة نقع الأحداث في dsRNA يمكن أن يكفي. ومع ذلك ، فإن فعالية هذا النهج وقابليته للتكرار تختلف اختلافا كبيرا مع أنواع الديدان الخيطية والجين المستهدف8. تم التحقيق في إسكات 20 جينا مشاركا في مسارات الحمض النووي الريبي للديدان الخيطية ذات عقدة الجذر ، Meloidogyne incognita ، باستخدام dsRNAs الطويلة كمحفزات ، مما أدى إلى استجابات متنوعة ، بما في ذلك زيادة وعدم حدوث تغيير في التعبير عن بعض الجينات9. تظهر هذه النتائج أن الجينات المستهدفة قد تستجيب لضربة RNAi القاضية بشكل مختلف ، مما يتطلب تقييما شاملا لمدى ملاءمتها كأهداف للتحكم في الديدان الخيطية عبر RNAi. ومع ذلك ، هناك حاليا ندرة في البحوث حول البيولوجيا التنموية والإنجابية ل B. xylophilus.
استمرارا للعمل السابق10،11،12،13 ، نصف هنا بروتوكولا لتطبيق RNAi لدراسة وظيفة جين ppm-1 من B. xylophilus ، بما في ذلك تخليق dsRNA ، ونقع المنشطات العصبية الاصطناعية ، والكشف الكمي عن تفاعل البوليميراز المتسلسل (qPCR). من المرجح أن تساهم المعرفة المكتسبة من هذا النهج التجريبي بشكل ملحوظ في فهم النظم البيولوجية الأساسية ومنع مرض ذبول الصنوبر.
Protocol
تمت الموافقة على الدراسة من قبل مجلس التجارب على الحيوانات بجامعة تشجيانغ الزراعية والحرجية. تم استخراج B. xylophilus المعزول NXY61 في الأصل من صنوبر ماسونيانا مريض في منطقة نينغبو بمقاطعة تشجيانغ ، الصين11.
1. استنساخ الجينات
ملاحظة: راجع جدول المواد للحصول على تفاصيل حول الاشعال المستخدمة في هذا البروتوكول.
- جمع الديدان الخيطية.
- ثقافة B. xylophilus سلالة على mycelia من Botrytis cinerea على لوحات البطاطا سكر العنب أجار (PDA) في 25 درجة مئوية لمدة 3-5 أيام.
- جمع الديدان الخيطية باستخدام طريقة قمع بيلمان14.
- ضع أنبوبا مطاطيا مثبتا أسفل القمع وضع طبقتين من ورق الترشيح في فم القمع. انقل الثقافات الفطرية إلى القمع وأضف الماء لغمر الحصيرة الفطرية. انتظر لمدة 2 ساعة ، ثم اجمع الديدان الخيطية.
- استخراج الحمض النووي الريبي الكلي من الديدان الخيطية باستخدام كاشف استخراج الحمض النووي الريبي الكلي (انظر جدول المواد)11 وفقا للخطوات التالية.
- أضف 500 ميكرولتر من كاشف الاستخراج و 100 ميكرولتر من الخرز المغناطيسي إلى أنبوب طرد مركزي 2 مل. استنشاق 20 ميكرولتر من الديدان الخيطية ونقل العينة إلى مطحنة لطحنها عند 9000 × غرام لمدة 30 ثانية. احتضان لمدة 5 دقائق ثم جهاز طرد مركزي لمدة 10 دقائق عند 12000 × غرام و 4 درجات مئوية.
- نقل supernatant إلى أنبوب جهاز طرد مركزي جديد. أضف 100 ميكرولتر من الكلوروفورم ، وقم بتغطية الأنبوب ، واخلطه عن طريق عكس الأنبوب عدة مرات. احتضنها لمدة 3 دقائق ثم جهاز طرد مركزي لمدة 10 دقائق عند 12000 × غرام عند 4 درجات مئوية.
- نقل supernatant إلى أنبوب جهاز طرد مركزي جديد. أضف 250 ميكرولتر من كحول الأيزوبروبيل والدوامة بقوة. جهاز طرد مركزي بسرعة 12000 × غرام لمدة 10 دقائق.
- تخلص من السوبرناتانت. أضف 500 ميكرولتر من الإيثانول بنسبة 75٪ لغسل الحمض النووي الريبي ثم دوامة العينة. قم بطرده المركزي لمدة 5 دقائق عند 12000 × جم و 4 درجات مئوية.
- جفف حبيبة الحمض النووي الريبي في الهواء لمدة 5 دقائق.
- أعد تعليق الكريات في 30 ميكرولتر من الماء الخالي من RNase.
- احسب تركيز الحمض النووي الريبي باستخدام الصيغة: تخفيف × A260 × 40 = ميكروغرام RNA/mL. احسب نسبة A260/A280.
ملاحظة: تعتبر نسبة ~ 2 نقية.
- إجراء النسخ العكسي للحمض النووي الريبي ذات النوعية الجيدة للحصول على قالب cDNA.
- تصميم واستخدام زوج من الاشعال المحددة، ppm-1-F/R (انظر جدول المواد)، لتضخيم تسلسل الترميز الجزئي للجين Bx-ppm-1 في B. xylophilus (رقم انضمام بنك الجينات QTZ96795).
- استنساخ تسلسل الجينات ppm-1 في ناقل pGEM-Teasy الذي يحتوي على مروج T7 باتباع بروتوكول استنساخ قياسي11.
- قم بإعداد تفاعلات PCR على النحو التالي: 2 ميكرولتر من cDNA ، و 25 ميكرولتر من 2x Ex Taq Polymerase Premix ، و 2 ميكرولتر من كل تمهيدي (10 pmol / l) ، والماء المقطر المعقم إلى حجم نهائي قدره 50 ميكرولتر.
- قم بإجراء التضخيم على النحو التالي: 5 دقائق عند 94 درجة مئوية ؛ تليها 35 دورة من 30 ثانية عند 94 درجة مئوية ، و 30 ثانية عند 55 درجة مئوية ، و 1 دقيقة عند 72 درجة مئوية ؛ وخطوة تمديد نهائية عند 72 درجة مئوية لمدة 5 دقائق.
- استنساخ المنتجات المضخمة إلى متجه pGEM-T Easy للتسلسل.
2. توليف dsRNA
- قم بإعداد قالب الحمض النووي لتخليق dsRNA باستخدام PCR مع الاشعال المصممة لإضافة مواقع الترويج T7 في كلا الطرفين. أضف تسلسل المروج T7 إلى نهاية 5 أقدام من التمهيدي.
- استخدم البلازميد الذي يحتوي على جزء الجين ppm-1 (894 bp) كقالب ل PCR واسترجع الجزء الذي يحتوي على مروج T711. استخدم إجراء PCR والنظام الموضح أعلاه.
- استخدم مجموعة نسخ في المختبر لتوليف dsRNA11.
- إذابة الكواشف المجمدة على الجليد.
- أضف 2 ميكرولتر من المخزن المؤقت للتفاعل 10x ، و 2 ميكرولتر من مزيج الإنزيم ، و 1 ميكروغرام من الحمض النووي إلى أنبوب طرد مركزي. أضف ماء خاليا من النوكليز لإنتاج تفاعل قياسي 4 ميكرولتر. ثم ، امزج كميات متساوية من محاليل الريبونوكليوتيد الأربعة (ATP ، CTP ، GTP ، و UTP) معا وأضف 8 ميكرولتر من الخليط إلى الأنبوب. تخلط جيدا وتحضن في 37 درجة مئوية لمدة 4 ساعات.
- أضف 1 ميكرولتر من DNase ، واخلطه جيدا ، واحتضنه لمدة 15 دقيقة عند 37 درجة مئوية.
- أوقف التفاعل وأضف 30 ميكرولتر من الماء الخالي من النوكليز و 30 ميكرولتر من محلول ترسيب LiCl لترسيب الحمض النووي الريبي. اخلطي جيدا. احتضان في -20 درجة مئوية بين عشية وضحاها.
- جهاز طرد مركزي لمدة 15 دقيقة عند 12000 × جم و 4 درجات مئوية. تخلص من السوبرناتانت.
- أضف 1 مل من الإيثانول بنسبة 75٪ لغسل الحمض النووي الريبي. دوامة العينة وطردها مركزيا لمدة 10 دقائق عند 12000 × جم و 4 درجات مئوية.
- جفف حبيبات الحمض النووي الريبي في الهواء لمدة 3 دقائق.
- أعد تعليق الكريات في 30 ميكرولتر من الماء الخالي من RNase.
- تحليل جودة الحمض النووي الريبوزي المرسال باستخدام مقياس الطيف الضوئي. ماصة 1 ميكرولتر من عينة dsRNA على قاعدة القياس وتعيين الطول الموجي إلى 340 نانومتر. تصور المنتجات على هلام الأغاروز بنسبة 1.0٪.
3. الحمض النووي الريبي عن طريق النقع
- امزج 4 ميكرولتر من المخزن المؤقت للنقع 5x (0.05٪ جيلاتين ، 5.5 mM KH 2 PO 4 ، 2.1 mM NaCl ، 4.7 mM NH4 Cl ، 3 mMspermidine) مع dsRNA و ddH2O لإنتاج حجم إجمالي قدره 20 ميكرولتروتركيز RNA نهائي قدره 0.8 ميكروغرام / مل.
- الحصول على يرقات J2.
- جمع الديدان الخيطية من الثقافات الفطرية ونقلها إلى طبق بتري زجاجي قطره 6 سم. أضف 10 مل من الماء إلى الطبق للتأكد من أن الديدان الخيطية يمكنها السباحة بحرية. احتفظ بالديدان الخيطية في الطبق لمدة 30 دقيقة وانتظر حتى يلتصق البيض بالقاع.
- قم بإزالة الماء والديدان الخيطية بعناية ، مع التأكد من عدم إزعاج البيض. كرر الخطوات حتى تتم إزالة جميع اليرقات والبالغين ، مع ترك البيض فقط في الطبق.
- فقس البيض الذي تم جمعه لمدة 24 ساعة في الظلام عند 25 درجة مئوية للحصول على يرقات J2. اجمع يرقات J2 ، وضعها في أنبوب ، واغسلها ثلاث مرات باستخدام ddH2O لتجربة RNAi15.
- انقل يرقات J2 إلى أنبوب 2 مل الذي يحتوي على محلول dsRNA وأضف محلول ريسورسينول (ملفوف في صفيح ومذاب في الماء) لإنتاج تركيز نهائي بنسبة 1.0٪. احتضن اليرقات بالطرد المركزي عند 15 × جم على طاولة اهتزاز لمدة 24 ساعة عند 25 درجة مئوية لضمان امتصاص اليرقات بفعالية ل dsRNA.
- نقع نفس الكمية من الديدان الخيطية في المخزن المؤقت للنقع بدون مسبار dsRNA أو باستخدام مسبار GFP dsRNA كعنصر تحكم. استخدم جين GFP (gfp ، M62653.1) كعنصر تحكم غير داخلي المنشأ وتوليف dsRNA من gfp باستخدام الاشعال الخاصة بالجينات T7-GFP-F / R.
4. الكشف عن qPCR
- نظف يرقات J2 باستخدام ddH2O ، بما في ذلك تلك التي تعاني من تداخل جيني مستهدف ، وتداخل جيني GFP ، ومجموعة التحكم غير المضطربة. استخراج إجمالي الحمض النووي الريبي من كل مجموعة باستخدام الطريقة الموضحة أعلاه.
- بدء تشغيل qPCR.
- صمم التمهيدي q-ppm-1-F/R باستخدام البرنامج المطلوب (انظر جدول المواد).
- قم بإعداد تفاعل qPCR في 12 ميكرولتر يحتوي على 1 ميكرولتر من cDNA ، و 6 ميكرولتر من بريمكس الفلورسنت ، و 0.4 ميكرولتر من كل تمهيدي (10 pmol / l) ، وماء مقطر معقم.
- أداء qPCR على النحو التالي: 2 دقيقة عند 95 درجة مئوية ؛ تليها 40 دورة من 10 ثانية عند 95 درجة مئوية ، و 30 ثانية عند 55 درجة مئوية ، و 1 دقيقة عند 72 درجة مئوية.
- استخدم جين actb (رقم انضمام بنك الجينات EU100952) وجين tbb-2 (رقم انضمام بنك الجينات MT769316) ، أو جينات أخرى ، كجينات مرجعية داخلية لتقييم التغيرات في مستوى التعبير الجيني بعد RNAi15.
- وفقا لقيمة عتبة الدورة (Ct) ومنحنى الانحلال ، استخدم طريقة 2-ΔΔCt لتقدير مستوى التعبير النسبي للجين المستهدف والتحقق من كفاءة التداخل.
- اطرح قيمة Ct للجين المرجعي الداخلي لكل عينة من قيمة Ct للجين المستهدف للحصول على قيمة ΔCt. ثم، اطرح قيمة ΔCt لمجموعة التداخل من قيمة ΔCt للمجموعة الضابطة للحصول على قيمة ΔΔCt.
ملاحظة: تشير قيمة ΔΔCt الأكبر من 0 إلى أن التداخل فعال.
- اطرح قيمة Ct للجين المرجعي الداخلي لكل عينة من قيمة Ct للجين المستهدف للحصول على قيمة ΔCt. ثم، اطرح قيمة ΔCt لمجموعة التداخل من قيمة ΔCt للمجموعة الضابطة للحصول على قيمة ΔΔCt.
5. تقييم طول الجسم من البالغين الديدان الخيطية بعد الحمض النووي الريبي
- بعد RNAi ، استزرع يرقات J2 حتى سن البلوغ على مروج B. cinerea في ألواح PDA لمدة 60 ساعة عند 25 درجة مئوية15.
- اجمع البالغين باستخدام طريقة قمع Bellman (راجع الخطوة 1.1.2.1)14.
- احصل على صور للديدان الخيطية البالغة تحت المجهر واستخدم برنامج ImageJ (أو برامج قياس أخرى) لقياس أطوال الجسم.
- قم بقياس الطول باستخدام ImageJ عن طريق تحديد تحليل | تعيين المقياس. إذا كانت المسافة معروفة، فأدخل قيمة طول الخط المستقيم المرسوم. أدخل وحدة الطول.
- حدد خانة الاختيار عمومي (استخدم هذا المعيار لكافة الصور)، وانقر فوق موافق لتحديد الطول المراد قياسه بخط مستقيم على الصورة المراد قياسها.
- استخدم الأمر Ctrl + M (القياس) لعرض النتائج وتسجيلها في نافذة النتائج .
- خذ قياسات 50 من الذكور و 50 من الإناث من الديدان الخيطية للتحليل الإحصائي12.
- تحليل البيانات عن طريق حساب المتوسط والانحراف المعياري لكل عينة. قارن بين وسائل العينات من المجموعات المختلفة باستخدام اختبار t للطالب.
النتائج
تحليل تعبير ppm-1 عن B. xylophilus بعد RNAi
كان مستوى التعبير النسبي لجين ppm-1 من B. xylophilus المنقوع مع GFP dsRNA والمنقوع بالجين المستهدف dsRNA 0.92 و 0.52 ، على التوالي (تم تعيين مستوى التعبير الجيني ppm-1 لمجموعة التحكم المعالجة ب ddH2O إلى 1) (الشكل 1). وبالتالي ، فإن dsRNA الخارجي ليس له أي تأثير على تعبير ppm-1 ل B. xylophilus. ومع ذلك ، يمكن ل ppm-1 dsRNA أن يمنع بشكل فعال التعبير عن الجين المستهدف.
تأثير تعبير ppm-1 على نمو وتطور B. xylophilus
بعد RNAi ، انخفض حجم البالغين بشكل ملحوظ (الشكل 2) ، مما أدى إلى النمط الظاهري المتحور SMA (حجم الجسم الصغير). على الرغم من أن الأفراد الذين عولجوا بالحمض النووي الريبي تطوروا إلى مرحلة النضج الجنسي ، إلا أن طول أجسامهم كان أصغر بكثير من البالغين العاديين. على وجه التحديد ، بعد RNAi في الديدان الخيطية في المرحلة J2 ، كان متوسط طول الجسم للإناث والذكور 544.61 ميكرومتر و 526.24 ميكرومتر ، على التوالي. وعلى النقيض من ذلك، بلغ متوسط طول جسم الإناث والذكور في المجموعة الضابطة 971.86 ميكرومتر و912.31 ميكرومتر، على التوالي (الشكل 3)، وهو ما يمثل اختلافات كبيرة (P = 0.0322).
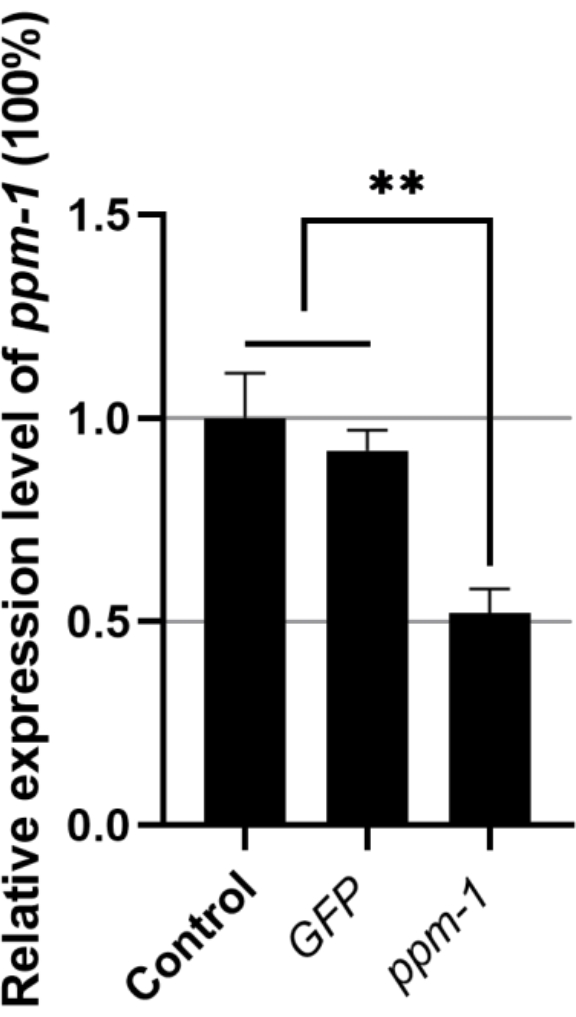
الشكل 1: التعبير عن الجين ppm-1 بعد الحمض النووي الريبي ل Bursaphelenchus xylophilus. ** P < 0.001. الاختصارات: RNAi = تداخل الحمض النووي الريبي; GFP = بروتين الفلورسنت الأخضر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تقليل طول الجسم للبالغين بعد تداخل جزء في المليون-1 في Bursaphelenchus xylophilus. صور لذكر بالغ (A) وأنثى (C) من مجموعة RNAi. صور لذكر بالغ (B) وأنثى (D) من المجموعة الضابطة. أشرطة المقياس = 50 ميكرومتر. اختصار: RNAi = تداخل الحمض النووي الريبي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
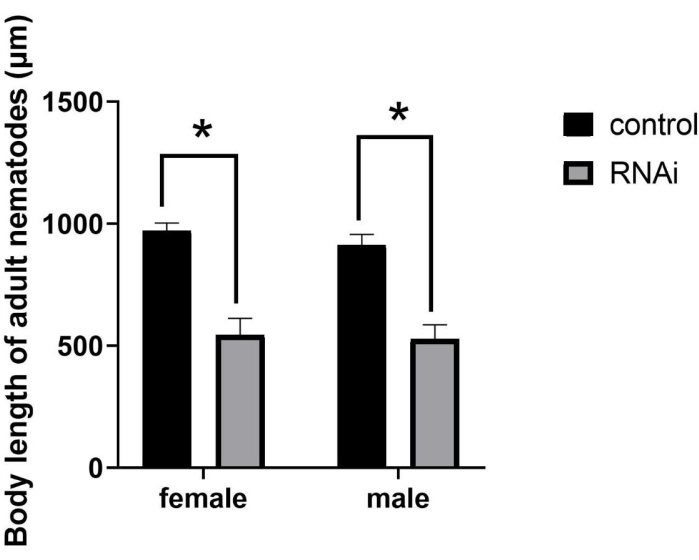
الشكل 3: القياس الكمي والتحليل الإحصائي لطول جسم البالغين من Bursaphelenchus xylophilus بعد RNAi للجين ppm-1 . (*P = 0.0322). اختصار: RNAi = تداخل الحمض النووي الريبي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
على الرغم من أن تاريخ الحياة والبيئة الطفيلية ل B. xylophilus تختلف عن تلك الموجودة في الديدان الخيطية الأخرى ، إلا أنه كان هناك بحث محدود حول التسبب الجزيئي لهذا العامل الممرض النباتي. على الرغم من التقدم الكبير المحرز في تطبيق تقنية تحرير الجينوم CRISPR / Cas9 في C. elegans والديدان الخيطية الأخرى ، إلا أن تقنية RNAi المطبقة على B. xylophilus هي الوحيدة التي تم نشرها حتى الآن17. RNAi هي واحدة من أقوى الأدوات المتاحة لدراسة الوظيفة الجينية للديدان الخيطية وقد استخدمت على نطاق واسع في الأبحاث التي توضح وظيفة جين B. xylophilus ، ومسارات نقل الإشارة ، والعلاج الجيني18،19،20. وعلى النقيض من نهج الضربة القاضية الجينية المستخدمة في نماذج اللافقاريات، فإن الضربة القاضية بوساطة الحمض النووي الريبي للجينات المستهدفة في الديدان الخيطية تمكن من التقييم السريع لوظيفة الجينات.
هناك ثلاث طرق لإجراء الحمض النووي الريبي في C. elegans: الحقن 6 ، نقع21 ، وتغذية6. نظرا لأن يرقات J2 لا تتغذى إلا بعد الإصابة ، فإن طريقة النقع تستخدم عادة في الحمض النووي الريبي للديدان الخيطية الطفيلية النباتية. الخطوة الرئيسية في طريقة النقع هي إضافة غاز أعصاب لتحفيز الديدان الخيطية على التغذية. استخدم أوروين الأخطبوط لأول مرة لتحفيز J2 من نوعين من الديدان الخيطية الفموية ، Globodera pallida ، و Heterodera glycines ، مما أدى إلى امتصاص dsRNA من محلول النقع22. تم استخدام نفس الطريقة بنجاح لحث J2 من الديدان الخيطية ذات العقدة الجذرية Meloidogyne incognita على امتصاص dsRNA 23. يمكن أن يحفز ريسورسينول أيضا امتصاص dsRNA بواسطة J2 من M. incognita وقد يكون أكثر فعالية من الأخطبوط لهذه الديدان الخيطية24. علاوة على ذلك ، فإن إضافة سبيرميدين إلى المخزن المؤقت للنقع مع وقت حضانة طويل أدى إلى تحسين كفاءة الحمض النووي الريبي في الديدان الخيطية25. بعد 24 ساعة من النقع ، يدخل dsRNA بفعالية B. xylophilus ، وبالتالي إسكات جين ppm-1.
وبالتالي ، يوفر هذا البروتوكول مرجعا للدراسة المستقبلية للحمض النووي الريبي للديدان الخيطية الطفيلية النباتية الأخرى مع سلوك البلعمة. بالإضافة إلى ذلك ، يلعب تأثير التعليق لطاولة الاهتزاز دورا مهما في زيادة الاستفادة من طريقة النقع. هذه الطريقة يمكن أن تسمح بالعلاج المتزامن لعدد كبير من الديدان الخيطية. يسهل تشغيل الحمض النووي الريبي عند التركيز على الجينات المستهدفة التي لا يمكن الحصول على الطفرات بسهولة وتقييم التأثيرات في نقاط مختلفة من التطور لأن الديدان الخيطية يمكن نقعها في أي مرحلة من مراحل الحياة. وبالتالي ، يمكن استخدام RNAi لدراسة وظيفة جين معين في مرحلة نمو محددة. قام وانغ وآخرون بتحليل تأثير MAPK على خصوبة B. xylophilus ودوره المهم في نمو وتطور الديدان الخيطية باستخدام dsRNA نقع26. وجد Qiu et al. أن سرعة هجرة وخصوبة B. xylophilus في أشجار الصنوبر انخفضت بعد انخفاض تنظيم جين Bxpel1 ، مما يشير إلى أن هذا الجين هو عامل مسبب للأمراض مهم في B. xylophilus27.
ومع ذلك ، ليس كل RNAi في الديدان الخيطية يعمل من خلال dsRNA. قام دولوفيتش وستريت بتطبيق الحمض النووي الريبي المتداخل الصغير (siRNAs) بدلا من الحمض النووي الريبي الأطول dsRNAs للتداخل بنجاح مع Strongyloides ratti28. قد يكون الحد من استخدام dsRNA ل RNAi في Strongyloides مرتبطا بغياب جينات مثل rsd-6 أو sid-1 أو sid-2 المعروفة بأنها تشارك في امتصاص dsRNA. يرتبط الحمض النووي الريبي أيضا بعيوب التأثير الموضعي والضربة القاضية المؤقتة وغير المكتملة وله فعالية محدودة لبعض الجينات وأنواع الخلايا (مثل الخلايا العصبية)29. ومع ذلك ، حتى يتم تحقيق اختراق في التكنولوجيا المعدلة وراثيا ل B. xylophilus ، يمثل RNAi استراتيجية بحثية فعالة نسبيا.
أظهر RNAi إمكانات كبيرة لحماية المحاصيل. باستخدام تقنية RNAi ، تم تربية البطاطس المعدلة وراثيا القادرة على إنتاج dsRNA التي تستهدف جينات الديدان الخيطية عقدة الجذر لإنتاج مقاومة كاملة للديدان الخيطية عقدة الجذر30. يمكن أن يوفر التعبير عن dsRNAs التي تستهدف جينات الحشرات حماية المحاصيل في غياب المبيدات الحشرية الكيميائية ويوفر ميزة إضافية تتمثل في عدم إنتاج البروتينات الأجنبية ، مع عدد غير محدود تقريبا من الجينات المستهدفة31. لذلك ، فإن البحث المتسارع في مجال الحمض النووي الريبي التطبيقي لمكافحة الآفات سيوفر أمنا بيولوجيا أفضل لمكافحة الديدان الخيطية النباتية من الطرق المعدلة وراثيا أو طرق المكافحة الكيميائية الأخرى.
في الختام ، يصف هذا البروتوكول إعداد dsRNA للجين ppm-1 لتحقيق RNAi عن طريق نقع يرقات B. xylophilus مباشرة في محلول dsRNA. تم تأكيد تأثير التداخل بناء على انخفاض كبير في حجم جسم اليرقات بعد أن تطورت إلى بالغين مقارنة بتأثير التحكم ، مما يدل على أن الجين ppm-1 يمارس تأثيرات على نمو وتطور B. xylophilus. توفر هذه الدراسة أساسا نظريا لمزيد من الكشف عن وظيفة ppm-1 مع قيمة عملية إضافية في توجيه المكافحة البيولوجية لهذا الطفيلي النباتي. ويعتقد أنه مع زيادة الكشف عن آلية تكنولوجيا الحمض النووي الريبي وتحسينها، فإن تطبيقها في مجال مكافحة B. xylophilus سيكون له آفاق واسعة.
Disclosures
ولم يعلن عن أي تضارب في المصالح.
Acknowledgements
تم تمويل هذا البحث من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (31870637 ، 31200487) وبتمويل مشترك من خطة تشجيانغ الرئيسية للبحوث (2019C02024 ، LGN22C160004).
Materials
| Name | Company | Catalog Number | Comments |
| Baermann funnel | n/a | n/a | to isolate nematodes |
| Beacon Designer 7.9 | Shanghai kangyusheng information technology co. | n/a | to design qPCR primers |
| Botrytis cinerea | n/a | n/a | as food for nematodes |
| Bursaphelenchus xylophilus | n/a | n/a | its number was NXY61 and was it was originally extracted from diseased Pinus massoniana in Ningbo, Zhejiang province, China. |
| constant temperature incubator | Shanghai Jing Hong Laboratory Instrument Co. | H1703544 | to cultur nematodes |
| Electrophoresis apparatus | Bio-Rad Laboratories | 1704466 | to achieve electrophoretic analysis |
| Ethanol, 75% | Sinopharm Chemical Reagent Co. | 80176961 | to extract RNA |
| Ex Taq Polymerase Premix | Takara Bio Inc. | RR030A | for PCR |
| Ex Taq Polymerase Premix | Takara Bio Inc. | RR390A | for PCR |
| Gel imager | LongGene Scientific Instruments Co. | LG2020 | to make nucleic acid bands visible |
| GraphPad Prism 8 | GraphPad Prism | n/a | to analyze the data and make figurs |
| High Speed Centrifuge | Hangzhou Allsheng Instruments Co. | AS0813000 | centrifug |
| High-flux tissue grinder | Bertin | to extract RNA | |
| ImageJ software | National Institutes of Health | n/a | to measure the body lengths |
| isopropyl alcohol | Shanghai Aladdin Biochemical Technology Co. | L1909022 | to extract RNA |
| Leica DM4B microscope | Leica Microsystems Inc. | to observe nematodes | |
| magnetic beads | Aoran science technology co. | 150010C | to extract RNA |
| MEGAscript T7 High Yield Transcription Kit | Thermo Fisher Scientific Inc. | AM1333 | to synthesize dsRNA in vitro |
| NanoDrop ND-2000 spectrophotometer | Thermo Fisher Scientific Inc. | NanoDrop 2000/2000C | to analyze the quality of the dsRNA |
| PCR Amplifier | Bio-Rad Life Medical Products Co. | 1851148 | to amplify nucleic acid sequence |
| Petri dishes | n/a | n/a | to cultur nematodes |
| pGEM-T Easy vector | Promega Corporation | A1360 | for cloning |
| Potato Dextrose Agar (Medium) | n/a | n/a | to cultur Botrytis cinerea |
| Prime Script RT reagent Kit with gDNA Eraser | Takara Bio Inc. | RR047B | to synthetic cDNA |
| Primer Premier 5.0 | PREMIER Biosoft | n/a | to design PCR primers |
| primers:ppm-1-F/R | Tsingke Biotechnology Co. | n/a | F: 5'-GATGCGAAGTTGCCAATCATTCT -3'; R: 5'- CCAGATCCAGTCCACCATACACC -3 |
| q-ppm-1-F/R | Tsingke Biotechnology Co. | n/a | F: 5'-CATCCGAATGGCAATACAG-3'; R: 5'-ACTATCCTCAGCGTTAGC-3' |
| Real-time thermal cycler qTOWER 2.2 | Analytique Jena Instruments (Beijing) Co. | for qPCR | |
| shaking table | Shanghai Zhicheng analytical instrument manufacturing co. | to soak nematodes | |
| stereoscopic microscope | Chongqing Optec Instrument Co. | 1814120 | to observe nematodes |
| T7-GFP-F/R | Tsingke Biotechnology Co. | n/a | F: 5'-TAATACGACTCACTATAGGGAAA GGAGAAGAACTTTTCAC-3'; R: 5'-TAATACGACTCACTATAGGGCTG TTACAAACTCAAGAAGG-3' |
| T7 promoter | Tsingke Biotechnology Co. | n/a | TAATACGACTCACTATAGGG |
| Takara MiniBEST Agarose Gel DNA Extraction Kit | Takara Bio Inc. | 9762 | to recover DNA |
| TaKaRa TB Green Premix Ex Taq (Tli RNaseH Plus) | Takara Bio Inc. | RR820A | for qPCR |
| trichloroethane | Shanghai LingFeng Chemical Reagent Co. | to extract RNA | |
| TRIzol Reagent | Thermo Fisher Scientific Inc. | 15596026 | total RNA extraction reagent,to extract RNA |
References
- Nicol, J. M., Jones, J., Gheysen, G., Fenoll, C., et al. Current nematode threats to world agriculture. Genomics and Molecular Genetics of Plant-Nematode Interactions. , 21-43 (2011).
- Jones, J. T., et al. Top 10 plant-parasitic nematodes in molecular plant pathology. Molecular Plant Pathology. 14 (9), 946-961 (2013).
- Kikuchi, T., et al. Genomic insights into the origin of parasitism in the emerging plant pathogen Bursaphelenchus xylophilus. PLoS Pathogens. 7 (9), 1002219 (2011).
- Megen, H. V., et al. A phylogenetic tree of nematodes based on about 1200 full-length small subunit ribosomal DNA sequences. Nematology. 11 (6), 927-950 (2009).
- Niu, J. H., Jian, H., Xu, J. M., Guo, Y. D., Liu, Q. RNAi technology extends its reach: Engineering plant resistance against harmful eukaryotes. African Journal of Biotechnology. 9 (45), 7573-7582 (2010).
- Fire, A., et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 91 (6669), 806-811 (1998).
- Shahid, M., Imran, A., Mazhar, H., Yusuf, Z., Rob, W. B. Engineering novel traits in plants through RNA interference. Trends in Plant Science. 11 (11), 559-565 (2006).
- Marmonier, A., et al. In vitro acquisition of specific small interfering RNAs inhibits the expression of some target genes in the plant ectoparasite Xiphinema index. International Journal of Molecular Sciences. 20 (13), 3266 (2019).
- Iqbal, S., Fosu-Nyarko, J., Jones, M. G. K. Attempt to silence genes of the RNAi pathways of the root-knot nematode, Meloidogyne incognita results in diverse responses including increase and no change in expression of some genes. Frontiers in Plant Science. 11, 328 (2020).
- Zhou, L. F., et al. Molecular characterization and functional analysis of akt-1 in pinewood nematode, Bursaphelenchus xylophilus. Forest Pathology. 51 (1), 12647 (2021).
- Zhou, L. F., et al. The role of mab-3 in spermatogenesis and ontogenesis of pinewood nematode, Bursaphelenchus xylophilus. Pest Management Science. 77 (1), 138-147 (2021).
- Tang, J., et al. Bxy-fuca encoding α-L-fucosidase plays crucial roles in development and reproduction of the pathogenic pinewood nematode, Bursaphelenchus xylophilus. Pest Management Science. 76 (1), 205-214 (2020).
- Wang, J. H., et al. Molecular characterization and functional analysis of daf-8 in the pinewood nematode, Bursaphelenchus xylophilus. Journal of Forestry Research. , (2021).
- Viglierchio, D. R., Schmitt, R. V. On the methodology of nematode extraction from field samples: Baermann funnel modifications. Journal of Nematology. 15 (3), 438-444 (1983).
- Zhu, N., et al. Observation and quantification of mating behavior in the pinewood nematode, Bursaphelenchus xylophilus. Journal of Visualized Experiments: JoVE. (118), e54842 (2016).
- Zhou, L. F., Chen, F. M., Ye, J. R., Pan, H. Y. Selection of reliable reference genes for RT-qPCR analysis of Bursaphelenchus mucronatus gene expression from different habitats and developmental stages. Frontiers in Genetics. 9, 269-279 (2018).
- Wang, M., et al. Double-stranded RNA-mediated interference of dumpy genes in Bursaphelenchus xylophilus by feeding on filamentous fungal transformants. International Journal for Parasitology. 46 (5-6), 351-360 (2016).
- Ma, H. B., Lu, Q., Liang, J., Zhang, X. Y. Functional analysis of the cellulose gene of the pine wood nematode, Bursaphelenchus xylophilus, using RNA interference. Genetics and Molecular Research: GMR. 10 (3), 1931-1941 (2011).
- Cheng, X. Y., Dai, S. M., Xiao, L., Xie, B. Y. Influence of cellulase gene knock down by dsRNA interference on the development and reproduction of the pine wood nematode, Bursaphelenchus xylophilus. Nematology. 12 (12), 225-233 (2010).
- Xue, Q., Wu, X. Q., Zhang, W. J., Deng, L. N., Wu, M. M. Cathepsin L-like cysteine proteinase genes are associated with the development and pathogenicity of pine wood nematode, Bursaphelenchus xylophilus. International Journal of Molecular Sciences. 20 (1), 215 (2019).
- Tabara, H., Grishok, A., Mello, C. C. RNAi in C. elegans: Soaking in the genome sequence. Science. 282 (5388), 430-431 (1998).
- Urwin, P. E., Lilley, C. J., Atkinson, H. J. Ingestion of double-stranded RNA by pre parasitic juvenile cyst nematodes leads to RNA interference. Molecular Plant-Microbe Interactions: MPMI. 15 (8), 747-752 (2002).
- Bakhetia, M., Charlton, W., Atkinson, H. J., McPherson, M. J. RNA interference of dual oxidase in the plant nematode Meloidogyne incognita. Molecular Plant-Microbe Interactions: MPMI. 18 (10), 1099-1106 (2005).
- Rosso, M. N., Dubrana, M. P., Cimbolini, N., Jaubert, S., Abad, P. Application of RNA interference to root-knot nematode genes encoding esophageal gland proteins. Molecular Plant-Microbe Interactions: MPMI. 18 (7), 615-620 (2005).
- Chen, Q., Rehman, S., Smant, G., Jones, J. T. Functional analysis of pathogenicity proteins of the potato cyst nematode Globodera rostochiensis using RNAi. Molecular Plant-Microbe Interactions: MPMI. 18 (7), 621-625 (2005).
- Wang, D. D., Li, Y., Li, J., Xie, B. Y., Chen, G. H. Molecular clone and its RNAi interference effect analysis of mapk gene in Bursaphelenchus xylophilus ( in Chinese). Acta Phytopathologica Sinica. 46 (5), 662-669 (2016).
- Qiu, X., Wu, X., Huang, L., Ye, J. R. Influence of Bxpel1 gene silencing by dsRNA interference on the development and pathogenicity of the pine wood nematode, Bursaphelenchus xylophilus. International Journal of Molecular Sciences. 17 (1), 125 (2016).
- Dulovic, A., Streit, A. RNAi-mediated knockdown of daf-12 in the model parasitic nematode Strongyloides ratti. PLoS Pathogens. 15 (3), 1007705 (2019).
- Li, L., Zhao, H., Cui, Y., Wei, H., Li, M. Research progress of gene editing technology. Life Science Research. 21 (3), 268-274 (2017).
- Bindhya, C. Y., Karuppannan, V., Kuppuswamy, S. Host-generated double stranded RNA induces RNAi in plant-parasitic nematodes and protects the host from infection. Molecular and Biochemical Parasitology. 148 (2), 219-222 (2006).
- Jiang, Z., Sher, A. K., David, G. H., Ralph, B. Next-generation insect-resistant plants: RNAi-mediated crop protection. Trends in Biotechnology. 35 (9), 871-882 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved