Method Article
Очистка и расширение мышечных инвариантных естественных Т-киллеров для исследований in vitro и in vivo
В этой статье
Резюме
Мы описываем быстрый и надежный протокол для обогащения инвариантных естественных Т-киллеров (iNKT) клеток из мышиной селезенки и расширения их in vitro до подходящих чисел для исследований in vitro и in vivo.
Аннотация
Инвариантные естественные Т-киллеры (iNKT) представляют собой врожденные Т-лимфоциты, экспрессирующие сохраненный полуинвариантный Т-клеточный рецептор (TCR), специфичный для собственных или микробных липидных антигенов, представленных неполиморфной молекулой CD1d, связанной с MHC класса I. Доклинические и клинические исследования подтверждают роль iNKT-клеток в раке, аутоиммунитете и инфекционных заболеваниях. Клетки iNKT очень сохранены во всех видах, и их исследование было облегчено мышиными моделями, включая мышей с дефицитом CD1d или iNKT-дефицитом, и возможностью однозначно обнаружить их у мышей и мужчин с тетрамерами CD1d или mAbs, специфичными для полуинвариантного TCR. Тем не менее, клетки iNKT редки, и их необходимо расширить, чтобы достичь управляемых чисел для любого исследования. Поскольку генерация первичной мышиной клеточной линии iNKT in vitro оказалась сложной, мы создали надежный протокол для очистки и расширения селезеночных клеток iNKT у трансгенных мышей iVα14-Jα18 (iVα14Tg), у которых клетки iNKT встречаются в 30 раз чаще. Здесь мы показываем, что первичные селезеночные iVα14Tg iNKT клетки могут быть обогащены с помощью процесса иммуномагнитного разделения, давая около 95-98% чистых клеток iNKT. Очищенные клетки iNKT стимулируются шариками против CD3/CD28 плюс IL-2 и IL-7, в результате чего к дню происходит 30-кратное расширение +14 культуры с чистотой 85-99%. Расширенными клетками iNKT можно легко генетически манипулировать, обеспечивая бесценный инструмент для препарирования механизмов активации и функционирования in vitro и, что более важно, также при приемном переносе in vivo.
Введение
Инвариантные естественные Т-клетки-киллеры (iNKT-клетки) представляют собой врожденные Т-лимфоциты, которые экспрессируют полуинвариантный рецептор αβ Т-клеток (TCR), образованный у мышей инвариантной цепью Vα14-Jα18 в паре с ограниченным набором разнообразных Vβ-цепей1,который специфичен для липидных антигенов, представленных молекулой CD1d2класса I MHC. Клетки iNKT проходят программу отбора агонистов, в результате чего уже в тимусе происходит приобретение активированного/врожденного эффекторного фенотипа, который происходит через несколько стадий созревания3,4,продуцируяCD4+ и CD4- подмножество. Благодаря этой программе клетки iNKT приобретают различные эффекторные фенотипыT-хелпера(T H), а именно TH1 (iNKT1), TH2 (iNKT2) и TH17 (iNKT17), идентифицируемые по экспрессии транскрипционных факторов T-bet, GATA3, PLZF и RORγt соответственно5. Клетки iNKT распознают ряд микробных липидов, но также самореактивны против эндогенных липидов, которые регулируются в контексте патологических ситуаций клеточного стресса и повреждения тканей, таких как рак и аутоиммунитет2. После активации клетки iNKT модулируют функции других врожденных и адаптивных иммунных эффекторных клеток посредством прямого контакта и производства цитокинов2.
Исследования клеток iNKT были облегчены мышиными моделями, включая мышей с дефицитом CD1d или Jα18, а также производством антиген-нагруженных cd1d тетрамеров плюс генерация моноклональных антител (mAbs), специфичных для полуинвариантного TCR человека. Однако генерация первичной мышиной клеточной линии iNKT оказалась затруднительной. Чтобы лучше охарактеризовать противоопухолевые функции клеток iNKT и использовать их для приемной клеточной терапии, мы создали протокол для очистки и расширения селезеночных iNKT-клеток трансгенных мышей iVα14-Jα18 (iVα14Tg)6,у которых клетки iNKT встречаются в 30 раз чаще, чем у мышей дикого типа.
Расширенные клетки iNKT могут быть использованы для анализов in vitro и in vivo при переносе обратно мышам. В этой обстановке, например, мы показали их мощные противоопухолевые эффекты7. Кроме того, расширенные in vitro клетки iNKT поддаются функциональной модификации посредством переноса или редактирования генов до их инъекции in vivo8,что позволяет проводить глубокий функциональный анализ молекулярных путей, а также прокладывать путь для передовой клеточной терапии.
протокол
Процедуры, описанные здесь, были рассмотрены и одобрены Институциональным комитетом по уходу за животными и их использованию (IACUC) (No 1048) в Научном институте Сан-Раффаэле.
ПРИМЕЧАНИЕ: Все процедуры должны выполняться в стерильных условиях. Все используемые реагенты перечислены в Таблице материалов.
1. Обработка селезенки
- Усыпление мышей iVα14-Jα18 путем вдыхания CO2 в соответствии с институциональной политикой.
ПРИМЕЧАНИЕ: мыши iVα14-Jα18 должны быть старше 8 недель. Чтобы избежать отторжения клеток от переноса клеток in vivo, учтите, что клетки, выделенные у самок мышей, могут быть усыновлены как у самцов, так и у самок реципиентов, тогда как клетки, выделенные у самцов мышей, могут быть перенесены только у самцов-реципиентов. Для экспериментов in vitro не следует учитывать гендерную предвзятость. Больше мышей может быть объединено, чтобы получить больше клеток. - Рассекните селезенку мыши и разбейте ее через клеточный ситечко 70 нм, чтобы получить одноклеточную суспензию в 10 мл фосфатно-буферного физиологического раствора (PBS) с 2% фетальной бычьей сывороткой (FBS).
- Центрифуга при 300 х г в течение 5 мин.
- Удаляют супернатант путем инверсии и обрабатывают буфером лизиса эритроцитов. Повторно суспендировать клеточную гранулу 1 мл стерильного буфера лизирования ACK (аммоний-хлорид-калий), инкубировать в течение 3 мин при комнатной температуре и блокировать 5 мл PBS с 2% FBS. Центрифуга при 300 х г в течение 5 мин.
ПРИМЕЧАНИЕ: ACK является коммерчески доступным; он состоит из раствора 0,15 M NH4Cl, 10 мМ KHCO3и 0,1 мМ Na2ЭДТА (этилендиаминтетрауксусной кислоты), растворенного в бидистиллированномH2O,рН 7,2-7,4. Если домашнее, стерилизуйте фильтрацией с помощью фильтра 0,22 мкм. - Удалите супернатант путем инверсии. Повторно суспендировать ячейку гранулы в 3 мл PBS с 2% FBS и удалить жировые остатки путем пипетки. При необходимости объедините клетки, поступающие от разных мышей.
- Подсчитайте клетки и сохраните 50 мкл для анализа FACS.
2. Обогащение Т-клеток
ПРИМЕЧАНИЕ: Для этапов обогащения работайте быстро, держите ячейки холодными и используйте растворы, предварительно охлажденные при 4 ° C в течение ночи, а затем хранящиеся на льду
- Центрифуга при 300 х г в течение 5 мин.
- Повторно суспендировать все клетки в соответствующем количестве PBS с 2% FBS (500 мкл на 107 клеток) и блокатором Fc (2,5 мкл х 107 клеток); инкубировать в течение 15 мин при комнатной температуре (RT).
- Промывайте 1-2 мл сепарационного буфера MACS (МБ) на 107 общих ячеек и центрифугу при 300 х г в течение 10 мин.
ПРИМЕЧАНИЕ: Буфер MACS коммерчески доступен. Он состоит из PBS pH 7,2, 0,5% бычьего сывороточного альбумина (BSA) и 2 мМ ЭДТА. Если домашнее, стерилизуйте фильтрацией с помощью фильтра 0,22 мкм. - Удаляют супернатант путем инверсии и окрашивают клетки CD19-FITC и H2(IA b)-FITC (используйте 5 мкл х 107 клеток в 100 мкл МБ). Хорошо перемешать и инкубировать в течение 15 мин в темноте при 4-8 °C.
- Промыть ячейки, добавив 1−2 мл МБ на 107 ячеек и центрифугу по 300 х г в течение 10 мин.
- Пипетка полностью отключает супернатант и повторно суспендирует клеточную гранулу в 90 мкл МБ на 107 общих клеток. Добавьте 10 мкл микрогранул Anti-FITC на 107 клеток. Хорошо перемешать и инкубировать в течение 15 мин в темноте при 4-8 °C.
- Промыть ячейки, добавив 1−2 мл МБ на 107 клеток и центрифугу по 300 х г в течение 10 мин.
- Пипетка полностью отключает супернатант и повторно суспендирует до 1,25 х 108 ячеек в 500 мкл МБ.
- Поместите колонку LD в магнитное поле сепаратора MACS, чтобы перейти к истощению. Чтобы избежать засорения, нанесите фильтр предварительного разделения на колонку LD и промойте 2 мл МБ.
- Когда резервуар колонны пуст, нанесите суспензию ячейки на фильтр. Соберите непомеченные ячейки, проходящие через столбец.
- Промыть 3 раза 1 мл МБ, только когда резервуар колонны пуст. Соберите общий объем сточных вод, которые будут обогащены Т-клетками, и подсчитайте ячейки. Всегда сохраняйте 50 мкл для анализа FACS.
3. Обогащение клеток iNKT
- Центрифугу при 300 х г в течение 5 мин и удаляют супернатант путем инверсии.
- Окрашивают клетки CD1d-тетрамером-PE (мышиный PBS57-CD1d-тетрамер), согласно титрованию антител в 50 мкл МБ на 106 клеток. Хорошо перемешать и инкубировать в течение 30 мин в темноте на льду.
ПРИМЕЧАНИЕ: Процедура также может быть выполнена с метками APC mCD1d тетрамерами и бусинами против APC; корректировка фторхромов, используемых при последующем окрашивании, соответствующим образом. В настоящем протоколе мы использовали мышиные PBS-57-CD1d-тетрамеры, предоставленные NIH. αgalactosylceramide (αGal-Cer) является прототипом антигена, распознаваемого клетками iNKT; PBS-57 является аналогом αGal-Cer с улучшенной растворимостью9; Тетрамерная установка NIH обеспечивает лиганд PBS-57, смешанный с тетрамерами CD1d. Тем не менее, другие димеры CD1d / тетрамеры / декстрамеры коммерчески доступны и могут быть загружены липидным антигеном как αGal-Cer. Мы предполагаем возможность корректировки протокола для их использования. - Промыть ячейки, добавив 1−2 мл МБ на 107 клеток и центрифугу по 300 х г в течение 10 мин.
- Пипетка полностью отключила супернатант и повторно суспендировала клеточную гранулу в 80 мкл МБ на 107 общих клеток. Добавьте 20 мкл анти-ПЭ микрошариков на 107 клеток. Хорошо перемешать и инкубировать в течение 15 мин в темноте при 4-8 °C.
- Промыть ячейки, добавив 1−2 мл МБ на 107 ячеек и центрифугу по 300 х г в течение 10 мин.
- Пипетка полностью снимает супернатант и повторно суспендирует до 108 клеток в 500 мкл МБ. В противном случае, если ячейки превышают10 8,отрегулируйте объем соответствующим образом.
- В соответствии с количеством ячеек поместите колонку LS (до10 8)или MS (до10 7)в магнитное поле сепаратора MACS. Смойте столбик МБ (3 мл для LS, 500 мкл для MS).
- Нанесите суспензию ячейки на столбец.
- Собирайте непомеченные клетки, которые проходят через них. Промывайте столбец 3 раза, добавляя соответствующее количество МБ (3 x 3 мл для столбца LS, 3 x 500 мкл для столбца MS) только тогда, когда резервуар колонны пуст. Суммарные стоки составляют отрицательную долю.
- Извлеките столбец из магнитного поля и поместите его на новую коллекционную трубку.
- Пипетка MB на колонку (5 мл для колонки LS или 1 мл для колонки MS); протолкните предоставленный плунжер в колонну и смывайте положительную фракцию (обогащенную ячейками iNKT).
- Для дальнейшего увеличения восстановления клеток iNKT центрифугируют отрицательную фракцию при 300 х г в течение 10 мин и повторяют шаги 3,6-3,7 с новой колонкой LS или MS. Объедините положительные дроби и определите количество ячеек. Сохраните 50 мкл как положительных, так и отрицательных фракций для анализа FACS.
- Проверьте этапы очистки с помощью анализа FACS. Образцы включают: селезенку ex-vivo, фракцию, обогащенную Т-клетками, положительную фракцию iNKT и отрицательную фракцию iNKT. Окрашивают клетки с помощью: CD19-FITC, IAb-FITC, CD1d-тетрамер-PE, TCRβ-APC и DAPI.
ПРИМЕЧАНИЕ: Ожидаемое восстановление из одной мыши iVα14-Jα18 составляет 2x106 ячеек iNKT.
4. Активация и расширение ячеек iNKT
- Активируйте очищенные клетки iNKT с помощью мышиного Т-активатора против CD3 / CD28 магнитных шариков в соотношении 1:1.
- Центрифугирование положительной фракции ячейки iNKT при 300 х г в течение 5 мин.
- Тем временем перенесите соответствующий объем анти-CD3/CD28 магнитных шариков на трубку и добавьте равный объем PBS, вихрь в течение 5 секунд. Поместите трубку на магнит на 1 минуту и выбросьте супернатант.
- Снимите трубку с магнита и повторно суспендируйте промытые магнитные шарики в надлежащем объеме полного RPMI (rpmI 1640 среда, 10% термоинактивированный FCS, 1 мМ пирувата натрия, 1% заменимых аминокислот, 10 ЕД/мл пенициллина и стрептомицина, 50 мкМ β-меркаптоэтанола), чтобы иметь 5 x 105 iNKT клеток в 1 мл. Используйте эту суспензию для повторного суспендирования центрифугированной положительной фракции iNKT.
- Пластина 1 мл клеточной суспензии (5 х10 5 iNKT ячеек) и анти-CD3/CD28 магнитные шарики в 48 скважинной пластине с 20 ЕД/мл ИЛ-2 и инкубируют при 37 °C.
- Через 5 дней добавляют 10 нг/мл ИЛ-7.
- Разделите ячейки 1:2, когда они достигнут 80-90% слияния, всегда добавляйте 20U/ml IL-2 и 10 нг/мл IL-7. В этих условиях клетки iNKT могут быть расширены на срок до 15 дней.
Результаты
Протокол, описанный в этой рукописи, позволяет обогатить клетки iNKT из селезенки трансгенных мышей iVa14-Ja18 посредством процесса иммуномагнитного разделения, обобщенного на рисунке 1А. Общие Т-клетки селезенки сначала отрицательно отбираются путем истощения В-клеток и моноцитов, за которыми следует иммуномагнитная сортировка iNKT-положительных клеток с помощью тетрамеров CD1d, нагруженных липидным антигеном PBS-57, которые позволяют специфически окрашивать только клетки iNKT. Этот протокол дает около 2 x 106 из 95-98% чистых клеток iNKT из селезенки одной мыши iVa14-Ja18 Tg. В отрицательной фракции не может быть обнаружено ни одной или очень мало ячеек iNKT(рисунок 1B).
После обогащения клетки iVa14 iNKT могут быть расширены шариками анти-CD3/CD28 плюс IL-2 и IL-7(Рисунок 2A),что приводит к 30-кратному расширению в среднем за день +14 культуры, как показано на рисунке 2B.
На рисунке 3A показана чистота клеток iNKT вместе с расширением in vitro и экспрессией молекулы CD4. Мы наблюдали уменьшение процента TCRβ+ CD1d-тетрамера+ двойных положительных клеток: сильная активация бусинами анти-CD3 / CD28 индуцирует пониженную регуляцию экспрессии TCR клеток iNKT на поверхности клетки, и появляется двойная отрицательная популяция. Большинство расширенных iNKT клеток были CD4-. На рисунке 3B показана характеристика экспрессии линейно-специфических транскрипционных факторов PLZF и RORγt на обогащенных клетках iNKT на 0-й день и 14 дней после расширения. Это окрашивание позволяет идентифицировать фенотипы NKT1 (PLZFlow RORγt-), NKT2 (PLZFhigh RORγt-) и NKT17 (PLZFint RORγt+). Будучи в основном NKT1 и NKT2, обогащенные клетки iNKT показывают TH0-подобный эффекторный фенотип. Этот фенотип сохраняется после 14 дней расширения, что подтверждается секрецией как IFN-γ, так и IL-4 после стимуляции PMA/Ionomycin, показанной на рисунке 3C.

Рисунок 1:Обогащение клеток iNKT. A) Схематическое изображение протокола иммуномагнитного разделения. B)Анализ проточной цитометрии каждой стадии обогащения. Процент частот Т-клеток показан на верхних участках, ограниченных жизнеспособными лимфоцитами. При этом процентное содержание частот клеток iNKT вдоль каждой ступени показано на нижних участках, защищенных на жизнеспособные CD19- TCRβ+ лимфоциты. Окрашивание на жизнеспособные CD19- TCRβ+ лимфоциты с ненагруженным cd1d тетрамером позволяют правильно нарисовать клеточный затвор iNKT. Показан один репрезентативный эксперимент. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2:расширение клетки iNKT in vitro. A) Количество клеток iNKT вдоль расширения клеток iNKT. Показаны три репрезентативных и независимых эксперимента. Б)Кратное увеличение количества клеток iNKT на 7 и 14 день после очистки и активации. Показаны средства ± SD. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
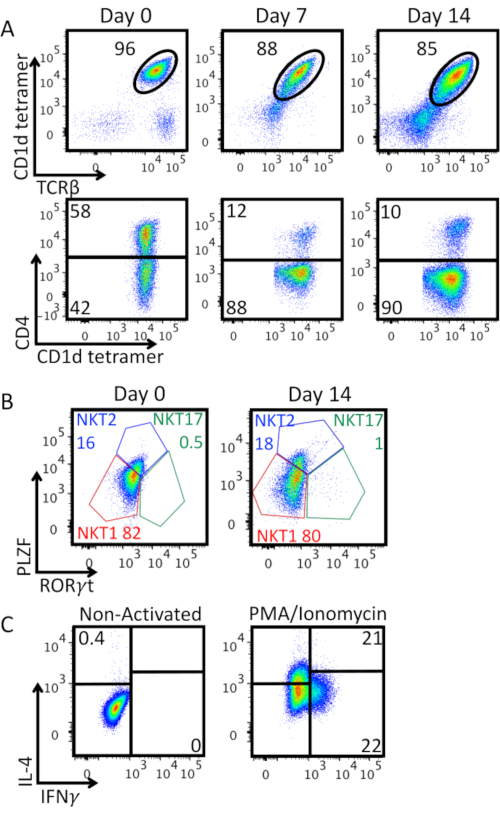
Рисунок 3:Расширенная характеристика ячеек iNKT. A) Анализ проточной цитометрии процента клеток iNKT и экспрессии CD4 в течение периода расширения. Верхние участки закрыты жизнеспособными лимфоцитами. Нижние участки закрыты на клетках iNKT (жизнеспособный CD1d-тетрамер+ TCRβ+ лимфоциты). B)Фенотипическая характеристика обогащенных (день 0) и расширенных (день 14) iNKT клеток. Участки закрыты на клетках iNKT (жизнеспособный CD1d-тетрамер+ TCRβ+ лимфоциты). Клетки были внутриядерно окрашены для факторов транскрипции с помощью буферного набора окрашивания фактора транскрипции Foxp3. Идентифицированы подмножества NKT1 (PLZFlow RORγt-), NKT2 (PLZFhigh RORγt-), и NKT17 (PLZFint RORγt+), частоты каждого подмножества показаны в процентах. C)Производство цитокинов расширенными клетками iNKT на 14-й день. Участки закрыты на клетках iNKT (жизнеспособный CD1d-тетрамер+ TCRβ+ лимфоциты). Клетки стимулировали в течение 4 часов PMA 25 нг/мл/иономицин 1 мкг/мл, в присутствии в течение последних 2 часов брефельдина А 10 мкг/мл. Затем клетки фиксировали с помощью PFA 2%, пермеабилизировали Permwash, а затем внутриклеточные окрашивали для производства цитокинов. Стратегия гейтинга была установлена на неактивированном элементе управления, левой панели. Показан один репрезентативный эксперимент. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Здесь мы показываем воспроизводимый и осуществимый протокол для получения миллионов готовых к использованию iNKT-клеток. Из-за нехватки этих клеток in vivo метод их расширения был крайне необходим. Протокол, который мы предлагаем, не требует ни конкретного прибора, ни большого количества мышей. Мы специально использовали трансгенных мышей iVα14-Jα18, чтобы уменьшить количество мышей, необходимых для процедуры.
Еще один успешный протокол расширения клеток iNKT от трансгенных мышей iVα14-Jα18 доступен в литературе10. Этот протокол включает в себя генерацию за 6 дней до очистки клеток iNKT свежих дендритных клеток, полученных из костного мозга, затем загруженных α-галактозилцерамидом и облученных, а также IL-2 и IL-7. Мы считаем уменьшение количества мышей, участвующих в процедуре, большим преимуществом протокола. Это также экономит время, так как настройка клеточной культуры длится один день, а не неделю. Возможным ограничением воспроизводимости текущего протокола может быть доступность трансгенных мышей iVα14-Jα18, которые, однако, коммерчески доступны. В отсутствие этих мышей мы предполагаем возможность использования большого количества мышей WT, но протокол должен быть настроен соответствующим образом из-за нехватки клеток iNKT у мышей WT.
Во время клеточной культуры мы обычно проверяем чистоту и фенотип расширенных клеток iNKT. Снижение процента TCRβ+ CD1d-тетрамер+ двойных положительных клеток(рисунок 3A) можнообъяснить естественной понижающей регуляцией инвариантной NKT клетки TCR от поверхности клетки после активации. Более того, большинство расширенных iNKT-клеток не экспрессировали CD4(рисунок 3A):это может представлять собой преимущество в контексте приемной клеточной терапии, поскольку было установлено, что клетки CD4- iNKT являются наиболее эффективными в контроле прогрессирования опухоли11. Более того, наблюдаемый TH0-подобный эффекторный фенотип(рисунок 3C)полностью согласуется с наблюдаемым в клетках iNKT человека после расширения in vitro и рестимуляции8,12,13,14,15. Расширенные клетки являются высокореакционноспособными in vivo и in vitro, поэтому полезны в контексте иммунотерапии на основе клеток iNKT. Приемный перенос неуправляемых или расширенных клеток iNKT предотвращает или улучшает острое заболевание «трансплантат против хозяина» (aGVHD), оставляя неизменным эффект трансплантата против лейкемии16,17,18,19. Адцептивно переносимые человеческие iNKT-клетки, расширенные in vitro с помощью αGal-Cer, облегчают ксеногенный aGVHD и этот эффект опосредуется CD4- но не CD4+ клетками20. Более того, учитывая, что iNKT-клетки не вызывают aGVHD, они представляют собой идеальные клетки для иммунотерапии CAR без необходимости удаления их TCR и доказали, что обладают длительной противоопухолевой активностью in vivo8,15. Клетки iNKT в настоящее время используются в текущих и завершенных клинических испытаниях21,22,23,24.
В заключение, описанный протокол является быстрым, простым и позволяет в 30 раз увеличить количество клеток iNKT, восстановленных из мышиной селезенки(рисунок 3B). Эти клетки могут быть легко использованы для анализов распознавания in vitro, систем кокультуры или приемной клеточной терапии в доклинических исследованиях. Клетки iNKT действительно играют решающую роль в иммунном надзоре за опухолями, инфекционных заболеваниях и аутоиммунитете. В этих контекстах клетки iNKT могут представлять собой мощный инструмент, являясь привлекательной альтернативой обычным Т-клеткам, лишенным ограничения MHC. Быстрая генерация большого количества этих клеток и возможность дальнейшего манипулирования ими in vitro может привести к разработке беспрецедентных терапевтических стратегий.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Благодарим Паоло Делабону и Джулию Касорати за научную поддержку и критическое прочтение рукописи. Мы также благодарим NIH Tetramer Core Facility за мышиный тетрамер CD1d. Исследование финансировалось Fondazione Cariplo Grant 2018-0366 (для M.F.) и стипендией Итальянской ассоциации по исследованию рака (AIRC) 2019-22604 (для G.D.).
Материалы
| Name | Company | Catalog Number | Comments |
| Ammonium-Chloride-Potassium (ACK) solution | in house | 0.15M NH4Cl, 10mM KHCO3, 0.1mM EDTA, pH 7.2-7.4 | |
| anti-FITC Microbeads | Miltenyi Biotec | 130-048-701 | |
| anti-PE Microbeads | Miltenyi Biotec | 130-048-801 | |
| Brefeldin A | Sigma | B6542 | |
| CD19 -FITC | Biolegend | 115506 | clone 6D5 |
| CD1d-tetramer -PE | NIH tetramer core facility | mouse PBS57-Cd1d-tetramers | |
| CD4 -PeCy7 | Biolegend | 100528 | clone RM4-5 |
| Fc blocker | BD Bioscience | 553142 | |
| Fetal Bovine Serum (FBS) | Euroclone | ECS0186L | heat-inactivated and filtered .22 before use |
| FOXP3 Transcription factor staining buffer | eBioscience | 00-5523-00 | |
| H2 (IAb) -FITC | Biolegend | 114406 | clone AF6-120.1 |
| hrIL-2 | Chiron Corp | ||
| Ionomycin | Sigma | I0634 | |
| LD Columns | Miltenyi Biotec | 130-042-901 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | |
| MACS buffer (MB) | in house | 0.5% Bovine Serum Albumin (BSA; Sigma-Aldrich) and 2Mm EDTA | |
| MS Columns | Miltenyi Biotec | 130-042-201 | |
| Non-essential amino acids | Gibco | 11140-035 | |
| Penicillin and streptomycin (Pen-Strep) | Lonza | 15140-122 | |
| PermWash | BD Bioscience | 51-2091KZ | |
| PFA | Sigma | P6148 | |
| Phosphate buffered saline (PBS) | EuroClone | ECB4004L | |
| PMA | Sigma | P1585 | |
| Pre-Separation Filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| Recombinat Mouse IL-7 | R&D System | 407-ML-025 | |
| RPMI 1640 with glutamax | Gibco | 61870-010 | |
| sodium pyruvate | Gibco | 11360-039 | |
| TCRβ -APC | Biolegend | 109212 | clone H57-597 |
| αCD3CD28 mouse T activator Dynabeads | Gibco | 11452D | |
| β-mercaptoethanol | Gibco | 31350010 |
Ссылки
- Bendelac, A., Savage, P. B., Teyton, L. The biology of NKT cells. Annual Review of Immunology. 25, 297-336 (2007).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews: Immunology. 13 (2), 101-117 (2013).
- Pellicci, D. G., et al. A natural killer T (NKT) cell developmental pathway iInvolving a thymus-dependent NK1.1(-)CD4(+) CD1d-dependent precursor stage. Journal of Experimental Medicine. 195 (7), 835-844 (2002).
- Benlagha, K., Kyin, T., Beavis, A., Teyton, L., Bendelac, A. A thymic precursor to the NK T cell lineage. Science. 296 (5567), 553-555 (2002).
- Lee, Y. J., Holzapfel, K. L., Zhu, J., Jameson, S. C., Hogquist, K. A. Steady-state production of IL-4 modulates immunity in mouse strains and is determined by lineage diversity of iNKT cells. Nature Immunology. 14 (11), 1146-1154 (2013).
- Griewank, K., et al. Homotypic interactions mediated by Slamf1 and Slamf6 receptors control NKT cell lineage development. Immunity. 27 (5), 751-762 (2007).
- Cortesi, F., et al. Bimodal CD40/Fas-Dependent Crosstalk between iNKT Cells and Tumor-Associated Macrophages Impairs Prostate Cancer Progression. Cell Reports. 22 (11), 3006-3020 (2018).
- Heczey, A., et al. Invariant NKT cells with chimeric antigen receptor provide a novel platform for safe and effective cancer immunotherapy. Blood. 124 (18), 2824-2833 (2014).
- Liu, Y., et al. A modified alpha-galactosyl ceramide for staining and stimulating natural killer T cells. Journal of Immunological Methods. 312 (1-2), 34-39 (2006).
- Chiba, A., et al. Rapid and reliable generation of invariant natural killer T-cell lines in vitro. Immunology. 128 (3), 324-333 (2009).
- Crowe, N. Y., et al. Differential antitumor immunity mediated by NKT cell subsets in vivo. Journal of Experimental Medicine. 202 (9), 1279-1288 (2005).
- de Lalla, C., et al. Production of profibrotic cytokines by invariant NKT cells characterizes cirrhosis progression in chronic viral hepatitis. Journal of Immunology. 173 (2), 1417-1425 (2004).
- Tian, G., et al. CD62L+ NKT cells have prolonged persistence and antitumor activity in vivo. Journal of Clinical Investigation. 126 (6), 2341-2355 (2016).
- Gaya, M., et al. Initiation of Antiviral B Cell Immunity Relies on Innate Signals from Spatially Positioned NKT Cells. Cell. 172 (3), 517-533 (2018).
- Rotolo, A., et al. Enhanced Anti-lymphoma Activity of CAR19-iNKT Cells Underpinned by Dual CD19 and CD1d Targeting. Cancer Cell. 34 (4), 596-610 (2018).
- Schneidawind, D., et al. Third-party CD4+ invariant natural killer T cells protect from murine GVHD lethality. Blood. 125 (22), 3491-3500 (2015).
- Schneidawind, D., et al. CD4+ invariant natural killer T cells protect from murine GVHD lethality through expansion of donor CD4+CD25+FoxP3+ regulatory T cells. Blood. 124 (22), 3320-3328 (2014).
- Schneidawind, D., Pierini, A., Negrin, R. S. Regulatory T cells and natural killer T cells for modulation of GVHD following allogeneic hematopoietic cell transplantation. Blood. 122 (18), 3116-3121 (2013).
- Leveson-Gower, D. B., et al. Low doses of natural killer T cells provide protection from acute graft-versus-host disease via an IL-4-dependent mechanism. Blood. 117 (11), 3220-3229 (2011).
- Coman, T., et al. Human CD4- invariant NKT lymphocytes regulate graft versus host disease. Oncoimmunology. 7 (11), 1470735 (2018).
- Xu, X., et al. NKT Cells Coexpressing a GD2-Specific Chimeric Antigen Receptor and IL15 Show Enhanced In vivo Persistence and Antitumor Activity against Neuroblastoma. Clinical Cancer Research. 25 (23), 7126-7138 (2019).
- Heczey, A., et al. Anti-GD2 CAR-NKT cells in patients with relapsed or refractory neuroblastoma: an interim analysis. Nature Medicine. 26 (11), 1686-1690 (2020).
- Exley, M. A., et al. Adoptive Transfer of Invariant NKT Cells as Immunotherapy for Advanced Melanoma: A Phase I Clinical Trial. Clinical Cancer Research. 23 (14), 3510-3519 (2017).
- Wolf, B. J., Choi, J. E., Exley, M. A. Novel Approaches to Exploiting Invariant NKT Cells in Cancer Immunotherapy. Frontiers in Immunology. 9, 384 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены