Method Article
Aufreinigung und Expansion von mausinvarianten natürlichen Killer-T-Zellen für in vitro und in vivo Studien
In diesem Artikel
Zusammenfassung
Wir beschreiben ein schnelles und robustes Protokoll, um invariante natürliche Killer-T-Zellen (iNKT) aus Mausmilz anzureichern und sie in vitro auf geeignete Zahlen für In-vitro- und In-vivo-Studien zu erweitern.
Zusammenfassung
Invariante Natural Killer T (iNKT)-Zellen sind angeborene T-Lymphozyten, die einen konservierten semi-invarianten T-Zellrezeptor (TCR) exprimieren, der spezifisch für selbst- oder mikrobielle Lipidantigene ist, die durch das nicht-polymorphe MHC-Klasse-I-bezogene Molekül CD1d präsentiert werden. iNKT-Zellen sind in allen Spezies sehr konserviert und ihre Untersuchung wurde durch Mausmodelle erleichtert, einschließlich CD1d-defizienter oder iNKT-defizienter Mäuse, und die Möglichkeit, sie eindeutig in Mäusen und Männern mit CD1d-Tetrameren oder mAbs nachzuweisen, die für die semi-invariante TCR spezifisch sind. iNKT-Zellen sind jedoch selten und müssen erweitert werden, um für jede Studie überschaubare Zahlen zu erreichen. Da sich die Erzeugung primärer Maus-iNKT-Zelllinien in vitro als schwierig erwiesen hat, haben wir ein robustes Protokoll zur Reinigung und Erweiterung von Milz-iNKT-Zellen aus den transgenen iVα14-Jα18-Mäusen (iVα14Tg) eingerichtet, in denen iNKT-Zellen 30-mal häufiger vorkommen. Wir zeigen hier, dass primäre milzhaltige iVα14Tg iNKT-Zellen durch einen immunmagnetischen Trennprozess angereichert werden können, was zu etwa 95-98% reinen iNKT-Zellen führt. Die gereinigten iNKT-Zellen werden durch Anti-CD3/CD28-Kügelchen plus IL-2 und IL-7 stimuliert, was zu einer 30-fachen Ausdehnung pro Tag +14 der Kultur mit 85-99% Reinheit führt. Die expandierten iNKT-Zellen können leicht genetisch manipuliert werden und bieten ein unschätzbares Werkzeug, um Mechanismen der Aktivierung und Funktion in vitro und vor allem auch beim adoptiven Transfer in vivo zu sezieren.
Einleitung
Invariante natürliche Killer-T-Zellen (iNKT-Zellen) sind angeborene T-Lymphozyten, die einen semi-invarianten αβ-T-Zellrezeptor (TCR) exprimieren, der in Mäusen durch eine invariante Vα14-Jα18-Kette gebildet wird, gepaart mit einem begrenzten Satz verschiedener Vβ-Ketten1, die spezifisch für Lipidantigene ist, die durch das MHC-Klasse-I-verwandte Molekül CD1d2präsentiert werden. iNKT-Zellen durchlaufen ein Agonisten-Selektionsprogramm, das zum Erwerb eines aktivierten/angeborenen Effektor-Phänotyps bereits im Thymus führt, der durch mehrere Reifestufen3,4auftrittundeine CD4+ und eine CD4- Untergruppe produziert. Durch dieses Programm erwerben iNKT-Zellen unterschiedliche T-Helfer (TH)-Effektor-Phänotypen, nämlich TH1 (iNKT1), TH2(iNKT2) und TH17 (iNKT17), die durch die Expression der Transkriptionsfaktoren T-bet, GATA3, PLZF und RORγt identifizierbar sind5. iNKT-Zellen erkennen eine Reihe von mikrobiellen Lipiden, sind aber auch selbstreaktiv gegen endogene Lipide, die im Kontext pathologischer Situationen von Zellstress und Gewebeschäden wie Krebs und Autoimmunität hochreguliert werden2. Nach der Aktivierung modulieren iNKT-Zellen die Funktionen anderer angeborener und adaptiver Immuneffektorzellen durch direkten Kontakt und Zytokinproduktion2.
Die Untersuchungen von iNKT-Zellen wurden durch Mausmodelle, einschließlich CD1d-defizienter oder Jα18-defizienter Mäuse, und durch die Produktion von antigenbeladenen CD1d-Tetrameren sowie die Erzeugung von monoklonalen Antikörpern (mAbs) speziell für die menschliche semi-invariante TCR erleichtert. Die Erzeugung der primären Maus-iNKT-Zelllinie hat sich jedoch als schwierig erwiesen. Um die Antitumorfunktionen von iNKT-Zellen besser zu charakterisieren und für die adoptive Zelltherapie zu nutzen, haben wir ein Protokoll zur Reinigung und Erweiterung von Milz-iNKT-Zellen von iVα14-Jα18 transgenen Mäusen (iVα14Tg)6eingerichtet, bei denen iNKT-Zellen 30-mal häufiger vorkommen als bei Wildtyp-Mäusen.
Expandierte iNKT-Zellen können für In-vitro-Assays und in vivo bei der Rückübertragung in Mäuse genutzt werden. In diesem Setting haben wir zum Beispiel ihre potenten Anti-Tumor-Effekte gezeigt7. Darüber hinaus sind in vitro expandierte iNKT-Zellen für eine funktionelle Modifikation durch Gentransfer oder Editierung vor ihrer Injektion in vivo8zugänglich, was eine aufschlussreiche funktionelle Analyse molekularer Signalwege ermöglicht und den Weg für fortschrittliche Zelltherapien ebnet.
Protokoll
Die hier beschriebenen Verfahren wurden vom Institutional Animal Care and Use Committee (IACUC) (Nr. 1048) am San Raffaele Scientific Institute überprüft und genehmigt.
HINWEIS: Alle Verfahren müssen unter sterilen Bedingungen durchgeführt werden. Alle verwendeten Reagenzien sind in der Materialtabelle aufgeführt.
1. Milzverarbeitung
- Euthanasierung von iVα14-Jα18-Mäusen durch Inhalation von CO2 gemäß der institutionellen Politik.
HINWEIS: iVα14-Jα18-Mäuse müssen mindestens 8 Wochen alt sein. Um eine Abstoßung der Zellen aus dem In-vivo-Transfer der Zellen zu vermeiden, bedenken Sie, dass Zellen, die von weiblichen Mäusen isoliert wurden, sowohl bei männlichen als auch bei weiblichen Empfängern adoptiv übertragen werden können, während Zellen, die aus männlichen Mäusen isoliert wurden, nur bei männlichen Empfängern übertragen werden können. Bei In-vitro-Experimenten darf kein Gender Bias berücksichtigt werden. Mehr Mäuse können gepoolt werden, um mehr Zellen zu erhalten. - Sezieren Sie die Milz der Maus und zerschlagen Sie sie durch ein 70-nm-Zellsieb, um eine Einzelzellsuspension in 10 ml phosphatgepufferter Kochsalzlösung (PBS) mit 2% fetalem Rinderserum (FBS) zu erhalten.
- Zentrifuge bei 300 x g für 5 min.
- Entfernen Sie den Überstand durch Inversion und verarbeiten Sie ihn mit Erythrozyten-Lysepuffer. Resuspendieren Sie das Zellpellet mit 1 ml sterilem ACK (Ammonium-Chlorid-Kalium) Lysing Buffer, inkubieren Sie für 3 min bei Raumtemperatur und blockieren Sie mit 5 ml PBS mit 2% FBS. Zentrifuge bei 300 x g für 5 min.
HINWEIS: ACK ist im Handel erhältlich; es besteht aus einer Lösung von 0,15 MNH4Cl, 10 mMKHCO3und 0,1 mMNa2EDTA (Ethylendiamintetraessigsäure), gelöst in bidistilliertemH2O,pH 7,2-7,4. Wenn hausgemacht, sterilisieren Sie durch Filtration mit einem 0,22 μm Filter. - Entfernen Sie den Überstand durch Inversion. Resuspendieren Sie das Zellpellet in 3 mL PBS mit 2% FBS und entfernen Sie Fettrückstände durch Pipettieren. Bei Bedarf bündeln Sie die Zellen, die von verschiedenen Mäusen stammen.
- Zählen Sie die Zellen und halten Sie 50 μL für die FACS-Analyse.
2. T-Zell-Anreicherung
HINWEIS: Für die Anreicherungsschritte schnell arbeiten, die Zellen kalt halten und Lösungen verwenden, die über Nacht bei 4 °C vorgekühlt und dann auf Eis gehalten werden
- Zentrifuge bei 300 x g für 5 min.
- Resuspendieren Sie alle Zellen in der entsprechenden Menge PBS mit 2% FBS (500 μL für 107 Zellen) und Fc-Blocker (2,5 μL x 107 Zellen); 15 min bei Raumtemperatur (RT) inkubieren.
- Waschen Sie mit 1-2 ml MACS-Trennpuffer (MB) pro 107 Gesamtzellen und zentrifugieren Sie bei 300 x g für 10 min.
HINWEIS: MACS-Puffer ist im Handel erhältlich. Es besteht aus PBS pH 7,2, 0,5% Rinderserumalbumin (BSA) und 2 mM EDTA. Wenn hausgemacht, sterilisieren Sie durch Filtration mit einem 0,22 μm Filter. - Entfernen Sie den Überstand durch Inversion und färben Sie die Zellenmit CD19-FITC und H2(IA b)-FITC (verwenden Sie 5 μL x 107 Zellen in 100 μL MB). Gut mischen und 15 min im Dunkeln bei 4-8 °C inkubieren.
- Waschen Sie die Zellen durch Zugabe von 1−2 ml MB pro 107 Zellen und zentrifugieren Sie bei 300 x g für 10 min.
- Pipettieren Sie den Überstand vollständig ab und resuspenieren Sie das Zellpellet in 90 μL MB pro 107 Gesamtzellen. Fügen Sie 10 μL Anti-FITC MicroBeads pro 107 Gesamtzellen hinzu. Gut mischen und 15 min im Dunkeln bei 4-8 °C inkubieren.
- Waschen Sie die Zellen durch Zugabe von 1−2 ml MB pro 107 Zellen und zentrifugieren Sie bei 300 x g für 10 min.
- Den Überstand vollständig abpfeifen und bis zu 1,25 x 108 Zellen in 500 μL MB resuspendieren.
- Platzieren Sie eine LD-Säule im Magnetfeld des MACS-Separators, um mit der Erschöpfung fortzufahren. Um Verstopfungen zu vermeiden, tragen Sie einen Vorzerlegungsfilter auf die LD-Säule auf und spülen Sie mit 2 ml MB ab.
- Wenn der Säulenbehälter leer ist, tragen Sie die Zellsuspension auf den Filter auf. Sammeln Sie die unbeschrifteten Zellen, die die Spalte passieren.
- 3 mal mit 1 ml MB waschen, nur wenn der Säulenbehälter leer ist. Sammeln Sie das gesamte Abwasser, das in T-Zellen angereichert wird, und zählen Sie die Zellen. Halten Sie immer 50 μL für die FACS-Analyse bereit.
3. iNKT-Zellanreicherung
- Zentrifugiere bei 300 x g für 5 min und entferne den Überstand durch Inversion.
- Färben Sie die Zellen mit CD1d-Tetramer-PE (Maus PBS57-CD1d-Tetramer) entsprechend der Antikörpertitration in 50 μL MB pro 106 Zellen. Gut mischen und 30 min im Dunkeln auf Eis inkubieren.
HINWEIS: Das Verfahren kann auch mit APC-markierten mCD1d-Tetrameren und Anti-APC-Perlen durchgeführt werden; Anpassung der fluorochrome, die in der folgenden Färbung verwendet werden, entsprechend. Im vorliegenden Protokoll verwendeten wir Maus-PBS-57-CD1d-Tetramere, die von NIH zur Verfügung gestellt wurden. αgalactosylceramid (αGal-Cer) ist das prototypische Antigen, das von iNKT-Zellen erkannt wird; PBS-57 ist ein Analogon von αGal-Cer mit verbesserter Löslichkeit9; Die NIH Tetramer Facility liefert PBS-57-Liganden, die zu CD1d-Tetrameren komplexiert sind. Andere CD1d-Dimere/Tetramere/Dextramere sind jedoch kommerziell erhältlich und können mit einem lipidischen Antigen wie αGal-Cer beladen werden. Wir sehen die Möglichkeit, das Protokoll für ihre Verwendung anzupassen. - Waschen Sie die Zellen durch Zugabe von 1−2 ml MB pro 107 Zellen und zentrifugieren Sie bei 300 x g für 10 min.
- Pipettieren Sie den Überstand vollständig ab und resuspenieren Sie das Zellpellet in 80 μL MB pro 107 Gesamtzellen. Fügen Sie 20 μL Anti-PE MicroBeads pro 107 Gesamtzellen hinzu. Gut mischen und 15 min im Dunkeln bei 4-8 °C inkubieren.
- Waschen Sie die Zellen durch Zugabe von 1−2 ml MB pro 107 Zellen und zentrifugieren Sie bei 300 x g für 10 min.
- Pipettieren Sie den Überstand vollständig ab und resuspendieren Sie bis zu 108 Zellen in 500 μL MB. Andernfalls, wenn die Zellen 108überschreiten, passen Sie die Lautstärke entsprechend an.
- Platzieren Sie je nach Zellzahl eine LS- (bis zu 108)oder MS- (bis zu 107) Säuleim Magnetfeld des MACS-Separators. Spülen Sie die Säule mit MB (3 ml für LS, 500 μL für MS).
- Tragen Sie die Zellsuspension auf die Säule auf.
- Sammeln Sie nicht markierte Zellen, die durchlaufen werden. Waschen Sie die Säule 3 Mal, indem Sie die entsprechende Menge MB (3 x 3 ml für die LS-Säule, 3 x 500 μL für die MS-Säule) nur dann hinzufügen, wenn der Säulenbehälter leer ist. Der Gesamtabfluss ist der negative Anteil.
- Entfernen Sie die Säule aus dem Magnetfeld und legen Sie sie auf ein neues Auffangrohr.
- Pipette MB auf die Säule (5 ml für LS-Säule oder 1 ml für MS-Säule); Drücken Sie den mitgelieferten Kolben in die Säule und spülen Sie die positive Fraktion (angereichert mit iNKT-Zellen) aus.
- Um die iNKT-Zellrückgewinnung weiter zu erhöhen, zentrifugieren Sie die negative Fraktion bei 300 x g für 10 min und wiederholen Sie die Schritte 3.6-3.7 mit einer neuen LS- oder MS-Säule. Bündeln Sie die positiven Fraktionen und bestimmen Sie die Zellzahl. Bewahren Sie 50 μL positiver und negativer Fraktionen für die FACS-Analyse auf.
- Überprüfen Sie die Reinigungsschritte anhand der FACS-Analyse. Zu den Proben gehören: Milz ex-vivo, mit T-Zellen angereicherte Fraktion, iNKT-positive Fraktion und iNKT-negative Fraktion. Färben Sie die Zellen mit: CD19-FITC, IAb-FITC, CD1d-Tetramer-PE, TCRβ-APC und DAPI.
HINWEIS: Die erwartete Erholung von einer iVα14-Jα18-Maus beträgt 2x106 iNKT-Zellen.
4. Aktivierung und Erweiterung der iNKT-Zelle
- Aktivieren Sie gereinigte iNKT-Zellen mit Maus-T-Aktivator Anti-CD3/CD28-Magnetperlen im Verhältnis 1:1.
- Zentrifugieren Sie die iNKT-Zellpositivfraktion bei 300 x g für 5 min.
- In der Zwischenzeit das entsprechende Volumen an Anti-CD3 / CD28-Magnetperlen in eine Röhre geben und eine gleiche Menge PBS hinzufügen, Wirbel für 5 Sekunden. Legen Sie das Rohr für 1 Minute auf einen Magneten und entsorgen Sie den Überstand.
- Entfernen Sie das Röhrchen vom Magneten und resuspendieren Sie die gewaschenen Magnetperlen im richtigen Volumen des vollständigen RPMI (RPMI 1640 Medium, 10% hitzeinaktiviertes FCS, 1 mM Natriumpyruvat, 1% nicht-essentielle Aminosäuren, 10 U / ml Penicyllin und Streptomycin, 50 μM β-Mercaptoethanol), um 5 x 105 iNKT-Zellen in 1 ml zu haben. Verwenden Sie diese Suspension, um die zentrifugierte iNKT-positive Fraktion zu resuspendieren.
- Platte 1 mL der Zellsuspension (5 x 105 iNKT-Zellen) und Anti-CD3/CD28-Magnetperlen in einer 48-Well-Platte mit 20 U/mL IL-2 und inkubieren bei 37 °C.
- Nach 5 Tagen 10 ng / ml IL-7 hinzufügen.
- Teilen Sie die Zellen 1: 2, wenn sie 80-90% Konfluenz erreichen, fügen Sie immer 20U / ml IL-2 und 10 ng / ml IL-7 hinzu. Unter diesen Bedingungen können iNKT-Zellen für bis zu 15 Tage expandiert werden.
Ergebnisse
Das in diesem Manuskript beschriebene Protokoll ermöglicht es, iNKT-Zellen aus der Milz transgener iVa14-Ja18-Mäuse durch einen immunmagnetischen Trennprozess anzureichern, der in Abbildung 1Azusammengefasst ist. Gesamtmilz-T-Zellen werden zunächst negativ selektiert, indem B-Zellen und Monozyten erschöpft werden, gefolgt von einer iNKT-Zell-positiven immunmagnetischen Sortierung mit PBS-57-Lipidantigen-beladenen CD1d-Tetrameren, die es ermöglichen, nur iNKT-Zellen spezifisch zu färben. Dieses Protokoll ergibt etwa 2 x 106 von 95-98% reinen iNKT-Zellen aus der Milz einer einzelnen iVa14-Ja18 Tg-Maus. In der negativen Fraktion können keine oder nur wirklich wenige iNKT-Zellen nachgewiesen werden (Abbildung 1B).
Nach der Anreicherung können iVa14 iNKT-Zellen mit Anti-CD3/CD28-Kügelchen plus IL-2 und IL-7 (Abbildung 2A) expandiert werden, was zu einer 30-fachen Ausdehnung bis zum durchschnittlichen Tag +14 der Kultur führt, wie in Abbildung 2Bgezeigt .
Abbildung 3A zeigt die iNKT-Zellreinheit zusammen mit der Expansion in vitro und der Expression des CD4-Moleküls. Wir beobachteten eine Abnahme des Prozentsatzes von TCRβ+ CD1d-Tetramer+ doppelt positiven Zellen: Die starke Aktivierung mit Anti-CD3/CD28-Kügelchen induziert die Herunterregulierung der iNKT-Zell-TCR-Expression auf der Zelloberfläche, und eine doppelt negative Population erscheint. Die Mehrheit der expandierten iNKT-Zellen waren CD4-. Abbildung 3B zeigt eine Charakterisierung der Expression der abstammungsspezifischen Transkriptionsfaktoren PLZF und RORγt auf angereicherten iNKT-Zellen am Tag 0 und 14 Tage nach der Expansion. Diese Färbung ermöglicht die Identifizierung der Phänotypen NKT1 (PLZFlow RORγt-),NKT2 (PLZFhigh RORγt-) und NKT17 (PLZFint RORγt+). Da es sich hauptsächlich um NKT1 und NKT2 handelt, zeigen die angereicherten iNKT-Zellen einen TH0-ähnlichen Effektor-Phänotyp. Dieser Phänotyp bleibt nach 14 Tagen der Expansion erhalten, wie die Sekretion von IFN-γ und IL-4 nach PMA/Ionomycin-Stimulation in Abbildung 3Cbestätigt.

Abbildung 1: iNKT-Zellanreicherung. A) Schematische Darstellung des immunomagnetischen Trennprotokolls. B)Durchflusszytometrische Analyse jedes Anreicherungsschritts. Der Prozentsatz der T-Zell-Frequenzen ist in den oberen Diagrammen dargestellt, die auf lebensfähigen Lymphozyten verteilt sind. Während der Prozentsatz der iNKT-Zellfrequenzen entlang jedes Schritts in den unteren Diagrammen angezeigt wird, sind sie auf lebensfähigen CD19- TCRβ+ Lymphozyten verteilt. Die Färbung auf lebensfähigem CD19- TCRβ+ Lymphozyten mit unbelastetem CD1d-Tetramer ermöglicht es, das iNKT-Zellgatter korrekt zu zeichnen. Ein repräsentatives Experiment wird gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: iNKT-Zell-in-vitro-Expansion. A) iNKT-Zellzählungen entlang der iNKT-Zellexpansion. Gezeigt werden drei repräsentative und unabhängige Experimente. B) Faltenvergrößerung der iNKT-Zellzahl am Tag 7 und 14 nach Reinigung und Aktivierung. Mittel ± SD werden angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
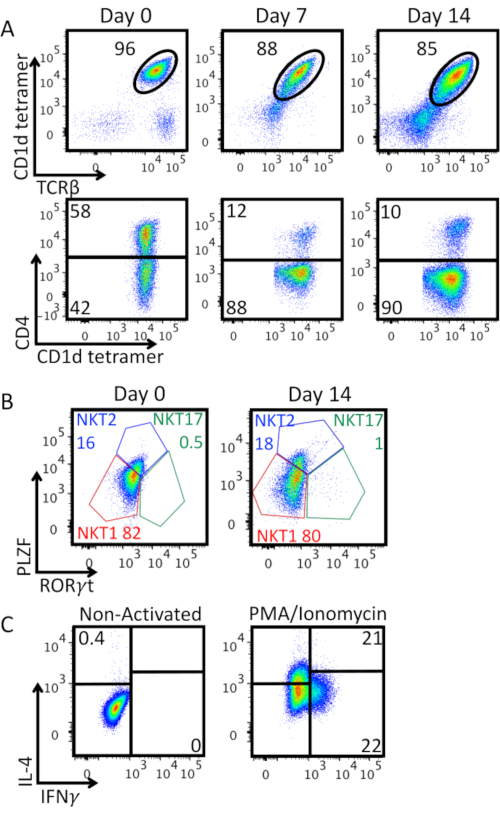
Abbildung 3: Erweiterte iNKT-Zellcharakterisierung. A) Durchflusszytometrische Analyse des iNKT-Zellprozentsatzes und der CD4-Expression entlang der Expansionsperiode. Obere Parzellen sind auf lebensfähigen Lymphozyten eingeschlossen. Niedrigere Plots sind auf iNKT-Zellen (lebensfähiges CD1d-Tetramer+ TCRβ+ Lymphozyten) ausgerichtet. B)Phänotypische Charakterisierung von angereicherten (Tag 0) und expandierten (Tag 14) iNKT-Zellen. Die Plots sind auf iNKT-Zellen (lebensfähiges CD1d-Tetramer+ TCRβ+ Lymphozyten) ausgerichtet. Die Zellen wurden mit dem Foxp3 Transcription Factor Staining Buffer Set intranukleär auf Transkriptionsfaktoren angefärbt. NKT1 (PLZFlow RORγt-), NKT2 (PLZFhigh RORγt- )und NKT17 (PLZFint RORγt+) Teilmengen wurden identifiziert, Häufigkeiten jeder Teilmenge sind in Prozent angegeben. C)Zytokinproduktion durch expandierte iNKT-Zellen am Tag 14. Die Plots sind auf iNKT-Zellen (lebensfähiges CD1d-Tetramer+ TCRβ+ Lymphozyten) ausgerichtet. Die Zellen wurden für 4 Stunden mit PMA 25 ng/ml/Ionomycin 1 μg/ml stimuliert, in Anwesenheit von Brefeldin A 10 μg/ml für die letzten 2 Stunden. Die Zellen wurden dann mit PFA 2% fixiert, mit Permwash permeabilisiert und dann intrazellulär für die Zytokinproduktion gefärbt. Die Gating-Strategie wurde auf dem nicht aktivierten Steuerelement im linken Bereich festgelegt. Ein repräsentatives Experiment wird gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Hier zeigen wir ein reproduzierbares und praktikables Protokoll, um Millionen von gebrauchsfertigen iNKT-Zellen zu erhalten. Aufgrund des Mangels an diesen Zellen in vivo war eine Methode, um sie zu erweitern, dringend erforderlich. Das von uns vorgeschlagene Protokoll erfordert weder eine bestimmte Instrumentierung noch eine hohe Anzahl von Mäusen. Wir nutzten iVα14-Jα18 transgene Mäuse absichtlich, um die Anzahl der für das Verfahren benötigten Mäuse zu reduzieren.
Ein weiteres erfolgreiches Protokoll für die iNKT-Zellexpansion von transgenen iVα14-Jα18-Mäusen ist in der Literatur verfügbar10. Dieses Protokoll beinhaltet die Erzeugung von frischen, aus dem Knochenmark stammenden dendritischen Zellen, die 6 Tage vor der iNKT-Zellreinigung erzeugt und dann mit α-Galactosylceramid beladen und bestrahlt werden, plus IL-2 und IL-7. Wir betrachten die Reduzierung der Anzahl der am Verfahren beteiligten Mäuse als großen Vorteil des Protokolls. Es ist auch zeitsparend, da der Aufbau der Zellkultur einen einzigen Tag statt einer Woche dauert. Eine mögliche Einschränkung der Reproduzierbarkeit des aktuellen Protokolls könnte die Verfügbarkeit von iVα14-Jα18 transgenen Mäusen sein, die jedoch kommerziell erhältlich sind. In Abwesenheit dieser Mäuse sehen wir die Möglichkeit, eine große Anzahl von WT-Mäusen zu verwenden, aber das Protokoll muss aufgrund des Mangels an iNKT-Zellen in WT-Mäusen entsprechend eingerichtet werden.
Während der Zellkultur überprüfen wir in der Regel die Reinheit und den Phänotyp von expandierten iNKT-Zellen. Die Abnahme des Prozentsatzes von TCRβ+ CD1d-Tetramer+ doppelt positiven Zellen (Abbildung 3A) kann durch eine natürliche Herunterregulierung des invarianten NKT-Zell-TCR von der Zelloberfläche nach Aktivierung erklärt werden. Darüber hinaus exprimierte die Mehrheit der expandierten iNKT-Zellen kein CD4 (Abbildung 3A): Dies kann im Rahmen einer adoptiven Zelltherapie einen Vorteil darstellen, da SICH CD4-iNKT-Zellen als am effektivsten bei der Kontrolle des Tumorverlaufs erwiesen haben 11. Darüber hinaus ist der beobachtete TH 0-ähnlicheEffektor-Phänotyp ( Abbildung3C) vollständig kohärent mit dem in menschlichen iNKT-Zellen nach in vitro Expansion und Restimulationbeobachteten 8,12,13,14,15. Die expandierten Zellen sind in vivo und in vitro hochreaktiv und daher im Kontext von iNKT-zellbasierten adoptiven Immuntherapien nützlich. Adoptive Übertragung von unmanipulierten oder expandierten iNKT-Zellen verhindert oder verbessert die akute Graft-Versus-Host-Krankheit (aGVHD) und lässt den Graft-Versus-Leukämie-Effekt unverändert16,17,18,19. Adoptiv übertragene humane iNKT-Zellen, die in vitro mit αGal-Cer expandiert wurden, lindern die xenogene aGVHD und dieser Effekt wird durch CD4- aber nicht durch CD4+ Zellenvermittelt 20. Da iNKT-Zellen keine aGVHD verursachen, stellen sie außerdem die idealen Zellen für die CAR-Immuntherapie dar, ohne dass ihre TCR gelöscht werden muss, und erwiesen sich in vivo als verlängerte Antitumoraktivität8,15. iNKT-Zellen werden derzeit in laufenden und abgeschlossenen klinischen Studien21,22,23,24.
Zusammenfassend lässt sich sagen, dass das beschriebene Protokoll schnell und unkompliziert ist und eine 30-fache Erhöhung der Anzahl der aus einer Mausmilz gewonnenen iNKT-Zellen ermöglicht (Abbildung 3B). Diese Zellen können leicht für In-vitro-Erkennungsassays, Co-Kultursysteme oder adoptive Zelltherapie in präklinischen Studien genutzt werden. iNKT-Zellen spielen in der Tat eine entscheidende Rolle bei der Überwachung von Tumorimmunen, Infektionskrankheiten und Autoimmunität. In diesen Kontexten können iNKT-Zellen ein leistungsfähiges Werkzeug darstellen, da sie eine attraktive Alternative zu herkömmlichen T-Zellen ohne die MHC-Einschränkung darstellen. Die schnelle Erzeugung großer Mengen dieser Zellen und die Möglichkeit, sie in vitro weiter zu manipulieren, kann zur Entwicklung beispielloser therapeutischer Strategien führen.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Wir danken Paolo Dellabona und Giulia Casorati für die wissenschaftliche Unterstützung und kritische Lektüre des Manuskripts. Wir danken auch der NIH Tetramer Core Facility für Maus-CD1d-Tetramer. Die Studie wurde durch das Fondazione Cariplo Grant 2018-0366 (an M.F.) und das Stipendium der Italian Association for Cancer Research (AIRC) 2019-22604 (an G.D.) finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Ammonium-Chloride-Potassium (ACK) solution | in house | 0.15M NH4Cl, 10mM KHCO3, 0.1mM EDTA, pH 7.2-7.4 | |
| anti-FITC Microbeads | Miltenyi Biotec | 130-048-701 | |
| anti-PE Microbeads | Miltenyi Biotec | 130-048-801 | |
| Brefeldin A | Sigma | B6542 | |
| CD19 -FITC | Biolegend | 115506 | clone 6D5 |
| CD1d-tetramer -PE | NIH tetramer core facility | mouse PBS57-Cd1d-tetramers | |
| CD4 -PeCy7 | Biolegend | 100528 | clone RM4-5 |
| Fc blocker | BD Bioscience | 553142 | |
| Fetal Bovine Serum (FBS) | Euroclone | ECS0186L | heat-inactivated and filtered .22 before use |
| FOXP3 Transcription factor staining buffer | eBioscience | 00-5523-00 | |
| H2 (IAb) -FITC | Biolegend | 114406 | clone AF6-120.1 |
| hrIL-2 | Chiron Corp | ||
| Ionomycin | Sigma | I0634 | |
| LD Columns | Miltenyi Biotec | 130-042-901 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | |
| MACS buffer (MB) | in house | 0.5% Bovine Serum Albumin (BSA; Sigma-Aldrich) and 2Mm EDTA | |
| MS Columns | Miltenyi Biotec | 130-042-201 | |
| Non-essential amino acids | Gibco | 11140-035 | |
| Penicillin and streptomycin (Pen-Strep) | Lonza | 15140-122 | |
| PermWash | BD Bioscience | 51-2091KZ | |
| PFA | Sigma | P6148 | |
| Phosphate buffered saline (PBS) | EuroClone | ECB4004L | |
| PMA | Sigma | P1585 | |
| Pre-Separation Filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| Recombinat Mouse IL-7 | R&D System | 407-ML-025 | |
| RPMI 1640 with glutamax | Gibco | 61870-010 | |
| sodium pyruvate | Gibco | 11360-039 | |
| TCRβ -APC | Biolegend | 109212 | clone H57-597 |
| αCD3CD28 mouse T activator Dynabeads | Gibco | 11452D | |
| β-mercaptoethanol | Gibco | 31350010 |
Referenzen
- Bendelac, A., Savage, P. B., Teyton, L. The biology of NKT cells. Annual Review of Immunology. 25, 297-336 (2007).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews: Immunology. 13 (2), 101-117 (2013).
- Pellicci, D. G., et al. A natural killer T (NKT) cell developmental pathway iInvolving a thymus-dependent NK1.1(-)CD4(+) CD1d-dependent precursor stage. Journal of Experimental Medicine. 195 (7), 835-844 (2002).
- Benlagha, K., Kyin, T., Beavis, A., Teyton, L., Bendelac, A. A thymic precursor to the NK T cell lineage. Science. 296 (5567), 553-555 (2002).
- Lee, Y. J., Holzapfel, K. L., Zhu, J., Jameson, S. C., Hogquist, K. A. Steady-state production of IL-4 modulates immunity in mouse strains and is determined by lineage diversity of iNKT cells. Nature Immunology. 14 (11), 1146-1154 (2013).
- Griewank, K., et al. Homotypic interactions mediated by Slamf1 and Slamf6 receptors control NKT cell lineage development. Immunity. 27 (5), 751-762 (2007).
- Cortesi, F., et al. Bimodal CD40/Fas-Dependent Crosstalk between iNKT Cells and Tumor-Associated Macrophages Impairs Prostate Cancer Progression. Cell Reports. 22 (11), 3006-3020 (2018).
- Heczey, A., et al. Invariant NKT cells with chimeric antigen receptor provide a novel platform for safe and effective cancer immunotherapy. Blood. 124 (18), 2824-2833 (2014).
- Liu, Y., et al. A modified alpha-galactosyl ceramide for staining and stimulating natural killer T cells. Journal of Immunological Methods. 312 (1-2), 34-39 (2006).
- Chiba, A., et al. Rapid and reliable generation of invariant natural killer T-cell lines in vitro. Immunology. 128 (3), 324-333 (2009).
- Crowe, N. Y., et al. Differential antitumor immunity mediated by NKT cell subsets in vivo. Journal of Experimental Medicine. 202 (9), 1279-1288 (2005).
- de Lalla, C., et al. Production of profibrotic cytokines by invariant NKT cells characterizes cirrhosis progression in chronic viral hepatitis. Journal of Immunology. 173 (2), 1417-1425 (2004).
- Tian, G., et al. CD62L+ NKT cells have prolonged persistence and antitumor activity in vivo. Journal of Clinical Investigation. 126 (6), 2341-2355 (2016).
- Gaya, M., et al. Initiation of Antiviral B Cell Immunity Relies on Innate Signals from Spatially Positioned NKT Cells. Cell. 172 (3), 517-533 (2018).
- Rotolo, A., et al. Enhanced Anti-lymphoma Activity of CAR19-iNKT Cells Underpinned by Dual CD19 and CD1d Targeting. Cancer Cell. 34 (4), 596-610 (2018).
- Schneidawind, D., et al. Third-party CD4+ invariant natural killer T cells protect from murine GVHD lethality. Blood. 125 (22), 3491-3500 (2015).
- Schneidawind, D., et al. CD4+ invariant natural killer T cells protect from murine GVHD lethality through expansion of donor CD4+CD25+FoxP3+ regulatory T cells. Blood. 124 (22), 3320-3328 (2014).
- Schneidawind, D., Pierini, A., Negrin, R. S. Regulatory T cells and natural killer T cells for modulation of GVHD following allogeneic hematopoietic cell transplantation. Blood. 122 (18), 3116-3121 (2013).
- Leveson-Gower, D. B., et al. Low doses of natural killer T cells provide protection from acute graft-versus-host disease via an IL-4-dependent mechanism. Blood. 117 (11), 3220-3229 (2011).
- Coman, T., et al. Human CD4- invariant NKT lymphocytes regulate graft versus host disease. Oncoimmunology. 7 (11), 1470735 (2018).
- Xu, X., et al. NKT Cells Coexpressing a GD2-Specific Chimeric Antigen Receptor and IL15 Show Enhanced In vivo Persistence and Antitumor Activity against Neuroblastoma. Clinical Cancer Research. 25 (23), 7126-7138 (2019).
- Heczey, A., et al. Anti-GD2 CAR-NKT cells in patients with relapsed or refractory neuroblastoma: an interim analysis. Nature Medicine. 26 (11), 1686-1690 (2020).
- Exley, M. A., et al. Adoptive Transfer of Invariant NKT Cells as Immunotherapy for Advanced Melanoma: A Phase I Clinical Trial. Clinical Cancer Research. 23 (14), 3510-3519 (2017).
- Wolf, B. J., Choi, J. E., Exley, M. A. Novel Approaches to Exploiting Invariant NKT Cells in Cancer Immunotherapy. Frontiers in Immunology. 9, 384 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten