Method Article
טיהור והתרחבות של עכבר Invariant טבעי רוצח תאי T עבור במבחנה ו in vivo מחקרים
In This Article
Summary
אנו מתארים פרוטוקול מהיר וחזק להעשרת תאי T (iNKT) של הרוצח הטבעי invariant מטחול העכבר ולהרחיב אותם במבחנה למספרים מתאימים למחקרי מבחנה ומחקרי ויוו.
Abstract
תאי T (iNKT) Invariant Natural Killer הם לימפוציטים דמויי T מולדים המבטאים קולטן תאי T חצי-אינבראנטים שמורים (TCR) הספציפי לאנטיגנים שומנים עצמיים או מיקרוביאליים המוצגים על ידי המולקולה הלא פולימורפית מסוג MHC I הקשורה למולקולה CD1d. מחקרים פרה-קליניים וקליניים תומכים בתפקיד לתאי iNKT בסרטן, אוטואימוניות ומחלות זיהומיות. תאי iNKT נשמרים מאוד בכל המינים והחקירה שלהם התאפשרה על ידי מודלים של עכברים, כולל עכברים לקויי CD1D או iNKT לקויים, ואת האפשרות לזהות אותם באופן חד משמעי בעכברים וגברים עם tetramers CD1d או mAbs ספציפי עבור TCR חצי invariant. עם זאת, תאי iNKT הם נדירים ויש להרחיב אותם כדי להגיע למספרים הניתנים לניהול עבור כל מחקר. מכיוון שהדור של קו תאי iNKT הראשי של העכבר במבחנה הוכח כקשה, הקמנו פרוטוקול חזק לטיהור והרחבת תאי iNKT טחול מהעכברים מהונדסים iVα14-Jα18 (iVα14Tg), שבו תאי iNKT שכיחים פי 30. אנו מראים כאן כי תאי iNKT iVα14Tg הטחול העיקריים יכולים להיות מועשרים באמצעות תהליך הפרדה אימונומגנטי, המניב כ 95-98% תאי iNKT טהורים. תאי iNKT המטוהרים מגורים על ידי חרוזי אנטי CD3/CD28 בתוספת IL-2 ו- IL-7, וכתוצאה מכך התרחבות פי 30 ביום +14 של התרבות עם טוהר של 85-99%. תאי iNKT המורחבים ניתנים למניפולציה גנטית בקלות, ומספקים כלי רב ערך לנתח מנגנוני הפעלה ותפקוד במבחנה, וחשוב מכך, גם עם העברה מאמצת ב- vivo.
Introduction
תאי T קטלניים טבעיים Invariant (תאי iNKT) הם לימפוציטים דמויי T מולדים המבטאים קולטן תאי T חצי אינבריאנט (TCR), שנוצר בעכברים על ידי שרשרת Vα14-Jα18 בשילוב עם קבוצה מוגבלת של שרשראות Vβ מגוונות1, אשר ספציפי עבור אנטיגנים שומנים המוצגים על ידי סוג MHC מולקולה הקשורה I CD1d2. תאי iNKT עוברים תוכנית בחירה אגוניסטית וכתוצאה מכך רכישת פנוטיפ מפעיל מופעל / מולד כבר התימוס, אשר מתרחשת דרך מספר שלביהתבגרות 3,4, הפקת CD4+ ו CD4- קבוצת משנה. באמצעות תוכנית זו, תאי iNKT לרכוש פנוטיפים מחולל T מובחנים (TH),כלומר TH1 (iNKT1), TH2 (iNKT2) ו TH17 (iNKT17), לזיהוי על ידי הביטוי של גורמי שעתוק T-bet, GATA3, PLZF, ו RORγt, בהתאמה5. תאי iNKT מזהים מגוון של שומנים מיקרוביאליים אך הם גם מגיבים בעצמם נגד שומנים אנדוגניים כי הם upregulated בהקשר של מצבים פתולוגיים של מתח התא ונזק לרקמות, כגון סרטן ו autoimunity2. עם ההפעלה, תאי iNKT לווסת את הפונקציות של תאים אחרים מחוללי מערכת החיסון המולדת והסתגלותית באמצעות מגע ישיר וייצור ציטוקינים2.
החקירות של תאי iNKT כבר הקלו על ידי דגמי עכבר, כולל CD1d-לקוי או עכברים Jα18-לקוי, ועל ידי ייצור של tetramers CD1D טעון אנטיגן בתוספת הדור של נוגדנים חד שבטיים (mAbs) ספציפי עבור TCR חצי invariant האנושי. עם זאת, הדור של קו תא iNKT עכבר ראשי הוכיח קשה. כדי לאפיין טוב יותר את פונקציות האנטיטומור של תאי iNKT ולהשתמש בהם לטיפול תאי מאמץ, הקמנו פרוטוקול לטיהור והרחבת תאי iNKT טחול של iVα14-Jα18 עכברים מהונדסים (iVα14Tg)6, שבו תאי iNKT שכיחים פי 30 מאשר בעכברים מסוג בר.
תאי iNKT מורחבים ניתנים לניצול לבדיקות במבחנה, וב-vivo עם המעבר חזרה לעכברים. בהגדרה זו, למשל, הראינו את ההשפעות החזקות שלהם נגד הגידול7. יתר על כן, אין ויטרו מורחב iNKT תאים נוחים לשינוי פונקציונלי באמצעות העברתגניםאו עריכה לפני הזרקתם ב vivo 8 , המאפשר ניתוח פונקציונלי תובנה של מסלולים מולקולריים, כמו גם לסלול את הדרך לטיפולים תאים מתקדמים.
Protocol
הנהלים המתוארים כאן נבדקו ואושרו על ידי הוועדה המוסדית לטיפול בבעלי חיים ושימוש (IACUC) (מס '1048) במכון המדעי סן רפאלה.
הערה: כל ההליכים חייבים להתבצע בתנאים סטריליים. כל הריאגנטים המשמשים מפורטים בטבלת החומרים.
1. עיבוד טחול
- המתת חסד iVα14-Jα18 עכברים על ידי שאיפת CO2 על פי המדיניות המוסדית.
הערה: עכברי iVα14-Jα18 חייבים להיות בני 8 שבועות ומעלה. כדי למנוע דחייה של התאים מהעברת in vivo של התאים, שקול כי תאים מבודדים מעכברים נקבות ניתן להעביר באופן מאמץ הן אצל נמענים זכריים והן נקבות, בעוד תאים מבודדים מעכברים זכרים ניתן להעביר רק אצל נמענים זכרים. לניסויים במבחנה, אין לקחת בחשבון הטיה מגדרית. ניתן לאגד עכברים נוספים על מנת להשיג תאים נוספים. - לנתח את טחול העכבר ולרסק אותו דרך מסננת תא 70 ננומטר כדי לקבל השעיה של תא יחיד ב 10 מ"ל של תמיסת מלח חוצצת פוספט (PBS) עם 2% סרום בקר עוברי (FBS).
- צנטריפוגה ב 300 x g במשך 5 דקות.
- הסר את supernatant על ידי היפוך ולעבד עם מאגר תמיסת אריתרוציטים. Resuspend את גלולה התא עם 1 מ"ל של ACK סטרילי (אמוניום-כלוריד-אשלגן) חוצץ ליסינג, דגירה במשך 3 דקות בטמפרטורת החדר, ולחסום עם 5 מ"ל של PBS עם 2% FBS. צנטריפוגה ב 300 x g במשך 5 דקות.
הערה: ACK זמין מסחרית; הוא מורכב מפתרון של 0.15 M NH4Cl, 10 מ"מ KHCO3, ו 0.1 מ"מ Na2EDTA (חומצה אתילנדימינטראצטית) מומס H2O דו-ליסטיל, pH 7.2-7.4. אם תוצרת בית, לעקר על ידי סינון עם מסנן 0.22 מיקרומטר. - הסר את סופר-טבעי על ידי היפוך. resuspend גלולה התא ב 3 מ"ל של PBS עם 2% FBS ולהסיר שאריות שומן על ידי pipetting. במידת הצורך, מאגר התאים המגיעים מעכברים שונים.
- ספר את התאים ולשמור 50 μL לניתוח FACS.
2. העשרת תאי T
הערה: עבור שלבי העשרה, לעבוד מהר, לשמור על התאים קרים ולהשתמש פתרונות מקוררים מראש ב 4 °C (4 °F) לילה ולאחר מכן המשיך על קרח
- צנטריפוגה ב 300 x g במשך 5 דקות.
- resuspend כל התאים בכמות המתאימה של PBS עם 2% FBS (500 μL עבור 107 תאים) וחוסם Fc (2.5 μL x 107 תאים); דגירה במשך 15 דקות בטמפרטורת החדר (RT).
- יש לשטוף עם 1-2 מ"ל של מאגר הפרדת MACS (MB) לכל 107 תאים וצנטריפוגה בסך הכל ב-300 x גרם למשך 10 דקות.
הערה: מאגר MACS זמין מסחרית. הוא מורכב PBS pH 7.2, 0.5% אלבומין סרום בקר (BSA), ו 2 mM EDTA. אם תוצרת בית, לעקר על ידי סינון עם מסנן 0.22 מיקרומטר. - הסר את supernatant על ידי היפוך ולהכתים את התאים עם CD19-FITC ו H2(IAb)-FITC (להשתמש 5 μL x 107 תאים ב 100 μL של MB). מערבבים היטב ודגרה במשך 15 דקות בחושך ב 4 -8 מעלות צלזיוס.
- לשטוף תאים על ידי הוספת 1−2 מ"ל של MB לכל 107 תאים וצנטריפוגה ב 300 x גרם במשך 10 דקות.
- פיפטה את supernatant לחלוטין resuspend גלולה התא ב 90 μL של MB לכל 107 תאים סה"כ. הוסף 10 μL של מיקרו-אבקסיסים נגד FITC לכל 107 תאים בסך הכל. מערבבים היטב ודגרה במשך 15 דקות בחושך ב 4 -8 מעלות צלזיוס.
- לשטוף את התאים על ידי הוספת 1−2 מ"ל של MB לכל 107 תאים וצנטריפוגה ב 300 x גרם במשך 10 דקות.
- פיפטה את supernatant לחלוטין resuspened עד 1.25 x 108 תא ב 500 μL של MB.
- מקם עמודת LD בשדה המגנטי של מפריד MACS כדי להמשיך לדלדול. כדי להימנע מסתימה, החל מסנן לפני הפרדה על עמודת LD ושטוף ב- 2 מ"ל של MB.
- כאשר מאגר העמודות ריק, החל את ההשעיה של התא על המסנן. אסוף את התאים הלא עם תווית שעוברים דרך העמודה.
- לשטוף 3 פעמים עם 1 מ"ל של MB, רק כאשר מאגר העמודות ריק. לאסוף את השפכים הכוללים, אשר יועשר בתאי T, ולספור את התאים. שמור תמיד 50 μL לניתוח FACS.
3. העשרת תאי iNKT
- צנטריפוגה ב 300 x g במשך 5 דקות ולהסיר את supernatant על ידי היפוך.
- להכתים את התאים עם CD1d-tetramer-PE (עכבר PBS57-CD1d-טטרמר), על פי טיטציה נוגדן ב 50 μL של MB לכל 106 תאים. מערבבים היטב ודגרה במשך 30 דקות בחושך על קרח.
הערה: ההליך יכול להתבצע גם עם tetramers mCD1d עם תווית APC וחרוזים נגד APC; התאמת הפלואורכרום המשמש את הכתמים הבאים בהתאם. בפרוטוקול הנוכחי השתמשנו בעכבר PBS-57-CD1d-tetramers שסופקו על ידי NIH. αgalactosylceramide (αGal-Cer) הוא אנטיגן טיפוסי המוכר על ידי תאי iNKT; PBS-57 הוא אנלוגי של αGal-Cer עם מסיסות משופרת9; מתקן NIH Tetramer מספק ליגנד PBS-57 המורכב מטטרמה CD1D. עם זאת, דימרים CD1d אחרים / tetramers / dextramers זמינים מסחרית והוא יכול להיות טעון עם אנטיגן שומנים כמו αGal-Cer. אנו מדמיינים את האפשרות להתאים את הפרוטוקול לשימושם. - לשטוף את התאים על ידי הוספת 1−2 מ"ל של MB לכל 107 תאים וצנטריפוגה ב 300 x גרם במשך 10 דקות.
- Pipette את supernatant לחלוטין resuspend גלולה התא ב 80 μL של MB לכל 107 תאים כוללים. הוסף 20 μL של מיקרואורגניזמים נגד PE לכל 107 תאים בסך הכל. מערבבים היטב ודגרה במשך 15 דקות בחושך ב 4 -8 מעלות צלזיוס.
- לשטוף תאים על ידי הוספת 1−2 מ"ל של MB לכל 107 תאים וצנטריפוגה ב 300 x גרם במשך 10 דקות.
- פיפטה את supernatant לחלוטין resuspened עד 108 תאים ב 500 μL של MB. אחרת אם תאים עולים על 108, להתאים את עוצמת הקול בהתאם.
- על פי ספירת התאים, מקם עמודת LS (עד 108) או MS (עד 107) בשדה המגנטי של מפריד MACS. לשטוף את העמודה עם MB (3 מ"ל עבור LS, 500 μL עבור MS).
- החל את ההשעיה של התא על העמודה.
- לאסוף תאים ללא תווית שעוברים. לשטוף את העמודה 3 פעמים על-ידי הוספת הכמות המתאימה של MB (3 x 3 מ"ל עבור עמודת LS, 3 x 500 μL עבור עמודת MS) רק כאשר מאגר העמודות ריק. הקולחים הכוללים הוא השבר השלילי.
- הסר את העמודה מהשדה המגנטי והצב אותה על צינור אוסף חדש.
- Pipette MB בעמודה (5 מ"ל עבור עמודת LS או 1 מ"ל עבור עמודת MS); לדחוף את הבוכנה שסופקה לתוך העמודה לשטוף את השבר החיובי (מועשר בתאי iNKT).
- כדי להגדיל עוד יותר את התאוששות תאי iNKT, צנטריפוגה השבר השלילי ב 300 x g במשך 10 דקות ולחזור על שלבים 3.6-3.7 עם עמודה חדשה LS או MS. איחד את השברים החיוביים וקבע את ספירת התאים. שמור 50 μL של שברים חיוביים ושליליים לניתוח FACS.
- בדוק את שלבי הטיהור על-ידי ניתוח FACS. הדגימות כוללות: טחול ex-vivo, שבר מועשר בתא T, שבר חיובי iNKT ושבר שלילי iNKT. להכתים את התאים עם: CD19-FITC, IAb-FITC, CD1d-tetramer-PE, TCRβ-APC ו- DAPI.
הערה: ההתאוששות הצפויה מעכבר iVα14-Jα18 הוא 2x106 תאי iNKT .
4. הפעלה והרחבה של תאים iNKT
- הפעל תאי iNKT מטוהרים עם עכבר T activator נגד CD3/ CD28 חרוזים מגנטיים ביחס של 1:1.
- צנטריפוגה שבר חיובי תא iNKT ב 300 x g במשך 5 דקות.
- בינתיים להעביר את הנפח המתאים של חרוזים מגנטיים נגד CD3 /CD28 לצינור ולהוסיף נפח שווה של PBS, מערבולת במשך 5 שניות. מניחים את הצינור על מגנט במשך דקה אחת ומשליכים את supernatant.
- הסר את הצינור מן המגנט ו resuspend החרוזים המגנטיים שטף בנפח הנכון של RPMI מלא (RPMI 1640 בינוני, 10% FCS מומת בחום, 1 mM נתרן pyruvate, 1% חומצות אמינו לא חיוניות, 10 פניציללין U /ml וסטרפטומיצין, 50 μM β-Mercaptoethanol) כדי לקבל 5 x 105 תאי iNKT ב 1 מ"ל. השתמש במתלה זה כדי resuspend שבר חיובי iNKT צנטריפוגה.
- צלחת 1 מ"ל של השעיית התא (5 x 105 תאי iNKT) וחרוזים מגנטיים נגד CD3/CD28 בלוח 48 טוב עם 20 U /mL IL-2 ודגרה ב 37 °C (5 °F).
- לאחר 5 ימים, להוסיף 10 ננוגרם / מ"ל IL-7.
- לפצל את התאים 1:2 כאשר הם מגיעים 80-90% מפגש, תמיד להוסיף 20U / מ"ל IL-2 ו 10 ng / mL IL-7. בתנאים אלה, תאי iNKT ניתן להרחיב עד 15 ימים.
תוצאות
הפרוטוקול המתואר בכתב יד זה מאפשר להעשיר תאי iNKT מהטחול של עכברים מהונדסים iVa14-Ja18 באמצעות תהליך הפרדה אימונומגנטי המסוכם באיור 1A. תאי T הטחול הכולל נבחרים לראשונה באופן שלילי על ידי דלדול תאי B ומונוציטים, ואחריו מיון אימונומגנטי חיובי של תאי iNKT עם Tetramers CD1d טעון של אנטיגן אנטיגן PBS-57, המאפשרים להכתים במיוחד רק תאי iNKT. פרוטוקול זה מניב כ 2 x 106 של 95-98% תאי iNKT טהורים מהטחול של עכבר iVa14-Ja18 Tg יחיד. לא ניתן לזהות או מעט מאוד תאי iNKT בשבר השלילי(איור 1B).
לאחר ההעשרה, ניתן להרחיב את תאי iNKT iVa14 עם חרוזי אנטי-CD3/CD28 בתוספת IL-2 ו-IL-7 (איור 2A),וכתוצאה מכך התרחבות של פי 30 בממוצע ביום +14 של התרבות כפי שמוצג באיור 2B.
איור 3A מציג את טוהר תאי iNKT יחד עם ההתפשטות במבחנה ואת הביטוי של מולקולת CD4. ראינו ירידה באחוז TCRβ+ CD1d-tetramer+ תאים חיוביים כפולים: ההפעלה החזקה עם חרוזי אנטי CD3/ CD28 היא גרימת ירידה של ביטוי TCR תא iNKT על פני התא, ואוכלוסייה שלילית כפולה מופיעה. רוב תאי iNKT המורחבים היו CD4-. איור 3B מציג אפיון של הביטוי של גורמי שעתוק ספציפיים לשושלת היוח השנייה PLZF ו- RORγt על תאי iNKT מועשרים ביום 0 ו -14 ימים לאחר ההתרחבות. כתמים אלה מאפשר לזהות את NKT1 (PLZFנמוך RORγt-), NKT2 (PLZFגבוה RORγt-), ו NKT17 (PLZFint RORγt+) פנוטיפים. להיות בעיקר NKT1 ו NKT2, תאי iNKT מועשר להראות פנוטיפ אפקט דמוי TH0. פנוטיפ זה נשמר לאחר 14 ימים של התרחבות כפי שאושר על ידי הפרשת הן IFN-γ והן IL-4 לאחר גירוי PMA / Ionomycin המוצג באיור 3C.

איור 1: העשרת תאי iNKT. א)ייצוג סכמטי של פרוטוקול ההפרדה האימונומגנטית. B) ניתוח ציטומטריה של זרימה של כל שלב העשרה. אחוז תדרי תאי T מוצגים בחלקות העליונות, מגודרים על לימפוציטים קיימא. בעוד אחוז של תדרי תא iNKT לאורך כל שלב מוצגים בחלקות התחתונות, מגודר על CD19 קיימא- TCRβ+ לימפוציטים. כתמים על CD19 קיימא- TCRβ+ לימפוציטים עם טטרמר CD1d לא טעון לאפשר לצייר כראוי את שער התא iNKT. ניסוי ייצוגי אחד מוצג. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: iNKT תא בהרחבה במבחנה. א)תאי iNKT סופרים לאורך הרחבת תאי iNKT. שלושה ניסויים מייצגים ועצמאיים מוצגים. B) לקפל את הגידול במספר התא iNKT ביום 7 ו 14 לאחר טיהור והפעלה. זה אומר ± SD מוצגים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
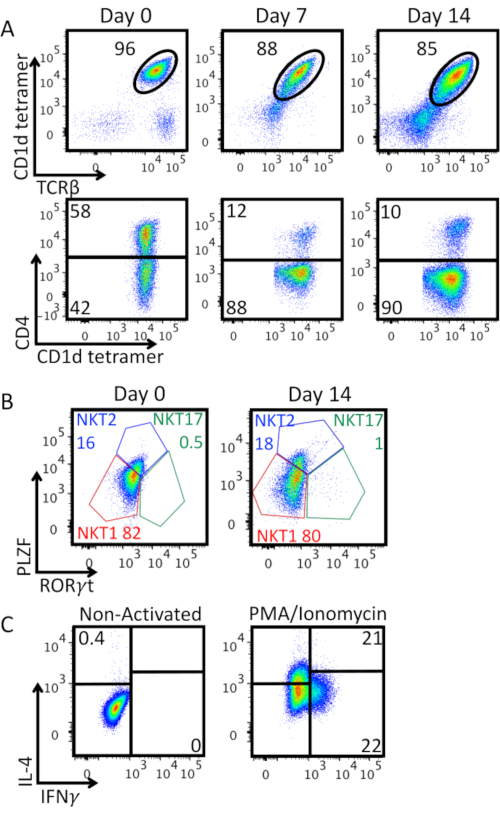
איור 3: אפיון תאי iNKT מורחב. A) ניתוח ציטומטריית זרימה של אחוז תא iNKT וביטוי CD4 לאורך תקופת ההרחבה. חלקות עליון מגודרות על לימפוציטים קיימא. חלקות נמוכות יותר מגודרות בתאי iNKT (CD1d-טטרמר קיימא+ TCRβ+ לימפוציטים). B) אפיון פנוטיפי של מועשר (יום 0) ומורחב (יום 14) תאי iNKT. חלקות מגודרות על תאי iNKT (CD1d-טטרמר קיימא+ TCRβ+ לימפוציטים). תאים היו מוכתמים תוך-גרעינית עבור גורמי שעתוק עם ערכת מאגר כתמי גורם שעתוק של Foxp3. NKT1 (PLZFנמוך RORγt-), NKT2 (PLZFגבוה RORγt-), ו NKT17 (PLZFint RORγt+) קבוצות משנה זוהו, תדרים של כל קבוצת משנה מוצגים באחוזים. ג) ייצור ציטוקינים על ידי תאי iNKT מורחבים ביום 14. חלקות מגודרות על תאי iNKT (CD1d-טטרמר קיימא+ TCRβ+ לימפוציטים). תאים היו מגורה במשך 4 שעות עם PMA 25 ng / mL / Ionomycin 1 מיקרוגרם / מ"ל, בנוכחות השעתיים האחרונות של Brefeldin A 10 מיקרוגרם / מ"ל. התאים תוקנו אז עם PFA 2%, חלחל עם Permwash ולאחר מכן מוכתם תאית לייצור ציטוקינים. אסטרטגיית Gating נקבעה על הפקד שאינו מופעל, לוח שמאלי. ניסוי ייצוגי אחד מוצג. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
כאן אנו מראים פרוטוקול לשחזור וישים כדי להשיג מיליוני תאי iNKT מוכנים לשימוש. בשל המחסור של תאים אלה ב vivo, שיטה להרחיב אותם היה נחוץ מאוד. הפרוטוקול שאנו מציעים אינו דורש מכשור מסוים ולא מספר גבוה של עכברים. ניצלנו עכברים מהונדסים iVα14-Jα18 בכוונה כדי להפחית את מספר העכברים הדרושים להליך.
פרוטוקול מוצלח נוסף להרחבת תאי iNKT מ- iVα14-Jα18 עכברים מהונדסים זמין בספרות10. פרוטוקול זה כרוך בדור, 6 ימים לפני טיהור תאי iNKT, של תאים דנדריטיים טריים שמקורם במח העצם, ואז עמוסים α-גלקטוסילכרמיד ומוקרן, בתוספת IL-2 ו- IL-7. אנו רואים בצמצום מספר העכברים המעורבים בהליך יתרון גדול של הפרוטוקול. זה גם חוסך זמן, שכן ההגדרה של תרבות התא נמשך יום אחד במקום שבוע. מגבלה אפשרית של יכולת הרבייה של הפרוטוקול הנוכחי יכולה להיות הזמינות של עכברים מהונדסים iVα14-Jα18, הזמינים עם זאת מסחרית. בהיעדר עכברים אלה, אנו מדמיינים את האפשרות להשתמש במספר רב של עכברי WT, אך יש להגדיר את הפרוטוקול בהתאם בשל המחסור בתאי iNKT בעכברים WT.
במהלך תרבית התא, אנחנו בדרך כלל לבדוק את הטוהר ואת הפנוטיפ של תאי iNKT מורחבים. הירידה באחוז ה- TCRβ+ CD1d-tetramer+ תאים חיוביים כפולים (איור 3A) יכולה להיות מוסברת על ידי ירידה טבעית של TCR תא NKT invariant מפני השטח של התא לאחר ההפעלה. יתר על כן, רוב תאי iNKT המורחבים לא הביעו CD4 (איור 3A): זה עשוי לייצג יתרון בהקשר של טיפול תאי מאמץ, שכן תאי CD4- iNKT נמצאו היעילים ביותר בשליטה על התקדמות הגידול11. יתר על כן, פנוטיפ המחולל דמוי TH0 הנצפה (איור 3C) קוהרנטי לחלוטין עם זה שנצפה בתאי iNKT האנושיים לאחר הרחבת במבחנה ושחזור8,12,13,14,15. התאים המורחבים מגיבים מאוד ב- vivo וב- itro, ובכך שימושיים בהקשרים של אימונותרפיות אימומציות מבוססות תא iNKT. העברה מאמצת של תאי iNKT לא מנוהלים או מורחבים מונעת או לשפר מחלת שתל-נגד-מארח חריפה (aGVHD) ומשאירה ללא ללא טעם את אפקט השתל נגד לוקמיה16,17,18,19. תאי iNKT אנושיים שהועברו באופן אימאמץ מורחבים במבחנה עם αGal-Cer להקל על aGVHD קסנוגני ואפקט זה מתווך על ידי CD4- אך לא CD4+ תאים20. יתר על כן, בהתחשב בכך שתאי iNKT אינם גורמים ל- aGVHD, הם מהווים את התאים האידיאליים לאימונותרפיה CAR ללא צורך במחיקת ה- TCR שלהם והוכיחו שיש להם פעילות אנטיטומור ממושכת ב- vivo8,15. תאי iNKT מנוצלים כיום בניסויים קליניים מתמשכים ומסיימת בניסויים קליניים21,22,23,24.
לסיכום, הפרוטוקול המתואר הוא מהיר, פשוט ומאפשר עלייה של פי 30 במספר תאי iNKT שנמצאו מטחול עכבר (איור 3B). תאים אלה ניתן לנצל בקלות עבור מבישיה זיהוי assays, מערכות תרבית משותפת, או טיפול בתאים מאמצים במחקרים פרה קליניים. תאי iNKT אכן, ממלאים תפקיד קריטי במעקב חיסוני של הגידול, מחלות זיהומיות וחיסון עצמי. בהקשרים אלה, תאי iNKT יכולים לייצג כלי רב עוצמה, להיות חלופה מושכת לתאי T קונבנציונליים נטולי הגבלת MHC. הדור המהיר של כמויות גדולות של תאים אלה ואת האפשרות להמשיך לתמרן אותם במבחנה יכול להוביל לפיתוח של אסטרטגיות טיפוליות חסרות תקדים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לפאולו דלבונה וג'וליה קאסורטי על התמיכה המדעית והקריאה הביקורתית של כתב היד. אנו מודים גם למתקן הליבה של NIH Tetramer עבור טטרמר CD1d עכבר. המחקר מומן על ידי פונדזיון קריפלו גרנט 2018-0366 (ל- M.F.) והאגודה האיטלקית לחקר הסרטן (AIRC) 2019-22604 (ל- G.D.).
Materials
| Name | Company | Catalog Number | Comments |
| Ammonium-Chloride-Potassium (ACK) solution | in house | 0.15M NH4Cl, 10mM KHCO3, 0.1mM EDTA, pH 7.2-7.4 | |
| anti-FITC Microbeads | Miltenyi Biotec | 130-048-701 | |
| anti-PE Microbeads | Miltenyi Biotec | 130-048-801 | |
| Brefeldin A | Sigma | B6542 | |
| CD19 -FITC | Biolegend | 115506 | clone 6D5 |
| CD1d-tetramer -PE | NIH tetramer core facility | mouse PBS57-Cd1d-tetramers | |
| CD4 -PeCy7 | Biolegend | 100528 | clone RM4-5 |
| Fc blocker | BD Bioscience | 553142 | |
| Fetal Bovine Serum (FBS) | Euroclone | ECS0186L | heat-inactivated and filtered .22 before use |
| FOXP3 Transcription factor staining buffer | eBioscience | 00-5523-00 | |
| H2 (IAb) -FITC | Biolegend | 114406 | clone AF6-120.1 |
| hrIL-2 | Chiron Corp | ||
| Ionomycin | Sigma | I0634 | |
| LD Columns | Miltenyi Biotec | 130-042-901 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | |
| MACS buffer (MB) | in house | 0.5% Bovine Serum Albumin (BSA; Sigma-Aldrich) and 2Mm EDTA | |
| MS Columns | Miltenyi Biotec | 130-042-201 | |
| Non-essential amino acids | Gibco | 11140-035 | |
| Penicillin and streptomycin (Pen-Strep) | Lonza | 15140-122 | |
| PermWash | BD Bioscience | 51-2091KZ | |
| PFA | Sigma | P6148 | |
| Phosphate buffered saline (PBS) | EuroClone | ECB4004L | |
| PMA | Sigma | P1585 | |
| Pre-Separation Filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| Recombinat Mouse IL-7 | R&D System | 407-ML-025 | |
| RPMI 1640 with glutamax | Gibco | 61870-010 | |
| sodium pyruvate | Gibco | 11360-039 | |
| TCRβ -APC | Biolegend | 109212 | clone H57-597 |
| αCD3CD28 mouse T activator Dynabeads | Gibco | 11452D | |
| β-mercaptoethanol | Gibco | 31350010 |
References
- Bendelac, A., Savage, P. B., Teyton, L. The biology of NKT cells. Annual Review of Immunology. 25, 297-336 (2007).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews: Immunology. 13 (2), 101-117 (2013).
- Pellicci, D. G., et al. A natural killer T (NKT) cell developmental pathway iInvolving a thymus-dependent NK1.1(-)CD4(+) CD1d-dependent precursor stage. Journal of Experimental Medicine. 195 (7), 835-844 (2002).
- Benlagha, K., Kyin, T., Beavis, A., Teyton, L., Bendelac, A. A thymic precursor to the NK T cell lineage. Science. 296 (5567), 553-555 (2002).
- Lee, Y. J., Holzapfel, K. L., Zhu, J., Jameson, S. C., Hogquist, K. A. Steady-state production of IL-4 modulates immunity in mouse strains and is determined by lineage diversity of iNKT cells. Nature Immunology. 14 (11), 1146-1154 (2013).
- Griewank, K., et al. Homotypic interactions mediated by Slamf1 and Slamf6 receptors control NKT cell lineage development. Immunity. 27 (5), 751-762 (2007).
- Cortesi, F., et al. Bimodal CD40/Fas-Dependent Crosstalk between iNKT Cells and Tumor-Associated Macrophages Impairs Prostate Cancer Progression. Cell Reports. 22 (11), 3006-3020 (2018).
- Heczey, A., et al. Invariant NKT cells with chimeric antigen receptor provide a novel platform for safe and effective cancer immunotherapy. Blood. 124 (18), 2824-2833 (2014).
- Liu, Y., et al. A modified alpha-galactosyl ceramide for staining and stimulating natural killer T cells. Journal of Immunological Methods. 312 (1-2), 34-39 (2006).
- Chiba, A., et al. Rapid and reliable generation of invariant natural killer T-cell lines in vitro. Immunology. 128 (3), 324-333 (2009).
- Crowe, N. Y., et al. Differential antitumor immunity mediated by NKT cell subsets in vivo. Journal of Experimental Medicine. 202 (9), 1279-1288 (2005).
- de Lalla, C., et al. Production of profibrotic cytokines by invariant NKT cells characterizes cirrhosis progression in chronic viral hepatitis. Journal of Immunology. 173 (2), 1417-1425 (2004).
- Tian, G., et al. CD62L+ NKT cells have prolonged persistence and antitumor activity in vivo. Journal of Clinical Investigation. 126 (6), 2341-2355 (2016).
- Gaya, M., et al. Initiation of Antiviral B Cell Immunity Relies on Innate Signals from Spatially Positioned NKT Cells. Cell. 172 (3), 517-533 (2018).
- Rotolo, A., et al. Enhanced Anti-lymphoma Activity of CAR19-iNKT Cells Underpinned by Dual CD19 and CD1d Targeting. Cancer Cell. 34 (4), 596-610 (2018).
- Schneidawind, D., et al. Third-party CD4+ invariant natural killer T cells protect from murine GVHD lethality. Blood. 125 (22), 3491-3500 (2015).
- Schneidawind, D., et al. CD4+ invariant natural killer T cells protect from murine GVHD lethality through expansion of donor CD4+CD25+FoxP3+ regulatory T cells. Blood. 124 (22), 3320-3328 (2014).
- Schneidawind, D., Pierini, A., Negrin, R. S. Regulatory T cells and natural killer T cells for modulation of GVHD following allogeneic hematopoietic cell transplantation. Blood. 122 (18), 3116-3121 (2013).
- Leveson-Gower, D. B., et al. Low doses of natural killer T cells provide protection from acute graft-versus-host disease via an IL-4-dependent mechanism. Blood. 117 (11), 3220-3229 (2011).
- Coman, T., et al. Human CD4- invariant NKT lymphocytes regulate graft versus host disease. Oncoimmunology. 7 (11), 1470735 (2018).
- Xu, X., et al. NKT Cells Coexpressing a GD2-Specific Chimeric Antigen Receptor and IL15 Show Enhanced In vivo Persistence and Antitumor Activity against Neuroblastoma. Clinical Cancer Research. 25 (23), 7126-7138 (2019).
- Heczey, A., et al. Anti-GD2 CAR-NKT cells in patients with relapsed or refractory neuroblastoma: an interim analysis. Nature Medicine. 26 (11), 1686-1690 (2020).
- Exley, M. A., et al. Adoptive Transfer of Invariant NKT Cells as Immunotherapy for Advanced Melanoma: A Phase I Clinical Trial. Clinical Cancer Research. 23 (14), 3510-3519 (2017).
- Wolf, B. J., Choi, J. E., Exley, M. A. Novel Approaches to Exploiting Invariant NKT Cells in Cancer Immunotherapy. Frontiers in Immunology. 9, 384 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved