Method Article
تنقية وتوسيع الخلايا T القاتل الطبيعي الثابت الماوس في المختبر وفي دراسات في الجسم الحي
In This Article
Summary
نحن نصف بروتوكول سريع وقوي لإثراء الخلايا القاتل الطبيعي الثابت T (iNKT) من طحال الماوس وتوسيعها في المختبر إلى أرقام مناسبة للدراسات المختبرية وفي الجسم الحي.
Abstract
الخلايا T القاتل الطبيعي الثابت (iNKT) هي خلايا ليمفاوية T تشبه الفطرية تعبر عن مستقبلات خلايا T شبه ثابتة (TCR) محفوظة محددة لمستضدات الدهون الذاتية أو الميكروبية التي يقدمها جزيء MHC غير متعدد الأشكال من الفئة I-RELATED CD1d. تدعم الدراسات قبل السريرية والسريرية دورا لخلايا iNKT في السرطان والمناعة الذاتية والأمراض المعدية. يتم الحفاظ على خلايا iNKT جدا في جميع أنحاء الأنواع وقد تم تسهيل تحقيقها من خلال نماذج الماوس ، بما في ذلك الفئران التي تعاني من نقص CD1d أو iNKT - deficient ، وإمكانية اكتشافها بشكل لا لبس فيه في الفئران والرجال الذين يعانون من رباعيات CD1d أو mAbs محددة لTCR شبه ثابتة. ومع ذلك، فإن خلايا iNKT نادرة وتحتاج إلى توسيعها للوصول إلى أرقام يمكن التحكم فيها لأي دراسة. لأن جيل خط الخلية iNKT الماوس الأساسي في المختبر قد ثبت صعوبة, وضعنا بروتوكول قوي لتنقية وتوسيع خلايا iNKT splenic من الفئران المعدلة وراثيا iVα14-Jα18 (iVα14Tg), التي خلايا iNKT هي 30 مرات أكثر تواترا. نظهر هنا أن خلايا iVα14Tg iNKTg الأولية يمكن تخصيبها من خلال عملية فصل مغناطيسية مناعية ، مما ينتج عنه حوالي 95-98٪ من خلايا iNKT النقية. يتم تحفيز خلايا iNKT المنقى بواسطة حبات مضادة للCD3/CD28 بالإضافة إلى IL-2 و IL-7 ، مما يؤدي إلى توسع 30 ضعفا بحلول اليوم +14 للثقافة مع نقاء 85-99٪. يمكن التلاعب بسهولة خلايا iNKT الموسعة وراثيا ، مما يوفر أداة لا تقدر بثمن لتشريح آليات التنشيط والوظيفة في المختبر ، والأهم من ذلك ، أيضا عند النقل بالتبني في الجسم الحي.
Introduction
الخلايا التائية القاتلة الطبيعية الثابتة (خلايا iNKT) هي خلايا ليمفاوية T تشبه الفطرية تعبر عن مستقبلات خلايا T شبه ثابتة (TCR) ، تشكلت في الفئران بواسطة سلسلة Vα14-Jα18 ثابتة مقترنة بمجموعة محدودة من سلاسل Vβ المتنوعة1، وهي محددة للمستضدات الدهنية التي يقدمها جزيء MHC I-RELATED CD1d2. تخضع خلايا iNKT لبرنامج اختيار ناهض مما يؤدي إلى اكتساب النمط الظاهري المنشط / الفطري الموجود بالفعل في الغدة الصعترية ، والذي يحدث من خلال عدة مراحلنضوج 3و4، وإنتاج CD4+ و CD4- فرعية. من خلال هذا البرنامج، تكتسب خلايا iNKT مساعد T متميز (TH)الأنماط الظاهرية المؤثرة، وهي TH1 (iNKT1) و TH2 (iNKT2) و TH17 (iNKT17)، التي يمكن التعرف عليها من خلال التعبير عن عوامل النسخ T-bet و GATA3 و PLZF و RORаt، على التوالي5. تتعرف خلايا iNKT على مجموعة من الدهون الميكروبية ولكنها أيضا ذاتية التفاعل ضد الدهون الذاتية التي يتم تنظيمها في سياق الحالات المرضية لإجهاد الخلايا وتلف الأنسجة ، مثل السرطان والمناعة الذاتية2. عند التنشيط، تعدل خلايا iNKT وظائف الخلايا المناعية الفطرية والتكيفية الأخرى عن طريق الاتصال المباشر وإنتاج السيتوكين2.
وقد تم تسهيل التحقيقات في خلايا iNKT من خلال نماذج الماوس ، بما في ذلك الفئران التي تعاني من نقص CD1d أو Jα18 ، وإنتاج رباعيات CD1d المحملة بالمستضد بالإضافة إلى توليد أجسام مضادة أحادية النسيلة (mAbs) محددة ل TCR البشري شبه المتغير. ومع ذلك، فقد ثبت أن إنشاء خط الخلية iNKT الماوس الأساسي صعبة. لتوصيف أفضل لوظائف antitumor من خلايا iNKT والاستفادة منها للعلاج بالخلايا بالتبني، وضعنا بروتوكول لتنقية وتوسيع خلايا iNKT splenic من الفئران المعدلة وراثيا iVα14-Jα18 (iVα14Tg)6،والتي خلايا iNKT هي 30 مرة أكثر تواترا مما كانت عليه في الفئران نوع البرية.
يمكن استغلال خلايا iNKT الموسعة لإجراء فحوصات في المختبر ، وفي الجسم الحي عند نقلها مرة أخرى إلى الفئران. في هذا الإعداد، على سبيل المثال، لقد أظهرنا آثارها المضادة للورم قوية7. وعلاوة على ذلك، في المختبر توسيع خلايا iNKT قابلة للتعديل الوظيفي عن طريق نقل الجينات أو التحرير قبل حقنها في الجسم الحي8،مما يسمح التحليل الوظيفي الثاقبة للمسارات الجزيئية، فضلا عن تمهيد الطريق لعلاجات الخلايا المتقدمة.
Protocol
تم استعراض الإجراءات الموصوفة هنا والموافقة عليها من قبل اللجنة المؤسسية لرعاية الحيوان واستخدامه (IACUC) (رقم 1048) في معهد سان رافائيل العلمي.
ملاحظة: يجب أن يتم تنفيذ جميع الإجراءات في ظل ظروف معقمة. يتم سرد كافة الكواشف المستخدمة في جدول المواد.
1. معالجة الطحال
- قتل رحيم iVα14-Jα18 الفئران عن طريق استنشاقثاني أكسيد الكربون وفقا للسياسة المؤسسية.
ملاحظة: يجب أن يكون عمر فئران iVα14-Jα18 8 أسابيع أو أكثر. لتجنب رفض الخلايا من نقل الخلايا في الجسم الحي ، اعتبر أن الخلايا المعزولة عن الفئران الأنثوية يمكن نقلها بالتبني في كل من المتلقين الذكور والإناث ، في حين يمكن نقل الخلايا المعزولة عن الفئران الذكور فقط في المتلقين الذكور. وفيما يتحتم النظر في أي تحيز جنساني في التجارب المختبرية. يمكن تجميع المزيد من الفئران من أجل الحصول على المزيد من الخلايا. - تشريح طحال الماوس وتحطيمه من خلال مصفاة خلية 70 نانومتر للحصول على تعليق خلية واحدة في 10 مل من المالحة العازلة الفوسفات (PBS) مع 2٪ مصل البقر الجنيني (FBS).
- جهاز طرد مركزي عند 300 × ز لمدة 5 دقائق.
- إزالة supernatant عن طريق عكس وعملية مع العازلة تحلل كريات الدم الحمراء. Resuspend بيليه الخلية مع 1 مل من ACK العقيمة (الأمونيوم كلوريد البوتاسيوم) Lysing العازلة، واحتضان لمدة 3 دقائق في درجة حرارة الغرفة، وكتلة مع 5 مل من برنامج تلفزيوني مع 2٪ FBS. جهاز طرد مركزي عند 300 × ز لمدة 5 دقائق.
ملاحظة: ACK متوفر تجاريا; وهو يتألف من حل 0.15 M NH4Cl, 10 mM KHCO3, و 0.1 mM Na2EDTA (حمض الإيثيلينديامينتتراستيك) المذاب في بيديستيليد H2O, pH 7.2-7.4. إذا كانت محلية الصنع، قم بتعقيمها عن طريق الترشيح باستخدام فلتر 0.22 ميكرومتر. - إزالة supernatant عن طريق الانعكاس. Resuspend بيليه الخلية في 3 مل من برنامج تلفزيوني مع 2٪ FBS وإزالة بقايا الدهون عن طريق pipetting. إذا لزم الأمر، تجمع الخلايا القادمة من فئران مختلفة.
- عد الخلايا والحفاظ على 50 ميكرولتر لتحليل FACS.
2. تي إثراء الخلية
ملاحظة: لخطوات التخصيب، اعمل بسرعة، حافظ على برودة الخلايا واستخدم الحلول المبردة مسبقا عند 4 درجات مئوية بين عشية وضحاها ثم احتفظ بها على الجليد
- جهاز طرد مركزي عند 300 × ز لمدة 5 دقائق.
- إعادة تشغيل جميع الخلايا في المبلغ المناسب من برنامج تلفزيوني مع 2٪ FBS (500 ميكرولتر ل107 خلايا) وحاصر Fc (2.5 ميكرولتر × 107 خلايا)؛ احتضان لمدة 15 دقيقة في درجة حرارة الغرفة (RT).
- اغسله بكمية 1-2 مل من حاجز فصل MACS لكل 10خلايا إجمالية وأجهزة طرد مركزي بمعدل 300 × ز لمدة 10 دقائق.
ملاحظة: المخزن المؤقت MACS متوفر تجاريا. وهو يتألف من PH PBS 7.2، 0.5٪ ألبوم مصل البقر (BSA)، و 2 MM EDTA. إذا كانت محلية الصنع، قم بتعقيمها عن طريق الترشيح باستخدام فلتر 0.22 ميكرومتر. - إزالة supernatant عن طريق عكس وصمة عار الخلايا مع CD19-FITC وH2 (IA ب)-FITC (استخدام 5 ميكرولتر × 107 خلايا في 100 ميكرولتر من ميغابايت). تخلط جيدا واحتضان لمدة 15 دقيقة في الظلام في 4-8 درجة مئوية.
- اغسل الخلايا بإضافة 1−2 مل من ميغا بايت لكل 107 خلايا وأجهزة طرد مركزي عند 300 × غرام لمدة 10 دقائق.
- ماصة قبالة supernatant تماما وإعادة إنفاق بيليه الخلية في 90 ميكرولتر من ميغابايت لكل 107 مجموع الخلايا. إضافة 10 ميكرولتر من مكافحة FITC MicroBeads لكل 107 مجموع الخلايا. تخلط جيدا واحتضان لمدة 15 دقيقة في الظلام في 4-8 درجة مئوية.
- اغسل الخلايا بإضافة 1−2 مل من ميغا بايت لكل 107 خلايا وأجهزة طرد مركزي بمعدل 300 × ز لمدة 10 دقائق.
- ماصة قبالة supernatant تماما وإعادة الإنفاق تصل إلى 1.25 × 108 خلية في 500 ميكرولتر من MB.
- ضع عمود LD في المجال المغناطيسي لمفصل MACS للشروع في الاستنفاد. لتجنب انسداد، وتطبيق مرشح ما قبل الفصل على العمود LD وشطف مع 2 مل من ميغابايت.
- عندما يكون خزان العمود فارغا، قم بتطبيق تعليق الخلية على الفلتر. جمع الخلايا غير التسمية التي تمر عبر العمود.
- اغسل 3 مرات مع 1 مل من ميغابايت، فقط عندما يكون خزان العمود فارغا. جمع مجموع النفايات السائلة، والتي سيتم إثراء في الخلايا التائية، والعد الخلايا. احتفظ دائما ب 50 ميكرولتر لتحليل FACS.
3. إثراء الخلية iNKT
- الطرد المركزي في 300 × ز لمدة 5 دقائق وإزالة supernatant عن طريق الانعكاس.
- وصمة عار الخلايا مع CD1d-tetramer-PE (الماوس PBS57-CD1d-tetramer)، وفقا ل المعايرة الأجسام المضادة في 50 ميكرولتر من ميغابايت لكل 106 خلايا. تخلط جيدا واحتضان لمدة 30 دقيقة في الظلام على الجليد.
ملاحظة: يمكن أيضا إجراء الإجراء باستخدام رباعيات MCD1d التي تحمل علامة APC والخرز المضاد ل APC؛ ضبط الفلوروشروم المستخدمة في تلطيخ التالية وفقا لذلك. في هذا البروتوكول استخدمنا الماوس PBS-57-CD1d-tetramers المقدمة من المعاهد القومية للصحة. αgalactosylceramide (αGal-Cer) هو مستضد نموذجي معترف به من قبل خلايا iNKT. برنامج تلفزيوني-57 هو التماثلية من αGal-Cer مع تحسين الذوبان9; يوفر مرفق تترامر NIH PBS-57 ligand معقدة إلى رباعيات CD1d. ومع ذلك، فإن أجهزة التعتيم CD1d/tetramers/dextramers الأخرى متوفرة تجاريا ويمكن تحميلها بمستضد دهون مثل αGal-Cer. ونحن نتصور إمكانية تعديل البروتوكول لاستخدامه. - اغسل الخلايا بإضافة 1−2 مل من ميغا بايت لكل 107 خلايا وأجهزة طرد مركزي بمعدل 300 × ز لمدة 10 دقائق.
- ماصة قبالة supernatant تماما وإعادة إنفاق بيليه الخلية في 80 ميكرولتر من ميغابايت لكل 107 مجموع الخلايا. إضافة 20 ميكرولتر من مكافحة PE MicroBeads لكل 107 مجموع الخلايا. تخلط جيدا واحتضان لمدة 15 دقيقة في الظلام في 4-8 درجة مئوية.
- اغسل الخلايا بإضافة 1−2 مل من ميغا بايت لكل 107 خلايا وأجهزة طرد مركزي عند 300 × غرام لمدة 10 دقائق.
- ماصة قبالة supernatant تماما وإعادة إنفاق ما يصل إلى 108 خلايا في 500 ميكرولتر من MB. وإلا إذا تجاوزت الخلايا 108،قم بضبط مستوى الصوت وفقا لذلك.
- وفقا لعدد الخلايا، ضع LS (حتى 108)أو MS (حتى 107)عمود في المجال المغناطيسي لفاصل MACS. شطف العمود مع MB (3 مل ل LS، 500 ميكرولتر للتصل بالتصلب المتعدد).
- تطبيق تعليق الخلية على العمود.
- جمع الخلايا غير البطاقة التي تمر من خلال. اغسل العمود 3 مرات بإضافة الكمية المناسبة من MB (3 × 3 مل لعمود LS و3 × 500 ميكرولتر لعمود MS) فقط عندما يكون خزان العمود فارغا. إجمالي النفايات السائلة هو الكسر السالب.
- قم بإزالة العمود من المجال المغناطيسي ووضعه على أنبوب تجميع جديد.
- ماصة ميغابايت على العمود (5 مل لعمود LS أو 1 مل لعمود MS)؛ دفع المكبس المقدمة في العمود وطرد الكسر الموجب (المخصب في خلايا iNKT).
- لزيادة استعادة الخلية iNKT، طرد المركزي الكسر السلبي في 300 x g لمدة 10 دقائق وكرر الخطوات 3.6-3.7 مع LS أو MS العمود الجديد. تجمع الكسور الموجبة وتحدد عدد الخلايا. احتفظ ب 50 ميكرولتر من الكسور الإيجابية والسلبية لتحليل FACS.
- تحقق من خطوات تنقية بواسطة تحليل FACS. وتشمل العينات: الطحال السابق فيفو، تي الخلية المخصب كسر، iNKT كسر إيجابي و iNKT كسر سلبي. وصمة عار الخلايا مع: CD19-FITC، IAb-FITC، CD1d-tetramer-PE، TCRа-APC وDAPI.
ملاحظة: الاسترداد المتوقع من فأر iVα14-Jα18 واحد هو 2x106 خلايا iNKT .
4. iNKT تنشيط الخلية والتوسع
- تنشيط خلايا iNKT المنقى مع الماوس T المنشط مكافحة CD3/CD28 الخرز المغناطيسي في نسبة 1:1.
- الطرد المركزي الخلية iNKT كسر إيجابي في 300 × ز لمدة 5 دقائق.
- وفي الوقت نفسه نقل الحجم المناسب من الخرز المغناطيسي المضادة CD3/CD28 إلى أنبوب وإضافة حجم متساو من برنامج تلفزيوني، دوامة لمدة 5 ثوان. ضع الأنبوب على مغناطيس لمدة دقيقة واحدة وتخلص من الناتورنت.
- إزالة أنبوب من المغناطيس وإعادة إنفاق الخرز المغناطيسي غسلها في الحجم المناسب من RPMI كاملة (RPMI 1640 المتوسطة، 10٪ FCS الحرارة المعطل، 1 mm الصوديوم بيروفات، 1٪ الأحماض الأمينية غير الأساسية، 10 U/ml البنسلين والستريبتوميسين، 50 ميكرومتر β ميركابتوثانول) أن يكون 5 × 105 خلايا iNKT في 1 مل. استخدم هذا التعليق لإعادة إنفاق الكسر الإيجابي iNKT الطرد المركزي.
- لوحة 1 مل من تعليق الخلية (5 × 105 خلايا iNKT) والخرز المغناطيسي المضادة CD3/CD28 في لوحة بئر 48 مع 20 U/mL IL-2 واحتضان في 37 درجة مئوية.
- بعد 5 أيام، أضف 10 نانوغرام/مل IL-7.
- تقسيم الخلايا 1:2 عندما تصل إلى التقاء 80-90٪، إضافة دائما 20U/mL IL-2 و 10 نانوغرام / مل IL-7. في هذه الظروف، يمكن توسيع خلايا iNKT لمدة تصل إلى 15 يوما.
النتائج
البروتوكول الموصوف في هذه المخطوطة يمكن من إثراء خلايا iNKT من طحال الفئران المعدلة وراثيا iVa14-Ja18 من خلال عملية فصل مغناطيسية مناعية ملخصة في الشكل 1A. يتم اختيار إجمالي خلايا الطحال T أولا بشكل سلبي عن طريق استنفاد الخلايا B والخلايا الأحادية ، تليها الفرز المناعي الإيجابي للخلايا iNKT مع مستضد الدهون PBS-57 المحملة رباعيات CD1d ، والتي تمكن من وصمة عار على وجه التحديد فقط خلايا iNKT. هذا البروتوكول ينتج حوالي 2 × 106 من 95-98٪ خلايا iNKT نقية من طحال فأرة iVa14-Ja18 TG واحدة. لا يمكن الكشف عن أي خلايا iNKT أو عدد قليل منها في الكسر السالب(الشكل 1B).
بعد الإثراء، يمكن توسيع iVa14 iNKT الخلايا مع مكافحة CD3/CD28 الخرز بالإضافة إلى IL-2 و IL-7 (الشكل 2A)، مما أدى إلى توسيع 30 أضعاف في المتوسط بحلول اليوم +14 من الثقافة كما هو مبين في الشكل 2B.
الشكل 3A يظهر نقاء الخلية iNKT جنبا إلى جنب مع التوسع في المختبر والتعبير عن جزيء CD4. لاحظنا تناقصا في النسبة المئوية ل TCRβ+ CD1d-tetramer+ خلايا إيجابية مزدوجة: التنشيط القوي مع حبات مكافحة CD3/CD28 يؤدي إلى خفض تنظيم تعبير TCR الخلية iNKT على سطح الخلية ، ويظهر عدد سلبي مزدوج. وكانت غالبية الخلايا iNKT الموسعة CD4-. ويبين الشكل 3 باء وصفا للتعبير عن عوامل النسخ الخاصة بالنسب PLZF و RORγt على خلايا iNKT المخصبة في اليومين 0 و 14 يوما بعد التوسع. هذا تلطيخ تمكن من تحديد NKT1 (PLZF RORγtمنخفضة -)، NKT2 (PLZF RORγtعالية -)، وNKT17 (PLZFint RORγt+) الأنماط الظاهرية. يجري في الغالب NKT1 و NKT2، والخلايا iNKT المخصب تظهر TH0 مثل تأثير النمط الظاهري. يتم الحفاظ على هذا النمط الظاهري بعد 14 يوما من التوسع كما أكد من قبل إفراز كل من IFN-γ وIL-4 بعد PMA / التحفيز الأيونوميسين هو مبين في الشكل 3C.

الشكل 1: إثراء الخلية iNKT. أ) التمثيل التخطيطي لبروتوكول الفصل المغناطيسي المناعي. ب)تحليل التدفق الخلوي لكل خطوة تخصيب. تظهر النسبة المئوية لترددات الخلايا التائية في المؤامرات العليا، مسورة على الخلايا الليمفاوية القابلة للحياة. في حين تظهر النسبة المئوية لترددات الخلايا iNKT على طول كل خطوة في المؤامرات السفلية ، مسورة على CD19 قابلة للحياة- TCRβ+ الخلايا الليمفاوية. تلطيخ على CD19 قابلة للحياة- TCRβ+ الخلايا الليمفاوية مع tetramer CD1d تفريغ تسمح لرسم بوابة الخلية iNKT بشكل صحيح. يتم عرض تجربة تمثيلية واحدة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: iNKT الخلية في توسع المختبر. أ)عدد خلايا iNKT على طول توسيع الخلية iNKT. يتم عرض ثلاث تجارب تمثيلية ومستقلة. ب)أضعاف زيادة في عدد الخلية iNKT في اليوم 7 و 14 بعد تنقية والتنشيط. يعني ± SD تظهر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
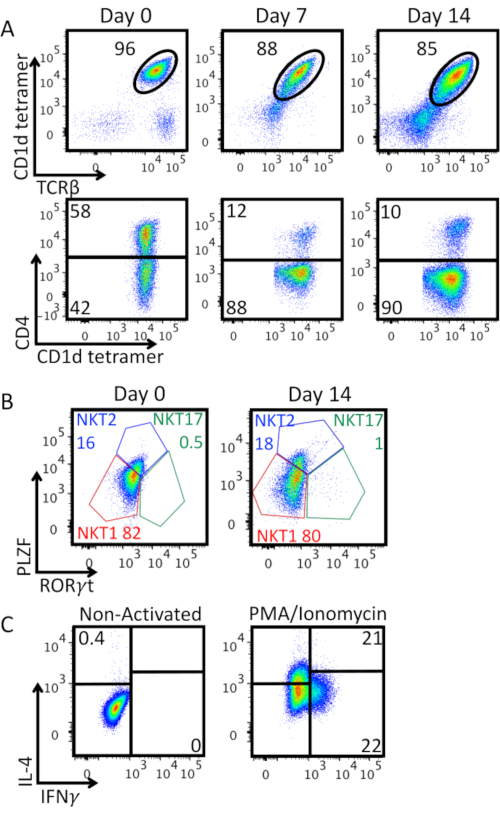
الشكل 3:توسيع توصيف الخلية iNKT. أ) تحليل تدفق قياس الخلايا من نسبة الخلية iNKT والتعبير CD4 على طول فترة التوسع. يتم بوابات المؤامرات العليا على الخلايا الليمفاوية قابلة للحياة. يتم بوابات المؤامرات السفلية على خلايا iNKT (CD1d-tetramer قابلة للحياة+ TCRβ+ الخلايا الليمفاوية). ب)وصف Phenotypic المخصب (اليوم 0) وتوسيع (اليوم 14) خلايا iNKT. يتم بوابات المؤامرات على خلايا iNKT (قابلة للحياة CD1d-tetramer+ TCRβ+ الخلايا الليمفاوية). كانت الخلايا ملطخة نوويا لعوامل النسخ مع مجموعة التخزين المؤقت لعوامل النسخ Foxp3. NKT1 (PLZF RORγtمنخفضة -), NKT2 (PLZF RORγtعالية -), وNKT17 (PLZFint RORγt+) تم تحديد مجموعات فرعية, يتم عرض ترددات كل مجموعة فرعية في النسبة المئوية. ج)إنتاج السيتوكين من قبل خلايا iNKT الموسعة في اليوم 14. يتم بوابات المؤامرات على خلايا iNKT (قابلة للحياة CD1d-tetramer+ TCRβ+ الخلايا الليمفاوية). تم تحفيز الخلايا لمدة 4 ساعات مع PMA 25 نانوغرام / مل / أيونوميسين 1 ميكروغرام / مل ، في وجود لآخر 2 ساعة من Brefeldin A 10 ميكروغرام / مل. ثم تم إصلاح الخلايا مع PFA 2٪، permeabilized مع Permwash ومن ثم ملطخة داخل الخلايا لإنتاج السيتوكين. تم تعيين استراتيجية غاتينج على عنصر التحكم غير المنشط، اللوحة اليسرى. يتم عرض تجربة تمثيلية واحدة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هنا نعرض بروتوكول قابل للاستنساخ وقابلة للتنفيذ للحصول على الملايين من خلايا iNKT الجاهزة للاستخدام. بسبب ندرة هذه الخلايا في الجسم الحي، كانت هناك حاجة ماسة إلى طريقة لتوسيعها. البروتوكول الذي نقترحه لا يتطلب أجهزة معينة ولا عدد كبير من الفئران. لقد استغلينا فئران iVα14-Jα18 المعدلة وراثيا عن قصد لتقليل عدد الفئران اللازمة لهذا الإجراء.
بروتوكول آخر ناجح لتوسيع الخلية iNKT من الفئران المعدلة وراثيا iVα14-Jα18 متاح في الأدب10. يتضمن هذا البروتوكول توليد خلايا دندريتيك طازجة مشتقة من نخاع العظم، قبل 6 أيام من تنقية الخلايا الجذعية المشتقة من نخاع العظم، ثم تحميلها α-galactosylceramide والمشعة، بالإضافة إلى IL-2 و IL-7. ونحن نعتبر تخفيض عدد الفئران المشاركة في الإجراء ميزة كبيرة للبروتوكول. كما أنه يوفر الوقت ، لأن إعداد ثقافة الخلية يستمر يوما واحدا بدلا من أسبوع. ويمكن أن يكون أحد القيود المحتملة على إمكانية استنساخ البروتوكول الحالي هو توافر فئران معدلة وراثيا من نوع iVα14-Jα18، وهي متاحة تجاريا. في غياب هذه الفئران ، ونحن نتصور إمكانية استخدام عدد كبير من الفئران WT ، ولكن البروتوكول يحتاج إلى إعداد وفقا لذلك بسبب ندرة خلايا iNKT في الفئران WT.
خلال ثقافة الخلية، ونحن عادة التحقق من نقاء والنمط الظاهري للخلايا iNKT الموسعة. ويمكن تفسير الانخفاض في النسبة المئوية لTCRβ+ CD1d-tetramer+ الخلايا الإيجابية المزدوجة(الشكل 3A)من خلال التنظيم الطبيعي للخلية NKT الثابتة TCR من سطح الخلية بعد التنشيط. وعلاوة على ذلك، فإن غالبية الخلايا iNKT الموسعة لم تعبر عن CD4 (الشكل 3A):وهذا قد يمثل ميزة في سياق العلاج بالخلايا بالتبني، منذ CD4- تم العثور على خلايا iNKT لتكون الأكثر فعالية في السيطرة على تطور الورم11. وعلاوة على ذلك، لوحظ TH0 مثل تأثير النمط الظاهري (الشكل 3C) هو متماسك تماما مع تلك التي لوحظت في خلايا iNKT الإنسان بعد التوسع في المختبر وراحة8،12،13،14،15. الخلايا الموسعة هي رد فعل للغاية في الجسم الحي وفي المختبر، وبالتالي مفيدة في سياقات العلاج المناعي بالتبني القائم على الخلايا iNKT. نقل بالتبني من الخلايا iNKT غير المتلاعب بها أو الموسعة يمنع أو يخفف من مرض الكسب غير المشروع مقابل المضيف الحاد (aGVHD) تاركا دون تغيير تأثير الكسب غير المشروع مقابل سرطان الدم16،17،18،19. نقل بالتبني الإنسان iNKT-الخلايا الموسعة في المختبر مع αGal-Cer تخفيف aGVHD xenogeneic ويتم التوسط في هذا التأثير من قبل CD4- ولكن ليس CD4+ الخلايا20. وعلاوة على ذلك، وبالنظر إلى أن خلايا iNKT لا تسبب aGVHD، فإنها تشكل الخلايا المثالية للعلاج المناعي CAR دون الحاجة إلى حذف TCR الخاصة بهم وثبت أن لديها نشاط مضاد للورم لفترات طويلة في الجسم الحي8،15. يتم استغلال خلايا iNKT حاليا في التجارب السريرية الجارية والمختتمة21،22،23،24.
في الختام، البروتوكول الموصوف سريع ومباشر ويسمح بزيادة 30x في عدد خلايا iNKT التي تم استردادها من طحال الماوس(الشكل 3B). يمكن استغلال هذه الخلايا بسهولة لإجراء فحوصات التعرف على المختبر أو أنظمة الثقافة المشتركة أو العلاج بالخلايا بالتبني في الدراسات ما قبل السريرية. خلايا iNKT في الواقع، تلعب دورا حاسما في مراقبة المناعة الورم، والأمراض المعدية والمناعة الذاتية. في هذه السياقات، يمكن أن تمثل خلايا iNKT أداة قوية، كونها بديلا جذابا للخلايا التائية التقليدية الخالية من قيود MHC. يمكن أن يؤدي التوليد السريع لكميات كبيرة من هذه الخلايا وإمكانية زيادة التلاعب بها في المختبر إلى تطوير استراتيجيات علاجية غير مسبوقة.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
نشكر باولو ديلابونا وجوليا كاسوراتي على الدعم العلمي والقراءة النقدية للمخطوطة. نشكر أيضا مرفق NIH Tetramer Core على رباعي الأقراص المضغوطة CD1d. تم تمويل الدراسة من قبل فوندازيون كاريبلو غرانت 2018-0366 (إلى M.F.) وزمالة الجمعية الإيطالية لأبحاث السرطان (AIRC) 2019-22604 (إلى G.D.).
Materials
| Name | Company | Catalog Number | Comments |
| Ammonium-Chloride-Potassium (ACK) solution | in house | 0.15M NH4Cl, 10mM KHCO3, 0.1mM EDTA, pH 7.2-7.4 | |
| anti-FITC Microbeads | Miltenyi Biotec | 130-048-701 | |
| anti-PE Microbeads | Miltenyi Biotec | 130-048-801 | |
| Brefeldin A | Sigma | B6542 | |
| CD19 -FITC | Biolegend | 115506 | clone 6D5 |
| CD1d-tetramer -PE | NIH tetramer core facility | mouse PBS57-Cd1d-tetramers | |
| CD4 -PeCy7 | Biolegend | 100528 | clone RM4-5 |
| Fc blocker | BD Bioscience | 553142 | |
| Fetal Bovine Serum (FBS) | Euroclone | ECS0186L | heat-inactivated and filtered .22 before use |
| FOXP3 Transcription factor staining buffer | eBioscience | 00-5523-00 | |
| H2 (IAb) -FITC | Biolegend | 114406 | clone AF6-120.1 |
| hrIL-2 | Chiron Corp | ||
| Ionomycin | Sigma | I0634 | |
| LD Columns | Miltenyi Biotec | 130-042-901 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | |
| MACS buffer (MB) | in house | 0.5% Bovine Serum Albumin (BSA; Sigma-Aldrich) and 2Mm EDTA | |
| MS Columns | Miltenyi Biotec | 130-042-201 | |
| Non-essential amino acids | Gibco | 11140-035 | |
| Penicillin and streptomycin (Pen-Strep) | Lonza | 15140-122 | |
| PermWash | BD Bioscience | 51-2091KZ | |
| PFA | Sigma | P6148 | |
| Phosphate buffered saline (PBS) | EuroClone | ECB4004L | |
| PMA | Sigma | P1585 | |
| Pre-Separation Filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| Recombinat Mouse IL-7 | R&D System | 407-ML-025 | |
| RPMI 1640 with glutamax | Gibco | 61870-010 | |
| sodium pyruvate | Gibco | 11360-039 | |
| TCRβ -APC | Biolegend | 109212 | clone H57-597 |
| αCD3CD28 mouse T activator Dynabeads | Gibco | 11452D | |
| β-mercaptoethanol | Gibco | 31350010 |
References
- Bendelac, A., Savage, P. B., Teyton, L. The biology of NKT cells. Annual Review of Immunology. 25, 297-336 (2007).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews: Immunology. 13 (2), 101-117 (2013).
- Pellicci, D. G., et al. A natural killer T (NKT) cell developmental pathway iInvolving a thymus-dependent NK1.1(-)CD4(+) CD1d-dependent precursor stage. Journal of Experimental Medicine. 195 (7), 835-844 (2002).
- Benlagha, K., Kyin, T., Beavis, A., Teyton, L., Bendelac, A. A thymic precursor to the NK T cell lineage. Science. 296 (5567), 553-555 (2002).
- Lee, Y. J., Holzapfel, K. L., Zhu, J., Jameson, S. C., Hogquist, K. A. Steady-state production of IL-4 modulates immunity in mouse strains and is determined by lineage diversity of iNKT cells. Nature Immunology. 14 (11), 1146-1154 (2013).
- Griewank, K., et al. Homotypic interactions mediated by Slamf1 and Slamf6 receptors control NKT cell lineage development. Immunity. 27 (5), 751-762 (2007).
- Cortesi, F., et al. Bimodal CD40/Fas-Dependent Crosstalk between iNKT Cells and Tumor-Associated Macrophages Impairs Prostate Cancer Progression. Cell Reports. 22 (11), 3006-3020 (2018).
- Heczey, A., et al. Invariant NKT cells with chimeric antigen receptor provide a novel platform for safe and effective cancer immunotherapy. Blood. 124 (18), 2824-2833 (2014).
- Liu, Y., et al. A modified alpha-galactosyl ceramide for staining and stimulating natural killer T cells. Journal of Immunological Methods. 312 (1-2), 34-39 (2006).
- Chiba, A., et al. Rapid and reliable generation of invariant natural killer T-cell lines in vitro. Immunology. 128 (3), 324-333 (2009).
- Crowe, N. Y., et al. Differential antitumor immunity mediated by NKT cell subsets in vivo. Journal of Experimental Medicine. 202 (9), 1279-1288 (2005).
- de Lalla, C., et al. Production of profibrotic cytokines by invariant NKT cells characterizes cirrhosis progression in chronic viral hepatitis. Journal of Immunology. 173 (2), 1417-1425 (2004).
- Tian, G., et al. CD62L+ NKT cells have prolonged persistence and antitumor activity in vivo. Journal of Clinical Investigation. 126 (6), 2341-2355 (2016).
- Gaya, M., et al. Initiation of Antiviral B Cell Immunity Relies on Innate Signals from Spatially Positioned NKT Cells. Cell. 172 (3), 517-533 (2018).
- Rotolo, A., et al. Enhanced Anti-lymphoma Activity of CAR19-iNKT Cells Underpinned by Dual CD19 and CD1d Targeting. Cancer Cell. 34 (4), 596-610 (2018).
- Schneidawind, D., et al. Third-party CD4+ invariant natural killer T cells protect from murine GVHD lethality. Blood. 125 (22), 3491-3500 (2015).
- Schneidawind, D., et al. CD4+ invariant natural killer T cells protect from murine GVHD lethality through expansion of donor CD4+CD25+FoxP3+ regulatory T cells. Blood. 124 (22), 3320-3328 (2014).
- Schneidawind, D., Pierini, A., Negrin, R. S. Regulatory T cells and natural killer T cells for modulation of GVHD following allogeneic hematopoietic cell transplantation. Blood. 122 (18), 3116-3121 (2013).
- Leveson-Gower, D. B., et al. Low doses of natural killer T cells provide protection from acute graft-versus-host disease via an IL-4-dependent mechanism. Blood. 117 (11), 3220-3229 (2011).
- Coman, T., et al. Human CD4- invariant NKT lymphocytes regulate graft versus host disease. Oncoimmunology. 7 (11), 1470735(2018).
- Xu, X., et al. NKT Cells Coexpressing a GD2-Specific Chimeric Antigen Receptor and IL15 Show Enhanced In vivo Persistence and Antitumor Activity against Neuroblastoma. Clinical Cancer Research. 25 (23), 7126-7138 (2019).
- Heczey, A., et al. Anti-GD2 CAR-NKT cells in patients with relapsed or refractory neuroblastoma: an interim analysis. Nature Medicine. 26 (11), 1686-1690 (2020).
- Exley, M. A., et al. Adoptive Transfer of Invariant NKT Cells as Immunotherapy for Advanced Melanoma: A Phase I Clinical Trial. Clinical Cancer Research. 23 (14), 3510-3519 (2017).
- Wolf, B. J., Choi, J. E., Exley, M. A. Novel Approaches to Exploiting Invariant NKT Cells in Cancer Immunotherapy. Frontiers in Immunology. 9, 384(2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ISSN 2689-3649
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.