Method Article
インビトロおよびインビボ研究のためのマウス不変性ナチュラルキラーT細胞の精製と拡大
要約
我々は、マウス脾臓から不変ナチュラルキラーT(iNKT)細胞を濃縮し、インビトロおよびインビボ研究に適した数にそれらを拡大するための迅速かつ堅牢なプロトコルを記述する。
要約
不変ナチュラルキラーT(iNKT)細胞は、非多形性MHCクラスI関連分子CD1dによって提示される自己または微生物脂質抗原に特異的な保存された半不変T細胞受容体(TCR)を発現する先天性Tリンパ球である。iNKT細胞は種全体を通して非常に保存されており、CD1d欠乏またはiNKT欠損マウスを含むマウスモデルによって調査が容易に行われ、半変量TCRに特異的なCD1d四量体またはmAbsを有するマウスおよび男性で明確に検出する可能性がある。しかし、iNKT細胞はまれであり、研究のために管理可能な数に達するように拡張する必要があります。インビトロでの一次マウスiNKT細胞株の生成が困難であることが証明されているため、iNKT細胞が30倍の頻度で頻繁に行われるiVα14-Jα18トランスジェニックマウス(iVα14Tg)から脾臓iNKT細胞を精製および拡張するための堅牢なプロトコルを設定しました。ここでは、一次脾臓iVα14Tg iNKT細胞は、免疫磁気分離プロセスを通じて濃縮され、約95〜98%の純粋なiNKT細胞を生み出すことができることを示しています。精製されたiNKT細胞は、抗CD3/CD28ビーズとIL-2およびIL-7によって刺激され、85〜99%の純度で培養の14日目までに30倍の膨張を生じる。拡大されたiNKT細胞は、簡単に遺伝的に操作することができ、インビトロで活性化および機能のメカニズムを解剖し、さらに重要なことに、生体内での導入転送時にも貴重なツールを提供する。
概要
不変ナチュラルキラーT細胞(iNKT細胞)は、半不変量αβT細胞受容体(TCR)を発現する先天性Tリンパ球であり、不変Vα14-Jα18鎖と多様なVβ鎖1の限定的なセットを組み合わせてマウスで形成される、MHCクラスI関連CD1d2によって提示される脂質抗原に特異的である。iNKT細胞は、いくつかの成熟段階3、4を経て起こる胸腺に既に活性化/先天性エフェクター表現型を獲得するアゴニスト選択プログラムを受け、CD4+およびCD4-サブセットを産生する。このプログラムを通じて、iNKT細胞は、それぞれT-ベット、GATA3、PLZF、およびRORγtの発現によって識別可能な、異なるTヘルパー(TH)エフェクター表現型、すなわちTH1(iNKT1)、TH2(iNKT2)およびTH17(iNKT17)を取得する。iNKT細胞は微生物脂質の範囲を認識するが、癌や自己免疫などの細胞ストレスや組織損傷の病的状況の状況においてアップレギュレートされる内因性脂質に対しても自己反応性である2。活性化すると、iNKT細胞は、直接接触およびサイトカイン産生2を介して他の先天性および適応免疫エフェクター細胞の機能を調節する。
iNKT細胞の研究は、CD1d欠損マウスやJα18欠損マウスを含むマウスモデル、および抗原搭載CD1d四量体の産生に加えて、ヒト半不変TCRに特異的なモノクローナル抗体(mAbs)の生成によって促進されている。しかし、一次マウスiNKT細胞株の生成は困難であることが判明した。iNKT細胞の抗腫瘍機能をより良く特徴付け、養子細胞療法に利用するために、iNKT細胞が野生型マウスの30倍の頻度でiNKT細胞を形成するiVα14-Jα18トランスジェニックマウス(iVα14Tg)6の脾臓iNKT細胞を精製・拡大するプロトコルを設定しました。
拡大したiNKT細胞は、インビトロアッセイに利用され、マウスに戻ると生体内で利用できます。この設定では、例えば、我々は、7の強力な抗腫瘍効果を示している。さらに、インビトロでのiNKT細胞は、インビボ8での注射前に遺伝子導入や編集を介した機能修飾に適しており、分子経路の洞察に富んだ機能解析を可能にし、高度な細胞療法への道を開きます。
プロトコル
ここで説明する手順は、サン・ラファエレ科学研究所の施設動物のケアと使用委員会(IACUC)(No. 1048)によって見直され、承認されました。
注:すべての手順は、無菌条件下で実行する必要があります。使用される試薬はすべて 、材料表にリストされています。
1. 脾臓処理
- iVα14-Jα18マウスを制度方針に従ってCO2 を吸入することにより安楽死させる。
注意:iVα14-Jα18マウスは8週齢以上でなければなりません。細胞のin vivo転移からの細胞の拒絶を避けるために、雌マウスから単離された細胞は男性と女性の両方のレシピエントで養子に移すことができるのに対し、雄マウスから単離された細胞は男性レシピエントでのみ移すことができると考えてください。インビトロ実験では、ジェンダーバイアスを考慮する必要はありません。より多くの細胞を得るためにより多くのマウスをプールすることができる。 - マウス脾臓を解剖し、70 nmの細胞ストレーナーを介してそれを粉砕し、2%のウシ胎児血清(FBS)を有するリン酸緩衝生理食塩水(PBS)の10mLで単細胞懸濁液を得る。
- 5分間300×gで遠心分離機。
- 反転によって上清を除去し、赤血球リシスバッファーで処理します。細胞ペレットを1 mLの無菌ACK(アンモニウム-塩化カリウム)ライシングバッファーで再懸濁し、室温で3分間インキュベートし、2%FBSで5mLのPBSでブロックします。5分間300×gで遠心分離機。
注: ACK は市販されています。それは0.15 M NH4Cl、10 mM KHCO3、および0.1 mMNa2EDTA(エチレンジアミントアセアセク酢酸)の溶液で構成され、変成されたH2O、pH 7.2-7.4に溶解した。自家製の場合は、0.22 μmフィルターで濾過して滅菌します。 - 上清を反転して取り除く。2%FBSで3mLのPBSで細胞ペレットを再懸濁し、ピペット処理により脂肪残渣を除去する。必要に応じて、異なるマウスから来る細胞をプールします。
- FACS分析のために細胞を数え、50 μLを保持します。
2. T細胞の濃縮
注:濃縮ステップのために、速く働き、細胞を冷たく保ち、一晩4°Cで予冷した溶液を使用し、氷の上に保つ
- 5分間300×gで遠心分離機。
- 2%FBS(107 セルの場合は500 μL)とFcブロッカー(2.5 μL x 107 セル)を使用して、適切な量のPBS内のすべてのセルを再中断します。室温(RT)で15分間インキュベートする。
- 107 細胞あたり1〜2mLのMACS分離バッファー(MB)、遠心分離機を300xgで10分間洗浄します。
メモ:MACSバッファは市販されています。それはPBS pH 7.2、0.5%のウシ血清アルブミン(BSA)、および2 mM EDTAから成っている。自家製の場合は、0.22 μmフィルターで濾過して滅菌します。 - 上清を反転して除去し、CD19-FITCとH2(IA b)-FITCで細胞を染色します(5 μL x 107細胞を100 μL MBで使用してください)。よく混ぜ、4-8 °Cで暗闇の中で15分間インキュベートします。
- 107 個の細胞あたり1〜2mLのMBを加え、遠心分離機を300xgで10分間洗浄します。
- 上清を完全に取り除き、合計107 個の細胞につき90μLのMBで細胞ペレットを再懸濁させる。107 細胞あたり10μLのアンチFITCマイクロビーズを加えます。よく混ぜ、4-8 °Cで暗闇の中で15分間インキュベートします。
- 107 個の細胞あたり1〜2mLのMBを、遠心分離機を300xgで10分間加えて洗浄します。
- 上清を完全に取り除き、500 μLのMBで最大1.25 x 108 セルを再懸濁します。
- MACSセパレータの磁場にLDカラムを配置して、枯渇に進みます。目詰まりを避けるには、LD 列に分離前フィルタを適用し、2 mL の MB でリンスします。
- カラムリザーバが空の場合は、セルサスペンションをフィルターに塗布します。列を通過するラベルのないセルを収集します。
- カラムリザーバーが空の場合のみ、1 mLのMBで3回洗浄してください。T細胞に富む総流出量を収集し、細胞を数えます。FACS 分析のために常に 50 μL を維持してください。
3. iNKT細胞の濃縮
- 5分間300×gで遠心分離機を使用し、反転により上清を除去します。
- CD1d-テトラマー-PE(マウスPBS57-CD1d-テトラマー)で細胞を染色し、106 細胞当たり50 μLのMBの抗体滴定に従う。よく混ぜ、氷の上の暗闇の中で30分間インキュベートします。
注:この手順は、APCラベルのmCD1dテトラマーとアンチAPCビーズでも実行できます。以下の染色に用いるフルオロクロムを適宜調整する。本プロトコルでは、NIHが提供するマウスPBS-57-CD1d-テトラマーを使用しました。αgalactosylセラミド(αGal-Cer)は、iNKT細胞によって認識される原型抗原である。PBS-57は、αGal-Cerの類似体であり、溶解度が改善された9;NIHテトラマー施設は、CD1dテトラマーに複合体化したPBS-57リガンドを提供します。しかし、他のCD1dダイマー/テトラマー/デキスタマーは市販されており、αGal-Cerとして脂質抗原を装填することができる。我々は、その使用のためのプロトコルを調整する可能性を想定しています。 - 107 個の細胞あたり1〜2mLのMBを、遠心分離機を300xgで10分間加えて洗浄します。
- 上清を完全に取り除き、合計107 個の細胞につき80μLのMBで細胞ペレットを再懸濁します。107 細胞あたり20μLのアンチPEマイクロビーズを加えます。よく混ぜ、4-8 °Cで暗闇の中で15分間インキュベートします。
- 107 個の細胞あたり1〜2mLのMBを加え、遠心分離機を300xgで10分間洗浄します。
- 上清を完全に取り除き、500 μLのMBで最大10個の8 個の細胞を再懸濁します。それ以外の場合は、セルが 108を超える場合は、それに応じて音量を調整します。
- セル数に応じて、MACS セパレータの磁場に LS (最大 108) または MS (最大 107)列を配置します。カラムをMB(LSの場合は3 mL、MSの場合は500 μL)でリンスします。
- セルのサスペンションを列に適用します。
- 通過するラベルのないセルを収集します。カラムリザーバが空の場合にのみ、適切な量のMB(LSカラムの場合は3 x 3 mL、MSカラムの場合は3 x 500 μL)を加えてカラムを3回洗浄します。総流出量は負の 分数です。
- 磁場からカラムを取り外し、新しい回収管に置きます。
- カラムにピペットMB(LSカラムの場合は5 mL、MSカラムの場合は1 mL)。提供されたプランジャーをカラムに押し込み、 正の分数 (iNKT細胞で富む)を洗い流します。
- iNKT細胞の回復をさらに高めるには、マイナスの分率を10分間300 x gで遠心し、新しいLSまたはMSカラムでステップ3.6-3.7を繰り返します。正の分数をプールし、セル数を決定します。FACS分析のために正と負の両方の分画の50 μLを保ちます。
- FACS 分析による精製ステップを確認してください。サンプルには、脾臓ex-vivo、T細胞濃縮画分、iNKT正分数およびiNKT負分数が含まれる。CD19-FITC、IAb-FITC、CD1d-テトラマーPE、TCRβ-APCおよびDAPIで細胞を染色する。
注意:iVα14-Jα18マウスからの期待される回復は2x106 iNKT細胞です。
4. iNKT細胞の活性化と拡張
- マウスTアクチベーター抗CD3/CD28磁気ビーズを1:1比で精製したiNKT細胞を活性化します。
- iNKT細胞正分を5分間300xgで遠心分離する。
- 一方、適切な量の抗CD3/CD28磁気ビーズをチューブに移し、等量のPBS、渦を5秒間追加します。チューブを磁石の上に1分間置き、上清を捨てます。
- マグネットからチューブを取り出し、洗浄した磁気ビーズを完全なRPMI(RPMI 1640培地、10%熱不活性化FCS、1mMナトリウムピルビン酸、1%非必須アミノ酸、10 U/mlペニシリンおよびストレプトマイシン、50μM βメルカプトエタノール)を5x50 m5Nkの細胞に適切な体積で再懸濁する。遠心分離されたiNKT陽性画分を再中断するには、この懸濁液を使用します。
- 細胞懸濁液のプレート1 mL(5 x 105 iNKT細胞)と抗CD3/CD28磁気ビーズを48ウェルプレートに20 U/mL IL-2とし、37°Cでインキュベートします。
- 5日後、10 ng/mL IL-7を追加します。
- 合流率が80~90%になったら細胞を1:2に分割し、常に20U/mL IL-2と10 ng/mL IL-7を追加します。これらの条件では、iNKT細胞は最大15日間拡張することができる。
結果
本稿に記載されたプロトコルは、図1Aに要約した免疫磁気分離プロセスを介してiVa14−Ja18トランスジェニックマウスの脾臓からiNKT細胞を濃縮することを可能にする。総脾臓T細胞は、まずB細胞および単球を枯渇させることによって負選択され、続いてiNKT細胞陽性免疫磁気選別がPBS-57脂質抗原を装填したCD1dテトラマーにより、iNKT細胞のみを特異的に染色することを可能にする。このプロトコルは、単一のiVa14-Ja18 Tgマウスの脾臓から95-98%の純粋なiNKT細胞の約2 x 106を生成します。負の分数では、iNKT細胞を検出できないか、実際に少ない(図1B)。
濃縮後、iVa14 iNKT細胞は、抗CD3/CD28ビーズにIL-2およびIL-7(図2A)を加えて拡張することができ、 図2Bに示すように、培養の日+14日までに平均30倍の膨張をもたらす。
図3Aは、iNKT細胞純度を、インビトロでの膨張およびCD4分子の発現と共に示す。TCRβ+CD1d-四量体+二重陽性細胞の割合の減少を観察した:抗CD3/CD28ビーズによる強い活性化は、細胞表面上のiNKT細胞TCR発現のダウンレギュレーションを誘導し、二重負母集団が現れる。拡大したiNKT細胞の大部分はCD4-.図3Bは、拡張後0日目および14日目の濃縮iNKT細胞に対するリネージ特異的転写因子PLZFおよびRORγtの発現の特徴を示す。この染色により、NKT1(PLZF低Rγt-)、NKT2(PLZF高Rγt-)、およびNKT17(PLZF int RORγt+)の型素体を同定することが可能となる。 主としてNKT1およびNKT2であり、富化されたiNKT細胞は、TH0様エフェクター表現型を示す。この表現型は、図3Cに示すPMA/イオノマイシン刺激後のIFN-γおよびIL-4の両方の分泌によって確認された14日後の拡張後に保存される。

図1: iNKT細胞の濃縮. A) 免疫磁気分離プロトコルの概略図B)各濃縮工程のフローサイトメトリー分析T細胞の周波数の割合は、生存可能なリンパ球にゲートされた上部プロットに示されています。各ステップに沿ったiNKT細胞周波数の割合は下のプロットに示されているが、実行可能なCD19-TCRβ+リンパ球にゲート付けされている。生き生き CD19- TCRβ+リンパ球にアンロードされた CD1d 四トラマーを使用して、iNKT細胞ゲートを正しく描画することができます。代表的な実験を1つ示す。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:iNKT細胞インビトロ拡張A)iNKT細胞の増殖に伴う細胞数3つの代表的かつ独立した実験が示されている。B)精製および活性化後7日目および14日目にiNKT細胞数の増加を折り返す。SD±示す意味です。この図の大きなバージョンを表示するには、ここをクリックしてください。
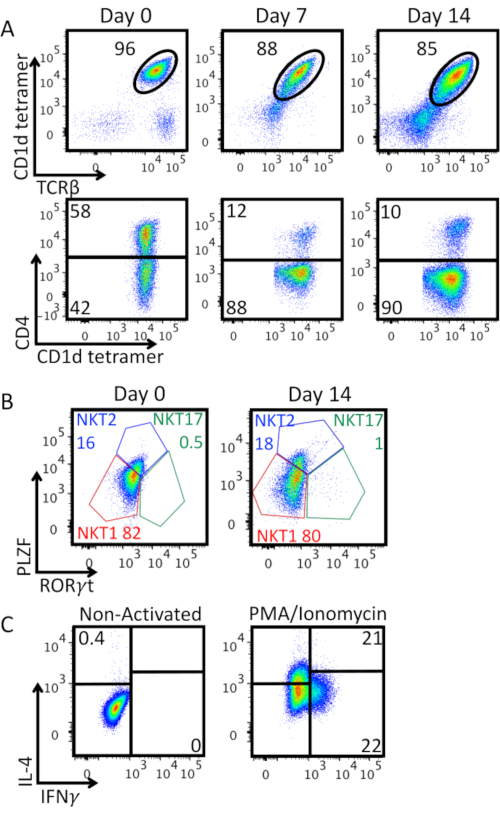
図3:iNKT細胞特性評価を拡張A) 膨張期に及ぶiNKT細胞の割合およびCD4発現のフローサイトメトリー分析。上のプロットは、生存可能なリンパ球にゲートされています。より低いプロットは、iNKT細胞(生き生きCD1d四トラマー +TCRβ+リンパ球)にゲートされています。B)iNKT細胞のエンリッチ化(0日目)および拡大(14日目)の表型特性プロットは、iNKT細胞(生き生きCD1d四トラマー+TCRβ+リンパ球)にゲートされています。細胞は、Foxp3転写因子染色バッファセットを用いて転写因子について核内染色した。NKT1(PLZF低RΓt-),NKT2(PLZF高RRγ-)、およびNKT17(PLZFint RORγ+)サブセットが同定され、各サブセットの周波数がパーセンテージで示される。C)14日目にiNKT細胞を拡張してサイトカイン産生を行う。プロットは、iNKT細胞(生き生きCD1d四トラマー+TCRβ+リンパ球)にゲートされています。細胞は、ブレフェルディンA 10 μg/mLの最後の2時間の存在下で、PMA 25 ng/mL/イオノマイシン1 μg/mLで4時間刺激された。次いで、細胞をPFA2%で固定し、パーマウォッシュで透過し、次に細胞内染色してサイトカイン産生を行った。ガッティング戦略は、非活性化コントロール、左パネルに設定されました。代表的な実験を1つ示す。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここでは、何百万ものすぐに使用できるiNKT細胞を得るための再現性と実現可能なプロトコルを示します。生体内ではこれらの細胞の貧弱性のために、それらを拡張する方法が非常に必要とされました。我々が提案するプロトコルは、特定の計装も多数のマウスも必要としない。iVα14-Jα18トランスジェニックマウスを意図的に利用し、処置に必要なマウスの数を減らした。
iVα14-Jα18トランスジェニックマウスからのiNKT細胞拡張のための別の成功したプロトコルは、文献10で入手可能である。このプロトコルは、iNKT細胞精製の6日前に、新鮮な骨髄由来樹状細胞の生成を含み、次いでαガラクトシルセラミドを装填し、照射し、IL-2およびIL-7を加えた。我々は、この手順に関与するマウスの数の減少を、プロトコルの大きな利点と考える。また、細胞培養の設定は1週間ではなく1日続くので、時間を節約できます。現在のプロトコルの再現性の可能な制限は、iVα14-Jα18トランスジェニックマウスの利用可能性があり、それは市販されている。これらのマウスが存在しない場合、大量のWTマウスを使用する可能性を想定していますが、WTマウスのiNKT細胞の貧弱性のためにプロトコルを設定する必要があります。
細胞培養中、拡大したiNKT細胞の純度と表現型を確認する。TCRβ+ CD1d-テトラマー+二重陽性細胞の割合の減少 (図 3A)は、活性化後の細胞表面からの不変NKT細胞TCRの自然なダウンレギュレーションによって説明することができる。また、拡大されたiNKT細胞の大部分はCD4を発現しなかった(図3A):これは、養子細胞療法の文脈において有利であり得るが、CD4−iNKT細胞は腫瘍進行11を制御するのに最も有効であることが判明した。また、観察されたTH型エフェクター(図3C)は、インビトロ拡張および再刺激後のヒトiNKT細胞において観察されたことと完全に一貫性がある8、12、13、14、15である。拡大された細胞は、生体内およびインビトロにおいて非常に反応性が高く、iNKT細胞ベースの養子免疫療法の文脈において有用である。操作されていないまたは拡張されたiNKT細胞の養子転写は、急性移植片対宿主病(aGVHD)を予防または改善し、移植片対白血病効果16、17、18、19を放置する。αGal-Cerを用いてインビトロで拡大した養子的に移されたヒトiNKT細胞は異種aGVHDを緩和し、この効果はCD4によって媒介されるがCD4+細胞20ではない。また、iNKT細胞がaGVHDを引き起こさないことを考えると、それらはTCRの欠失を必要とせずCAR免疫療法にとって理想的な細胞を構成し、生体内8,15において抗腫瘍活性を長期化したことが証明された。iNKT細胞は現在、臨床試験21、22、23、24で利用されています。
結論として、記述されたプロトコルは高速で簡単であり、マウス脾臓から回収されるiNKT細胞の数を30倍に増加させる(図3B)。これらの細胞は、前臨床試験でのインビトロ認識アッセイ、共培養システム、または養子細胞療法のために容易に利用することができる。iNKT細胞は確かに、腫瘍免疫監視、感染症および自己免疫において重要な役割を果たす。これらの文脈において、iNKT細胞は、MHC制限を欠いた従来のT細胞に代わる魅力的な代替手段である強力なツールを表すことができる。大量のこれらの細胞の急速な生成と、さらにvitroでそれらを操作する可能性は、前例のない治療戦略の開発につながることができます。
開示事項
著者らは開示するものは何もない。
謝辞
パオロ・デラボーナとジュリア・カソラティの科学的支援と原稿の批判的な読書に感謝します。また、マウスCD1dテトラマー用のNIHテトラマーコアファシリティに感謝します。この研究は、フォンダツィオーネ・カリプロ・グラント2018-0366(M.F.)とイタリアがん研究協会(AIRC)フェローシップ2019-22604(G.D.)によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| Ammonium-Chloride-Potassium (ACK) solution | in house | 0.15M NH4Cl, 10mM KHCO3, 0.1mM EDTA, pH 7.2-7.4 | |
| anti-FITC Microbeads | Miltenyi Biotec | 130-048-701 | |
| anti-PE Microbeads | Miltenyi Biotec | 130-048-801 | |
| Brefeldin A | Sigma | B6542 | |
| CD19 -FITC | Biolegend | 115506 | clone 6D5 |
| CD1d-tetramer -PE | NIH tetramer core facility | mouse PBS57-Cd1d-tetramers | |
| CD4 -PeCy7 | Biolegend | 100528 | clone RM4-5 |
| Fc blocker | BD Bioscience | 553142 | |
| Fetal Bovine Serum (FBS) | Euroclone | ECS0186L | heat-inactivated and filtered .22 before use |
| FOXP3 Transcription factor staining buffer | eBioscience | 00-5523-00 | |
| H2 (IAb) -FITC | Biolegend | 114406 | clone AF6-120.1 |
| hrIL-2 | Chiron Corp | ||
| Ionomycin | Sigma | I0634 | |
| LD Columns | Miltenyi Biotec | 130-042-901 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | |
| MACS buffer (MB) | in house | 0.5% Bovine Serum Albumin (BSA; Sigma-Aldrich) and 2Mm EDTA | |
| MS Columns | Miltenyi Biotec | 130-042-201 | |
| Non-essential amino acids | Gibco | 11140-035 | |
| Penicillin and streptomycin (Pen-Strep) | Lonza | 15140-122 | |
| PermWash | BD Bioscience | 51-2091KZ | |
| PFA | Sigma | P6148 | |
| Phosphate buffered saline (PBS) | EuroClone | ECB4004L | |
| PMA | Sigma | P1585 | |
| Pre-Separation Filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| Recombinat Mouse IL-7 | R&D System | 407-ML-025 | |
| RPMI 1640 with glutamax | Gibco | 61870-010 | |
| sodium pyruvate | Gibco | 11360-039 | |
| TCRβ -APC | Biolegend | 109212 | clone H57-597 |
| αCD3CD28 mouse T activator Dynabeads | Gibco | 11452D | |
| β-mercaptoethanol | Gibco | 31350010 |
参考文献
- Bendelac, A., Savage, P. B., Teyton, L. The biology of NKT cells. Annual Review of Immunology. 25, 297-336 (2007).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews: Immunology. 13 (2), 101-117 (2013).
- Pellicci, D. G., et al. A natural killer T (NKT) cell developmental pathway iInvolving a thymus-dependent NK1.1(-)CD4(+) CD1d-dependent precursor stage. Journal of Experimental Medicine. 195 (7), 835-844 (2002).
- Benlagha, K., Kyin, T., Beavis, A., Teyton, L., Bendelac, A. A thymic precursor to the NK T cell lineage. Science. 296 (5567), 553-555 (2002).
- Lee, Y. J., Holzapfel, K. L., Zhu, J., Jameson, S. C., Hogquist, K. A. Steady-state production of IL-4 modulates immunity in mouse strains and is determined by lineage diversity of iNKT cells. Nature Immunology. 14 (11), 1146-1154 (2013).
- Griewank, K., et al. Homotypic interactions mediated by Slamf1 and Slamf6 receptors control NKT cell lineage development. Immunity. 27 (5), 751-762 (2007).
- Cortesi, F., et al. Bimodal CD40/Fas-Dependent Crosstalk between iNKT Cells and Tumor-Associated Macrophages Impairs Prostate Cancer Progression. Cell Reports. 22 (11), 3006-3020 (2018).
- Heczey, A., et al. Invariant NKT cells with chimeric antigen receptor provide a novel platform for safe and effective cancer immunotherapy. Blood. 124 (18), 2824-2833 (2014).
- Liu, Y., et al. A modified alpha-galactosyl ceramide for staining and stimulating natural killer T cells. Journal of Immunological Methods. 312 (1-2), 34-39 (2006).
- Chiba, A., et al. Rapid and reliable generation of invariant natural killer T-cell lines in vitro. Immunology. 128 (3), 324-333 (2009).
- Crowe, N. Y., et al. Differential antitumor immunity mediated by NKT cell subsets in vivo. Journal of Experimental Medicine. 202 (9), 1279-1288 (2005).
- de Lalla, C., et al. Production of profibrotic cytokines by invariant NKT cells characterizes cirrhosis progression in chronic viral hepatitis. Journal of Immunology. 173 (2), 1417-1425 (2004).
- Tian, G., et al. CD62L+ NKT cells have prolonged persistence and antitumor activity in vivo. Journal of Clinical Investigation. 126 (6), 2341-2355 (2016).
- Gaya, M., et al. Initiation of Antiviral B Cell Immunity Relies on Innate Signals from Spatially Positioned NKT Cells. Cell. 172 (3), 517-533 (2018).
- Rotolo, A., et al. Enhanced Anti-lymphoma Activity of CAR19-iNKT Cells Underpinned by Dual CD19 and CD1d Targeting. Cancer Cell. 34 (4), 596-610 (2018).
- Schneidawind, D., et al. Third-party CD4+ invariant natural killer T cells protect from murine GVHD lethality. Blood. 125 (22), 3491-3500 (2015).
- Schneidawind, D., et al. CD4+ invariant natural killer T cells protect from murine GVHD lethality through expansion of donor CD4+CD25+FoxP3+ regulatory T cells. Blood. 124 (22), 3320-3328 (2014).
- Schneidawind, D., Pierini, A., Negrin, R. S. Regulatory T cells and natural killer T cells for modulation of GVHD following allogeneic hematopoietic cell transplantation. Blood. 122 (18), 3116-3121 (2013).
- Leveson-Gower, D. B., et al. Low doses of natural killer T cells provide protection from acute graft-versus-host disease via an IL-4-dependent mechanism. Blood. 117 (11), 3220-3229 (2011).
- Coman, T., et al. Human CD4- invariant NKT lymphocytes regulate graft versus host disease. Oncoimmunology. 7 (11), 1470735 (2018).
- Xu, X., et al. NKT Cells Coexpressing a GD2-Specific Chimeric Antigen Receptor and IL15 Show Enhanced In vivo Persistence and Antitumor Activity against Neuroblastoma. Clinical Cancer Research. 25 (23), 7126-7138 (2019).
- Heczey, A., et al. Anti-GD2 CAR-NKT cells in patients with relapsed or refractory neuroblastoma: an interim analysis. Nature Medicine. 26 (11), 1686-1690 (2020).
- Exley, M. A., et al. Adoptive Transfer of Invariant NKT Cells as Immunotherapy for Advanced Melanoma: A Phase I Clinical Trial. Clinical Cancer Research. 23 (14), 3510-3519 (2017).
- Wolf, B. J., Choi, J. E., Exley, M. A. Novel Approaches to Exploiting Invariant NKT Cells in Cancer Immunotherapy. Frontiers in Immunology. 9, 384 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
ISSN 2689-3649
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。