Method Article
Purificación y expansión de células T asesinas naturales invariantes de ratón para estudios in vitro e in vivo
En este artículo
Resumen
Describimos un protocolo rápido y robusto para enriquecer células T asesinas naturales invariantes (iNKT) del bazo de ratón y expandirlas in vitro a números adecuados para estudios in vitro e in vivo.
Resumen
Las células T asesinas naturales invariantes (iNKT) son linfocitos T innatos que expresan un receptor de células T semiinvariante (TCR) conservado específico para antígenos lipídicos propios o microbianos presentados por la molécula no polimórfica MHC de clase I CD1d. Los estudios preclínicos y clínicos respaldan un papel de las células iNKT en el cáncer, la autoinmunidad y las enfermedades infecciosas. Las células iNKT están muy conservadas en todas las especies y su investigación ha sido facilitada por modelos de ratón, incluidos ratones deficientes en CD1d o deficientes en iNKT, y la posibilidad de detectarlas inequívocamente en ratones y hombres con tetrámeros CD1d o mAbs específicos para el TCR semiinvariante. Sin embargo, las células iNKT son raras y necesitan ser expandidas para alcanzar números manejables para cualquier estudio. Debido a que la generación de la línea celular iNKT primaria de ratón in vitro ha demostrado ser difícil, hemos establecido un protocolo robusto para purificar y expandir las células iNKT esplénicas de los ratones transgénicos iVα14-Jα18 (iVα14Tg), en los que las células iNKT son 30 veces más frecuentes. Mostramos aquí que las células iVα14Tg iNKT esplénicas primarias se pueden enriquecer a través de un proceso de separación inmunomagnética, produciendo aproximadamente un 95-98% de células iNKT puras. Las células iNKT purificadas son estimuladas por perlas anti-CD3/CD28 más IL-2 e IL-7, lo que resulta en una expansión de 30 veces por día +14 del cultivo con una pureza del 85-99%. Las células iNKT expandidas se pueden manipular genéticamente fácilmente, proporcionando una herramienta invaluable para diseccionar los mecanismos de activación y función in vitro y, lo que es más importante, también en la transferencia adoptiva in vivo.
Introducción
Las células T asesinas naturales invariantes (células iNKT) son linfocitos T innatos que expresan un receptor de células T αβ (TCR) semiinvariante, formado en ratones por una cadena invariante Vα14-Jα18 emparejada con un conjunto limitado de diversas cadenas Vβ1,que es específico para los antígenos lipídicos presentados por la molécula relacionada con MHC clase I CD1d2. Las células iNKT se someten a un programa de selección de agonistas que resulta en la adquisición de un fenotipo efector activado/innato ya en el timo, que se produce a través de varias etapas de maduración3,4,produciendo unsubconjunto CD4+ y un subconjunto CD4.. A través de este programa, las células iNKT adquieren fenotipos efectores T auxiliares (TH),a saber, TH1 (iNKT1), TH2 (iNKT2) y TH17 (iNKT17), identificables por la expresión de los factores de transcripción T-bet, GATA3, PLZF y RORγt, respectivamente5. Las células iNKT reconocen una gama de lípidos microbianos, pero también son autorreactivas contra los lípidos endógenos que están regulados al alza en el contexto de situaciones patológicas de estrés celular y daño tisular, como el cáncer y la autoinmunidad2. Tras la activación, las células iNKT modulan las funciones de otras células efectoras inmunes innatas y adaptativas a través del contacto directo y la producción de citoquinas2.
Las investigaciones de las células iNKT han sido facilitadas por modelos de ratón, incluidos ratones deficientes en CD1d o deficientes en Jα18, y por la producción de tetrámeros CD1d cargados de antígenos más la generación de anticuerpos monoclonales (mAbs) específicos para el TCR semiinvariante humano. Sin embargo, la generación de la línea celular iNKT primaria de ratón ha resultado difícil. Para caracterizar mejor las funciones antitumorales de las células iNKT y utilizarlas para la terapia celular adoptiva, establecimos un protocolo para purificar y expandir las células iNKT esplénicas de ratones transgénicos iVα14-Jα18 (iVα14Tg)6, en el que las células iNKT son 30 veces más frecuentes que en ratones de tipo salvaje.
Las células iNKT expandidas pueden ser explotadas para ensayos in vitro, e in vivo al transferirse de nuevo a ratones. En este contexto, por ejemplo, hemos demostrado sus potentes efectos antitumorales7. Además, las células iNKT expandidas in vitro son susceptibles de modificación funcional a través de la transferencia o edición de genes antes de su inyección in vivo8,lo que permite un análisis funcional perspicaz de las vías moleculares, así como allanar el camino para terapias celulares avanzadas.
Protocolo
Los procedimientos aquí descritos fueron revisados y aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) (no. 1048) en el Instituto Científico San Raffaele.
NOTA: Todos los procedimientos deben realizarse en condiciones estériles. Todos los reactivos utilizados se enumeran en la Tabla de Materiales.
1. Procesamiento del bazo
- Eutanasiar ratones iVα14-Jα18 por inhalación de CO2 según la política institucional.
NOTA: Los ratones iVα14-Jα18 deben tener 8 semanas de edad o más. Para evitar el rechazo de las células por la transferencia in vivo de las células, considere que las células aisladas de ratones hembra pueden transferirse adoptivamente tanto en receptores machos como hembras, mientras que las células aisladas de ratones machos pueden transferirse solo en receptores machos. Para los experimentos in vitro, no se debe considerar ningún sesgo de género. Se pueden agrupar más ratones para obtener más células. - Diseccionar el bazo del ratón y aplastarlo a través de un colador celular de 70 nm para obtener una suspensión unicelular en 10 ml de solución salina tamponada con fosfato (PBS) con suero bovino fetal (FBS) al 2%.
- Centrifugadora a 300 x g durante 5 min.
- Retire el sobrenadante por inversión y procese con tampón de lisis eritrocitaria. Resuspender el pellet celular con 1 mL de tampón de lisado ACK (cloruro de amonio-potasio) estéril, incubar durante 3 min a temperatura ambiente y bloquear con 5 ml de PBS con 2% de FBS. Centrifugadora a 300 x g durante 5 min.
NOTA: ACK está disponible comercialmente; consiste en una solución de 0,15 M NH4Cl, 10 mM KHCO3y 0,1 mM Na2EDTA (ácido etilendiaminotetraacético) disuelto en bidistilled H2O, pH 7.2-7.4. Si es casero, esterilice por filtración con un filtro de 0,22 μm. - Retire el sobrenadante por inversión. Resuspend el pellet celular en 3 mL de PBS con 2% de FBS y eliminar los residuos de grasa mediante pipeteo. Si es necesario, agrupe las células provenientes de diferentes ratones.
- Cuente las células y mantenga 50 μL para el análisis FACS.
2. Enriquecimiento de células T
NOTA: Para los pasos de enriquecimiento, trabaje rápido, mantenga las celdas frías y use soluciones preenfriadas a 4 ° C durante la noche y luego mantenidas en hielo
- Centrifugadora a 300 x g durante 5 min.
- Resuspendir todas las células en la cantidad adecuada de PBS con 2% de FBS (500 μL para 107 células) y bloqueador de Fc (2.5 μL x 107 células); incubar durante 15 min a temperatura ambiente (RT).
- Lavar con 1-2 ml de tampón de separación MACS (MB) por 107 celdas totales y centrifugar a 300 x g durante 10 min.
NOTA: El búfer MACS está disponible comercialmente. Consiste en PBS pH 7.2, 0.5% de albúmina sérica bovina (BSA) y 2 mM de EDTA. Si es casero, esterilice por filtración con un filtro de 0,22 μm. - Retire el sobrenadante por inversión y manche las célulascon CD19-FITC y H2(IA b)-FITC (use 5 μL x 107 células en 100 μL de MB). Mezclar bien e incubar durante 15 min en la oscuridad a 4-8 °C.
- Lavar las células añadiendo 1−2 mL de MB por 107 células y centrifugar a 300 x g durante 10 min.
- Pipetee completamente el sobrenadante y resuspenda el pellet celular en 90 μL de MB por 107 células totales. Añadir 10 μL de Microbeads Anti-FITC por cada 107 células totales. Mezclar bien e incubar durante 15 min en la oscuridad a 4-8 °C.
- Lave las células agregando 1−2 ml de MB por 107 células y centrífuga a 300 x g durante 10 min.
- Pipetee el sobrenadante por completo y resuspenda hasta 1.25 x 108 celdas en 500 μL de MB.
- Coloque una columna LD en el campo magnético del separador MACS para proceder al agotamiento. Para evitar obstrucciones, aplique un filtro de preseparación en la columna LD y enjuague con 2 ml de MB.
- Cuando el depósito de la columna esté vacío, aplique la suspensión de celda sobre el filtro. Recopile las celdas sin etiquetar que pasan a través de la columna.
- Lavar 3 veces con 1 ml de MB, solo cuando el depósito de columna esté vacío. Recoger el efluente total, que se enriquecerá en células T, y contar las células. Mantenga siempre 50 μL para el análisis FACS.
3. Enriquecimiento celular iNKT
- Centrifugar a 300 x g durante 5 min y retirar el sobrenadante por inversión.
- Teñir las células con CD1d-tetrámero-PE (ratón PBS57-CD1d-tetrámero), según la titulación de anticuerpos en 50 μL de MB por 106 células. Mezclar bien e incubar durante 30 min en la oscuridad sobre hielo.
NOTA: El procedimiento también se puede realizar con tetrámeros mCD1d marcados con APC y perlas anti-APC; ajustando los fluorocromos utilizados en la siguiente tinción en consecuencia. En el presente protocolo se utilizaron tetrámeros PBS-57-CD1d-ratón proporcionados por los NIH. La αgalactosilceramida (αGal-Cer) es el antígeno prototípico reconocido por las células iNKT; PBS-57 es un análogo de αGal-Cer con solubilidad mejorada9; la instalación de tetrámeros de los NIH proporciona ligando PBS-57 complejado a tetrámeros CD1d. Sin embargo, otros dímeros/tetrámeros/dextramers CD1d están disponibles comercialmente y pueden cargarse con un antígeno lipídico como αGal-Cer. Prevemos la posibilidad de ajustar el protocolo para su uso. - Lave las células agregando 1−2 ml de MB por 107 células y centrífuga a 300 x g durante 10 min.
- Pipetear el sobrenadante por completo y resuspendir el pellet celular en 80 μL de MB por 107 células totales. Añadir 20 μL de Microbeads Anti-PE por cada 107 células totales. Mezclar bien e incubar durante 15 min en la oscuridad a 4-8 °C.
- Lavar las células añadiendo 1−2 mL de MB por 107 células y centrifugar a 300 x g durante 10 min.
- Pipetee el sobrenadante por completo y resuspenda hasta 108 células en 500 μL de MB. De lo contrario, si las celdas exceden10 8, ajuste el volumen en consecuencia.
- De acuerdo con el recuento de células, coloque una columna LS (hasta10 8) o MS (hasta 107) en el campo magnético del separador MACS. Enjuague la columna con MB (3 ml para LS, 500 μL para MS).
- Aplique la suspensión de celdas sobre la columna.
- Recoger las células no etiquetadas que pasan a través. Lave la columna 3 veces agregando la cantidad adecuada de MB (3 x 3 ml para la columna LS, 3 x 500 μL para la columna MS) solo cuando el depósito de columna esté vacío. El efluente total es la fracción negativa.
- Retire la columna del campo magnético y colóquela en un nuevo tubo de recolección.
- Pipetear MB en la columna (5 ml para la columna LS o 1 ml para la columna MS); empuje el émbolo proporcionado en la columna y elimine la fracción positiva (enriquecida en celdas iNKT).
- Para aumentar aún más la recuperación de células iNKT, centrífuga la fracción negativa a 300 x g durante 10 min y repita los pasos 3.6-3.7 con una nueva columna LS o MS. Agrupe las fracciones positivas y determine el recuento de células. Mantenga 50 μL de fracciones positivas y negativas para el análisis FACS.
- Verifique los pasos de purificación mediante el análisis FACS. Las muestras incluyen: bazo ex-vivo, fracción enriquecida con células T, fracción positiva iNKT y fracción negativa iNKT. Teñir las células con: CD19-FITC, IAb-FITC, CD1d-tetramer-PE, TCRβ-APC y DAPI.
NOTA: La recuperación esperada de un ratón iVα14-Jα18 es de 2x106 celdas iNKT.
4. Activación y expansión de la célula iNKT
- Active las células iNKT purificadas con perlas magnéticas anti-CD3/CD28 activadoras T de ratón en una proporción de 1:1.
- Centrifugar la fracción positiva de la célula iNKT a 300 x g durante 5 min.
- Mientras tanto, transfiera el volumen apropiado de perlas magnéticas anti-CD3 / CD28 a un tubo y agregue un volumen igual de PBS, vórtice durante 5 segundos. Coloque el tubo sobre un imán durante 1 minuto y deseche el sobrenadante.
- Retire el tubo del imán y vuelva a suspender las perlas magnéticas lavadas en el volumen adecuado de RPMI completo (medio RPMI 1640, FCS inactivado por calor al 10%, piruvato de sodio 1 mM, aminoácidos no esenciales al 1%, 10 U / ml de penicilina y estreptomicina, 50 μM β-mercaptoetanol) para tener 5 x 105 células iNKT en 1 ml. Utilice esta suspensión para resuspendir la fracción positiva iNKT centrifugada.
- Placa 1 mL de la suspensión celular (5 x 105 células iNKT) y perlas magnéticas anti-CD3/CD28 en una placa de 48 pocillos con 20 U/mL IL-2 e incubar a 37 °C.
- Después de 5 días, agregue 10 ng / ml de IL-7.
- Divida las células 1:2 cuando alcancen el 80-90% de confluencia, siempre agregue 20U/mL IL-2 y 10 ng/mL IL-7. En estas condiciones, las células iNKT se pueden expandir hasta por 15 días.
Resultados
El protocolo descrito en este manuscrito permite enriquecer células iNKT del bazo de ratones transgénicos iVa14-Ja18 a través de un proceso de separación inmunomagnética resumido en la Figura 1A. Las células T del bazo total se seleccionan primero negativamente agotando las células B y los monocitos, seguidas de la clasificación inmunomagnética positiva de las células iNKT con tetrámeros CD1d cargados con antígeno lipídico PBS-57, que permiten teñir específicamente solo las células iNKT. Este protocolo produce aproximadamente 2 x 106 de 95-98% de células iNKT puras del bazo de un solo ratón iVa14-Ja18 Tg. No se pueden detectar células iNKT o realmente pocas en la fracción negativa(Figura 1B).
Después del enriquecimiento, las células iVa14 iNKT se pueden expandir con perlas anti-CD3/CD28 más IL-2 e IL-7(Figura 2A),lo que resulta en una expansión de 30 veces en promedio por día +14 del cultivo como se muestra en la Figura 2B.
La Figura 3A muestra la pureza de la célula iNKT junto con la expansión in vitro y la expresión de la molécula CD4. Observamos una disminución en el porcentaje de TCRβ+ CD1d-tetrámero+ células doblemente positivas: la fuerte activación con perlas anti-CD3/CD28 está induciendo la regulación a la baja de la expresión de TCR de células iNKT en la superficie celular, y está apareciendo una población doble negativa. La mayoría de las células iNKT expandidas eran CD4-. La Figura 3B muestra una caracterización de la expresión de los factores de transcripción específicos del linaje PLZF y RORγt en células iNKT enriquecidas en el día 0 y 14 días después de la expansión. Esta tinción permite identificar los fenotipos NKT1 (PLZFlow RORγt-), NKT2 (PLZFhigh RORγt-), y NKT17 (PLZFint RORγt+). Siendo en su mayoría NKT1 y NKT2, las células iNKT enriquecidas muestran un fenotipo efector similar a TH0. Este fenotipo se conserva después de 14 días de expansión como lo confirma la secreción de IFN-γ e IL-4 después de la estimulación de PMA/Ionomicina que se muestra en la Figura 3C.

Figura 1: Enriquecimiento celular iNKT. A) Representación esquemática del protocolo de separación inmunomagnética. B)Análisis de citometría de flujo de cada paso de enriquecimiento. El porcentaje de frecuencias de células T se muestra en las parcelas superiores, cerradas en linfocitos viables. Mientras que el porcentaje de frecuencias celulares iNKT a lo largo de cada paso se muestran en las parcelas inferiores, cerradas en linfocitos CD19- TCRβ+ viables. La tinción en linfocitos CD19- TCRβ+ viables con tetrámero CD1d descargado permite dibujar correctamente la puerta celular iNKT. Se muestra un experimento representativo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Expansión in vitro de la célula iNKT. A ) Lacélula iNKT cuenta a lo largo de la expansión de la célula iNKT. Se muestran tres experimentos representativos e independientes. B)Aumento del pliegue en el número de células iNKT en los días 7 y 14 después de la purificación y activación. Se muestran los medios ± SD. Haga clic aquí para ver una versión más grande de esta figura.
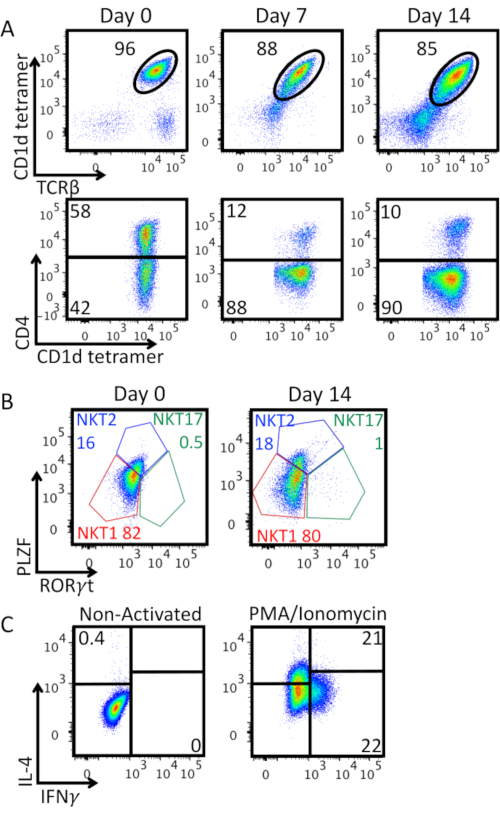
Figura 3: Caracterización ampliada de células iNKT. A) Análisis de citometría de flujo del porcentaje de células iNKT y la expresión de CD4 a lo largo del período de expansión. Las parcelas superiores están cerradas en linfocitos viables. Las parcelas inferiores están cerradas en las células iNKT (cdtrámero CD1dviable + TCRβ+ linfocitos). B)Caracterización fenotípica de células iNKT enriquecidas (día 0) y expandidas (día 14). Las parcelas están cerradas en células iNKT (cdtrámero CD1dviable + TCRβ+ linfocitos). Las células se tiñeron intranuclearmente para detectar factores de transcripción con el Foxp3 Transcription Factor Staining Buffer Set. Se identificaron los subconjuntos NKT1 (PLZFlow RORγt-), NKT2 (PLZFhigh RORγt-), y NKT17 (PLZFint RORγt+),las frecuencias de cada subconjunto se muestran en porcentaje. C)Producción de citoquinas por células iNKT expandidas en el día 14. Las parcelas están cerradas en células iNKT (cdtrámero CD1dviable + TCRβ+ linfocitos). Las células fueron estimuladas durante 4 horas con PMA 25 ng/mL/Ionomicina 1 μg/mL, en presencia durante las últimas 2 horas de Brefeldina A 10 μg/mL. Las células se fijaron con PFA 2%, se permeabilizaron con Permwash y luego se tiñeron intracelularmente para la producción de citoquinas. La estrategia de gating se estableció en el panel izquierdo de control no activado. Se muestra un experimento representativo. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí mostramos un protocolo reproducible y factible para obtener millones de células iNKT listas para usar. Debido a la escasez de estas células in vivo, era muy necesario un método para expandirlas. El protocolo que proponemos no requiere ni una instrumentación particular ni un alto número de ratones. Explotamos ratones transgénicos iVα14-Jα18 a propósito para reducir el número de ratones necesarios para el procedimiento.
Otro protocolo exitoso para la expansión de células iNKT de ratones transgénicos iVα14-Jα18 está disponible en la literatura10. Este protocolo implica la generación, 6 días antes de la purificación de células iNKT, de células dendríticas frescas derivadas de la médula ósea, luego cargadas con α-galactosilceramida e irradiadas, más IL-2 e IL-7. Consideramos que la reducción del número de ratones involucrados en el procedimiento es una gran ventaja del protocolo. También ahorra tiempo, ya que la instalación del cultivo celular dura un solo día en lugar de una semana. Una posible limitación de la reproducibilidad del protocolo actual podría ser la disponibilidad de ratones transgénicos iVα14-Jα18, que sin embargo están disponibles comercialmente. En ausencia de estos ratones, prevemos la posibilidad de utilizar un gran número de ratones WT, pero el protocolo debe configurarse en consecuencia debido a la escasez de células iNKT en ratones WT.
Durante el cultivo celular, solemos comprobar la pureza y el fenotipo de las células iNKT expandidas. La disminución en el porcentaje de TCRβ+ CD1d-tetrámero+ células doblemente positivas (Figura 3A) puede explicarse por una regulación descendente natural del TCR invariante de la célula NKT de la superficie celular después de la activación. Además, la mayoría de las células iNKT expandidas no expresaban CD4(Figura 3A):esto puede representar una ventaja en el contexto de una terapia celular adoptiva, ya que se encontró que las células CD4- iNKT eran las más efectivas para controlar la progresión tumoral11. Además, el fenotipo efector TH0-like observado(Figura 3C)es totalmente coherente con el observado en células iNKT humanas después de la expansión y reestimulación in vitro8,12,13,14,15. Las células expandidas son altamente reactivas in vivo e in vitro, por lo que son útiles en contextos de inmunoterapias adoptivas basadas en células iNKT. La transferencia adoptiva de células iNKT no manipuladas o expandidas previene o mejora la enfermedad aguda de injerto contra huésped (aGVHD) dejando inalterado el efecto de injerto contra leucemia16,17,18,19. Las células iNKT humanas transferidas adoptivamente expandidas in vitro con αGal-Cer alivian la aGVHD xenogénica y este efecto está mediado por cd4- pero no cd4+ células20. Además, dado que las células iNKT no causan aGVHD, constituyen las células ideales para la inmunoterapia CAR sin necesidad de deleción de su TCR y han demostrado tener una actividad antitumoral prolongada in vivo8,15. Las células iNKT se explotan actualmente en ensayos clínicos en curso y concluidos21,22,23,24.
En conclusión, el protocolo descrito es rápido, sencillo y permite un aumento de 30 veces en el número de células iNKT recuperadas de un bazo de ratón(Figura 3B). Estas células se pueden explotar fácilmente para ensayos de reconocimiento in vitro, sistemas de cocultivo o terapia celular adoptiva en estudios preclínicos. De hecho, las células iNKT desempeñan un papel crítico en la vigilancia inmune tumoral, las enfermedades infecciosas y la autoinmunidad. En estos contextos, las células iNKT pueden representar una herramienta poderosa, siendo una alternativa atractiva a las células T convencionales desprovistas de la restricción MHC. La rápida generación de grandes cantidades de estas células y la posibilidad de manipularlas aún más in vitro puede conducir al desarrollo de estrategias terapéuticas sin precedentes.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Paolo Dellabona y Giulia Casorati por el apoyo científico y la lectura crítica del manuscrito. También agradecemos al NIH Tetramer Core Facility por el tetrámero CD1d de ratón. El estudio fue financiado por la Fondazione Cariplo Grant 2018-0366 (a M.F.) y la beca de la Asociación Italiana para la Investigación del Cáncer (AIRC) 2019-22604 (a G.D.).
Materiales
| Name | Company | Catalog Number | Comments |
| Ammonium-Chloride-Potassium (ACK) solution | in house | 0.15M NH4Cl, 10mM KHCO3, 0.1mM EDTA, pH 7.2-7.4 | |
| anti-FITC Microbeads | Miltenyi Biotec | 130-048-701 | |
| anti-PE Microbeads | Miltenyi Biotec | 130-048-801 | |
| Brefeldin A | Sigma | B6542 | |
| CD19 -FITC | Biolegend | 115506 | clone 6D5 |
| CD1d-tetramer -PE | NIH tetramer core facility | mouse PBS57-Cd1d-tetramers | |
| CD4 -PeCy7 | Biolegend | 100528 | clone RM4-5 |
| Fc blocker | BD Bioscience | 553142 | |
| Fetal Bovine Serum (FBS) | Euroclone | ECS0186L | heat-inactivated and filtered .22 before use |
| FOXP3 Transcription factor staining buffer | eBioscience | 00-5523-00 | |
| H2 (IAb) -FITC | Biolegend | 114406 | clone AF6-120.1 |
| hrIL-2 | Chiron Corp | ||
| Ionomycin | Sigma | I0634 | |
| LD Columns | Miltenyi Biotec | 130-042-901 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | |
| MACS buffer (MB) | in house | 0.5% Bovine Serum Albumin (BSA; Sigma-Aldrich) and 2Mm EDTA | |
| MS Columns | Miltenyi Biotec | 130-042-201 | |
| Non-essential amino acids | Gibco | 11140-035 | |
| Penicillin and streptomycin (Pen-Strep) | Lonza | 15140-122 | |
| PermWash | BD Bioscience | 51-2091KZ | |
| PFA | Sigma | P6148 | |
| Phosphate buffered saline (PBS) | EuroClone | ECB4004L | |
| PMA | Sigma | P1585 | |
| Pre-Separation Filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| Recombinat Mouse IL-7 | R&D System | 407-ML-025 | |
| RPMI 1640 with glutamax | Gibco | 61870-010 | |
| sodium pyruvate | Gibco | 11360-039 | |
| TCRβ -APC | Biolegend | 109212 | clone H57-597 |
| αCD3CD28 mouse T activator Dynabeads | Gibco | 11452D | |
| β-mercaptoethanol | Gibco | 31350010 |
Referencias
- Bendelac, A., Savage, P. B., Teyton, L. The biology of NKT cells. Annual Review of Immunology. 25, 297-336 (2007).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews: Immunology. 13 (2), 101-117 (2013).
- Pellicci, D. G., et al. A natural killer T (NKT) cell developmental pathway iInvolving a thymus-dependent NK1.1(-)CD4(+) CD1d-dependent precursor stage. Journal of Experimental Medicine. 195 (7), 835-844 (2002).
- Benlagha, K., Kyin, T., Beavis, A., Teyton, L., Bendelac, A. A thymic precursor to the NK T cell lineage. Science. 296 (5567), 553-555 (2002).
- Lee, Y. J., Holzapfel, K. L., Zhu, J., Jameson, S. C., Hogquist, K. A. Steady-state production of IL-4 modulates immunity in mouse strains and is determined by lineage diversity of iNKT cells. Nature Immunology. 14 (11), 1146-1154 (2013).
- Griewank, K., et al. Homotypic interactions mediated by Slamf1 and Slamf6 receptors control NKT cell lineage development. Immunity. 27 (5), 751-762 (2007).
- Cortesi, F., et al. Bimodal CD40/Fas-Dependent Crosstalk between iNKT Cells and Tumor-Associated Macrophages Impairs Prostate Cancer Progression. Cell Reports. 22 (11), 3006-3020 (2018).
- Heczey, A., et al. Invariant NKT cells with chimeric antigen receptor provide a novel platform for safe and effective cancer immunotherapy. Blood. 124 (18), 2824-2833 (2014).
- Liu, Y., et al. A modified alpha-galactosyl ceramide for staining and stimulating natural killer T cells. Journal of Immunological Methods. 312 (1-2), 34-39 (2006).
- Chiba, A., et al. Rapid and reliable generation of invariant natural killer T-cell lines in vitro. Immunology. 128 (3), 324-333 (2009).
- Crowe, N. Y., et al. Differential antitumor immunity mediated by NKT cell subsets in vivo. Journal of Experimental Medicine. 202 (9), 1279-1288 (2005).
- de Lalla, C., et al. Production of profibrotic cytokines by invariant NKT cells characterizes cirrhosis progression in chronic viral hepatitis. Journal of Immunology. 173 (2), 1417-1425 (2004).
- Tian, G., et al. CD62L+ NKT cells have prolonged persistence and antitumor activity in vivo. Journal of Clinical Investigation. 126 (6), 2341-2355 (2016).
- Gaya, M., et al. Initiation of Antiviral B Cell Immunity Relies on Innate Signals from Spatially Positioned NKT Cells. Cell. 172 (3), 517-533 (2018).
- Rotolo, A., et al. Enhanced Anti-lymphoma Activity of CAR19-iNKT Cells Underpinned by Dual CD19 and CD1d Targeting. Cancer Cell. 34 (4), 596-610 (2018).
- Schneidawind, D., et al. Third-party CD4+ invariant natural killer T cells protect from murine GVHD lethality. Blood. 125 (22), 3491-3500 (2015).
- Schneidawind, D., et al. CD4+ invariant natural killer T cells protect from murine GVHD lethality through expansion of donor CD4+CD25+FoxP3+ regulatory T cells. Blood. 124 (22), 3320-3328 (2014).
- Schneidawind, D., Pierini, A., Negrin, R. S. Regulatory T cells and natural killer T cells for modulation of GVHD following allogeneic hematopoietic cell transplantation. Blood. 122 (18), 3116-3121 (2013).
- Leveson-Gower, D. B., et al. Low doses of natural killer T cells provide protection from acute graft-versus-host disease via an IL-4-dependent mechanism. Blood. 117 (11), 3220-3229 (2011).
- Coman, T., et al. Human CD4- invariant NKT lymphocytes regulate graft versus host disease. Oncoimmunology. 7 (11), 1470735(2018).
- Xu, X., et al. NKT Cells Coexpressing a GD2-Specific Chimeric Antigen Receptor and IL15 Show Enhanced In vivo Persistence and Antitumor Activity against Neuroblastoma. Clinical Cancer Research. 25 (23), 7126-7138 (2019).
- Heczey, A., et al. Anti-GD2 CAR-NKT cells in patients with relapsed or refractory neuroblastoma: an interim analysis. Nature Medicine. 26 (11), 1686-1690 (2020).
- Exley, M. A., et al. Adoptive Transfer of Invariant NKT Cells as Immunotherapy for Advanced Melanoma: A Phase I Clinical Trial. Clinical Cancer Research. 23 (14), 3510-3519 (2017).
- Wolf, B. J., Choi, J. E., Exley, M. A. Novel Approaches to Exploiting Invariant NKT Cells in Cancer Immunotherapy. Frontiers in Immunology. 9, 384(2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ISSN 2689-3649
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
Utilizamos cookies para mejorar su experiencia en nuestra página web.
Al continuar usando nuestro sitio web o al hacer clic en 'Continuar', está aceptando nuestras cookies.