Method Article
Purificazione ed espansione di cellule T Natural Killer invarianti di topo per studi in vitro e in vivo
In questo articolo
Riepilogo
Descriviamo un protocollo rapido e robusto per arricchire le cellule T natural killer invarianti (iNKT) dalla milza di topo ed espanderle in vitro a numeri adatti per studi in vitro e in vivo.
Abstract
Le cellule Invariant Natural Killer T (iNKT) sono linfociti T innata che esprimono un recettore delle cellule T semi-invariante (TCR) conservato specifico per antigeni lipidici auto o microbici presentati dalla molecola non polimorfica MHC di classe I CD1d. Studi preclinici e clinici supportano un ruolo delle cellule iNKT nel cancro, nell'autoimmunità e nelle malattie infettive. Le cellule iNKT sono molto conservate in tutte le specie e la loro indagine è stata facilitata da modelli murini, tra cui topi cd1d-carenti o iNKT-carenti, e la possibilità di rilevarle inequivocabilmente in topi e uomini con tetrameri CD1d o mAbs specifici per il TCR semi-invariante. Tuttavia, le cellule iNKT sono rare e devono essere espanse per raggiungere numeri gestibili per qualsiasi studio. Poiché la generazione della linea cellulare iNKT di topo primario in vitro si è dimostrata difficile, abbiamo istituito un protocollo robusto per purificare ed espandere le cellule iNKT spleniche dai topi transgenici iVα14-Jα18 (iVα14Tg), in cui le cellule iNKT sono 30 volte più frequenti. Mostriamo qui che le cellule iNKT iVα14Tg miliniche primarie possono essere arricchite attraverso un processo di separazione immunomagnetica, producendo circa il 95-98% di cellule iNKT pure. Le cellule iNKT purificate sono stimolate da perline anti-CD3 / CD28 più IL-2 e IL-7, con conseguente espansione di 30 volte al giorno +14 della coltura con purezza dell'85-99%. Le cellule iNKT espanse possono essere facilmente manipolate geneticamente, fornendo uno strumento inestimabile per sezionare i meccanismi di attivazione e funzione in vitro e, soprattutto, anche dopo il trasferimento adottivo in vivo.
Introduzione
Le cellule T natural killer invarianti (cellule iNKT) sono linfociti T innati che esprimono un recettore semi-invariante delle cellule T αβ (TCR), formato nei topi da una catena Vα14-Jα18 invariante accoppiata con un insieme limitato di diverse catene Vβ1, che è specifico per gli antigeni lipidici presentati dalla molecola correlata alla classe I MHC CD1d2. Le cellule iNKT subiscono un programma di selezione agonista con conseguente acquisizione di un fenotipo effettore attivato/innato già presente nel timo, che avviene attraverso diversi stadi di maturazione3,4,producendo un sottoinsieme CD4+ ecd4- sottoinsieme. Attraverso questo programma, le cellule iNKT acquisiscono fenotipi effettrici T helper (TH) distinti, vale a dire TH1 (iNKT1), TH2 (iNKT2) e TH17 (iNKT17), identificabili dall'espressione dei fattori di trascrizione T-bet, GATA3, PLZF e RORγt, rispettivamente5. Le cellule iNKT riconoscono una serie di lipidi microbici ma sono anche autoreattive nei confronti dei lipidi endogeni che sono sovraregolati nel contesto di situazioni patologiche di stress cellulare e danno tissutale, come il cancro e l'autoimmunità2. Al momento dell'attivazione, le cellule iNKT modulano le funzioni di altre cellule effettrici immunitarie innate e adattative attraverso il contatto diretto e la produzione di citochine2.
Le indagini sulle cellule iNKT sono state facilitate da modelli murini, tra cui topi cd1d-deficienti o Jα18-carenti, e dalla produzione di tetrameri CD1d caricati con antigene più la generazione di anticorpi monoclonali (mAbs) specifici per il TCR semi-invariante umano. Tuttavia, la generazione della linea cellulare iNKT del topo primario si è dimostrata difficile. Per caratterizzare meglio le funzioni antitumorali delle cellule iNKT e utilizzarle per la terapia cellulare adottiva, abbiamo istituito un protocollo per purificare ed espandere le cellule iNKT spleniche di topi transgenici iVα14-Jα18 (iVα14Tg)6, in cui le cellule iNKT sono 30 volte più frequenti rispetto ai topi wild type.
Le cellule iNKT espanse possono essere sfruttate per saggi in vitro e in vivo al momento del trasferimento nei topi. In questo contesto, ad esempio, abbiamo mostrato i loro potenti effettiantitumorali 7. Inoltre, le cellule iNKT espanse in vitro sono suscettibili di modificazione funzionale tramite trasferimento genico o modifica prima della loro iniezione in vivo8, consentendo un'analisi funzionale approfondita dei percorsi molecolari, oltre a spianare la strada a terapie cellulari avanzate.
Protocollo
Le procedure qui descritte sono state esaminate e approvate dal Comitato Istituzionale per la Cura e l'Uso degli Animali (IACUC) (n. 1048) dell'Istituto Scientifico San Raffaele.
NOTA: Tutte le procedure devono essere eseguite in condizioni sterili. Tutti i reagenti utilizzati sono elencati nella Tabella dei Materiali.
1. Lavorazione della milza
- Eutanasia dei topi iVα14-Jα18 per inalazione di CO2 secondo la politica istituzionale.
NOTA: i topi iVα14-Jα18 devono avere almeno 8 settimane. Per evitare il rigetto delle cellule dal trasferimento in vivo delle cellule, si consideri che le cellule isolate da topi femmina possono essere trasferite adottivamente sia in riceventi maschi che femmine, mentre le cellule isolate da topi maschi possono essere trasferite solo in riceventi maschi. Per gli esperimenti in vitro, non deve essere considerato alcun pregiudizio di genere. Più topi possono essere raggruppati per ottenere più cellule. - Sezionare la milza di topo e romperla attraverso un colino cellulare da 70 nm per ottenere una sospensione unicellulare in 10 ml di soluzione salina tamponata con fosfato (PBS) con il 2% di siero bovino fetale (FBS).
- Centrifuga a 300 x g per 5 min.
- Rimuovere il surnatante per inversione ed elaborare con tampone di lisi degli eritrociti. Risospesere il pellet cellulare con 1 mL di tampone di lisatura sterile ACK (Ammonio-Cloruro-Potassio), incubare per 3 minuti a temperatura ambiente e bloccare con 5 ml di PBS con il 2% di FBS. Centrifuga a 300 x g per 5 min.
NOTA: ACK è disponibile in commercio; è costituito da una soluzione di 0,15 M NH4Cl, 10 mM KHCO3e 0,1 mM Na2EDTA (acido etilendiamminotetraacetico) disciolto in H2O bidillato, pH 7,2-7,4. Se fatto in casa, sterilizzare per filtrazione con un filtro da 0,22 μm. - Rimuovere il surnatante per inversione. Risospesciare il pellet cellulare in 3 ml di PBS con il 2% di FBS e rimuovere i residui di grasso mediante pipettaggio. Se necessario, raggruppare le cellule provenienti da topi diversi.
- Contare le cellule e mantenere 50 μL per l'analisi FACS.
2. Arricchimento delle cellule T
NOTA: Per le fasi di arricchimento, lavorare velocemente, mantenere le celle fredde e utilizzare soluzioni pre-raffreddate a 4 °C durante la notte e poi mantenute sul ghiaccio
- Centrifuga a 300 x g per 5 min.
- Risospendare tutte le celle nella quantità appropriata di PBS con 2% FBS (500 μL per 107 celle) e bloccante Fc (2,5 μL x 107 celle); incubare per 15 minuti a temperatura ambiente (RT).
- Lavare con 1-2 mL di tampone di separazione MACS (MB) per10 7 celle totali e centrifugare a 300 x g per 10 min.
NOTA: il buffer MACS è disponibile in commercio. È costituito da PBS pH 7,2, 0,5% di albumina sierica bovina (BSA) e 2 mM EDTA. Se fatto in casa, sterilizzare per filtrazione con un filtro da 0,22 μm. - Rimuovere il surnatante per inversione e macchiare le cellule con CD19-FITC e H2(IA b)-FITC (utilizzare 5 μL x 107 celle in 100 μL di MB). Mescolare bene e incubare per 15 minuti al buio a 4-8 °C.
- Lavare le celle aggiungendo 1−2 mL di MB per 107 celle e centrifugare a 300 x g per 10 min.
- Pipettare completamente il surnatante e risospescere il pellet cellulare in 90 μL di MB per 107 celle totali. Aggiungere 10 μL di MicroBeads Anti-FITC per 107 celle totali. Mescolare bene e incubare per 15 minuti al buio a 4-8 °C.
- Lavare le celle aggiungendo 1−2 mL di MB per 107 celle e centrifugare a 300 x g per 10 min.
- Pipettare completamente il surnatante e risospendere fino a 1,25 x 108 celle in 500 μL di MB.
- Posizionare una colonna LD nel campo magnetico del separatore MACS per procedere all'esaurimento. Per evitare intasamenti, applicare un filtro di pre-separazione sulla colonna LD e risciacquare con 2 ml di MB.
- Quando il serbatoio della colonna è vuoto, applicare la sospensione della cella sul filtro. Raccogliere le celle senza etichetta che passano attraverso la colonna.
- Lavare 3 volte con 1 ml di MB, solo quando il serbatoio della colonna è vuoto. Raccogliere l'effluente totale, che sarà arricchito in cellule T, e contare le cellule. Mantenere sempre 50 μL per l'analisi FACS.
3. Arricchimento cellulare iNKT
- Centrifugare a 300 x g per 5 min e rimuovere il surnatante per inversione.
- Colorare le cellule con CD1d-tetramer-PE (topo PBS57-CD1d-tetramero), secondo la titolazione anticorpale in 50 μL di MB per 106 cellule. Mescolare bene e incubare per 30 minuti al buio sul ghiaccio.
NOTA: La procedura può essere eseguita anche con tetrameri mCD1d marcati APC e perline anti-APC; regolare di conseguenza i fluorocromi utilizzati nella successiva colorazione. Nel presente protocollo abbiamo utilizzato mouse PBS-57-CD1d-tetrameri forniti da NIH. αgalactosylceramide (αGal-Cer) è l'antigene prototipico riconosciuto dalle cellule iNKT; PBS-57 è un analogo di αGal-Cer con solubilità migliorata9; il NIH Tetramer Facility fornisce il ligando PBS-57 complessato ai tetrameri CD1d. Tuttavia, altri dimeri / tetrameri / dextramer CD1d sono disponibili in commercio e possono essere caricati con un antigene lipidico come αGal-Cer. Prevediamo la possibilità di adeguare il protocollo per il loro utilizzo. - Lavare le celle aggiungendo 1−2 mL di MB per 107 celle e centrifugare a 300 x g per 10 min.
- Pipettare completamente il surnatante e risospescere il pellet cellulare in 80 μL di MB per 107 celle totali. Aggiungere 20 μL di MicroBeads Anti-PE per 107 cellule totali. Mescolare bene e incubare per 15 minuti al buio a 4-8 °C.
- Lavare le celle aggiungendo 1−2 mL di MB per 107 celle e centrifugare a 300 x g per 10 min.
- Pipettare completamente il surnatante e risospendere fino a 108 celle in 500 μL di MB. In caso contrario, se le celle superano10 8, regolare il volume di conseguenza.
- In base al conteggio delle celle, posizionare una colonna LS (fino a10 8) o MS (fino a10 7) nel campo magnetico del separatore MACS. Risciacquare la colonna con MB (3 mL per LS, 500 μL per MS).
- Applicare la sospensione della cella sulla colonna.
- Raccogli le cellule senza etichetta che passano attraverso. Lavare la colonna 3 volte aggiungendo la quantità appropriata di MB (3 x 3 mL per la colonna LS, 3 x 500 μL per la colonna MS) solo quando il serbatoio della colonna è vuoto. L'effluente totale è la frazione negativa.
- Rimuovere la colonna dal campo magnetico e posizionarla su un nuovo tubo di raccolta.
- Pipetta MB sulla colonna (5 mL per la colonna LS o 1 mL per la colonna MS); spingere lo stantuffo fornito nella colonna e scovare la frazione positiva (arricchita in celle iNKT).
- Per aumentare ulteriormente il recupero delle cellule iNKT, centrifugare la frazione negativa a 300 x g per 10 minuti e ripetere i passaggi 3.6-3.7 con una nuova colonna LS o MS. Raggruppare le frazioni positive e determinare il conteggio delle cellule. Mantenere 50 μL di frazioni sia positive che negative per l'analisi FACS.
- Controllare le fasi di purificazione mediante analisi FACS. I campioni includono: milza ex-vivo, frazione arricchita di cellule T, frazione positiva iNKT e frazione negativa iNKT. Colorare le cellule con: CD19-FITC, IAb-FITC, CD1d-tetramer-PE, TCRβ-APC e DAPI.
NOTA: il recupero previsto da un mouse iVα14-Jα18 è 2x106 celle iNKT .
4. Attivazione ed espansione delle celle iNKT
- Attivare le cellule iNKT purificate con perline magnetiche anti-CD3/CD28 attivatore T del mouse in un rapporto 1:1.
- Centrifugare la frazione positiva della cella iNKT a 300 x g per 5 min.
- Nel frattempo trasferire il volume appropriato di perline magnetiche anti-CD3 / CD28 su un tubo e aggiungere un volume uguale di PBS, vortice per 5 secondi. Posizionare il tubo su un magnete per 1 minuto ed eliminare il surnatante.
- Rimuovere il tubo dal magnete e risospesciare le perle magnetiche lavate nel giusto volume di RPMI completo (RPMI 1640 medio, 10% FCS inattivato dal calore, 1 mM piruvato di sodio, 1% aminoacidi non essenziali, 10 U/ ml di penicillina e streptomicina, 50 μM β-Mercaptoetanolo) per avere 5 x 105 cellule iNKT in 1 mL. Utilizzare questa sospensione per risospendere la frazione positiva centrifugata iNKT.
- Piastra 1 mL della sospensione cellulare (5 x 105 celle iNKT) e perline magnetiche anti-CD3/CD28 in una piastra a 48 pozzetti con 20 U/mL IL-2 e incubare a 37 °C.
- Dopo 5 giorni, aggiungere 10 ng /mL IL-7.
- Dividere le celle 1:2 quando raggiungono l'80-90% di confluenza, aggiungere sempre 20U/mL IL-2 e 10 ng/mL IL-7. In queste condizioni, le cellule iNKT possono essere espanse fino a 15 giorni.
Risultati
Il protocollo descritto in questo manoscritto consente di arricchire le cellule iNKT dalla milza di topi transgenici iVa14-Ja18 attraverso un processo di separazione immunomagnetica riassunto in Figura 1A. Le cellule T della milza totale vengono prima selezionate negativamente esaurendo le cellule B e i monociti, seguite dallo smistamento immunomagnetico positivo delle cellule iNKT con tetrameri CD1d caricati con antigene lipidico PBS-57, che consentono di colorare specificamente solo le cellule iNKT. Questo protocollo produce circa 2 x 106 di cellule iNKT pure al 95-98% dalla milza di un singolo topo iVa14-Ja18 Tg. Nessuna o pochissime cellule iNKT possono essere rilevate nella frazione negativa (Figura 1B).
Dopo l'arricchimento, le cellule iNKT iVa14 possono essere espanse con perline anti-CD3/CD28 più IL-2 e IL-7 (Figura 2A), con conseguente espansione di 30 volte in media entro il giorno +14 della coltura come mostrato nella Figura 2B.
La Figura 3A mostra la purezza delle cellule iNKT insieme all'espansione in vitro e all'espressione della molecola CD4. Abbiamo osservato una diminuzione della percentuale di TCRβ+ CD1d-tetramero+ cellule doppie positive: la forte attivazione con perline anti-CD3/CD28 sta inducendo la downregulation dell'espressione TCR delle cellule iNKT sulla superficie cellulare e sta comparendo una doppia popolazione negativa. La maggior parte delle cellule iNKT espanse erano CD4-. La Figura 3B mostra una caratterizzazione dell'espressione dei fattori di trascrizione specifici del lignaggio PLZF e RORγt su cellule iNKT arricchite al giorno 0 e 14 giorni dopo l'espansione. Questa colorazione consente di identificare i fenotipi NKT1 (PLZFlow RORγt-), NKT2 (PLZFhigh RORγt-), e NKT17 (PLZFint RORγt+). Essendo per lo più NKT1 e NKT2, le cellule iNKT arricchite mostrano un fenotipo effettore simile a TH0. Questo fenotipo viene conservato dopo 14 giorni di espansione, come confermato dalla secrezione di IFN-γ e IL-4 dopo stimolazione pma/ionomicina mostrata in Figura 3C.

Figura 1: Arricchimento cellulare iNKT. A) Rappresentazione schematica del protocollo di separazione immunomagnetica. B)Analisi citometrica a flusso di ogni fase di arricchimento. La percentuale di frequenze delle cellule T è mostrata nei grafici superiori, recintati su linfociti vitali. Mentre la percentuale di frequenze cellulari iNKT lungo ogni passo sono mostrate nei grafici inferiori, gated su linfociti CD19- TCRβ+ vitali. La colorazione su linfociti VITALI CD19- TCRβ+ con tetramero CD1d scaricato consente di disegnare correttamente il cancello cellulare iNKT. Viene mostrato un esperimento rappresentativo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Espansione in vitro delle cellule iNKT. A ) Contadelle cellule iNKT lungo l'espansione cellulare iNKT. Vengono mostrati tre esperimenti rappresentativi e indipendenti. B)Aumento del numero di cellule iNKT ai giorni 7 e 14 dopo la purificazione e l'attivazione. Vengono mostrati i mezzi ± SD. Fare clic qui per visualizzare una versione più grande di questa figura.
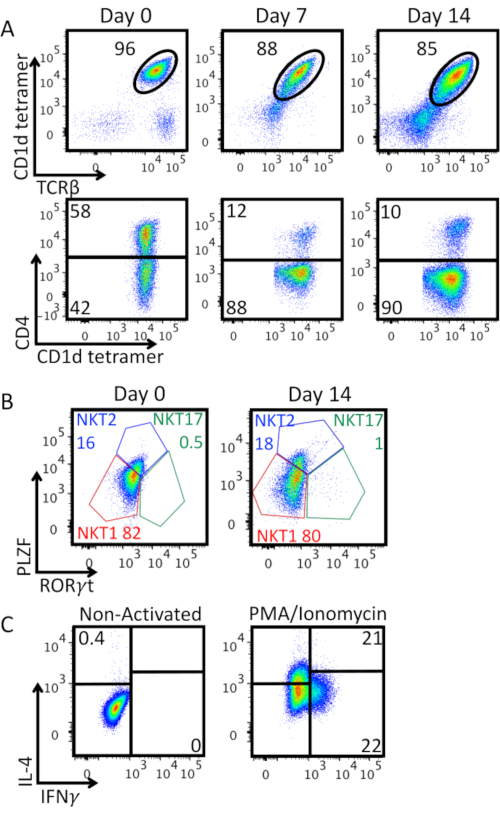
Figura 3: Caratterizzazione espansa delle cellule iNKT. A) Analisi citometrica a flusso della percentuale di cellule iNKT e dell'espressione di CD4 lungo il periodo di espansione. Le trame superiori sono recintate su linfociti vitali. I grafici inferiori sono recintati sulle cellule iNKT (cd1d-tetramero vitale+ TCRβ+ linfociti). B)Caratterizzazione fenotipica di cellule iNKT arricchite (giorno 0) ed espanse (giorno 14). I grafici sono recintati su cellule iNKT (cd1d-tetramero vitale+ TCRβ+ linfociti). Le cellule sono state colorate per via intranucleare per i fattori di trascrizione con il set di buffer di colorazione del fattore di trascrizione Foxp3. Sono stati identificati i sottoinsiemi NKT1 (PLZFlow RORγt-), NKT2 (PLZFhigh RORγt-), e NKT17 (PLZFint RORγt+), le frequenze di ciascun sottoinsieme sono mostrate in percentuale. C)Produzione di citochine da parte di cellule iNKT espanse al giorno 14. I grafici sono recintati su cellule iNKT (cd1d-tetramero vitale+ TCRβ+ linfociti). Le cellule sono state stimolate per 4 ore con PMA 25 ng/mL/Ionomicina 1 μg/mL, in presenza nelle ultime 2 ore di Brefeldina A 10 μg/mL. Le cellule sono state quindi fissate con PFA 2%, permeabilizzate con Permwash e quindi colorate intracellulari per la produzione di citochine. La strategia di Gating è stata impostata sul pannello di sinistra del controllo non attivato. Viene mostrato un esperimento rappresentativo. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Qui mostriamo un protocollo riproducibile e fattibile per ottenere milioni di celle iNKT pronte all'uso. A causa della scarsità di queste cellule in vivo, era altamente necessario un metodo per espanderle. Il protocollo che proponiamo non richiede né una particolare strumentazione né un elevato numero di topi. Abbiamo sfruttato i topi transgenici iVα14-Jα18 di proposito per ridurre il numero di topi necessari per la procedura.
Un altro protocollo di successo per l'espansione cellulare iNKT da topi transgenici iVα14-Jα18 è disponibile in letteratura10. Questo protocollo prevede la generazione, 6 giorni prima della purificazione delle cellule iNKT, di cellule dendritiche fresche derivate dal midollo osseo, quindi caricate con α-galattosilceramide e irradiate, più IL-2 e IL-7. Consideriamo la riduzione del numero dei topi coinvolti nella procedura un grande vantaggio del protocollo. È anche un risparmio di tempo, dal momento che l'impostazione della coltura cellulare dura un solo giorno invece di una settimana. Una possibile limitazione della riproducibilità dell'attuale protocollo potrebbe essere la disponibilità di topi transgenici iVα14-Jα18, comunque disponibili in commercio. In assenza di questi topi, prevediamo la possibilità di utilizzare un gran numero di topi WT, ma il protocollo deve essere impostato di conseguenza a causa della scarsità di cellule iNKT nei topi WT.
Durante la coltura cellulare, di solito controlliamo la purezza e il fenotipo delle cellule iNKT espanse. La diminuzione della percentuale di TCRβ+ CD1d-tetramero+ cellule doppie positive (Figura 3A) può essere spiegata da una naturale downregulation della cellula NKT invariante TCR dalla superficie cellulare dopo l'attivazione. Inoltre, la maggior parte delle cellule iNKT espanse non esprimeva CD4 (Figura 3A): questo può rappresentare un vantaggio nel contesto di una terapia cellulare adottiva, poiché le cellule CD4- iNKT sono risultate essere le più efficaci nel controllo della progressione tumorale11. Inoltre, il fenotipo effetologico TH0-like osservato(Figura 3C)è del tutto coerente con quello osservato nelle cellule iNKT umane dopo espansione e ristimolazione in vitro8,12,13,14,15. Le cellule espanse sono altamente reattive in vivo e in vitro, quindi utili in contesti di immunoterapie adottive basate su cellule iNKT. Il trasferimento adottivo di cellule iNKT non manipolate o espanse previene o migliora la malattia acuta Graft-Versus-Host (aGVHD) lasciando inalterato l'effetto Graft-Versus-Leukaemia16,17,18,19. Le cellule iNKT umane trasferite adottivamente espanse in vitro con αGal-Cer alleviano l'aGVHD xenogenico e questo effetto è mediato da CD4- ma non da CD4+ cellule20. Inoltre, dato che le cellule iNKT non causano aGVHD, costituiscono le cellule ideali per l'immunoterapia CAR senza necessità di delezione del loro TCR e hanno dimostrato di avere una prolungata attività antitumorale in vivo8,15. Le cellule iNKT sono attualmente sfruttate in studi clinici in corso e conclusi21,22,23,24.
In conclusione, il protocollo descritto è veloce, semplice e consente un aumento di 30 volte del numero di cellule iNKT recuperate da una milza di topo (Figura 3B). Queste cellule possono essere facilmente sfruttate per saggi di riconoscimento in vitro, sistemi di co-coltura o terapia cellulare adottiva in studi preclinici. Le cellule iNKT, infatti, svolgono un ruolo fondamentale nella sorveglianza immunitaria del tumore, nelle malattie infettive e nell'autoimmunità. In questi contesti, le cellule iNKT possono rappresentare uno strumento potente, essendo un'alternativa attraente alle cellule T convenzionali prive della restrizione MHC. La rapida generazione di grandi quantità di queste cellule e la possibilità di manipolarle ulteriormente in vitro possono portare allo sviluppo di strategie terapeutiche senza precedenti.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Paolo Dellabona e Giulia Casorati per il supporto scientifico e la lettura critica del manoscritto. Ringraziamo anche il NIH Tetramer Core Facility per il tetramero CD1d del topo. Lo studio è stato finanziato dalla Fondazione Cariplo Grant 2018-0366 (a M.F.) e dalla borsa di studio 2019-22604 dell'Associazione Italiana per la Ricerca sul Cancro (AIRC) (a G.D.).
Materiali
| Name | Company | Catalog Number | Comments |
| Ammonium-Chloride-Potassium (ACK) solution | in house | 0.15M NH4Cl, 10mM KHCO3, 0.1mM EDTA, pH 7.2-7.4 | |
| anti-FITC Microbeads | Miltenyi Biotec | 130-048-701 | |
| anti-PE Microbeads | Miltenyi Biotec | 130-048-801 | |
| Brefeldin A | Sigma | B6542 | |
| CD19 -FITC | Biolegend | 115506 | clone 6D5 |
| CD1d-tetramer -PE | NIH tetramer core facility | mouse PBS57-Cd1d-tetramers | |
| CD4 -PeCy7 | Biolegend | 100528 | clone RM4-5 |
| Fc blocker | BD Bioscience | 553142 | |
| Fetal Bovine Serum (FBS) | Euroclone | ECS0186L | heat-inactivated and filtered .22 before use |
| FOXP3 Transcription factor staining buffer | eBioscience | 00-5523-00 | |
| H2 (IAb) -FITC | Biolegend | 114406 | clone AF6-120.1 |
| hrIL-2 | Chiron Corp | ||
| Ionomycin | Sigma | I0634 | |
| LD Columns | Miltenyi Biotec | 130-042-901 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | |
| MACS buffer (MB) | in house | 0.5% Bovine Serum Albumin (BSA; Sigma-Aldrich) and 2Mm EDTA | |
| MS Columns | Miltenyi Biotec | 130-042-201 | |
| Non-essential amino acids | Gibco | 11140-035 | |
| Penicillin and streptomycin (Pen-Strep) | Lonza | 15140-122 | |
| PermWash | BD Bioscience | 51-2091KZ | |
| PFA | Sigma | P6148 | |
| Phosphate buffered saline (PBS) | EuroClone | ECB4004L | |
| PMA | Sigma | P1585 | |
| Pre-Separation Filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| Recombinat Mouse IL-7 | R&D System | 407-ML-025 | |
| RPMI 1640 with glutamax | Gibco | 61870-010 | |
| sodium pyruvate | Gibco | 11360-039 | |
| TCRβ -APC | Biolegend | 109212 | clone H57-597 |
| αCD3CD28 mouse T activator Dynabeads | Gibco | 11452D | |
| β-mercaptoethanol | Gibco | 31350010 |
Riferimenti
- Bendelac, A., Savage, P. B., Teyton, L. The biology of NKT cells. Annual Review of Immunology. 25, 297-336 (2007).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews: Immunology. 13 (2), 101-117 (2013).
- Pellicci, D. G., et al. A natural killer T (NKT) cell developmental pathway iInvolving a thymus-dependent NK1.1(-)CD4(+) CD1d-dependent precursor stage. Journal of Experimental Medicine. 195 (7), 835-844 (2002).
- Benlagha, K., Kyin, T., Beavis, A., Teyton, L., Bendelac, A. A thymic precursor to the NK T cell lineage. Science. 296 (5567), 553-555 (2002).
- Lee, Y. J., Holzapfel, K. L., Zhu, J., Jameson, S. C., Hogquist, K. A. Steady-state production of IL-4 modulates immunity in mouse strains and is determined by lineage diversity of iNKT cells. Nature Immunology. 14 (11), 1146-1154 (2013).
- Griewank, K., et al. Homotypic interactions mediated by Slamf1 and Slamf6 receptors control NKT cell lineage development. Immunity. 27 (5), 751-762 (2007).
- Cortesi, F., et al. Bimodal CD40/Fas-Dependent Crosstalk between iNKT Cells and Tumor-Associated Macrophages Impairs Prostate Cancer Progression. Cell Reports. 22 (11), 3006-3020 (2018).
- Heczey, A., et al. Invariant NKT cells with chimeric antigen receptor provide a novel platform for safe and effective cancer immunotherapy. Blood. 124 (18), 2824-2833 (2014).
- Liu, Y., et al. A modified alpha-galactosyl ceramide for staining and stimulating natural killer T cells. Journal of Immunological Methods. 312 (1-2), 34-39 (2006).
- Chiba, A., et al. Rapid and reliable generation of invariant natural killer T-cell lines in vitro. Immunology. 128 (3), 324-333 (2009).
- Crowe, N. Y., et al. Differential antitumor immunity mediated by NKT cell subsets in vivo. Journal of Experimental Medicine. 202 (9), 1279-1288 (2005).
- de Lalla, C., et al. Production of profibrotic cytokines by invariant NKT cells characterizes cirrhosis progression in chronic viral hepatitis. Journal of Immunology. 173 (2), 1417-1425 (2004).
- Tian, G., et al. CD62L+ NKT cells have prolonged persistence and antitumor activity in vivo. Journal of Clinical Investigation. 126 (6), 2341-2355 (2016).
- Gaya, M., et al. Initiation of Antiviral B Cell Immunity Relies on Innate Signals from Spatially Positioned NKT Cells. Cell. 172 (3), 517-533 (2018).
- Rotolo, A., et al. Enhanced Anti-lymphoma Activity of CAR19-iNKT Cells Underpinned by Dual CD19 and CD1d Targeting. Cancer Cell. 34 (4), 596-610 (2018).
- Schneidawind, D., et al. Third-party CD4+ invariant natural killer T cells protect from murine GVHD lethality. Blood. 125 (22), 3491-3500 (2015).
- Schneidawind, D., et al. CD4+ invariant natural killer T cells protect from murine GVHD lethality through expansion of donor CD4+CD25+FoxP3+ regulatory T cells. Blood. 124 (22), 3320-3328 (2014).
- Schneidawind, D., Pierini, A., Negrin, R. S. Regulatory T cells and natural killer T cells for modulation of GVHD following allogeneic hematopoietic cell transplantation. Blood. 122 (18), 3116-3121 (2013).
- Leveson-Gower, D. B., et al. Low doses of natural killer T cells provide protection from acute graft-versus-host disease via an IL-4-dependent mechanism. Blood. 117 (11), 3220-3229 (2011).
- Coman, T., et al. Human CD4- invariant NKT lymphocytes regulate graft versus host disease. Oncoimmunology. 7 (11), 1470735 (2018).
- Xu, X., et al. NKT Cells Coexpressing a GD2-Specific Chimeric Antigen Receptor and IL15 Show Enhanced In vivo Persistence and Antitumor Activity against Neuroblastoma. Clinical Cancer Research. 25 (23), 7126-7138 (2019).
- Heczey, A., et al. Anti-GD2 CAR-NKT cells in patients with relapsed or refractory neuroblastoma: an interim analysis. Nature Medicine. 26 (11), 1686-1690 (2020).
- Exley, M. A., et al. Adoptive Transfer of Invariant NKT Cells as Immunotherapy for Advanced Melanoma: A Phase I Clinical Trial. Clinical Cancer Research. 23 (14), 3510-3519 (2017).
- Wolf, B. J., Choi, J. E., Exley, M. A. Novel Approaches to Exploiting Invariant NKT Cells in Cancer Immunotherapy. Frontiers in Immunology. 9, 384 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon