Method Article
Скрининг для Термотога маритима Мембрана-Связанные пирофосфаза ингибиторы
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем метод скрининга для мембранной связаны пирофосфатазы (от Thermotoga maritima) ингибиторы на основе молибдена синяя реакция в 96 хорошо пластины формате.
Аннотация
Мембрана связаны пирофосфазазов (mPPases) являются димерические ферменты, которые встречаются в бактериях, археях, растений и протист паразитов. Эти белки расщепивают пирофосфат на две молекулы ортофосфата, которые соединяют с протоном и/или ионом натрия, перекачивающимися по мембране. Поскольку никаких гомологических белков не происходит у животных и людей, mPPases являются хорошими кандидатами в разработке потенциальных целей наркотиков. Здесь мы представляем подробный протокол для проверки ингибиторов mPPase с использованием молибдена синяя реакция в 96 хорошо пластины системы. Мы используем mPPase из термофильной бактерии Thermotoga maritima (TmPPase) в качестве образцового фермента. Этот протокол прост и недорог, что дает стабильный и надежный результат. Завершение протокола оценки активности занимает всего около часа с начала ассеидов до измерения абсорбции. Так как синий цвет, произведенный в этом анализе, стабилен в течение длительного периода времени, последующий анализ (ы) может быть выполнен сразу после предыдущей партии, а абсорбция может быть измерена позже для всех партий сразу. Недостатком этого протокола является то, что это делается вручную и, таким образом, может быть утомительным, а также требуют хороших навыков пайпеттинга и хранения времени. Кроме того, раствор арсенита,цитрата, используемый в этом ассее, содержит арсенит натрия, который является токсичным и должен быть обработан с необходимыми мерами предосторожности.
Введение
Приблизительно 25% от общего количества клеточных белков являются мембранными белками и около 60% из них являются лекарственными целями1,2. Одной из потенциальных целей препарата3, мембранно-связанных пирофосфатазы (mPPases), являются димерические ферменты, которые перекачивают протон и / или ион натрия через мембрану путем гидролизза пирофосфата в два ортофосфата4. mPPases можно найти в различных организмах5, таких как бактерии, археи, растения и протеистовые паразиты, за исключением людей и животных4. В протеист паразитов, например Plasmodium falciparum, Toxoplasma gondii и Trypanosoma brucei, mPPases имеют важное значение для паразита вирулентности6 и нокаут этого выражения у паразитов привести к сбою в поддержании внутриклеточного рН при воздействии на внешние основные рН7. Из-за их важности и отсутствия гомологиального белка, присутствующем у позвоночных, mPPases можно рассматривать в качестве потенциальных целей препарата для протистальных заболеваний3.
Скрининг ингибиторов mPPase в пробирке в этой работе основан на модели системы TmPPase. TmPPase является натрия ионнасоса и калий ионзависимых mPPase от T. maritima и имеет свою оптимальную активность на 71 C8. Преимуществами этого фермента являются, например, его легкость в производстве и очистке, хорошая тепловая устойчивость и высокая специфическая активность. TmPPase показывает как высокое сходство в дополнение к полному сохранению позиции, так и идентичность всех каталитических остатков к протеистам mPPases3,9 и к разрешенной структуре Vigna radiata10 mPPase. Доступные структуры TmPPase в различных конформациях также полезны для эксперимента по проектированию лекарств на основе структуры (как виртуальный скрининг и de novo design).
Здесь мы сообщаем подробный протокол для скрининга ингибиторов TmPPase в формате 96 хорошо пластины (Рисунок 1). Протокол основан на колоритном методе молибдена голубой реакции, который был впервые разработан Fiske и Subbarow11. Этот метод включает в себя образование 12-фофофомолибдовой кислоты из ортофосфата и молибдата в кислых условиях, которая затем уменьшается, чтобы дать характерные синего цвета фофофомолибдин видов12.
протокол
1. Препарат протеина
ПРИМЕЧАНИЕ: Выражение и очищение TmPPase было описано в другом месте13.
- Приготовьте 10 мл буферного раствора реактивации, содержащего 20 мМ2-(N-морфолино)этанесульфоновая кислота (MES) pH 6.5, 3.5% (v/v) глицерол, 2 мМ дитиотрейтол (DTT), и 0,05% dodecyl maltoside (DDM).
- Приготовьте 10 мл реакционной смеси, содержащей 200 мм Tris-Cl pH 8.0, 8.0 mM MgCl2, 333 мМ KCl, и 67 мм NaCl.
ПРИМЕЧАНИЕ: Mg2 "требуется, чтобы хелат пирофосфат, как субстрат mPPase, Kq требуется для увеличения активности фермента, как TmPPase является калий зависимых mPPase, и Naq необходимо для фермента деятельности во время ионного транслокации натрия TmPPase. - Приготовьте 30 мг/мл липосом для реактивации ферментов.
- Добавьте 10 мл 20 мм Tris-HCl pH 8.0 с 1 мМ DTT до 0,3 г L-й-фосфатидиилхолина из сои до 10 мл 20 мм Tris-HCl pH 8.0 с 1 мм DTT.
- Положите липосому на лед, и sonicate с 1 секунды интервал импульса в течение 1 минуты, пауза в течение 1 минуты, и повторить, пока раствор становится прозрачным желтым.
- Aliquot липосомы, заморозить в жидком азоте и хранить при -80 градусов по Цельсию до использования.
- Реактивируйте фермент.
- Смешайте 40 зл раствора липосом с 22,5 л 20% ДДМ.
- Нагрейте смесь при температуре 55 градусов по Цельсию в течение 15 минут и дайте ей остыть до комнатной температуры.
- Добавьте 36,5 л раствора буфера реактивации, смешайте и добавьте 1 кл/л концентрированного белка (13 мг/мл), чтобы сделать общую концентрацию 0,13 мг/мл.
ПРИМЕЧАНИЕ: Белок обычно замораживается в 10 аликотах после очистки и оттаивает на льду перед использованием.
- Возьмите 20 qL реактивированного фермента и добавьте к 1480 л реакционной смеси, затем аккуратно перемешайте.
ПРИМЕЧАНИЕ: Добавление реактивированного фермента в реакционную смесь должно быть выполнено непосредственно перед его усвоение.
2. Комплексная подготовка
- Растворите соединения в диметилсульфодоксид (DMSO), чтобы сделать запас решения 25-100 мМ в 50-200 мл, на основе наличия соединений.
ПРИМЕЧАНИЕ: Все соединения, используемые здесь (Рисунок 2A) были опубликованы ранее9. Если растворимость соединения низкая, концентрация запасов может быть соответствующим образом скорректирована. - Подготовьте три различные концентрации каждого соединения в воде.
ПРИМЕЧАНИЕ: Окончательные концентрации в реакционной смеси будут 1, 5 и 50 микромоляров или 1, 5 и 20 микромолярных для растворимых и экономно растворимых соединений, соответственно.- Разбавить бульонраствора водой до 1 мл в микротрубках, чтобы дать 2 ММ, 10 мкм и 100 мкм для растворимых соединений, или же 2 мкм, 10 мкм и 40 мкм для экономно растворимых соединений.
- Vortex раствор соединения мгновенно после разбавления бульона раствор для правильного смешивания.
- Проверьте наличие агрегации соединений с помощью нефелометра.
ПРИМЕЧАНИЕ: Это было изучено как трипликируется в трех концентрациях (1 МКм, 5 мкм и 20 мкм) и нормализовалось до заготовки в 96 скважинной пластине.- Распределите 75 л реакционной смеси в каждую скважину с помощью многоканального пипетки.
- Добавьте 75 кл.с каждого соединения (для пустого, используйте 75 л воды вместо) и смешайте путем pipetting вверх и вниз 5 ".
- Измерьте каждый колодец при 300 В с помощью микроплитного нефелометра.
3. Реагенты для подготовки к ассею
- Приготовьте раствор арсенитов-цитрата.
- Взвесить 5 г арсенита натрия и 5 г тринатриевого цидрара.
ВНИМАНИЕ: Арсенит натрия является токсичным, поэтому используйте надлежащее защитное оборудование и ручку с особой осторожностью. В качестве меры предосторожности, не обрабатывать, прежде чем все необходимые меры предосторожности были прочитаны и поняты. Ручка только в дым овой капот, чтобы не вдыхать пыль / пары соединения или его решения (ы). При вдыхании, перейти на свежий воздух и получить медицинскую помощь. Носите соответствующие химические защитные очки безопасности, защитные перчатки и одежду, чтобы избежать приема и глаз / кожи контакта. При проглатывании немедленно позвоните в токсикологический центр или к врачу/врачу. Если он попадает на кожу или в глаза (ы), мыть с большим количеством воды и получить медицинскую помощь. - Растворите в 100 мл воды.
- Добавьте 5 мл ледниковой уксусной кислоты, перемешайте и добавьте воду до 250 мл.
- Хранить при комнатной температуре, защищенной от света.
ПРИМЕЧАНИЕ: Решение стабильно уже более года.
- Взвесить 5 г арсенита натрия и 5 г тринатриевого цидрара.
- Подготовьте решение А и решение B.
- Для раствора А добавьте 10 мл ледяного холода 0,5 м ЛЦ до 0,3 г аскорбиновой кислоты. Растворите аскорбиновую кислоту путем вихря.
- Для раствора B добавьте 1 мл ледяной воды в 70 мг гептамолибта аммония тетрагидрат и вихрь для растворения.
ПРИМЕЧАНИЕ: Храните оба раствора на льду до использования. Для согласованности результата, оба решения могут храниться на льду в течение максимум одной недели.
- Подготовьте фосфат (Pi) стандарт с концентрацией 0 мкм, 62,5 мкм, 250 мкм и 500 мкм для калибровки.
- Добавьте к четырем микротрубам, содержащим 370 л реакционных смесей, 0 qL, 25 qL, 50 л и 100 мКм 5 мМ Na2HPO4 dihydrate.
- Сверху до 1 мл с водой.
4. Деятельность асссы для одного 96 хорошо пластины
ПРИМЕЧАНИЕ: См. Рисунок 1 для схематического рабочего процесса асссея.
- Добавьте 1 мл раствора B до 10 мл раствора А, перемешайте путем вихря и храните раствор на льду.
ПРИМЕЧАНИЕ: Это решение должно быть прозрачным и желтым. Храните раствор А и В на льду в течение не менее 30 минут до его использования. Тем не менее, использовать решение в течение 3 ч, как это будет идти плохо после длительного хранения. - Добавьте 40 qL 0 мкм, 62.5 мкм, 250 мкм и 500 мкм Pi стандарт к прокладкам трубки в тройнике с помощью многоканального пипетка.
ПРИМЕЧАНИЕ: Реакция смесь без Pя добавил будет использоваться в качестве пробела. - Добавьте 25 зл и слой катактного раствора к прокладке трубки с помощью многоканального пипетки.
ПРИМЕЧАНИЕ: Каждое соединение имеет три различных концентрации в тройной, которая достаточна для первоначальной оценки половины максимальной ингибирующей концентрации (IC50). Для более точного определения IC50 можно использовать восемь различных концентраций соединений. Для раскованного фермента раствор соединения заменяется равным количеством воды. В качестве положительного контроля были использованы 2,5 мкм, 25 мкм и 250 мкм соли натрия имидодифосфата (ВПЛ). - Добавьте 15 юртей смеси раствора mPPase к прокладкам пробки (за исключением трубок, содержащих стандарт Pi) с помощью многоканальной пипетки.
- Печать полоски трубки с клейу уплотнения листа. Вырезать уплотнения лист, чтобы отделить каждую полосу трубки.
- Предварительно инкубировать образцы в течение 5 мин при 71 градусах Цельсия. Поместите образцы на нагревательный блок с интервалом 20 с интервалом между каждой полосой, чтобы свести к минимуму время потребления во время последующих шагов.
- Для каждой полосы откройте клейгерие. Добавьте 10 л из 2 мМ пирофосфата натрия dibasic с помощью многоканальной пипетки и перемешайте трубацией вверх и вниз в течение 5 ". Печать полосы трубки снова с помощью того же уплотнения.
ПРИМЕЧАНИЕ: Этот шаг может быть первоначально трудно выполнить в 20 с; однако, это станет легче после некоторых анализов. - Инкубировать при 71 градусах по Цельсию в течение 5 мин.
- Поместите образцы на охлаждающий аппарат с интервалом 20 с интервалом между каждой полосой. Дайте им остыть в течение 10 мин, но центрифуга каждой полосе кратко после 5 минут охлаждения, чтобы decant капли воды под уплотнительного листа, а затем положить его обратно в охлаждающий аппарат и удалить уплотнения.
ПРИМЕЧАНИЕ: Охлаждающий аппарат может быть просто сделано путем размещения 96 хорошо ПЦР пластины на полистирол Петри блюдо (размер 150 мм и 15 мм) заполнены водой и заморожены, по крайней мере 1 ч. Аппарат должен быть вывезен из морозильной камеры около 5 минут до начала асссе. Не вынимайте охлаждающий аппарат прямо перед охлаждением образца, так как он заморозит реакционную смесь и затруднит развитие цвета. - После 10 минут охлаждения добавьте 60 л раствора А и В, смешайте трубачат вверх и вниз в течение 5 "и держите прокладки трубки на охлаждающем аппарате в течение 10 минут.
- Добавьте 90 л раствора арсенита и держите при комнатной температуре не менее 30 минут, чтобы создать стабильный синий цвет.
ВНИМАНИЕ: Из-за своей токсичности все растворы, содержащие арсенит натрия, должны быть обработаны с дополнительной осторожностью в любое время. Таким образом, добавление раствора арсенита-цитрата должно быть сделано в дымовом капюшоне. - Распределите 180 л каждой реакционной смеси в чистую 96 скважину полистирола микроплитой.
- Измерьте абсорбцию каждой скважины на уровне 860 нм с помощью микроплитного спектрофотометра.
5. Анализ результатов
- Среднее трипликации каждого образца и стандарты Pi. Затем вычесть с пустым для устранения фонового сигнала.
- Сделайте кривую калибровки, назначая значения абсорбции (A860)на фоне значения стандарта Pi (nmol) и выполните линейную регрессию для получения функции тренда с помощью следующей формулы:
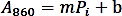
- Рассчитайте количество фосфатов (нмол), высвобожденое из ферментатической реакции на основе формулы линейной регрессии выше.
- Рассчитайте конкретное занятие с помощью следующей формулы:
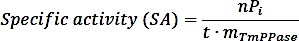
где nPi - это количество фосфатов, выделяемых в результате реакции (нмол), т время реакции (мин), а mTmPPase - это количество чистого TmPPase, используемого в ассе (мг). - Рассчитайте процентную активность для каждой концентрации ингибитора, используя следующую формулу:
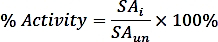
где SAisспецифическая деятельность образца с ингибитором и SAun специфическая деятельность раскованного образца. - Рассчитайте logIC50 (оценка) и IC50 (оценка) с нелинейным регрессией, подходящей из кривой доза-реакции из четырех параметров, используя следующую формулу:
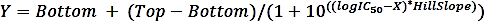
где X является журнал концентрации (ММ), Y является активность (%), Сверху и снизу являются плато в том же блоке, как Y (100% и 0%, соответственно), logIC50 имеет те же единицы журнала, как X, и HillSlope - фактор наклона или склон аплода, который является безеленным.
ПРИМЕЧАНИЕ: Программное обеспечение (Таблица материалов) используется для установки. Используйте концентрацию 0,01 мкм (вместо 0,00 мкм) для образца без ингибитора, так как logarithm нуля не определен.
Результаты
В этом протоколе, восемь соединений (рисунок 2A ) были протестированы(Рисунок 2A) вместе с ВПЛ, общим ингибитором пирофосфатаз, в качестве положительного контроля. Каждое соединение было протестировано в трех различных концентрациях (1 МКм, 5 мкм и 20 мкм) в тройном. Рабочий процесс скрининга изображен на рисунке 1,начиная с подготовки образца и реагента до измерения абсорбции на уровне 860 нм.
В конце этого протокола, после добавления раствора А З В и арсенит-цитрат, растворы развивают стабильный синий цвет с максимальным поглощением на уровне 709 нм и 860 нм14 благодаря сложному образованию фосфатных ионов с молибдатом, которые можно наблюдать и показывает возникновение ферментатической реакции. Для этого эксперимента, мы используем абсорбцию на 860 нм для измерения PI количество освобождено, как он имеет лучший предел обнаружения и чувствительность по сравнению с абсорбцией на 709 нм15. Синий цвет полностью развит в 30 минут инкубации при комнатной температуре и стабилен, по крайней мере 5 ч14. Анализ имеет чувствительность до Pi концентрации 10 мкм и абсорбции является линейным в течение диапазона концентрации 10-800 мкм14. В репрезентативном результате здесь, скважины E1'E3(Рисунок 2C) содержат реакционную смесь без ингибитора и синий раствор может наблюдаться в конце ассе. Это также можно наблюдать при низких концентрациях соединения, где полное ингибирование не было достигнуто, как и в скважинах F1-F3 для ВПЛ и скважин A4-A6 для соединения 1 (ATC, недавно известный неконкурентоспособный ингибитор TmPPase9) при концентрации 2,5 мкм и 1 МКм, соответственно. Чем выше концентрация ВПЛ и соединения 1,тем меньше синего цвета можно наблюдать (G1-G3 и H1-H3 для ВПЛ и B4-B6 и C4-C6 для соединения 1),что указывает на ингибирование ферментатической активности. Все три концентрации неингибирующих соединений(2, 3и 8)отображаются с той же интенсивностью синего цвета, что и скважины E1-E3 без ингибитора(рисунок 2С).
После измерения абсорбции на уровне 860 нм данные могут быть обработаны и проанализированы (см. раздел протокола 5). На рисунке 2D показан калибровочный участок стандарта Pi с его линейной фитингом (y 0.0576x 0.0019; р2 и 0,999). На рисунке 3 показан сюжет ферментативной деятельности (%) против концентрации каждого исследуемого соединения. Для соединений с ингибирующей активностью также показана нелинейная кривая установка. ВПЛ, используемые в качестве позитивного контроля, ясно свидетельствуют о снижении активности при более высокой концентрации. IC50 (оценка), рассчитанная на основе трех различных концентраций, составляет 88,2 мкм(таблица 1),что аналогично предыдущему измерению (80,0 мкм) с восемью концентрационными точками14. Соединения 1, 4, 5, 6, и 7 показали аналогичную тенденцию, как ВПЛ, так как концентрация увеличилась с IC50 (оценка) примерно 1,3 мкм, 7,4 мкм, 19,0 мкм, 37,4 мкм, и 156,1 мкм, соответственно(таблица 1). Для соединений 2, 3и 8 не может быть замечено снижение активности или ингибирования при концентрациях асссе. Дополнительный ассс с восемью точками концентрации может быть сделано для создания точного IC50. На рисунке 4 показана кривая торможения для соединений 1, 5, 6, 7 и 8 с IC50 из 1,7 мкм, 21,4 мкм, 58,8 мкм, 239,0 мкм и йgt;500 мкм, соответственно9.
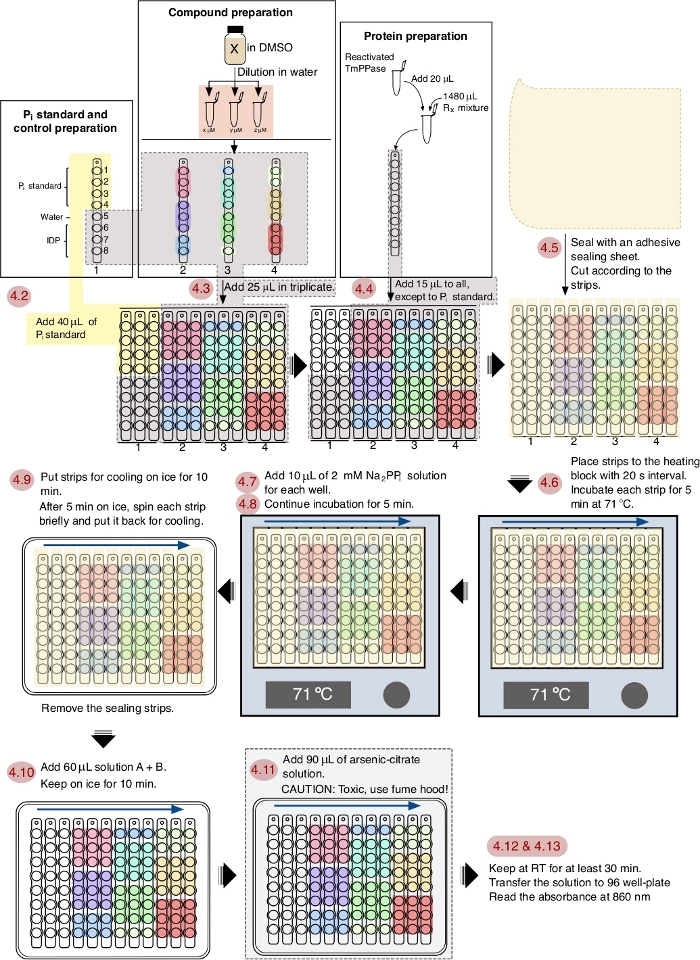
Рисунок 1: Схематический рабочий процесс ингибирования TmPPase в формате 96 скважин. Красная нумеровка показывает шаги ассеа в соответствии с протоколом, а синие стрелки показывают интервальный ордер. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
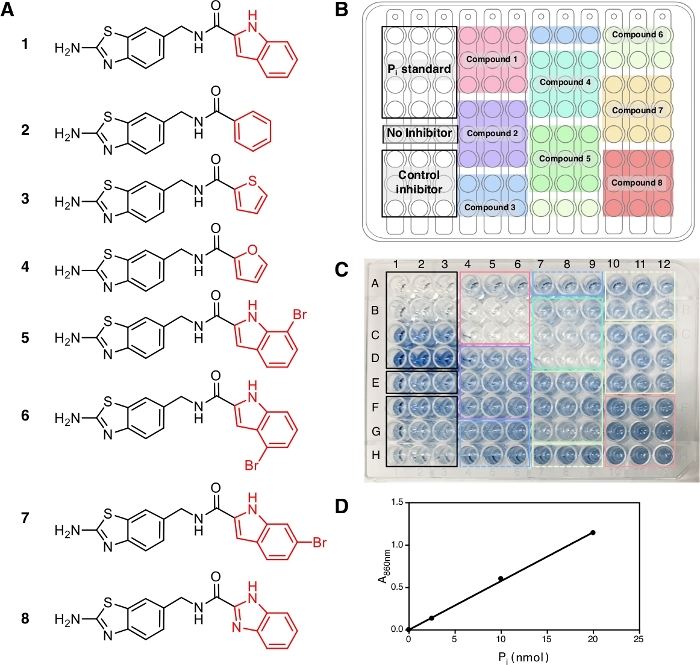
Рисунок 2: Образцы, их расположение и развитие цвета в 96 хорошо пластины. (A) Структуры соединений 1и8, используемых для асссе. Ингибирующая активность этих соединений была зарегистрирована в Vidilaseris и др.9. (B) Схема образца. (C) Развитие цвета, 30 мин после добавления раствора арсенита-цитрата. Концентрации контрольного ингибитора (IdP) и используемых образцов, расположенных сверху донизу, составляют 2,5 мкм, 25 мкм и 250 мкм концентрации и 1 МКм, 5 мкм и 20 мкм концентрации, соответственно. Интенсивность синего цвета соответствует количеству Pi, выпущенного из-за ферментативной реакции, а отсутствие цвета не соответствует ферментативной реакции. (D) Кривая калибровки для стандарта Pi (nmol) против A860 с линейной фитингом (y 0.0576x 0.0019; р2 и 0,999). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
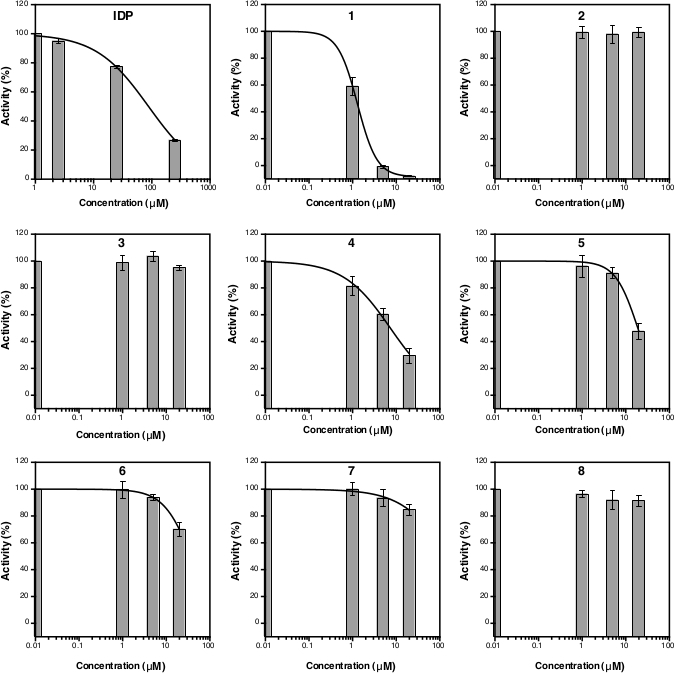
Рисунок 3: Кривая активности TmPPase процентов для трех различных концентраций ингибитора. Кривые нелинейной регрессии для расчета IC50 (оценка) показаны для ВПЛ, а также для соединений 1, 4, 5, 6 и 7, но не для соединений 2, 3и 8, поскольку они не подавляют активность TmPPase в концентрациях. LogIC50 и IC50 (оценка) каждого соединения показаны в таблице 1. Все данные отображаются как средние SD с тремя репликациями. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Кривая ингибирования из восьми точек концентрации соединений 1, 5, 6, 7 и 8. Эта цифра взята из Vidilaseris и др.9 с небольшими изменениями. Все данные отображаются как средние SD с тремя репликациями. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Образец | LogIC50 | IC50 (оценка) (ММ) |
| Idp | 1,95 х 0,0142 | 87,9 и 2,46 |
| 1 | 0,112 и 0,0274 | 1,29 и 0,0816 |
| 2 | − | без торможения |
| 3 | − | без торможения |
| 4 | 0,870 и 0,0447 | 7,39 х 0,760 |
| 5 | 1,28 и 0,0296 | 19.0 и 1,29 |
| 6 | 1,57 и 0,0846 | 37,4 и 7,29 |
| 7 | 2,19 и 0,366 | 156 х 131 |
| 8 | − | без торможения |
Таблица 1: LogIC50 и IC50 (оценка) ВПЛ и соединений 1'8 на основе данных на рисунке 3.
Обсуждение
Здесь мы сообщаем подробный протокол для простого скрининга ингибиторов для мембранной пирофосфатазы от T. maritima в 96 хорошо пластины форматна на основе Vidilaseris и др.14. Этот протокол недорог и основан на 12-фофофофлибдной кислоте, которая образуется из ортофосфата и молибдата в кислых условиях и сводится к фофофомолибдному виду с отчетливым синим цветом12. Этот метод является предпочтительным по сравнению с другими протоколами, такими как более чувствительный малахит зеленый ассса16, потому что этот метод не показывает вмешательства в наличие высокой концентрации фосфолипидов, которая необходима для реактивации TmPPase14.
Рабочий процесс протокола скрининга изображен на рисунке 1, и этот процесс может быть полностью выполнен в 1 ч. Этот протокол оптимизирован для TmPPase с оптимальной рабочей температурой в 71 градусов по Цельсию и 5 минут времени реакции. Поскольку вода будет испаряться при такой температуре от реакционной смеси, клейовый уплотнительный лист (нарезанный, чтобы соответствовать и покрывать полоски) применяется для предотвращения испарения14 и испаряется вода просто вспоминается с центрифугированием. 5 мин инкубации время выбрано, как он все еще находится в линейном диапазоне ферментативно выпустила фосфат и достаточно для надежного скрининга14. В этом протоколе, сроки и трубач ные навыки являются важными факторами для получения хорошего и надежного результата. Добавление реагентов во время асссеса с интервалом 20 с интервалом между полосами является оптимизированным вариантом синхронизации для удобства выполнения последующих шагов.
Для различных mPPases оптимальная температура и время инкубации должны быть определены отдельно перед использованием в ингибировании асссеев. Протокол реактивации ферментов выше оптимизирован для TmPPase и других mPPases, возможно, потребуется другой протокол реактивации. Например, DDM не следует добавлять для реактивации mPPase из Pyrobaculum аэрофилума, как это снизит его ферментативной активности17. Поскольку фермент станет менее активным, если его готовить заблаговременно, добавление реактивированного фермента следует добавить в реакционную смесь незадолго до начала проверки. После добавления раствора арсенита-цитрата реакционный продукт стабилен не менее 5 ч14. Таким образом, следующая партия ассеа может быть выполнена немедленно, и измерение абсорбции может быть сделано позже для всех партий сразу.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантами от Фонда Джейн и Аатоса Эркко и BBSRC (BB/M021610) Адриану Голдману, Финляндская академия (No 308105) Кени Видилазерису (No 310297) Анри Хаарду и (No 265481) Яри Или-Каухалуоме, а Исследовательский фонд Хельсинкского университета - Густаву Бойе аф Геннесу. Авторы благодарят Бернадетт Гель за техническую помощь во время проекта.
Материалы
| Name | Company | Catalog Number | Comments |
| Adhesive sealing sheet | Thermo Scientific | AB0558 | |
| Ammonium heptamolybdate tetrahydrate | Merck | F1412481 636 | |
| Ascorbic acid | Sigma-Aldrich | 95212-250G | |
| BioLite 96Well Multidish | Thermo Scientific | 130188 | |
| Dimethyl sulfoxide (DMSO) | Merck | 1167431000 | |
| 8-well PCR Tube Strips 0.2 ml without caps (120) | Nippon genetics | FG-028 | |
| Dodecyl maltoside (DDM) | Melford | B2010-100G | |
| Ethanol | Merck | 1009901001 | |
| Glacial acetic acid | Merck | 1000631011 | |
| Hydrochloric acid | Sigma-Aldrich | 258148-500ML | |
| Imidodiphosphate sodium salt | Sigma-Aldrich | I0631-1G | |
| L-α-Phosphatidyl choline from soybean lecithin | Sigma | 429415-100GM | |
| Magnesium chloride | Sigma-Aldrich | 8147330500 | |
| Multiplate 96-Well PCR Plates | Bio-Rad | MLL9651 | |
| MultiSkan Go | Thermo Scientific | 10680879 | |
| Nepheloskan Ascent (Type 750) | Labsystems | ||
| Polystyrene Petri dish (size 150 mm x 15 mm) | Sigma-Aldrich | P5981-100EA | |
| Potassium chloride | Merck | 104936 | |
| Prism 6 software | GraphPad | ||
| QBT2 Heating block | Grant Instruments | ||
| Sodium meta-arsenite | Fisher Chemical | 12897692 | |
| Sodium phosphate dibasic (Pi) | Sigma | S0876-1KG | |
| Sodium pyrophosphate dibasic | Fluka | 71501-100G | |
| Trisodium citrate dihydrate | Fluka | 71404-1KG |
Ссылки
- Terstappen, G. C., Reggiani, A. In silico research in drug discovery. Trends in Pharmacological Sciences. 22 (1), 23-26 (2001).
- Rask-Andersen, M., Almen, M. S., Schioth, H. B. Trends in the exploitation of novel drug targets. Nature Reviews Drug Discovery. 10 (8), 579-590 (2011).
- Shah, N. R., Vidilaseris, K., Xhaard, H., Goldman, A. Integral membrane pyrophosphatases: a novel drug target for human pathogens. AIMS Biophysics. 3 (1), 171-194 (2016).
- Baykov, A. A., Malinen, A. M., Luoto, H. H., Lahti, R. Pyrophosphate-Fueled Na+ and H+ Transport in Prokaryotes. Microbiology and Molecular Biology Reviews. 77 (2), 267-276 (2013).
- Serrano, A., Perez-Castineira, J. R., Baltscheffsky, M., Baltscheffsky, H. H+-PPases: yesterday, today and tomorrow. IUBMB Life. 59 (2), 76-83 (2007).
- Liu, J., et al. A vacuolar-H+-pyrophosphatase (TgVP1) is required for microneme secretion, host cell invasion, and extracellular survival of Toxoplasma gondii. Molecular Microbiology. 93 (4), 698-712 (2014).
- Lemercier, G., et al. A pyrophosphatase regulating polyphosphate metabolism in acidocalcisomes is essential for Trypanosoma brucei virulence in mice. Journal of Biological Chemistry. 279 (5), 3420-3425 (2004).
- Belogurov, G. A., et al. Membrane-bound pyrophosphatase of Thermotoga maritima requires sodium for activity. Biochemistry. 44 (6), 2088-2096 (2005).
- Vidilaseris, K., et al. Asymmetry in catalysis by Thermotoga maritima membrane-bound pyrophosphatase demonstrated by a nonphosphorus allosteric inhibitor. Science Advances. 5 (5), (2019).
- Lin, S. M., et al. Crystal structure of a membrane-embedded H+-translocating pyrophosphatase. Nature. 484 (7394), 399-403 (2012).
- Fiske, C. H., Subbarow, Y. The colorimetric determination of phosphorus. Journal of Biological Chemistry. 66 (2), 375-400 (1925).
- Nagul, E. A., McKelvie, I. D., Worsfold, P., Kolev, S. D. The molybdenum blue reaction for the determination of orthophosphate revisited: Opening the black box. Analytica Chimica Acta. 890, 60-82 (2015).
- Kellosalo, J., Kajander, T., Palmgren, M. G., Lopez-Marques, R. L., Goldman, A. Heterologous expression and purification of membrane-bound pyrophosphatases. Protein Expression and Purification. 79 (1), 25-34 (2011).
- Vidilaseris, K., Kellosalo, J., Goldman, A. A high-throughput method for orthophosphate determination of thermostable membrane-bound pyrophosphatase activity. Analytical Methods. 10 (6), 646-651 (2018).
- He, Z. Q., Honeycutt, C. W. A modified molybdenum blue method for orthophosphate determination suitable for investigating enzymatic hydrolysis of organic phosphates. Communications in Soil Science and Plant Analysis. 36 (9-10), 1373-1383 (2005).
- Martin, B., Pallen, C. J., Wang, J. H., Graves, D. J. Use of fluorinated tyrosine phosphates to probe the substrate specificity of the low molecular weight phosphatase activity of calcineurin. Journal of Biological Chemistry. 260 (28), 14932-14937 (1985).
- Strauss, J., Wilkinson, C., Vidilaseris, K., Harborne, S. P. D., Goldman, A. A simple strategy to determine the dependence of membrane-bound pyrophosphatases on K+ as a cofactor. Methods in Enzymology. 607, 131-156 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены