Method Article
써모토가 마리티마 멤브레인 경계 파이로포스파타제 억제제 스크리닝
* 이 저자들은 동등하게 기여했습니다
요약
여기에서 우리는 96 웰 플레이트 포맷에서 몰리브덴 청색 반응에 기초한 막 결합 된 열광파타제 (Thermotoga maritima에서)억제제에 대한 스크리닝 방법을 제시한다.
초록
막 결합 된 열광파타제 (mPPases)는 박테리아, 고고학, 식물 및 프로티스트 기생충에서 발생하는 디메라 효소입니다. 이 단백질은 양성자 및 /또는 나트륨 이온이 막을 가로 질러 펌핑과 결합된 두 개의 정형 외과 인산염 분자로 파이로 포스페이트를 갈라. 동물과 인간에서 상동성 단백질이 발생하지 않았기 때문에 mPPases는 잠재적인 약물 표적의 설계에 좋은 후보입니다. 여기서 우리는 96 웰 플레이트 시스템에서 몰리브덴 청색 반응을 활용하는 mPPase 억제제에 대한 상세한 프로토콜을 제시한다. 우리는 모델 효소로 열성 박테리아 써모토가 마리티마 (TmPPase)에서 mPPase를 사용합니다. 이 프로토콜은 간단하고 저렴하여 일관되고 강력한 결과를 생성합니다. 분석의 시작부터 흡광도 측정까지 활성 분석 프로토콜을 완료하는 데 약 1시간 밖에 걸리지 않습니다. 이 분석에서 생성된 청색은 오랜 기간 동안 안정되기 때문에, 후속 분석은 이전 배치 직후에 수행될 수 있으며, 흡광도는 나중에 모든 배치에 대해 한 번에 측정될 수 있다. 이 프로토콜의 단점은 수동으로 수행되므로 파이펫팅 및 시간 유지의 좋은 기술을 필요로 할뿐만 아니라 소진 될 수 있다는 것입니다. 또한,이 분석법에 사용되는 비소 - 구연산염 용액은 독성이 있으며 필요한 예방 조치로 처리되어야하는 나트륨 비소염을 포함합니다.
서문
총 세포 단백질의 약 25%는 막 단백질이고 그 중 약 60%는 약물 표적1,2입니다. 잠재적인 약물 표적 중 하나인3,막 결합 된 열광파타스 (mPPases)는 양성자 및 / 또는 나트륨 이온을 두 개의 정형 외과 인산염으로 열분해하여 막을 가로 질러 펌핑하는효소입니다 4. mPPases는 인간과동물을제외하고 박테리아, 고고학, 식물 및 프로티스트 기생충과 같은 다양한 유기체5에서 발견될 수 있습니다 4. 프로티스트 기생충에서, 예를 들어 플라스모듐 팔시파룸, 톡소플라즈마 곤디, 트리파노소마 브루시,mPPases는 기생충 에서 이러한 발현의 결손증6 및 녹아웃에 필수적이며 외부 기본pH7에노출시 세포내 pH를 유지하는 데 실패로 이어진다. 척추동물에 존재하는 상동 단백질의 중요성과 부족으로 인해 mPPases는 프로티스탈 질환에 대한 잠재적 인 약물 표적으로 간주 될 수 있습니다3.
이 작품에서 mPPase 억제제의 시험관 내 스크리닝은 TmPPase 모델 시스템을 기반으로 합니다. TmPPase는 T. 마리티마에서 나트륨 이온 펌핑 및 칼륨 이온 의존 mPPase이며 71 °C8에서최적의 활성을 갖는다. 이 효소의 장점은 예를 들어 생산 및 정제의 용이성, 좋은 열 안정성 및 높은 특정 활성입니다. TmPPase는 프로티스트 mPPases3,9 및 비냐 라디에타10 mPPase의 해결 된 구조에 대한 모든 촉매 잔류물의 완전한 보존뿐만 아니라 위치의 완전한 보존뿐만 아니라 높은 유사성을 나타낸다. 다른 적합성에서 TmPPase의 사용 가능한 구조는 구조 기반 약물 설계 실험 (가상 스크리닝 및 de novo 설계)에도 유용합니다.
여기서 우리는 96 웰 플레이트 포맷으로 TmPPase 억제제의 스크리닝을 위한 상세한 프로토콜을 보고한다(도1). 이 프로토콜은 먼저 Fiske 및 Subbarow11에의해 개발된 몰리브덴 청색 반응의 대색 방법을 기반으로 합니다. 이 방법은 산성 조건 하에서 정형 외과 스포산염및 몰리브데이트에서 12-인산성 산의 형성을 수반하며, 이는 특징적인 청색 인화질 종12종을주기 위해 감소된다.
프로토콜
1. 단백질 준비
참고: TmPPase의 발현 및 정제는 다른곳에서 13에기술되었습니다.
- 20 mM-(N-morpholino)에탄에설포닉산(MES) pH 6.5, 3.5% (v/v) 글리세롤, 2 mM 디티오트레이톨(DTT) 및 0.05% 도데실 말토사이드(DDM)를 함유하는 재활성화 완충액의 10 mL을 준비한다.
- 200 mM Tris-Cl pH 8.0, 8.0 mM MgCl2,333 mM KCl 및 67 mM NaCl을 포함하는 반응 혼합물의 10 mL을 준비한다.
참고: Mg2+는 mPPase의 기질로서 파이로포스페이트에 chelate하는 데 필요하며,K+는 TmPPase가 칼륨 의존성 mPPase로서 효소 활성을 증가시키는 데 필요하며,Na+는 TmPPase에 의한 나트륨 이온 전좌 동안효소 활성에 필요하다. - 효소 재활성화를 위해 30 mg/mL 리포솜을 준비하십시오.
- 10 mL의 20 mM 트리스-HCl pH 8.0을 1 mMDTT와 1 mM DTT를 추가하여 1mMM DTT를 사용하여 20 mM Tris-HCl pH 8.0의 10 mL에 대두에서 L-α-phosphatidylcholine0.3 g에 1mMDTT를 추가합니다.
- 리포솜을 얼음 위에 올려 놓고 1초 동안 1초의 펄스 간격으로 초음파 처리한 다음 1분 동안 일시 중지한 다음 용액이 투명하게 노랗게 될 때까지 반복합니다.
- 리포좀을 알리쿼트하고 액체 질소로 얼리고 사용 될 때까지 -80 °C에서 보관하십시오.
- 효소를 다시 활성화합니다.
- 리포솜 용액 40 μL을 20% DDM의 22.5 μL과 혼합합니다.
- 혼합물을 55 °C에서 15 분 동안 가열하고 실온으로 식힙니다.
- 재활성화 완충액 36.5 μL을 넣고 혼합하고 농축 단백질 1 μL(13 mg/mL)을 추가하여 총 농도가 0.13 mg/mL입니다.
참고: 단백질은 일반적으로 정제 후 10 μL aliquots로 동결되고 사용하기 전에 얼음에 해동됩니다.
- 재활성화된 효소의 20 μL을 취하고 반응 혼합물의 1,480 μL에 추가한 다음 부드럽게 섞습니다.
참고 : 반응 혼합물에 재 활성화 된 효소를 첨가하면 사용 직전에 수행해야합니다.
2. 화합물 준비
- 디메틸 설폭사이드(DMSO)에 화합물을 용해하여 화합물의 가용성에 따라 50-200 μL에서 25-100 mM의 재고 용액을 만듭니다.
참고: 여기에 사용된 모든화합물(그림 2A)은이전에9. 화합물 용해도가 낮은 경우, 재고 농도는 그에 따라 조정될 수 있다. - 물에 각 화합물의 세 가지 다른 농도를 준비합니다.
참고: 반응 혼합물의 최종 농도는 각각 1, 5 및 50 마이크로몰 또는 1, 5 및 20 마이크로몰로 수용성 및 아껴서 수용성 화합물에 대한 것입니다.- 용해성 화합물에 대해 2 μM, 10 μM 및 100 μM을 제공하기 위해 마이크로튜브에서 물로 1 mL로 스톡 용액을 희석하거나, 아껴서 수용성 화합물에 대해 2 μM, 10 μM 및 40 μM을 제공합니다.
- 적절한 혼합을 위해 스톡 용액의 희석 후 즉시 화합물 용액을 소용돌이.
- nephelometer를 사용하여 복합 집계를 확인합니다.
참고: 이것은 3개의 농도(1 μM, 5 μM 및 20 μM)에서 삼중체로서 연구되었고, 96웰 플레이트에서 블랭크로 정규화하였다.- 멀티채널 파이펫을 사용하여 각 웰내로 반응 혼합물의 75 μL을 분배한다.
- 각 화합물의 75 μL을 추가하고 (빈 경우 75 μL의 물을 대신 사용하십시오) 위아래로 5 ×로 섞습니다.
- 마이크로 플레이트 nephelometer를 사용하여 300V에서 각 잘 측정합니다.
3. 분석 준비를위한 시약
- 비소성 구연산염 용액을 준비합니다.
- 비소나트륨 5 g과 구연산 나트륨 디하이드레이트 5 g의 무게를 측정하십시오.
주의: 비소 나트륨은 독성이 있으므로 적절한 보호 장비를 사용하고 특별한주의를 기울여 처리하십시오. 예방 조치로서 필요한 모든 안전 예방 조치를 읽고 이해하기 전에 는 처리하지 마십시오. 화합물 또는 용액의 먼지 /증기를 흡입하지 않도록 연기 후드에서만 취급하십시오. 흡입하면 신선한 공기로 이동하여 의사의 진료를 받으하십시오. 섭취와 눈/피부 접촉을 피하기 위해 적절한 화학 안전 고글, 보호 장갑 및 의류를 착용하십시오. 삼켰을 경우 즉시 독극물 센터 나 의사 / 의사에게 전화하십시오. 피부나 눈에 닿으면 충분한 물로 씻고 의사의 진료를 받으라. - 100 mL의 물에 녹입니다.
- 5 mL의 빙하 아세트산을 넣고 섞은 다음 물을 250 mL에 추가합니다.
- 빛으로부터 보호된 실온에서 보관하십시오.
참고 : 솔루션은 1 년 이상 안정적입니다.
- 비소나트륨 5 g과 구연산 나트륨 디하이드레이트 5 g의 무게를 측정하십시오.
- 솔루션 A 및 솔루션 B를 준비합니다.
- 용액 A의 경우, 얼음 차가운 0.5 M HCl 10 mL을 아스코르브 산 0.3 g에 추가하십시오. 소용돌이에 의해 아스코르브 산을 용해.
- 용액 B의 경우, 녹을 수 있는 테트라하이드레이트와 소용돌이를 70 mg의 암모늄 헵타몰리브데이트에 얼음 차가운 물 1 mL을 추가합니다.
참고: 두 가지 용액을 모두 사용할 때까지 얼음 위에 보관하십시오. 분석 결과의 일관성을 위해 두 용액을 최대 1 주일 동안 얼음에 저장할 수 있습니다.
- 캘리브레이션을 위해 0 μM, 62.5 μM, 250 μM 및 500 μM의 농도로 인산염(Pi)표준을 준비합니다.
- 반응 혼합물의 370 μL을 함유하는 4개의 마이크로튜브에 5 mMNa 2HPO 4 의 0 μL, 25 μL, 및 100μL을 첨가한다.
- 최대 1mL의 물로 물을 마시면 됩니다.
4. 96 웰 플레이트 1개에 대한 활동 분석
참고: 분석의 회로도 워크플로우에 대해서는 그림 1을 참조하십시오.
- 용액 B 10 mL에 1 mL를 추가하고, 소용돌이에 섞어서 용액을 얼음에 저장하십시오.
참고: 이 솔루션은 투명하고 노란색이어야 합니다. 사용 하기 전에 적어도 30 분 동안 얼음에 용액 A + B를 유지 합니다. 그러나 장기 보관 후 불량이 될 수 있으므로 3 시간 이내에 솔루션을 사용하십시오. - 멀티채널 파이펫을 사용하여 튜브 스트립에 40 μM, 62.5 μM, 250 μM 및 500 μM Pi 표준을 추가합니다.
참고 :P가 첨가되지 않은 반응 혼합물은 공백으로 사용됩니다. - 멀티채널 파이펫을 사용하여 튜브 스트립에 25 μL의 화합물 용액을 추가합니다.
참고: 각 화합물은 반 최대 억제 농도 (IC50)의초기 추정에 충분 한 삼중 항에 세 가지 다른 농도. 보다 정확한 IC50 측정을 위해 8가지 화합물 농도를 사용할 수 있습니다. 억제되지 않은 효소의 경우 화합물 용액은 동일한 양의 물로 대체됩니다. 양성 대조군으로서 2.5 μM, 25 μM, 및 250 μM의 이미다이드포스페이트(IDP) 나트륨 염을 사용하였다. - 멀티채널 파이펫을 사용하여 튜브 스트립(Pi 표준을 포함하는 튜브 제외)에 15 μL의 mPPase 용액 혼합물을 추가합니다.
- 튜브 스트립을 접착제 밀봉 시트로 밀봉합니다. 각 튜브 스트립을 분리하기 위해 밀봉 시트를 잘라.
- 71°C에서 5분 동안 샘플을 미리 배양하였다. 후속 단계 동안 소비 시간을 최소화하기 위해 각 스트립 사이에 20 s 간격으로 가열 블록에 샘플을 놓습니다.
- 각 스트립에 대해 접착제 밀봉을 엽니다. 멀티채널 파이펫을 사용하여 2 mM 나트륨 파이로포스페이트 디베이직 10 μL을 추가하고 위아래로 5×로 파이펫팅하여 섞습니다. 동일한 밀봉을 사용하여 튜브 스트립을 다시 밀봉하십시오.
참고: 이 단계는 처음에는 20초 안에 수행하기 어려울 수 있습니다. 그러나, 그것은 몇 가지 asays 후 쉽게 될 것입니다. - 71°C에서 5분 동안 배양합니다.
- 각 스트립 사이에 20s 간격으로 냉각 장치에 샘플을 놓습니다. 10 분 동안 식히지만 냉각 5 분 후에 각 스트립을 잠시 원심 분리하여 밀봉 시트 아래에 물을 떨어 뜨린 다음 냉각 장치에 다시 넣고 밀봉을 제거하십시오.
참고 : 냉각 장치는 단순히 적어도 1 시간 동안 물로 채워진 폴리스티렌 페트리 접시 (크기 150mm × 15mm)에 96 웰 PCR 플레이트를 배치하여 만들 수 있습니다. 장치는 분석의 시작 전에 약 5 분 냉동고에서 꺼내야한다. 반응 혼합물을 동결시키고 색상 개발을 방해하기 때문에 시료 냉각 직전에 냉각 장치를 꺼내지 마십시오. - 10분 동안 냉각한 후 용액 A + B 60 μL을 추가하고, 5×로 위아래로 파이펫팅하여 혼합하고 튜브 스트립을 냉각 장치에 10분 동안 유지합니다.
- 비소산 구연산액 90 μL을 첨가하고 실온에서 30분 이상 유지하여 안정적인 청색을 생성합니다.
주의: 독성으로 인해 비소 나트륨을 함유 한 모든 솔루션은 항상 각별한주의를 기울여 처리해야합니다. 따라서, 비소성 구연산액의 첨가는 연기 후드에서 이루어져야한다. - 각 반응 혼합물의 180 μL을 투명한 96 웰 폴리스티렌 마이크로플레이트에 분배한다.
- 마이크로 플레이트 분광광도계를 사용하여 860 nm에서 각 우물의 흡광도를 측정합니다.
5. 결과 분석
- 각 샘플및Pi 표준의 평균 세 배입니다. 그런 다음 빈 으로 빼서 배경 신호를 제거합니다.
- Pi 표준(nmol)의 양에 대해 흡광도(A860)값을 플로팅하여 보정 곡선을 만들고 선형 회귀를 수행하여 다음 공식을 사용하여 추세선 함수를 얻습니다.
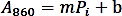
- 상기 선형 회귀 식에 기초하여 효소 반응으로부터 방출된 인산염 양(nmol)을 계산한다.
- 다음 수식을 사용하여 특정 활동을 계산합니다.
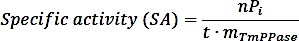
여기서 nPi는 반응(nmol)으로부터 방출되는 인산염의 양이고, t는 반응 시간(min), 및 mTmPPase는 분석(mg)에 사용되는 순수한 TmPPase의 양이다. - 다음 공식을 사용하여 각 억제제 농도에 대한 백분율 활성을 계산합니다.
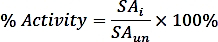
여기서 SAi는억제제 및 SAun을 가진 샘플의 특정 활성은 억제되지 않은 샘플의 특정 활성이다. - 다음 공식을 사용하여 4개의 파라미터 용량-응답 곡선에서 비선형 회귀 적합으로 logIC50(추정) 및 IC 50(추정값)을 계산합니다.
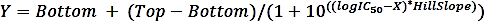
여기서 X는 농도로그(μM), Y는 활동(%) 이고, 상부와 하부는 Y(각각 100% 및 0%)와 동일한 단위의 고원이며, logIC50은 X와 동일한 로그 단위를 가지며, HillSlope = 경사계수 또는 언덕 경사도는 단위가 없는 것입니다.
참고 : 소프트웨어(재료 표)는피팅에 사용됩니다. 0의 로그렘이 정의되지 않았기 때문에 억제제없이 샘플에 대해 0.01 μM (대신 0.00 μM)의 농도를 사용하십시오.
결과
본 프로토콜에서, 8개의 화합물(1−8)을 양성 대조군으로서 열포염의 일반적인 억제제인 IDP와 함께 시험하였다(도2A). 각 화합물은 삼중항에서 3개의 상이한 농도(1 μM, 5 μM 및 20 μM)에서 시험하였다. 스크리닝의 워크플로우는 샘플 및 시약 준비부터 860 nm의 흡광도 측정까지 의 도 1에도시되어 있습니다.
이 프로토콜의 끝에서, 용액 A + B 및 비소성 구연산염의 첨가 후, 용액은 관찰 될 수있는 몰리브데이트와 인산이온의 복잡한 형성으로 인해 709 nm 및 860 nm14에서 최대 흡수와 안정적인 푸른 색을 개발하고 효소 반응의 발생을 보여줍니다. 본 실험을 위해, 우리는 709 nm15에서흡광도에 비해 검출 한계 및 감도가 더 우수하기 때문에 방출된 Pi 양의 측정을 위해 860 nm에서 흡광도를 사용한다. 청색은 실온에서 30 분 동안 완전히 발달되고 적어도 5 시간14동안 안정적입니다. 이 분석은 Pi 농도가 10 μM까지 의 민감도를 가지며 흡광도는 10-800 μM14의농도 범위에 걸쳐 선형적이다. 여기서 대표적인 결과에서, 웰 E1−E3(도2C)는억제제 없이 반응 혼합물을 함유하고 청색 용액은 분석의 끝에서 관찰될 수 있다. 이는 또한 완전한 저해에 도달하지 않은 낮은 화합물 농도에서 관찰될 수 있으며, IDP용 우물 F1-F3 및 화합물 1에 대한 웰 A4−A6(ATC, TmPPase9의최근 알려진 비경쟁 억제제)에서 각각 2.5 μM 및 1 μM의 농도에서 관찰될 수 있다. IDP 및 화합물 1의높은 농도는, 덜 청색이 관찰될 수 있다(화합물 1에 대한 IDP 및 B4−B6 및 C4−C6에 대한 G1−G3 및 H1-H3) 효소 활성의 억제를 나타낸다. 비억제 화합물의 세 가지농도(2, 3및 8)는어떠한 억제제없이 E1−E3와 동일한 청색 강도를 나타냈다(도2C).
860 nm에서 흡광도 측정 후, 데이터를 처리하고 분석할 수 있다(프로토콜 섹션 5 참조). 그림 2D는 선형 피팅을 가진 Pi 표준의 교정 플롯을 나타낸다(y = 0.0576x + 0.0019; r2 = 0.999). 그림 3은 효소 활성의 플롯을 보여줍니다(%) 각 테스트 화합물의 농도에 대해. 억제 활성이 있는 화합물의 경우 비선형 곡선 피팅도 표시됩니다. 양성 대조군으로 사용되는 IDP는 더 높은 농도에서 활성의 감소를 명확하게 나타낸다. 3개의 상이한 농도를 기준으로 계산된 IC 50(추정)은 88.2 μM(표1)이며,이는 8개의 농도포인트(14)를가진 이전 측정(80.0 μM)과 유사하다. 화합물 1, 4, 5, 6,및 7은 IC50(추정치)과 함께 농도가 약 1.3 μM, 7.4 μM, 19.0 μM, 37.4 μM 및 156.1 μM으로 증가했기 때문에 IDP와 유사한 경향을 보였다(표1). 화합물 2, 3,및 8활성 또는 억제의 감소는 분석 농도에서 관찰될 수 없다. 정확한 IC50을생성하기 위해 8개의 농도 점을 가진 추가 분석이 이루어질 수 있다. 도 4는 IC50을 1.7 μM, 21.4 μM, 58.8 μM, 239.0 μM 및 >500 μM으로 각각9, 5, 5, 6, 7 및 8에 대한 억제 곡선을 나타낸다.
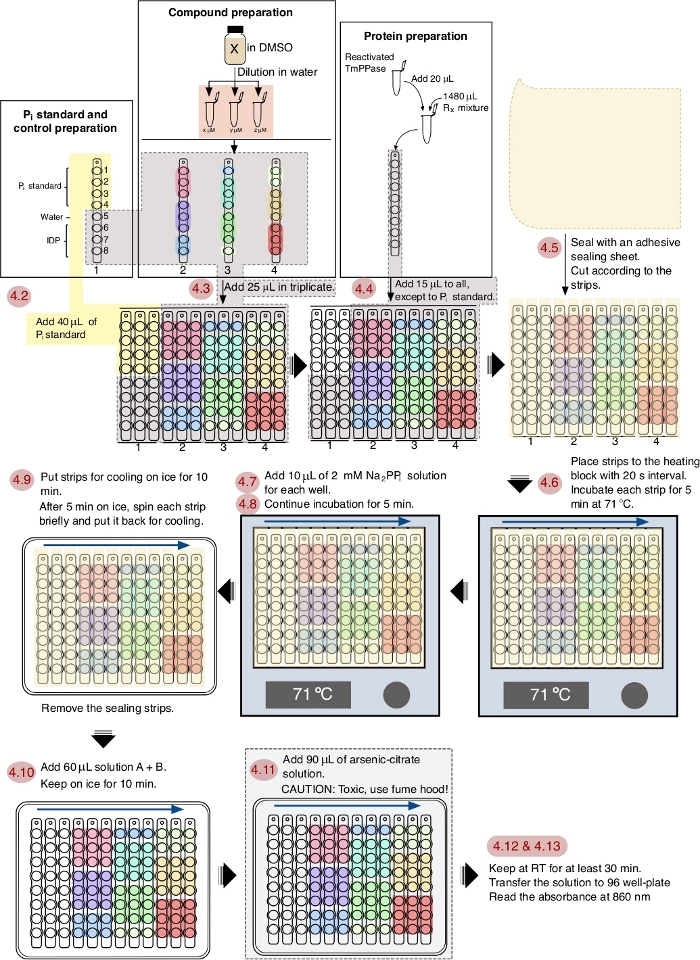
도 1: 96 웰 플레이트 포맷의 TmPPase 억제 분석법의 개략적 워크플로우. 빨간색 번호 매기기는 프로토콜에 따른 분석의 단계를 나타내고 파란색 화살표는 간격 순서를 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
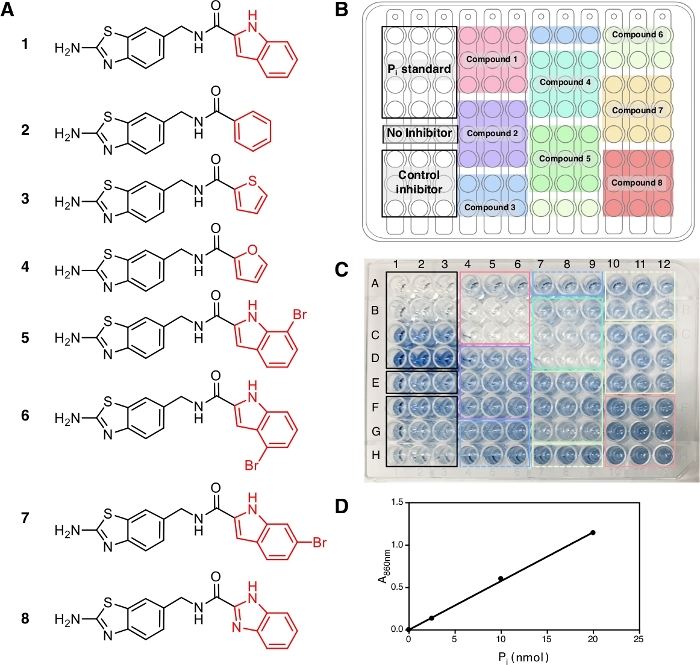
도 2: 샘플, 그들의 배열 및 96 웰 플레이트의 색상 개발. (A)화합물 1의구조 -8은 분석에 사용된다. 이들 화합물의 억제 활성은 Vidilaseris 등에서보고되었다. 9. (B)샘플 배열. (C)색 전개, 비소 성 구연산염 용액을 첨가 한 후 30 분. 위에서 아래로 배열된 제어 억제제(IDP) 및 샘플의 농도는 각각 2.5 μM, 25 μM 및 250 μM 농도 및 1 μM, 5 μM 및 20 μM 농도입니다. 청색의 강도는 효소 반응으로 인해 방출된Pi의 양에 해당하며 색의 부족은 효소 반응없음에 해당한다. (D)선형 피팅을 가진 A860에 대하여 Pi 표준(nmol)에 대한 캘리브레이션 곡선(y = 0.0576x + 0.0019; r2 = 0.999). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
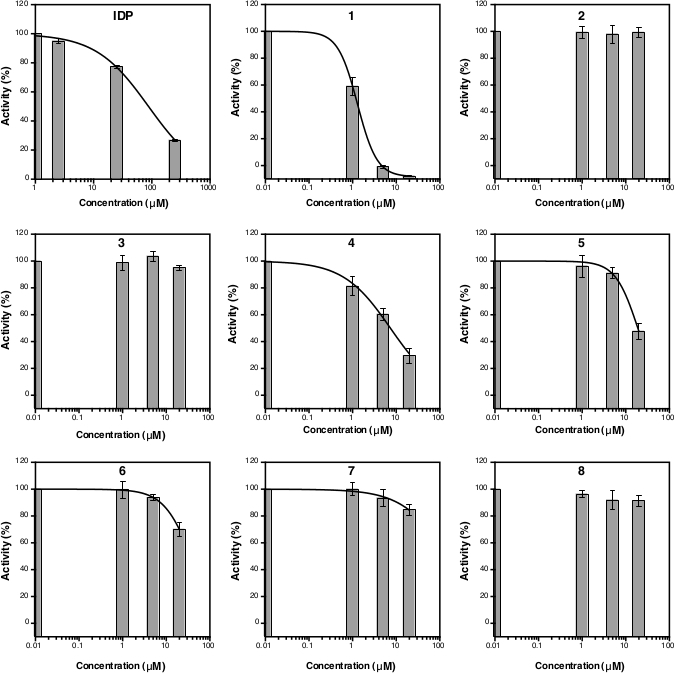
도 3: 3개의 상이한 억제제 농도에 대한 TmPPase 퍼센트 활성의 곡선. IC50(추정)을 계산하는 비선형 회귀 곡선은 분석 농도에서 TmPPase 활성을 저해하지 않았기 때문에 화합물 1, 4, 5, 6 및 7뿐만 아니라 화합물 2, 3및 8에 대해서도 나타내지 않았다. 각 화합물의 logIC50 및 IC50(추정)은 표 1에나타내고 있다. 모든 데이터는 3개의 복제가 있는 평균 ± SD로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 화합물 1, 5, 6, 7 및 8의 8농도 지점에서의 억제 곡선. 이 그림은 약간의 수정으로 Vidilaseris등. 9에서 가져온 것입니다. 모든 데이터는 3개의 복제가 있는 평균 ± SD로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 샘플 | 로그IC50 | IC50(추정치) (μM) |
| Idp | 1.95 ± 0.0142 | 87.9 ± 2.46 |
| 1 | 0.112 ± 0.0274 | 1.29 ± 0.0816 |
| 2 | − | 억제 없음 |
| 3 | − | 억제 없음 |
| 4 | 0.870 ± 0.0447 | 7.39 ± 0.760 |
| 5 | 1.28 ± 0.0296 | 19.0 ± 1.29 |
| 6 | 1.57 ± 0.0846 | 37.4 ± 7.29 |
| 7 | 2.19 ± 0.366 | 156 ± 131 |
| 8 | − | 억제 없음 |
표 1: 그림3의 데이터를 기반으로 IDP 및 화합물 1-8의 LogIC 50 및 IC50(추정).
토론
여기에서 우리는 Vidilaseris 등14에근거를 둔 96 개의 웰 플레이트 포맷에서 T. maritima에서 막 결합 된 열성 포에 대한 억제제의 간단한 스크리닝을위한 상세한 프로토콜을보고합니다. 이 프로토콜은 저렴하고 산성 조건하에서 정형 외과 및 몰리브데이트에서 형성되고 뚜렷한 청색12를가진 인산염 종으로 감소되는 12-포스포모모리브딕 산을 기반으로 합니다. 이 방법은 보다 민감한 말라카이트 녹색분석법(16)과같은 다른 프로토콜보다 선호되며, 이 방법은 TmPPase재활성화에필요한 높은 인지질 농도의 존재에 간섭을 나타내지 않기 때문이다.
스크리닝 프로토콜의 워크플로우는 그림 1에 도시되어 있으며 이 프로세스는 1시간 안에 완전히 완료될 수 있습니다. 이 프로토콜은 71 °C에서 최적의 작동 온도와 5 분 의 반응 시간으로 TmPPase에 최적화되어 있습니다. 물이 반응 혼합물로부터 이 온도에서 증발함에 따라, 증발을 방지하기 위해 접착제 밀봉 시트(스트립에 맞고 덮기 위해 슬라이스)가 도포되고 증발된 물은 원심분리로 단순히 회수됩니다. 5분 배양 시간은 효소방출인산염의 선형 범위에 여전히 있고 신뢰할 수 있는스크리닝(14)에충분하기 때문에 선택된다. 이 프로토콜에서 타이밍 및 파이펫팅 기술은 좋은 신뢰할 수있는 결과를 얻기 위해 중요한 요소입니다. 스트립 사이의 20 s 간격으로 분석 하는 동안 시약의 추가 후속 단계를 수행 하기 위한 최적화 된 타이밍 옵션입니다.
상이한 mPPases의 경우, 억제 분석에서 사용하기 전에 최적 온도 및 배양 시간을 별도로 결정해야 합니다. 상기 효소 재활성화 프로토콜은 TmPPase에 최적화되어 있으며 다른 mPases는 다른 재활성화 프로토콜이 필요할 수 있습니다. 예를 들어, DDM은 효소 활성17을감소시킬 것이기 때문에 피로콜룸 에어로필럼으로부터 mPPase의 재활성화를 위해 추가되어서는 안 된다. 효소가 미리 잘 준비되면 덜 활성화되기 때문에, 재활성화 된 효소의 첨가는 분석이 시작되기 직전에 반응 혼합물에 첨가되어야합니다. 비소산 구연산액을 첨가한 후 반응 생성물은 적어도 5 시간14동안안정하다. 따라서, 분석의 다음 배치는 즉시 수행 될 수 있고, 흡광도 측정은 한 번에 모든 배치에 나중에 수행 할 수 있습니다.
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품은 제인과 아토스 에르코 재단과 BBSRC (BB / M021610)의 보조금에 의해 지원되었다, 핀란드 아카데미(308105번)에서 케니 비디라리스(310297번)에서 헨리 샤드까지, (265481번) 사리 일리-카우할루마, 헬싱키 대학 연구 기금에서 구스타프 보이예 af Gennäs. 저자는 프로젝트 기간 동안 그녀의 기술적 인 도움에 대한 버나데트 겔에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Adhesive sealing sheet | Thermo Scientific | AB0558 | |
| Ammonium heptamolybdate tetrahydrate | Merck | F1412481 636 | |
| Ascorbic acid | Sigma-Aldrich | 95212-250G | |
| BioLite 96Well Multidish | Thermo Scientific | 130188 | |
| Dimethyl sulfoxide (DMSO) | Merck | 1167431000 | |
| 8-well PCR Tube Strips 0.2 ml without caps (120) | Nippon genetics | FG-028 | |
| Dodecyl maltoside (DDM) | Melford | B2010-100G | |
| Ethanol | Merck | 1009901001 | |
| Glacial acetic acid | Merck | 1000631011 | |
| Hydrochloric acid | Sigma-Aldrich | 258148-500ML | |
| Imidodiphosphate sodium salt | Sigma-Aldrich | I0631-1G | |
| L-α-Phosphatidyl choline from soybean lecithin | Sigma | 429415-100GM | |
| Magnesium chloride | Sigma-Aldrich | 8147330500 | |
| Multiplate 96-Well PCR Plates | Bio-Rad | MLL9651 | |
| MultiSkan Go | Thermo Scientific | 10680879 | |
| Nepheloskan Ascent (Type 750) | Labsystems | ||
| Polystyrene Petri dish (size 150 mm x 15 mm) | Sigma-Aldrich | P5981-100EA | |
| Potassium chloride | Merck | 104936 | |
| Prism 6 software | GraphPad | ||
| QBT2 Heating block | Grant Instruments | ||
| Sodium meta-arsenite | Fisher Chemical | 12897692 | |
| Sodium phosphate dibasic (Pi) | Sigma | S0876-1KG | |
| Sodium pyrophosphate dibasic | Fluka | 71501-100G | |
| Trisodium citrate dihydrate | Fluka | 71404-1KG |
참고문헌
- Terstappen, G. C., Reggiani, A. In silico research in drug discovery. Trends in Pharmacological Sciences. 22 (1), 23-26 (2001).
- Rask-Andersen, M., Almen, M. S., Schioth, H. B. Trends in the exploitation of novel drug targets. Nature Reviews Drug Discovery. 10 (8), 579-590 (2011).
- Shah, N. R., Vidilaseris, K., Xhaard, H., Goldman, A. Integral membrane pyrophosphatases: a novel drug target for human pathogens. AIMS Biophysics. 3 (1), 171-194 (2016).
- Baykov, A. A., Malinen, A. M., Luoto, H. H., Lahti, R. Pyrophosphate-Fueled Na+ and H+ Transport in Prokaryotes. Microbiology and Molecular Biology Reviews. 77 (2), 267-276 (2013).
- Serrano, A., Perez-Castineira, J. R., Baltscheffsky, M., Baltscheffsky, H. H+-PPases: yesterday, today and tomorrow. IUBMB Life. 59 (2), 76-83 (2007).
- Liu, J., et al. A vacuolar-H+-pyrophosphatase (TgVP1) is required for microneme secretion, host cell invasion, and extracellular survival of Toxoplasma gondii. Molecular Microbiology. 93 (4), 698-712 (2014).
- Lemercier, G., et al. A pyrophosphatase regulating polyphosphate metabolism in acidocalcisomes is essential for Trypanosoma brucei virulence in mice. Journal of Biological Chemistry. 279 (5), 3420-3425 (2004).
- Belogurov, G. A., et al. Membrane-bound pyrophosphatase of Thermotoga maritima requires sodium for activity. Biochemistry. 44 (6), 2088-2096 (2005).
- Vidilaseris, K., et al. Asymmetry in catalysis by Thermotoga maritima membrane-bound pyrophosphatase demonstrated by a nonphosphorus allosteric inhibitor. Science Advances. 5 (5), (2019).
- Lin, S. M., et al. Crystal structure of a membrane-embedded H+-translocating pyrophosphatase. Nature. 484 (7394), 399-403 (2012).
- Fiske, C. H., Subbarow, Y. The colorimetric determination of phosphorus. Journal of Biological Chemistry. 66 (2), 375-400 (1925).
- Nagul, E. A., McKelvie, I. D., Worsfold, P., Kolev, S. D. The molybdenum blue reaction for the determination of orthophosphate revisited: Opening the black box. Analytica Chimica Acta. 890, 60-82 (2015).
- Kellosalo, J., Kajander, T., Palmgren, M. G., Lopez-Marques, R. L., Goldman, A. Heterologous expression and purification of membrane-bound pyrophosphatases. Protein Expression and Purification. 79 (1), 25-34 (2011).
- Vidilaseris, K., Kellosalo, J., Goldman, A. A high-throughput method for orthophosphate determination of thermostable membrane-bound pyrophosphatase activity. Analytical Methods. 10 (6), 646-651 (2018).
- He, Z. Q., Honeycutt, C. W. A modified molybdenum blue method for orthophosphate determination suitable for investigating enzymatic hydrolysis of organic phosphates. Communications in Soil Science and Plant Analysis. 36 (9-10), 1373-1383 (2005).
- Martin, B., Pallen, C. J., Wang, J. H., Graves, D. J. Use of fluorinated tyrosine phosphates to probe the substrate specificity of the low molecular weight phosphatase activity of calcineurin. Journal of Biological Chemistry. 260 (28), 14932-14937 (1985).
- Strauss, J., Wilkinson, C., Vidilaseris, K., Harborne, S. P. D., Goldman, A. A simple strategy to determine the dependence of membrane-bound pyrophosphatases on K+ as a cofactor. Methods in Enzymology. 607, 131-156 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유