Method Article
Лентивирные посредничества Джин Silencing в человека Pseudoislet Подготовлено в низких пластин присоединения
В этой статье
Резюме
Представлен протокол для создания геномодифицированных человеческих псевдоизоляторов из рассеянных клеток островков человека, которые переводятся лецивирусом, несущим короткую ШПильку РНК (shRNA). Этот протокол использует легко доступные ферменты и культурные сосуды, может быть выполнена легко, и производит генетически модифицированные человеческие псевдоизоляторы, пригодные для функциональных и морфологических исследований.
Аннотация
Различные генетические инструменты доступны для модулирования генов в островках поджелудочной железы грызунов для вскрытия функции островковых генов для исследования диабета. Однако данные, полученные с островков грызунов, часто не полностью воспроизводятся или применимы к островкам человека из-за хорошо известных различий в структуре и функции островка между видами. В настоящее время методы, доступные для манипулирования экспрессией генов человеческих островков, очень ограничены. Введение трансгена в нетронутые островки аденовирусом, плазмидом и олигонуклеотидами часто страдает от низкой эффективности и высокой токсичности. Низкая эффективность особенно проблематична в исследованиях по снижению генов в нетронутых островках, которые требуют высокой эффективности. Было известно, что ферментативно-рассеянные островковые клетки реагрегируются в культуре формирования сфероидов, называемых псевдоислетами. Контролируемые размером реагрегации клеток островка человека создают псевдоизоляторы, которые поддерживают динамическую секрецию инсулина первой фазы после длительной культуры и обеспечивают окно для эффективного введения лентивирусной короткой ШПильки РНК (SHRNA) с низкой токсичностью. Здесь описан подробный протокол для создания человеческих псевдоислетов после трансдукции ллентивиров с использованием двух коммерчески доступных мультивеллных пластин. Протокол может быть легко выполнен и позволяет эффективно едить внизрегулрецию генов и оценку динамизма секреции инсулина с использованием человеческих клеток-разлеток. Таким образом, человеческие псевдоизоляторы с опосредованной генной модуляцией обеспечивают мощную и универсальную модель для оценки функции генов в клетках островков человека.
Введение
Потеря функциональной бета-клеточной массы является центральной патологией какдля диабета типа 1, так и для 2-го типа 1. В то время как бета-клетки являются производителями инсулина в островках поджелудочной железы, связь между бета-клетками и небета-клетками играет важную роль в регуляции секреции инсулина2. Кроме того, дисрегуляция секреции глюкагона способствует гипергликемии при диабете3. Таким образом, существует большой интерес к модулировать экспрессию генов клеток в островках поджелудочной железы для решения механизма развития дисфункции островка при диабете. Различные подходы, включая трансгенных мышей доступны для модулировать экспрессию генов островков мыши. Тем не менее, человек и мышь островки показывают различные иннервации, распределение клеток, соотношение бета-клеток к альфа-клетки, и ответ на secretagogues4. Поэтому прямая оценка функции генов в островках человека чрезвычайно важна для понимания патофизиологии островков поджелудочной железы человека.
Аденовирусный вектор является наиболее широко используемым вирусным вектором для претворения островков поджелудочной железы в пробирке из-за высокой эффективности трансдукции в неразделяющихся клетках. Однако аденовирус не проникает в ядро островков эффективно, особенно в островки человека5,и является цитотоксическим в высоких дозах6. Сравнительно, лентивирусный вектор менее цитотоксичен и поставляет экзогенные гены постоянно в хромосому пост-митотических клеток, что делает его широко проверенным средством для генной терапии7. Тем не менее, способность лентивирус проникнуть в ядро нетронутых островков человека также ограничена, тем самым требуя частичной дисперсии путем ферментативного пищеварения для повышения эффективности трансдукции8. Предостережение с дисперсией нетронутых островков человека прерывание клеток и клеточной матрицы связи, которая ставит под угрозу динамическую регуляцию секреции инсулина решающее значение для поддержания гомеостаза глюкозы у людей9. Таким образом, было сложно оценить влияние модуляции генов на динамическую регуляцию островковой функции в модели островков человека.
Известно, что рассеянные островков ы токсы с островков человека и грызунов автономно реагрегатируются на островоподобные структуры, называемые «псевдоизлетами». Псевдоислеты показывают бета-и небета-клеточная дистрибуция, аналогичная родному островкам10,11. Кроме того, после долговременной культуры, родные островкипостепенно теряют надежную первую фазу секреции инсулина 5,10,11,12. Тем не менее, псевдоизлеты продемонстрировали лучшее сохранение секреции инсулина первой фазы в ответ на глюкозу по сравнению с местными островками после того же периода культуры5. В дополнение к лучшей секреции инсулина, контролируемые размером реагрегации клеток человека в низких пластинах крепления11 предоставляет окно возможностей для введения лентивирусных векторов до их реагрегации в псевдовизлеты. Несколько исследований продемонстрировали полезность псевдоизлетов в сочетании с опосредования трансдукции лентивиральной. Caton et al.13 сообщили, что введение зеленого флуоресцентного белка (GFP), выражающего лентивирус, мало повлияло на секрецию инсулина при достижении однородного выражения ГФП в крысиных псевдоислетах по сравнению с неинфицированным контролем. Они также продемонстрировали специфическое влияние различных connexins на секрецию инсулина путем overexpressing connexins 32, 36, и 43 через lentivirus13. Человеческие псевдовизлеты, подготовленные с коммерчески доступной 96-хорошо ультра-низкой пластины крепления показали, что lentiviral-опосредованное переэкспрессия транскрипционного фактора SIX3 улучшает секрецию инсулина оценивается статической инкубации14. Недавно, человеческие псевдовизлеты, подготовленные с 96-хорошо ультра-низкой пластины крепления были использованы для downregulate глюкокиназы через lentiviral короткой шпильки РНК (SHRNA) в качестве доказательства принципа, чтобы показать, что глюкоза стимулировали секреции инсулина уменьшается, в то время как KCl-стимулировали секрецию инсулина была сохранена5. Исследование также показало, что человеческие псевдоизоляторы похожи на родние островки в экспрессии генов и секреторных профилях, что еще больше поддерживает полезность человеческих псевдоизлетов для вскрытия регуляции островной функции5. Хотя перифузия не была выполнена, биоинженерных микроколодцы культуры пластины, которые недавно стали коммерчески доступны, также сообщается, что совместимы для лентивирусной трансдукции и производства человеческих псевдоизоляторов, которые выставлены отличные инсулина секреция in vitro и in vivo после трансплантации11. В совокупности, формирование человеческого псевдоистлета в сочетании с лентивирусной трансдукцией является простым и эффективным подходом к исследованию патологиологии островков человека, обеспечивая ценный инструмент для проведения механистических исследований на человеческих островках.
В настоящем докладе представлен протокол для формирования человеческих псевдоизоляторов, трансцизированных с помощью лентивирусной платформы, 96-хорошо ультра-низкой пластины крепления и микроколодцы культуры пластины. Оба достигают эффективной модуляции экспрессии генов и создают человеческие псевдоизоляторы, совместимые для оценки вниз по течению, включая статическое инкубацию и перифузию.
протокол
До начала исследований, человеческие предметы исследования определение было сделано ВУниверситете штата Айова Институциональный обзор совета, который определил, что исследование не соответствует критериям для исследования человеческих субъектов. Проконсультируйтесь с местным наблюдательным советом перед началом исследования, чтобы определить, требует ли источник островков и запланированного исследования предварительного утверждения.
ПРИМЕЧАНИЕ: Как правило, для образования 192 псевдоизоляторов размером с 3000 клеток/псевдоизлетов в 96-хорошей ультранизкой пластине крепления или 1200 псевдоизоляторах размером с 500 клеток/псевдоизлетов в 96 скважинах или 1200 псевдоислетов размером с 500 клеток/псевдоизлетов в микроколодцы культуры пластины. МТЗ островков требуется варьируется между различными препаратами человека островков в качестве донорских факторов (возраст, здоровье, вес), эффективность изоляции, и культурные условия влияют на выход одной подвески клеток. В этом протоколе используется лентивирус, содержащий shRNA, ориентированный на ген интереса. Цитомегаловирус (ЦМВ) и человека фосхоглицерат киназы (hPGK) промоутер основе лентивирных векторов, как сообщается, вниз-регулировать ген эффективно в человеческих псевдоизоляторов5,15. Использование лентивирус требует предосторожности, как биоопасность16. Свяжитесь с местным комитетом по биобезопасности до начала использования ллентивируса.
1. Ночная культура островков человека для восстановления после отгрузки
- Подготовка Connaught Медицинские исследовательские лаборатории 1066 (CMRL-1066) средний дополнен 1% человеческого сыворотки альбумина (HSA) путем объединения 50 мл CMRL-1066, 0,5 г HSA, 0,5 мл пенициллина-стрептомицина, и 0,5 мл 100 мг/мл клеет HS безопасности шкаф (BSC) и прохождения через фильтр 0,2 мкм для стерилизации.
- Аккуратно закружить доставку бутылку держать островки в подвеске. Перенос судоходной среды, содержащей островки, в коническую центрифугу 50 мл. Пусть трубка сидеть в BSC в течение 15 минут, так что островки оседают на дно трубки.
- Удалите транспортировку среды осторожно, не нарушая платка капельницы с помощью 10 мл пипетки. Повторно приостановить гранулы на газе в 1% HSA CMRL до концентрации 400 МВЗ/мл.
- Передача островков в нетканеную культуру обработанного блюда. Если островки делятся на несколько блюд, держите островки равномерно приостановлено в среде, мягко закрученного перед расщеплением. Культурные островки при 37 градусах По Цельсию в инкубаторе CO2 на ночь.
ПРИМЕЧАНИЕ: Использование нетканеной культуры обработанные блюда требуется для предотвращения привязанности островков к пластине.
2. Подготовка одноклеточной подвески с островков человека
- Подготовка следующих: CMRL-1066 среда с 10% тепло-инактивированной сыворотки крупного рогатого скота плода (HiFBS), пенициллин-стрептомицин, и глутамин (10% HiFBS CRML) при комнатной температуре (RT), 40 мкм ситечко, 35 мм Петри блюдо, 1 мл туберкулина sy.
- Перенос островков человека после ночной культуры в коническую центрифугу мощностью 15 мл. Центрифуга при 190 х г в течение 5 мин в размахивая ведро ротора. Аспирная среда с пипеткой 5 мл, не нарушая гранулы на клет.
- Вымойте гранулы, добавив 10 мл фосфат-буферного солира (PBS) в трубку, аккуратно перемешайте и центрифуги при 190 х г в течение 5 мин. Aspirate PBS, не нарушая газолет.
- Повторно приостановить островк гранулы в 0,5 мл предварительно разогретой протеолитической и коллагенолитной ферментной смеси и пипетки 5x с помощью пипетки P1000 для смешивания островков. Инкубировать при 37 градусах по Цельсию в течение 5 мин. Смешайте трубачом вверх и вниз осторожно 1-5 раз.
ПРИМЕЧАНИЕ: Агрессивное пипеттинг увеличит потерю клеток. - Проверьте облачность (одиночные клетки) и количество хлопьев (непереваренных островков). Добавляйте инкубацию от 2 до 37 градусов по Цельсию в зависимости от степени пищеварения, о ценящейся по облачности и количеству хлопьев. Остановить пищеварение, когда хлопья сводятся к 10% от предварения и раствор облачно.
ПРИМЕЧАНИЕ: Время, необходимое для пищеварения, отличается в зависимости от размера газона каждого человека, подготовки к газетам. - Поместите 40 мкм ситечко в 35 мм Петри блюдо и мокрый ситечко, добавив 1 мл 10% HiFBS CMRL и нажав с 1 мл шприца поршень. Перенесите всю клеточную подвеску поверх ситечко и соберите проходвую в свежей трубке 15 мл.
- Вымойте трубку, используемую для пищеварения газолетов с 0,5 мл свежей среды CMRL для сбора оставшихся клеток и пройти мыть через ситечко. Объедините проходвую в трубке 15 мл. Повторите один раз.
- Далее, диссоциатив непереваренные островки, оставшиеся на ситечке, нажав ситечко, помещенное в 35-мм тарелку с 1 мл шприца поршенем. Соберите проходной снова и мыть ситечко со свежимCM CMRL-1066, чтобы удалить все оставшиеся переваренные островки из ситечко и блюдо. В общей сложности 3 мл одноклеточной подвески теперь будет находиться в трубке 15 мл.
- Запишите общий объем суспензии клеток и возьмите 10 аликотов клеток, чтобы подсчитать номер клетки на гемоцитометре.
- Центрифуги ядолок подвески в течение 5 мин на 200 х г. Удалите среду, не нарушая гранулы. Приступить к шагу 3.1.1 при использовании 96-хорошо ультра-низкой пластины крепления или шаг 3.2.1 при использовании 24 хорошо microwell культуры пластины для реагрегирования клеток.
3. Псевдослет Формирование и Трансдукция лентивирусом
- Протокол с использованием 96-хорошо ультра-низкой пластины крепления
- Определите желаемое количество клеток на псевдоизолятор и количество псевдоизоляторов для создания. Как правило, 1000-3000 ячеек используются для каждого псевдоислета для 96-колодец ультра-низкой пластины крепления. Для 3000 ячеек на псевдоизолятор, отрегулируйте суспензию клетки до 1 х 105 ячеек/мл, приостановив работу капельного пеллета со ступени 2,10 в 10% HiFBS CMRL, так что 30 зл клеточной суспензии имеет 3000 клеток. Рассчитайте общий объем 1 х 105 ячеек/мл одноклеточной подвески (мЛ), необходимой с помощью следующего уравнения:
Общий объем 1 х 105 ячеек/мл одноклеточной подвески (мл) (количество ячеек на псевдоизолятор) x (количество псевдоизлетов) / 1 x 105.
ПРИМЕЧАНИЕ: Отрегулируйте концентрацию клеточной суспензии на основе желаемого количества клеток на псевдоизолятор так, чтобы 30 злклеточной суспензии сделали один псевдоистлет. - Перенесите необходимый объем (30 л л х количество псевдоизоляторов) одноклеточной подвески на свежую трубку 15 мл. Добавьте 250 трансдукционных единиц (ТУ)/ячейку лентивирусной, содержащей шРНК, нацеленную на ген интереса или контроля.
ПРЕДЕКТО: Лентивирус классифицируется как уровень биобезопасности 2 и может быть интегрирован в ДНК инфицированных клеток.
ПРИМЕЧАНИЕ: Используйте концентрированный лецивирус, чтобы объем добавленного ллентивируса был минимальным. Титер, необходимый на одну клетку для эффективного замалчивания генов, может отличаться в зависимости от лентивирусной конструкции. - Смешайте суспензию клеток с вирусом, аккуратно протянив 5x с пипеткой P1000. Перенесите смешанные клетки в стерильный резервуар реагента 50 мл при использовании 8-канального пипетки.
- Распределить 30 зл на скважину одноклеточной подвески, смешанной с лентивирусом в каждую скважину с помощью 8-канального пипетки или пипетки P200 в зависимости от количества скважин.
- Centrifuge 96-ну в размахивая ведро пластины центрифуги на 270 х г на RT в течение 7 мин. Проверьте, являются ли клетки собраны в центре каждого колодца. Если нет, то центрифуга снова как сбор всех клеток в центре колодца имеет решающее значение для формирования псевдоислета. Культура при 37 градусах По Цельсия в увлажненных 5% CO2 инкубатора ночь.
- Добавить 100 л предварительно разогретых 10% HiFBS CMRL на следующее утро, чтобы избежать высыхания клеток во время последующей культуры. Центрифуга при 270 х г,RT в течение 7 мин. Культура при 37 градусах по Цельсию в 5% CO2 инкубатора. Псевдоизлеты завершат формирование через 5–7 дней.
- При сборе псевдоизоляторов предварительно разогрейте желаемый объем в размере 10% HiFBS CMRL (100 л на островк), приготовьте один стерильный резервуар 50 мл, одну стерильную тарелку 10 см Петри и одну 8-канциоцидрую пипетку в BSC.
- Снимите 96-хорошую пластину из инкубатора и поместите в BSC. Пипетка 100 л на подолет 10% HiFBS CMRL в резервуар.
- Пипетка 100 л на колодец 10% HiFBS CMRL от резервуара до псевдоизлетов и пипетки вверх и вниз в 2-3 раза мягко в колодце, чтобы поднять островки вверх. Затем, аспирсредо среды в колодце, содержащем псевдоислет и выбрасывать в 10 см Чашку Петри. Использование 8-канального пипетки позволяет передавать 8 псевдоислетов одновременно.
- Проверьте пластину под световым микроскопом, чтобы обеспечить полное удаление всех псевдоизлетов. Псевдоизлеты образуют фирменные агрегаты и остаются агрегированными после подъема. Псевдовизлеты теперь готовы к экспериментам ниже по течению.
- Определите желаемое количество клеток на псевдоизолятор и количество псевдоизоляторов для создания. Как правило, 1000-3000 ячеек используются для каждого псевдоислета для 96-колодец ультра-низкой пластины крепления. Для 3000 ячеек на псевдоизолятор, отрегулируйте суспензию клетки до 1 х 105 ячеек/мл, приостановив работу капельного пеллета со ступени 2,10 в 10% HiFBS CMRL, так что 30 зл клеточной суспензии имеет 3000 клеток. Рассчитайте общий объем 1 х 105 ячеек/мл одноклеточной подвески (мЛ), необходимой с помощью следующего уравнения:
- Протокол с использованием 24-колодца микроколодцы культуры пластины
- Разогрейте анти-придерживающийся ополчивания раствор(Таблица материалов) к RT для эффективного образования сфероидов. Кроме того, предварительно теплый равнине CMRL-1066 и 10% HiFBS CMRL.
- Добавьте 500 qL в колодец анти-приверженности промывки раствор для каждого колодца 24-хорошо микроколодцы культуры пластины, которые будут использоваться для pseudoislets. Центрифуга при 1300 х г в течение 5 мин в размахивая ведро пластины центрифуги.
- Наблюдайте за пластиной под микроскопом, чтобы обеспечить удаление пузырьков воздуха из микроколодцев. Если пузырьки воздуха оказались в ловушке в микроуэллах, центрифуга на 1300 х г в течение 5 минут снова.
- Примачить анти-придерживающихся очистных решений из скважин в BSC. Промыть каждую скважину с 2 мл теплой равнины CMRL-1066 один раз. Аспират CMRL-1066. Добавьте 0,5 мл/хорошо теплого 10% HiFBS CMRL к каждому хорошо спланированного для использования. Скважины теперь готовы к загрузке рассеянных человеческих клеток-абонек, подготовленных в шаге 2.10.
- Определите общее количество клеток, необходимых для каждой скважины. Один из 24-колодца микроколодцы культуры пластины содержит 1200 микровелл и образует 1200 псевдоизлетов. 500 клеток на псевдоислет x 1200 микровелл ы 6 х 105 клеток. Перепристените одиночные клетки от шага 2.10 до 6 x 105 клеток в 0.8 ml 10% HiFBS CMRL в стерильной трубке 1.5 mL.
ПРИМЕЧАНИЕ: Максимальный объем на скважину составляет 2 мл. Объем клеточной суспензии не должен превышать 1,5 мл. Протокол описывает шаги для создания одного колодца псевдоизлета, трансиндуцированного лентивирусом. Масштабирование в зависимости от количества скважин, которые должны быть сделаны для каждого лентивирусного. - Для вирусной трансдукции добавьте 125 ТУ/клеток в одноклеточную подвеску. Держите объем вируса ниже 0,2 мл. Инкубировать клеточной и вирусной смеси при 37 градусов по Цельсию с редким нежным смешиванием в течение 1 ч, чтобы контакт клеток с вирусом до конденсации клеток в шаге 3.2.8.
ПРИМЕЧАНИЕ: Используйте концентрированный лецивирус, чтобы объем добавленного ллентивируса был минимальным. Меньшее количество ТУ на ячейку используется для Протокола 2 по сравнению с Протоколом 1, так как общий объем среднего числа клеток меньше. Тем не менее, титер, необходимый на одну клетку для эффективного замалчивания генов, может отличаться в зависимости от лентивирусной конструкции и нуждается в оптимизации.
ПРЕДЕКТО: Лентивирус классифицируется как уровень биобезопасности 2 и может быть интегрирован в ДНК инфицированных клеток. - После 1 ч отрегулируйте общий объем мотоклетки и вирусной смеси до 1 мл, добавив 10% HiFBS CMRL. Если клетки образуют сгусток после 1 ч инкубации, рассеять сядутную подвеску на одну клетку нежным и быстрым трубачом 2-3 раза. Пипетка очень важна для равномерного распределения клеток по микроскважинам. Передача подвески клеток в один из 24-колодца microwell культуры пластины.
- Сразу же после pipetting, центрифуга на 100 х г в течение 3 мин на RT, чтобы захватить клетки во всех микроуэллов. Обратите внимание под микроскопом, чтобы убедиться, что клетки равномерно распределены во всех микроуэллах.
- Культура микроколодца культуры пластины на 37 градусов по Цельсию в 5% CO2 инкубатора. Псевдоизлеты будут формироваться в 24-48 ч. Псевдоизлеты могут быть культивированы без средних изменений на срок до 7 дней.
- При изменении среды для культуры за 7 дней, заменить 50% до 75% среды для каждого среднего изменения следующим образом. Медленно удалите 0,5-1 мл среды с помощью пипетки P1000 из каждой скважины. Добавить 0,5-1 мл свежего 10% HiFBS CMRL медленно, поставив наконечник к стене колодца, чтобы избежать вытеснения псевдоизлетов из микроколодца культуры пластины.
- Чтобы подготовиться к сбору псевдоизлетов, разогрейте 10% среды HiFBS CMRL. Псевдоислеты, как правило, плавают в сыворотке свободной CMRL-1066 делает его трудно выбрать их.
- Аспир 0,5 мл среды от хорошо с помощью 1 мл пипетки и обойтись сми силой обратно на поверхность пластины, чтобы поднять псевдоизоляторы из микроколодца культуры пластины.
- Аккуратно аспирированные выбитые псевдоизлеты с помощью 1 мл пипетки и передачи островков в не-ткани культуры обработаны 6-хорошо пластины. Пройдите через небольшой 37 мкм обратимый ситечко, помещенный на коническую трубку 15 мл. Псевдоислеты останутся на фильтре; любые неинкорпорированные одиночные ячейки будут протекать через.
ПРИМЕЧАНИЕ: Чтобы избежать потери меньшего размера псевдоизлетов через ситечко, ситечко может быть опущен. - Распределите 1 мл 10% HiFBS CMRL по всей поверхности скважины, чтобы выбить все оставшиеся псевдоизоляторы, аспирировать выбитых псевдоизлетов, и пройти через ситечко. Повторите 3x, чтобы обеспечить полную коллекцию всех псевдослетов из скважин.
- Обратите внимание на микроколодцы культуры пластины под инвертмикроскопом, чтобы убедиться, что все псевдоизлеты собраны. Повторите мыть, как в шаге 3.2.14, если псевдоизлеты остаются.
4. Извлечение РНК для оценки эффективности джинного замалчивания
- Выберите псевдоизоляторы в RNase бесплатно PBS в 1,5 мл микроцентрифуги трубки и центрифуги на 300 х г в течение 3 мин при 4 кс. Удалите PBS, не нарушая гранулы на клетчатке и мыть один раз с PBS следуют центрифугации на 300 х г в течение 3 мин при 4 c.
- Аспирируй большую часть PBS с помощью пипетки P1000. Затем, изменить на P10 пипетка, чтобы удалить остальную часть PBS, не нарушая капельного пеллета.
- Добавьте 0,5 мл биоцианатного реагента для извлечения РНК(Таблицаматериалов) на трубку. Гомогенизировать псевдовизмы с помощью моторного пестика в течение 2–3 раз. Гомогенат в биоцианате гиоцинат экстракционизма РНК теперь может храниться при -80 градусах Цельсия или обрабатываться для очистки РНК.
ПРИМЕЧАНИЕ: 24 из 3000 клеток-псевдоизлетов, образованных в 96 хорошо пластины или 48 из 500 клеток-псевдоизлетов, образованных в микроколодцы культуры пластины достаточно, чтобы получить 0,5-1 мкг РНК.
Результаты
Рисунок 1 иллюстрирует ключевые шаги в производстве псевдоизлетов с использованием 96-хорошо ультра-низкой пластины крепления и микроколодцы культуры пластины. На рисунке 2а показаны последовательные изменения в морфологии при формировании псевдоизоляторов из 3 х 103 клеток островков человека в 96-хорошей ультра-низкой пластине крепления. Монослойные или свободные скопления клеток, наблюдаемых в первый день, превращаются в твердые агрегаты с гладкой, круглой границей на 5-7 день(рисунок 2а). В микроколодце культуры пластины, образование твердых псевдоизлетов, как правило, видны в течение 4 дней(рисунок 2b). Когда 600 клеток/микровелл были покрыты в плите культуры microwell, клетки человека-аклетов были конденсированы в сфероиды равномерного размера. Отмечается, что пластина культуры микроколодца позволяет успешно формировать псевдоизлеты из небольшого количества клеток по сравнению с 96-хорошо ультра-низкой пластиной крепления. Как правило, более 1500 клеток / псевдоизолятор необходимы для 96-хорошо ультра-низкой пластины вложения, в то время как 500 клеток / псевдоизолятор достаточно для 24-хорошо микроколодцы культуры пластины. Успешно сформированные псевдоизоляторы остаются сфероидами после восстановления от 96 ультра-низкой пластины крепления или микроколодца культуры пластины и совместимы для вниз по течению приложений, включая статическое инкубации (Рисунок 3a) и перифузии ( Рисунок (Рисунок 3b). Равномерный размер псевдоизоляторов уменьшает вариации в тестовой группе и позволяет статическое инкубацию, используя всего лишь 5 псевдоизоляторов на измерение(рисунок 3a). Кроме того, человеческие псевдоизлеты поддерживали надежную секрецию инсулина первой фазы в ответ на глюкозу после 7 дней культуры, когда оригинальные островки человека культивировались в течение аналогичного периода времени показали притупленные первой фазы глюкозно-стимулируемой секреции инсулина ( Рисунок 3b)5. Внедрение лецивируса в одноклеточную суспензию обеспечивает эффективную и однородную трансдукцию клеток газиката и достигает высокоэффективной вниз-регуляции генов, как показано на рисунке 3c. Все результаты были получены с помощью человеческих островков от недиабетических доноров.

Рисунок 1: Процесс подготовки человека псевдоистлет. () Подвеска, содержащая 4000 МЭЗ человеческих островков становится облачной после пищеварения протеолитической и коллагенолитической ферментной смесью и мягким пипеттингом. (b) Островки человека после дисперсии проходят через ситечко. Непереваренные островки, оставшиеся на верхней части ситечко, рассеиваются с помощью шприца 1 мл. (c,d) Микроскоп изображения одноклеточной подвески, содержащей 3000 клеток / хорошо в 96-хорошо ультра-низкой пластины вложения до (с) и после (d) центрифугирования. (е,f) Микроскоп изображения одной клеточной подвески, содержащей 500 клеток / микроколодцв в 24-хорошо микроколодцы культуры пластины до (е) и после (f) центрифугирования. Шкала бар 250 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Морфология человеческих псевдоизлетов. Последовательные изменения в морфологии человеческих псевдоизлетов, созданных (a) в 96-хорошо ультра-низкой пластины крепления из 3000 клеток и (b) в 24-хорошо микроколодцы культуры пластины из 500 клеток. Шкала бар 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
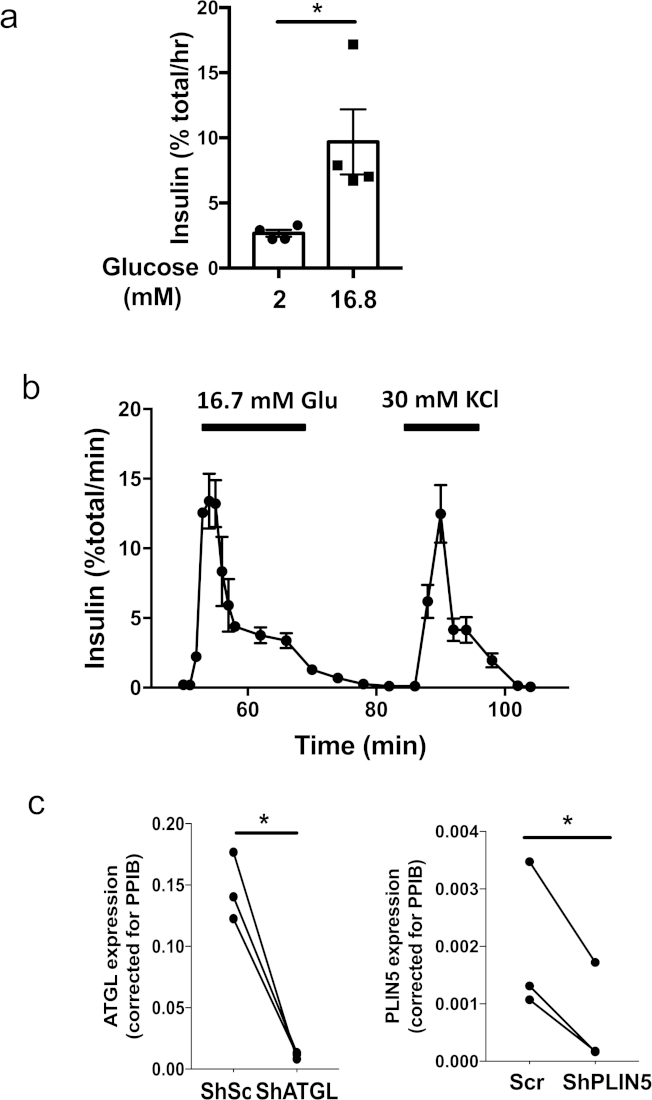
Рисунок 3: Примеры функциональные анализы с использованием человеческих псевдоизлетов. () Представитель статической инкубации осуществляется с использованием человеческих псевдоизлетов, созданных в микроколодцы культуры пластины от одного донора в размере 500 клеток островка человека на псевдоостров. Четыре комплекта по 5 псевдовизлетов были инкубированы на 1 ч в буфере бикарбоната Кребса-ринджера, дополненном глюкозой 2 мМ или 16,8 мм. Каждый символ представляет секрецию инсулина из одного набора из 5 псевдоизлетов. Показано среднее погрешность средней (SEM). Вопрос, р-л; 0,05 на тест едля студента т. Результаты представительских данных от трех доноров. (b) Представитель перифузии тестирования секреции инсулина от человека pseudoislets, созданных в микроколодцы культуры пластины в ответ на 16,7 мм глюкозы и 30 мм KCl. Метод перифузии ранее был опубликован5. Показано среднее сечение инсулина из двух наборов из 40 псевдоизлетов, созданных в микроколодцной культуре пластины от одного донора размером 500 клеток островка человека на псевдопластинку. Репрезентативные данные шести доноров. (c) Псевдоислеты были созданы с лентивирусом, несущим шРНК, нацеленный на человека ATGL (таргетинг CCTCcCCCTACTACTGAGGAGCTTAA, слева) или PLIN5 (таргетинг GACAAGCTGGAGAGAAGCTT, справа). Контроль псевдоизлетов были трансукторована с лентивирусом, выражающим скремблированную последовательность (Scr), ранее опубликованную5. Выражение мРНК каждого гена было определено в режиме реального времени полимеразной цепной реакцией (ПЦР), как ранее опубликовано5. Данные были выражены с помощью 2-DDCT принимая пептидилпролил Исомера B (PPIB) в качестве внутреннего контроля17. Каждая точка представляет данные от каждого донора для указанного грунтовки, а набор данных одного и того же донора соединен строкой. N No 3 донора. *; р Злт; 0,05 по тесту студента t. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Здесь представлен подробный протокол для генерации человеческих псевдоизлетов, которые трансцируются с помощью 96-хорошо ультра-низкой пластины крепления или микроколодца культуры пластины. Псевдоизоляторы, как сообщается, демонстрируют морфологию и секреторные функции, похожиена островки родного человека, и могут быть культивированы в течение длительного времени в пробирке 5,11,18. В отличие от местных островков человека, которые показывают широкие различия в размерах, псевдоизоляторы относительно однородны по размеру, уменьшая различия между донорами и экспериментальными репликациями5,11. Снижение регулировки генов, требующих высокой эффективности трансдукции, может быть легко выполнено до образования псевдоизлетов в одноклеточной суспензии. Этот метод позволяет избежать сложности вирусного проникновения через слои клеток в нетронутых островках. Таким образом, этот простой, высокоэффективный и воспроизводимый протокол для создания человеческих псевдоизоляторов имеет широкое применение.
Хотя несколько различных платформ были зарегистрированы для формирования псевдоизлетов12,14,19,20, как 96-хорошо ультра-низкой пластины вложения и микроколодцы культуры пластины являются коммерчески доступны, что позволяет этот метод, который будет принят в любой лаборатории. Хотя метод повешенияпадение 12 также позволяет формирование человеческих псевдоизоляторов с использованием общих лабораторных программ, потенциальные ограничения включают трудности в контроле размера и продолжительности реагрегации псевдоизлетов. Эти ограничения были обусловлены ограниченным объемом на каплю псевдоислета и продолжающимся испарением в течение 5–дневной культуры, необходимой для формирования псевдоислета. Кроме того, легче содержать лентивирус с использованием 96 хорошо ультра-низкой пластины вложения или микроколодцы культуры пластины по сравнению с висячие капли метода.
Несколько этапов в рамках протокола требуют пристального внимания. Оптимизация пищеварения нетронутых островков с протеолитической и коллагенолитной ферментной смесью имеет решающее значение, поскольку как под-, так и чрезмерное переваривание снизит урожайность одноклеточной подвески и впоследствии повлияет на агрегацию псевдоизоляторов. Во время пищеварения важно внимательно следить за островками на причину исчезновения скоплений и увеличения облачности, поскольку островки делятся на одиночные клетки. Важно отметить, что оптимальное время для пищеварения варьируется между островками от разных доноров. Оптимальное время зависит от нескольких факторов, включая историю болезни и возраст каждого донора, продолжительность времени ишемии, используемая процедура изоляции на кисти, размер айсова, чистота на килет, жизнеспособность на киотов и условия доставки. Как правило, используются островки человека с жизнеспособностью и чистотой выше 80% и в течение 5 дней изоляции. Тщательный и нежный трубач во время дисперсии также важно для поддержания жизнеспособности и восстановления клеток, что в конечном итоге повлияет на агрегацию клеток и окончательный размер псевдоизлетов формируется. При распределении суспензии клеток на скважины (шаги 3.1.4 и 3.2.7) нежное и тщательное смешивание клеток важно для достижения равномерного распределения одиночных клеток в микроколодцы. Если клетки образуют комки после 1 ч инкубации с лентивирусом, это требует нежного трубача, чтобы разбить комки на одноклеточную подвеску до окончательного центрифугации.
Мы имели аналогичный успех в создании человеческих псевдоизлетов после лентивирусной трансдукции с использованием как 96-колодец пластины и микроколодца культуры пластины. Выбор между двумя платформами зависит от размера и количества желаемых псевдоизлетов. Плита культуры microwell имеет малые, форменные днища пирамиды позволяющ конденсацию более малого количества клеток сравненных с 96 наилучшим образом круглой нижней плитой. Таким образом, количество клеток на псевдоизолятор может быть уменьшено для микроколодца культуры пластины. Кроме того, один шаг центрифугации создает все псевдоизлеты одновременно в микроколодцы культуры пластины в то время как несколько pipetting требуется для создания псевдоизлетов в 96-хорошо пластины. Таким образом, масштабирование создания псевдоизлетов легче в микроколодце культуры пластины. Тем не менее, в настоящее время доступна микроколодцы культуры пластины не предлагает гибкость в количестве псевдоизлетов создаются. В настоящее время минимальное количество псевдоизлетов, созданных с использованием микроколодца культуры пластины составляет 1200 и может быть увеличена только в 1200. Таким образом, мы обычно используем 96-хорошую пластину для экспериментов небольшого масштаба и для эксперимента, в котором достаточно небольшого количества образцов, таких как секреция инсулина и экстракция РНК для экспрессии генов. Мы использовали псевдоизлеты из микроколодца культуры пластины для анализов, которые требуют большого количества клеток, таких как западная поместье, определение скорости потребления кислорода метаболический анализатор, и экстракции триглицеридов.
Основным ограничивающим фактором для генерации человеческих псевдоизлетов является потеря клеток при подготовке одноклеточной подвески. В то время как 1 МЭЗ человеческого наикса, как считается, содержит около 2000 клеток, восстановление одноклеточной суспензии, как правило, 30% или ниже из-за многократного мытья и прохождения через ситечко. Гетерогенность размера островка также затрудняет одновременное разобщение всех островков. В то время как нежный пипеттинг и использование протеолитической и коллагенолитной ферментной смеси в протоколе являются попытками объединить механические и ферментативные силы для максимального восстановления одиночных клеток, все же происходит неизбежная потеря клеток. Таким образом, применение псевдоизлетов требует четкого обоснования изучения нетронутых человеческих островков. Следует также напомнить, что секреция инсулина из псевдоислетов является более надежной, чем островки культивируется за тот же период времени, но, как правило, ниже по сравнению со свежеизолированными островками5,11.
Хотя ограничения существуют, стабильный и высокоэффективный заглушение генов в сочетании с лучшим сохранением глюкозно-стимулируемой секреции инсулина в течение длительного времени в культуре позволяют оценить функцию генов в клетках человека. Кроме того, комплексная межклеточная связь между бета-бета-бета-бета и бета-небета-клетками предлагается играть регулирующую роль в функции наиболее точного сытов. Однако в настоящее время имеется ограниченная информация о межклеточной коммуникации внутри островков человека. С увеличением доступности клеточных специфических маркеров21,возможно создать человеческие псевдоизоляторы с определенным составом клеток, как недавно сообщалось в клетках островков мыши22, что облегчит лучшее понимание клеток-клеток связи между клетками человека. Недавнее развитие изображения трехмерных тканей также потенциально увеличивает полезность человеческих псевдоизоляторов в качестве модели для разоблачения того, как клеточная полярность и межклеточная связь регулируются в человеческих островках. Таким образом, человеческие псевдоизоляторы обеспечивают полезную модель для вскрытия функций генов, представляющих интерес, и других вопросов в области островной биологии.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была финансово поддержана Национальными институтами здравоохранения в Y.I. (R01-DK090490) и Американской диабетической ассоциацией в Y.I. (1-17-IBS-132). J.A. и Y.I. поддерживаются Братским Орденом Орловского Научно-исследовательского центра диабета. A.B. поддерживается грантом на обучение национальных институтов здравоохранения (T32NS45549). Авторы использовали островки поджелудочной железы человека, предоставленные финансируемой NIDDK Комплексной программой распределения островок (IIDP) в городе Надежда (2UC4DK098085).
Материалы
| Name | Company | Catalog Number | Comments |
| Anti-adherence rinsing solution | Stemcell technologies | 7919 | |
| Biological safety cabinet | Thermo Scientific | 1300 Series Type A2 | |
| Cell strainer, 40 micrometer | Corning | 431750 | |
| CMRL-1066 | ThermoFisher | 11530037 | |
| CO2 incubator | Thermo Scientific | Heracell VIOS 160i | |
| Conical centrifuge tube, 15 mL | VWR | 89039-666 | |
| Conical centrifuge tube, 50 mL | VWR | 89039-658 | |
| Fetal bovine serum | ThermoFisher | 26140079 | |
| Guanidinium thiocyanate RNA extraction reagent | ThermoFisher | 15596026 | Trizol |
| Glutamine | ThermoFisher | 25030164 | |
| Hemocytometer | Marien Feld | Neubauer-Improved Bright line | |
| Human serum albumin | Sigma | A1653 | |
| Inverted microscope | Fisher brand | 11-350-119 | |
| Microcentrifuge | Beckman Coulter | Microfuge 20 | |
| Microcentrifuge tube, 1.5 mL | USA Scientific | 1615-5500 | |
| Microwell culture plate | Stemcell technologies | 34411 | Aggrewell 400, 24 well |
| Motor-driven pestle | GAMUT | #399X644 | |
| Non-tissue culture treated dish, 10 cm | Fisher Scientific | FB0875713 | |
| PBS | ThermoFisher | 14190250 | |
| Penicillin-streptomycin | ThermoFisher | 10378016 | |
| Petri dish, 35 mm | Celltreat | 229638 | |
| Pipette, 5 mL | DOT Scientific, | 667205B | |
| Pipette, 8-channel | VWR | #613-5253 | |
| Pipette, 10 mL | VWR | 667210B | |
| Pipette, P10 | Denville | UEZ-P-10 | |
| Pipette, P200 | Denville | UEZ-P-200 | |
| Pipette, P1000 | Denville | UEZ-P-1000 | |
| Proteolytic and collagenolytic enzyme mixture | Sigma | A6965 | Accutase |
| Reagent reservoir, 50 mL | VWR | 89094-680 | |
| Reversible strainer, 37 micrometer | Stemcell technologies | 27251 | |
| Swing bucket plate centrifuge | Beckman Coulter | Allegra X-14R | |
| Swing bucket rotor | Beckman Coulter | SX4750A | |
| Tuberculin syringe, 1 mL | BD | 309659 | |
| Ultra low attachment microplate, 96 well | Corning | 4515 |
Ссылки
- Chen, C., Cohrs, C. M., Stertmann, J., Bozsak, R., Speier, S. Human beta cell mass and function in diabetes: Recent advances in knowledge and technologies to understand disease pathogenesis. Molecular Metabolism. 6 (9), 943-957 (2017).
- Hong, H., Jo, J., Sin, S. J. Stable and flexible system for glucose homeostasis. Physiological Review E covering statistical, nonlinear, biological, and soft matter physic. 88 (3), 032711 (2013).
- Cryer, P. E. Minireview: Glucagon in the pathogenesis of hypoglycemia and hyperglycemia in diabetes. Endocrinology. 153 (3), 1039-1048 (2012).
- Arrojo e Drigo, R., et al. New insights into the architecture of the islet of Langerhans: a focused cross-species assessment. Diabetologia. 58 (10), 2218-2228 (2015).
- Harata, M., et al. Delivery of shRNA via lentivirus in human pseudoislets provides a model to test dynamic regulation of insulin secretion and gene function in human islets. Physiological Reports. 6 (20), e13907 (2018).
- Barbu, A. R., Akusjarvi, G., Welsh, N. Adenoviral-mediated transduction of human pancreatic islets: importance of adenoviral genome for cell viability and association with a deficient antiviral response. Endocrinology. 146 (5), 2406-2414 (2005).
- Hughes, A., et al. Gene therapy to improve pancreatic islet transplantation for Type 1 diabetes mellitus. Current Diabetes Reviews. 6 (5), 274-284 (2010).
- Jimenez-Moreno, C. M., et al. A Simple High Efficiency Intra-Islet Transduction Protocol Using Lentiviral Vectors. Current Gene Therapy. 15 (4), 436-446 (2015).
- Bonora, E., et al. Prevalence and correlates of post-prandial hyperglycaemia in a large sample of patients with type 2 diabetes mellitus. Diabetologia. 49 (5), 846-854 (2006).
- Halban, P. A., Powers, S. L., George, K. L., Bonner-Weir, S. Spontaneous reassociation of dispersed adult rat pancreatic islet cells into aggregates with three-dimensional architecture typical of native islets. Diabetes. 36 (7), 783-790 (1987).
- Yu, Y., et al. Bioengineered human pseudoislets form efficiently from donated tissue, compare favourably with native islets in vitro and restore normoglycaemia in mice. Diabetologia. 61 (9), 2016-2029 (2018).
- Zuellig, R. A., et al. Improved physiological properties of gravity-enforced reassembled rat and human pancreatic pseudo-islets. Journal of Tissue Engineering and Regenerative Medicine. 11 (1), 109-120 (2017).
- Caton, D., et al. Lentivirus-mediated transduction of connexin cDNAs shows level- and isoform-specific alterations in insulin secretion of primary pancreatic beta-cells. Journal of Cell Science. 116 (Pt 11), 2285-2294 (2003).
- Arda, H. E., et al. Age-Dependent Pancreatic Gene Regulation Reveals Mechanisms Governing Human beta Cell Function. Cell Metabolism. 23 (5), 909-920 (2016).
- Peiris, H., et al. Discovering human diabetes-risk gene function with genetics and physiological assays. Nature Communications. 9 (1), 3855 (2018).
- Schlimgen, R., et al. Risks Associated With Lentiviral Vector Exposures and Prevention Strategies. Journal of Occupational and Environmental Medicine. 58 (12), 1159-1166 (2016).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Li, N., et al. Engineering islet for improved performance by optimized reaggregation in alginate gel beads. Biotechnology and Applied Biochemistry. 64 (3), 400-405 (2017).
- Ramachandran, K., Peng, X., Bokvist, K., Stehno-Bittel, L. Assessment of re-aggregated human pancreatic islets for secondary drug screening. British Journal of Pharmacology. 171 (12), 3010-3022 (2014).
- Hilderink, J., et al. Controlled aggregation of primary human pancreatic islet cells leads to glucose-responsive pseudoislets comparable to native islets. Journal of Cellular and Molecular Medicine. 19 (8), 1836-1846 (2015).
- Saunders, D. C., et al. Ectonucleoside Triphosphate Diphosphohydrolase-3 Antibody Targets Adult Human Pancreatic beta Cells for In Vitro and In Vivo Analysis. Cell Metabolism. (18), (2018).
- Reissaus, C. A., Piston, D. W. Reestablishment of Glucose Inhibition of Glucagon Secretion in Small Pseudoislets. Diabetes. 66 (4), 960-969 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены