Method Article
Silenciamento gênico mediado por Lentivirus em Pseudoislet humano preparado em placas de baixo acessório
Neste Artigo
Resumo
Um protocolo para criar pseudoislets humanos modificados gene das pilhas de ilhotas humanas dispersas que são transados pelo Lentivirus que carreg o RNA curto do hairpin (shRNA) é apresentado. Este protocolo utiliza prontamente-as embarcações disponíveis da enzima e da cultura, podem ser executadas facilmente, e produzem os pseudoislets humanos genetically modificados apropriados para estudos funcionais e morfológicos.
Resumo
Várias ferramentas genéticas estão disponíveis para modular genes em Ilhéus pancreáticos de roedores para dissecar a função de genes de ilhotas para pesquisa de diabetes. No entanto, os dados obtidos a partir de ilhotas de roedores muitas vezes não são totalmente reproduzidos ou aplicáveis às ilhotas humanas devido a diferenças bem conhecidas na estrutura e função da ilhós entre as espécies. Atualmente, as técnicas que estão disponíveis para manipular a expressão gênica de ilhotas humanas são muito limitadas. A introdução de transgene em ilhotas intactas por adenovirus, plasmídeo, e oligonucleotídeos muitas vezes sofre de baixa eficiência e alta toxicidade. A baixa eficiência é especial problemática em estudos do downregulation do gene em ilhotas intactas, que exigem a eficiência elevada. Soube-se que as pilhas enzymaticamente-dispersadas do Islet reagregam na cultura que dá forma aos esferoides denominados pseudoislets. O Reaggregation tamanho-controlado de pilhas humanas da ilhotas cria os pseudoislets que mantêm a primeira secreção dinâmica da insulina da fase após a cultura prolongada e fornecem uma janela para introduzir eficientemente o RNA curto lentivirais do hairpin (shRNA) com baixa toxicidade. Aqui, um protocolo detalhado para a criação de pseudoislets humanos após o transdução lentivirais usando duas placas de comercialmente disponíveis é descrito. O protocolo pode ser facilmente realizado e permite a downregulation eficiente dos genes e a avaliação do dinamismo da secreção de insulina usando células de Illet humanas. Assim, os pseudoislets humanos com modulação mediada lentivirais do gene fornecem um modelo poderoso e versátil para avaliar a função do gene dentro das pilhas humanas da ilhotas.
Introdução
A perda da massa beta funcional da pilha é a patologia central para o tipo-1 e o tipo-2 diabetes1. Enquanto as células beta são os produtores de insulina em ilhotas pancreáticas, a comunicação entre as células beta e as células não beta desempenha um papel crítico na regulação da secreção de insulina2. Além disso, a disregulação da secreção de glucagon contribui para a hiperglicemia no diabetes3. Assim, há um forte interesse em modular a expressão gênica de células dentro de ilhotas pancreáticas para abordar o mecanismo por trás do desenvolvimento da disfunção de ilhotas no diabetes. Uma variedade de aproximações que incluem ratos transgênicas está disponível para modular a expressão do gene de Islets do rato. Entretanto, as ilhotas humanas e do rato mostram a inervação distinta, a distribuição da pilha, a relação de beta às pilhas alfa, e a resposta aos secretagogos4. Portanto, a avaliação direta da função gênica em ilhotas humanas é extremamente importante para a compreensão da fisiopatologia das ilhotas pancreáticas humanas.
O vetor adenoviral é o vetor viral mais utilizado para transduce ilhotas pancreáticas in vitro devido à alta eficiência de transdução em células não-divisoras. No entanto, o adenovírus não penetra no núcleo das ilhotas de forma eficiente, especialmente nas ilhotas humanas5, e é citotóxica em altas doses6. Comparativamente, o vetor lentivirais é menos citotóxica e entrega genes exógenos permanentemente no cromossoma de pilhas borne-mitotic, fazendo lhe um veículo extensamente testado para a terapia do gene7. Entretanto, a capacidade do Lentivirus de penetrar o núcleo de ilhotas humanas intactas é limitada igualmente, assim exigindo a dispersão parcial pela digestão enzimática para aumentar a eficiência da transdução8. A ressalva com a dispersão de ilhotas humanas intactas é a interrupção da comunicação célula-célula e célula-matriz, que compromete a regulação dinâmica da secreção de insulina crítica para a manutenção da homeostase da glicose em seres humanos9. Assim, tem sido desafiador avaliar o impacto da modulação gênica na regulação dinâmica da função de ilhotas em um modelo de Ilhéus humanos.
Soube-se que as pilhas dispersadas do Islet das ilhotas humanas e do roedor reagregam autonomamente em Islet-como as estruturas chamadas "pseudoislets". Pseudoislets mostra a distribuição beta e non-beta da pilha similar às ilhotas nativas10,11. Adicionalmente, após a cultura a longo prazo, as ilhotas nativas perdem progressivamente a secreção robusta de insulina de primeira fase5,10,11,12. No entanto, as pseudoilhotas demonstraram melhor preservação da secreção de insulina de primeira fase em resposta à glicose em comparação com as ilhotas nativas após o mesmo período de cultura5. Além de ter melhor preservação da secreção de insulina, a reagregação controlada por tamanho de células de Illet humanas em placas de fixação baixas11 fornece uma janela de oportunidade para introduzir vetores de Lentivirus antes de sua reagregação em pseudoislets. Diversos estudos demonstraram a utilidade dos pseudoislets combinados com o transdução mediada lentivirais. Caton et al.13 relataram que a introdução da proteína verde fluorescente (GFP) expressando Lentivirus teve pouco efeito sobre a secreção de insulina, obtendo expressão homogênea de GFP em pseudoislets de ratos em comparação com o controle não infectado. Eles também demonstraram o efeito específico de diferentes connexinas na secreção de insulina por sobreexpressar as connexinas 32, 36 e 43 via Lentivirus13. Os pseudoislets humanos preparados com uma placa de acessório ultra-baixa disponível comercialmente de 96-well demonstraram que o superexpressão lentiviral-negociado do fator SIX3 da transcrição melhora o secretion da insulina avaliado pela incubação estática14. Recentemente, os pseudoislets humanos preparados com uma placa ultra-baixa do acessório 96-well foram usados para downregulam o glucokinase através do RNA curto lentivirais do hairpin (shRNA) como uma prova do princípio para mostrar que a secreção glucose-estimulada do insulin é reduzida, quando A secreção de insulina estimulada por KCl foi preservada5. O estudo igualmente demonstrou que os pseudoislets humanos são similares às ilhotas nativas na expressão de gene e nos perfis secretora, suportando mais a utilidade de pseudoislets humanos para dissecar a regulação da função de ilhotas5. Embora o perifusion não fosse executado, uma placa geneticamente modificados da cultura do de micropoços que se tornasse recentemente disponível comercialmente, foi relatada igualmente para ser compatível para o transdução lentivirais e produziu os pseudoislets humanos que exibiram a insulina excelente secreção in vitro e in vivo após o transplante11. Coletivamente, a formação de pseudoislet humana combinada com a transdução lentivirais é uma abordagem simples e eficiente para investigar a fisiopatologia da ilhotas humana, proporcionando uma valiosa ferramenta para realizar estudos mecanísticos em ilhotas humanas.
No relatório atual, um protocolo para dar forma a pseudoislets humanos transou com o Lentivirus usando duas plataformas comercialmente disponíveis, uma placa ultra-baixa do acessório 96-well e uma placa da cultura do de micropoços são apresentadas. Ambos conseguem a modulação eficiente da expressão gênica e criam pseudoislets humanos que são compatíveis para avaliações a jusante, incluindo incubação estática e perifusão.
Protocolo
Antes do início dos estudos, a determinação da pesquisa de sujeitos humanos foi feita pelo Conselho de revisão institucional da Universidade de Iowa, que determinou que o estudo não atendera aos critérios para pesquisa de sujeitos humanos. Consulte o Comitê de revisão local antes do início do estudo para determinar se a fonte de ilhotas e o estudo planejado exigem aprovação prévia.
Nota: Tipicamente, o equivalente do Islet 1200 − 1400 (IEQ) das ilhotas humanas é exigido para a formação de 192 pseudoislets no tamanho de 3.000 pilhas/pseudoislets em uma placa de acessório 96-bem ultra-baixa ou em 1.200 pseudoislets no tamanho de 500 pilhas/pseudoislets em um placa de cultura de micropoços. O IEQ das ilhotas exigidas varia entre diferentes preparações de ilhotas humanas como fatores doadores (idade, saúde, peso), eficiência de isolamento e condições de cultura afetam o rendimento da suspensão de uma única célula. Neste protocolo, o Lentivirus contendo shRNA visando um gene de interesse é usado. O citomegalovírus (CMV) e os vetores lentivirais baseados promotor da quinase do fosfoglicerato (hpgk) são relatados para para baixo-regulam o gene eficientemente em pseudoislets humanos5,15. O uso de Lentivirus requer precaução como Biohazard16. Entre em contato com o Comitê de biossegurança local antes do início do uso de Lentivirus.
1. cultura overnight de ilhotas humanas para recuperação após a expedição
- Prepare Connaught Medical Research Laboratories 1066 (CMRL-1066) médio suplementado com 1% de albumina sérica humana (HSA), combinando 50 mL de CMRL-1066, 0,5 g de HSA, 0,5 mL de penicilina-estreptomicina, e 0,5 mL de 100 mg/mL de glutamina (1% HSA CMRL) em biológico Gabinete de segurança (BSC) e passando por um filtro de 0,2 μm para esterilização.
- Rode suavemente a garrafa de transporte para manter as ilhotas em suspensão. Transfira o meio de transporte contendo ilhotas para um tubo de centrífuga cônico de 50 mL. Deixe o tubo sentar-se no BSC para 15 minutos de modo que as ilhotas se instalem à parte inferior do tubo.
- Retire o meio de transporte suavemente sem perturbar a pelota da ilífica usando uma pipeta de 10 mL. Re-suspender o pellet Islet em 1% HSA CMRL para uma concentração de 400 IEQ/mL.
- Ilhotas de transferência em um prato Tratado cultura não-tecido. Se as ilhotas são divididas em vários pratos, mantenha as ilhotas uniformemente suspensas em meio, girando suavemente antes de rachar. Ilhotas da cultura em 37 ° c em uma incubadora de 5% CO2 durante a noite.
Nota: O uso de um prato Tratado da cultura do não-tecido é exigido para impedir o acessório dos ilhotas à placa.
2. preparação de uma única célula de suspensão de ilhotas humanas
- Prepare o seguinte: CMRL-1066 médio com 10% de soro bovino fetal inativado por calor (HiFBS), penicilina-estreptomicina e glutamina (10% HiFBS CRML) à temperatura ambiente (RT), um filtro de 40 μm, um prato de Petri de 35 mm, uma seringa de tuberculina de 1 mL e um hemociômetro.
- Transfira ilhotas humanas após a cultura durante a noite em um tubo de centrífuga cônico de 15 mL. Centrifugador em 190 x g por 5 minutos em um rotor da balanç-cubeta. Aspirar meio com uma pipeta de 5 mL sem perturbar o pellet Islet.
- Lave o pellet adicionando 10 mL de soro fisiológico tamponado a fosfato (PBS) no tubo, misture suavemente e centrifugue a 190 x g durante 5 min. Aspire PBS sem perturbar a pelota da Illet.
- Re-suspender o pellet Islet em 0,5 mL de uma mistura de enzima proteolítica e colagenolítica pré-aquecido e pipeta 5x usando uma pipeta P1000 para misturar ilhotas. Incubar a 37 ° c durante 5 min. Misture pipetando para cima e para baixo suavemente 1 − 5 vezes.
Nota: A pipetagem agressiva aumentará a perda de células. - Verifique se há nebulosidade (células individuais) e o número de flocos (ilhotas não digeridas). Adicione 2 − 3 minutos à incubação de 37 ° c dependendo da extensão da digestão julgada pelo nebulosidade e pelo número de flocos. Pare a digestão quando os flocos são reduzidos a ~ 10% da pré-digestão e a solução é nebulosa.
Nota: O tempo exigido para a digestão difere dependendo da distribuição do tamanho do Islet de cada preparação humana do Islet. - Coloque um filtro de 40 μm em uma placa de Petri de 35 mm e molhe o filtro adicionando 1 mL de HiFBS de 10% CMRL e pressionando com o êmbolo da seringa de 1 mL. Transfira toda a suspensão da pilha em cima do filtro e colete a passagem em um tubo de 15 mL fresco.
- Lave o tubo usado para a digestão da Ilina com 0,5 mL de meio fresco de CMRL para coletar pilhas restantes e para passar a lavagem através do filtro. Combine a passagem em um tubo de 15 mL. Repita uma vez.
- Em seguida, dissociar ilhotas não digeridas restantes no filtro pressionando o filtro colocado em um prato de 35 mm com 1 mL de êmbolo da seringa. Colete a passagem novamente e lave o filtro com o CMRL-1066 fresco para remover todas as ilhotas digeridas restantes do filtro e do prato. Um total de ~ 3 mL de suspensão de uma única célula será agora no tubo de 15 mL.
- Registre o volume total da suspensão celular e tome 10 μL de alíquota de células para contar o número da célula em um hemociômetro.
- Centrifugar a suspensão da célula durante 5 min a 200 x g. Remova o meio sem perturbar o pellet. Avance para o passo 3.1.1 se utilizar uma placa de fixação 96-bem Ultrabaixa ou passo 3.2.1 se utilizar uma placa de cultura de micropoços de 24 poços para reagregar as células.
3. formação de pseudoislet e transdução por Lentivirus
- Protocolo usando um 96-bem ultra-baixa placa de fixação
- Determine o número desejado de células por pseudoislet e o número de pseudoislets a serem criados. Tipicamente, as pilhas 1000 − 3000 são usadas para cada pseudoislet para uma placa ultra-baixa do acessório 96-well. Para 3.000 pilhas por o pseudoislet, ajuste a suspensão da pilha a 1 x 105 Cells/ml resuspendo a pelota da Ilina da etapa 2,10 em 10% HiFBS CMRL de modo que 30 μl da suspensão da pilha tenham 3.000 pilhas. Calcule o volume total de 1 x 105 células/ml de suspensão de célula única (ml) necessária usando a seguinte equação:
O volume total de 1 x 105 células/ml de uma única célula de suspensão (ml) = (número de células por pseudoislet) x (número de pseudoislets que está sendo feito)/1 x 105.
Nota: Ajuste a concentração da suspensão celular com base no número desejado de células por pseudoislet para que 30 μL de suspensão celular faça um pseudoislet. - Transfira o volume necessário (30 μL x número de pseudoislets que estão sendo feitos) da única suspensão da pilha a um tubo de 15 mL fresco. Adicionar 250 unidades de transdução (TU)/célula de Lentivirus contendo shRNA visando um gene de interesse ou controle.
Atenção: O Lentivirus é classificado como nível de biossegurança 2 e pode ser integrado ao DNA de células infectadas.
Nota: Use Lentivirus concentrado para que o volume de Lentivirus adicionado é mínimo. O Titer exigido por a pilha para o silenciamento de gene eficiente pode diferir dependendo da construção lentivirais. - Misture a suspensão celular com o vírus pipetando suavemente 5x com uma pipeta P1000. Transfira células mistas para um reservatório de reagente estéril de 50 mL se utilizar uma pipeta de 8 canais.
- Dispense 30 μL por poço de suspensão de célula única misturada com Lentivirus em cada poço usando uma pipeta de 8 canais ou uma pipeta P200 dependendo do número dos poços.
- Centrifugue a placa 96-well em um centrifugador da placa da balanç-cubeta em 270 x g em RT para 7 min. verific se as pilhas estão recolhidas no centro de cada poço. Se não, centrifugue outra vez como a coligação de todas as pilhas no centro do poço é crítica para a formação do pseudoislet. Cultura em 37 ° c em uma incubadora humidificada de 5% CO2 durante a noite.
- Adicionar 100 μL de pré-aquecido 10% HiFBS CMRL por bem na manhã seguinte para evitar a secagem de células durante a cultura subsequente. Centrifugador em 270 x g, RT para a cultura de 7 min. em 37 ° c em uma incubadora de 5% co2 . Os pseudoislets completarão a formação em 5 − 7 dias.
- Ao colher pseudoislets, pré-aqueça o volume desejado de 10% HiFBS CMRL (100 μL por ilhós), prepare 1 50 mL de reservatório estéril, uma placa de Petri estéril de 10 cm, e uma pipeta de 8 canais em BSC.
- Retire a placa 96-well da incubadora e coloc no BSC. Pipete 100 μL por ilhã de 10% de HiFBS CMRL em um reservatório.
- Pipeta 100 μL por poço de 10% HiFBS CMRL de um reservatório a pseudoislets e pipeta acima e para baixo 2-3 vezes delicadamente no poço para levantar ilhotas acima. Em seguida, aspirar meio no poço contendo um pseudoillet e ejetar em um prato de Petri de 10 cm. O uso de uma pipeta de 8 canais permite a transferência de 8 pseudoislets ao mesmo tempo.
- Verific a placa um microscópio claro para assegurar a remoção completa de todos os pseudoislets. Os pseudoislets formam agregados firmes e permanecem agregados após o levantamento. Os pseudoislets estão agora prontos para experimentos a jusante.
- Determine o número desejado de células por pseudoislet e o número de pseudoislets a serem criados. Tipicamente, as pilhas 1000 − 3000 são usadas para cada pseudoislet para uma placa ultra-baixa do acessório 96-well. Para 3.000 pilhas por o pseudoislet, ajuste a suspensão da pilha a 1 x 105 Cells/ml resuspendo a pelota da Ilina da etapa 2,10 em 10% HiFBS CMRL de modo que 30 μl da suspensão da pilha tenham 3.000 pilhas. Calcule o volume total de 1 x 105 células/ml de suspensão de célula única (ml) necessária usando a seguinte equação:
- Protocolo utilizando uma placa de cultura de micropoços de 24 poços
- Aqueça a solução de enxaguamento de anti aderência (tabela de materiais) para RT para uma formação esferóide eficiente. Também, CMRL liso pre-morno-1066 e 10% HiFBS CMRL.
- Adicione 500 μL por poço da solução de enxaguamento de antiaderência a cada poço da placa de cultura de micropoços de 24 poços a ser usada para pseudoislets. Centrifugador em 1.300 x g por 5 minutos em um centrifugador da placa da balanç-cubeta.
- Observe a placa um microscópio para assegurar-se de que as bolhas de ar estejam removidas dos micropoços. Se as bolhas de ar estiverem presas em micropoços, centrifugue a 1.300 x g por 5 min novamente.
- Aspirar a solução de enxaguamento antiaderenciante dos poços em um BSC. Enxágüe cada poço com 2 mL de CMRL-1066 liso morno uma vez. Aspirar CMRL-1066. Adicionar 0,5 mL/poço de quente 10% HiFBS CMRL a cada poço planejado para uso. Os poços estão agora prontos para carregar células de Ilíadas humanas dispersas preparadas na etapa 2,10.
- Determine o número total de células necessárias para cada poço. Um poço da placa da cultura do de micropoços de 24 poços contem 1.200 micropoços e formulários 1.200 pseudoislets. 500 células por pseudoislet x 1200 micropoços = 6 x 105 células. Ressuscitem células únicas da etapa 2,10 para 6 x 105 células em 0,8 ml de 10% HiFBS CMRL em um tubo de 1,5 ml estéril.
Nota: O volume máximo por poço é de 2 mL. O volume de suspensão celular não deve exceder 1,5 mL. O protocolo descreve as etapas para criar um poço do pseudoislet transado pelo Lentivirus. Escale acima dependendo do número de poços a ser feitos para cada Lentivirus. - Para a transdução viral, adicione 125 TU/célula à suspensão de uma única célula. Mantenha o volume de vírus abaixo de 0,2 mL. Incubar a mistura da pilha e do vírus em 37 ° c com a mistura delicada ocasional para 1 h para permitir o contato das pilhas com o vírus antes da condensação das pilhas na etapa 3.2.8.
Nota: Use Lentivirus concentrado para que o volume de Lentivirus adicionado é mínimo. Menor número de TU por célula é usado para o protocolo 2 em comparação com o protocolo 1 como o volume total de médio por número de células é menor. No entanto, o título exigido por célula para o silenciamento genético eficiente pode diferir dependendo da construção lentivirais e das necessidades de otimização.
Atenção: O Lentivirus é classificado como nível de biossegurança 2 e pode ser integrado ao DNA de células infectadas. - Após 1 h, ajuste o volume total da pilha de Islet e a mistura de vírus para 1 mL adicionando 10% de HiFBS CMRL. Se as células formam o moita após a incubação de 1 h, dispersam-se na única suspensão da pilha por pipetagem suave e rápida 2 − 3 vezes. A pipetagem é muito importante para a distribuição uniforme de células através de micropoços. Transfira a suspensão da pilha a um poço da placa da cultura do de micropoços de 24 poços.
- Imediatamente após a pipetagem, centrifugue a 100 x g durante 3 min em RT para capturar células em todos os micropoços. Observe um microscópio para verificar se as células estão distribuídas uniformemente em todos os micropoços.
- Cultura a placa da cultura do de micropoços em 37 ° c em uma incubadora de 5% co2 . Os pseudoislets formarão em 24 − 48 h. os Pseudoislets podem ser cultivados sem mudança média por até 7 dias.
- Ao mudar o meio para a cultura além de 7 dias, substitua 50% − 75% do meio para cada mudança média como segue. Retire lentamente 0,5 − 1 mL de meio usando uma pipeta P1000 de cada poço. Adicione 0.5 − 1 ml de hifbs frescos de 10% cmrl lentamente coloc uma ponta à parede do poço para evitar desalojar pseudoislets da placa da cultura do de micropoços.
- Para se preparar para a colheita de pseudoislets, aqueça o meio de HiFBS CMRL de 10%. Pseudoislets tendem a flutuar acima no soro livre CMRL-1066 que faz o duro escolhê-los.
- Aspirar 0,5 ml do meio do poço usando uma pipeta de 1 ml e dispensar meios vigorosamente de volta à superfície da placa para levantar pseudoislets da placa da cultura do de micropoços.
- Aspirar delicadamente pseudoislets desalojados usando a pipeta de 1 mL e as ilhotas de transferência em uma cultura do não-tecido trataram a placa de 6 poços. Passe por um pequeno filtro reversível de 37 μm colocado em um tubo cônico de 15 mL. Pseudoislets permanecerá no filtro; todas as células únicas não incorporadas fluirão.
Nota: Para evitar a perda de pseudoislets do tamanho menor através do filtro, o filtro pode ser omitido. - Dispense 1 mL de 10% de HiFBS CMRL em toda a superfície do poço para desalojar quaisquer pseudoilhotas remanescentes, aspirar pseudoislets desalojadas e passar pelo filtro. Repita 3x para assegurar a coleção completa de todos os pseudoislets dos poços.
- Observe a placa da cultura do micropoço um microscópio invertido para assegurar-se de que todos os pseudoislets estejam recolhidos. Repita a lavagem como na etapa 3.2.14 se os pseudoislets remanescem.
4. extração de RNA para avaliação da eficiência da Silenciação genética
- Escolha pseudoislets no PBS livre de RNase em um tubo do microcentrifugador de 1,5 mL e centrifugue em 300 x g por 3 minutos em 4 ° c. Retire a PBS sem perturbar a pelota da Ilina e lave uma vez com PBS seguida de centrifugação a 300 x g durante 3 min a 4 ° c.
- Aspirar a maioria de PBS usando uma pipeta P1000. Em seguida, mude para uma pipeta P10 para remover o resto da PBS sem perturbar o pellet Islet.
- Adicionar 0,5 mL de reagente de extração de RNA de tiocianato de guanidínio (tabela de materiais) por tubo. Homogeneize os pseudoislets usando um pilão motor-conduzido por 2 − 3 vezes. O homogeneate no reagente da extração do RNA do tiocianato do guanidina pode agora ser armazenado em-80 ° c ou ser processado para a purificação do RNA.
Nota: 24 das 3.000 células-pseudoislets formadas em uma placa de poço 96 ou 48 das 500 células-pseudoislets formadas em uma placa de cultura de micropoços são suficientes para obter 0,5 − 1 ΜG de RNA.
Resultados
A Figura 1 ilustra as etapas-chave na produção de pseudoislets usando uma placa de fixação ultra-baixa de 96 poços e uma placa de cultura de micropoços. A Figura 2a mostra alterações sequenciais na morfologia durante a formação de pseudoislets de 3 x 103 células de ilhotas humanas em uma placa de fixação ultra-baixa de 96 poços. Monocamada ou aglomerações soltas de células observadas no dia 1 mudaram para agregados sólidos com uma borda lisa e arredondada por dia 5 a 7 (Figura 2a). Em uma placa da cultura do de micropoços, a formação de pseudoislets contínuos é geralmente visível dentro de 4 dias (Figura 2b). Quando 600 pilhas/micropoços foram chapeados na placa da cultura do de micropoços, as pilhas humanas do Islet foram condensadas em esferoides do tamanho uniforme. Observa-se que uma placa da cultura do de micropoços permite a formação bem sucedida dos pseudoislets de um número pequeno de pilhas comparado com uma placa ultra-baixa do acessório 96-well. Tipicamente, sobre 1.500 pilhas/pseudoislet são necessários para uma placa ultra-baixa do acessório 96-well, quando as pilhas 500/pseudoislet forem suficientes para uma placa da cultura do de micropoços de 24 poços. Os pseudoislets formados com sucesso permanecem como esferoides após a recuperação de uma placa de acessório ultra-baixa 96 ou de uma placa da cultura do de micropoços e são compatíveis para aplicações a jusante que incluem a incubação estática (Figura 3a) e o perifusion (Figura 3B). o tamanho uniforme dos pseudoislets reduz a variação dentro de um grupo de teste e permite a incubação estática usando tão pouco quanto 5 pseudoislets por a medida (Figura 3a). Também, os pseudoislets humanos mantiveram a primeira secreção robusta da insulina da fase em resposta à glicose após 7 dias da cultura quando as ilhotas humanas originais cultivadas por um período similar de tempo mostraram a secreção glicose-estimulada primeira fase da insulina-estimulação ( Figura 3B)5. A introdução do Lentivirus em uma única suspensão da pilha assegura a transdução eficiente e homogênea de pilhas da Illet e alcança altamente eficiente para baixo-regulagem dos genes como mostrado na Figura 3C. Todos os resultados mostrados foram obtidos por meio de ilhotas humanas de doadores não diabéticos.

Figura 1: processo de preparação de pseudoislet humano. (a) a suspensão contendo 4.000 IEQ de ilhotas humanas torna-se turva após a digestão por uma mistura proteolítica e colagenolítica da enzima e pipetagem ligeira. (b) as ilhotas humanas após a dispersão são passadas através de um filtro. As ilhotas não digeridas restantes no topo do filtro são dispersas utilizando um êmbolo de seringa de 1 mL. (c, d) Imagens do microscópio da única suspensão da pilha que contem 3.000 pilhas/poço em uma placa ultra-baixa do acessório 96-well antes (c) e após (d) centrifugação. (e, f) Imagens do microscópio da única suspensão da pilha que contem 500 pilhas/de micropoços em uma placa da cultura do de micropoços de 24 poços antes (e) e após (f) centrifugação. Barra de escala = 250 μm. por favor clique aqui para ver uma versão maior desta figura.

Figura 2: morfologia de pseudoislets humanas. As mudanças sequenciais na morfologia de pseudoislets humanos criaram (a) em uma placa ultra-baixa do acessório 96-well de 3.000 pilhas e (b) em uma placa da cultura do de micropoços de 24 poços de 500 pilhas. Barra de escala = 100 μm. por favor clique aqui para ver uma versão maior desta figura.
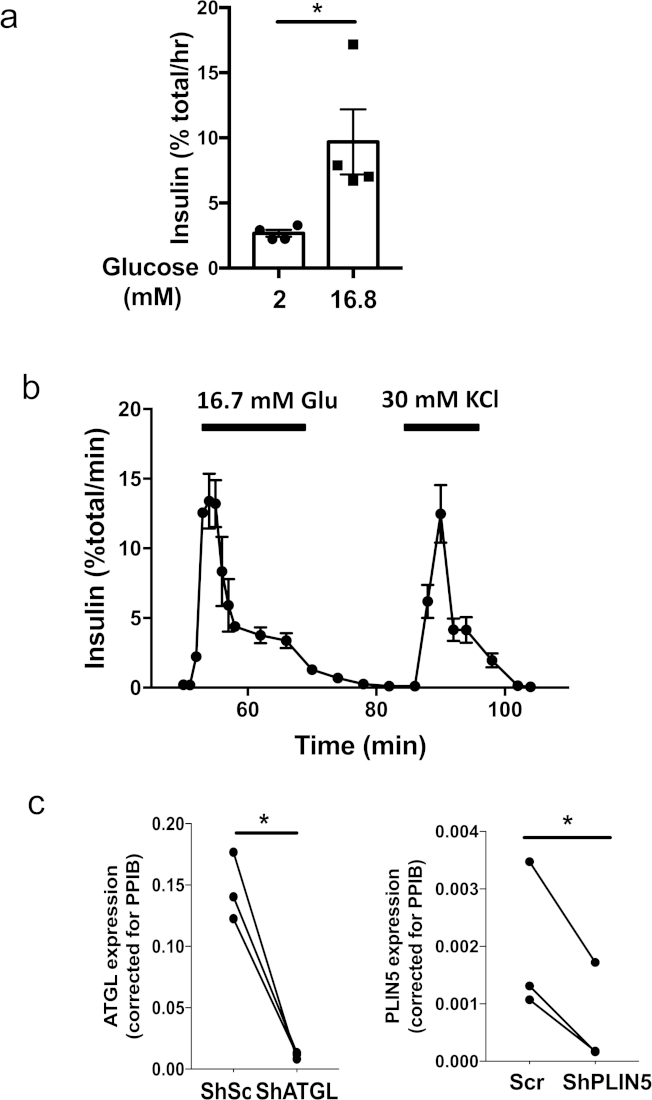
Figura 3: exemplos de ensaios funcionais utilizando pseudoilhotas humanas. (a) a incubação estática representativa executou usando os pseudoislets humanos criados em uma placa da cultura do de micropoços de um único doador no tamanho de 500 pilhas humanas da ilhotas por o pseudoislet. Quatro conjuntos de 5 pseudoislets foram incubados por 1 h em tampão de bicarbonato de Krebs-Ringer suplementado com glicose de 2 mM ou 16,8 mM. Cada símbolo representa a secreção de insulina de um conjunto de 5 pseudoilhotas. Média ± erro padrão da média (MEV) é mostrada. *, p < 0, 5 pelo teste t de Student. Resultados representativos de três doadores. (b) a secreção de insulina representativa de testes de perifusão de pseudoislets humanas criadas em uma placa de cultura de micropoços em resposta a 16,7 mm de glicose e 30 mm de KCl. o método para o perifusion foi publicado previamente5. A média ± SEM da secreção de insulina de dois conjuntos de 40 pseudoislets criados em uma placa de cultura de micropoços de um único doador no tamanho de 500 células de ilhotas humanas por placa de pseudoislet é mostrada. Dados representativos de seis doadores. (c) pseudoislets foram criados com Lentivirus transportando shRNA visando atgl humano (visando CCTGCCACTCTATGAGCTTAA, esquerda) ou PLIN5 (segmentação GACAAGCTGGAAGAGAAGCTT, direita). Os pseudoislets do controle foram transados com o Lentivirus que expressa a seqüência embaralhada (SCR) publicou previamente5. A expressão do mRNA de cada gene foi determinada pela reacção em cadeia do polymerase do tempo real (PCR) como publicado previamente5. Os dados foram expressos por meio de 2-DDCT tomando peptidilprolil isomerase B (PPIB) como controle interno17. Cada ponto representa dados de cada doador para uma cartilha indicada e um conjunto de dados do mesmo doador é conectado por uma linha. N = 3 doadores. *; p < 0, 5 pelo teste t de Student. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Aqui, um protocolo detalhado para gerar pseudoislets humanos que são transviados pelo Lentivirus usando uma placa de acessório ultra-baixa 96-well ou uma placa da cultura do de micropoços é apresentado. Os pseudoislets foram relatados para demonstrar a morfologia e as funções secretora similares às ilhotas humanas nativas e podem ser cultivados por o tempo prolongado in vitro5,11,12. Ao contrário das ilhotas humanas nativas que mostram uma grande variação no tamanho, os pseudoislets são relativamente uniformes no tamanho, reduzindo a variação entre doadores e repetições experimentais5,11. O downregulation dos genes que exigem a eficiência elevada da transdução pode ser executado facilmente antes da formação de pseudoislets na única suspensão da pilha. Este método evita a dificuldade de penetração viral através de camadas de células em ilhotas intactas. Assim, este protocolo simples, altamente eficiente, e reprodutível para a criação de pseudoislets humanos tem aplicações largas.
Enquanto várias plataformas diferentes foram relatadas para a formação de pseudoislets12,14,19,20, tanto uma placa de fixação 96-bem ultra-baixa e uma placa de cultura micropoços são disponível comercialmente, permitindo que esta técnica seja adotada por qualquer laboratório. Embora o método de queda de suspensão12 também permite a formação de pseudoislets humanos usando Labware comum, as limitações potenciais incluem a dificuldade em controlar o tamanho e a duração da reagregação de pseudoislets. Estas limitações eram devido ao volume limitado por a gota do pseudoislet e da evaporação em curso durante a cultura do dia 5 − 7 exigida para a formação do pseudoislet. Além disso, é mais fácil conter Lentivirus com o uso de uma placa de fixação 96 bem ultra baixa ou uma placa de cultura de micropoços em comparação com o método de suspensão-gota.
Várias etapas dentro do protocolo exigem muita atenção. Otimizando a digestão de ilhotas intactas com a mistura proteolítica e colagenolítica enzima é crítico, uma vez que tanto sob-e excesso de digestão irá reduzir o rendimento de suspensão única célula e, subsequentemente, afetam a agregação de pseudoislets. Durante a digestão, é importante monitorar de perto as ilhotas para o desaparecimento de aglomerados e o aumento da nebulosidade como ilhotas dissociam-se em células individuais. É importante notar que o tempo ideal para a digestão varia entre ilhotas de diferentes doadores. O tempo ideal depende de vários fatores, incluindo a história médica e a idade de cada doador, o tempo de isquemia, o procedimento de isolamento da Ilíada, o tamanho das ilhas, a pureza da Illet, a viabilidade das ilhas e as condições de transporte. Tipicamente, as ilhotas humanas com viabilidade e pureza superiores a 80% e dentro de 5 dias de isolamento são utilizadas. A pipetagem cuidadosa e suave durante a dispersão também é importante para manter a viabilidade celular e recuperação que acabará por afetar a agregação celular e o tamanho final de pseudoislets sendo formado. Ao dispensar a suspensão da pilha da Illet aos poços (etapas 3.1.4 e 3.2.7), a mistura delicada e completa das pilhas é importante conseguir uma distribuição uniforme de únicas pilhas em micropoços. Se as células formam aglomeração após 1 h de incubação com Lentivirus, requer pipetagem suave para quebrar os aglomerantes em suspensão única célula antes da centrifugação final.
Nós tivemos o sucesso similar em criar pseudoislets humanos após a transdução lentivirais usando uma placa da placa e da cultura do de micropoços de 96-well. A escolha entre as duas plataformas depende do tamanho e do número de pseudoislets desejados. Uma placa de cultura micropoços tem pequenas, fundo em forma de pirâmide permitindo a condensação de um menor número de células em comparação com uma placa de fundo 96 bem redonda. Assim, o número de pilhas por o pseudoislet pode ser reduzido para uma placa da cultura do de micropoços. Também, uma única etapa da centrifugação cria todos os pseudoislets simultaneamente em uma placa da cultura do de micropoços quando a pipetagem múltipla for exigida criando pseudoislets em uma placa 96-well. Assim, escalar acima a criação dos pseudoislets é mais fácil em uma placa da cultura do de micropoços. No entanto, a placa de cultura de micropoços atualmente disponível não oferece flexibilidade no número de pseudoislets que estão sendo criados. Atualmente, o número mínimo de pseudoislets criados usando uma placa da cultura do de micropoços é 1.200 e pode ser aumentado somente pelo fator de 1.200. Assim, nós usamos tipicamente uma placa 96-well para experimentos piloto da escala pequena e para um experimento em que a quantidade pequena de amostras é suficiente tal como um ensaio da secreção do insulin e a extração do RNA para a expressão de Gene. Nós usamos pseudoislets de uma placa da cultura do de micropoços para os ensaios que exigem o grande número de pilhas tais como o borrão ocidental, a determinação da taxa do consumo do oxigênio por um analisador metabólico, e a extração do triglicérides.
O fator limitante principal para a geração de pseudoislets humanos é a perda de pilhas durante a preparação da única suspensão da pilha. Quando 1 IEQ do Islet humano for considerado conter ao redor 2.000 pilhas, a recuperação da única suspensão da pilha é tipicamente 30% ou mais baixa devido à lavagem múltipla e ao passar através de um filtro. A heterogeneidade do tamanho do ilhós também torna difícil dissociar todas as ilhotas simultaneamente. Quando a pipetagem delicada e o uso da mistura proteolíticas e gelatinolitica da enzima no protocolo forem esforços combinar forças mecânicas e enzimáticas para a recuperação máxima de únicas pilhas, há ainda uma perda inevitável de pilhas. Assim, a aplicação de pseudoislets exige a justificação desobstruída sobre estudar ilhotas humanas intactas. Ele também precisa ser lembrado que a secreção de insulina de pseudoislets é mais robusta do que as ilhotas cultivadas para o mesmo período do tempo, mas tende a ser menor em comparação com ilhotas recém-isoladas5,11.
Embora existam limitações, o silenciamento genético estável e altamente eficiente combinado com uma melhor preservação da secreção de insulina estimulada por glicose por tempo prolongado na cultura possibilita a avaliação da função gênica em células de ilhas humanas. Adicionalmente, a comunicação intercelular complexa entre beta-beta e beta-não beta-pilhas é propor para ter um papel regulamentar na função do Islet. No entanto, há atualmente informações limitadas sobre a comunicação intercelular dentro das ilhotas humanas. Com a disponibilidade aumentada de marcadores específicos da pilha21, é praticável criar pseudoislets humanos com composição da pilha definida, como relatado recentemente nas pilhas22da ilhotas do rato, que facilitará a compreensão melhorada do Cell-Cell comunicação entre as células da ilíte humana. O avanço recente da imagem latente de tecidos tridimensionais igualmente aumenta potencialmente a utilidade de pseudoislets humanos como um modelo para desmascarar como a polaridade celular e a comunicação intercelular são reguladas em ilhotas humanas. Assim, os pseudoislets humanos fornecem um modelo útil para dissecar as funções dos genes do interesse e das outras perguntas no campo da biologia do Islet.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado financeiramente pelos institutos nacionais de saúde para Y.I. (R01-DK090490) e American Diabetes Association to Y.I. (1-17-IBS-132). J.A. e Y.I. são apoiados pela ordem fraterna do centro de pesquisa de diabetes Eagles. O A.B. é apoiado por um subsídio de formação nacional dos institutos de saúde (T32NS45549). Os autores utilizaram ilhotas pancreáticas humanas fornecidas pelo programa integrado de distribuição de ilhotas (IIDP), financiado pela NIDDK, na cidade da esperança (2UC4DK098085).
Materiais
| Name | Company | Catalog Number | Comments |
| Anti-adherence rinsing solution | Stemcell technologies | 7919 | |
| Biological safety cabinet | Thermo Scientific | 1300 Series Type A2 | |
| Cell strainer, 40 micrometer | Corning | 431750 | |
| CMRL-1066 | ThermoFisher | 11530037 | |
| CO2 incubator | Thermo Scientific | Heracell VIOS 160i | |
| Conical centrifuge tube, 15 mL | VWR | 89039-666 | |
| Conical centrifuge tube, 50 mL | VWR | 89039-658 | |
| Fetal bovine serum | ThermoFisher | 26140079 | |
| Guanidinium thiocyanate RNA extraction reagent | ThermoFisher | 15596026 | Trizol |
| Glutamine | ThermoFisher | 25030164 | |
| Hemocytometer | Marien Feld | Neubauer-Improved Bright line | |
| Human serum albumin | Sigma | A1653 | |
| Inverted microscope | Fisher brand | 11-350-119 | |
| Microcentrifuge | Beckman Coulter | Microfuge 20 | |
| Microcentrifuge tube, 1.5 mL | USA Scientific | 1615-5500 | |
| Microwell culture plate | Stemcell technologies | 34411 | Aggrewell 400, 24 well |
| Motor-driven pestle | GAMUT | #399X644 | |
| Non-tissue culture treated dish, 10 cm | Fisher Scientific | FB0875713 | |
| PBS | ThermoFisher | 14190250 | |
| Penicillin-streptomycin | ThermoFisher | 10378016 | |
| Petri dish, 35 mm | Celltreat | 229638 | |
| Pipette, 5 mL | DOT Scientific, | 667205B | |
| Pipette, 8-channel | VWR | #613-5253 | |
| Pipette, 10 mL | VWR | 667210B | |
| Pipette, P10 | Denville | UEZ-P-10 | |
| Pipette, P200 | Denville | UEZ-P-200 | |
| Pipette, P1000 | Denville | UEZ-P-1000 | |
| Proteolytic and collagenolytic enzyme mixture | Sigma | A6965 | Accutase |
| Reagent reservoir, 50 mL | VWR | 89094-680 | |
| Reversible strainer, 37 micrometer | Stemcell technologies | 27251 | |
| Swing bucket plate centrifuge | Beckman Coulter | Allegra X-14R | |
| Swing bucket rotor | Beckman Coulter | SX4750A | |
| Tuberculin syringe, 1 mL | BD | 309659 | |
| Ultra low attachment microplate, 96 well | Corning | 4515 |
Referências
- Chen, C., Cohrs, C. M., Stertmann, J., Bozsak, R., Speier, S. Human beta cell mass and function in diabetes: Recent advances in knowledge and technologies to understand disease pathogenesis. Molecular Metabolism. 6 (9), 943-957 (2017).
- Hong, H., Jo, J., Sin, S. J. Stable and flexible system for glucose homeostasis. Physiological Review E covering statistical, nonlinear, biological, and soft matter physic. 88 (3), 032711 (2013).
- Cryer, P. E. Minireview: Glucagon in the pathogenesis of hypoglycemia and hyperglycemia in diabetes. Endocrinology. 153 (3), 1039-1048 (2012).
- Arrojo e Drigo, R., et al. New insights into the architecture of the islet of Langerhans: a focused cross-species assessment. Diabetologia. 58 (10), 2218-2228 (2015).
- Harata, M., et al. Delivery of shRNA via lentivirus in human pseudoislets provides a model to test dynamic regulation of insulin secretion and gene function in human islets. Physiological Reports. 6 (20), e13907 (2018).
- Barbu, A. R., Akusjarvi, G., Welsh, N. Adenoviral-mediated transduction of human pancreatic islets: importance of adenoviral genome for cell viability and association with a deficient antiviral response. Endocrinology. 146 (5), 2406-2414 (2005).
- Hughes, A., et al. Gene therapy to improve pancreatic islet transplantation for Type 1 diabetes mellitus. Current Diabetes Reviews. 6 (5), 274-284 (2010).
- Jimenez-Moreno, C. M., et al. A Simple High Efficiency Intra-Islet Transduction Protocol Using Lentiviral Vectors. Current Gene Therapy. 15 (4), 436-446 (2015).
- Bonora, E., et al. Prevalence and correlates of post-prandial hyperglycaemia in a large sample of patients with type 2 diabetes mellitus. Diabetologia. 49 (5), 846-854 (2006).
- Halban, P. A., Powers, S. L., George, K. L., Bonner-Weir, S. Spontaneous reassociation of dispersed adult rat pancreatic islet cells into aggregates with three-dimensional architecture typical of native islets. Diabetes. 36 (7), 783-790 (1987).
- Yu, Y., et al. Bioengineered human pseudoislets form efficiently from donated tissue, compare favourably with native islets in vitro and restore normoglycaemia in mice. Diabetologia. 61 (9), 2016-2029 (2018).
- Zuellig, R. A., et al. Improved physiological properties of gravity-enforced reassembled rat and human pancreatic pseudo-islets. Journal of Tissue Engineering and Regenerative Medicine. 11 (1), 109-120 (2017).
- Caton, D., et al. Lentivirus-mediated transduction of connexin cDNAs shows level- and isoform-specific alterations in insulin secretion of primary pancreatic beta-cells. Journal of Cell Science. 116 (Pt 11), 2285-2294 (2003).
- Arda, H. E., et al. Age-Dependent Pancreatic Gene Regulation Reveals Mechanisms Governing Human beta Cell Function. Cell Metabolism. 23 (5), 909-920 (2016).
- Peiris, H., et al. Discovering human diabetes-risk gene function with genetics and physiological assays. Nature Communications. 9 (1), 3855 (2018).
- Schlimgen, R., et al. Risks Associated With Lentiviral Vector Exposures and Prevention Strategies. Journal of Occupational and Environmental Medicine. 58 (12), 1159-1166 (2016).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Li, N., et al. Engineering islet for improved performance by optimized reaggregation in alginate gel beads. Biotechnology and Applied Biochemistry. 64 (3), 400-405 (2017).
- Ramachandran, K., Peng, X., Bokvist, K., Stehno-Bittel, L. Assessment of re-aggregated human pancreatic islets for secondary drug screening. British Journal of Pharmacology. 171 (12), 3010-3022 (2014).
- Hilderink, J., et al. Controlled aggregation of primary human pancreatic islet cells leads to glucose-responsive pseudoislets comparable to native islets. Journal of Cellular and Molecular Medicine. 19 (8), 1836-1846 (2015).
- Saunders, D. C., et al. Ectonucleoside Triphosphate Diphosphohydrolase-3 Antibody Targets Adult Human Pancreatic beta Cells for In Vitro and In Vivo Analysis. Cell Metabolism. (18), (2018).
- Reissaus, C. A., Piston, D. W. Reestablishment of Glucose Inhibition of Glucagon Secretion in Small Pseudoislets. Diabetes. 66 (4), 960-969 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados