Method Article
Lentiviral vermittelte Gen-Silencing in humanem Pseudoislet in niedrigen Befestigungsplatten zubereitet
In diesem Artikel
Zusammenfassung
Ein Protokoll zur Erstellung genmodifizierter menschlicher Pseudoislets aus dispergierten menschlichen Inselzellen, die durch Lentivirus mit kurzer Haarnadel-RNA (shRNA) transduziert werden, wird vorgestellt. Dieses Protokoll verwendet leicht verfügbare Enzym- und Kulturgefäße, kann leicht durchgeführt werden und produziert genetisch veränderte menschliche Pseudoislets, die für funktionelle und morphologische Studien geeignet sind.
Zusammenfassung
Verschiedene genetische Werkzeuge stehen zur Verfügung, um Gene in Pankreasinseln von Nagetieren zu modulieren, um die Funktion von Inselgenen für die Diabetesforschung zu sezieren. Die von Nagetierinseln gewonnenen Daten werden jedoch aufgrund bekannter Unterschiede in der Inselstruktur und -funktion zwischen den Arten oft nicht vollständig auf menschlichen Inseln reproduziert oder sind auf sie anwendbar. Derzeit sind Techniken, die zur Verfügung stehen, um die Genexpression menschlicher Inseln zu manipulieren, sehr begrenzt. Die Einführung von Transgen entumlässt durch Adenovirus, Plasmid und Oligonukleotide in intakte Inseln und leidet häufig unter geringer Effizienz und hoher Toxizität. Eine geringe Effizienz ist besonders problematisch in Gendownregulationsstudien an intakten Inselchen, die eine hohe Effizienz erfordern. Es ist bekannt, dass enzymatisch dispergierte Inselzellen sich in kulturbildenden Sphäroiden, die als Pseudoislets bezeichnet werden, neu anaggregieren. Die größengesteuerte Reaggregation menschlicher Inselzellen erzeugt Pseudoislets, die die dynamische Insulinsekretion der ersten Phase nach längerer Kultur aufrechterhalten und ein Fenster zur effizienten Einführung von lentiviraler Kurzhaarnadel-RNA (shRNA) mit geringer Toxizität bieten. Hier wird ein detailliertes Protokoll zur Herstellung menschlicher Pseudoislets nach lentiviraler Transduktion mit zwei handelsüblichen Mehrwellplatten beschrieben. Das Protokoll kann leicht durchgeführt werden und ermöglicht eine effiziente Downregulation von Genen und die Beurteilung der Dynamik der Insulinsekretion mit menschlichen Ischenzellen. So bieten menschliche Pseudoislets mit lentiviral vermittelter Genmodulation ein leistungsfähiges und vielseitiges Modell zur Beurteilung der Genfunktion in menschlichen Inselzellen.
Einleitung
Der Verlust der funktionellen Beta-Zellmasse ist die zentrale Pathologie für Typ-1- und Typ-2-Diabetes1. Während Betazellen die Produzenten von Insulin in Pankreasinseln sind, spielt die Kommunikation zwischen Betazellen und Nicht-Beta-Zellen eine entscheidende Rolle bei der Regulierung der Insulinsekretion2. Darüber hinaus trägt die Dysregulation der Glucagon-Sekretion zu Hyperglykämie bei Diabetes3bei. Daher besteht ein starkes Interesse daran, die Genexpression von Zellen innerhalb der Pankreasinseln zu modulieren, um den Mechanismus hinter der Entwicklung von Inselfunktionsstörungen bei Diabetes anzugehen. Es gibt eine Vielzahl von Ansätzen, einschließlich transgener Mäuse, um die Genexpression von Mausinseln zu modulieren. Jedoch, menschliche und Maus-Inseln zeigen deutliche Innervation, Zellverteilung, Verhältnis von Beta-Alpha-Zellen, und Reaktion auf Sekretagogen4. Daher ist die direkte Beurteilung der Genfunktion bei menschlichen Inseln äußerst wichtig für das Verständnis der Pathophysiologie menschlicher Pankreasinseln.
Adenoviraler Vektor ist der am weitesten verbreitete virale Vektor, um Pankreasinseln in vitro zu transducen, da die Transduktion in nicht teilenden Zellen hoch ist. Jedoch, Adenovirus dringt nicht in den Kern der Inselchen effizient, vor allem bei menschlichen Inseln5, und ist zytotoxisch bei hohen Dosen6. Im Vergleich dazu ist der lentivirale Vektor weniger zytotoxisch und liefert exogene Gene dauerhaft in das Chromosom postmitotischer Zellen, was ihn zu einem weithin getesteten Vehikel für die Gentherapiemacht 7. Allerdings ist auch die Fähigkeit des Lentivirus, in den Kern intakter menschlicher Inseln einzudringen, begrenzt, so dass eine partielle Dispersion durch enzymatische Verdauung erforderlich ist, um die Transduktionseffizienz zu erhöhen8. Der Vorbehalt mit der Dispersion intakter menschlicher Inseln ist die Unterbrechung der Zellzell- und Zellmatrixkommunikation, die die dynamische Regulierung der Insulinsekretion beeinträchtigt, die für die Aufrechterhaltung der Glukosehomöostase beim Menschen entscheidend ist9. Daher war es schwierig, die Auswirkungen der Genmodulation auf die dynamische Regulierung der Inselfunktion in einem Modell menschlicher Inselchen zu bewerten.
Es ist bekannt, dass sich zerstreute Inselzellen von menschlichen und Nagetierinseln autonom zu inselähnlichen Strukturen, sogenannten "Pseudoislets", zusammenschließen. Pseudoislets zeigen Beta- und Nicht-Beta-Zellverteilung ähnlich wie native Inselchen10,11. Zusätzlich verlieren einheimische Inselchen nach langfristiger Kultur nach und nach robuste Sendephase Insulinsekretion5,10,11,12. Dennoch zeigten Pseudoislets eine bessere Konservierung der Insulinsekretion der ersten Phase als Reaktion auf Glukose im Vergleich zu einheimischen Inselchen nach der gleichen Kulturperiode5. Neben einer besseren Konservierung der Insulinsekretion bietet die größengesteuerte Reaggregation menschlicher Isletzellen in niedrigen Anbauplatten11 eine Möglichkeit, Lentivirus-Vektoren vor ihrer Reaggregation in Pseudoislets. Mehrere Studien haben den Nutzen von Pseudoislets in Kombination mit lentiviral vermittelter Transduktion nachgewiesen. Caton et al.13 berichteten, dass die Einführung des grünen fluoreszierenden Proteins (GFP), das Lentivirus ausdrückt, wenig Einfluss auf die Insulinsekretion hatte, während eine homogene Expression von GFP in Rattenpseudoislets im Vergleich zur nicht infizierten Kontrolle erreicht wurde. Sie zeigten auch die spezifische Wirkung verschiedener Connexine auf die Insulinsekretion, indem sie die Connexine 32, 36 und 43 über das Lentivirus13überexzieren. Menschliche Pseudoislets, die mit einer handelsüblichen 96-Well-Ultra-Low-Attachment-Platte hergestellt wurden, zeigten, dass die lentiviral-vermittelte Überexpression des Transkriptionsfaktors SIX3 die Insulinsekretion verbessert, die durch statische Inkubation bewertet wird14. Kürzlich wurden menschliche Pseudoislets, die mit einer 96-well ultra-niedrigen Anbauplatte hergestellt wurden, verwendet, um Glukokkinase über lentivirale Kurzhaarnadel-RNA (shRNA) als Beweis für den Nachweis zu regulieren, dass die glukosestimulierte Insulinsekretion reduziert wird, während KCl-stimulierte Insulinsekretion wurde5erhalten. Die Studie zeigte auch, dass menschliche Pseudoislets nativen Inselchen in Genexpression und sekretoreichen Profilen ähneln, was den Nutzen menschlicher Pseudoislets zur Sezieren der Regulation der Inselfunktion5weiter unterstützt. Obwohl die Perifusion nicht durchgeführt wurde, wurde eine biotechnologische Mikrobrunnen-Kulturplatte, die vor kurzem kommerziell erhältlich war, auch als kompatibel für lentivirale Transduktion und produzierte menschliche Pseudoislets, die ausgezeichnete Insuline Sekretion in vitro und in vivo nach Transplantation11. Zusammen genommen ist die Bildung menschlicher Pseudoislet in Kombination mit der lentiviralen Transduktion ein einfacher und effizienter Ansatz zur Untersuchung der Pathophysiologie der menschlichen Insel und stellt ein wertvolles Werkzeug zur Durchführung mechanistischer Studien an menschlichen Inseln bereit.
Im aktuellen Bericht wird ein Protokoll zur Bildung menschlicher Pseudoislets, die mit Lentivirus über zwei kommerziell erhältliche Plattformen, eine 96-Well ultra-low Attachment Platte und eine Microwell-Kulturplatte transduziert wurden, vorgestellt. Beide erreichen eine effiziente Modulation der Genexpression und schaffen menschliche Pseudoislets, die für nachgelagerte Bewertungen, einschließlich statischer Inkubation und Perifusion, kompatibel sind.
Protokoll
Vor Studienbeginn wurde eine Forschungsbestimmung für Humansubjekte durch das Institutional Review Board der University of Iowa getroffen, der feststellte, dass die Studie die Kriterien für die Forschung an menschlichen Probanden nicht erfüllte. Konsultieren Sie vor Beginn der Studie das örtliche Prüfungsgremium, um festzustellen, ob die Quelle der Inselchen und die geplante Studie einer vorherigen Genehmigung bedarf.
HINWEIS: Für die Bildung von 192 Pseudoislets in der Größe von 3.000 Zellen/Pseudoislets in einer 96-Well-Ultra-Low-Attachment-Platte oder 1.200 Pseudoislets in der Größe von 500 Zellen/Pseudoislets in einem Microwell Kulturplatte. IEQ der benötigten Inseln variiert zwischen verschiedenen Präparaten menschlicher Inseln, da Spenderfaktoren (Alter, Gesundheit, Gewicht), Isolationseffizienz und Kulturbedingungen die Ausbeute der Einzelzellsuspension beeinflussen. In diesem Protokoll wird das Lentivirus verwendet, das shRNA enthält, das auf ein Gen von Interesse abzielt. Die Cytomegalievirus (CMV) und humane Phosphoglyceratkinase (hPGK) Promotor-basierte lentivirale Vektoren werden berichtet, um Das Gen effizient in menschlichen Pseudoislets5,15zu regulieren. Die Verwendung von Lentivirus erfordert Vorsicht als Biohazard16. Wenden Sie sich vor Beginn der Verwendung des Lentivirus an den örtlichen Ausschuss für biologische Sicherheit.
1. Übernacht Kultur der menschlichen Inseln für die Erholung nach dem Versand
- Vorbereiten Connaught Medical Research Laboratories 1066 (CMRL-1066) Medium ergänzt mit 1% humanem Serumalbumin (HSA) durch Kombination von 50 ml CMRL-1066, 0,5 g HSA, 0,5 ml Penicillin-Streptomycin und 0,5 ml von 100 mg/ml Glutamin (1% HSA CMRL) in biologischer Sicherheitsschrank (BSC) und durcheinen 0,2-mm-Filter zur Sterilisation.
- Wirbeln Sie die Versandflasche vorsichtig, um Inselchen in Suspension zu halten. Übertragen Sie das Versandmittel mit Inselchen auf ein 50 ml kegelförmiges Zentrifugenrohr. Lassen Sie das Rohr 15 min in BSC sitzen, damit sich die Inselchen an der Unterseite des Rohres absetzen.
- Entfernen Sie das Versandmedium vorsichtig, ohne das Isletpellet mit einer 10 ml Pipette zu stören. Setzen Sie das Isletpellet in 1% HSA CMRL auf eine Konzentration von 400 IEQ/ml wieder aus.
- Übertragen Sie Inselchen in eine nicht-Gewebekultur behandelte Schale. Wenn Inselchen in mehrere Gerichte aufgeteilt werden, halten Sie die Inselchen gleichmäßig in Medium aufgehängt, indem Sie sanft wirbeln, bevor sie geteilt werden. Kulturinseln bei 37 °C in einem 5% CO2-Inkubator über Nacht.
HINWEIS: Die Verwendung einer nicht-Gewebekultur behandeltschale ist erforderlich, um die Befestigung von Inselchen an der Platte zu verhindern.
2. Vorbereitung der Einzelzellsuspension von menschlichen Inseln
- Bereiten Sie Folgendes vor: CMRL-1066 Medium mit 10% hitzeinaktiviertem fetalem Rinderserum (HiFBS), Penicillin-Streptomycin und Glutamin (10% HiFBS CRML) bei Raumtemperatur (RT), 40-mm-Sieb, 35 mm Petrischale, 1 ml Tuberkulinspritze und Hämyltometer.
- Übertragen Sie menschliche Inselchen nach der Nachtkultur in ein 15 ml kegelförmiges Zentrifugenrohr. Zentrifuge bei 190 x g für 5 min in einem Schwingschaufelrotor. Aspirieren Sie Medium mit einer 5 ml Pipette, ohne das Inselpellet zu stören.
- Waschen Sie das Pellet, indem Sie 10 ml Phosphat-gepufferte Saline (PBS) in das Rohr geben, sanft mischen und zentrifugieren bei 190 x g für 5 min. Aspirieren PBS, ohne das Inselpellet zu stören.
- Das Inselpellet in 0,5 ml einer vorgewärmten proteolytischen und kollagenlytischen Enzymmischung und Pipette 5x mit einer P1000 Pipette zum Mischen von Inselchen wieder aufhängen. Bei 37 °C für 5 min inkubieren. Mischen Sie durch Pipettieren nach oben und unten sanft 1-5 mal.
HINWEIS: Aggressive Pipettierung erhöht den Zellverlust. - Überprüfen Sie die Trübung (einzelne Zellen) und die Anzahl der Flocken (unverdaute Inselchen). Fügen Sie 2 x 3 min bis 37 °C Inkubation je nach dem Grad der Verdauung durch Trübung und die Anzahl der Flocken beurteilt. Beenden Sie die Verdauung, wenn Flocken auf 10 % der Präverdauung reduziert werden und die Lösung trüb ist.
HINWEIS: Die für die Verdauung benötigte Zeit hängt von der Verteilung der Inselgröße der einzelnen menschlichen Inselpräparationen ab. - Legen Sie ein 40-mm-Sieb in eine 35-mm-Petrischale und befeuchten Sie das Sieb, indem Sie 1 ml 10% HiFBS CMRL hinzufügen und mit 1 ml Spritzenkolben pressen. Übertragen Sie die gesamte Zellsuspension auf das Sieb und sammeln Sie den Durchgang in einem frischen 15 ml Rohr.
- Waschen Sie das Rohr für die Islet-Verdauung mit 0,5 ml frischem CMRL-Medium verwendet, um übrig gebliebene Zellen zu sammeln und die Wäsche durch das Sieb passieren. Kombinieren Sie den Durchgang in einem 15 ml Rohr. Wiederholen Sie dies einmal.
- Als nächstes dissoziieren Sie unverdaute unverdaute Inselchen, die auf dem Sieb verbleiben, indem Sie das Sieb drücken, das in eine 35-mm-Schale mit 1 ml Spritzenkolben gelegt wird. Sammeln Sie den Durchgang wieder und waschen Sie das Sieb mit frischem CMRL-1066, um alle verbleibenden verdauten Inselchen aus dem Sieb und der Schale zu entfernen. In der 15 ml-Röhre belaufen sich nun insgesamt 3 ml Einzelzellsuspension.
- Zeichnen Sie das Gesamtvolumen der Zellsuspension auf, und nehmen Sie 10 L Aliquot von Zellen, um die Zellzahl auf einem Hämozytometer zu zählen.
- Zentrifugieren Sie die Zellsuspension für 5 min bei 200 x g. Entfernen Sie das Medium, ohne das Pellet zu stören. Fahren Sie mit Schritt 3.1.1 fort, wenn Sie eine 96-Well ultra-niedrige Befestigungsplatte oder Schritt 3.2.1 verwenden, wenn Sie eine 24 Well-Mikrowell-Kulturplatte verwenden, um die Zellen neu zu aggregieren.
3. Pseudoislet-Bildung und Transduktion durch Lentivirus
- Protokoll mit einer 96-Well ultra-low Befestigungsplatte
- Bestimmen Sie die gewünschte Anzahl von Zellen pro Pseudoislet und die Anzahl der zu erstellenden Pseudoislets. In der Regel werden für jedes Pseudoislet 1.000 bis 3.000 Zellen für eine 96-Well ultraniedrige Befestigungsplatte verwendet. Passen Sie für 3.000 Zellen pro Pseudoislet die Zellsuspension auf 1 x 105 Zellen/ml an, indem Sie das Ischenpellet von Schritt 2.10 in 10% HiFBS CMRL wieder aufhängen, sodass 30 L Zellsuspension 3.000 Zellen haben. Berechnen Sie das Gesamtvolumen von 1 x 105 Zellen/ml einzelliger Suspension (ml), die mit der folgenden Gleichung erforderlich ist:
Das Gesamtvolumen von 1 x 105 Zellen/ml Einzelzellsuspension (mL) = (Anzahl der Zellen pro Pseudoislet) x (Anzahl der hergestellten Pseudoislets) / 1 x 105.
HINWEIS: Passen Sie die Konzentration der Zellsuspension basierend auf der gewünschten Anzahl von Zellen pro Pseudoislet so an, dass 30 l Zellsuspension ein Pseudoislet bilden. - Übertragen Sie das benötigte Volumen (30 l x Anzahl der pseudoislets) der einzelzelligen Suspension auf ein frisches 15 ml-Rohr. Fügen Sie 250 Transduktionseinheiten (TU)/Zelle des Lentivirus hinzu, die shRNA enthalten und auf ein Gen von Interesse oder Kontrolle abzielen.
ACHTUNG: Das Lentivirus wird als Biosicherheitsstufe 2 eingestuft und kann in die DNA infizierter Zellen integriert werden.
HINWEIS: Verwenden Sie konzentrierte lentivirus, so dass das Volumen der Lentivirus hinzugefügt ist minimal. Titer, der pro Zelle für eine effiziente Gen-Silencing benötigt wird, kann je nach lentiviralem Konstrukt variieren. - Mischen Sie die Zellsuspension mit dem Virus, indem Sie sanft 5x mit einer P1000 Pipette pipetieren. Übertragen Sie gemischte Zellen in ein 50 ml steriles Reagenzreservoir, wenn Sie eine 8-Kanal-Pipette verwenden.
- Geben Sie 30 l pro Bohrung der einzelligen Suspension mit Lentivirus in jeden Brunnen mit einer 8-Kanal-Pipette oder einer P200-Pipette je nach Anzahl der Brunnen.
- Zentrifugieren Sie die 96-Well-Platte in einer Schwing-Bock-Plattenzentrifuge bei 270 x g bei RT für 7 min. Prüfen Sie, ob Zellen in der Mitte jedes Brunnens gesammelt werden. Wenn nicht, ist zentrifugieren sie wieder als Sammeln aller Zellen in der Mitte des Brunnens entscheidend für die Pseudoisletbildung. Kultur bei 37 °C in einem befeuchteten 5% CO2-Inkubator über Nacht.
- Fügen Sie am nächsten Morgen 100 l vorgewärmten 10% HiFBS CMRL pro Brunnen hinzu, um das Trocknen der Zellen während der nachfolgenden Kultur zu vermeiden. Zentrifuge bei 270 x g, RT für 7 min. Kultur bei 37 °C in einem 5% CO2-Inkubator. Pseudoislets werden die Bildung in 5 bis 7 Tagen abschließen.
- Bei der Ernte von Pseudoislets das gewünschte Volumen von 10% HiFBS CMRL (100 l pro Insel) vorerwärmen, ein 50 ml steriles Reservoir, eine sterile 10 cm Petrischale und eine 8-Kanal-Pipette in BSC zubereiten.
- Entfernen Sie die 96-Well-Platte aus dem Inkubator und legen Sie sie in BSC ab. Pipette 100 l pro Islet von 10% HiFBS CMRL in ein Reservoir.
- Pipette 100 l pro Bohrung von 10% HiFBS CMRL aus einem Reservoir zu Pseudoislets und Pipette nach oben und unten 2-3 mal sanft im Brunnen, um Inselchen nach oben zu heben. Dann das Medium im Brunnen, der ein Pseudoislet enthält, ansaugen und in eine 10 cm Petrischale auswerfen. Die Verwendung einer 8-Kanal-Pipette ermöglicht die Übertragung von 8 Pseudoislets gleichzeitig.
- Überprüfen Sie die Platte unter einem Lichtmikroskop, um die vollständige Entfernung aller Pseudoislets sicherzustellen. Pseudoislets bilden feste Aggregate und bleiben nach dem Heben aggregiert. Die Pseudoislets sind nun für nachgelagerte Experimente bereit.
- Bestimmen Sie die gewünschte Anzahl von Zellen pro Pseudoislet und die Anzahl der zu erstellenden Pseudoislets. In der Regel werden für jedes Pseudoislet 1.000 bis 3.000 Zellen für eine 96-Well ultraniedrige Befestigungsplatte verwendet. Passen Sie für 3.000 Zellen pro Pseudoislet die Zellsuspension auf 1 x 105 Zellen/ml an, indem Sie das Ischenpellet von Schritt 2.10 in 10% HiFBS CMRL wieder aufhängen, sodass 30 L Zellsuspension 3.000 Zellen haben. Berechnen Sie das Gesamtvolumen von 1 x 105 Zellen/ml einzelliger Suspension (ml), die mit der folgenden Gleichung erforderlich ist:
- Protokoll mit einer 24-Well-Mikrowell-Kulturplatte
- Erwärmen Sie die Anti-Haft-Spüllösung (Tabelle der Materialien) zu RT für eine effiziente Sphäroidbildung. Auch vorwarme Ebene CMRL-1066 und 10% HiFBS CMRL.
- Fügen Sie 500 l pro Bohrung der Anti-Haft-Spüllösung zu jedem Brunnen der 24-Well-Mikrowell-Kulturplatte hinzu, die für Pseudoislets verwendet werden soll. Zentrifuge bei 1.300 x g für 5 min in einer Schwing-Bock-Plattenzentrifuge.
- Beobachten Sie die Platte unter dem Mikroskop, um sicherzustellen, dass Luftblasen aus Mikrobrunnen entfernt werden. Wenn Luftblasen in Mikrobrunnen gefangen sind, Zentrifuge bei 1.300 x g für 5 min wieder.
- Aspirieren Sie die Anti-Haft-Spüllösung aus den Brunnen in einem BSC. Spülen Sie jeden Brunnen mit 2 ml warme ebene CMRL-1066 einmal. Aspirate CMRL-1066. Fügen Sie 0,5 ml/Well von warm 10% HiFBS CMRL zu jedem gut geplanten Für den Einsatz hinzu. Brunnen sind nun bereit für das Laden verteilter menschlicher Isletzellen, die in Schritt 2.10 vorbereitet wurden.
- Bestimmen Sie die Gesamtzahl der Zellen, die für jeden Brunnen benötigt werden. Ein Brunnen von 24-Well-Mikrowell-Kulturplatte enthält 1.200 Mikrobrunnen und bildet 1.200 Pseudoislets. 500 Zellen pro Pseudoislet x 1200 Mikrobrunnen = 6 x 105 Zellen. Setzen Sie einzelne Zellen von Schritt 2,10 bis 6 x 105 Zellen in 0,8 ml von 10% HiFBS CMRL in einem sterilen 1,5 ml Rohr aus.
HINWEIS: Das maximale Volumen pro Bohrung beträgt 2 ml. Das Volumen der Zellsuspension sollte 1,5 ml nicht überschreiten. Das Protokoll beschreibt Schritte zur Schaffung eines Brunnens von Pseudoislet durch Lentivirus transduziert. Skalieren Sie in Abhängigkeit von der Anzahl der Brunnen, die für jedes Lentivirus gemacht werden sollen. - Für die virale Transduktion 125 TU/Zelle zur einzelzelligen Suspension hinzufügen. Halten Sie das Virusvolumen unter 0,2 ml. Inkubieren Sie die Zell- und Virusmischung bei 37 °C mit gelegentlicher sanfter Mischung für 1 h, um den Kontakt von Zellen mit Viren vor Kondensation der Zellen in Schritt 3.2.8 zu ermöglichen.
HINWEIS: Verwenden Sie konzentrierte lentivirus, so dass das Volumen der Lentivirus hinzugefügt ist minimal. Für Protokoll 2 wird eine geringere ANZAHL von TU pro Zelle im Vergleich zu Protokoll 1 verwendet, da das Gesamtvolumen des Mediums pro Zellenzahl geringer ist. Allerdings kann der pro Zelle für eine effiziente Gen-Silencing benötigte Titer jedoch je nach lentiviralem Konstrukt und Bedarfsoptimierung variieren.
ACHTUNG: Das Lentivirus wird als Biosicherheitsstufe 2 eingestuft und kann in die DNA infizierter Zellen integriert werden. - Nach 1 h, passen Sie das Gesamtvolumen der Islet-Zelle und Virusmischung auf 1 ml, indem Sie 10% HiFBS CMRL hinzufügen. Wenn Zellen nach 1 h Inkubation Klumpen bilden, dispergieren Sie in Einzelzellsuspension durch sanfte und schnelle Pipettierung 2 x 3 mal. Die Pipettenz ist sehr wichtig für die gleichmäßige Verteilung von Zellen über Mikrobrunnen. Übertragen Sie die Zellsuspension auf einen Brunnen der 24-Well-Mikrowell-Kulturplatte.
- Unmittelbar nach der Pipettierung zentrifugieren Sie bei 100 x g für 3 min bei RT, um Zellen in alle Mikrobrunnen zu erfassen. Beobachten Sie unter dem Mikroskop, um zu überprüfen, ob die Zellen gleichmäßig in allen Mikrobrunnen verteilt sind.
- Kultur kulturieren Sie die Mikrobrunnen-Kulturplatte bei 37 °C in einem 5% CO2-Inkubator. Pseudoislets bilden sich in 24-48 h. Pseudoislets können bis zu 7 Tage lang ohne mittlere Veränderung kultiviert werden.
- Wenn Sie das Medium für Kultur über 7 Tage hinaus ändern, ersetzen Sie 50 % bis 75 % des Mediums für jede mittlere Veränderung wie folgt. Mit einer P1000-Pipette aus jedem Brunnen werden langsam 0,5 x 1 ml Medium entfernt. Fügen Sie 0,5 x 1 ml frische 10% HiFBS CMRL langsam hinzu, indem Sie eine Spitze an die Wand des Brunnens legen, um zu vermeiden, dass Pseudoislets von der Mikrowell-Kulturplatte verdrängt werden.
- Um sich auf die Ernte von Pseudoislets vorzubereiten, erwärmen Sie das 10% HiFBS CMRL Medium. Pseudoislets neigen dazu, in Serum frei CMRL-1066 zu schweben, was es schwierig macht, sie zu pflücken.
- 0,5 ml Medium aus einer 1 ml Pipette aussaugen und Medien kräftig zurück zur Plattenoberfläche abgeben, um Pseudoislets von der Mikrowell-Kulturplatte zu heben.
- Absaugend eindemunierte Pseudoislets mit der 1 ml Pipette und übertragen Sie Inselchen in eine nicht-gewebebehandelte 6-Well-Platte. Passieren Sie ein kleines, umkehrbares Sieb mit einer Wertunterlage von 37 m, das auf einem 15 ml konischen Rohr platziert ist. Pseudoislets bleiben auf dem Filter; alle nicht inkorporierteeinzelten Einzelzellen fließen durch.
HINWEIS: Um den Verlust kleinerer Pseudoislets durch Das Sieb zu vermeiden, kann das Sieb weggelassen werden. - Verteilen Sie 1 ml 10% HiFBS CMRL über die gesamte Oberfläche des Brunnens, um alle verbleibenden Pseudoislets zu vertreiben, dislodged Pseudoislets zu aspirieren und das Sieb zu durchlaufen. Wiederholen Sie 3x, um die vollständige Sammlung aller Pseudoislets aus Brunnen sicherzustellen.
- Beobachten Sie die Mikrowell-Kulturplatte unter einem Invertierender, um sicherzustellen, dass alle Pseudoislets gesammelt werden. Wiederholen Sie die Wäsche wie in Schritt 3.2.14, wenn Pseudoislets verbleiben.
4. RNA-Extraktion zur Bewertung der Gen-Silencing-Effizienz
- Pseudoislets in einem 1,5 ml Mikrozentrifugenrohr und Zentrifuge bei 300 x g für 3 min bei 4 °C in die RNase-freie PBS kommissionieren. PBS entfernen, ohne das Isletpellet zu stören und einmal mit PBS zu waschen, gefolgt von Zentrifugation bei 300 x g für 3 min bei 4 °C.
- Aspirieren Sie die meisten PBS mit einer P1000 Pipette. Wechseln Sie dann zu einer P10-Pipette, um den Rest der PBS zu entfernen, ohne das Isletpellet zu stören.
- Fügen Sie 0,5 ml Guanidinium thiocyanat-RNA-Extraktionsreagenz (Materialtabelle) pro Tube hinzu. Homogenisieren Sie die Pseudoislets mit einem motorisch angetriebenen Stößel für 2-3-mal. Das Homogenat im Guanidinium-Thiocyanat-RNA-Extraktionsreagenz kann nun bei -80 °C gespeichert oder zur RNA-Reinigung verarbeitet werden.
HINWEIS: 24 der 3.000 Zell-Pseudoislets, die in einer 96-Well-Platte gebildet werden, oder 48 der 500 Zellpseudoislets, die in einer Mikrowell-Kulturplatte gebildet werden, reichen aus, um 0,5-1-g-RNA zu erhalten.
Ergebnisse
Abbildung 1 zeigt die wichtigsten Schritte bei der Herstellung von Pseudoislets mit einer 96-well ultra-niedrigen Befestigungsplatte und einer Mikrowell-Kulturplatte. Abbildung 2a zeigt sequenzielle Veränderungen in der Morphologie bei der Bildung von Pseudoislets aus 3 x 103 menschlichen Inselzellen in einer 96-well ultraniedrigen Befestigungsplatte. Monolayer oder lose Zellklumpen, die am tag 1 beobachtet wurden, verwandelten sich bis Tag 5 bis 7 in feste Aggregate mit einem glatten, runden Rand (Abbildung 2a). In einer Mikrowell-Kulturplatte ist die Bildung fester Pseudoislets in der Regel innerhalb von 4 Tagen sichtbar (Abbildung 2b). Als 600 Zellen/Mikrowell in die Mikrobrunnenkulturplatte eintäuschten, wurden menschliche Isletzellen zu Sphäroiden einheitlicher Größe kondensiert. Es wird beobachtet, dass eine Mikrowell-Kulturplatte die erfolgreiche Bildung von Pseudoislets aus einer kleinen Anzahl von Zellen im Vergleich zu einer 96-well ultra-niedrigen Befestigungsplatte ermöglicht. In der Regel werden über 1.500 Zellen/Pseudoislet für eine 96-well ultra-low Attachment Platte benötigt, während 500 Zellen/Pseudoislet für eine 24-Well-Mikrowell-Kulturplatte ausreichen. Erfolgreich geformte Pseudoislets bleiben nach der Rückgewinnung von einer 96 ultraniedrigen Anbauplatte oder einer Mikrowell-Kulturplatte als Sphäroide erhalten und sind für nachgeschaltete Anwendungen wie statische Inkubation (Abbildung3a) und Perifusion kompatibel (Abbildung 3b). Die einheitliche Größe von Pseudoislets reduziert die Streuung innerhalb einer Testgruppe und ermöglicht eine statische Inkubation mit nur 5 Pseudoislets pro Messung (Abbildung 3a). Auch die menschliche Pseudoislets hielten eine robuste Insulinsekretion in der ersten Phase als Reaktion auf Glukose nach 7 Tagen Kultur aufrecht, als die ursprünglichen menschlichen Inselchen, die für einen ähnlichen Zeitraum kultiviert wurden, eine stumpfe erste Phase der Glukose-stimulierten Insulinsekretion zeigten ( Abbildung 3b)5. Die Einführung des Lentivirus in eine Einzelzellsuspension gewährleistet eine effiziente und homogene Transduktion von Ischenzellen und erreicht eine hocheffiziente Downregulation von Genen, wie in Abbildung 3cdargestellt. Alle gezeigten Ergebnisse wurden mit menschlichen Inseln von nicht-diabetischen Spendern erzielt.

Abbildung 1: Prozess der vorbereitung auf menschliche Syletten. (a) Die Suspension, die 4.000 IEQ menschlicher Inselchen enthält, wird nach der Verdauung durch eine proteolytische und kollagenlytische Enzymmischung und milde Pipetten artig. (b) Menschliche Inselchen nach der Dispersion werden durch ein Sieb geleitet. Unverdaute Inselchen, die auf dem Sieb verbleiben, werden mit einem 1 ml Spritzenkolben dispergiert. (c,d) Mikroskopbilder der einzelzelligen Suspension mit 3.000 Zellen/Well in einer 96-well ultra-niedrigen Befestigungsplatte vor (c) und nach (d) Zentrifugation. (e,f) Mikroskopbilder der einzelligen Suspension mit 500 Zellen/Mikrowell in einer 24-Well-Mikrowell-Kulturplatte vor (e) und nach (f) Zentrifugation. Maßstabsleiste = 250 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Morphologie menschlicher Pseudoislets. Sequenzielle Veränderungen in der Morphologie menschlicher Pseudoislets, die (a) in einer 96-well ultraniedrigen Befestigungsplatte aus 3.000 Zellen und (b) in einer 24-Well-Mikrowell-Kulturplatte aus 500 Zellen erstellt wurden. Maßstabsleiste = 100 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
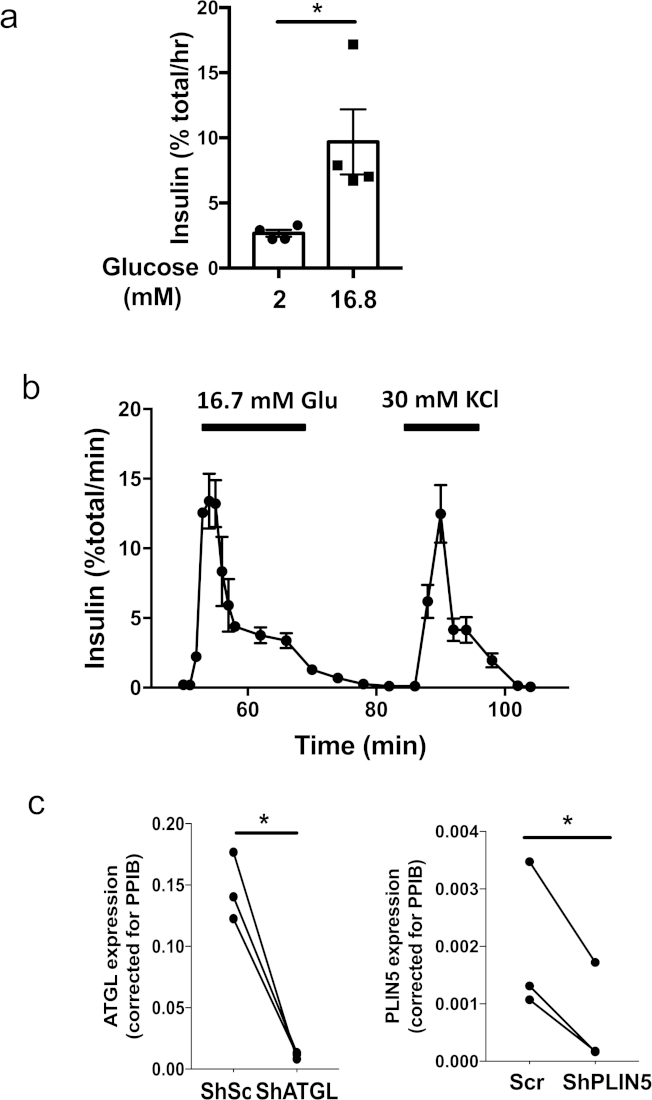
Abbildung 3: Beispiele für funktionelle Assays mit menschlichen Pseudoislets. (a) Repräsentative statische Inkubation, die mit menschlichen Pseudoislets durchgeführt wird, die in einer Mikrowell-Kulturplatte von einem einzelnen Spender in der Größe von 500 menschlichen Inselzellen pro Pseudoislet erzeugt wurden. Vier Sätze von 5 Pseudoislets wurden für 1 h in Krebs-Ringer BicarbonatPuffer mit 2 mM oder 16,8 mM Glukose ergänzt inkubiert. Jedes Symbol stellt die Insulinsekretion aus einem Satz von 5 Pseudoislets dar. Mittelwert des Mittelwerts (SEM) wird angezeigt. *, p < 0,05 durch Schüler-t-Test. Repräsentative Ergebnisse von drei Spendern. (b) Repräsentative Perifusionstests Insulinsekretion aus menschlichen Pseudoislets, die in einer Mikrowell-Kulturplatte als Reaktion auf 16,7 mM Glukose und 30 mM KCl erzeugt wurden. Die mittlere SEM der Insulinsekretion aus zwei Sätzen von 40 Pseudoislets, die in einer Mikrowell-Kulturplatte von einem einzelnen Spender in der Größe von 500 menschlichen Inselzellen pro Pseudoisletplatte erstellt wurden, wird gezeigt. Repräsentative Daten von sechs Spendern. (c) Pseudoislets wurden mit Lentivirus mit shRNA für humanes ATGL (targeting CCTGCCACTCTCTCTTAA, links) oder PLIN5 (Targeting GACAAGCTGGAAGAGAAGCTT, rechts) erstellt. Kontroll-Pseudoislets wurden mit Lentivirus-Exzessausdrücken der Rührsequenz (Scr) transduziert, die zuvor veröffentlicht wurde5. Die mRNA-Expression jedes Gens wurde durch Echtzeit-Polymerase-Kettenreaktion (PCR) bestimmt, wie zuvor veröffentlicht5. Die Daten wurden mit 2-DDCT unter Peptidylprolyl Isomerase B (PPIB) als interne Kontrolle17ausgedrückt. Jeder Punkt stellt Daten von jedem Spender für eine angegebene Grundierung dar, und ein Datensatz desselben Spenders ist durch eine Linie verbunden. N = 3 Spender. *; p < 0,05 durch Schüler-t-Test. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Hier wird ein detailliertes Protokoll zur Erzeugung menschlicher Pseudoislets vorgestellt, die mit einer 96-Well-Ultra-Low-Attachment-Platte oder einer Mikrowell-Kulturplatte durch Lentivirus transduziert werden. Pseudoislets sollen Morphologie und sekretotische Funktionen ähnlich wie einheimische menschliche Inselchen demonstrieren und können über einen längeren Zeitraum in vitrokultiviertwerden 5,11,18. Im Gegensatz zu einheimischen menschlichen Inselchen, die eine große Variation in der Größe zeigen, sind Pseudoislets relativ gleichmäßig in der Größe, Verringerung der Variation zwischen Spendern und experimentellen Repliken5,11. Die Downregulation von Genen, die eine hohe Effizienz der Transduktion erfordern, kann leicht vor der Bildung von Pseudoislets in einzelliger Suspension durchgeführt werden. Diese Methode vermeidet die Schwierigkeit der viralen Penetration durch Zellschichten in intakten Inselchen. Somit hat dieses einfache, hocheffiziente und reproduzierbare Protokoll zur Erstellung menschlicher Pseudoislets breite Anwendungen.
Während mehrere verschiedene Plattformen für die Bildung von Pseudoislets12,14,19,20berichtet wurden, sind sowohl eine 96-Well ultra-low Attachment Plate als auch eine Microwell-Kulturplatte kommerziell erhältlich, so dass diese Technik von jedem Labor übernommen werden kann. Obwohl die Hängetropfenmethode12 auch die Bildung menschlicher Pseudoislets mit gängiger Labware ermöglicht, schließen mögliche Einschränkungen die Schwierigkeit bei der Kontrolle der Größe und der Reaggregationsdauer von Pseudoislets ein. Diese Einschränkungen waren auf das begrenzte Volumen pro Tropfen Pseudoislet und die anhaltende Verdunstung während der 5-7-Tage-Kultur zurückzuführen, die für die Pseudoisletbildung erforderlich war. Darüber hinaus ist es einfacher, Lentivirus mit der Verwendung einer 96 gut ultra-niedrigen Befestigungsplatte oder einer Mikrowell-Kulturplatte im Vergleich zur Hanging-Drop-Methode einzudämmen.
Mehrere Schritte innerhalb des Protokolls erfordern eine genaue Aufmerksamkeit. Die Optimierung der Verdauung intakter Inselchen mit der proteolytischen und kollagenenlytischen Enzymmischung ist von entscheidender Bedeutung, da sowohl unter- als auch überverdauungsdurchflutet die Ausbeute der Einzelzellsuspension verringert und anschließend die Aggregation von Pseudoislets beeinflusst wird. Während der Verdauung ist es wichtig, Inselchen für das Verschwinden von Klumpen und die Zunahme der Trübung genau zu überwachen, da sich Inselchen in einzelne Zellen auflösen. Es ist wichtig zu beachten, dass die optimale Zeit für die Verdauung zwischen Inselchen von verschiedenen Spendern variiert. Die optimale Zeit hängt von mehreren Faktoren ab, einschließlich der Krankengeschichte und des Alters jedes Spenders, der Dauer der Ischämiezeit, dem verwendeten Islet-Isolationsverfahren, der Größe der Islet, der Islet-Reinheit, der Lebensfähigkeit der Islet und der Versandbedingungen. In der Regel werden menschliche Inseln mit Lebensfähigkeit und Reinheit von mehr als 80% und innerhalb von 5 Tagen nach Isolation verwendet. Sorgfältige und schonende Pipettierung während der Dispersion ist auch wichtig, um die Zelllebensfähigkeit und -wiederherstellung aufrechtzuerhalten, was sich letztlich auf die Zellaggregation und die endgültige Größe der gebildeten Pseudoislets auswirkt. Bei der Abgabe der Zellsuspension der Isletzellen an Brunnen (Schritte 3.1.4 und 3.2.7) ist eine schonende und gründliche Vermischung von Zellen wichtig, um eine gleichmäßige Verteilung einzelner Zellen in Mikrobrunnen zu erreichen. Wenn Zellen nach 1 h Inkubation mit Lentivirus Klumpen bilden, erfordert es eine sanfte Pipettion, um die Klumpen vor der endgültigen Zentrifugation in einzelzellige Suspension zu brechen.
Wir hatten ähnliche Erfolge bei der Schaffung menschlicher Pseudoislets nach lentiviraler Transduktion mit einer 96-Well-Platte und einer Mikrowell-Kulturplatte. Die Wahl zwischen den beiden Plattformen hängt von der Größe und Anzahl der gewünschten Pseudoislets ab. Eine Mikrowell-Kulturplatte hat kleine, pyramidenförmige Böden, die eine verdichtende Anzahl von Zellen im Vergleich zu einer gut runden Bodenplatte von 96 ermöglichen. So kann die Anzahl der Zellen pro Pseudoislet für eine Mikrowell-Kulturplatte reduziert werden. Außerdem erzeugt ein einzelner Zentrifugationsschritt alle Pseudoislets gleichzeitig in einer Mikrowell-Kulturplatte, während mehrere Pipetten erforderlich sind, um Pseudoislets in einer 96-Well-Platte zu erstellen. So ist die Skalierung der Erstellung von Pseudoislets in einer Mikrowell-Kulturplatte einfacher. Die derzeit verfügbare Mikrowell-Kulturplatte bietet jedoch keine Flexibilität bei der Anzahl der erstellten Pseudoislets. Derzeit beträgt die Mindestanzahl von Pseudoislets, die mit einer Mikrowell-Kulturplatte erstellt werden, 1.200 und kann nur um den Faktor 1.200 erhöht werden. Daher verwenden wir in der Regel eine 96-Well-Platte für kleine Pilotversuche und für ein Experiment, bei dem eine kleine Menge von Proben ausreichend ist, wie z. B. ein Insulinsekretionstest und eine RNA-Extraktion für die Genexpression. Wir haben Pseudoislets aus einer Mikrowell-Kulturplatte für Assays verwendet, die eine große Anzahl von Zellen wie Western Blot, Sauerstoffverbrauchsrate Bestimmung durch einen metabolischen Analysator und Triglyceridextraktion erfordern.
Der wichtigste begrenzende Faktor für die Erzeugung menschlicher Pseudoislets ist der Verlust von Zellen bei der Herstellung einer einzelzelligen Suspension. Während 1 IEQ der menschlichen Islet gilt als rund 2.000 Zellen enthalten, die Wiederherstellung der Einzelzellsuspension ist in der Regel 30% oder niedriger aufgrund von mehrfachem Waschen und Durchlaufen eines Siebs. Die Heterogenität der Inselgröße erschwert auch die gleichzeitige Trennung aller Inselchen. Während sanftes Pipettieren und die Verwendung der proteolytischen und kollagenenlytischen Enzymmischung im Protokoll Bemühungen sind, mechanische und enzymatische Kräfte für eine maximale Rückgewinnung einzelner Zellen zu kombinieren, gibt es immer noch einen unvermeidlichen Zellverlust. Daher erfordert die Anwendung von Pseudoislets eine klare Rechtfertigung gegenüber dem Studium intakter menschlicher Inseln. Es muss auch daran erinnert werden, dass Insulinsekretion aus Pseudoislets robuster ist als Inseln, die für den gleichen Zeitraum kultiviert werden, aber tendenziell niedriger sind als frisch isolierte Inselchen5,11.
Obwohl Es Einschränkungen gibt, ermöglichen stabile und hocheffiziente Gen-Silencing in Kombination mit einer besseren Konservierung der glukosestimulierten Insulinsekretion für längere Zeit in der Kultur die Beurteilung der Genfunktion in menschlichen Ischenzellen. Darüber hinaus wird vorgeschlagen, die komplexe interzelluläre Kommunikation zwischen Beta-Beta- und Beta-Nicht-Beta-Zellen eine regulierende Rolle in der Islet-Funktion zu spielen. Allerdings gibt es derzeit nur begrenzte Informationen über die interzelluläre Kommunikation innerhalb menschlicher Inselchen. Mit erhöhter Verfügbarkeit von zellspezifischen Markern21ist es möglich, menschliche Pseudoislets mit definierter Zellzusammensetzung zu erstellen, wie kürzlich in den Mausinselzellen22berichtet, was ein besseres Verständnis der Zellzelle erleichtern wird. Kommunikation zwischen menschlichen Ischenzellen. Die jüngste Weiterentwicklung der Bildgebung von dreidimensionalen Geweben erhöht möglicherweise auch den Nutzen menschlicher Pseudoislets als Modell, um zu entlarven, wie zelluläre Polarität und interzelluläre Kommunikation in menschlichen Inselchen reguliert werden. So bieten menschliche Pseudoislets ein nützliches Modell, um die Funktionen von Genen von Interesse und andere Fragen auf dem Gebiet der Inselbiologie zu sezieren.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde von den National Institutes of Health to Y.I. (R01-DK090490) und der American Diabetes Association to Y.I. (1-17-IBS-132) finanziell unterstützt. J.A. und Y.I. werden vom Fraternal Order of Eagles Diabetes Research Center unterstützt. A.B. wird durch ein Stipendium der National Institutes of Health (T32NS45549) unterstützt. Die Autoren nutzten menschliche Pankreasinseln, die vom NIDDK-finanzierten Integrated Islet Distribution Program (IIDP) in City of Hope (2UC4DK098085) bereitgestellt wurden.
Materialien
| Name | Company | Catalog Number | Comments |
| Anti-adherence rinsing solution | Stemcell technologies | 7919 | |
| Biological safety cabinet | Thermo Scientific | 1300 Series Type A2 | |
| Cell strainer, 40 micrometer | Corning | 431750 | |
| CMRL-1066 | ThermoFisher | 11530037 | |
| CO2 incubator | Thermo Scientific | Heracell VIOS 160i | |
| Conical centrifuge tube, 15 mL | VWR | 89039-666 | |
| Conical centrifuge tube, 50 mL | VWR | 89039-658 | |
| Fetal bovine serum | ThermoFisher | 26140079 | |
| Guanidinium thiocyanate RNA extraction reagent | ThermoFisher | 15596026 | Trizol |
| Glutamine | ThermoFisher | 25030164 | |
| Hemocytometer | Marien Feld | Neubauer-Improved Bright line | |
| Human serum albumin | Sigma | A1653 | |
| Inverted microscope | Fisher brand | 11-350-119 | |
| Microcentrifuge | Beckman Coulter | Microfuge 20 | |
| Microcentrifuge tube, 1.5 mL | USA Scientific | 1615-5500 | |
| Microwell culture plate | Stemcell technologies | 34411 | Aggrewell 400, 24 well |
| Motor-driven pestle | GAMUT | #399X644 | |
| Non-tissue culture treated dish, 10 cm | Fisher Scientific | FB0875713 | |
| PBS | ThermoFisher | 14190250 | |
| Penicillin-streptomycin | ThermoFisher | 10378016 | |
| Petri dish, 35 mm | Celltreat | 229638 | |
| Pipette, 5 mL | DOT Scientific, | 667205B | |
| Pipette, 8-channel | VWR | #613-5253 | |
| Pipette, 10 mL | VWR | 667210B | |
| Pipette, P10 | Denville | UEZ-P-10 | |
| Pipette, P200 | Denville | UEZ-P-200 | |
| Pipette, P1000 | Denville | UEZ-P-1000 | |
| Proteolytic and collagenolytic enzyme mixture | Sigma | A6965 | Accutase |
| Reagent reservoir, 50 mL | VWR | 89094-680 | |
| Reversible strainer, 37 micrometer | Stemcell technologies | 27251 | |
| Swing bucket plate centrifuge | Beckman Coulter | Allegra X-14R | |
| Swing bucket rotor | Beckman Coulter | SX4750A | |
| Tuberculin syringe, 1 mL | BD | 309659 | |
| Ultra low attachment microplate, 96 well | Corning | 4515 |
Referenzen
- Chen, C., Cohrs, C. M., Stertmann, J., Bozsak, R., Speier, S. Human beta cell mass and function in diabetes: Recent advances in knowledge and technologies to understand disease pathogenesis. Molecular Metabolism. 6 (9), 943-957 (2017).
- Hong, H., Jo, J., Sin, S. J. Stable and flexible system for glucose homeostasis. Physiological Review E covering statistical, nonlinear, biological, and soft matter physic. 88 (3), 032711 (2013).
- Cryer, P. E. Minireview: Glucagon in the pathogenesis of hypoglycemia and hyperglycemia in diabetes. Endocrinology. 153 (3), 1039-1048 (2012).
- Arrojo e Drigo, R., et al. New insights into the architecture of the islet of Langerhans: a focused cross-species assessment. Diabetologia. 58 (10), 2218-2228 (2015).
- Harata, M., et al. Delivery of shRNA via lentivirus in human pseudoislets provides a model to test dynamic regulation of insulin secretion and gene function in human islets. Physiological Reports. 6 (20), e13907 (2018).
- Barbu, A. R., Akusjarvi, G., Welsh, N. Adenoviral-mediated transduction of human pancreatic islets: importance of adenoviral genome for cell viability and association with a deficient antiviral response. Endocrinology. 146 (5), 2406-2414 (2005).
- Hughes, A., et al. Gene therapy to improve pancreatic islet transplantation for Type 1 diabetes mellitus. Current Diabetes Reviews. 6 (5), 274-284 (2010).
- Jimenez-Moreno, C. M., et al. A Simple High Efficiency Intra-Islet Transduction Protocol Using Lentiviral Vectors. Current Gene Therapy. 15 (4), 436-446 (2015).
- Bonora, E., et al. Prevalence and correlates of post-prandial hyperglycaemia in a large sample of patients with type 2 diabetes mellitus. Diabetologia. 49 (5), 846-854 (2006).
- Halban, P. A., Powers, S. L., George, K. L., Bonner-Weir, S. Spontaneous reassociation of dispersed adult rat pancreatic islet cells into aggregates with three-dimensional architecture typical of native islets. Diabetes. 36 (7), 783-790 (1987).
- Yu, Y., et al. Bioengineered human pseudoislets form efficiently from donated tissue, compare favourably with native islets in vitro and restore normoglycaemia in mice. Diabetologia. 61 (9), 2016-2029 (2018).
- Zuellig, R. A., et al. Improved physiological properties of gravity-enforced reassembled rat and human pancreatic pseudo-islets. Journal of Tissue Engineering and Regenerative Medicine. 11 (1), 109-120 (2017).
- Caton, D., et al. Lentivirus-mediated transduction of connexin cDNAs shows level- and isoform-specific alterations in insulin secretion of primary pancreatic beta-cells. Journal of Cell Science. 116 (Pt 11), 2285-2294 (2003).
- Arda, H. E., et al. Age-Dependent Pancreatic Gene Regulation Reveals Mechanisms Governing Human beta Cell Function. Cell Metabolism. 23 (5), 909-920 (2016).
- Peiris, H., et al. Discovering human diabetes-risk gene function with genetics and physiological assays. Nature Communications. 9 (1), 3855 (2018).
- Schlimgen, R., et al. Risks Associated With Lentiviral Vector Exposures and Prevention Strategies. Journal of Occupational and Environmental Medicine. 58 (12), 1159-1166 (2016).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Li, N., et al. Engineering islet for improved performance by optimized reaggregation in alginate gel beads. Biotechnology and Applied Biochemistry. 64 (3), 400-405 (2017).
- Ramachandran, K., Peng, X., Bokvist, K., Stehno-Bittel, L. Assessment of re-aggregated human pancreatic islets for secondary drug screening. British Journal of Pharmacology. 171 (12), 3010-3022 (2014).
- Hilderink, J., et al. Controlled aggregation of primary human pancreatic islet cells leads to glucose-responsive pseudoislets comparable to native islets. Journal of Cellular and Molecular Medicine. 19 (8), 1836-1846 (2015).
- Saunders, D. C., et al. Ectonucleoside Triphosphate Diphosphohydrolase-3 Antibody Targets Adult Human Pancreatic beta Cells for In Vitro and In Vivo Analysis. Cell Metabolism. (18), (2018).
- Reissaus, C. A., Piston, D. W. Reestablishment of Glucose Inhibition of Glucagon Secretion in Small Pseudoislets. Diabetes. 66 (4), 960-969 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten