Method Article
Lentiviral mediato gene silenziamento in pseudoislet umano preparato in piastre a basso attaccamento
In questo articolo
Riepilogo
Viene presentato un protocollo per creare pseudoislets umani modificati in gene da cellule di isole umane disperse che vengono tradusse da lentivirus che trasportano RNA a forcina corta (shRNA). Questo protocollo utilizza vasi enzimatici e di coltura prontamente disponibili, può essere eseguito facilmente e produce pseudoislets umani geneticamente modificati adatti per studi funzionali e morfologici.
Abstract
Sono disponibili vari strumenti genetici per modulare i geni nelle isole pancreatiche dei roditori per sezionare la funzione dei geni dell'isolotto per la ricerca sul diabete. Tuttavia, i dati ottenuti dalle isole di roditori spesso non sono completamente riprodotti o applicabili alle isole umane a causa di ben note differenze nella struttura e nella funzione delle isole tra le specie. Attualmente, le tecniche disponibili per manipolare l'espressione genica delle isole umane sono molto limitate. L'introduzione del transgene in isole intatte mediante adenovirus, plasmide e oligonucleotidi spesso soffre di bassa efficienza e di elevata tossicità. La bassa efficienza è particolarmente problematica negli studi di downregulation genica in isole intatte, che richiedono un'elevata efficienza. È noto che le cellule di isole enzimaticamente disperse si riaggregano nella coltura formando sferoidi chiamato pseudoislets. La riaggregazione controllata dalle dimensioni delle cellule dell'isolotto umano crea pseudoislets che mantengono la secrezione dinamica dell'insulina della prima fase dopo una coltura prolungata e forniscono una finestra per introdurre in modo efficiente l'RNA a tornante corto lentivirale (shRNA) con bassa tossicità. Qui, viene descritto un protocollo dettagliato per la creazione di pseudoislets umane dopo la trasduzione lentivirale utilizzando due piastre multiwell disponibili in commercio. Il protocollo può essere facilmente eseguito e consente una svalutazione efficiente dei geni e la valutazione del dinamismo della secrezione di insulina utilizzando cellule di isolazione umana. Pertanto, gli pseudoislets umani con modulazione genica mediata lentivirale forniscono un modello potente e versatile per valutare la funzione genica all'interno delle cellule dell'isolele umana.
Introduzione
La perdita di massa funzionale delle cellule beta è la patologia centrale sia per il diabete di tipo 1 che per il diabete di tipo 21. Mentre le cellule beta sono i produttori di insulina in isole pancreatiche, la comunicazione tra le cellule beta e le cellule non beta svolge un ruolo critico nella regolazione della secrezione di insulina2. Inoltre, la disregolazione della secrezione glucagone contribuisce all'iperglicemia nel diabete3. Quindi, c'è un forte interesse a modulare l'espressione genica delle cellule all'interno delle isole pancreatiche per affrontare il meccanismo alla base dello sviluppo della disfunzione delle isole nel diabete. Sono disponibili una varietà di approcci, tra cui i topi transgenici, per modulare l'espressione genica delle isole del topo. Tuttavia, gli isolotti umani e murini mostrano l'innervazione distinta, la distribuzione cellulare, il rapporto tra le cellule beta e alfa e la risposta a secretagoghi4. Pertanto, la valutazione diretta della funzione genica nelle isole umane è estremamente importante per comprendere la fisiopatologia delle isole pancreatiche umane.
Il vettore adenovirale è il vettore virale più utilizzato per trasdurare le isole pancreatiche in vitro a causa dell'elevata efficienza della trasduzione nelle cellule non dividendo. Tuttavia, l'adenovirus non penetra nel nucleo delle isole in modo efficiente, soprattutto nelle isole umane5, ed è citotossico a dosi elevate6. Comparativamente, il vettore lentivirale è meno citotossico e fornisce geni esogeni permanentemente nel cromosoma delle cellule post-mitotiche, rendendolo un veicolo ampiamente testato per la terapia genica7. Tuttavia, anche la capacità del lentivirus di penetrare nel nucleo delle isole umane intatte è limitata, richiedendo così una dispersione parziale per digestione ezimatica per aumentare l'efficienza della trasduzione8. L'avvertenza con la dispersione di isolotti umani intatti è l'interruzione della comunicazione cellulare-cellula e cellula-matrice, che compromette la regolazione dinamica della secrezione di insulina critica per il mantenimento dell'omeostasi del glucosio negli esseri umani9. Pertanto, è stato difficile valutare l'impatto della modulazione genica sulla regolazione dinamica della funzione delle isole in un modello di isole umane.
È noto che le cellule di isole disperse provenienti da isole umane e roditori si reaggregano autonomamente in strutture simili a isole chiamate "pseudoislets". Gli pseudoislets mostrano la distribuzione di celle beta e non beta simile alle islet native10,11. Inoltre, dopo la cultura a lungo termine, le isole native perdono progressivamente robusta secrezione di insulina in prima fase5,10,11,12. Tuttavia, gli pseudoislets hanno dimostrato una migliore conservazione della secrezione di insulina della prima fase in risposta al glucosio rispetto alle isole native dopo lo stesso periodo di coltura5. Oltre ad avere una migliore conservazione della secrezione di insulina, la riaggregazione a dimensione delle cellule dell'isolotto umano in piastre a basso attaccamento11 fornisce una finestra di opportunità per introdurre vettori di lentivirus prima della loro riaggregazione in pseudoislets. Diversi studi hanno dimostrato l'utilità di pseudoislets combinati con la trasduzione mediata lentivirale. Caton et al.13 ha riferito che l'introduzione della proteina fluorescente verde (GFP) che esprime lentivirus ha avuto poco effetto sulla secrezione di insulina, ottenendo al contempo un'espressione omogenea della GFP nelle pseudoislets di ratto rispetto al controllo non infetto. Hanno anche dimostrato l'effetto specifico di diverse connessine sulla secrezione di insulina sovraesprimendo connexins 32, 36 e 43 tramite lentivirus13. Gli pseudoislets umani preparati con una piastra di fissaggio ultra-bassa disponibile in commercio hanno dimostrato che la sovraespressione mediata di lentivirale del fattore di trascrizione SIX3 migliora la secrezione dell'insulina valutata dall'incubazione statica14. Recentemente, sono stati utilizzati pseudoislets umani preparati con una piastra di fissaggio ultra-bassa di 96 pozzetti per ridurre la glucokinasi tramite RNA di forcina corta lentivirale (shRNA) come prova di principio per dimostrare che la secrezione di insulina stimolata dal glucosio è ridotta, mentre La secrezione di insulina stimolata da KCl è stata conservata5. Lo studio ha anche dimostrato che gli pseudoislets umani sono simili agli isolotti nativi nell'espressione genica e nei profili secretoria, sostenendo ulteriormente l'utilità degli pseudoislets umani per sezionare la regolazione della funzione islet5. Anche se la perifusione non è stata eseguita, una piastra di coltura di microwell bioingegnerizzata che recentemente è diventata disponibile in commercio, è stata anche segnalata per essere compatibile per la trasduzione lentivirale e ha prodotto pseudoislets umane che presentano eccellenti insulina secrezione in vitro e in vivo dopo il trapianto11. Collettivamente, la formazione dello pseudoislet umano combinata con la trasduzione lentivirale è un approccio semplice ed efficiente per studiare la fisiopatologia delle isole umane, fornendo uno strumento prezioso per eseguire studi meccanicistici nelle isole umane.
Nella relazione attuale, viene presentato un protocollo per formare pseudoislets umane tradusse con lentivirus utilizzando due piattaforme disponibili in commercio, una piastra di fissaggio ultra-bassa 96-pozzetto e una piastra di coltura microwell. Entrambi ottengono un'efficace modulazione dell'espressione genica e creano pseudoislets umane compatibili per le valutazioni a valle, tra cui l'incubazione statica e la perifusione.
Protocollo
Prima dell'inizio degli studi, l'University of Iowa Institutional Review Board ha determinato che lo studio non soddisfaceva i criteri per la ricerca sui soggetti umani. Consultare il comitato di revisione locale prima dell'avvio dello studio per determinare se la fonte delle issolte e lo studio pianificato richiedono l'approvazione preventiva.
NOT: Tipicamente, sono necessari 1.200-1.400 isolotti equivalenti (IEQ) di isolotti umani per la formazione di 192 pseudoislets delle dimensioni di 3.000 cellule / pseudoislets in un attacco ultra-basso 96-well o 1.200 pseudoislets delle dimensioni di 500 cellule / pseudoislets in un piastra di coltura microwell. IEQ di isolotti necessari varia tra le diverse preparazioni di isolotti umani come fattori donatori (età, salute, peso), efficienza di isolamento, e le condizioni di coltura influenzano la resa della sospensione a singola cellula. In questo protocollo, viene utilizzato il lentivirus contenente shRNA che mira a un gene di interesse. Il citomegalovirus (CMV) e la chinasi del fosfoglicere umano (hPGK) vettori lentivirali a base di promotore sono segnalati per down-regolare il gene in modo efficiente nelle pseudoislets umane5,15. L'uso di lentivirus richiede precauzione come rischio biologico16. Contattare il comitato locale per la biosicurezza prima dell'avvio dell'uso di lentivirus.
1. Durante la notte cultura delle isole umane per il recupero dopo la spedizione
- Preparare connaught Medical Research Laboratories 1066 (CMRL-1066) medio integrato con 1% albumina siero umano (HSA) combinando 50 mL di CMRL-1066, 0,5 g di HSA, 0,5 mL di penicillina-streptomicina e 0,5 mL di 100 mg/mL di glutammina (1% HSA CMRL) in biologico sicurezza (BSC) e passando attraverso un filtro da 0,2 m per la sterilizzazione.
- Ruotare delicatamente la bottiglia di spedizione per mantenere le isole in sospensione. Trasferire il mezzo di spedizione contenente isolotti in un tubo di centrifuga conica da 50 mL. Lasciare riposare il tubo in BSC per 15 min in modo che le isole si stabiliscano sul fondo del tubo.
- Rimuovere delicatamente il mezzo di spedizione senza disturbare il pellet di isolotto utilizzando una pipetta da 10 mL. Sospendere nuovamente il pellet di isolotto in 1% HSA CMRL ad una concentrazione di 400 IEQ/mL.
- Trasferire le isole in un piatto trattato con coltura non tissutale. Se le isole sono suddivise in più piatti, tenere le isole sospese in modo uniforme in media ruotando delicatamente prima di dividersi. Isolotti di coltura a 37 gradi centigradi in un incubatore di CO2 durante la notte.
NOT: L'uso di un piatto trattato non di coltura di tessuto è necessario per evitare l'attaccamento delle isolotti al piatto.
2. Preparazione della sospensione a cella singola dalle isole umane
- Preparare quanto segue: CMRL-1066 media con 10% di siero bovino fetale inattivato dal calore (HiFBS), penicillina-streptomicina e glutammina (10% HIFBS CRML) a temperatura ambiente (RT), un colino da 40 m, una crema di prateria da 35 mm, una siringa da tubercologlia da 1 mL e un'emotocuma.
- Trasferire le isole umane dopo la coltura durante la notte in un tubo di centrifuga conica da 15 mL. Centrifuga a 190 x g per 5 min in un rotore oscillante-secchio. Mezzo aspirato con una pipetta da 5 mL senza disturbare il pellet di isolot.
- Lavare il pellet aggiungendo 10 mL di salina con buffer fosfato (PBS) nel tubo, mescolare delicatamente e centrifugare a 190 x g per 5 min.
- Sospendere nuovamente il pellet di isolot in 0,5 mL di una miscela di enzimi proteolitici e collagenolitici preriscaldati e di pipetta 5x utilizzando una pipetta P1000 per mescolare le isse. Incubare a 37 gradi centigradi per 5 min. Mescolare convogliando su e giù delicatamente 1/5 volte.
NOT: Pipettaggio aggressivo aumenterà la perdita di cellule. - Verificare la nuvolosità (celle singole) e il numero di scaglie (isole non digerite). Aggiungete l'incubazione da 2/3 a 37 gradi a seconda dell'entità della digestione giudicata dalla nuvolosità e dal numero di fiocchi. Interrompere la digestione quando i fiocchi sono ridotti al 10% della predigestione e la soluzione è nuvolosa.
NOT: Il tempo necessario per la digestione varia a seconda della distribuzione delle dimensioni dell'isolotto di ogni preparazione dell'isolotto umano. - Mettere un colino da 40 m in un piatto Petri da 35 mm e umido il colino aggiungendo 1 mL di 10% HiFBS CMRL e premendo con uno mL di siringa. Trasferire tutte le sospensioni cellulari sulla parte superiore del colino e raccogliere il pass-through in un tubo fresco da 15 mL.
- Lavare il tubo utilizzato per la digestione dell'isolotto con 0,5 mL di mezzo CMRL fresco per raccogliere le cellule rimaste e passare il lavaggio attraverso il colino. Unire il pass-through in un tubo da 15 mL. Ripetere una volta.
- Successivamente, dissociare isolotti non digeriti rimasti sul colino premendo il colino posto in un piatto da 35 mm con 1 mL di siringa. Raccogliere nuovamente il pass-through e lavare il colino con CMRL-1066 fresco per rimuovere tutte le restanti isolotti digerite dal colino e dal piatto. Un totale di 3 mL di sospensione a cella singola sarà ora nel tubo da 15 mL.
- Registrare il volume totale della sospensione cellulare e prendere 10 laliquot di cellule per contare il numero di cellulare su un emocitometro.
- Centrifugare la sospensione cellulare per 5 min a 200 x g. Rimuovere il mezzo senza disturbare il pellet. Procedere al passaggio 3.1.1 se si utilizza una piastra di fissaggio ultra-bassa del 96 po' o del passaggio 3.2.1 se si utilizza una piastra di coltura microwell da 24 pozze per riaggregare le cellule.
3. Formazione pseudoisletta e trasduzione da Lentivirus
- Protocollo con una piastra di fissaggio ultra-bassa 96 pozzetto
- Determinare il numero desiderato di celle per pseudoislet e il numero di pseudoislet da creare. Tipicamente, vengono utilizzate 1.000-3.000 celle per ogni pseudoislet per una piastra di fissaggio ultra-bassa di 96 pozze. Per 3.000 celle per pseudoislet, regolare la sospensione cellulare a 1 x 105 celle/mL rispendendo il pellet di islet dal punto 2.10 nel 10% HiFBS CMRL in modo che 30 l ha 3.000 cellule. Calcolare il volume totale di 1 x 105 celle / mL di sospensione a cella singola (mL) richiesto utilizzando la seguente equazione:
Il volume totale di 1 x 105 celle/mL di sospensione a cella singola (mL) - (numero di cellule per pseudoislet) x (numero di pseudoislets in corso) / 1 x 105.
NOT: Regolare la concentrazione della sospensione cellulare in base al numero desiderato di cellule per pseudoislet in modo che 30 -L- di sospensione cellulare faccia uno pseudoislet. - Trasferire il volume richiesto (30 x numero di pseudoislets) di sospensione a cella singola in un tubo fresco da 15 mL. Aggiungere 250 unità di trasduzione (TU)/cellula di lentivirus contenenti shRNA che prendono di mira un gene di interesse o di controllo.
ATTENZIONE: Il lentivirus è classificato come livello di biosicurezza 2 e può essere integrato nel DNA delle cellule infette.
NOT: Utilizzare lentivirus concentrato in modo che il volume di lentivirus aggiunto è minimo. Il titer richiesto per cellula per un silenziamento genico efficiente può variare a seconda del costrutto lentivirale. - Mescolare la sospensione cellulare con il virus pipettando delicatamente 5x con una pipetta P1000. Trasferire le cellule miste in un serbatoio di reagente sterile da 50 mL se si utilizza una pipetta a 8 canali.
- Distribuisci 30 l per pozzo di sospensioni a cella singola mescolato con lentivirus in ogni pozzo utilizzando una pipetta a 8 canali o una pipetta P200 a seconda del numero di pozzi.
- Centrifugare la piastra 96-po in una piastra oscillante-secchio centrifuga a 270 x g a RT per 7 min. Controllare se le cellule sono raccolte al centro di ogni pozzo. In caso contrario, centrifugare di nuovo come raccolta di tutte le cellule al centro del pozzo è fondamentale per la formazione di pseudoislet. La coltura a 37 gradi centigradi in un'incubatrice umidizzata del 5% di CO2 durante la notte.
- Aggiungete 100 l di CMRL preriscaldato al 10% di HiFBS per bene la mattina successiva per evitare l'essiccazione delle cellule durante la successiva coltura. Centrifuga a 270 x g, RT per 7 min. Coltura a 37 gradi centigradi in un 5% di CO2 incubatrice. Gli pseudoisti completeranno la formazione tra 5 o 7 giorni.
- Durante la raccolta di pseudoisti, preriscaldare il volume desiderato del 10% di HiFBS CMRL (100 -L per isolotto), preparare un serbatoio sterile da 50 mL, una parabola Petri sterile da 10 cm e una pipetta a 8 canali in BSC.
- Rimuovere la piastra da 96 pozzi dall'incubatrice e metterla in BSC. Pipetta 100 L per isolotto del 10% di HiFBS CMRL in un serbatoio.
- Pipetta 100 L per pozzo del 10% Di HiFBS CMRL da un serbatoio a pseudoislets e pipette su e giù 2-3 volte delicatamente nel pozzo per sollevare le isole. Quindi, mezzo aspirato nel pozzo contenente uno pseudoislet ed espellere in un piatto Petri 10 cm. L'uso di una pipetta a 8 canali consente il trasferimento di 8 pseudoislets contemporaneamente.
- Controllare la piastra al microscopio leggero per garantire la rimozione completa di tutte le pseudoislets. Le pseudoistiche formano aggregati solidi e rimangono aggregati dopo il sollevamento. Gli pseudoislets sono ora pronti per gli esperimenti a valle.
- Determinare il numero desiderato di celle per pseudoislet e il numero di pseudoislet da creare. Tipicamente, vengono utilizzate 1.000-3.000 celle per ogni pseudoislet per una piastra di fissaggio ultra-bassa di 96 pozze. Per 3.000 celle per pseudoislet, regolare la sospensione cellulare a 1 x 105 celle/mL rispendendo il pellet di islet dal punto 2.10 nel 10% HiFBS CMRL in modo che 30 l ha 3.000 cellule. Calcolare il volume totale di 1 x 105 celle / mL di sospensione a cella singola (mL) richiesto utilizzando la seguente equazione:
- Protocollo con una piastra di coltura microwell a 24 pozze
- Riscaldare la soluzione anti-aderenza di risciacquo (Tabella dei materiali) a RT per una formazione efficiente degli sferoidi. Inoltre, pre-caldo pianura CMRL-1066 e 10% HiFBS CMRL.
- Aggiungere 500 l per pozzo della soluzione di risciacquo anti-aderenza ad ogni pozzo della piastra di coltura microwell da utilizzare per le pseudoislets. Centrifuga a 1.300 x g per 5 min in una centrifuga a piastra oscillante.
- Osservare la piastra al microscopio per assicurarsi che le bolle d'aria vengano rimosse dai micropozzi. Se le bolle d'aria sono intrappolate nei micropozzi, centrifugare a 1.300 x g per 5 min di nuovo.
- Aspirati la soluzione anti-aderenza risciacquo dai pozzi in un BSC. Risciacquare ogni pozzetto con 2 mL di cMRL-1066 pianura calda una volta. Aspirato CMRL-1066. Aggiungere 0,5 mL/pozze di caldo 10% HiFBS CMRL ad ogni ben pianificato per l'uso. I pozzi sono ora pronti per caricare le cellule di isolotto umano disperse preparate al punto 2.10.
- Determinare il numero totale di celle necessarie per ogni pozzo. Un pozzo di 24 pozzetti di coltura di microwell contiene 1.200 micropozzi e forma 1.200 pseudoislets. 500 cellule per pseudoislet x 1200 micropozzi : 6 x 105 cellule. Risospendere le singole cellule dal passo 2,10 a 6 x 105 cellule in 0,8 mL di 10% HiFBS CMRL in un tubo sterile da 1,5 mL.
NOT: Il volume massimo per pozzo è 2 mL. Il volume della sospensione cellulare non deve superare 1,5 mL. Il protocollo descrive i passi per la creazione di un pozzo di pseudoislet transdotto da lentivirus. Scalabilità verticale a seconda del numero di pozzi da fare per ogni lentivirus. - Per la trasduzione virale, aggiungere 125 TU/cellule alla sospensione a singola cella. Mantenere il volume del virus al di sotto di 0,2 mL. Incubare la miscela di cellule e virus a 37 gradi centigradi con una miscelazione delicata occasionale per 1 h per consentire il contatto delle cellule con virus prima della condensazione delle cellule al punto 3.2.8.
NOT: Utilizzare lentivirus concentrato in modo che il volume di lentivirus aggiunto è minimo. Il numero inferiore di TU per cella viene utilizzato per il Protocollo 2 rispetto al Protocollo 1, poiché il volume totale di media per numero di cella è inferiore. Tuttavia, il titro richiesto per cellula per un silenziamento genico efficiente può variare a seconda del costrutto lentivirale e necessita di ottimizzazione.
ATTENZIONE: Il lentivirus è classificato come livello di biosicurezza 2 e può essere integrato nel DNA delle cellule infette. - Dopo 1 h, regolare il volume totale della miscela di cellule isolotti e virus a 1 mL aggiungendo 10% HiFBS CMRL. Se le cellule si formano ciuffo dopo 1 h incubazione, si disperdono in sospensione a singola cella con un pipeting delicato e veloce 2/3 volte. Il pipettaggio è molto importante per la distribuzione uniforme delle cellule tra i micropozzi. Trasferire la sospensione cellulare in un pozzo della piastra di coltura microwell a 24 pozze.
- Subito dopo la pipettatura, centrifugare a 100 x g per 3 min a RT per catturare le cellule in tutti i micropozzi. Osservare al microscopio per verificare che le cellule siano distribuite uniformemente in tutti i micropozzi.
- Coltura la piastra di coltura microwell a 37 gradi centigradi in un incubatore di CO2 del 5%. Gli pseudoislets si formeranno in 24/48 h. Gli pseudoislets possono essere coltivati senza cambiamenti medi per un massimo di 7 giorni.
- Quando si modifica il mezzo per la cultura oltre i 7 giorni, sostituire il 50%-75% del mezzo per ogni cambiamento medio come segue. Rimuovere lentamente 0,5 mL di mezzo utilizzando una pipetta P1000 da ogni pozzo. Aggiungete lentamente 0,5 mL di CMRL HiFBS fresco mettendo una punta alla parete del pozzo per evitare di spostare le pseudoislets dalla piastra di coltura del microwell.
- Per preparare la raccolta degli pseudoischi, riscaldare il mezzo HiFBS CMRL al 10%. Gli pseudoislets tendono a fluttuare nel CMRL-1066 libero dal siero, rendendo difficile la loro selezione.
- Aspirate 0,5 mL di mezzo da pozzo utilizzando una pipetta da 1 mL e erogare con forza di nuovo alla superficie piastra per sollevare pseudoislets dalla piastra di coltura microwell.
- Aspirare delicatamente le pseudoislets slodged utilizzando la pipetta da 1 mL e le isole di trasferimento in una coltura non tissutale trattata a 6 pozzetti. Passare attraverso un piccolo colino reversibile di 37 m posto su un tubo conico da 15 ml. Gli pseudoislets rimarranno sul filtro; tutte le singole celle non incorporate scorreranno attraverso.
NOT: Per evitare la perdita di pseudoislets di dimensioni più piccole attraverso il colino, il colino può essere omesso. - Distribuisci 1 mL di 10% HiFBS CMRL su tutta la superficie del pozzo per spostare eventuali pseudoislets rimanenti, aspirare pseudoislets slombld e passare attraverso il colino. Ripetere 3x per garantire la raccolta completa di tutti gli pseudoislets dei pozzi.
- Osservare la piastra di coltura del microgone al microscopio per garantire che tutte le pseudoislets siano raccolte. Ripetere il lavaggio come al punto 3.2.14 se rimangono pseudoislets.
4. Estrazione dell'RNA per la valutazione dell'efficienza del silenziamento genico
- Raccogliere pseudoislets nel PBS libero di RNase in un tubo di microcentrifuga da 1,5 ml e centrifugare a 300 x g per 3 min a 4 gradi centigradi. Rimuovere PBS senza disturbare il pellet di isolotto e lavare una volta con PBS seguito dalla centrifugazione a 300 x g per 3 min a 4 gradi centigradi.
- Aspirare la maggior parte di PBS utilizzando una pipetta P1000. Quindi, passare a una pipetta P10 per rimuovere il resto del PBS senza disturbare il pellet di isolotto.
- Aggiungere 0,5 mL di reagente di estrazione dell'RNA di guanidianio (Tabella dei materiali) per tubo. Omogeneizza gli pseudoislets usando un pestello a motore per 2/3 volte. L'omociclone nel reagente di estrazione dell'RNA tiocianato del guaniofonio può ora essere immagazzinato a -80 gradi centigradi o lavorato per la purificazione dell'RNA.
NOTA: 24 dei 3.000 pseudoislets cellulari formati in una piastra di 96 pozzetti o 48 delle 500 pseudoislets cellulari formate in una piastra di coltura microwell sono sufficienti per ottenere 0,5 ,1 g di RNA.
Risultati
La figura 1 illustra i passaggi chiave nella produzione di pseudoislets utilizzando una piastra di fissaggio ultra-bassa di 96 pozzetti e una piastra di coltura microwell. La figura 2a mostra cambiamenti sequenziali nella morfologia durante la formazione di pseudoislets da 3 x 103 cellule di isolotto umano in una piastra di fissaggio ultra-bassa di 96 pozzetti. Il monostrato o i ciuffi sciolti di cellule osservate nel giorno 1 si sono trasformati in aggregati solidi con un bordo liscio e rotondo al giorno 5 a 7 (Figura 2a). In una piastra di coltura microwell, la formazione di pseudoislets solide è di solito visibile entro 4 giorni (Figura 2b). Quando 600 cellule/microwell sono state placcate nella piastra di coltura del microwell, le cellule dell'isolotto umano sono state condensate in sferoidi di dimensioni uniformi. Si osserva che una piastra di coltura microwell permette la formazione di successo di pseudoislets da un piccolo numero di cellule rispetto a una piastra di fissaggio ultra-bassa 96-well. Tipicamente, oltre 1.500 cellule /pseudoislet sono necessari per una piastra di fissaggio ultra-bassa 96-pozzo, mentre 500 cellule / pseudoislet sono sufficienti per una piastra di coltura microwell 24-well. Gli pseudoislets formati con successo rimangono come sferoidi dopo il recupero da una piastra di fissaggio ultra-bassa 96 o da una piastra di coltura microwell e sono compatibili per le applicazioni a valle, tra cui l'incubazione statica (Figura 3a) e la perifusione (Figura 3b). La dimensione uniforme degli pseudoislets riduce la variazione all'interno di un gruppo di test e consente l'incubazione statica utilizzando appena 5 pseudoislets per misura (Figura 3a). Inoltre, gli pseudoislets umani hanno mantenuto una robusta secrezione di insulina nella prima fase in risposta al glucosio dopo 7 giorni di coltura, quando le isole umane originali coltivate per un periodo di tempo simile hanno mostrato una secrezione di insulina stimolata dal glucosio nella prima fase ( Figura 3b)5. L'introduzione del lentivirus in una singola sospensione cellulare garantisce la trasduzione efficiente e omogenea delle cellule dell'isolotto e raggiunge una regolazione altamente efficiente dei geni, come illustrato nella Figura 3c. Tutti i risultati mostrati sono stati ottenuti utilizzando isolotti umani di donatori non diabetici.

Figura 1: Processo di preparazione dello pseudoislet umano. (a) La sospensione contenente 4.000 IEQ di isolotti umani diventa torbida dopo la digestione da parte di una miscela di enzimi proteolitici e collagenolitici e tubi lievi. (b) Le isole umane dopo la dispersione vengono passate attraverso un colino. Le isole non digerite che rimangono sopra il colino vengono disperse utilizzando uno stantuffo di siringa da 1 mL. (c,d) Immagini al microscopio della sospensione a singola cellula contenenti 3.000 cellule/pozzo in una piastra di fissaggio ultra-bassa 96-pozzo prima (c) e dopo (d) centrifugazione. (e,f) Immagini al microscopio della sospensione a cella singola contenenti 500 cellule/microwell in una piastra di coltura microwell di 24 pozzetti prima (e) e dopo la centrifugazione di(f). Barra di scala 250 m. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Morfologia degli pseudoislets umani. Cambiamenti sequenziali nella morfologiadegli pseudoislets umani creati (a ) in una piastra di fissaggio ultra-bassa di 96 pozzetti da 3.000 cellule e (b) in una piastra di coltura microwell di 24 pozzetti provenienti da 500 cellule. Barra di scala: 100 m. Fare clic qui per visualizzare una versione più grande di questa figura.
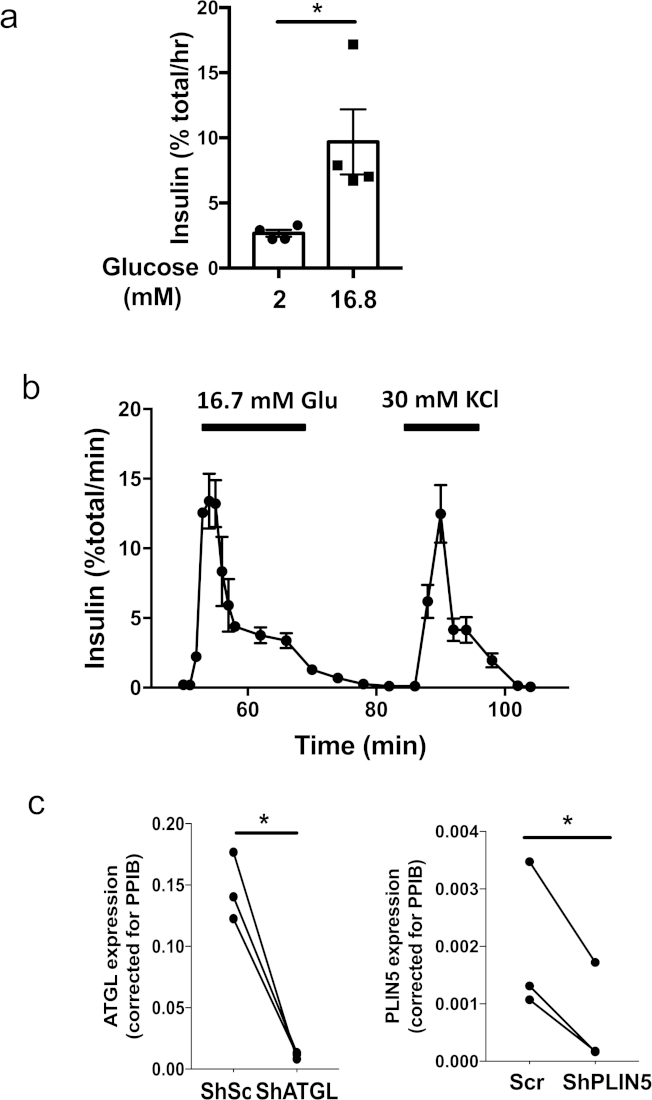
Figura 3: Esempi di saggi funzionali usando pseudoislets umani. (a) Incubazione statica rappresentativa eseguita utilizzando pseudoislets umani creati in una piastra di coltura microwell da un singolo donatore delle dimensioni di 500 cellule di isole umane per pseudoislet. Quattro serie di 5 pseudoislets sono state incubate per 1 h nel tampone di bicarbonato Krebs-ringer integrato con 2 mM o 16,8 mM di glucosio. Ogni simbolo rappresenta la secrezione di insulina da una serie di 5 pseudoislets. Viene visualizzato l'errore medio della media (SEM). p < 0,05 dal test t dello studente. Risultati rappresentativi di tre donatori. (b) Rappresentante della secrezione di insulina perifusione da pseudoislets umani creati in una piastra di coltura microwell in risposta a 16,7 mM di glucosio e 30 mM KCl. Il metodo per la perifusione è stato precedentemente pubblicato5. Medi - SEM di secrezione di insulina da due serie di 40 pseudoislets create in una piastra di coltura microwell da un singolo donatore delle dimensioni di 500 cellule di isole umane per piastra pseudoislet. Dati di rappresentanza di sei donatori. (c) Sono stati creati pseudoislets con lentivirus che trasporta lo shRNA che si rivolge all'ATGL umano (mirato a CCTGCCACTCTCTCTAGAAA, a sinistra) o PLIN5 (miraga GACAAGCTGGAAGAGAAGCTCT, a destra). Pseudoislets di controllo sono stati tradotti con lentivirus che esprime sequenza strapazzata (Scr) precedentemente pubblicato5. L'espressione dell'mRNA di ogni gene è stata determinata dalla reazione a catena della polimerasi in tempo reale (PCR) come pubblicato in precedenza5. I dati sono stati espressi utilizzando 2-DDCT prendendo peptidilprolyl Isomerare B (PPIB) come controllo interno17. Ogni punto rappresenta i dati di ogni donatore per un primer indicato e un set di dati dello stesso donatore è collegato da una linea. N - 3 donatori. *; p < 0,05 dal test t dello studente. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Qui, viene presentato un protocollo dettagliato per generare pseudoislets umani che vengono tradotti da lentivirus utilizzando una piastra di fissaggio ultra-bassa 96-pozzetti o una piastra di coltura microwell. Gli pseudoislets sono stati segnalati per dimostrare la morfologia e le funzioni secretorie simili agli isolotti umani nativi e possono essere coltivati per un tempo prolungato in vitro5,11,18. A differenza delle isole umane autoctone che mostrano un'ampia variazione di dimensioni, gli pseudoislets sono di dimensioni relativamente uniformi, riducendo la variazione tra donatori e repliche sperimentali5,11. La downregolazione dei geni che richiedono un'elevata efficienza di trasduzione può essere eseguita facilmente prima della formazione di pseudoislets in sospensione a singola cellula. Questo metodo evita la difficoltà di penetrazione virale attraverso strati di cellule in isole intatte. Così, questo protocollo semplice, altamente efficiente e riproducibile per la creazione di pseudoislets umane ha ampie applicazioni.
Mentre sono state segnalate diverse piattaforme per la formazione di pseudoislets12,14,19,20, sia una piastra di fissaggio ultra-bassa 96-pozzo e una piastra di coltura microwell sono disponibili in commercio, consentendo l'adozione di questa tecnica da parte di qualsiasi laboratorio. Anche se il metodo di caduta sospesa12 consente anche la formazione di pseudoislets umani utilizzando labware comune, potenziali limitazioni includono la difficoltà nel controllare le dimensioni e la durata di riaggregazione delle pseudoislets. Queste limitazioni erano dovute al volume limitato per goccia di pseudoislet e all'evaporazione in corso durante la cultura di 5-7 giorni necessaria per la formazione della pseudoislet. Inoltre, è più facile contenere lentivirus con l'uso di una piastra di fissaggio ben alta 96 o di una piastra di coltura microwell rispetto al metodo di sospensione.
Diversi passaggi all'interno del protocollo richiedono molta attenzione. L'ottimizzazione della digestione delle isole intatte con la miscela di enzimi proteolitici e collagenolitici è fondamentale poiché sia la sotto- che l'eccessiva digestione ridurrà la resa della sospensione a singola cellula e successivamente influenzerà l'aggregazione di pseudoislets. Durante la digestione, è importante monitorare attentamente le isole per la scomparsa dei grumi e l'aumento della nuvolosità man mano che le isolotti si dissociano in singole cellule. È importante notare che il tempo ottimale per la digestione varia tra le isolotti di diversi donatori. Il tempo ottimale dipende da diversi fattori, tra cui la storia medica e l'età di ogni donatore, la durata del tempo di ischemia, la procedura di isolamento dell'isola utilizzata, la dimensione dell'isolotto, la purezza dell'isolotto, la vitalità dell'isolotto e le condizioni di spedizione. Tipicamente, isole umane con vitalità e purezza superiore all'80% e entro 5 giorni di isolamento vengono utilizzati. Un'attenta e delicata pipettaggio durante la dispersione è anche importante per mantenere la vitalità cellulare e il recupero che in ultima analisi influenzeranno l'aggregazione cellulare e la dimensione finale degli pseudoislets in formazione. Quando si eslascerà la sospensione delle cellule islet ai pozzi (passaggi 3.1.4 e 3.2.7), la miscelazione delicata e accurata delle cellule è importante per ottenere una distribuzione uniforme delle singole cellule nei micropozzi. Se le cellule si formano grumi dopo 1 h incubazione con lentivirus, richiede pipettaggio delicato per rompere i grumi in sospensione a singola cellula prima della centrifugazione finale.
Abbiamo avuto un successo simile nella creazione di pseudoislets umane dopo la trasduzione lentivirale utilizzando sia una piastra di 96 pozzetti che una piastra di coltura microwell. La scelta tra le due piattaforme dipende dalle dimensioni e dal numero di pseudoislets desiderate. Una piastra di coltura microwell ha piccoli fondali a forma di piramide che consentono la condensazione di un numero minore di cellule rispetto a una piastra inferiore rotonda di 96. Così, il numero di cellule per pseudoislet può essere ridotto per una piastra di coltura microwell. Inoltre, un singolo passo di centrifugazione crea tutte le pseudoislets contemporaneamente in una piastra di coltura microwell, mentre è necessario il pipettaggio multiplo per la creazione di pseudoislets in una piastra di 96 pozzetti. Così, aumentare la creazione di pseudoislets è più facile in una piastra di coltura microwell. Tuttavia, la piastra di coltura microwell attualmente disponibile non offre flessibilità nel numero di pseudoislets in fase di creazione. Attualmente, il numero minimo di pseudoislets creati utilizzando una piastra di coltura microwell è 1.200 e può essere aumentato solo del fattore 1.200. Pertanto, di solito usiamo una piastra di 96 pozzetti per esperimenti pilota su piccola scala e per un esperimento in cui una piccola quantità di campioni è sufficiente, come un saggio di secrezione di insulina e l'estrazione di RNA per l'espressione genica. Abbiamo usato pseudoislets da una piastra di coltura microwell per saggi che richiedono un gran numero di cellule come la macchia occidentale, la determinazione del tasso di consumo di ossigeno da parte di un analizzatore metabolico e l'estrazione di trigliceridi.
Il principale fattore limitante per la generazione di pseudoislets umani è la perdita di cellule durante la preparazione della sospensione a singola cellula. Mentre 1 IEQ di isolotto umano è considerato per contenere circa 2.000 cellule, il recupero della sospensione a singola cellula è in genere 30% o inferiore a causa di lavaggi multipli e passando attraverso un colino. L'eterogeneità delle dimensioni dell'isolotto rende anche difficile dissociare tutte le isolotti contemporaneamente. Mentre la pipettatura delicata e l'uso della miscela di enzimi proteolitici e collagenolitici nel protocollo sono sforzi per combinare forze meccaniche ed enzimatiche per il massimo recupero di singole cellule, c'è ancora un'inevitabile perdita di cellule. Pertanto, l'applicazione di pseudoislets richiede una chiara giustificazione rispetto allo studio di isole umane intatte. Va anche ricordato che la secrezione di insulina dagli pseudoislets è più robusta delle isole coltivate per lo stesso periodo del tempo, ma tende ad essere inferiore rispetto alle isole appena isolate5,11.
Sebbene esistano limitazioni, il silenziamento genico stabile e altamente efficiente combinato con una migliore conservazione della secrezione di insulina stimolata dal glucosio per un tempo prolungato in coltura consente la valutazione della funzione genica nelle cellule dell'isolotto umano. Inoltre, la complessa comunicazione intercellulare tra le cellule beta beta-beta e beta-non beta è proposta per avere un ruolo normativo nella funzione islet. Tuttavia, attualmente ci sono informazioni limitate per quanto riguarda la comunicazione intercellulare all'interno delle isole umane. Con una maggiore disponibilità di marcatori specifici delle cellule21, è possibile creare pseudoislets umane con composizione cellulare definita, come recentemente riportato nelle celle dell'isolotto del mouse22, che faciliterà una migliore comprensione della cellula-cellula comunicazione tra le cellule dell'isola umana. Il recente progresso dell'imaging dei tessuti tridimensionali aumenta anche potenzialmente l'utilità delle pseudoislets umane come modello per smascherare il modo in cui la polarità cellulare e la comunicazione intercellulare sono regolate nelle isole umane. Così, pseudoislets umani forniscono un modello utile per sezionare le funzioni dei geni di interesse e altre domande nel campo della biologia degli isolotti.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto finanziariamente dai National Institutes of Health to Y.I. (R01-DK090490) e dall'American Diabetes Association a Y.I. (1-17-IBS-132). J.A. e Y.I. sono supportati dal Centro di ricerca sul diabete dell'Ordine Fraterno delle Aquile. A.B. è sostenuto da una sovvenzione di formazione dei National Institutes of Health (T32NS45549). Gli autori hanno utilizzato isole pancreatiche umane fornite dal programma integrato di distribuzione dell'isola (IIDP) finanziato dalla NIDDK a City of Hope (2UC4DK098085).
Materiali
| Name | Company | Catalog Number | Comments |
| Anti-adherence rinsing solution | Stemcell technologies | 7919 | |
| Biological safety cabinet | Thermo Scientific | 1300 Series Type A2 | |
| Cell strainer, 40 micrometer | Corning | 431750 | |
| CMRL-1066 | ThermoFisher | 11530037 | |
| CO2 incubator | Thermo Scientific | Heracell VIOS 160i | |
| Conical centrifuge tube, 15 mL | VWR | 89039-666 | |
| Conical centrifuge tube, 50 mL | VWR | 89039-658 | |
| Fetal bovine serum | ThermoFisher | 26140079 | |
| Guanidinium thiocyanate RNA extraction reagent | ThermoFisher | 15596026 | Trizol |
| Glutamine | ThermoFisher | 25030164 | |
| Hemocytometer | Marien Feld | Neubauer-Improved Bright line | |
| Human serum albumin | Sigma | A1653 | |
| Inverted microscope | Fisher brand | 11-350-119 | |
| Microcentrifuge | Beckman Coulter | Microfuge 20 | |
| Microcentrifuge tube, 1.5 mL | USA Scientific | 1615-5500 | |
| Microwell culture plate | Stemcell technologies | 34411 | Aggrewell 400, 24 well |
| Motor-driven pestle | GAMUT | #399X644 | |
| Non-tissue culture treated dish, 10 cm | Fisher Scientific | FB0875713 | |
| PBS | ThermoFisher | 14190250 | |
| Penicillin-streptomycin | ThermoFisher | 10378016 | |
| Petri dish, 35 mm | Celltreat | 229638 | |
| Pipette, 5 mL | DOT Scientific, | 667205B | |
| Pipette, 8-channel | VWR | #613-5253 | |
| Pipette, 10 mL | VWR | 667210B | |
| Pipette, P10 | Denville | UEZ-P-10 | |
| Pipette, P200 | Denville | UEZ-P-200 | |
| Pipette, P1000 | Denville | UEZ-P-1000 | |
| Proteolytic and collagenolytic enzyme mixture | Sigma | A6965 | Accutase |
| Reagent reservoir, 50 mL | VWR | 89094-680 | |
| Reversible strainer, 37 micrometer | Stemcell technologies | 27251 | |
| Swing bucket plate centrifuge | Beckman Coulter | Allegra X-14R | |
| Swing bucket rotor | Beckman Coulter | SX4750A | |
| Tuberculin syringe, 1 mL | BD | 309659 | |
| Ultra low attachment microplate, 96 well | Corning | 4515 |
Riferimenti
- Chen, C., Cohrs, C. M., Stertmann, J., Bozsak, R., Speier, S. Human beta cell mass and function in diabetes: Recent advances in knowledge and technologies to understand disease pathogenesis. Molecular Metabolism. 6 (9), 943-957 (2017).
- Hong, H., Jo, J., Sin, S. J. Stable and flexible system for glucose homeostasis. Physiological Review E covering statistical, nonlinear, biological, and soft matter physic. 88 (3), 032711 (2013).
- Cryer, P. E. Minireview: Glucagon in the pathogenesis of hypoglycemia and hyperglycemia in diabetes. Endocrinology. 153 (3), 1039-1048 (2012).
- Arrojo e Drigo, R., et al. New insights into the architecture of the islet of Langerhans: a focused cross-species assessment. Diabetologia. 58 (10), 2218-2228 (2015).
- Harata, M., et al. Delivery of shRNA via lentivirus in human pseudoislets provides a model to test dynamic regulation of insulin secretion and gene function in human islets. Physiological Reports. 6 (20), e13907 (2018).
- Barbu, A. R., Akusjarvi, G., Welsh, N. Adenoviral-mediated transduction of human pancreatic islets: importance of adenoviral genome for cell viability and association with a deficient antiviral response. Endocrinology. 146 (5), 2406-2414 (2005).
- Hughes, A., et al. Gene therapy to improve pancreatic islet transplantation for Type 1 diabetes mellitus. Current Diabetes Reviews. 6 (5), 274-284 (2010).
- Jimenez-Moreno, C. M., et al. A Simple High Efficiency Intra-Islet Transduction Protocol Using Lentiviral Vectors. Current Gene Therapy. 15 (4), 436-446 (2015).
- Bonora, E., et al. Prevalence and correlates of post-prandial hyperglycaemia in a large sample of patients with type 2 diabetes mellitus. Diabetologia. 49 (5), 846-854 (2006).
- Halban, P. A., Powers, S. L., George, K. L., Bonner-Weir, S. Spontaneous reassociation of dispersed adult rat pancreatic islet cells into aggregates with three-dimensional architecture typical of native islets. Diabetes. 36 (7), 783-790 (1987).
- Yu, Y., et al. Bioengineered human pseudoislets form efficiently from donated tissue, compare favourably with native islets in vitro and restore normoglycaemia in mice. Diabetologia. 61 (9), 2016-2029 (2018).
- Zuellig, R. A., et al. Improved physiological properties of gravity-enforced reassembled rat and human pancreatic pseudo-islets. Journal of Tissue Engineering and Regenerative Medicine. 11 (1), 109-120 (2017).
- Caton, D., et al. Lentivirus-mediated transduction of connexin cDNAs shows level- and isoform-specific alterations in insulin secretion of primary pancreatic beta-cells. Journal of Cell Science. 116 (Pt 11), 2285-2294 (2003).
- Arda, H. E., et al. Age-Dependent Pancreatic Gene Regulation Reveals Mechanisms Governing Human beta Cell Function. Cell Metabolism. 23 (5), 909-920 (2016).
- Peiris, H., et al. Discovering human diabetes-risk gene function with genetics and physiological assays. Nature Communications. 9 (1), 3855 (2018).
- Schlimgen, R., et al. Risks Associated With Lentiviral Vector Exposures and Prevention Strategies. Journal of Occupational and Environmental Medicine. 58 (12), 1159-1166 (2016).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Li, N., et al. Engineering islet for improved performance by optimized reaggregation in alginate gel beads. Biotechnology and Applied Biochemistry. 64 (3), 400-405 (2017).
- Ramachandran, K., Peng, X., Bokvist, K., Stehno-Bittel, L. Assessment of re-aggregated human pancreatic islets for secondary drug screening. British Journal of Pharmacology. 171 (12), 3010-3022 (2014).
- Hilderink, J., et al. Controlled aggregation of primary human pancreatic islet cells leads to glucose-responsive pseudoislets comparable to native islets. Journal of Cellular and Molecular Medicine. 19 (8), 1836-1846 (2015).
- Saunders, D. C., et al. Ectonucleoside Triphosphate Diphosphohydrolase-3 Antibody Targets Adult Human Pancreatic beta Cells for In Vitro and In Vivo Analysis. Cell Metabolism. (18), (2018).
- Reissaus, C. A., Piston, D. W. Reestablishment of Glucose Inhibition of Glucagon Secretion in Small Pseudoislets. Diabetes. 66 (4), 960-969 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon